ИЗМЕНЕНИЕ рН ВОДЫ, БУФЕРНАЯ СИСТЕМА
- Подробности
Просмотров: 4353
Процесс жизнедеятельности гидробионтов сопровождается закислением среды, подробнее
этот вопрос будет рассмотрен ниже. В некоторых рыбоводных установках снижение рН прини-
мает опасные для культивируемых видов формы. Так, например, нормой работы замкнутых по
воде установок является снижение рН до 6 – 6,5 при значение рН подпиточной воды 7 – 8. При
непринятие мер рН снижается до опасных значений.
Природные воды располагают собственной буферной системой, определенным образом га-
сящей рост концентрации ионов водорода. Буферные свойства воды определяются растворен-
ной в ней двуокисью углерода СО2 с образованием угольной кислоты Н2СО3. Эта слабая кисло-
35
та взаимодействует с карбонатосодержащими породами СаСО3 с образованием бикарбоната
Са(НСО3)2.
Бикарбонат диссоциирует с образованием водородных и карбонатных ионов.
растворения углерода в воде описывается серией уравнений
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3
– ↔ Н+ + СО3
2-. /15/
Эти химические реакции во многом зависят от концентрации ионов водорода. С повышени-
ем концентрации ионов водорода (снижение рН) реакция сдвигается влево. Однако, эта хими-
ческая система обладает буферностью, она сопротивляется любым изменениям концентрации
ионов водорода. При добавление ионов водорода частная реакция
Н+ + НСО3
– ↔ Н+ + СО3
2- /16/
остается относительно стабильной, поскольку в обеих частях содержатся ионы Н+. Сдвиг ре-
акции влево компенсирует добавление ионов водорода. Поскольку концентрация угольной ки-
слоты в частной реакции (уравнение 16) увеличилось, то это приводит к частичной диссоциа-
ции угольной кислоты с образованием воды и углекислого газа
СО2 + Н2О ↔ Н2СО3. /17/
Происходит сдвиг реакции влево, при этом наблюдается уменьшение концентрации бикар-
боната в воде (НСО3
-).
 В результате реакций большая часть ионов водорода будет связана в Н2О
В результате реакций большая часть ионов водорода будет связана в Н2Ои НСО3
-.
Если вода контактирует с карбонатными отложениями СаСО3, то пополнение утраченного
бикарбоната (НСО3
-) произойдет за счет диссоциации карбонатных отложений
CaCO3 ↔ Ca2+ + CO3
2-, /18/
CO3
2- + H+ ↔ HCO3
-.
С целью стабилизации рН водных систем, например, аквариумов, в воду вносят материалы,
содержащие СаСО3: раковины моллюсков, мраморную крошку и т.п.
В воде океанов рН поверхностных вод обычно находится в пределах 7,8 – 8,3, то есть имеет
щелочную реакцию. Этим объясняется наличие прочных раковин у морских моллюсков. В кис-
лых водах пресных водоемов раковины растворяются.
В природных водах озер рН изменяется от 6 до 9. Под влиянием вулканических кислот рН
(Камчатка, Курилы). Если питающие хозяйство воды текут по известковым отложениям, то рН
может достигнуть значения 9.
 Чаще всего это бывает в артезианских источниках.
Чаще всего это бывает в артезианских источниках.Буферные свойства воды оцениваются по ЩЕЛОЧНОСТИ ВОДЫ, тесно связанной с карбо-
натной жесткостью воды. Щелочность (ее обозначают символом А1к) выражает концентрацию
анионов слабых кислот (угольной, борной, фосфорной и др.), связанных с сильным основанием.
Щелочность вычисляется по формуле:
HCO3
– в мг/л СО3
2- в мг/л
А1к = –––––––––––– + ––––––––––––, (мг-экв/л). /19/
61 24
Связь между рН воды и формами углерода, входящими в буферную систему пресной воды,
приведена на рис.18.
Рис.18. Графическая связь pH и форм углерода в пресной воде.
Если в замкнутых по воде рыбоводных установках буферные свойства подпиточной воды
невысоки, то для стабилизации рН воды используется известковое молоко, получаемое при га-
шении извести СаО. При гашении СаО образуется сильное основание – гидроксид кальция
Са(ОН)2.
CaO + Н2O = Са(ОН)2 + 16 ккал /20/
На 1 кг аммиака, выделяемого гидробионтами (Nh5
+ – N), потребуется примерно 4 кг СаО.

Буферная емкость | Любителям аквариума
Буферная емкость и Буферное опрокидывание.
Буферностью называют способность раствора (а аквариумная вода — это слабый раствор) сохранять величину водородного показателя при добавлении щелочи или кислоты. Буферность аквариумной воды не измеряют, ее лишь характеризуют словами “слабая” или “сильная”. Бывают растворы со слабой буферностью, когда каждая добавленная капля кислоты или щелочи изменяет рН, бывают сильно буферные растворы, способные поддерживать постоянную величину рН, несмотря на существенные добавки химических веществ. Конечно, в определенных условиях даже вода с сильной буферностью начинает изменять рН, однако важно ориентироваться в особенностях этого свойства и правильно использовать его там, где это необходимо.
Любые изменения в уровне рН должны производиться плавно и постепенно! Скудно буферизованная вода будет более подвержена резким колебаниям уровня pH, нежели хорошо буферизованная.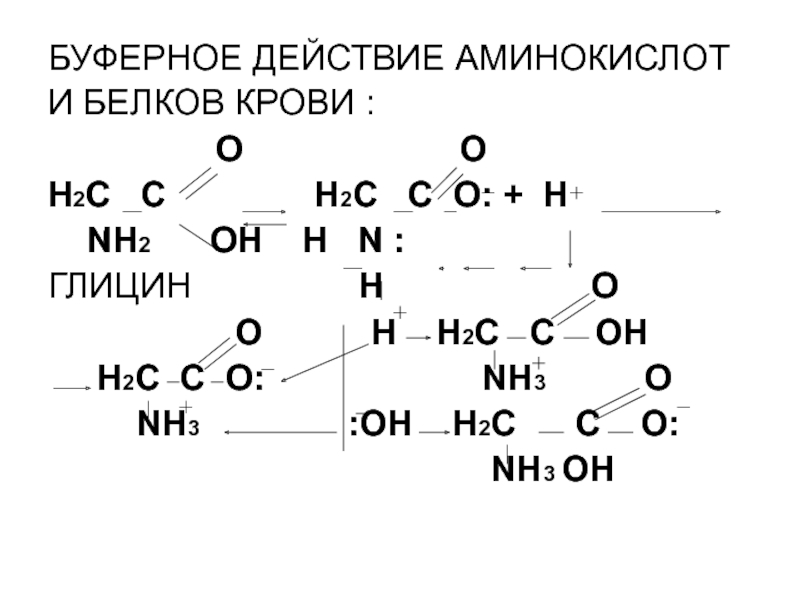 Буфером может считаться грунт, имеющий в своем составе много известняка — для поддержания высокой жесткости воды. Аквариумный гравий часто состоит из кальцийсодержащего материала, который повышает жесткость воды и рН. Также буфером может являться кусок дерева, коряга, которая подкисляет воду и понижает pH. Заметим, что буферизация и щелочность тесно связаны, т.к. фактически, щелочность является буфером, замедляющим изменение pH в воде. Как правило, жёсткая вода обычно имеет щелочной состав (pH более 7) и является хорошим буфером. В то же время мягкая вода (pH ниже 7) – несколько кислее и в качестве буфера не годится.
Буфером может считаться грунт, имеющий в своем составе много известняка — для поддержания высокой жесткости воды. Аквариумный гравий часто состоит из кальцийсодержащего материала, который повышает жесткость воды и рН. Также буфером может являться кусок дерева, коряга, которая подкисляет воду и понижает pH. Заметим, что буферизация и щелочность тесно связаны, т.к. фактически, щелочность является буфером, замедляющим изменение pH в воде. Как правило, жёсткая вода обычно имеет щелочной состав (pH более 7) и является хорошим буфером. В то же время мягкая вода (pH ниже 7) – несколько кислее и в качестве буфера не годится.
Карбонатная жесткость — это концентрация в воде анионов гидрокарбоната и карбоната. KH и pH взаимосвязаны между собой, и потому будет логичным рассмотреть их совместно. Связь же этих параметров очень проста. Чем выше содержание гидрокарбоната в воде, то есть значение KH, тем выше, а самое главное, стабильнее, значение pH, так, например, гидрокарбонат кальция является прекрасным буфером воды. Обратите внимание на слово “стабильнее”. В данном контексте оно означает, что вода с высокой, более 12 градусов карбонатной жесткостью, имеет щелочную реакцию. Вода средней жесткости (6-12 градусов) скорее всего, будет близка к нейтральной реакции (pH ~7.0), а вот вода с карбонатной жесткостью менее 6 градусов KH, по большому счету может быть какой угодно, но, скорее всего, будет кислой.
Обратите внимание на слово “стабильнее”. В данном контексте оно означает, что вода с высокой, более 12 градусов карбонатной жесткостью, имеет щелочную реакцию. Вода средней жесткости (6-12 градусов) скорее всего, будет близка к нейтральной реакции (pH ~7.0), а вот вода с карбонатной жесткостью менее 6 градусов KH, по большому счету может быть какой угодно, но, скорее всего, будет кислой.
Буферное опрокидывание — резкое изменение значения рН, наиболее вероятно в щелочной среде или в среде, близкой к щелочной, когда значение рН приближается к 7. При этом вследствие щелочной реакции безвредный аммоний переходит в аммиак, и рыбы, особенно молодые, быстро погибают. Такое явление обычно наблюдается в аквариумах, перегруженных рыбами, при добавлении свежей воды. В таких аквариумах на изменения рН влияют процессы окисления, вызываемые как белковыми соединениями, в избытке имеющимися в перегруженных аквариумах, так и накапливающимися продуктами обмена, видимыми и невидимыми (растворимыми). Добавку воды в такие аквариумы следует производить небольшими порциями, причем показатель pH добавляемой воды должен быть ниже 7. В слишком жесткой и щелочной (рН выше 9) воде, тоже все плохо.
Добавку воды в такие аквариумы следует производить небольшими порциями, причем показатель pH добавляемой воды должен быть ниже 7. В слишком жесткой и щелочной (рН выше 9) воде, тоже все плохо.
Во-первых, при повышении щелочности воды все большее количество ионизированного аммония переходит в чистый аммиак, растворенный в воде. Аммиак во много раз токсичнее аммония, поэтому при незначительных, казалось бы, увеличениях концентрации аммония неожиданно может произойти тяжелое отравление всего аквариума. Не допускать этого просто — нужно чаще подменивать воду. Либо пользуйтесь специальными кондиционерами воды. Во-вторых, по мере повышения щелочности среды у рыб ухудшается усваивание кислорода. В щелочной среде рыба может задохнуться при вполне, вроде бы, достаточном его содержании в воде. Ну и, конечно, сама по себе (особенно при резком повышении рН) щелочная вода вызывает ожоги и повреждения внешних органов рыб.
В пресноводных аквариумах, уровень буферизации зависит от уровня карбонатов и бикарбонатов в воде.
Буферная емкость имеет, и положительные и отрицательные качества. Положительная сторона, когда при функционировании цикла азота появляется нитрат, он подкисляет воду. Без буферизации, показатель pH аквариума понизился бы через некоторое время, (это плохо).
Какой уровень буферизации необходим для аквариума? В большинстве случаев тестовые наборы, предназначенные для измерения буферизации, фактически измеряют KH воды. Чем выше KH, тем более стойкой будет вода к изменению pH. KH воды в аквариуме должна быть достаточно высока, чтобы предотвратить большие колебания pH, в течение некоторого времени. Если KH воды — ниже 4,5° dH, Вы должны постоянно контролировать уровень pH в аквариуме, для того что бы быть уверенным, что он не изменяется в опасных пределах. Это особенно важно, если Вы не производите регулярных подмен воды. В частности цикл азота, создает тенденцию для уменьшения уровня pH в течение некоторого времени.
Насколько точно понизится уровень pH, зависит от количества произведенных нитратов, также как и от жесткости воды. Если pH снижается больше чем на 0,2 пункта в месяц, необходимо позаботиться о повышении жесткости воды, либо более часто производить ее подмену. К тому же следует учесть важную особенность воды – ее способность к самовосстановлению. В особенности это касается жесткой воды. Так, например, разбавив на 50% водопроводную воду с рН = 7,5 дистиллированной водой и опустив тем самым рН до 6,5 или еще ниже, можете быть уверены, что через несколько часов рН станет близко к первоначальному 7,5. KH воды непосредственно не влияет на рыб, и обычно нет никакой необходимости точно выдерживать фиксированный уровень жесткости для специфических рыб.
В аквариуме с озерными цихлидами необходимо обеспечить достаточную буферизацию воды солями кальция и магния, так как нечаянный перекорм рыбок может запросто привести к самым печальным последствиям. Речные африканские виды легко выдерживают подкисление воды ниже уровня 7,0, но все же лучше себя чувствуют в щелочной воде. Нужно поддерживать идеальную чистоту и стабильный хим. состав воды.
Нужно поддерживать идеальную чистоту и стабильный хим. состав воды.
Влияние показателя рН на жизнь рыбок и растений.
Равновесие рН – КН – Со2. Определение показателя активной реакции воды.
Буферные системы
Буферная емкость крови. Образующаяся в различных органах и тканях рыб СО2 поступает в кровь, однако там концентрация свободной двуокиси углерода невелика. Объясняется это тем, что С02, диффундирующая из тканей в кровь, изменяет Свое физическое состояние путем образования угольной кислоты и затем бикарбоната. В результате в плазме крови возникает равновесие между растворенными С02, Н2С03, НСО и СО32. Поскольку при физиологических pH крови концентрация карбоната (СОэ2) чрезвычайно мала, основная часть двуокиси углерода находится в виде бикарбоната и угольной кислоты. В свою очередь, содержание бикарбонат-ионов при нормальной для крови величине pH в 20 раз больше, чем угольной кислоты [199]. Образующийся при диссоциации угольной кислоты Н+ не оказывает существенного влияния на величину pH крови благодаря наличию у позвоночных, в том числе и у рыб, мощной буферной системы крови. Основные звенья этой системы: Двуокись углерода — бикарбонат и белки крови (гемоглобин и плазменные белки). Буферные свойства белков определяются их амфотерностью, способностью диссоциировать, вследствие чего они могут служить как донорами, так и акцепторами ионов водорода.[ …]
Основные звенья этой системы: Двуокись углерода — бикарбонат и белки крови (гемоглобин и плазменные белки). Буферные свойства белков определяются их амфотерностью, способностью диссоциировать, вследствие чего они могут служить как донорами, так и акцепторами ионов водорода.[ …]
В почве имеются буферные системы, работающие по разнообразным механизмам, часто без участия твердой фазы почвы. Например, кислотно-основная буферность почвы может в значительной степени определяться наличием в почвенном растворе слабых кислот, оснований и их с лей. Наличие разнообразных буферных систем вызывает определенные трудности в разработке удобной для практического использования системы показателей, позволяющих количественно оценивать буферную способность почв.[ …]
Вследствие наличия в воде буферной системы (гидрокарбонат-ионы и углекислота) с рН; близким к 7, pH воды при гидролизе коагулянтов практически не изменяется.[ …]
Процесс удаления основан на химии буферной системы сульфит/бисульфит. [ …]
[ …]
В связи с тем, что природная вода является буферной системой, содержащей ионы НСОз- в присутствии малодиссоцииро-ванной Н2С03, pH ее при коагуляции меняется в небольших пределах и непропорционально дозе коагулянта. Поэтому применение данного показателя даже при наличии автоматических рН-метров нецелесообразно.[ …]
При нейтрализации промышленных сточных вод буферная система обычно не образуется; на рис. 7.8 приведены интегральные кривые, характеризующие изменение величины pH среды при нейтрализации едким натром осноос-новных кислот, имеющих различные константы ионизации (см. п. 2.14.2), и многоосновных (поливалентных) кислот; для сильных кислот характерен резкий скачок значения pH в точке эквивалентности.[ …]
Если взять смесь Прянишникова, то в ней имеется буферная система 1 ГН4ГГОз + СаНР04-2Н20; здесь азот представлен физиологически кислой солью и буфером против прдкисления служит СаНР04 • 2Н20.[ …]
Из приведенных уравнений видно, что Мировой океан может служить буферной системой, регулирующей содержание С02 в атмосфере. [ …]
[ …]
Существенное влияние на изменение концентрации Са2+ в клетке оказывав!1 буферная система цитозоля. Это третий механизм поддерживания низкого уровня свободных ионов Са2+ в цитоплазме. Система включает растворимые белки, связывающие Са2 что приводит к снижению его концентрации почти на два порядка при непрерывном поступлении Са2+ в клетку.[ …]
Размер этого подщелочения или подкисления зависит от начальной реакции и от буферного действия смеси. Если питательная смесь обладает буферной системой, то сдвиги реакции под влиянием физиологически кислых или физиологически щелочных солей ослабляются.[ …]
Казалось бы, при очень высокой замкнутости биосферного круговорота углерода и огромной буферной емкости биосферы и океана по связыванию атмосферного избытка С02 это увеличение не должно приводить к нарушению равновесия. Более того, можно было бы ожидать улучшения углеродного питания растений и повышения их продуктивности. Но в действительности содержание СО, в атмосфере на протяжении последних десятилетий неуклонно увеличивается. Следовательно, буферные системы биосферы и океана не справляются с регулированием равновесия потоков С02. Это можно объяснить снижением ассимиляционного потенциала земной флоры (в основном из-за быстрого сокращения площади лесов) и значительным загрязнением суши и поверхности океана.[ …]
Следовательно, буферные системы биосферы и океана не справляются с регулированием равновесия потоков С02. Это можно объяснить снижением ассимиляционного потенциала земной флоры (в основном из-за быстрого сокращения площади лесов) и значительным загрязнением суши и поверхности океана.[ …]
В природных водах эти формы, переходящие одна в другую, находятся в подвижном равновесии, участвуют в буферной системе воды и в круговороте веществ в водоеме.[ …]
Все буферные системы содержали 0,01 М Na SOs для предотвращения инактивации вследствие окисления [190]. Б. Осаждение ВТМ в ияоаликтричссной точно при pH, близком к 3,4. ТТпфскципштость снова может достичь нормы при подведении pH раствора, в котором находится осажденный материал, к значению, равному примерно 7,0 [180]. По оси ординат показано количество поражений, вызываемых испытуемой суспензией вируса, в процентах от контроля.[ …]
Кислые или щелочные стоки, попадающие в водоем, в определенном количестве могут быть нейтрализованы карбонатной буферной системой природных вод, состоящей из свободной угольной кислоты и гидрокарбонатов. Это же способствует поддержанию постоянства pH воды при введении реагентов в процессе обработки. В щелочных водах (при рН>8,5) буферные свойства природных вод определяются второй карбонатной буферной системой, состоящей из гидрокарбонатов и средних карбонатов (например, ЫаНС03 и Ыа2С03).[ …]
Это же способствует поддержанию постоянства pH воды при введении реагентов в процессе обработки. В щелочных водах (при рН>8,5) буферные свойства природных вод определяются второй карбонатной буферной системой, состоящей из гидрокарбонатов и средних карбонатов (например, ЫаНС03 и Ыа2С03).[ …]
В отсутствие аммонийного буфера подщелачивание может проводиться гидроксидами, карбонатами или гидрокарбонатами, в этом случае образуется буферная система карбонат/гидрокарбонат. Для поддержания стабильности анаэробного процесса могут потребоваться щелочи в количествах до 6000 мг/л. В общем, считается желательным, чтобы отношение количества жирных кислот к количеству, например, СаСОз было, по крайней мере, 1 :6.[ …]
Таким образом, концентрация ионов водорода прямо пропорциональна количеству Н2С03 и обратно пропорциональна содержанию НСОд. Концентрация водородных ионов такой буферной системы незначительно изменяется с разбавлением, так как pH системы определяется не концентрацией1 кислоты и ее соли, а отношением этих концентраций. [ …]
[ …]
Активная реакция водоема отличается также значительным постоянством. Она регулируется за счет определенных физикохимических явлений вследствие наличия в нем особой буферной системы, автоматически ее регулирующей.[ …]
Тяжелые металлы довольно устойчивы. Поступая в водоемы, они включаются в круговорот веществ и подвергаются различным превращениям. Неорганические соединения связываются буферной системой воды и переходят в слаборастворимые гидроксиды, карбонаты, сульфиды и фосфаты, а также образуют металлоорганические комплексы, адсорбируются донными осадками. Под воздействием живых организмов (микроорганизмов и др.) ртуть, олово, мышьяк подвергаются метилированию, превращаясь в более токсичные алкильные соединения. Кроме того, металлы способны накапливаться в различных организмах и передаваться в возрастающих количествах по трофической цепи. Особенно опасны ртуть, свинец, кадмий, мышьяк, так как они, поступая с пищей в организм человека и высших животных, могут вызывать отравления. Коэффициент материальной кумуляции у них колеблется от сотен до нескольких тысяч.[ …]
Однако при накоплении летучих кислот в больших количествах, что имело место при термофильных условиях, наблюдается существенное изменение pH до значения ниже критического для бикарбонатной буферной системы (р/С=6,35). Значения pH (кривая 3 на рис. 25.1) определяли, исходя из уравнения кислотно-щелочного равновесия, которое выводится ниже.[ …]
Когда создавались питательные смеси, методика измерения pH еще отсутствовала, но эмпирически в состав смесей подбирали соли в паре таким образом, чтобы влиянию физиологической реакции противодействовала соответствующая буферная система.[ …]
Поступающие в водоемы токсиканты включаются в круговорот веществ и претерпевают различные физико-химические превращения. Малостойкие, простые твердые и летучие вещества оседают на дно или улетучиваются, окисляются, связываются солями буферной системы воды или разлагаются под действием микроорганизмов и подвергаются детоксикации. Они оказывают на гидробион-тов прямое токсическое или косвенное воздействие, ухудшая физические свойства воды, газовый и солевой режимы водоемов.[ …]
Благодаря установке автоматического дозирования реагентов удалось обеспечить устойчивый режим нейтрализации промышленных стоков до pH=6,54-8,5. Отсутствие в кислых сточных водах слабых кислот и их солей в количестве, достаточном для создания буферной системы, позволило контролировать весь процесс нейтрализации по pH нейтрализованной воды.[ …]
Определяющую роль в смене ледниковых эпох межледниковыми играли орбитальные параметры Земли, ее размеры, исходная структура и состав, т.е. атрибуты космической организованности, более широкий спектр которых и предопределил неуничтоже-ние жизни, хотя эти факторы действовали в интеграции с буферными системами биосферы. И можно полагать, что роль последних со временем возрастала.[ …]
При попадании в кровь водородных или гидроксильных ионов в результате нормального процесса обмена веществ или в результате воздействия внешней среды (с повышенной концентрацией водородных или гидроксильных ионов), или в результате патологии в первую очередь эти ионы вступают во взаимодействие с буферной системой. Благодаря этому регулирование pH крови осуществляется прежде всего чисто физико-химическим путем за счет буферных свойств крови. Если же поступление в кровь Н или ОН продолжается с возрастающей силой и физико-химическим путем не удается нормализовать pH крови, тогда в регуляцию вступает гемоглобин и белки плазмы крови. Они как амфолиты реагируют на изменения pH, связывая или отдавая Н или ОН.[ …]
До сих пор иногда еще используют титриметрические методы определения озона и других окислителей. Эти методы обычно недостаточно чувствительны и, как указывается в работе [291, их результаты не отличаются стабильностью. Недостатком распространенного нейтрального иодидного метода, описанного Щир-ской [38], является отсутствие буферной системы в поглотительном растворе. Однако преимуществом этого метода может явиться то, что выделяющийся иод сразу же связывается солянокислым диметил-п-фенилендиамином. При этом развивается стабильная окраска и мешающее действие восстановителей значительно менее существенно, чем в других модификациях иодидного метода. Это обстоятельство отмечено в работе [39]. Целесообразно также для увеличения экстинкции поглотительного раствора за счет определения большего количества перекисных соединений добавлять в него катализатор — молибдат аммония (см. ниже).[ …]
В то же время исследования показывают [33], что даже в гомогенных трещиноватых породах должны наблюдаться довольно сильные различия в скоростях переноса и масштабах дисперсии между ионными и коллоидными миграционными формами, что связано с наличием вторичных минеральных отложений на стенках трещин: эти отложения увеличивают буферность системы по отношению к растворенному веществу, а кинетика их молекулярно-диффузионного насыщения увеличивает суммарную дисперсию фронтов — в сравнении с чисто механической дисперсией коллоидов. Кроме того, авторы работ [29,30] напоминают, что коллоиды, как более тяжелые частицы, концентрируются в средней плоскости трещин, где имеют место повышенные скорости движения воды. Определенную роль может играть и исключение трещин ограниченного раскрытия из процесса миграции коллоидов, что также приводит к их перемещению со скоростями, превышающими средние действительные скорости движения подземных вод (и -у/п).[ …]
Биогеохимический цикл серы характеризуется обширным резервным фондом в земной коре, и меньшим – в атмосфере (рис. 10.6). В результате слаженного взаимодействия обменного и резервного фондов сера не является лимитирующим фактором. И, наконец, углерод участвует в цикле с небольшим, но весьма подвижным фондом в атмосфере (рис. 10.7). Благодаря буферной системе карбонатного цикла круговорот приобретает устойчивость, но он все-таки уязвим из-за небольшого объема резервного фонда (0,029% С02).[ …]
Наиболее подходящим решением является применение биологической очистки, главным образом в аэротенках с продленной аэрацией. При этом скорость восходящего потока в осветлителе должна быть низкой. Продленная аэрация позволяет существенно снизить объем образующегося избыточного ила и обеспечить благодаря большому объему аэротенка значительную буферность системы, что дает ей возможность справиться с особенно резкими колебаниями нагрузки, характерными для системы очистки стоков предприятий этой отрасли промышленности.[ …]
Так как эти ионы вызывают контракцию пигментной клетки; только в неповрежденной чешуйке, то надо считать, что указанные ионы проникают не через общую поверхность эктоплазмы меланофора, а только через неповрежденный синапс. Изменения pH, омывающего клетку раствора, в пределах 4,47—7 не оказывают влияния нг сократимость меланофора. Это указывает на то, что его собственная буферная система очень сильно выражена.[ …]
Предложенная Лавлоком гипотеза Геи указывает на важность изучения и сохранения регулирующих механизмов, которые позволяют биосфере приспособиться по крайней мере к некоторому количеству не сосредоточенных в одной точке загрязнений, например загрязнении двуокисью углерода, «теплом», окислами азота и т. д. Соответственно, стремясь всеми средствами снизить уровень загрязнения, человек должен также сохранять целостность п крупномаспггабность буферной системы жизнеобеспечения.[ …]
Для оценки качества воды важной характеристикой является pH. У большинства поверхностных вод pH колеблется в пределах от 6,5 до 8,5. Подземные воды иногда имеют повышенное значение pH. Кислую реакцию среды имеют рудничные воды сульфидных, колчеданных месторождений, содержащие сульфат железа (II), воды болот, в которых находится значительное количество гумусовых кислот. Обычно pH природных вод данного источника является величиной постоянной. Постоянство pH природных вод обусловлено наличием в них буферной системы, состоящей из свободной угольной кислоты и гидрокарбонатов. Поэтому заметные изменения pH могут быть показателем загрязнения воды бытовыми или промышленными стоками. Дистиллированная вода, вследствие растворения диоксида углерода из воздуха, может иметь pH до 5,7. Водородный показатель морской воды изменяется в пределах от 8,2 до 8,5.[ …]
Для изменения концентрации ионов Н+ в любом водном растворе используют так называемую шкалу pH, с помощью которой обозначают концентрацию водородных ионов (Н+) в водных растворах, кислотность которых находится между 1,0 МН+ и 1,0 МОН . Так значение pH для нейтрального раствора составляет 7,0, тогда как растворы, имеющие pH выше 7,0, — это щелочные растворы, а меньше 7,0 — это кислые растворы. Например, pH питьевой воды составляет 9,0, нашатырного спирта — 12,0, черного кофе — 5,0 лимонного сока — 2,0, а желудочного сока — 1,0. Величины pH характерны для всех внутриклеточных и внеклеточных жидкостей в организме, причем постоянство концентрации водородных ионов поддерживается буферными системами, которые у млекопитающих представлены фосфатной и бикарбонатной системами. Величины pH всех жидкостей организмов исключительно постоянны. Их изменения чрезвычайно неблагоприятны для организмов, поскольку даже небольшие сдвиги pH характеризуются значительным падением каталитической активности ферментов.[ …]
Регуляция кислотно-щелочного баланса осуществляется органами выделения и дыхания, однако удельный вес этих органов у наземных и водных позвоночных неодинаков. У позвоночных с воздушным дыханием ведущую роль в поддержании кислотно-щелочного равновесия играют почки (выведение электролитов с мочой), а у позвоночных с водным дыханием — жабры. Нетрудно себе представить, какие сложные физиологические задачи по перестройке регуляции кислотно-щелочного равновесия возникают у двоякодышащих рыб, вынужденных периодически переходить с водного дыхания на воздушное и наоборот. Ведь у рыб кислотно-щелочное равновесие адаптировано к напряжению С02 порядка 2—3 мм рт.ст. При переходе двоякодышащих рыб на воздушное дыхание напряжение С02 в крови резко возрастает, что ставит перед необходимостью перестройки буферной системы крови для удаления избытка С02 из крови. Экспериментально установлено, что переход двоякодышащих рыб на воздушное дыхание приводит к возникновению дыхательного ацидоза, отрицательные последствия которого компенсируются развивающимся метаболическим алкалозом [475]. Напомним, что при дыхательном ацидозе pH крови снижается, концентрация бикарбоната возрастает, а при дыхательном алкалозе наступают противоположные по направленности изменения. Таким образом, дыхание, сопровождающееся образованием двуокиси углерода, ее поступлением в кровяное русло и выведением из организма, а точнее — нарушение нормального хода этих процессов может оказать существенное влияние на кислотно-щелочное равновесие и величину pH крови, что, в свою очередь, отразится на эффективности механизмов связывания и транспортировки кислорода гемоглобином.[ …]
Соотношение свободной угольной кислоты (С02 + Н2С03), ионов бикарбоната (НСОз) и карбоната СОр) меняется в зависимости от величины pH. В кислой среде при pH, равном 4,0, в воде присутствует только свободная углекислота, а ионы бикарбоната практически отсутствуют (рис. 8). В интервале pH от 6 до 10 в воде в разных соотношениях имеются свободная углекислота и ионы бикарбоната, причем в слабощелочной среде (pH 8,37) ионы бикарбоната составляют 98% всей углекислоты. При дальнейшем увеличении щелочности (pH больше 10,5) резко нарастает количество ионов карбоната и углекислота представлена уже в основном карбонатами. Иными словами, чем больше в воде свободной углекислоты, тем ниже величина pH, и наоборот. В кислой среде ионы карбоната превращаются в ионы бикарбоната за счет связывания ионов Н+, что ведет к повышению величины pH, сдвигая ее в щелочную сторону. Напротив, в щелочной среде вследствие диссоциации угольной кислоты ионы Н+ накапливаются, а величина pH снижается. При этом количество ионов карбоната увеличивается. Ионы бикарбоната и карбоната, вступая во взаимодействие с ионами щелочноземельных металлов, главным образом Сз2+ и отчасти Мд2+, играют важнейшую роль в создании буферной системы, препятствующей резкому изменению величины pH в природных водах.[ …]
Жёсткость и буферные свойства воды. gH и kH в растительном аквариуме
Жёсткость и буферные свойства воды. gH и kH.
Наверное, качественная вода в аквариуме — это самый главный аспект успешного акваскейпа. Правы те, кто говорят, что содержание аквариума — это содержание воды.
Ко мне часто обращаются за консультацией с вопросом о том, как сделать красивый, успешный аквариум, но при условии, что «у меня не идеальная вода».
Так вот первое, с чего необходимо начать путь к здоровому растительному аквариуму — озаботиться качеством воды в аквариуме. Невозможно взять любого качества воду и сделать в ней шедевр. Воду необходимо создать (подготовить), а затем уже использовать в аквариуме.
При подходе «использовать ровно то, что течёт из крана» придти к успешному аквариуму гораздо сложнее. И зачастую именно водопроводная вода является первоочередной проблемой появления водорослей, заболевания рыб, гибели креветок.
Пришла пора разобраться, что же за такие значения в воде кН, gH, TS, TDS, TSS.
Как их измерять и контролировать. И вообще, зачем всё это нужно.
TS (общий объём солей) = TDS+TSS — это всё, что растворено в воде. В зависимости от гранулометрического состава можно выделить:
TSS (объём взвешенных частиц) = общее содержание частиц, размер которых превышает 2 микрона. Это могут быть отходы рыб, бактерий, отгнившие ткани растений. Это инструментально неизмеримый показатель, который можно заменить на параметр «прозрачность\мутность». В аквариумах такие тестирования не проводятся, разве что на глаз, но для любознательных коротко расскажу про тестирование воды на показатель TSS.
Сквозь специальный фильтр проливается вода, после чего фильтр промывается деионизационной водой (из-под фильтра обратного осмоса). Это делается с той целью, чтобы показатели растворённых солей (TDS) не влияли на показания TSS. Затем измеряется прирост в весе фильтра.
Работая сотрудником галереи природных аквариумов, я заметил, что многие отмечали чрезвычайную прозрачность воды в аквариумах. Это как раз можно и отнести к параметру TSS.
Этот параметр важен при содержании мелких рыбок и креветок. У них нежные жабры, которые могут забиваться частичками TSS, что может привести к их гибели.
TSS можно регулировать:
- механически с помощью мощной фильтрации внешними фильтрами, внутренними фильтрами с синтепоновым наполнителем.
- химически с помощью специальных кондиционеров от мутной воды, осаждающих из толщи воды на дно столь крупные частицы. Затем их необходимо отсифонить со дна.
Обилие взвешенных частиц может быть следствием перекорма ваших рыбок, перенаселения аквариума (много отходов жизнедеятельности рыбок и, как следствие, бактерий), гибели листьев растений (а, значит, что-то в аквариуме не в порядке) или недостаточной фильтрации в вашем аквариуме.
С точки зрения акваскейпинга обилие взвешенных частиц влияет на появление водорослей на листьях, т. к. эти частицы могут осаждаться на листьях растений и, значит, являться местом (субстратом) роста водорослей. Многими любимый мох и вовсе может погибнуть от обилия TSS на листьях и стеблях.
Исходя из этого, в акваскейпах профессионалов редко можно увидеть одновременно большое количество рыб (тем более крупных) и обилие мха.
Степень фильтрации аквариума оценивается не только с позиции объёма фильтрущего наполнителя (media), но и по мощности течения из фильтра. Так, присутствие большого количества взвешенных частиц может может говорить и о недостаточно течения в аквариуме. Не забудьте позаботиться и об этом. Например, своевременно промывать фильтр, менять наполнители.
В случае сильно разросшегося аквариума, возможно, будет хорошим решением поставить помпу течения. Она не имеет наполнителя, а лишь создаёт дополнительное течение в аквариуме.
Также, чем больше растворённых веществ в воде, тем меньше прозрачность воды, что оказывает сильное воздействие на проникновение света в воду. А это прямая зависимость с процессом фотосинтеза растений.
Думаю, с TSS разобрались.
TDS (объём растворённых солей) = gH + kH + Нитраты + Нитриты + Хлориды + Хлорамины + Сульфаты + Фосфаты + Аммоний + Карбонаты + Бикарбонаты + другие соединения (удобрения, кондиционеры для воды, лекарства для рыб)
Инструментально измеряемый параметр воды, показывающий, сколько всяких химических добавок растворено в воде.
Например, с помощью него можно понять, насколько вода жёсткая или мягкая (но это не является оптимальным параметром для такого анализа), насколько хорошо растения потребляют добавляемые в воду удобрения.
По количеству растворённых солей выделяются следующие категории:
Менее 1500 мг\л (ppm) — пресная вода
1500-5000 мг\л (ppm) — солоноватая вода
Более 1500 мг\л (ppm) — морская вода
Особенно высокое значение TDS может быть признаком низкого качества воды.
В случае с TSS нам часто бывает достаточно установить качественный фильтр и взвешенных частиц станет гораздо меньше в воде или их не будет вовсе. В случае же с TDS механическая фильтрация не работает. Здесь нам в помощь будет только химическая компонента фильтрации аквариума.
Зачем нам необходимо знать про TDS и где именно это применяется в аквариумистике?
Первое и, наверное, самое важное — это химическая чистота исходной воды. Почти все профессиональные акваскейперы используют фильтры обратного осмоса для создания своих аквариумов. Это специальные фильтры, устанавливающиеся в магистрали водопровода вашего дома или квартиры, наподобие обычных бытовых фильтров, с той лишь разницей, что пить такую воду нельзя и она используется в специализированных целях, одна из которых, как раз, аквариум с растениями.
Фильтры обратного осмоса очищают водопроводную воду до состояния почти дистиллированной. Степень очистки воды контролируется как раз параметром TDS.
Обратноосмотический фильтр состоит из префильтров: фильтра механической очистки и угольного фильтра, а также мембраны — основного элемента обратноосмотического фильтра. Префильтры служат в качестве защиты мембраны для увеличения её срока работы.
При TDS из водопровода ~ 300 картридж угольного фильтра расходуется в течение недели, картридж механической очистки — в течение двух недель, а вот состояние мембраны можно оценить только по TDS. Новый фильтр очищает воду с ~300 TDS до ~4. Когда значение TDS воды после фильтра (обычно измерение делается на выходе из мембраны) начинает расти даже с учётом новых фильтров, значит, близится время замены мембраны на новую.
Стоимость полной статьи 1000р
Чтобы прочитать остальные 70%, напишите мне в Инстаграм или Телеграм
Изучение кислотно-основной буферности почв методом непрерывного потенциометрического титрования
Кислотно-основная буферность почвы является важнейшей почвенно-химической характеристикой, ее определяют как способность почвы противостоять изменению рН при добавлении к почве кислоты или основания.
Буферные свойства почвы по отношению к кислотам и основаниям играют ключевую роль в поддержании экологического равновесия не только в самом профиле почвы, но и в ландшафте. Именно от этих свойств зависит количество кислотных и оснóвных реагентов, которое задерживается в почвенном профиле или мигрирует с раствором через почву и попадает в другие компоненты экосистем – в биоту, почвообразующие породы, поверхностные и грунтовые воды. Это положение справедливо как для фоновых территорий, так и для районов, подвергающихся большой антропогенной нагрузке и техногенному загрязнению.
Буферность почв оценивают по экстенсивному и интенсивному показателям.
Экстенсивный показатель – это общее количество кислоты или основания, которое нужно добавить к суспензии почвы или к вытяжке из почвы при заданном разбавлении, для смещения значения рН от начальной точки титрования до заданного конечного значения, которое определяется целью и задачами исследования. Каждый почвенный образец характеризуется единственным показателем общей буферности. Этот показатель измеряется в молях эквивалентов кислоты или основания на единицу массы почвы.
Интенсивный показатель или интенсивность буферности определяют по экспериментальным данным и рассчитывают по уравнению:
β = ΔCi/ΔpH,
где ΔCi– количество добавленного в условиях опыта реагента, ΔpH – измеренное изменение рН в системе, которое произошло после добавления очередной порции титранта. Образец почвы не может быть охарактеризован единственным показателем интенсивности буферности, т.к. по мере изменения рН в системе при добавлении кислоты или основания в буферные реакции вступают различные компоненты почвы. Поэтому интенсивность буферности обычно представляют в виде графика зависимости буферности или логарифма этой величины от рН.
На кафедре химии почв есть титратор фирмы Mettler Toledo модель DL-58, позволяющий в автоматическом режиме проводить непрерывное титрование суспензий и вытяжек из почвы в широком интервале значений рН с заданным шагом добавления титранта в атмосфере без СО2 при постоянном перемешивании. Прибор обеспечен необходимыми компьютерными программами. Титратор находится в комнате 398П в ведении профессора И.И.Толпешта.
На рисунке представлен график зависимости интенсивности буферности к кислоте и основанию для горизонта А перегнойно-глеевой почвы до и после обработки по Мера и Джексону. Данные получены аспиранткой Ю.Г.Изосимовой в ходе выполнения диссертационной работы.
БУФЕРНЫЕ СВОЙСТВА (буферное действие и растворы)
БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции раствора, которое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным действием.
Буферное действие
Если к десяти кубических см децинормального раствора уксусной кислоты постепенно добавлять раствор едкого натра такой же концентрации, то кислотность раствора, определяемая концентрацией содержащихся в нем свободных водородных ионов, будет уменьшаться. При прибавлении 10 кубических см NaOH процесс связывания кислоты щелочью, процесс нейтрализации, окажется законченным, вся уксусная кислота превратится в соответствующую соль – уксуснокислый натрий, а соединившиеся Н и ОН-ионы дадут молекулы воды. Дальнейшее добавление NaOH даст преобладание свободным гидроксильным ионам – щелочную реакцию. Помещаемая здесь кривая (смотрите рисунок 1, сплошная линия) передает изменения реакции, выраженной через рН (водородный показатель, – смотрите Водородные ионы), наблюдаемые при нейтрализации уксусной кислоты.
Рисунок 1. Изменение реакции (буферные свойства в действии)
Прерывистая линия на том же рисунке изображает соответствующее изменение реакции (рН) при прибавлении NaOH к децинормальной соляной кислоте. Если сравнить обе кривые и посмотреть, сколько потребовалось щелочи для одинакового изменения реакции, напр., для изменения рН от 4 до 5, то результаты окажутся весьма различными: в первом случае – около 5 кубических см NaOH, во втором – едва уловимые следы последнего. Количество щелочи (или соответственно кислоты), которое требуется для определенного изменения реакции, и является мерилом устойчивости реакции раствора, величины его буферного действия. В первом случае оно весьма значительно, во втором – совершенно ничтожно. Если количество грамм-эквивалентов щелочи (или, соответственно, кислоты), прибавленной к литру испытуемого раствора, обозначить знаком ДВ, а вызванное этим изменение реакции через ДрН, то, по Ван-Слайку (Van-Slyke), буферное действие будет равно отношению этих величин: Буферное действие = отношение ДВ к ДрН. Различие в хорде кривых для обоих рассмотренных выше растворов обусловлено свойствами обеих кислот. Соляная кислота принадлежит к сильным кислотам, полностью диссоциированным на свои ионы. Напротив, уксусная кислота сравнительно слабо диссоциирована: только небольшая часть ее молекул (в децинормальном растворе около 1,3%) распадается и дает водородные ионы, определяющие кислую реакцию раствора. Поэтому, уксусная кислота имеет значительно менее кислую реакцию (больший рН), чем соляная в одинаковой молекулярной концентрации. При прибавлении NaOH гидроксильные ионы щелочи связывают водородные ионы. Но в силу общих условий химическом равновесия удаление продуктов диссоциации вызывает распад новых, прежде недиссоциированных молекул, освобождая все новые количества Н-ионов на место связываемых щелочью. Таким образом, уксусная кислота (в отличие от полностью диссоциированной соляной), кроме свободных, активных Н-ионов, обусловливающих активную реакцию раствора, обладает еще в своих недиссоциированных молекулах запасными, резервными водородными ионами, резервной кислотностью, способной быстро пополнять убыль свободных ионов. Эти кислотные резервы (или щелочные, если раствор может освобождать запасные ОН-ионы и связывать прибавляемые кислоты) и обусловливают его буферное действие; оно тем значительнее, чем больше резервных ионов мобилизуется при данном изменении реакции. Самое название (буферное действие) было дано по аналогии с железнодорожными буферами, смягчающими резкость механических толчков. Более правильным было бы сравнение с сосудами различной емкости, в которых прибавление одинакового количества жидкости вызывает различное изменение уровня. Чем значительнее емкость сосуда, тем больше требуется жидкости для определенного повышения уровня; подобным же образом от количества резервных Н – или О Н-ионов («буферной емкости») зависит количество щелочи (или кислоты), необходимое для данного изменения «уровня» реакции.
Буферные растворы
Электролитическая диссоциация слабых кислот и щелочей резко понижается в присутствии солей, имеющих общий с ними ион. Напр., уксусная кислота значительно слабее диссоциирована в присутствии своей натриевой соли (уксуснокислого натрия, дающего, подобно уксусной кислоте, ацетат-ион) и дает значительно меньше водородных ионов, чем в чистом растворе. Концентрация водородных ионов прямо пропорциональна концентрации молекул уксусной кислоты и обратно пропорциональна концентрации ацетат-ионов. Так как нейтральные соли принадлежат к сильным электролитам, почти полностью диссоциированным на свои ионы, можно с достаточным приближением, вместо концентрации ацетат-ионов, взять просто концентрацию соответствующей соли. Концентрация водородных ионов в таком растворе, содержащем слабую кислоту и ее соль, выразится тогда простой формулой (в которой прямоугольные скобки обозначают концентрацию стоящих в них веществ): [Н’]=К [кислота] / [соль] (1).
Подобным же образом в смеси слабой щелочи и ее соли концентрация гидроксильных ионов (по которой точно так же легко вычислить тесно связанную с ней концентрацию Н-ионов и реакцию раствора) определяется аналогичным выражением: [Н’]=К [щелочь] / [соль] (2).
Для более точного расчета необходимо было бы в обеих формулах несколько уменьшить знаменатель, умножив его на степень диссоциации соли (величину меньшую единицы). Такие смеси имеют особенно большие количества резервных, легко мобилизуемых Н- и ОН-ионов и соответственно особенно большое буферное действие. При этом они делают реакцию раствора устойчивой одновременно по отношению и к щелочам и к кислотам. Так, напрример, смесь уксусной кислоты с уксуснокислым натрием (получающаяся при частичной нейтрализации уксусной кислоты едким натром, смотрите рисунок), как мы видели, сравнительно мало изменяет свою реакцию при подщелачивании. Точно так же при прибавлении сильной кислоты, напр., соляной, действие ее ослабляется благодаря тому, что она соединяется с натрием, вытесняя эквивалентное количество слабой уксусной кислоты из ее соли. Растворы подобных смесей слабой кислоты или щелочи с соответствующей солью, так называемые буферные растворы, приобрели особенное значение благодаря той легкости, с которой по приведенным формулам (1) и (2) может быть вычислена их реакция. Постоянная К в этих формулах представляет характерную для каждой кислоты или щелочи константу – т. н. константу диссоциации. Если кислота и ее соль присутствуют в равной (эквивалентной) концентрации, то, очевидно, концентрация водородных ионов делается численно равной константе диссоциации ([Н’]=К). Таким образом, константа диссоциации кислоты (или, соответственно, щелочи) непосредственно указывает среднюю реакцию, в районе которой проявляется буферное действие данной смеси. В этой точке буферное действие более чем особенно велико. В следующей таблице приведен водородный показатель нескольких буферных растворов: смеси уксусной кислоты и уксуснокислого натрия (ацетатная смесь), однометаллического (первичного) и двуметаллического (вторичного) фосфата натрия (NaH2PO4 и Na2HPO4) и аммиака с хлористым аммонием.
Таблица рН буферных смесей.
Уксусная кислота
Молярное соотношение
Уксусно- кисл. Na
32:1 3,2 16:1 3,5 8:1 3,8 4:1 4,1 2:1 4,4 1:1 4,7 1:2 5,0 1:4 5,3 1:8 5,6 1:16 5,9 1:32 6,2 Первичный фосфат
Вторичный фосфат
Хлор. аммоний
Аммиан
1 4 7 0 3 7 3,3 8,0 8,3 8,6 8,9 9,2 9,5 9,8 10,1 10,4 10,7 11,0
Из формул (1) и (2) можно непосредственно вывести одно очень важное свойство буферных растворов: реакция, даваемая буферной смесью, зависит (в первом приближении) исключительно от соотношения и её компонентов, а не от их абсолютной концентрации. Поэтому и в приведенной таблице можно было, не приводя концентрации кислоты (или щелочи) и соли, ограничиться указанием их соотношения. Разбавление буферного раствора не влияет на его реакцию. Конечно, того же нельзя сказать о буферном действии. При данной реакции оно тем значительнее, чем выше концентрация буферов. Рассмотренные свойства буферных растворов определяют их важнейшие практические применения:
- Очень многие биохимические и биологические процессы в высокой степени чувствительны даже к незначительным изменениям реакции (смотрите Активная реакция и Водородные ионы). В самом ходе этих процессов часто вырабатываются большие количества кислых или щелочных продуктов, которые могли бы изменить или даже совершенно остановить их дальнейшее течение. Для точного изучения подобных процессов необходимо их проводить в условиях, исключающих возможность сколько-нибудь значительных колебаний реакции. Для этого служат буферные растворы, применяемые здесь как регуляторы реакции. Этот метод был применен Серенсеном (Sorensen, 1909 г.) для изучения влияния активной реакции на деятельность ферментов. В зависимости от количества вырабатываемых кислых или щелочных продуктов, с одной стороны, от желательной степени постоянства реакции – с другой, приходится применять растворы с более или менее значительным буферным действием.
- В других случаях величина буферного действия не имеет особенно существенного значения, а применение буферных растворов основано на даваемой ими возможности готовить стойкие растворы любой желательной реакции (смотрите таблицу). При помощи индикаторов – веществ, меняющих свою окраску в зависимости от активной реакции раствора, можно сравнивать исследуемый раствор с серией буферных растворов известной реакции. Устанавливая, в каком из этих растворов данный индикатор принимает такую же окраску, как и в испытуемом, можно определить реакцию последнего. Таким образом, буферы применяются здесь как стандартные растворы, путем сравнения с которыми измеряется реакция. Применение таких стандартных буферных растворов лежит в основе индикаторного, или колориметрического метода измерения реакции. Другие буферные системы. Другие хим. системы также могут оказывать более или менее значительное буферное действие. Оно может зависеть, например, от выпадения в осадок прибавляемой щелочи или кислоты. Так, если к морской воде прибавлять едкий натр, раствор будет подщелачиваться до тех пор, пока его рН не сделается равным, приблизительно 8,6. При этой реакции начнет осаждаться Mg(OH)2, образующийся из магниевых солей и прибавляемого NaOH; дальнейшее увеличение щелочности приостановится, пока весь магний не выпадет из раствора. Далее, даже нерастворимые вещества (например, животный уголь) могут захватывать прибавляемые кислоты или щелочи путем адсорпции. Наконец, очень сильным буферное действием отличаются белки и другие амфотерные вещества (смотрите Амфолиты). Благодаря своей двойственной («амфотерной») природе, они могут связывать как кислоты, так и щелочи. Амфотерный характер клеточных коллоидов имеет большое значение для постоянства внутриклеточной реакции.
Буферы морской воды
Изменения реакции оказывают огромное влияние на жизненные явления; жизнь возможна лишь в определенном, для большинства организмов сравнительно узком, интервале концентраций Н- и ОН-ионов. Поэтому в природе буферы играют большую роль в поддержании необходимого для жизни постоянства реакции. Морская вода, представляющая естественную внешнюю среду большинства водных организмов, обладает весьма значительным буферное действием, которое зависит от содержащейся в ней бикарбонатной смеси – сочетания углекислоты и двууглекислого натрия (бикарбоната натрия). Благодаря наличию этого буфера, сохраняется обычная слабощелочная реакция морской воды и умеряются колебания реакции, которые производят водные организмы, поглощающие при фотосинтезе CO2 или выделяющие кислые продукты обмена веществ.
Буферные свойства крови
Особенный интерес представляют буферные свойства внутренней среды организма, в частности, крови. Кровь имеет слабощелочную реакцию, отличающуюся большим постоянством. Даже in vitro кровь стойко удерживает свою реакцию и обладает весьма большим буферным действием. К ней приходится прибавлять в несколько десятков раз больше едкого натра, чем к дистиллированной воде, чтобы вызвать одинаковое подщелачивание раствора, и в несколько сот раз больше НС1 для одинакового подкисления. Так же, как и в морской воде, главным буфером кровяной сыворотки является бикарбонатная смесь – сочетание CO2 и NaHCO3. Даваемая ею концентрация Н-ионов приближенно определяется так: [Н’]=К [СO2] / [NaHCO3] (3), где К равняется, приблизительно, 3 * 10-7. В сыворотке содержатся также фосфаты, однако, по сравнению с бикарбонатами, их количество и их роль невелики. В отношении буферного действия бикарбонатный раствор вполне сходен с кровяной сывороткой.
Так, например, обе жидкости растворяют одинаковое количество CO2, пропорциональное ее парциальному давлению в окружающем воздухе. При изменении этого давления, как показывает формула (3), во столько же раз изменяется в них концентрация водородных ионов. Цельная кровь со своими форменными элементами обнаруживает при тех же условиях заметно большее постоянство реакции. Это добавочное, по сравнению с сывороткой, Буферное действие зависит от амфотерных белковых веществ крови, в частности – от находящегося в эритроцитах НЬ. Последний представляет очень слабую кислоту, настолько слабую, что его кислый характер не может проявиться при избытке CO2. Но, когда давление последней понижено, например, в артериальной крови, оксигемоглобин, как кислота, разлагает некоторое количество бикарбоната, вытесняя из него CO2. В результате уменьшается знаменатель в формуле (3) и отчасти компенсируется влияние пониженного содержания CO2.
Таким образом, НЬ оказывает существенное влияние на кривую связывания углекислоты, а тем самым и на реакцию крови. В частности, он умеряет различия, связанные с различным давлением CO2 в артериальной и в венозной крови. Во всяком случае, в конечном итоге реакция крови вполне определяется соотношением углекислоты и бикарбоната, т. е. отношением свободной (растворенной) CO2 и CO2 химически связанной. Первая легко выделяется из крови, вторая может быть вытеснена путем разложения бикарбонатов кислотами. Обе эти величины – количество свободной и связанной CO2 – совместно характеризуют буферные свойства и реакцию крови. Их измерение получило в последнее время большое распространение и значение.
В отношении своей реакции кровь обладает теми же свойствами, что и другие буферные растворы. Мы видели, что реакция буферной смеси определяется соотношением кислоты и ее соли, а не их абсолютной концентрацией. Соответственно этому и реакция крови остается практически неизменной даже при многократном разбавлении ее изотоническим раствором NaCl (или любым другим безбуферным раствором). Этим свойством крови нередко пользуются при измерении ее реакции, применяя с этой целью небольшое количество крови, разбавленной раствором NaCl. Оно же делает безвредным внутривенное вливание различных так наз. «физиологических растворов», нередко имеющих ненормальную реакцию, которая оказалась бы гибельной для организма, если бы уже небольшая примесь крови не приближала ее к физиологической норме. При прибавлении к крови in vitro щелочи эта последняя нейтрализуется углекислотой; напротив, всякая кислота реагирует с бикарбонатом и, образуя нейтральную соль, заменяется эквивалентным количеством вытесненной ею из бикарбоната CO2. Этим объясняется замечательный факт, не раз уже обращавший на себя внимание исследователей: путем введения в кровь (in vivo) различных кислот – от наиболее слабых до самых сильных – оказывается совершенно невозможным добиться различного (соответственно силе применяемой кислоты) изменения реакции крови.
Пока в крови остается некоторое количество бикарбонатного буфера, изменения реакции оказываются во всех случаях одинаково ничтожными. Затем, одновременно с резким нарушением реакции, наступает смерть. Эти грубые экспериментальные воздействия дают наглядное представление о том, что происходит в организме в естественных условиях. Огромное большинство продуктов обмена веществ имеет кислый характер (фосфорная, угольная, молочная, масляная и другие кислоты). От этих непрерывно поступающих из тканей кислот и должны буферы крови предохранить ее нормальную реакцию. Последняя является слабощелочной, то есть характеризуется небольшим избытком активных гидроксил-ионов. Водородный показатель (рН) крови равняется, в среднем, 7,4, концентрация Н-ионов – 0,44 * 10-7, концентрация ОН-ионов – около 7 * 10-7 (при 37°). По сравнению с этой незначительной концентрацией свободных ОН-ионов количество резервных ионов, которое может быть освобождено для связывания прибавляемых кислот, весьма велико (около 2 * 10-2). Их количество, однако, далеко не отличается таким постоянством, как активная реакция крови, и может подвергаться сильным изменениям, особенно в патологических условиях.
Щелочные растворы представляют лишь первый барьер против вводимых извне или вырабатываемых в организме кислых продуктов. Производимое последними нарушение реакции во много раз ослабляется буферами крови, но не может быть ими совершенно устранено: связывание части молекул бикарбоната и освобождение CO2 смещает первоначальное соотношение этой основной буферные смеси. Более тонкая регуляция реакции совершается легкими. Всякое увеличение концентрации водородных ионов служит возбудителем дыхательного центра и немедленно усиливает вентиляцию легких (смотрите Дыхание). Благодаря высокой чувствительности дыхательного центра к Н-ионам, аппарат легочной регуляции работает необычайно точно: удаляя из крови, в зависимости от существующей в ней активной реакции, большие или меньшие количества CO2, он автоматически восстанавливает нормальное соотношение между нею и бикарбонатом.
Буферы крови защищают организм от резких колебаний реакции, которые были бы для него гибельны; дыхательный аппарат обеспечивает постоянное соотношение компонентов буферной смеси (даже при резких изменениях их абсолютной концентрации) и тем самым – точное постоянство активной реакции. Особенно значительное патологическое накопление нелетучих кислот и соответствующее уменьшение резервной щелочности наблюдаются при ацидозах. Однако, и оно обычно не ведет к изменению активной реакции крови: путем усиленной вентиляции легких достигается уменьшение содержания CO2, компенсирующее в большинстве случаев понижение концентрации бикарбоната («компенсированный ацидоз»). Противоположное явление представляет компенсированный алкалоз, при котором увеличение щелочных резервов компенсируется пропорциональным повышением давления CO2. Изменения содержания СО 2 в альвеолярном воздухе легких может служить в обоих случаях прямым показателем изменений концентрации бикарбонатов в крови. Общее количество буферов в крови в первом случае уменьшается, во втором увеличивается, но активная реакция остается практически постоянной.
Литература: Мiсhаеlis L., Die Wassers offionen-konzentration, Т. 1, Aufl. 2, B„ 1922; Кора-cuwsly W., Les ions d’hydrogene, P., 1926; Kolthoff J. M., Der Gebraueh von Farbenindi-katoren, 3 Aufl., В., 1926; Van Slyke D., The carbon dioxide carriers of the blood, Physical Review, v. I, p. 141, 1921. Д. Рубинштейн. В.
Изучайте:
- ЛАЗАРЕТ
ЛАЗАРЕТ, стационарное леч. заведение, гл. обр. в войсках. Л. получил свое название от проказы, носившей в нек-рых стран… - ТЕЛЛУР
ТЕЛЛУР, Tellurium, хим. символ Те, занимает 52-е место в периодической системе. Гомолог серы и селена (VІ группа). Ат. … - ЛОГАРИФМИЧЕСКАЯ ЛИНЕЙКА
ЛОГАРИФМИЧЕСКАЯ ЛИНЕЙКА, прибор, позволяющий быстро, хотя и не очень точно, производить математические вычисления (умно… - ERETHISMUS: эретизм
ERETHISMUS: эретизм, (от греч. Erethiso – раздражаю, возбуждаю), эретизм, термин, употребляемый преимущественно по отн… - БИСЕКСУАЛИЗМ
БИСЕКСУАЛИЗМ (от лат. bis—дважды и sexus—пол), одновременное наличие у нормально раздельнополого животного, в том числе…
Формула воды: состав и водоподготовка.
Сегодня бариста и обжарщики хорошо знают о влиянии воды на качество кофейных напитков. О водоподготовке написаны отличные пособия Water Quality Handbook SCA и Water for Coffee Максвелла Колонны-Дэшвуда и Кристофера Хэндона. Но интереснее не следовать готовым формулам, а ставить эксперименты.Специалист по кофе в Royal Coffee Крис Конрман/ Chris Kornman исследует разную воду, чтобы выяснить ее влияние на вкус кофе. В первой части Крис рассматривает химический состав воды и основы водоподготовки. Оригинал статьи опубликован на Daily Coffee News. Мы подготовили перевод в сокращенном виде.
Вода: состав и поведение
Вода – это гораздо больше, чем знакомая нам формула h3О. Кстати, именно она делает возможной разные типы сложных химических взаимодействий. Важное доказательство сложности воды – ее молекулярная структура, довольно слабые связи между элементами внутри формулы h3O. Например, вода (h3O) взаимодействует с атмосферным углекислым газом (CO2), создавая угольную кислоту h3CO3. Подобные свойства воды важны для понимания ее буферной системы и буферной емкости. Буферная емкость – свойство, которое мешает резким колебаниям pH и поддерживает его постоянный уровень. Для воды буферная емкость ассоциируется с содержанием гидрокарбонатов или с щелочностью (alkalinity). Из-за чего меняется pH воды? Например, из-за того же углекислого газа. Здесь достаточно вспомнить о закислении мирового океана.
Рассмотрим еще один пример поглощательной способности воды. Дождевая вода, проходя через известняковые породы, забирает кальций в форме CaCO3 (карбонат кальция). Сам по себе CaCO3 нерастворим, но при встрече с углекислым газом в воде он легко создает растворимый гидрокарбонат кальция. Когда уровень CO2 в воде снижается (например, при нагреве), гидрокарбонат кальция начинает выпадать в осадок и откладываться на всем, с чем контактирует: чайники, бойлеры, трубы и так далее. Так образуется накипь.
Кроме кальция в воде можно найти магний, железо, медь, свинец, соли натрия и калия (все вещества будут составлять TDS, общую минерализацию), а также разные типы загрязнений: следы нитратов, хлорамины, сульфаты, хлораты и т.д.
Самый хороший способ узнать состав своей водопроводной воды – отправить ее на анализ в химическую лабораторию. Если вы покупаете новое оборудование, например, эспрессо машины, часто производители сами предлагают сделать тест воды (верно для США – прим.SCR), поскольку заинтересованы в долгой работе оборудования.
Приготовление воды для кофе
Составом воды можно управлять. Есть три вещи, которые надо держать в голове при выборе формулы воды: долгий срок службы оборудования для заваривания, органолептические показатели качества, безопасность для здоровья.
Если вы будете поддерживать относительно нейтральный или в сторону легкой щелочности pH воды, то сбалансированная жесткость поможет защитить бойлеры, эспрессо машины и другое оборудование. Гидрокарбонаты (определяющие щелочность) ведут себя как буферная система и без них у воды повышаются коррозийные свойства.
Книга Water for Coffee ясно объясняет важность кальция и магния для хорошей экстракции. Хэндон и Колонна-Дэшвуд утверждают, что магний действует эффективнее: лучше вкус и меньше накипи, чем в случае с кальцием. Тем не менее, в естественном виде кальций в воде встречается гораздо чаще, чем магний. В своих описаниях воды SCA использует кальций как стандарт для содержания твердых минералов. То, что остается – хлорамины, нитраты и следы других загрязнений – можно убрать, используя угольный фильтр. Это первый шаг на пути к созданию хорошей воды для кофе: фильтр буквально убирает все, что может повлиять на цвет и запах, вода становится безопасна для здоровья и в ней остаются нужные нам минералы. Но что делать дальше, будет зависеть от того, что вы считаете идеалом вкуса и от химического состава воды в вашем регионе.
Для жесткой воды
Жесткая вода (жесткость более 150-200 ppm), вероятно, станет лучше, если снизить в ней количество минералов. Сделать это можно несколькими способами. Два самых распространенных – это ионный обмен и обратный осмос.
Картриджные фильтры ионного обмена работают следующим образом. При пропускании через фильтр из воды удаляются нежелательные ионы и замещаются ионами из ионита. Фильтр замещает ионы кальция и магния на соли натрия и калия. Это обычно повышает буферную емкость воды, но также может привести к повышению минерализации. Однако многие современные ионные системы очистки точны и легко настраиваемы. Они занимают относительно мало места и фактически безотходны, нужно только менять картридж.
В системе обратного осмоса вода проходит через мембрану, которая задерживает растворенные минералы. В накопительный бак попадает «пустая» вода, к которой можно подмешать процент исходной воды. Недостатки системы обратного осмоса: нужны «выделенная» линия и помпа давления, чтобы подавать очищенную воду в оборудование; остается много отработанной воды»; не решается проблема с дисбалансом минералов при подмешивании водопроводной воды.
Для мягкой воды
Если у вашей воды жесткость ниже 50 ppm, возможно, не помешает реминерализация, чтобы, во-первых, помочь заварить вам кофе вкусно, во-вторых, предотвратить возможную коррозию оборудования из-за низкой щелочности.
Это немного труднее, чем понизить минерализацию в жесткой воде. Есть картриджные фильтры, например, на основе измельченных кораллов, которые насыщают воду кальцием и магнием. Но работа таких фильтров зависит от времени контакта с водой. Если вода слишком быстро проходит через фильтр, она не успевает насытиться минералами, если находится в фильтре долго, то перенасыщается минералами.
Есть системы, предлагающие собственные составы для минерализации воды. Например, Global Customized Water или Third Wave Water.
Время математики
Если вы планируете минерализовать воду собственными силами или хотите лучше понять графики и язык, используемый индустрией, вот важное техническое замечание.
Количество минералов в воде чаще всего обозначается как «частиц на миллион» ppm.
Многие ученые используют карбонат кальция CaCO3 как стандарт измерения, эквивалент концентрации любого компонента в воде. Это значит, что минералы, которые нас интересуют, обычно пишутся в ppm как что-то иное, нежели то, чем они есть на самом деле. Мы может расшифровать этот запутанный язык, используя немного вычислений.
Почему CaCO3 берется за образец измерения? Это соединение имеет удобную молярную массу: 100 грамм/моль. Вспомним школьный курс химии: моль – это число: 6.022 на 10 в 23 степени, которое используют для подсчета молекул. То есть молярная масса CaCO3, с одной стороны, удобна при расчетах, а с другой, с ней затруднительно показать содержание других веществ.
Например, я добавил 1 грамм хлорида магния MgCl2 к 1 литру воды. Он будет доступен как гексагидрат хлорида магния MgCl2 · 6h3O. По массе хлорид магния это примерно 11,9% иона магния, то есть в воду мы добавили примерно 119 ppm иона магния (Mg2+). Математика здесь проста: 1 грамм/литр x 11.9% = 0.119 грамм/литр = 119 ppm Mg2+. (Мы также добавили около 348 ppm хлорида, что для нас будет проблемой, но об этом немного позже).
Mg2+ имеет молярную массу 24.305 грамм/моль. Это значит, что магний менее плотный, чем CaCO3. Но поскольку эквивалент у нас CaCO3, нам надо посчитать плотность магния по сравнению с CaCO3, а затем умножить ее на ppm магния в воде.
100 грамм/моль ÷ 24.305 грамм/моль = 4.11. Магний в 4,11 раз менее плотный, чем CaCO3. 119 ppm x 4,11 = 489 ppm магния в эквиваленте CaCO3.
Еще раз. Содержание магния Mg2+ в воде в этом примере 119 частиц на миллион. Но ученые преобразуют это отношение, как если бы магнии был карбонатом кальция. А если так, то в одном литре воды мы имеем 489 ppm.
Немного сбивает с толку, но важно, когда мы начнем говорить о минеральном составе. Аналогичные вычисления можно провести для кальция и гидрокарбонатов.
- Кальций: 40,078 грамм/моль, в 2,495 раз менее плотный, чем CaCO3.
- Гидрокарбонаты: 61, 016 грамм/моль и разница по плотности 1,639 ppm и 0,82 как показатель щелочности.
Пользовательская формула воды (из расчета 1грамм/литр).
- Хлорид кальция (CaCl2) – 273 ppm Ca2+ или 681,2 ppm как CaCO3
- Сульфат кальция (CaSO4) – 233 ppm Ca2+ или 581,4 ppm как CaCO3
- Хлорид магния (MgCl2) – 119 ppm Mg2+ или 489 ppm как CaCO3
- Сульфат магния (MgSO4) – 99 ppm Mg2+ или 407.3 ppm как CaCO3
- Гидрокарбонат калия (KHCO3) – 726 ppm HCO3- или 1198 ppm как CaCO3 или 595,32 как показатель щелочности.
- Гидрокарбонат натрия (NaHCO3) – 609 ppm HCO3- или 998,1 ppm как CaCO3 или 499,38 как показатель щелочности.
Теперь вы легко можете расшифровать некоторые формулы для получения воды. Например, вы хотите сделать 4 литра воды с жесткостью 80 ppm, равными частями хлоридов кальция и магния и щелочностью (гидрокарбонаты) 40 ppm, с добавлением гидрокарбоната калия. Это характеристики воды, которые рекомендует SCA и Water for Coffee.
40ppm Ca2+ (в эквиваленте CaCO3) ÷ 681.2 = 0.0587 g x 4L = 0.235 грамм хлорида кальция CaCl2 на 4 литра воды.
40ppm Mg2+ (в эквиваленте CaCO3) ÷ 489.6 = 0.0817 g x 4L = 0.327 грамм хлорида магния MgCl2 на 4 литра воды.
40ppm HCO3– (щелочность в эквиваленте CaCO3) ÷ 595.32 = 0.067 g x 4L = 0.269 грамм гидрокарбоната калия на 4 литра воды.
Теперь вернемся к хлоридам. Хлориды (не путать с хлором) увеличивают проводимость воды и агрессивны по отношению к металлам при определенных условиях: низкий pH, высокое давление и/или высокая температура. Производители эспрессо машин, например, устанавливают ограничения на содержание хлоридов и проводимость воды. В нашем примере мы добавили 1 грамм хлорида магния, и это привело к высокой концентрации магния и хлоридов. Сократите это до 0,1 хлорида магния, и мы получим разумное количество магния (около 49 ppm эквивалентных CaCO3) и безопасный уровень хлоридов, ниже 200 ppm, рекомендованный для нержавеющей стали низкого класса. Но при горячей температуре и высоком давлении коррозийные свойства хлоридов повышаются, поэтому, например La Marzocco рекомендует содержание хлоридов меньше 30 ppm.
Выводы
Мы рассмотрели химический состав воды и то, как она себя ведет в разных условиях, а также рассказали о нескольких способах водоподготовки. Во второй части мы разберем на практике, как разная минерализация и щелочность воды могут влиять на вкус кофе.
Часть вторая.
Новичок: химия воды
Начинающий: химия водыЧто вам нужно знать о химии воды и почему?
Вода в природе редко бывает чистой в смысле «дистиллированной воды»; Это содержит растворенные соли, буферы, питательные вещества и т. д. с точным концентрация зависит от местных условий. Рыба (и растения) имеют эволюционировали за миллионы лет до конкретных условий воды в в их естественной среде обитания и могут быть не в состоянии разные среды.
Новичкам (и особенно ленивым) следует выбирать простой подход выбора рыбы, потребности которой соответствуют качеству их обычного водопровода вода.В качестве альтернативы продвинутый (и энергичный!) Аквариумист может изменить характеристики воды в соответствии с потребностями рыбы, хотя сделать это почти всегда труднее, чем кажется на первый взгляд. В в любом случае вам необходимо знать достаточно о химическом составе воды, чтобы что вода в вашем аквариуме имеет нужные свойства для рыб, которых вы хранятся.
Вода имеет четыре часто используемых измеримых свойства. чтобы охарактеризовать его химию. Они есть:
- pH означает, что вода является кислотой, основанием или ни одной из них.
(нейтральный).PH 7 считается нейтральным, pH ниже 7 – «кислым».
а значения pH выше 7 являются «основными» или «щелочными». Как шкала Рихтера
шкала pH, используемая для измерения землетрясений, является логарифмической. PH 5,5
в 10 раз кислотнее воды при pH 6,5. Таким образом, изменяя
pH в небольшом количестве (внезапно) больше связано с химическим изменением (и более
стресс для рыбалки!), чем может показаться на первый взгляд.
Для рыбовода важны два аспекта pH. Во-первых, быстрые изменения pH вызывают стресс для рыб, и их следует избегать.Изменение pH на известно, что более 0,3 единицы в день вызывают стресс у рыб. Таким образом, вы хотите pH вашего аквариума, чтобы оставаться постоянным и стабильным в течение длительного времени. Во-вторых, рыба приспособилась к жизни в (иногда узком) диапазоне pH. Вы хотите быть уверены, что pH вашего аквариума соответствует определенному потребности рыбы, которую вы держите.
Большинство рыб могут приспосабливаться к pH, несколько выходящему за пределы оптимального. диапазоны. Если pH вашей воды естественным образом находится в диапазоне от 6,5 до 7.5, вы сможете содержать большинство видов рыб без каких-либо проблемы.Если ваш pH находится в этом диапазоне, вероятно, нет нужно отрегулировать его вверх или вниз.
- Буферная способность означает способность воды поддерживать pH.
стабилен при добавлении кислот или оснований. pH и буферная способность
переплетаются друг с другом; хотя можно подумать, что добавление
равные объемы кислой и нейтральной воды приведут к pH
На полпути это редко случается на практике. Если в воде есть
достаточная буферная емкость, буферная емкость может поглощать и
нейтрализовать добавленную кислоту без значительного изменения pH.Концептуально буфер действует как большая губка. Как более
добавляется кислота, «губка» впитывает кислоту, не меняя pH.
много. Однако емкость «губки» ограничена; после буферизации
емкость исчерпывается, pH изменяется быстрее, чем добавляются кислоты.
Буферизация имеет как положительные, так и отрицательные последствия. О плюсе Кроме того, цикл нитрификации производит азотную кислоту (нитрат). Без буферизация, pH вашего аквариума со временем упадет (плохо). С участием достаточная буферизация, pH остается стабильным (хорошо).На отрицательная сторона, жесткая водопроводная вода часто почти всегда имеет большой буферная емкость. Если pH воды слишком высок для вашей рыбы, буферная способность затрудняет снижение pH до более соответствующее значение. Наивные попытки изменить pH воды обычно сбой, поскольку игнорируются эффекты буферизации.
В пресноводных аквариумах большая часть буферной способности воды обусловлена карбонатам и бикарбонатам. Таким образом, термины «карбонатная жесткость» (KH), «щелочность» и «буферная емкость» взаимозаменяемы.Хотя технически это не одно и то же, в практика в контексте рыбоводства. Примечание: термин «щелочность» не следует путать с термином «щелочной». Щелочность относится к буферизация, в то время как акалин относится к раствору, который является основанием (например, pH > 7).
Сколько буферизации нужно вашему танку? Большая буферизация аквариума Наборы для проверки емкости фактически измеряют KH. Чем больше KH, тем больше Ваша вода будет устойчивой к изменениям pH. KH танка должен быть высоким достаточно, чтобы предотвратить резкие колебания pH в вашем аквариуме с течением времени.Если ваш KH ниже примерно 4,5 dH, вам следует обратить особое внимание на pH резервуара (например, проверяйте еженедельно, пока не почувствуете, насколько стабильна pH есть). Это ОСОБЕННО важно, если вы пренебрегаете частыми частичная подмена воды. В частности, цикл нитрификации создает тенденция к снижению установленного pH в аквариуме с течением времени. В точное изменение pH зависит от количества и скорости нитратов произведены, как и KH. Если ваш pH падает более чем примерно на два десятых долей балла за месяц, вам следует подумать об увеличении KH или выполнять частичную подмену воды чаще.KH не влияют на рыбу напрямую, поэтому нет необходимости сопоставлять виды рыб с в частности KH.
Примечание: не рекомендуется использовать в баке дистиллированную воду. От По определению, дистиллированная вода практически не имеет KH. Это означает, что добавление даже небольшого количества кислоты значительно изменит pH (подчеркивая рыбу). Из-за своей нестабильности дистиллированный (или любой другой по существу чистая вода) никогда не используется напрямую. Водопроводная вода или другое соли должны быть сначала добавлены к нему, чтобы увеличить его GH и KH.
- Общая жесткость (GH) относится к растворенной концентрации
ионы магния и кальция. Когда говорят, что рыба предпочитает «мягкую» или
«жесткая» вода – это GH (а не KH).
Примечание: GH, KH и pH образуют Бермудский треугольник воды. химия. Хотя эти три свойства различны, все они взаимодействуют друг с другом в разной степени, что затрудняет отрегулируйте одно, не затрагивая другое. Это одна из причин, почему начинающим аквариумистам рекомендуется НЕ изменять эти параметры. без крайней необходимости.Например, “жесткая” вода часто часто поступает из известняковых водоносных горизонтов. Известняк содержит кальций карбонат, который при растворении в воде увеличивает как GH (от кальций) и KH (из карбоната) компонентов. Увеличение KH компонент также обычно увеличивает pH. Концептуально KH действует как «губка», впитывающая кислоту, присутствующую в воде, повышая pH воды.
Жесткость воды соответствует следующим требованиям. Единица dH означает «степень твердости», в то время как ppm означает «части на миллион», что примерно эквивалентно мг / л в воде.1 единица dH равна 17,8 ppm CaCO3. Большинство тестовых наборов дают жесткость в единицах CaCO3; это означает жесткость эквивалентна количеству CaCO3 в воде, но не означает это фактически произошло из CaCO3.
0 - 4 dH, 0 - 70 ppm: очень мягкий 4-8 dH, 70-140 частей на миллион: мягкий 8 - 12 dH, 140 - 210 ppm: средняя твердость 12 - 18 dH, 210 - 320 ppm: довольно сложно 18 - 30 dH, 320 - 530 ppm: жесткий выше: жидкая порода (озеро Малави и Лос-Анджелес, Калифорния) - Соленость относится к общему количеству растворенных веществ.При измерениях солености учитываются как компоненты GH, так и KH, а также такие компоненты.
другие вещества, такие как натрий. Знание солености воды становится важным
в аквариумах с соленой водой. В резервуарах с пресной водой, зная pH, GH и KH
достаточно.
Соленость обычно выражается через ее удельный вес, отношение веса раствора к весу равного объема дистиллированной вода. Поскольку вода расширяется при нагревании (изменяя свою плотность), используется обычная эталонная температура 39 градусов по Фаренгейту. Соленость измеряется ареометром, который откалиброван для использования в определенных температура (например,г., 75 градусов F является обычным явлением).
Одним из компонентов солености, который не включает ни GH, ни KH, является натрий. Некоторые пресноводные рыбы переносят (или даже предпочитают) небольшое количество соли. (стимулирует рост слизистой оболочки). Более того, паразиты (например, ick) действительно совсем не переносит соли. Таким образом, соль в концентрациях (до) 1 столовая ложка на 5 галлонов действительно может помочь предотвратить и вылечить болезнь и другие паразитарные инфекции.
С другой стороны, некоторые виды рыб не переносят ЛЮБОЙ соли хорошо.Рыба без чешуи (в общем) и некоторые сомы Коридора далеки более чувствительны к соли, чем большинство пресноводных рыб. Добавляйте соль, только если вы уверены, что все обитатели вашего танка его предпочитают или могут по крайней мере терпеть это.
Что еще мне нужно знать о химическом составе воды?
Помимо GH, KH, pH и солености, есть еще несколько вещества, о которых вы, возможно, захотите узнать. Большая часть водопроводной воды содержит Ассортимент микроэлементов в очень низких концентрациях.Присутствие (или отсутствие) микроэлементов может быть важным в некоторых ситуациях. Конкретно:
- Фосфаты связаны с ростом водорослей. Если у вас есть настойчивый
проблемы с водорослями, высокое содержание фосфатов может быть одним из факторов. В
бак для растений, идеальный уровень фосфатов составляет 0,2 мг / л или ниже. Контролировать
водорослей часто рекомендуют частую частичную подмену воды для уменьшения
уровни питательных веществ. Если в вашей водопроводной воде содержится избыток фосфатов, вода
изменения могут усугубить ситуацию.Ваша местная водопроводная компания
могу сказать вам, каковы точные уровни фосфатов.
Для роста растениям необходимо минимальное количество железа. Водопроводная вода во многих области вообще не содержат железа. Обратитесь к FAQ по установке для получения более подробной информации.
Как я могу поднять свой GH и / или KH?
Следующие измерения являются приблизительными; используйте тестовый набор для проверки вы достигли желаемых результатов.Чтобы поднять и GH, и KH одновременно, добавьте карбонат кальция. (CaCO3). Две чайные ложки на 50 литров воды увеличивают как KH и GH примерно на 4 dH.Как вариант, добавьте морские ракушки, кораллы, известняк, мраморная крошка и т. д. к фильтру.
Чтобы поднять KH без повышения GH, добавьте бикарбонат натрия. (NaHCO3), широко известный как пищевая сода. Одна чайная ложка на 50 литров повышает KH примерно на 4 dH. Бикарбонат натрия приближает pH равновесное значение 8,2.
Как повысить или понизить pH?
Можно повысить или понизить pH, добавив химикаты. Из-за буферизация, однако, процесс трудно наладить.Увеличение или снижение pH (стабильным способом) фактически включает изменение KH. Наиболее распространенный подход – добавить буфер, состояние равновесия которого поддерживает желаемое значение pH.
Соляная (соляная) кислота может использоваться для снижения pH. Обратите внимание, что точное необходимое количество зависит от буферной способности воды. Фактически, вы добавляете достаточно кислоты, чтобы использовать всю буферную емкость. Как только это будет сделано, снизить pH станет легко. Однако следует Следует отметить, что полученная вода с более низким pH имеет гораздо меньшую буферность по KH. чем раньше, что делает его более восприимчивым к колебаниям pH, когда (скажем) повышается уровень нитратов.Предупреждение: само собой разумеется, что кислоты ОЧЕНЬ опасно! Не используйте этот подход, если не знаете, что ты делаешь!
Такие продукты, как «pH-Down», созданы на основе кислой фосфорной кислоты. Фосфорная кислота имеет тенденцию поддерживать pH примерно на уровне (6,5? ХХХ). К сожалению, использование фосфорной кислоты имеет сторону BIG . эффект повышения уровня фосфатов в вашем аквариуме, стимулирующий рост водорослей рост. Сложно контролировать рост водорослей в аквариуме с повышенный уровень фосфатов.
Один из безопасных способов понизить pH БЕЗ корректировки KH – это CO2 (углекислый газ) через резервуар. CO2 растворяется в воде, и часть его образует угольную кислоту. Образование кислоты снижает pH. Конечно, для того, чтобы этот подход был практичным, постоянный источник пузырьков CO2 (например, баллон с CO2) необходим для поддержания pH в место. Как только CO2 уходит, pH возвращается к прежнему значению. значение. Высокая стоимость системы впрыска CO2 не позволяет использовать ее в качестве Техника понижения pH в большинстве аквариумов.Однако системы впрыска CO2 очень популярны в тяжелых резервуарах, потому что дополнительный выброс CO2 стимулирует рост растений.
Как смягчить воду (например, снизить ее GH)?
Некоторые рыбы (например, дискусы, кардинальные тетры и т. Д.) Предпочитают мягкую воду. Хотя они могут выжить в более жесткой воде, они вряд ли выживут. порода. Таким образом, вы можете почувствовать необходимость смягчить воду, несмотря на хлопот, связанных с этим.
Обычные домашние водоумягчители умягчают воду с использованием известного метода как «ионный обмен».То есть они удаляют ионы кальция и магния путем заменяя их ионами натрия. Хотя это технически делает вода мягче, большинство рыб не заметят разницы. То есть рыба любители мягкой воды тоже не любят натрий, а для них такие смягчители воды совсем не помогают. Таким образом, домашние умягчители воды не подходящий способ смягчения воды для использования в аквариуме.
Рыбные магазины также продают «подушки для смягчения воды». Они используют тот же принцип ионного обмена. Подушку «перезаряжают», намочив ее. в растворе соленой воды, затем помещает его в резервуар, где натрий ионы попадают в воду и заменяются кальцием и магнием ионы.Через несколько часов или дней подушка (вместе с кальцием и магний) удаляются, а подушка заряжается. Подушки продаются в магазинах, слишком малы, чтобы работать на практике, и не должны использоваться по той же причине, указанной выше.
Торфяной мох смягчает воду и снижает ее жесткость (GH). Большинство эффективный способ смягчить воду с помощью торфа – это аэрировать воду на 1-2 часа. недель в ведре, содержащем торфяной мох. Например, получить (пластиковый) ведро подходящего размера. Затем получите большое количество торфа. (галлон или больше), вскипятите (чтобы он тонул), положите в подушку ящик и поместите его в ведро с водой.Используйте воздушный насос для аэрации Это. Через 1-2 недели вода станет мягче и кислее. Использовать это стареющая вода при частичной подмене воды в вашем аквариуме.
Торф можно купить в зоомагазинах, но он дорогой. Это много Более выгодно покупать его оптом в местном садовом магазине. Читать этикетки внимательно! Вы не хотите использовать торф, содержащий удобрения или другие добавки.
Хотя некоторые люди помещают торф в фильтры своих резервуаров, Техника имеет ряд недостатков.Во-первых, торф легко забивается, поэтому добавление торфа не всегда эффективно. Во-вторых, торф может быть грязным и может замутните воду в вашем аквариуме. В-третьих, точное количество торфа. необходимое для эффективного смягчения воды оценить сложно. Использование неправильного количества приводит к неправильному химическому составу воды. Ну наконец то, при подмене воды химический состав вашего аквариума меняется, когда новая вода добавлен (у него неправильные свойства). В течение следующих нескольких дней химический состав меняется по мере того, как торф вступает в силу. Использование выдержанной воды помогает убедитесь, что химический состав вашего аквариума не меняется при выполнении подмены воды.
Жесткую воду также можно смягчить, разбавив ее дистиллированной водой. или слив воды. Вода R / O (обратного осмоса) – это очищенная вода, произведенная Блок R / O. К сожалению, блоки R / O слишком дороги (100-500 долларов США) для большинство увлечений. Воду R / O также можно купить в некоторых рыбных магазинах, но для большинства людей затраты и хлопоты того не стоят. Тоже самое распространяется на дистиллированную воду, купленную в продуктовых магазинах.
Следующий раздел: Новичок: очистка воды
1.3: Введение – вода и буферы
Источник: BiochemFFA_1_3.pdf. Весь учебник доступен бесплатно у авторов по адресу http://biochem.science.oregonstate.edu/content/biochemistry-free-and-easy
.Когда дело доходит до воды, мы буквально тонем в ней, поскольку вода – это самый распространенный компонент каждой клетки. Чтобы понять жизнь, мы начинаем обсуждение с основ воды, потому что все, что происходит в клетках, даже реакции, скрытые глубоко внутри ферментов, вдали от воды, находится под влиянием химического состава воды.
Молекула воды имеет широкую V-образную форму (угол HO-H составляет 104 °) с неравномерным распределением электронов между атомами кислорода и водорода (Рисунок 1.23). Кислород с его более высокой электроотрицательностью удерживает электроны ближе к себе, чем водород. В результате водород описывается как имеющий частичный положительный заряд (обычно обозначаемый как δ +), а кислород имеет частичный отрицательный заряд (обозначаемый как δ-). Таким образом, вода является полярной молекулой, потому что заряды распределены вокруг нее неравномерно, а не симметрично.
Вода как растворитель
Вода (рис. 1.23) описывается как растворитель из-за ее способности сольватировать (растворять) многие, но не все молекулы.Ионные или полярные молекулы легко растворяются в воде, но неполярные вещества растворяются в воде плохо, если вообще растворяются. Например, неполярное масло отделяется от воды при смешивании с ней. С другой стороны, хлорид натрия, который ионизирует, и этанол, который является полярным, способны образовывать водородные связи, поэтому оба растворяются в воде. Растворимость этанола в воде имеет решающее значение для пивоваров, виноделов и дистилляторов, но для этого свойства не было бы ни вина, ни пива, ни спиртных напитков. Как объяснялось в предыдущем разделе, мы используем термин «гидрофильный» для описания веществ, которые хорошо взаимодействуют с водой и растворяются в ней, а термин «гидрофобный» – для обозначения неполярных и не растворяющихся в воде материалов.В таблице 1.3 показаны некоторые полярные и неполярные вещества. Третий термин, амфифильный, относится к соединениям, которые обладают обоими свойствами. Мыло, например, амфифильное, оно содержит длинный неполярный алифатический хвост и ионизирующую головку.
Таблица 1.3 Изображение Алеи Ким
Растворимость
Рисунок 1.23 – Расположение атомов в воде Изображение Алейи КимРастворимость материалов в воде основана на изменении свободной энергии, измеряемой с помощью ΔG.Помните, из химии, что H – энтальпия (тепло при постоянном давлении), а S – энтропия. Учитывая это,
\ [ΔG = ΔH – TΔS \]
где T – температура в Кельвинах. Чтобы процесс был благоприятным, ΔG для него должно быть меньше нуля.
Рисунок 1.24 – Структура мылаИсходя из уравнения, пониженные значения ΔG будут благоприятствовать уменьшению энтальпии и / или увеличению энтропии. Давайте сначала рассмотрим, почему неполярные материалы не растворяются в воде. Мы могли бы представить себе ситуацию, когда процесс растворения включает «окружение» каждой молекулы неполярного растворенного вещества в воде, точно так же, как каждый ион натрия и каждый хлорид-ион окружаются молекулами воды по мере растворения соли.
Водохозяйственная организация
Рисунок 1.25 – Структуры, образованные амфифильными веществами в воде. Image by Aleia KimТем не менее, существует значительная разница между окружением неполярной молекулы молекулами воды и окружающими ионами (или полярными соединениями) молекулами воды.
Разница в том, что, поскольку неполярные молекулы на самом деле не взаимодействуют с водой, вода ведет себя совсем иначе, чем с ионами или молекулами, которые образуют водородные связи. Фактически, вокруг каждой неполярной молекулы вода очень организована, регулярно выравниваясь.Как, вероятно, помнит любой первокурсник-химик, энтропия – это мера беспорядка, поэтому, когда что-то становится упорядоченным, энтропия уменьшается, а это означает, что ΔS отрицательно, поэтому член TΔS в уравнении положительный (отрицательный или отрицательный).
Рисунок 1.26 – Фосфолипид – амфифильное веществоПоскольку смешивание неполярного вещества с водой обычно не имеет значительного теплового компонента, ΔG является положительным. Это означает, что растворение неполярного соединения в воде неблагоприятно и не происходит в какой-либо значительной степени.Кроме того, когда неполярный материал связывается с самим собой, а не с водой, молекулы воды могут свободно смешиваться без упорядочения, что приводит к увеличению энтропии. Таким образом, энтропия приводит к отделению неполярных веществ от водных растворов.
Рисунок 1.27 – Уксус (черный) и масло (желтый) Смесь полярных и неполярных соединений WikipediaАмфифильные вещества
Далее мы рассматриваем смешивание амфифильного вещества, такого как мыло, с водой (рисунок 1.24). Ионы натрия, присоединенные к жирным кислотам в мыле, легко отделяются в водном растворе, оставляя отрицательно заряженную молекулу на одном конце и неполярную область на другом конце. Ионизация мыла вызывает увеличение энтропии – две частицы вместо одной. Неполярная часть отрицательно заряженного мыльного иона проблематична – если подвергнуться воздействию воды, это вызовет организацию воды и приведет к снижению энтропии и положительному ΔG.
Рисунок 1.28 – Окружающая среда липидного бислоя.Вода концентрируется вдали от гидрофобного центра, будучи насыщенной снаружи, полунасыщенной около соединения голова-хвост и полностью обезвоженной в середине. Изображение Алейи КимПоскольку мы знаем, что жирные кислоты растворяются в воде, должно быть что-то еще. Там есть. Подобно тому, как неполярные молекулы в первом примере связаны друг с другом, а не с водой, неполярные части мыльных ионов также связываются друг с другом и исключают воду. В результате ионы мыла образуют мицеллы (рис.25) с неполярными частями внутри конструкции вдали от воды, а полярные части снаружи взаимодействуют с водой.
Рисунок 1.29 – Сворачивание белка распределяет гидрофобные аминокислоты (черные точки) внутри белка.Взаимодействие полярных головок с водой возвращает воду в ее более неупорядоченное состояние. Это увеличение беспорядка или энтропии приводит к образованию мицелл. Как будет видно при обсуждении липидного бислоя, одни и те же силы заставляют глицерофосфолипиды и сфинголипиды спонтанно формировать бислои, где неполярные части молекул взаимодействуют друг с другом, чтобы исключить воду, а полярные части располагаются на внешней стороне бислой (рисунок 1.28).
Рисунок 1.30 – Общие водородные связи в биохимии Изображение Aleia KimЕще один пример – сворачивание глобулярных белков в цитоплазме. Неполярные аминокислоты находятся во внутренней части белка (исключая воду). Взаимодействие неполярных аминокислот оказывается движущей силой сворачивания белков, поскольку они образуются в водном растворе.
Водородные связи
Значение водородных связей в биохимии (Рисунок 1.30) сложно переоценить. Сам Линус Полинг сказал:
“. . . . Я считаю, что по мере дальнейшего применения методов структурной химии к физиологическим проблемам будет обнаружено, что значение водородной связи для физиологии больше, чем значение любой другой отдельной структурной особенности ».
Рисунок 1.31 – Водородные связи между молекулами воды Изображение Pehr JacobsonВ 2011 году рабочая группа IUPAC дала основанное на фактах определение водородных связей, которое гласит:
«Водородная связь – это притягивающее взаимодействие между атомом водорода из молекулы или молекулярного фрагмента X – H, в котором X является более электроотрицательным, чем H, и атомом или группой атомов в той же или другой молекуле в что есть свидетельства образования облигаций.”
Частичная зарядка
Разница в электроотрицательности между водородом и молекулой, с которой он ковалентно связана, приводит к возникновению частичных зарядов, как описано выше. Эти крошечные заряды (δ + и δ-) приводят к образованию водородных связей, которые возникают, когда частичный положительный заряд атома водорода притягивается к частичному отрицательному заряду другой молекулы. В воде это означает, что водород одной молекулы воды притягивается к кислороду другой (рис.1.31). Поскольку вода представляет собой асимметричную молекулу, это также означает, что заряды асимметричны. Такое неравномерное распределение – вот что делает диполь. Диполярные молекулы важны для взаимодействия с другими диполярными молекулами и для растворения ионных веществ (рис. 1.32).
Водородные связи относятся не только к воде. Фактически, они являются важными силами, удерживающими вместе макромолекулы, которые включают белки и нуклеиновые кислоты. Водородные связи возникают внутри макромолекул и между ними.
Фигура 1.32 – Пример дипольных взаимодействий в биохимии Изображение от Aleia KimНапример, комплементарное спаривание, которое происходит между основаниями в противоположных цепях ДНК, основано на водородных связях. Каждая водородная связь относительно слабая (по сравнению, например, с ковалентной связью – Таблица 1.4), но в совокупности они могут быть довольно прочными.
Таблица 1.4 Изображение Алейи Ким
Преимущества слабого взаимодействия
Их слабость, однако, на самом деле весьма полезна для клеток, особенно в отношении нуклеиновых кислот (Рисунок 1.33). Например, нити ДНК должны быть разделены на короткие отрезки в процессах репликации и синтеза РНК. Поскольку одновременно необходимо разделять только несколько пар оснований, энергия, необходимая для этого, невелика, и ферменты, участвующие в процессах, могут легко разделить их при необходимости. Водородные связи также играют роль в связывании субстратов с ферментами, катализе и белок-белковом взаимодействии, а также в других видах связывания, таких как белок-ДНК или антитело-антиген.
Рисунок 1.33 – Водородные связи в паре оснований ДНК Изображение от Aleia KimКак уже отмечалось, водородные связи слабее ковалентных (таблица 1.4), и их сила варьируется от очень слабой (1-2 кДж / моль) до довольно сильной (29 кДж / моль). Водородные связи возникают только на относительно коротких расстояниях (от 2,2 до 4,0 Å). Чем дальше расстояние между водородными связями, тем слабее связь.
Прочность связи в кДж / моль представляет собой количество тепла, которое необходимо направить в систему для разрыва связи – чем больше число, тем выше прочность связи.Водородные связи легко разрушаются при нагревании. Например, кипячение воды требует разрыва водородных связей. Когда биологическая структура, такая как белок или молекула ДНК, стабилизируется водородными связями, разрыв этих связей дестабилизирует структуру и может привести к денатурации вещества – потере структуры. Частично по этой причине большинство белков и все ДНК теряют свою естественную или свернутую структуру при нагревании до кипения.
Изображение Алейи Ким Таблица 1.5
Для молекул ДНК денатурация приводит к полному отделению цепей друг от друга. Для большинства белков это означает потерю характерной трехмерной структуры и, как следствие, потерю функции, которую они выполняли. Хотя некоторые белки могут легко восстановить свою первоначальную структуру при охлаждении раствора, в котором они находятся, большинство – нет. Это одна из причин, по которой мы готовим пищу. Белки необходимы для жизни, поэтому денатурация бактериальных белков приводит к гибели любых микроорганизмов, загрязняющих пищу.
Важность буферов
Вода может ионизироваться в небольшой степени (10-7 M) с образованием H + (протон) и OH- (гидроксид). Мы измеряем концентрацию протонов в растворе с помощью pH, который представляет собой отрицательный логарифм концентрации протонов.
pH = -Log [H +]
Если концентрация протонов, [H +] = 10-7 M, то pH равен 7. Мы могли бы так же легко измерить концентрацию гидроксида с pOH с помощью параллельного уравнения,
pOH = -Log [OH – ]
В чистой воде при диссоциации протона одновременно образуется гидроксид, поэтому pOH чистой воды также равно 7.Это также означает, что
pH + pOH = 14
Теперь, поскольку протоны и гидроксиды могут объединяться с образованием воды, большое количество одного будет вызывать небольшое количество другого. Почему это так? Проще говоря, если я брошу 0,1 моль H + в раствор чистой воды, высокая концентрация протонов будет реагировать с относительно небольшим количеством гидроксидов с образованием воды, тем самым уменьшая концентрацию гидроксида. Точно так же, если я выливаю избыток гидроксида (например, NaOH) в чистую воду, концентрация протонов падает по той же причине.
Кислоты и основания
Химики используют термин «кислота» для обозначения вещества, которое имеет протоны, которые могут диссоциировать (отрываться) при растворении в воде. Они используют термин «основа» для обозначения вещества, которое может поглощать протоны при растворении в воде. И кислоты, и основания бывают сильными и слабыми. (Примеры слабых кислот показаны в таблице 1.5.) Сильные кислоты, такие как HCl, полностью диссоциируют в воде. Если мы добавим 0,1 моль (6,02х1022 молекул) HCl к раствору, чтобы получился литр, он будет иметь 0.1 моль H + и 0,1 моль Cl- или по 6,02х1022 молекул каждого. Когда это произойдет, не останется HCl. Сильное основание, такое как NaOH, также полностью диссоциирует на Na + и OH-.
Слабые кислоты
Слабые кислоты и основания отличаются от своих сильных аналогов. Когда вы помещаете один моль уксусной кислоты (HAc) в чистую воду, только крошечный процент молекул HAc диссоциирует на H + и Ac-. Ясно, что слабые кислоты сильно отличаются от сильных кислот. Слабые основания ведут себя аналогичным образом, за исключением того, что они принимают протоны, а не отдают их.Поскольку мы можем рассматривать все как форму слабой кислоты, мы не будем использовать здесь термин «слабое основание».
Рисунок 1.34 – Диссоциация слабой кислоты Изображение Алейи КимСтуденты часто озадачиваются и ожидают, что [H + ] = [A – ], потому что уравнение диссоциации показывает каждое из них от HA. На самом деле это верно ТОЛЬКО, когда ГК диссоциируют в чистой воде. Обычно ГК помещают в раствор, содержащий протоны и гидроксиды, влияющие на вещи. Эти протоны и / или гидроксиды изменяют концентрацию H + и A неодинаково, поскольку A- может поглощать часть протонов и / или HA может выделять H + под влиянием OH- в растворе.Следовательно, необходимо рассчитать концентрацию протонов по pH, используя уравнение Хендерсона-Хассельбаха.
\ [pH = pKa + log ([Ac – ] / [HAc]) \]
Изображение Aleia Kim Таблица 1.6
Вы можете спросить, почему мы заботимся о слабых кислотах. Возможно, вы никогда не задумывались о слабых кислотах, когда изучали общую химию. Ваш инструктор описал их как буферы, и вы, вероятно, послушно запомнили тот факт, что «буферы – это вещества, сопротивляющиеся изменению pH», не совсем понимая, что это означает «Очистка путаницы».Буферы слишком важны, чтобы думать о них подобным образом.
ИБП
Слабые кислоты критически важны для жизни, потому что их сродство к протонам заставляет их вести себя как ИБП. Мы не имеем в виду ИБП, который является United Parcel Service, а вместо этого имеем в виду встроенные системы резервного питания от батарей для компьютеров, называемые источниками бесперебойного питания, которые включаются, чтобы поддерживать работу компьютера во время сбоя питания. Например, аккумулятор портативного компьютера – это ИБП.
Мы можем думать о слабых кислотах как о непрерывных поставщиках протонов в определенных диапазонах pH, обеспечивающих (или поглощающих) протоны по мере необходимости.Таким образом, слабые кислоты помогают поддерживать концентрацию H + (и, следовательно, pH) раствора, в котором они находятся, относительно постоянным.
Рассмотрим систему бикарбонат / угольная кислота. На рис. 1.35 показано, что происходит при диссоциации H 2 CO 3 . Добавление гидроксид-ионов (путем добавления сильного основания, такого как NaOH) к раствору заставляет ионы H + реагировать с ионами OH- с образованием воды. Следовательно, концентрация ионов H + снизится, а pH повысится.
Рисунок 1.35 – Кривая титрования для угольной кислоты Изображение Aleia KimОднако, в отличие от ситуации с раствором чистой воды, существует резервный источник H +, доступный в виде H 2 CO 3 .Вот где срабатывает функция UPS. Поскольку протоны уносятся добавленными гидроксильными ионами (образуя воду), они частично заменяются протонами из H 2 CO 3 . Вот почему слабая кислота является буфером. Он сопротивляется изменениям pH, высвобождая протоны, чтобы компенсировать те, которые «израсходованы» в реакции с гидроксильными ионами.
Хендерсон-Хассельбах
Полезно иметь возможность предсказать реакцию системы H 2 CO 3 на изменения концентрации H +.Уравнение Хендерсона-Хассельбаха определяет соотношение между pH и соотношением HCO 3 – и H 2 CO 3 . Это
pH = pKa + log ([HCO 3 – ] / [H 2 CO 3 ])
Это простое уравнение определяет соотношение между pH раствора и соотношением в нем HCO 3 – и H 2 CO 3 . Новый термин, называемый pKa, определяется как
.pKa = -Log K a ,
так же, как
pH = -Log [H + ].
Ka – это константа диссоциации кислоты и мера силы кислоты. Для обычной кислоты HA, которая диссоциирует как
HA ⇄ H + + A – , K a = [H + ] [A – ] / [HA]
Таким образом, чем сильнее кислота, тем больше протонов отделяется от нее при добавлении в воду и тем большее значение будет иметь ее Ка. Большие значения Ka переводятся в более низкие значения pKa. В результате, чем ниже значение pKa для данной кислоты, тем сильнее слабая кислота.
Константа pKa
Обратите внимание, что pKa является константой для данной кислоты. PKa для угольной кислоты составляет 6,37. Для сравнения, pKa муравьиной кислоты составляет 3,75. Таким образом, муравьиная кислота является более сильной кислотой, чем уксусная кислота. Более сильная кислота будет иметь больше протонов, диссоциированных при данном pH, чем более слабая кислота.
Итак, как это влияет на стабилизацию pH? На рисунке 1.35 показана кривая титрования. На этой кривой титрование начинается с условий в нижнем левом углу (очень низкий pH).При этом pH преобладает форма H 2 CO 3 , но по мере добавления все большего и большего количества OH- (переход к 45 Почему мы заботимся о pH? Потому что биологические молекулы в некоторых случаях могут быть чрезвычайно чувствительны к изменения в нем. При изменении pH раствора заряды молекул в растворе могут измениться, как вы увидите. Изменение зарядов на биологических молекулах, особенно на белках, может резко повлиять на их работу и даже на то, как они работают. ), pH повышается, количество HCO3- увеличивается и (соответственно) количество H 2 CO 3 понижается.Обратите внимание, что кривая «сглаживается» около pKa (6.37).
Буферная область
Сглаживание кривой говорит нам о том, что pH не сильно меняется (не растет так быстро), как это было раньше, когда было добавлено такое же количество гидроксида. Система сопротивляется изменению pH (не останавливая изменение, а замедляя его) в области примерно на одну единицу pH выше и на одну единицу pH ниже pKa. Таким образом, буферная область буфера угольная кислота / бикарбонат составляет примерно от 5,37 до 7.37. Он максимально силен при pH 6,37.
Теперь становится ясно, как работает буфер. HA может отдавать протоны, когда требуются дополнительные вещества (например, когда OH- добавляется к раствору путем добавления NaOH). Точно так же A- может принимать протоны, когда в раствор добавляется дополнительный H + (например, добавление HCl). Максимальная способность отдавать или принимать протоны наступает, когда
[A –] = [HA]
Это согласуется с уравнением Хендерсона-Хассельбаха и кривой титрования.Когда [A – ] = [HA], pH = 6,37 + Log (1). Поскольку Log (1) = 0, pH = 6,37 = pKa для угольной кислоты. Таким образом, для любого буфера буфер будет иметь максимальную прочность и отображать сглаженную кривую титрования, когда [A – ] = [HA] и когда pH = pKa. Если буфер имеет более одного pKa (рис. 1.36), то каждая область pKa будет отображать поведение.
с буферизацией и без буферизации
Чтобы понять, насколько хорошо буфер защищает от изменений pH, рассмотрим эффект добавления.01 моль HCl на 1,0 литр чистой воды (без изменения объема) при pH 7, по сравнению с добавлением ее к 1,0 литру 1M ацетатного буфера при pH 4,76. Поскольку HCl полностью диссоциирует, в 0,01 М (10-2 М) HCl будет 0,01 М H +. Для чистой воды pH снижается с 7,0 до 2,0 (pH = -log (0,01M)).
Напротив, pH ацетатного буфера после добавления того же количества HCl составляет 4,74. Таким образом, pH раствора чистой воды падает с 7 до 2 (5 единиц pH), тогда как pH буферного раствора падает с 4.От 76 до 4,74 (0,02 единицы pH). Очевидно, что буфер минимизирует влияние добавленных протонов по сравнению с чистой водой.
Буферная емкость
Важно отметить, что емкость буферов ограничена их концентрацией. Представим, что в предыдущем абзаце мы добавили 0,01 моль HCl в ацетатный буфер с концентрацией 0,01 М и равными количествами Ac- и HAc. Когда мы пытаемся провести математику параллельно с предыдущим вычислением, мы видим, что там 0.01M протонов, но только 0,005M A- для их поглощения. Мы могли представить, что 0,005M протонов будет поглощено, но это все равно оставит 0,005M протонов без буферизации. Таким образом, pH этого раствора будет приблизительно
.pH = -log (0,005M) = 2,30
Превышение буферной емкости значительно снизило pH по сравнению с добавлением того же количества протонов в 1М ацетатный буфер. Следовательно, при рассмотрении буферов важно понимать, что их концентрация устанавливает их пределы.Другой предел – это диапазон pH, в котором предполагается контролировать концентрацию протонов.
Несколько ионизируемых групп
Итак, что произойдет, если в молекуле есть две (или более) ионизируемые группы? Оказывается, что неудивительно, что каждая группа будет иметь свой собственный pKa и, как следствие, будет иметь несколько областей буферизации.
Рисунок 1.36 – Титрование кислой аминокислоты Изображение Aleia KimРисунок 1.36 показывает кривую титрования аминокислоты аспарагиновой кислоты.Обратите внимание, что вместо одного сплющивания кривой, как это было видно для уксусной кислоты, на кривой титрования аспарагиновой кислоты отображаются три таких участка. Это отдельные буферные области, каждая из которых сосредоточена на соответствующих значениях pKa для карбоксильной группы и аминогруппы.
Аспарагиновая кислота имеет четыре возможных заряда: +1 (α-карбоксильная группа, α-аминогруппа и карбоксильная группа R-группы каждая имеет протон), 0 (α-карбоксильная группа не имеет протона, α-аминогруппа имеет протон, R-группа карбоксил имеет протон), -1 (α-карбоксильная группа и карбоксильная группа R-группы не имеют протона, α-аминогруппа сохраняет протон), -2 (α-карбоксил, карбоксильная группа R-группы и α-аминогруппы все лишний протон).
Прогноз
Как можно предсказать заряд аминокислоты при заданном pH? Хорошее практическое правило для оценки заряда состоит в том, что если pH более чем на одну единицу ниже pKa для группы (карбоксильной или амино), протон включен. Если pH больше чем на одну единицу выше pKa для группы, протон выключен. Если pH НЕ больше единицы или меньше одной единицы pH от pKa, это простое предположение не сработает.
Кроме того, важно понимать, что эти практические правила являются только оценочными.PI (pH, при котором заряд молекулы равен нулю) представляет собой точное значение, вычисленное как среднее из двух значений pKa по обе стороны от нулевой области. Он рассчитывается как среднее из двух значений pKa около точки, где заряд молекулы равен нулю. Для аспарагиновой кислоты это соответствует pK a1 и pK a2 .
Список литературы
- http://www.lpi.usra.edu/lunar/missions/apollo/ apollo_12/examples / Surveyor /
- Арунан, Эланганнан; Дезираджу, Гаутам Р.; Klein, Roger A .; Садлей, Джоанна; Шайнер, Стив; Алькорта, Ибон; Клэри, Дэвид К .; Крэбтри, Роберт Х .; Данненберг, Джозеф Дж .; Хобза, Павел; Kjaergaard, Henrik G .; Легон, Энтони С .; Меннуччи, Бенедетта; Несбитт, Дэвид Дж. (2011). «Определение водородной связи». Pure Appl. Chem. 83 (8): 1637–1641. DOI: 10.1351 / PAC-REC-10-01-02
Буферизация
Буферизация … довольно короткая, не слишком
техническая версия.
Поток буферизируется, когда он может противостоять изменениям pH, например, из-за добавления
кислая шахтная вода.Поток получает буферную способность за счет известняка.
(или подобный минерал) растворенный в нем. Известняк добавляет карбонат и
бикарбонат-ионы, обладающие способностью нейтрализовать кислоту. Буферизованный
поток будет поддерживать pH, близкий к нейтральному (7). Чем больше растворяется
известняк, тем лучше буферная способность. Это действительно хорошо
иметь поток с высокой степенью буферизации. Это позволяет потоку поглощать окружающую среду.
поражает, не уничтожая водную флору и фауну. Буферизация делает водную систему
более надежный.Буферный поток, вероятно, будет иметь высокую щелочность.
Буферизация для технически подкованных людей
Забуференный раствор – это раствор, устойчивый к изменению его pH. когда добавлены ионы водорода (H + ) или ионы гидроксида (OH – ). Вода, которая не забуферена, подвержена резкому изменению pH при добавлении кислоты или основания. Пример – чистая вода. В природе самые здоровые, самые биологически разнообразные ручьи и водотоки имеют pH близок к 7 (нейтральный) и не изменяется более чем на единицу pH.Способность к сопротивляться изменениям pH за счет добавления определенных химикатов, которые могут потребляют ионы водорода (H + ) или ионы гидроксида (OH – ).
Что касается проблем с AMD, нам нужно беспокоиться о посягательствах на pH. только с кислотной стороны, т.е. нежелательное добавление кислотности в форме H + от пиритовых реакций. Увеличение количество ионов H + в растворе снизит pH небуферизованного решение, иногда радикально. Однако, если в воде присутствуют химические вещества, которые могут потребляя или связывая ионы H + , можно избежать резких изменений pH. Это функция буфера.
Безусловно, самый важный буфер для водных систем в природа – карбонатная (CO 3 2-) система. Здесь множество химических видов и происходят очень интерактивные реакции. Источник химикатов углекислый газ из атмосферы и карбонатсодержащие минералы в земля, наиболее распространенная из которых – известняк. Для тех, кто не интересуется подробности, вот краткое описание. Если достаточно известняка (CaCO 3 ) растворяется в потоке, он будет содержать достаточное количество карбоната (CO 3 2-) и бикарбонат (HCO 3 – ) ионов, которые, в свою очередь, способны потребление ионов водорода и поддержание довольно постоянного и почти нейтрального pH. Этот буфер на основе карбоната защищает струю от слишком низкого pH и может смягчить пагубные последствия AMD. Однако, если поступает больше ионов H + , поток, чем есть карбонатные и бикарбонатные ионы, чтобы противодействовать им, буфер становится переполненным и больше не действует. Вода, которая была посчастливилось контактировать с известняком, пользуется определенной защитой (все равно от кислотности) от AMD.
Сумма всех кислотностей (H + ) потребляющий ион концентрации гидроксида [OH – ], карбоната [CO 3 2- ], и бикарбонат [HCO 3 – ] известен как щелочность. Щелочность – это способность поглощать или нейтрализовать кислотность.
Щелочность = [OH – ] + 2 [CO 3 2- ] + [HCO 3 –] – [H + ]
Первичный механизм растворения известняка в наличие кислотности (H + ) равно следующим образом
CaCO 3 (s) + H + (водн.) Ca 2+ (водн.) + HCO 3 – (водн.)
образует щелочность в виде бикарбоната (HCO 3 – ).Когда бикарбонат является преобладающим карбонатом, вода забуферена при pH близко к 7. Часто используется термин бикарбонатная щелочность .
Другие реакции с потреблением кислоты карбонатная система
CO 3 2- (водн.) + H + (водн.) HCO 3 – (водн.) (карбонат в бикарбонат)
HCO 3 – (водн.) + H + (водн.) H 2 CO 3 (водн.) (бикарбонат в угольную кислоту)
ОН – (водн.) + H + (водн.) H 2 O (гидроксид в воду)
Обратите внимание, что карбонат может эффективно потреблять 2 иона водорода (за 2 шага), и поэтому 2 является фактором уравнение щелочности.
Также обратите внимание, что все из этих химических уравнений может происходить в любом направлении (обратимо). А Таким образом, между всеми химическими соединениями устанавливается сложное равновесие. в конечном итоге отвечает за результирующий pH. Однако расчеты довольно утомительны, и их лучше оставить для более тщательного рассмотрения предмет.
Условия буферизация и щелочность , когда относящиеся к потокам, часто используются как синонимы.
Щелочность известняка может возникнуть естественным путем, если
вода проходит через геологические пласты, содержащие известняк.AMD, которая
имел счастье иметь достаточную щелочность, как правило, легче всего
удовольствие. С другой стороны, если AMD не была буферизована естественным образом, обычная
стратегия лечения заключается в
добавить щелочность известняка по дизайну.
См. Окружающая среда колледжа Сент-Винсент Модуль “Образовательный центр” на pH / щелочность / кислотность / буферность.
pH, щелочность и буферная способность воды
Присоединяйтесь к нашему форуму сейчас иЗадайте любой вопрос БЕСПЛАТНО Станьте участником Smart Fertilizer Knowledge Hub
Сообщество экспертов по питанию растений Спасибо за участие и добро пожаловать на наш форум!
Измерение pH поливной воды и почвенного раствора имеет большое значение и может фактически определить успех или неудачу урожая.
pH – показатель концентрации ионов водорода (H +) в воде. Он определяется как –Log (H +).
Чем выше концентрация ионов водорода в воде, тем ниже значение pH.
Шкала pH от 0 до 14, где:
- Вода с pH ниже 7 считается кислой (более высокая концентрация H +)
- Вода с pH выше 7 считается основной (более низкая концентрация H +)
- Вода с pH 7.0 считается нейтральным
Поскольку pH имеет логарифмическую шкалу, изменение pH на одну единицу (например, с 5,0 до 6,0) означает 10-кратное изменение концентрации ионов H +!
Ионы водорода принимают участие в большинстве химических реакций, протекающих в воде и почве, что делает их чрезвычайно важными. Их концентрация (следовательно, pH) влияет на растворимость удобрений, ионные формы солей (например, PO4-3 по сравнению с h3PO4-), доступность питательных веществ для растений, стабильность хелатов и т. Д.
Вода или почвенный раствор со слишком высоким pH может привести к дефициту питательных веществ, в основном таких микроэлементов, как железо.
Поддержание pH поливной воды ниже 7,0 также важно для предотвращения засорения эмиттера из-за осаждения солей.
С другой стороны, слишком низкий pH может привести к токсичности питательных микроэлементов и повреждению корневой системы растения.
Желательный диапазон pH в корневой зоне, комфортный для большинства растений, составляет 5.5-6,5. Поэтому многим цветоводам приходится добавлять кислоту в поливную воду.
Добавление кислоты фактически означает добавление ионов водорода. Однако для определения количества добавляемой кислоты недостаточно знать pH воды. Следует учитывать еще один важный параметр: щелочность воды.
Легко составьте план внесения удобрений с помощью нашего программного обеспечения
Начните использовать и увеличьте урожай до 40%
Создайте свой планЩЕЛОЧНОСТЬ И БУФЕРНАЯ ЕМКОСТЬ ВОДЫ
Щелочность воды связана с pH, но на самом деле это другой параметр.Это мера способности воды противостоять изменениям pH или, другими словами, буферная способность воды. Не путайте «щелочность» с «щелочностью» (что означает pH 7,0–14,0).
Основными составляющими щелочности воды являются:
- Карбонаты (CO3-2)
- Бикарбонаты (HCO3-)
- Гидроксиды растворимые (OH-)
Щелочность обычно выражается в ppm или мг / л карбоната кальция (CaCO3).
Чем выше щелочность, тем больше кислоты можно добавить без значительного изменения pH.Это связано с тем, что бикарбонаты (HCO3-) и карбонаты (CO3-2) реагируют с ионами водорода (H +), вносимыми кислотой, предотвращая их снижение pH.
Как только все компоненты щелочности в воде нейтрализуются кислотой, концентрация свободных ионов водорода в воде увеличивается, и происходит резкое падение pH воды. Следующий график иллюстрирует эту «точку разрыва», когда pH падает:
Вот простой пример того, как буферная емкость воды влияет на повседневные решения:
- Гровер A имеет исходную воду с pH 9.0 и щелочность 45 мг / л CaCO3.
- Grower B имеет исходную воду с pH 8,0 и щелочностью 120 мг / л CaCO3.
Оба производителя нуждаются в том, чтобы pH их поливной воды был 5,0, и для этой цели используют серную кислоту.
Даже несмотря на то, что вода гровера A имеет более высокий pH (концентрация ионов водорода в его воде в 10 раз выше, чем вода гровера B), ему действительно нужно добавлять меньше кислоты, чем у гровера B, чтобы достичь того же целевого pH.
Менее 45 мг / л CaCO3 считается низкой щелочностью воды и низкой буферной емкостью.Кислота, добавленная в эту воду, быстро повлияет на ее pH.
Таким образом, очевидно, что и pH, и щелочность важны для определения правильного количества кислоты, которую вы должны добавить в поливную воду для достижения необходимого pH.
Вот уравнения, которые связывают pH и щелочность:
pH = 6,37 + log (HCO3- / h3CO3)
или
pH = 10,33 + log (CO3-2 / HCO3-)
- Рекомендует идеальную смесь / смеси удобрений
- Экономия до 50% на удобрениях
- Исчерпывающие данные по сотням сортов сельскохозяйственных культур
- Интерпретирует результаты испытаний для любого метода экстракции.
Попробовать наше программное обеспечение сейчас
Вы хотите прочитать статью полностью? Оставьте пожалуйста свой электронный адрес
Мы регулярно обновляем нашу базу статей, а также работаем над качеством материалов.Оставьте свой адрес электронной почты и всегда получайте новые статьи в нашей еженедельной рассылке. Узнай первым, не упускай важного!
Буферная емкость – обзор
Окислительный стресс и воспаление
Окислительный стресс, присутствие активных форм кислорода сверх доступной буферной емкости антиоксидантов, является характерной чертой преэклампсии.Известно, что окислительный стресс повреждает белки, клеточные мембраны и ДНК и является потенциальным медиатором эндотелиальной дисфункции. Было высказано предположение, что при преэклампсии факторы, ответственные за окислительный стресс плацентарного происхождения, передаются в большой круг кровообращения, что приводит к окислительному повреждению эндотелиальных клеток сосудов по всему телу. Сторонники этой теории сосредотачиваются на самом окислительном стрессе как на связующем звене между плацентой и заболеванием материнского органа-мишени (501, 503).
Есть много отчетов, в которых задокументировано повышение маркеров окислительного стресса в плаценте и кровообращении у пациентов с преэклампсией.К ним относятся снижение экспрессии ферментных антиоксидантов, аномально высокое образование супероксида, более высокие уровни перекисного окисления липидов, а также повышенная выработка и секреция изопростанов в плаценте (549, 613, 614, 616, 617, 648). Маркеры материнской сыворотки включают увеличение пероксинитрита, карбонилов белка (649). Также увеличивается количество летучих органических соединений в альвеолярном дыхании (427), хотя это оспаривается (378, 495).
Модели на животных и испытания на людях также предполагают роль окислительного стресса.Одну животную модель преэклампсии получают инфузией L-NAME (метиловый эфир L-нитро-аргинина), ингибитора синтеза NO, беременным крысам. Это вызывает синдром, подобный преэклампсии, с гипертонией, протеинурией и тромбоцитопенией (480, 638). Исследование, проведенное в Соединенном Королевстве, показало, что дефицит селена, микроэлемента с антиоксидантными свойствами, был связан с повышенным риском преэклампсии (491). Но наиболее клинически значимые выводы получены в результате испытаний на людях: если окислительный стресс является ключевым элементом преэклампсии, можно ожидать, что лечение антиоксидантами будет полезным.Рандомизированное контролируемое исследование Chappell et al. показали, что добавление витаминов C и E уменьшало преэклампсию у беременных из группы высокого риска (OR, 0,4). PAI-1 и PAI-2, маркеры активации эндотелия, также были снижены в группе лечения (98). Аналогичным образом, в небольшом рандомизированном исследовании было обнаружено, что лечение антиоксидантом ликопином снижает риск преэклампсии почти на 50% (528). Однако в двойном слепом плацебо-контролируемом исследовании 109 женщин витамины C и E, по-видимому, не влияли на частоту преэклампсии (54).Однако все эти исследования были ограниченными, и в настоящее время проводится несколько крупных рандомизированных слепых плацебо-контролируемых многоцентровых исследований.
Таким образом, рассмотренные данные позволяют предположить, что окислительный стресс может играть важную роль в патогенезе преэклампсии. Ограниченные результаты испытаний предполагают роль антиоксидантов в предотвращении заболевания, концепция в настоящее время изучается в крупных клинических испытаниях.
Щелочность и вода
• Школа наук о воде ГЛАВНАЯ • Темы о свойствах воды • Темы о качестве воды •
Способность нейтрализовать щелочность и кислотность
Измерение щелочности в мобильной лаборатории при работе на Мадди-Крик, восточная часть Юты, октябрь 2015 г.
Кредит: Стив Гернер, USGS
Щелочность – это не химическое вещество в воде, а, скорее, это свойство воды, которое зависит от присутствия в воде определенных химических веществ, таких как бикарбонаты, карбонаты и гидроксиды. Тогда определение щелочности будет «буферной способностью водоема; мерой способности водоема нейтрализовать кислоты и основания и, таким образом, поддерживать довольно стабильный уровень pH ». Проще говоря, вода с высокой щелочностью будет испытывать меньшее изменение собственной кислотности, например, когда кислая вода, такая как , кислотный дождь или пролив кислоты, попадает в водоем.
Вы можете использовать эту аналогию – вы и ваш друг находитесь в разных небольших гребных лодках в озере . Обе лодки имеют протечку, что вас не беспокоит, поскольку вы оба были достаточно мудры, чтобы принести на борт ведро для спасения на случай непредвиденных обстоятельств. Вот только ваш друг схватил ведро размером с галлон, а все, что у вас есть, – это ведро поменьше, размером с пинту. Вы оба начинаете выкачивать воду из лодки, но через некоторое время ноги вашего друга становятся едва влажными, а внутри вашей лодки вода до колен.Ваш друг может выгрузить поступающую воду так же быстро, как она поступает, но вы не успеваете. У вашего друга лучшая «буферная способность», чем у вас, и он может в большей степени нейтрализовать поступающую воду. По этой аналогии его лодка будет иметь более высокую щелочность, чем ваша.
Почему важна щелочность
Хотя вы не часто слышите о щелочности вашего любимого озера в новостях, щелочность может иметь важное значение для здоровья и благополучия озера.Экосистема и организмы, обитающие в озере, эволюционировали в водоемах, которые не менялись быстро. До прихода людей водоемы не подвергались разливам химикатов и кислотным дождям. Вероятно, pH и водные характеристики озера не сильно изменились за короткий промежуток времени, что вполне подходило для рыб в озере.
В наше время водные объекты могут подвергаться внезапному поступлению химических веществ, таких как те, что содержатся в кислотных дождях и сточных водах , которые могут вызвать быстрые изменения кислотно-щелочного баланса озера, что снижает pH воды в озере. , например.Внезапное изменение pH вредно для рыб и организмов, живущих в воде. Водные организмы выигрывают от стабильных значений pH, а вода с высокой щелочностью лучше способна поддерживать довольно постоянный pH.
Что влияет на щелочность?
В поверхностных водоемах, например в озере, щелочность воды в основном связана с камнями и землей, окружающими озеро. Осадки выпадают в водораздел, окружающий озеро, и большая часть воды, попадающей в озеро, происходит от стока над ландшафтом.Если ландшафт находится в области, содержащей камни, такие как известняк, то сток улавливает химические вещества, такие как карбонат кальция (CaCO 3 ), что повышает pH и щелочность воды. Например, в областях, где геология содержит большое количество гранита, озера будут иметь более низкую щелочность. Но пруд в пригороде, даже в области с большим количеством гранита, может иметь высокую щелочность из-за стока с домашних газонов, где был применен известняк (используется для повышения pH почвы для лучшего выращивания газонов).
Измерение щелочности
Измерение пробы воды в лаборатории для определения щелочности.
Кредит: Джозеф Айотте, USGS
Один из распространенных методов, используемых Геологической службой США (USGS) для измерения щелочности, состоит в том, чтобы взять образец воды и добавить в него кислоту, одновременно проверяя pH воды по мере добавления кислоты. Снимают начальное значение pH воды, затем постепенно добавляют небольшие количества кислоты, воду перемешивают и измеряют pH.Это делается много раз. Вначале добавленная кислота будет нейтрализована соединениями в воде, такими как бикарбонаты. По мере добавления кислоты бикарбонаты «расходуются», так как они также нейтрализуются кислотой. В конце концов, все кислотонейтрализующие соединения израсходованы. После этого любая кислота, добавленная в воду, будет понижать pH линейным образом, и ученый сможет увидеть эту точку отражения, просмотрев линейную диаграмму количества кислоты, добавленной в воду, и результирующего pH.Точка, в которой линия изменения pH становится линейной, используется для определения щелочности воды.
На этом снимке ученый Геологической службы США выполняет титрование щелочности, чтобы определить щелочность образца воды. Обратите внимание на pH-метр на заднем плане (на данный момент он показывает 5,477). Большая серая трубка, идущая в стакан, – это зонд pH. Черное устройство с правой стороны проталкивает фиксированное количество кислоты через белую трубку, которая попадает в правую сторону стакана с водой.Черный ящик на дне имеет вращающийся магнит, который затем вращает небольшой магнит, расположенный на дне стакана, который поддерживает перемешивание пробы воды.
Карта щелочности поверхностных вод в США
Вот карта, составленная Агентством по охране окружающей среды США (EPA), на которой показаны значения щелочности для поверхностных вод США. Согласно EPA, эта карта представляет собой общую иллюстрацию национальных закономерностей щелочности поверхностных вод на территории Соединенных Штатов.Щелочность является наиболее доступным показателем кислотонейтрализующей способности поверхностных вод и дает разумную оценку относительной потенциальной чувствительности озер и водотоков к кислотным осаждениям. Хотя фактическая чувствительность водного объекта зависит от многих характеристик и процессов водосбора, области с низкой щелочностью на карте указывают, где наиболее вероятно обнаружение чувствительных поверхностных вод.
Карта щелочности поверхностных вод в U.S. Карта основана на данных о щелочности примерно 39 000 участков озер и ручьев и на ассоциациях значений данных с такими факторами, как землепользование, физиография, геология и почвы. Данные были получены из различных источников, включая федеральные агентства и агентства штата, университетских исследователей. и частные корпорации. Во многих областях, представленных определенным диапазоном щелочности, в данных о качестве воды наблюдался еще больший диапазон. Затенением на карте обозначен диапазон щелочности, в который попадают среднегодовые значения большей части поверхностных вод данного района.
Авторы и права: Джеймс М. Омерник, Гленн Э. Гриффит, Джеффри Т. Айриш и Коллин Б. Джонсон
(PDF) Щелочность и буферная способность воды
P1: OTE / SPH P2: OTE
SVNY335-Ibanez (V2) 6 сентября 2007 г. 0:35
30 3. Щелочность и буферная емкость воды
присутствует (когда он достигает pH около 6,5), и из всех
бикарбонат-ионы присутствуют до pH 4,5. Общее количество кислоты
указывает на общую щелочность.Для более точного титрования
за pH необходимо следить с помощью pH-метра
. Учащийся сравнит количество каждого добавленного титранта
и pH каждой пробы, помимо определения
, прекращающего щелочность и графического определения
буферной емкости каждого образца. Студент также
определит слабые или сильные буферы.
Во второй части эксперимента (Часть B) ученик
подготовит растворы с различными пропорциями
карбонатных и фосфатных солей и титрует их
, чтобы оценить их пределы буферизации и соотношение
, которое даст лучшую буферную емкость –
.Учащийся будет наблюдать эффект изменения
пропорций кислоты и конъюгированного основания как
, а также изменения концентрации присутствующих компонентов буфера –
. Также будут отмечены различия между используемыми конъюгированными системами
.
В Части C ученик будет использовать уравнение Хендерсона–
Хассельбаха, чтобы определить соотношение конъюгата
основание / слабая кислота для буферизации желаемого pH, и предварительно
сравнит его экспериментально.Начальный pH и буферная емкость
затем определяются титрованием, и они
контролируются по изменениям pH, которые приводят к
при добавлении определенных количеств стандартизированной кислоты
или основания.
Меры безопасности
Титранты не должны контактировать с кожей или глазами
, так как они могут вызвать коррозию. Ученик
должен учитывать все меры безопасности, обычно принимаемые при работе с такими реагентами.В случае разлива раствора кислоты
или контакта с кожей протрите
чистой тканью и тщательно промойте, а
обильно водой (сбрызните стол или поверхность
бикарбонатом натрия). Все остатки
, полученные в этом эксперименте, могут быть сброшены в сток
после того, как они были нейтрализованы.
Экспериментальная последовательность
Расчетное необходимое время: 5 мин на образец
Часть A. Измерение щелочности или ANC
Образцы и процедура:
1.Соберите образцы (или приготовьте их синтетическим путем)
: (1) речной или озерной воды, (2) океанской воды, (3)
минеральной воды (или, если есть, используйте грунтовые воды),
(4) водопроводной воды, и (5) DI вода. Используйте откалиброванный pH-метр
на протяжении всего эксперимента и
подождите, пока не будут получены стабильные показания.
2. Измерьте pH и температуру каждого образца –
пл. Если pH выше 8,3, определите P-щелочность
. Если это не так, только M-щелочность
(т.е.например, метиловый оранжевый или бромкрезоловый зеленый щелочь (
() при pH = 4,3).
3. Если pH <4,3, измерьте кислотность пробы.
4. Чтобы предотвратить маскирование конечной точки при использовании цветных индикаторов, убедитесь, что образец
бесцветный и не мутный. Чтобы получить этот раствор, отфильтруйте образец перед титрованием и – если
цвет был проблемой – добавьте небольшое количество
активированного угля (перед фильтрацией).Фильтрация
может осуществляться с помощью шприца, снабженного
держателем фильтра и фильтром с мелкими порами. Чтобы исключить любой свободный хлор, который может помешать титрованию
, добавьте одну или две капли 0,01 М тиосульфата натрия
.
5. Поместите микробюретку на подставку, промойте ее небольшим количеством 0,01 М кислотного титранта
и залейте
до желаемой отметки.
6. С помощью мерной пипетки возьмите 10-миллилитровую порцию
пробы воды и поместите ее в стакан емкостью 25 или
на 50 мл.Поместите микромагнитную мешалку
внутрь стакана и поместите стакан на перемешивающую пластину
. Погрузите колбу pH-электрода в жидкую пробу
, не касаясь стержня для перемешивания.
Измерьте pH.
7. Добавьте 2-3 капли фенолфталеинового индикатора (например, с помощью пипетки Берала). Обратите внимание, появляется ли какой-либо цвет
.
8. Если при добавлении индикатора P нет цвета,
, то щелочность P равна нулю.В этом случае im-
непосредственно добавляют 1-2 капли индикатора метилового оранжевого
(или бромкрезолового зеленого) и начинают титрование
до конечной точки.
9. Если при добавлении нолфталеина phe-
появляется розовый цвет, титруйте по каплям (с шагом 0,1
или 0,2 мл), осторожно перемешайте и запишите
результирующего pH и объема добавленного титранта.
Запишите значение pH в тот момент, когда цвет индикатора
исчезнет (он должен быть близок к
8.