Всё о тритии
Батарейка сядет не скоро
Мир развивается, повсюду внедряются инновационные решения, требующие новых стабильных, безопасных источников энергии с длительным сроком службы. Ученые многих стран мира (и России в том числе) считают перспективным направление радиоизотопных источников питания, в том числе тритиевых. Все радиоизотопные источники можно условно разделить на две категории: с тепловым циклом и без него.
К первой категории относятся термоэлектрические преобразователи, так называемые РИТЭГи, в которых используется большое количество радиоактивного материала. Сначала этот материал разогревается, затем тепловая энергия преобразуется в электрический ток. Это достаточно большие устройства, их мощность может доходить до сотен ватт, и вес таких конструкций внушительный — до нескольких тонн. Это скорее миниатюрные подстанции, а не батареи. Их можно размещать в труднодоступных регионах, например, в Арктике. Устройства поменьше регулярно устанавливаются на спутниках и прочих космических аппаратах, задача которых — выйти за пределы Солнечной системы.
Миниатюрные источники питания без теплового цикла тоже разделяются на несколько категорий. К первой относятся те, в которых используется прямое преобразование энергии: энергия радиоактивного распада преобразуется в электрический ток, например, с помощью полупроводников. Самые известные такие источники — работающие на основе прямого преобразования бета-излучения (бета-вольтаические). Ко второй категории относятся источники на основе промежуточного преобразования бета-излучения в фотоны света (фотоэлектрические преобразователи с двойным преобразованием).
У каждого типа источников есть свои преимущества и недостатки; при этом тритий можно применять в каждом из них.
Радиоизотопами — кандидатами на роль топлива в миниатюрных батарейках — могут выступать несколько изотопов. Первые батарейки изготавливались с применением 90Sr. Этот изотоп достаточно дешевый, его получают при переработке ОЯТ. Однако у стронция слишком высокая энергия бета-излучения. Кроме того, в результате образуется 90Y с энергией бета-излучения примерно 2,3 МэВ — такого излучения не выдержит ни один существующий полупроводник.
Были попытки создать устройства на основе 147Pm. Он требует дополнительной очистки, зато имеет комфортную энергию бета-распада. Однако его проблема заключается в коротком периоде полураспада — примерно 2,6 года. За это время мощность батарейки снижается примерно в два раза. Проблематично найти потребителя, готового использовать дорогостоящее устройство, мощность которого за три года снизится на 50%.
Одна из основных проблем на пути создания качественной батарейки — эффективность преобразования бета-излучения. От качества полупроводника, по большому счету, зависят характеристики будущего устройства. Сейчас полупроводниковая промышленность всего мира в основном занимается развитием солнечных батарей, то есть преобразованием света в электрический ток. Полупроводниковые преобразователи для бета-излучения — очень узкая сфера деятельности, и без дополнительных финансовых вливаний, без исследований это направление далеко не продвинется.
Работы с прометием и стронцием дали импульс развитию этого направления. Сегодня наиболее перспективными изотопами для батареек считаются 63Ni и тритий. Основные различия между этими изотопами — период полураспада: у трития он составляет 12,3 года, у 63Ni — около 100 лет. Конечно, батарейка, работающая целый век, выглядит очень привлекательно.
Сегодня наиболее перспективными изотопами для батареек считаются 63Ni и тритий. Основные различия между этими изотопами — период полураспада: у трития он составляет 12,3 года, у 63Ni — около 100 лет. Конечно, батарейка, работающая целый век, выглядит очень привлекательно.
Но, во‑первых, технология получения чистого 63Ni достаточно сложная и дорогая: стоимость 1 грамма трития и 63Ni различается чуть ли не на порядки. Во-вторых, технологии по тритию давно отработаны, а получение 63Ni еще 10 лет назад казалось фантастикой. Сейчас 63Ni высокого обогащения появляется в атомной отрасли, но эту технологию еще предстоит обкатать. В-третьих, преимущество никеля — период полураспада в 100 лет — одновременно и недостаток; он имеет низкую радиоактивность: поток бета-частиц 63Ni ниже, чем у трития. Ученые надеются получить 63Niz с удельной активностью 80 кюри на 1 грамм — это планка, которой пока тяжело достичь. А удельная активность чистого газообразного трития — почти 10 тыс. кюри на 1 грамм, то есть потоки бета-частиц у трития и никеля различаются кардинально. В-четвертых, нужно понимать, что пока не существует устройства, которое гарантированно проработает 100 лет. Даже не каждый производитель полупроводниковых преобразователей гарантирует срок службы 20−30 лет.
А удельная активность чистого газообразного трития — почти 10 тыс. кюри на 1 грамм, то есть потоки бета-частиц у трития и никеля различаются кардинально. В-четвертых, нужно понимать, что пока не существует устройства, которое гарантированно проработает 100 лет. Даже не каждый производитель полупроводниковых преобразователей гарантирует срок службы 20−30 лет.
В силу всех этих причин на первый план выходит тритий. Есть технологии его наработки и удержания, есть готовые площадки по обращению с ним. Бета-излучение его достаточно мягкое и практически не разрушает структуру полупроводника.
Кстати, в некоторых странах, например, в США, производители тритиевых батареек имеют лицензию чуть ли не на свободное распространение этих устройств. То есть купить такую батарейку теоретически может любое юрлицо. В нашей стране организации, использующей радиоизотопные источники питания, необходимо иметь санитарно-эпидемиологическое заключение на право проведения таких работ. Свободное распространение радиоизотопных источников имеет свои нюансы — это значит, что производителю нужно продумать «защиту от дурака», потому что в случае разрушения ядерной батарейки радиоактивное вещество может нанести вред и человеку, и окружающей среде.
Разница между Протием и Дейтерием
Ключевое различие между Протием и Дейтерием состоит в том, что у Протия нет нейтронов в его атомном ядре, тогда как у Дейтерия есть один нейтрон.
Протий и Дейтерий являются изотопами водорода. Они отличаются друг от друга по количеству нейтронов, присутствующих в их атомном ядре. Водород содержит один протон в атомном ядре: таким образом, атомный номер водорода равен 1. Существует три изотопа водорода и все три изотопа содержат один протон, а количество нейтронов у них разное. Называются они Протий, Дейтерий и Тритий, а обозначают их 1H, 2H и 3H. Значения в верхнем индексе являются атомными массами этих элементов.
Три изотопа водорода — Протий, Дейтерий и ТритийСодержание
- Обзор и основные отличия
- Что такое Протий
- Что такое Дейтерий
- В чем разница между Протием и Дейтерием
- Заключение
Что такое Протий?
Протий — это изотоп водорода, который содержит один протон и один электрон.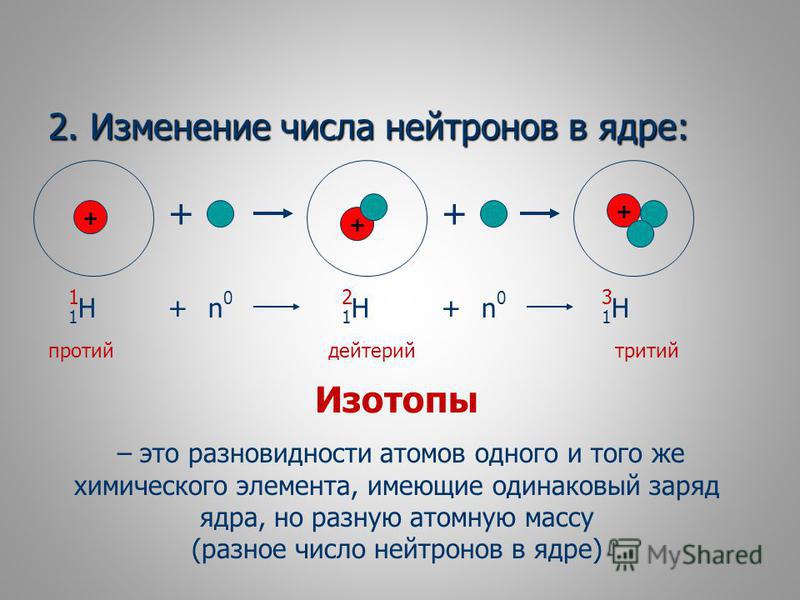 У него нет никаких нейтронов в атомном ядре. У него в ядре присутствует только один протон.
У него нет никаких нейтронов в атомном ядре. У него в ядре присутствует только один протон.
Этот изотоп назван так из-за присутствия этого единственного протона. Обозначается он как 1Н или водород-1, где 1 — атомная масса протия.
Протий является наиболее распространенным изотопом водорода. Количество его составляет около 99% всего водорода. Он является стабильным изотопом, так как протон в этом атоме никогда не подвергался распаду. Однако, согласно теориям, он подвергается распаду с очень большим периодом полураспада, из-за этого увидеть этот распад не представляется возможным.
Что такое Дейтерий?
Дейтерий — это изотоп водорода, имеющий протон, нейтрон и электрон. В отличие от протия, этот изотоп имеет протон и нейтрон вместе в атомном ядре. Следовательно, атомная масса этого изотопа равна 2. Дейтерий ещё называют водород-2 или 2Н. Он, также является стабильным изотопом водорода. Количество дейтерия очень мало по сравнению с протием и оно колеблется в пределах от 0,0026 до 0,0184%. В отличие от трития, дейтерий не является радиоактивным веществом и не является токсичным.
В отличие от трития, дейтерий не является радиоактивным веществом и не является токсичным.
Вода обычно содержит водород-1 в сочетании с атомами кислорода. Но в ней может быть водород-2 в сочетании с кислородом, который образует воду. Эта вода называется — тяжелой водой. Химическая формула тяжелой воды — D2O, где D — это дейтерий, а O — кислород. Дейтерий и его соединения часто используются в химических экспериментах. Например, они применяются в качестве нерадиоактивных меток в экспериментах, таких как растворители, используемые в ЯМР-спектроскопии. Кроме того, тяжелую воду используют в качестве замедлителя нейтронов и теплоносителя для ядерных реакторов. Также, дейтерий является топливом для ядерного деления, и используют его в промышленности.
В чем разница между Протием и Дейтерием?
Существует три изотопа водорода: Протий, Дейтерий и Тритий. Ключевое различие между Протием и Дейтерием состоит в том, что у Протия нет нейтронов в его атомном ядре, тогда как у Дейтерия есть один нейтрон.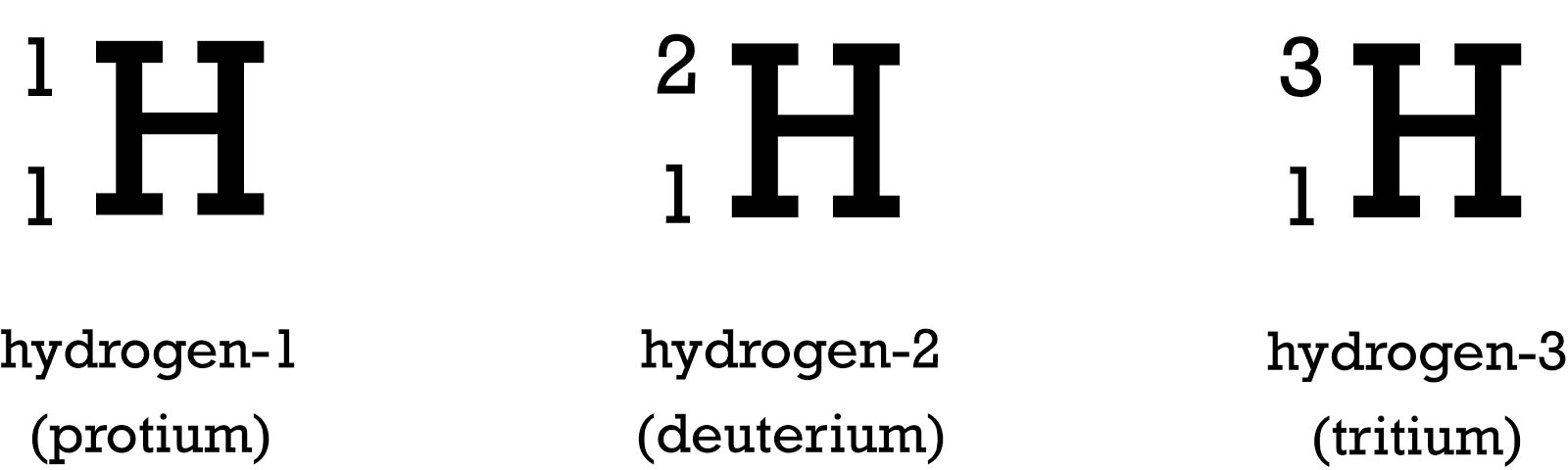 Поэтому эти три изотопа отличаются друг от друга по количеству нейтронов, присутствующих в их атомном ядре. Кроме того, атомная масса протия равна 1, а атомная масса дейтерия равна 2.
Поэтому эти три изотопа отличаются друг от друга по количеству нейтронов, присутствующих в их атомном ядре. Кроме того, атомная масса протия равна 1, а атомная масса дейтерия равна 2.
Кроме того, изотоп водорода — Протий обозначается еще, как водород-1 или 1H, а дейтерий — как водород-2 или 2H. Протий является наиболее распространенным изотопом водорода, и его содержание составляет около 99% всего водорода. Тогда как Дейтерий сравнительно менее распространен (около 0,002%). Тем не менее, он также стабилен как Протий.
Заключение — Протий против Дейтерия
Существует три изотопа водорода: Протий, Дейтерий и Тритий. Эти три изотопа отличаются друг от друга в зависимости от атомной массы, которая является числом протонов и нейтронов в атомном ядре. Ключевое различие между Протием и Дейтерием заключается в том, что у Протия нет нейтронов в его атомном ядре, тогда как у Дейтерия есть один нейтрон.
Изотопы водорода – плутоний, дейтерий, тритий с примерами и видео
Содержание
Протий Дейтерий Тритий Часто задаваемые вопросы
Что такое изотопы водорода?
В природе существуют три изотопа водорода: тритий , дейтерий и протий .
Каждый изотоп обладает уникальными свойствами. Эти изотопы широко используются до настоящего времени. 4 H — 7 H — это изотопы ядер, которые используются в лаборатории. Одним из наименее стабильных изотопов водорода является 9.0019 7 H, а наиболее стабильным изотопом является 5 H. Наиболее стабильным радиоизотопом водорода является тритий.
Рекомендуемые видео
Водород является первым элементом в периодической таблице и имеет атомный номер один. Те элементы, которые имеют одинаковый атомный номер, но разные массовые числа, называются изотопами. Существует три изотопа водорода, а именно протий
В протии нет нейтронов, тогда как в дейтерии у нас есть один нейтрон, а в тритии у нас есть два нейтрона.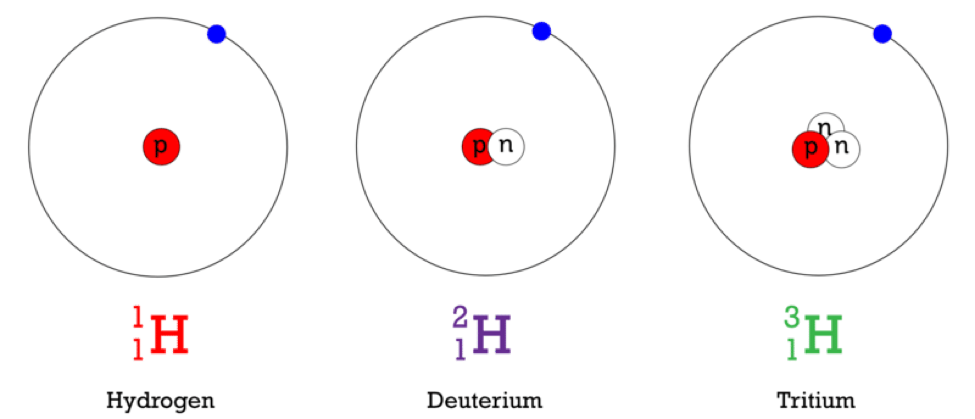 Наиболее заметной формой водорода является протий, 0,0156% водорода присутствует на земной поверхности в виде дейтерия. В тритии концентрация составляет один атом на 1018 атомов протия. Из этих трех изотопов водорода
Наиболее заметной формой водорода является протий, 0,0156% водорода присутствует на земной поверхности в виде дейтерия. В тритии концентрация составляет один атом на 1018 атомов протия. Из этих трех изотопов водорода
Из этих трех изотопов водорода только тритий является радиоактивным по своей природе, который испускает низкоэнергетические бета-частицы. Поскольку электронная конфигурация изотопов одинакова, все они имеют схожие химические свойства. Но у них есть разница в скорости реакции, это происходит из-за разных энтальпий диссоциации связи. Они имеют разные физические свойства из-за больших различий в массе.
Возникновение водорода на Земле затруднено из-за его легкой природы. В совокупности он образует 15,4% водорода, содержащегося в земной коре и океанах. Водород также встречается в растительных и животных тканях, углеводородах, белках, гидридах и многих других соединениях. Во Вселенной водород является самым распространенным элементом (70% от общей массы), а также основным элементом солнечной атмосферы. Даже такие огромные планеты, как Юпитер и Сатурн, в основном состоят из водорода.
Даже такие огромные планеты, как Юпитер и Сатурн, в основном состоят из водорода.
1. Протиум (
1 Н ) Это один из распространенных изотопов водорода. Его много в природе с обилием 99,98%. Одна из причин этого заключается в том, что ядро этого изотопа состоит из одного протона, и этот протон, как сообщается, ни разу не распался. Масса протия 1,007825 а.е.м. Водород обычно соединяется с другими атомами в соединениях и обычно встречается в H
2. Дейтерий (
2 Н) В его ядре содержится 1 протон и 1 нейтрон. Ядро водорода 2 называется дейтроном. Он не радиоактивный. Его соединения используются в химическом анализе и растворителях для водорода 1. Тяжелая вода обогащена молекулами, состоящими из дейтерия вместо протия. Он используется в качестве теплоносителя и замедлителя нейтронов. Водород 2 также используется в качестве топлива в ядерном синтезе (коммерческий). В природе встречается в виде газообразного дейтерия.
В природе встречается в виде газообразного дейтерия.
Применение дейтерия
- Наркотики
- Ядерное оружие
- Контрастные свойства
- Отслеживание
- ЯМР-спектроскопия
- Ядерные реакторы и атомные электростанции
3. Тритий (
3 H )В его ядре содержится 2 нейтрона и 1 протон. Небольшие следы водорода 3 или трития встречаются в природе из-за синергии космических лучей с атмосферными газами. Они также высвобождаются в небольшом количестве во время испытаний ядерного оружия. Радиоактивен, распадается на гелий 3 в результате бета-распада. Водород 3 имеет атомную массу 3,016049.2 ед.
Применение трития
- Аналитическая химия
- Управляемый ядерный синтез
- Тритий во вторичных компонентах водородной бомбы
- Повышение
- Нейтронный инициатор
- Ядерное оружие
- Освещение с автономным питанием
- Используется в качестве океанического транзиентного индикатора
Водород-4
В его ядре содержится 1 протон и 3 нейтрона.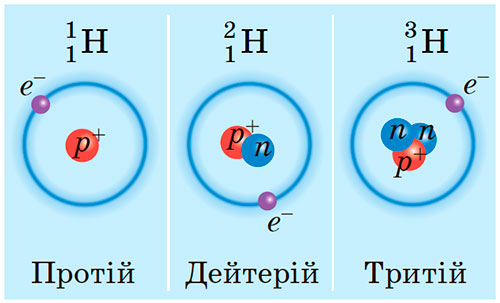 Водород-4 — очень нестабильный изотоп водорода. Он используется в лабораториях, бомбардирующих тритий быстро движущимися ядрами дейтерия. Его атомная масса составляет 4,02781 ± 0,00011.
Водород-4 — очень нестабильный изотоп водорода. Он используется в лабораториях, бомбардирующих тритий быстро движущимися ядрами дейтерия. Его атомная масса составляет 4,02781 ± 0,00011.
Водород-5
Состоит из 4 нейтронов и 1 протона. Водород-5 — очень нестабильный изотоп водорода. Он был получен в лаборатории путем бомбардировки трития быстро движущимися ядрами трития.
Водород-6
Период полураспада 290 йоктосекунд. Он распадается в результате тройного испускания нейтронов на водород-3.
Водород-7
Состоит из 6 нейтронов и 1 протона. Его период полураспада составляет 23 йоктосекунды.
Часто задаваемые вопросы – Часто задаваемые вопросы
Сколько изотопов в водороде?
Элемент водорода имеет три изотопа: водород, дейтерий и тритий. У каждого из нас есть один протон (Z = 1), но количество нейтронов у них разное. В водороде нет нейтрона, в дейтерии один, в тритии два нейтрона.
Какие изотопы водорода радиоактивны?
Период полураспада около 12,32 года. Тритий — самый стабильный радиоизотоп водорода. То есть тритий является наименее радиоактивным из всех радиоактивных изотопов водорода. Четыре других радиоактивных изотопа водорода были получены исследователями, но эти изотопы очень летучи и просто не существуют.
Является ли протий изотопом водорода?
Протий — наиболее распространенный изотоп водорода. На его долю приходится более 99,98% всего водорода во Вселенной. Поскольку его ядро имеет только один протон, его называют протием. Атомная масса протия составляет 1,00782504(7) ед.
Все ли изотопы радиоактивны?
Элементы с атомным номером больше 83 являются радиоизотопами, что означает, что они имеют нестабильные ядра и что они радиоактивны. У них есть изотопы (стабильное ядро), и у большинства есть по крайней мере один радиоизотоп (нестабильное ядро).
Опасны ли изотопы?
Радиоактивные изотопы представляют собой типы химических элементов, образующихся в результате естественного распада атомов. Радиационное воздействие обычно считается опасным для человеческого организма, но в медицине радиоизотопы очень ценны, особенно при диагностике и лечении заболеваний.
Разница между протием, дейтерием и тритием
Основное отличие — протий, дейтерий и тритий
Протий, дейтерий и тритий являются изотопами элемента водорода. Изотопы — это разные формы одного и того же элемента, которые отличаются друг от друга в зависимости от количества нейтронов, содержащихся в их ядрах. Следовательно, изотопы имеют одинаковый атомный номер, но разные атомные массы. По этой причине изотопы имеют разные физические свойства, но химические свойства остаются неизменными, поскольку количество электронов, присутствующих в изотопах, одинаково. Поэтому протий, дейтерий и тритий имеют как общие черты, так и различия.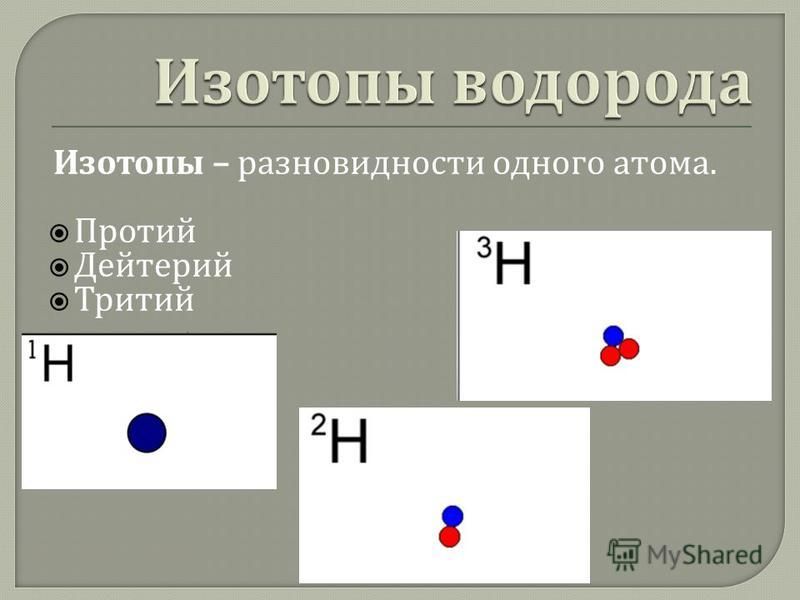 Основное различие между Protium Deuterium и Tritium заключается в том, что В ядрах протия нет нейтронов, тогда как дейтерий состоит из одного нейтрона, а тритий состоит из двух нейтронов.
Основное различие между Protium Deuterium и Tritium заключается в том, что В ядрах протия нет нейтронов, тогда как дейтерий состоит из одного нейтрона, а тритий состоит из двух нейтронов.
Ключевые области, охватываемые
1. Что такое Protium
– Определение, свойства и численность
2. Что является дейтерием
– определение, свойства и изобилие
3.
– Определение, свойства и содержание
4. Каковы сходства между протием-дейтерием и тритием
– Outline of Common Features
5. What is the Difference Between Protium Deuterium and Tritium
– Comparison of Key Differences
Key Terms: Atomic Mass, Atomic Number, Deuterium, Isotopes, Neutron, Protium , Тритий
Что такое протий
Протий — изотоп водорода, состоящий из одного протона и одного электрона. Это самая распространенная форма водорода. Содержание этого изотопа в земной коре составляет около 99,9%. В ядре протия нет нейтронов. Считается самым стабильным изотопом водорода. Поэтому, когда мы обычно говорим о водороде, мы говорим о протии.
Это самая распространенная форма водорода. Содержание этого изотопа в земной коре составляет около 99,9%. В ядре протия нет нейтронов. Считается самым стабильным изотопом водорода. Поэтому, когда мы обычно говорим о водороде, мы говорим о протии.
Атомный номер протия равен 1 из-за наличия одного протона. Массовое число протия также равно 1, так как в ядре протия нет нейтронов. Атомная масса протия составляет около 1,00794 а.е.м. Символ протия 1 H. Электронная конфигурация протия 1s 1 .
Протий встречается в природе в виде двухатомной газообразной формы или в виде водорода в молекуле H 2 O. Связь между двумя атомами в двухатомной молекуле имеет более высокую энтальпию диссоциации связи. В основном это связано с тем, что эти атомы очень маленькие и имеют полную электронную конфигурацию на единственной орбитали (s-орбитали) в форме их двухатомных молекул.
Рисунок 1: Атомная структура протия
На приведенном выше изображении показана атомная структура протия.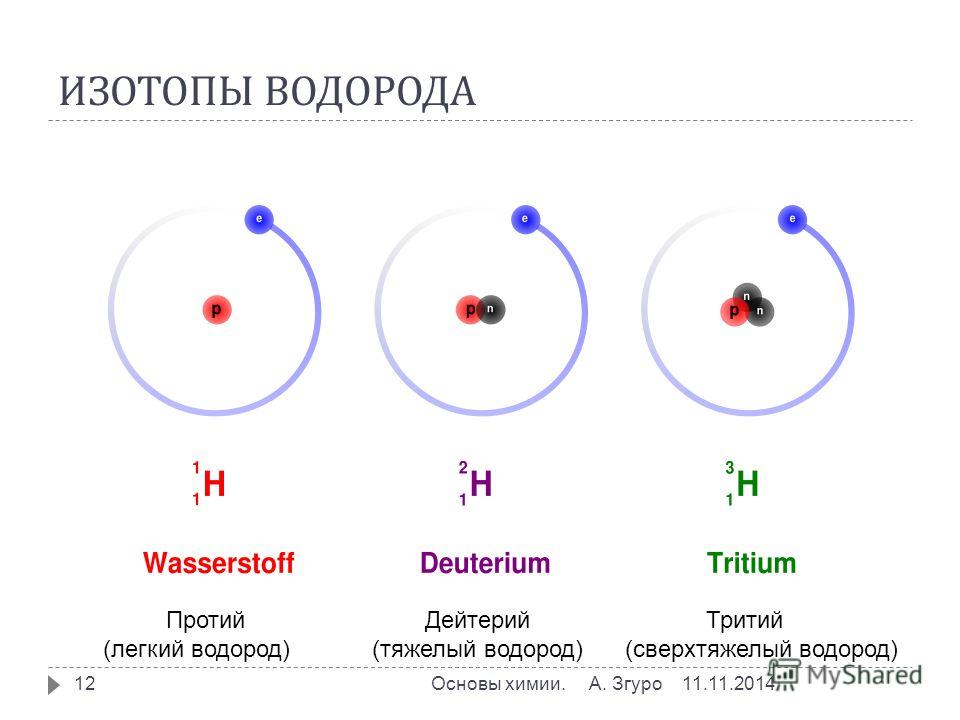 Здесь протон показан в центре атома (ядра), а электрон показан вне ядра синим цветом.
Здесь протон показан в центре атома (ядра), а электрон показан вне ядра синим цветом.
Что такое дейтерий
Дейтерий — изотоп водорода, состоящий из одного протона, одного нейтрона и одного электрона. Ядро дейтерия состоит из протона и нейтрона. Символ дейтерия дается как 2 H. Атомный номер дейтерия равен 1, а массовое число равно 2. Атомная масса может быть равна 2,014 а.е.м. Это также стабильный изотоп водорода, но менее распространенный. Обилие дейтерия в земной коре рассчитано как 0,015%. Он не радиоактивен, так как дейтерий стабилен с одним протоном и одним нейтроном в ядре.
Рисунок 2: Атомная структура дейтерия
Дейтерий может находиться в газовой или жидкой фазе. Дейтерий существует в виде двухатомных газов, таких как D 2 или HD (в сочетании с водородом). Если нет, то дейтерий можно найти в виде тяжелой воды. Тяжелая вода состоит из молекул D 2 O. В большинстве случаев дейтерий действует так же, как протий. Но есть и определенные отличия. Из-за присутствия нейтрона атомная масса дейтерия в два раза больше массы протия. Следовательно, длина связи и энергия связи отличаются от таковых у протия. Более того, лед из тяжелой воды будет тонуть в жидкой воде из-за высокой плотности (обычный лед плавает на поверхности жидкой воды).
Но есть и определенные отличия. Из-за присутствия нейтрона атомная масса дейтерия в два раза больше массы протия. Следовательно, длина связи и энергия связи отличаются от таковых у протия. Более того, лед из тяжелой воды будет тонуть в жидкой воде из-за высокой плотности (обычный лед плавает на поверхности жидкой воды).
Есть и некоторые применения дейтерия. В ЯМР-спектроскопии соединения, содержащие дейтерий, используются в качестве растворителя вместо соединений, состоящих из водорода. Тогда пики, данные атомами водорода аналита, можно отличить от атомов растворителя.
Что такое тритий
Тритий — изотоп водорода, состоящий из одного протона, двух нейтронов и одного электрона. Символ трития — 3 H. Атомный номер трития равен 1, а атомная масса трития равна 3. Массу можно определить как 3,016 а.е.м. Этот изотоп водорода является радиоактивным из-за наличия большого количества нейтронов по сравнению с количеством протонов.
Тритий часто подвергается бета-распаду. Это производит Helim-3 и высвобождает большое количество энергии. Период полураспада трития был рассчитан как 12,32 года. Однако содержание трития в земной коре очень мало.
Это производит Helim-3 и высвобождает большое количество энергии. Период полураспада трития был рассчитан как 12,32 года. Однако содержание трития в земной коре очень мало.
Рисунок 3: Атомная структура трития
На приведенном выше изображении показана атомная структура трития. Массовое число трития равно 3 из-за наличия двух нейтронов (красный цвет) и протона (синий цвет).
Сходства между протием-дейтерием и тритием-
- Протий, дейтерий и тритий являются изотопами водорода.
- Эти изотопы состоят из 1 протона на ядро.
- Все три состоят из 1 электрона.
Рисунок 4: Протий Дейтерий Тритий
Разница между протием, дейтерием и тритием
Определение
Протий: Протий – изотоп водорода, состоящий из одного протона и одного электрона.
Дейтерий: Дейтерий — изотоп водорода, состоящий из одного протона, одного нейтрона и одного электрона.
Тритий: Тритий — изотоп водорода, состоящий из одного протона, двух нейтронов и одного электрона.
Содержание
Протий: Содержание протия составляет около 99,9%.
Дейтерий: Содержание дейтерия составляет около 0,015%.
Тритий: Тритий обнаружен в очень незначительных количествах.
Химический символ
Протий: Символ для профиля составляет 1 H.
Deuterium: Символ Deuterium – 1 H.
Тритий: .
Массовое число
Протий: Массовое число протия 1.
Дейтерий: Массовое число дейтерия 2.
Тритий: Массовое число 3. Тритий
Атомная масса
Протий: Атомная масса протия составляет 1,00794 а.е.м.
Дейтерий: Атомная масса дейтерия составляет 2,014 а. е.м.
е.м.
Тритий: Атомная масса трития составляет 3,016 а.е.м.
Радиоактивность
Протий: Протий не радиоактивен.
Дейтерий: Дейтерий нерадиоактивен.
Тритий: Тритий радиоактивен.
Вывод
Протий, дейтерий и тритий — три изотопа водорода. Помимо этих изотопов, могут быть и другие формы водорода. Но они очень нестабильны из-за присутствия большого количества нейтронов. Основное различие между протием, дейтерием и тритием заключается в том, что в ядрах протия нет нейтронов, в то время как дейтерий состоит из одного нейтрона, а тритий состоит из двух нейтронов.
Ссылки:
1. «Изотопы водорода – безграничный открытый учебник». Безграничный. Безграничный, 20 сентября 2016 г. Интернет. Доступна здесь. 02 августа 2017 г.
2. «Дейтерий, тритий и протий — три изотопа водорода». Причудливая наука. Np, 25 марта 2017 г. Интернет. Доступна здесь. 02 августа 2017 г.
