Не просто вода: почему её формула не Н2О?
Вода – самая известная и самая востребованная жидкость
на нашей планете. Она наполняет океаны, моря и реки, является как домом для
миллиардов живых существ, так и одной из важнейших составляющих курсовых,
дипломов и рефератов круговоротов в природе, а также неотъемлемой частью
всех живых организмов. Причина в том, что вода – важнейший растворитель, и во
многом именно её особые свойства, отличающие её от других оксидов неметаллов,
обуславливают её уникальность. Это относится также и к тому факту, что всем
известная формула H2O является обобщённой, но не исчерпывающей. Так
почему же?
Рассмотрим саму молекулу
воды. Она состоит из двух атомов водорода и одного атома кислорода, связанных
ковалентной полярной связью. На внешнем электронном уровне у атома кислорода
находится 6 электронов, 2 из которых занимают s-орибиталь. Кислород имеет sp3-гибридизацию
атомных орбиталей, по методу валентных связей в молекуле воды каждый из
неспаренных 2p-электронов кислорода взаимодействует с 1s-электроном
атома водорода, образуя общие электронные пары, а две «пустые» sp Эти гибридные орбитали
кислорода, стремясь занять максимально удалённое друг от друга положение в
пространстве, оказываются вытянуты к вершинам тетраэдра, а поскольку две из них
связей не образуют, молекула H2O имеет угловую форму.
Эти гибридные орбитали
кислорода, стремясь занять максимально удалённое друг от друга положение в
пространстве, оказываются вытянуты к вершинам тетраэдра, а поскольку две из них
связей не образуют, молекула H2O имеет угловую форму.
Молекула воды полярна, а также может образовывать водородные связи. Благодаря их наличию вода и лёд имеют определённую структуру. Конечно, в жидкой воде о наличии какой-либо жёсткой структуры говорить не приходится: все молекулы постоянно находятся в тепловом движении и в растворе одновременно сосуществуют и переходят друг в друга несколько разных состояний. Соседние водородные связи влияют друг на друга, и разрыв или искажение водородных связей у одной молекулы приводит к образованию других связей между соседними молекулами. Кажется, что в таком хаосе и не разобраться, но экспериментально установлено, что каждую из молекул воды одновременно окружают 3-4 других молекулы, учёные считают, что эта структура напоминает сетчатую. На рисунке изображён “ансамбль” – молекула воды в окружении своих 4 соседей, связанных водородными связями:
Этот элемент является одним из наиболее часто встречающихся в структуре воды. Образование и разрушение связей между молекулами тоже может влиять на её формулу.
Образование и разрушение связей между молекулами тоже может влиять на её формулу.Тяжёлая вода
Водород (как и кислород) имеет несколько изотопов: протий H, дейтерий D и тритий T, которые содержат, соответственно 0, 1 и 2 нейтрона.
Тритий радиоактивен, дейтерий и протий – нет, а поскольку последние два более устойчивы, то оба встречаются в жидкой воде. Правда, в природной воде оксида дейтерия D2O и смешанного оксида HOD довольно мало – около 0,00015% ат. (т.е. на один атом D приходится около 6600 атомов Н). Оксид дейтерия получают из воды, из-за разности атомных масс, дейтрериевую воду называют тяжёлой. Она отличается по свойствам от обычной, лёгкой воды и является токсичной.
Кислород тоже имеет три стабильных изотопа, правда, без особых названий 16O, 17O и 18O. Преобладает изотоп 16O, но также встречаются и другие и концентрация их выше, чем трития и дейтерия. Таким образом, в 1 кг обычной воды может содержаться почти 3 г тяжёлой воды из изотопов кислорода и водорода:
Конечно же, это влияет на состав воды, количество изотопной
воды сопоставимо с концентрацией микроэлементов в минеральной воде.
Ученые Сколтеха уточнили формулу воды
https://ria.ru/20200709/1574132897.html
Ученые Сколтеха уточнили формулу воды
Ученые Сколтеха уточнили формулу воды – РИА Новости, 09.07.2020
Ученые Сколтеха уточнили формулу воды
Российские ученые в сотрудничестве с немецкими коллегами выяснили, что вода содержит большое количество короткоживущих ионов. Это коренным образом меняет… РИА Новости, 09.07.2020
2020-07-09T19:18
2020-07-09T19:18
2020-07-09T19:18
наука
физика
химия
сколковский институт науки и технологий
открытия – риа наука
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn22.img.ria.ru/images/149988/43/1499884311_0:283:5442:3344_1920x0_80_0_0_eecf326339221d319655c6d154e47306.jpg
МОСКВА, 9 июл — РИА Новости. Российские ученые в сотрудничестве с немецкими коллегами выяснили, что вода содержит большое количество короткоживущих ионов. Это коренным образом меняет понимание динамической структуры воды и подходы к оценке кислотности. Результаты исследования опубликованы в журнале Scientific Reports.Природная вода представляет собой многокомпонентную смесь изотопологов —комбинаций различных изотопов кислорода и водорода, двух элементов, из которых состоит вода.Ученые из Сколтеха и Штутгартского университета изучили ионно-молекулярный состав трех изотопологов воды — обычной (h3O), тяжелой (D2O) и полутяжелой (HDO) — и выяснили, что на очень коротких, субпикосекундных временных интервалах чистая жидкая вода содержит большие концентрации короткоживущих ионов h4O+ и OH- — намного выше, чем учитывается при оценке pH. До нескольких процентов молекул h3O были временно ионизированы.Ионные виды жидкой воды играют важную роль в окислительно-восстановительных процессах, каталитических реакциях и электрохимических системах. Ранее предполагалось, что слабобарьерное туннелирование атома водорода между молекулами h3O, вызванное ядерными квантовыми эффектами, может приводить к возникновению кратковременных избыточных протонных состояний, но до настоящего времени не было ни экспериментального подтверждения таких состояний, ни информации о концентрации избыточных протонов в чистой воде.
Это коренным образом меняет понимание динамической структуры воды и подходы к оценке кислотности. Результаты исследования опубликованы в журнале Scientific Reports.Природная вода представляет собой многокомпонентную смесь изотопологов —комбинаций различных изотопов кислорода и водорода, двух элементов, из которых состоит вода.Ученые из Сколтеха и Штутгартского университета изучили ионно-молекулярный состав трех изотопологов воды — обычной (h3O), тяжелой (D2O) и полутяжелой (HDO) — и выяснили, что на очень коротких, субпикосекундных временных интервалах чистая жидкая вода содержит большие концентрации короткоживущих ионов h4O+ и OH- — намного выше, чем учитывается при оценке pH. До нескольких процентов молекул h3O были временно ионизированы.Ионные виды жидкой воды играют важную роль в окислительно-восстановительных процессах, каталитических реакциях и электрохимических системах. Ранее предполагалось, что слабобарьерное туннелирование атома водорода между молекулами h3O, вызванное ядерными квантовыми эффектами, может приводить к возникновению кратковременных избыточных протонных состояний, но до настоящего времени не было ни экспериментального подтверждения таких состояний, ни информации о концентрации избыточных протонов в чистой воде. “Мы использовали различные изотопологи воды, чтобы идентифицировать избыточные протонные состояния, — приводятся в пресс-релизе слова одного из авторов исследования Хенни Уердана (Henni Ouerdane), профессора Центра энергетических наук и технологий Сколтеха (CEST). — Постепенно заменяя атомы водорода (H) дейтерием (D), мы изменили относительную концентрации частиц, связанных с избытком протонов, таких как HD2O+, Dh3O+, h4O+ и D3O+, и определили их вклад в кумулятивное инфракрасное поглощение”.На инфракрасных спектрах авторы увидели максимумы, которые существующие модели не могли объяснить.”Мы обнаружили концентрационно-зависимые спектральные особенности вблизи молекулярных изгибных мод полутяжелых водных спектров. Мы считаем, что эти особенности связаны с избытком протонов, которые существуют в пикосекундном масштабе времени”, — говорит Уердан.”В то время как предыдущие исследования структуры воды были основаны на кристаллографических экспериментах и не отражали динамику воды, наше исследование дает новое представление о сложной структуре воды в ультракоротком масштабе времени”, — отмечает ведущий автор статьи, старший научный сотрудник CEST Василий Артемов.
“Мы использовали различные изотопологи воды, чтобы идентифицировать избыточные протонные состояния, — приводятся в пресс-релизе слова одного из авторов исследования Хенни Уердана (Henni Ouerdane), профессора Центра энергетических наук и технологий Сколтеха (CEST). — Постепенно заменяя атомы водорода (H) дейтерием (D), мы изменили относительную концентрации частиц, связанных с избытком протонов, таких как HD2O+, Dh3O+, h4O+ и D3O+, и определили их вклад в кумулятивное инфракрасное поглощение”.На инфракрасных спектрах авторы увидели максимумы, которые существующие модели не могли объяснить.”Мы обнаружили концентрационно-зависимые спектральные особенности вблизи молекулярных изгибных мод полутяжелых водных спектров. Мы считаем, что эти особенности связаны с избытком протонов, которые существуют в пикосекундном масштабе времени”, — говорит Уердан.”В то время как предыдущие исследования структуры воды были основаны на кристаллографических экспериментах и не отражали динамику воды, наше исследование дает новое представление о сложной структуре воды в ультракоротком масштабе времени”, — отмечает ведущий автор статьи, старший научный сотрудник CEST Василий Артемов.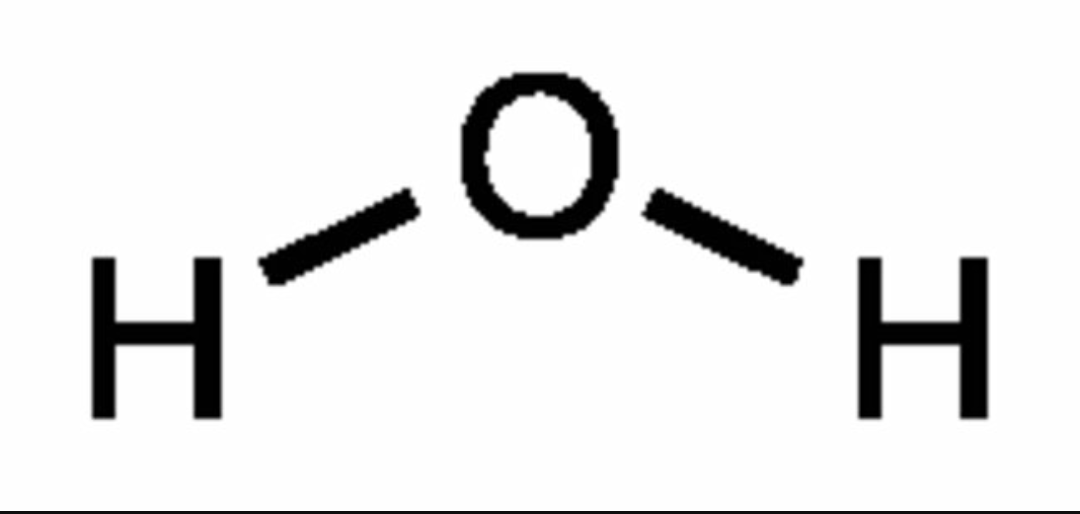 Ученые считают, что учет ионных частиц в ультракоротком временном масштабе улучшит и значительно упростит модели физико-химических и электрохимических систем, в которых жидкая вода играет важную роль, а также поможет в будущих исследованиях аномальных свойств воды, например, при ее взаимодействии с электрическим полем.
Ученые считают, что учет ионных частиц в ультракоротком временном масштабе улучшит и значительно упростит модели физико-химических и электрохимических систем, в которых жидкая вода играет важную роль, а также поможет в будущих исследованиях аномальных свойств воды, например, при ее взаимодействии с электрическим полем.
https://ria.ru/20191017/1559912207.html
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2020
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn23. img.ria.ru/images/149988/43/1499884311_302:0:5138:3627_1920x0_80_0_0_eb2fdf9a55c853b629cfddd01a67bae3.jpg
img.ria.ru/images/149988/43/1499884311_302:0:5138:3627_1920x0_80_0_0_eb2fdf9a55c853b629cfddd01a67bae3.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
физика, химия, сколковский институт науки и технологий, открытия – риа наука
МОСКВА, 9 июл — РИА Новости. Российские ученые в сотрудничестве с немецкими коллегами выяснили, что вода содержит большое количество короткоживущих ионов. Это коренным образом меняет понимание динамической структуры воды и подходы к оценке кислотности. Результаты исследования опубликованы в журнале Scientific Reports.Природная вода представляет собой многокомпонентную смесь изотопологов —комбинаций различных изотопов кислорода и водорода, двух элементов, из которых состоит вода.
Ионные виды жидкой воды играют важную роль в окислительно-восстановительных процессах, каталитических реакциях и электрохимических системах. Ранее предполагалось, что слабобарьерное туннелирование атома водорода между молекулами h3O, вызванное ядерными квантовыми эффектами, может приводить к возникновению кратковременных избыточных протонных состояний, но до настоящего времени не было ни экспериментального подтверждения таких состояний, ни информации о концентрации избыточных протонов в чистой воде.
“Мы использовали различные изотопологи воды, чтобы идентифицировать избыточные протонные состояния, — приводятся в пресс-релизе слова одного из авторов исследования Хенни Уердана (Henni Ouerdane), профессора Центра энергетических наук и технологий Сколтеха (CEST). — Постепенно заменяя атомы водорода (H) дейтерием (D), мы изменили относительную концентрации частиц, связанных с избытком протонов, таких как HD2O+, DH2O+, H3O+ и D3O+, и определили их вклад в кумулятивное инфракрасное поглощение”.
— Постепенно заменяя атомы водорода (H) дейтерием (D), мы изменили относительную концентрации частиц, связанных с избытком протонов, таких как HD2O+, DH2O+, H3O+ и D3O+, и определили их вклад в кумулятивное инфракрасное поглощение”.
На инфракрасных спектрах авторы увидели максимумы, которые существующие модели не могли объяснить.
“Мы обнаружили концентрационно-зависимые спектральные особенности вблизи молекулярных изгибных мод полутяжелых водных спектров. Мы считаем, что эти особенности связаны с избытком протонов, которые существуют в пикосекундном масштабе времени”, — говорит Уердан.
“В то время как предыдущие исследования структуры воды были основаны на кристаллографических экспериментах и не отражали динамику воды, наше исследование дает новое представление о сложной структуре воды в ультракоротком масштабе времени”, — отмечает ведущий автор статьи, старший научный сотрудник CEST Василий Артемов.
Ученые считают, что учет ионных частиц в ультракоротком временном масштабе улучшит и значительно упростит модели физико-химических и электрохимических систем, в которых жидкая вода играет важную роль, а также поможет в будущих исследованиях аномальных свойств воды, например, при ее взаимодействии с электрическим полем.
17 октября 2019, 19:33НаукаУченые усовершенствовали способ получения чистого топлива из водыВОДА, h3O – это… Что такое ВОДА, h3O?
Вода – получить на Академике актуальный промокод на скидку Перекресток или выгодно вода купить с дисконтом на распродаже в Перекресток
h3O: Просто добавь воды — h3O: Just Add Water … Википедия
Вода — ВОДА, h3O, жидкость без запаха, вкуса и цвета; плотность 1,000 г/см3 (3,98°C), tпл 0°C, tкип 100°C; при замерзании образует лед. Одно из наиболее распространенных соединений в природе (количество воды на поверхности Земли 1,39´1018 т, в атмосфере … Иллюстрированный энциклопедический словарь
вода — вода, h3O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плотность 1000 г/см3 (3,98ºC), tпл 0ºС, tкип 100ºC. Самое распространённое вещество … Сельское хозяйство. Большой энциклопедический словарь
Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плотность 1000 г/см3 (3,98ºC), tпл 0ºС, tкип 100ºC. Самое распространённое вещество … Сельское хозяйство. Большой энциклопедический словарь
h3O: Просто добавь воды. Список серий телесериала — Содержание 1 Эпизоды 2 Обзор сезонов 3 Список серий 3.1 … Википедия
Вода — хим. соединение водорода и кислорода. Весовой состав ее: 11,19% Н и 88,81% О. Молекулярная масса 18,0153. В молекуле В. имеется 10 электронов (5 пар): одна пара внутренних электронов расположена вблизи ядра кислорода, две пары внешних электронов… … Геологическая энциклопедия
ВОДА — вода, окись водорода, h3O, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Молекулярная масса 18,0160, t замерзания 0°C (при 1 ат), t кипения 100ºC (при 1 ат), плотность при… … Ветеринарный энциклопедический словарь
вода (вещество) — — [http://www.
вода адсорбційна — вода адсорбционная adsorbtion water Adsorptionswasser молекули h3O, які притягаються мінералами під впливом поверхневої енергії … Гірничий енциклопедичний словник
ВОДА — h3O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плота. 1000 г/см3 (3,98 °С), tпл 0 °С, tкип 100 °С. Самое распространённое в во в природе … Сельско-хозяйственный энциклопедический словарь
Вода — окись водорода, h30, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе), молекулярная масса 18,0160; бесцветная жидкость без запаха и вкуса (в толстых слоях… … Большая советская энциклопедия
Формула воды в химии
Химическая и структурная формула воды
Химическая формула: Н2O
Структурная формула:
Молярная масса: 18,01528 г/моль.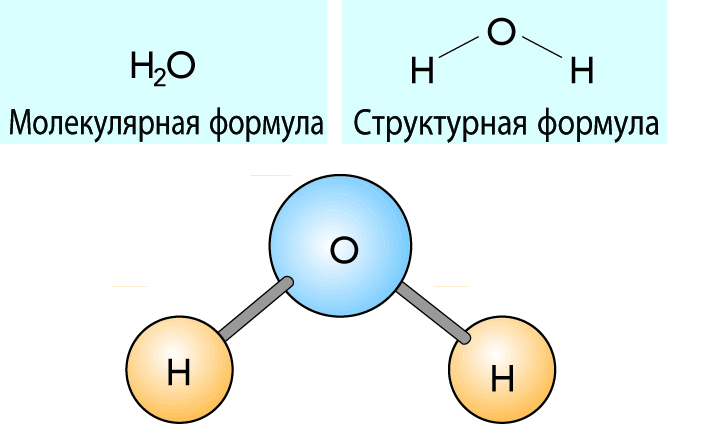
Альтернативные названия: оксид водорода, гидроксид водорода, гидроксильная кислота, монооксид дигидрогена, оксидан, дигидромонооксид.
В молекуле воды атом кислорода находится в состоянии sp3–гибридизации, поскольку в образовании гибридных орбиталей участвуют не только валентные электроны, но и неподеленные электронные пары. Гибридные орбитали направлены к вершинам тетраэдра:
Вследствие большой разницы электроотрицательностей кислорода и водорода связи в молекуле сильно поляризованы, и происходит смещение электрон ной плотности в сторону кислорода. Молекула воды обладает большим дипольным моментом, поскольку полярные связи расположены несимметрично.
С сильной поляризацией связи О – Н связано образование водородных связей между молекулами воды. Каждая молекула воды может образовывать до четырёх водородных связей – две из них образует атом кислорода, а еще две – атомы водорода:
Образование водородных связей определяет более высокую температуру кипения, вязкость и поверхностное натяжение воды по сравнению с гидридами аналогов (серы селена и теллура).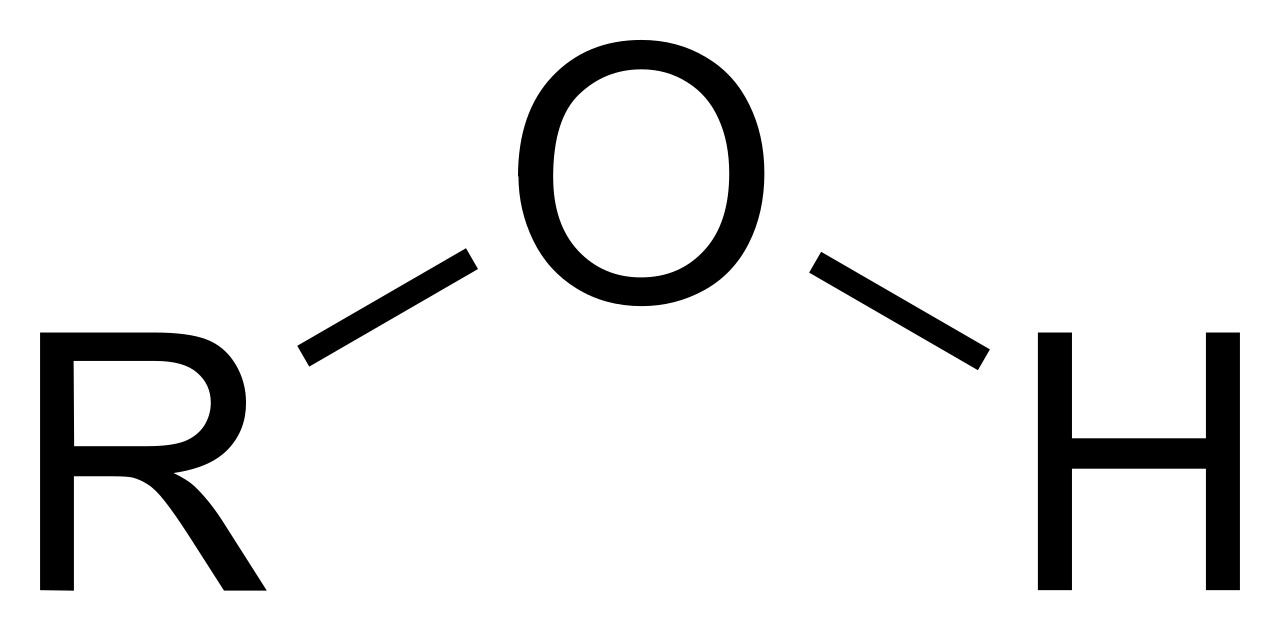
Изотопные модификации воды
В зависимости от типа изотопов водорода, входящих в состав молекулы, выделяют следующие изотопные модификации воды:
| Название | Формула |
|---|---|
|
Легкая вода (основной компонент природной воды) |
H2O |
|
Тяжёлая вода (дейтериевая) |
D2O |
|
Сверхтяжёлая вода (тритиевая) |
T2O |
|
Тритий-дейтериевая вода |
TDO |
|
Тритий-протиевая вода |
THO |
|
Дейтерий-протиевая вода |
DHO |
С учетом того, что у кислорода три стабильных изотопа (16O, 17O и 18O), можно составить 18 формул молекул воды, различающихся изотопным составом. Как правило, природная вода содержит все эти разновидности молекул.
Как правило, природная вода содержит все эти разновидности молекул.
Примеры решения задач по теме «формула воды»
Формула воды, h3O. Стоковая иллюстрация № 4249951, иллюстратор Светлана Самаркина / Фотобанк Лори
Корзина Купить!
Изображение помещёно в вашу корзину покупателя.Вы можете перейти в корзину для оплаты или продолжить выбор покупок.
Перейти в корзину…
удалить из корзины
Размеры в сантиметрах указаны для справки, и соответствуют печати с разрешением 300 dpi. Купленные файлы предоставляются в формате JPEG.
¹ Стандартная лицензия разрешает однократную публикацию изображения в интернете или в печати (тиражом до 250 тыс.
² Расширенная лицензия разрешает прочие виды использования, в том числе в рекламе, упаковке, дизайне сайтов и так далее;
Подробнее об условиях лицензий
³ Лицензия Печать в частных целях разрешает использование изображения в дизайне частных интерьеров и для печати для личного использования тиражом не более пяти экземпляров.
* Пакеты изображений дают значительную экономию при покупке большого числа работ (подробнее)
Размер оригинала: 8910×6299 пикс. (56.1 Мп)
Указанная в таблице цена складывается из стоимости лицензии на использование изображения (75% полной стоимости) и стоимости услуг фотобанка (25% полной стоимости). Это разделение проявляется только в выставляемых счетах и в конечных документах (договорах, актах,
реестрах), в остальном интерфейсе фотобанка всегда присутствуют полные суммы к оплате.
Это разделение проявляется только в выставляемых счетах и в конечных документах (договорах, актах,
реестрах), в остальном интерфейсе фотобанка всегда присутствуют полные суммы к оплате.
Внимание! Использование произведений из фотобанка возможно только после их покупки. Любое иное использование (в том числе в некоммерческих целях и со ссылкой на фотобанк) запрещено и преследуется по закону.
Вода с химической точки зрения – строение, взаимодействие.
Вода – это неорганическое соединение, образованное двумя элементами. Ее химическая формула Н2O, то есть молекула включает два атома водорода и один – кислорода. В обычных условиях вода является жидкостью. Ее твердое состояние называется лед, а газообразное – пар.Свойства воды многообразны, она охватывает большинство сторон жизни на Земле. Без нее в принципе невозможна жизнь. А ее влияние на течение базовых процессов не сравнится ни с чем, ведь вода содержится и в живых организмах, и во всех веществах.

Получение воды
В ходе различных реакций можно получить Н2О. Одна из них – разложение пероксида углерода, в процессе 2Н2О2 делится на 2Н2О и О2. Гидрокарбонат натрия при соединении с уксусной кислотой образует воду, углекислый газ и ацетат натрия.
В ходе реакции нейтрализации (при взаимодействии кислоты и щелочи) также выделяется вода, как и при реакциях восстановления оксидов металлов водородом.
Химические реакции при участии воды
Химические свойства Н2О проявляются в различных реакциях с ее участием. Вещество взаимодействует с металлами, неметаллами, их оксидами. При соединении с металлами выделяется кислород , но участвуют в реакциях активные металлы – щелочные и щелочеземельные I и II групп. Неметаллы реагируют менее активно, для этого требуется нагревание.
Реакции воды с оксидами являются реакциями соединения. Так при соединении с оксидом серы (IV) образуется сернистая кислота, оксидом серы (VI) – серная кислота, диоксидом углерода – угольная кислота.
 При вступлении в реакцию с оксидом кальция образуется гашеная известь. Но не все оксиды металлов взаимодействуют с водой. Например, оксиды цинка, титана, хрома добавляют в стойкие краски, так как они не растворяются в воде. Также не реагируют с Н2О оксиды железа.
При вступлении в реакцию с оксидом кальция образуется гашеная известь. Но не все оксиды металлов взаимодействуют с водой. Например, оксиды цинка, титана, хрома добавляют в стойкие краски, так как они не растворяются в воде. Также не реагируют с Н2О оксиды железа.При воздействии эл. тока происходит окислительно-восстановительная реакция, в ходе которой Н2О выступает окислителем и восстановителем. В результате соединение распадается на кислород и водород.
Н2О образует гидраты и кристаллогидраты. Их особенность в сохранении молекулы. Такие соединения активно применяют в виде осушителей воздуха.
Также вода участвует в реакции био-синтеза, в ходе которой при участии двуокиси углерода выделяется кислород. Даная реакция возможна под действием света.
Доступность чистой воды
Давно уже известна способность воды оказывать влияние на человеческий организм. Обеспечивая обменные процессы, эта жидкость может нести в себе и угрозу, если содержит вредные химические соединения, примеси, бактерии, микроорганизмы.
 Поэтому важно обеспечить доступ к чистой питьевой воде дома и на работе. Это легко сделать, если заказать воду в офис в нашей компании. Стоит это недорого. Привозится вода в 19 литровых бутылях, что очень удобно.
Поэтому важно обеспечить доступ к чистой питьевой воде дома и на работе. Это легко сделать, если заказать воду в офис в нашей компании. Стоит это недорого. Привозится вода в 19 литровых бутылях, что очень удобно.Кроме доставки воды в офис, мы предлагаем аренду, очистку кулера. По доступной стоимости весь коллектив и клиенты будут обеспечены чистой водой, а оборудование позволит в любой момент выпить чай или кофе, не тратя время на ожидание закипания чайника.
Мы всегда заботимся о покупателях, поэтому доставка воды в офис осуществляется в рабочее время. Чтобы сделать заказ, позвоните, напишите нам или оставьте заявку на сайте.
химическая формула – Translation into English – examples Russian
These examples may contain rude words based on your search.
These examples may contain colloquial words based on your search.
Анализ показал, что химическая формула вещества – C6h20O5.
В уведомлении должны быть указаны химическая формула вещества и его известные названия.
The notification should contain the chemical formula of the substance and its known names.Возникшая химическая формула снижает температуру вашего тела
Your formula appears to have lowered your core body temperature.h3O – химическая формула воды, льда и пара.
То, что я написал это химическая формула гидроксида натрия.
В твоём желудке кимбап, удон, угорь, куриная ножка, скумбрия – не самая плохая химическая формула.
У него, конечно, есть своя химическая формула… но вам её знать не обязательно.
Обладая диэлектрическими свойствами, он не приводит к возникновению коротких замыканий и выходу из строя оборудования, а его химическая формула не токсична для людей и живых организмов.
With dielectric properties, it does not cause short circuits and damage to equipment, and its chemical formula is not toxic to humans and living organisms.Химическая формула – Ce2O3, цвет – золотисто-жёлтый.
Это просто химическая формула.
Какова химическая формула для пропана?
Химическая формула воды – Н-О-Н.
Химическая формула воды – H₂O.
Химическая формула: SiO2.
Да ничего, только химическая формула.
Но там была химическая формула с ноотропной составляющей.
Ты – химическая формула, которую фармацевтический отдел “Мирамаунт-Нагасаки” так блестяще открыл.
Это химическая формула для добычи золота?
Это химическая формула бензола.
Это химическая формула удобрения.
h3O – OVO
h3O – химическая формула воды. Это означает, что каждая молекула воды состоит из двух атомов водорода, обозначенных буквой H, и одного атома кислорода, обозначенного буквой O. Вода – это химическое вещество без запаха, вкуса и цвета. Как и все химические вещества, он может существовать в трех различных состояниях: твердом, жидком или газообразном. При температуре ниже нуля градусов по Цельсию вода замерзает и называется льдом. При температуре выше нуля градусов происходит явление, называемое плавлением, в результате которого лед превращается в жидкую воду.При гораздо более высоких температурах вода закипает и превращается из жидкости в газ: водяной пар. Точная температура, при которой вода закипает, меняется в зависимости от высоты. На уровне моря температура кипения составляет 100 градусов по Цельсию, но температура, необходимая для доведения воды до кипения, падает с увеличением высоты. На пике Эвереста температура кипения составляла всего 68 градусов по Цельсию.
При температуре выше нуля градусов происходит явление, называемое плавлением, в результате которого лед превращается в жидкую воду.При гораздо более высоких температурах вода закипает и превращается из жидкости в газ: водяной пар. Точная температура, при которой вода закипает, меняется в зависимости от высоты. На уровне моря температура кипения составляет 100 градусов по Цельсию, но температура, необходимая для доведения воды до кипения, падает с увеличением высоты. На пике Эвереста температура кипения составляла всего 68 градусов по Цельсию. Плотность воды изменяется в разных состояниях. Например, такой же объем воды легче твердого вещества, чем жидкости.Вот почему лед плавает по воде. Многие вещества, включая соли, сахара и кислоты, растворяются при погружении в жидкую воду. Это потому, что вода в целом является хорошим растворителем. Вещества, которые не тают в воде, включают масла и жиры. Вода широко распространена во Вселенной. Межзвездные облака богаты водяным паром. Лед присутствует на многих небесных телах, включая Марс и спутники Юпитера и Сатурна. Кометы также в основном состоят из льда. Однако вода в жидком состоянии в изобилии доступна только на Земле.На нашей планете примерно одна тысяча миллиардов тонн воды, что составляет примерно 71% земного шара. Взятые вместе, формы воды на Земле называются гидросферой. 97% гидросферы состоит из жидкой соленой воды морей и океанов. Лед составляет 2%. Только 1% – это пресная вода.
Кометы также в основном состоят из льда. Однако вода в жидком состоянии в изобилии доступна только на Земле.На нашей планете примерно одна тысяча миллиардов тонн воды, что составляет примерно 71% земного шара. Взятые вместе, формы воды на Земле называются гидросферой. 97% гидросферы состоит из жидкой соленой воды морей и океанов. Лед составляет 2%. Только 1% – это пресная вода.
Вода – главный компонент всех известных форм жизни. Около 70% человеческого тела состоит из воды. У других животных, например медуз, содержание воды может превышать 95%. Вода также играет важную роль в человеческих технологиях: каждый год промышленные процессы потребляют огромное количество воды.Перенаселение превратило воду во все более ценный товар. Управление водными ресурсами планеты считается одной из основных задач, стоящих перед человечеством в ближайшие десятилетия.
Тайна, искусство и наука о воде: химический состав воды: структура
Вода – это химическое вещество !?
Действительно! Вода – одно из самых распространенных химических веществ. Его химическая формула, h30, вероятно, самая известная из всех химических формул.
Его химическая формула, h30, вероятно, самая известная из всех химических формул.Что нам говорит химическая формула?
Формула h30 говорит нам, что одна молекула воды состоит из двух атомов водорода и одного атома кислорода, связанных вместе. Связи, которые удерживают водород и кислород вместе, называются ковалентными связями – они очень прочные.
Давайте посмотрим на изображение молекулы воды: на этом рисунке два атома водорода представлены белыми сферами, а кислород – красной сферой.
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия и жизнь», 4-е издание, Джон У. Хилл, Дороти М. Фейгл и Стюарт Дж. Баум, Macmillan Publishing Company, Нью-Йорк, 1993
На этом втором изображении водород показаны белыми сферами, а oygen – красной сферой. «Палочки», удерживающие водород по отношению к кислороду, представляют собой ковалентные связи.
Почему молекула воды выглядит изогнутой?
Молекула воды сохраняет изогнутую форму (угол 107.Фактически 5 градусов) по двум причинам. Во-первых, тетраэдрическое расположение вокруг кислорода и, во-вторых, наличие неподеленных пар электронов на кислороде.
Во-первых, тетраэдрическое расположение вокруг кислорода и, во-вторых, наличие неподеленных пар электронов на кислороде.
Что такое электроны с неподеленной парой? Это электроны, не участвующие в ковалентных связях. Пары электронов остаются в покое. На нашем рисунке они представлены двойными точками. Эти неподеленные пары очень отрицательны – каждая из них содержит по два отрицательных электрона – и хотят держаться друг от друга как можно дальше.Эти силы отталкивания сближают атомы водорода.
Вы сказали «Тетраэдр» – Что это значит?
Тетраэдр означает «четырехгранный». В химии мы интерпретируем это в нашем воображении. Нарисуйте центральный атом в воображаемом пространстве. Затем поместите атомы, прикрепленные к центральному атому, вокруг него так, чтобы расстояние между ними было максимальным. Расположение, которое вы примете, будет иметь форму правильного тетраэдра.Эта молекулярная форма показана ниже. Он имеет регулярные валентные углы 109,5
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия и жизнь», 4-е издание, Джон У. Хилл, Дороти М. Фейгл и Стюарт Дж. Баум, Macmillan Publishing Company, Нью-Йорк, 1993
Хилл, Дороти М. Фейгл и Стюарт Дж. Баум, Macmillan Publishing Company, Нью-Йорк, 1993
Если мы сделаем аналогичное расположение воды, поместив кислород в центр и используя два атома водорода и две неподеленные пары по углам, мы также получим тетраэдрическое расположение. Однако есть одно важное отличие – валентные углы для воды не равны 109.5. Из-за наличия очень отрицательных электронов неподеленной пары два атома водорода сжимаются вместе, поскольку две неподеленные пары пытаются уйти друг от друга как можно дальше. Полученный угол дает воде валентный угол 104,5. Поскольку мы не «видим» электроны, полученный тетраэдр «выглядит» ИЗогнутым!
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия и жизнь», 4-е издание, Джон У. Хилл, Дороти М. Фейгл и Стюарт Дж. Баум, Macmillan Publishing Company, Нью-Йорк, 1993
В чем твоя точка? Как и многое другое в химическом мире, форма и структура молекулы являются важным фактором, определяющим ее функцию.Важность изогнутой структуры воды состоит в том, что она дает воде две различные «стороны»: одна сторона молекулы воды имеет две отрицательные неподеленные пары, а другая сторона представляет два атома водорода.
 Давайте еще раз посмотрим: [рис. карты электронной плотности воды]
Давайте еще раз посмотрим: [рис. карты электронной плотности воды]Это делает воду необычной?
ДА! Но не только изгиб молекулы делает его особенным. Вода также очень полярна – две стороны воды имеют очень разный заряд.Неподеленные пары отрицательны – положительны ли атомы водорода ? Водород – слегка положительный. Это происходит из-за «электроотрицательности» кислорода. Электроотрицательность – это мера того, насколько один атом хочет иметь электронов, а кислород хочет иметь электронов больше, чем водород. Кислород имеет более высокую электроотрицательность. Из-за этой разницы в электроотрицательности электроны в ковалентных связях между кислородом и водородом слегка притягиваются к кислороду.Это оставляет водород немного электронодефицитным и, следовательно, слегка положительным. Мы можем нарисовать эту поляризацию так:
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия в контексте» Wm C. Brown Publishers, Dubuque Iowa, 2-е издание, проект Американского химического общества, изд .
 : А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
: А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»Или посмотрите на это с точки зрения “чистой поляризации”, например:
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия и жизнь», 4-е издание, John W.Хилл, Дороти М. Фейгл и Стюарт Дж. Баум, Macmillan Publishing Company, Нью-Йорк, 1993
Какое отношение поляризация имеет к свойствам воды?
Все! Поскольку вода имеет слегка отрицательный конец и слегка положительный конец, она может взаимодействовать с собой и образовывать высокоорганизованную «межмолекулярную» сеть. Положительный водородный конец одной молекулы может благоприятно взаимодействовать с отрицательной неподеленной парой другой молекулы воды.Это взаимодействие называется «водородной связью». Это тип слабого электростатического притяжения (от положительного к отрицательному). Поскольку каждая из молекул воды может образовывать четыре водородные связи, образуется сложная сеть молекул.ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия в контексте» Wm C. Brown Publishers, Dubuque Iowa, 2-е издание, проект Американского химического общества, изд .
Но если водородные связи слабые, как они могут быть важны? Подумайте, сколько их! В числах сила!
Полярность также позволяет воде взаимодействовать с электрическим полем:
И взаимодействовать с другими полярными молекулами – так вещества растворяются в воде.
ИСТОЧНИК ИЗОБРАЖЕНИЯ: «Химия в контексте» Wm C. Brown Publishers, Dubuque Iowa, 2-е издание, проект Американского химического общества, изд .: А. Трумэн Шварц и др., 1997, глава 5 «Чудо воды»
Химический состав
2
Открытие нетоксичных полупроводников с прямой запрещенной зоной в ближнем инфракрасном диапазоне
Мар.23 февраля 2021 г. – Ученые обнаружили потенциально многообещающий инфракрасный светодиод и инфракрасный детектор. Это соединение, состоящее из кальция, кремния и кислорода, дешево в производстве и нетоксично. Многие из …
Химики используют синергетический эффект галлия
21 января 2021 г. – Химики продемонстрировали ценность «командной работы», успешно используя взаимодействие между двумя атомами галлия в новом соединении, чтобы разделить особенно прочную связь между ними…
– Химики продемонстрировали ценность «командной работы», успешно используя взаимодействие между двумя атомами галлия в новом соединении, чтобы разделить особенно прочную связь между ними…
Новые продукты с азотом в воздухе
12 августа 2020 г. – Исследователи нашли способ объединить атмосферный азот с бензолом, чтобы получить химическое соединение под названием анилин, которое является предшественником материалов, используемых для производства различных синтетических …
Чеснок из лабораторного стенда
23 августа 2018 г. – Экстракты свежего чеснока содержат множество полезных для здоровья сероорганических соединений, среди которых аджоен является одним из основных компонентов, экстрагируемых маслом.Теперь химики синтезировали аджоен из легкодоступных …
Обнаружено соединение, нацеленное на раковые клетки, лишенные защитного «гена-хранителя» P53
15 августа 2018 г. – Разработано новое химическое соединение, способное разрушать трудноизлечимые раковые клетки, и . ..
..
Искусственные ферменты взаимодействуют с живыми клетками
26 июля 2018 г. – Природа разработала тысячи ферментов для облегчения многих химических реакций, протекающих внутри организмов для поддержания жизни.Теперь исследователи разработали искусственные ферменты, которые находятся на …
В поисках светового материала будущего
1 мая 2020 г. – Исследователи узнали о многообещающем материале для органических светодиодов (OLED). Вещество обеспечивает высокий световой выход и будет недорогим в производстве в больших масштабах – …
Синтез дикарбоновых кислот и водорода одновременно из диолов
30 июля 2020 г. – Исследователи разрабатывают более безопасный и эффективный способ производства дикарбоновой кислоты.Используя иридиевый катализатор, связанный с бипиридонатным лигандом, исследователи смогли синтезировать дикарбоновые кислоты из …
Пористые материалы проливают свет на очистку окружающей среды
5 июля 2018 г. – Ученые разработали стабильные монокристаллические пористые органические каркасы с водородными связями, которые термически и химически устойчивы, обладают большой площадью поверхности и флуоресцентными свойствами. …
– Ученые разработали стабильные монокристаллические пористые органические каркасы с водородными связями, которые термически и химически устойчивы, обладают большой площадью поверхности и флуоресцентными свойствами. …
Химия магния перевернула голову
14 мая 2021 г. – Новые открытия произведут революцию во всей химии магния.Исследовательская группа обнаружила магний, который обычно имеет двойной положительный заряд в химических соединениях, в …
Как мы узнаем, что вода действительно h3O?
Как мы узнаем, что вода – это h3O, если мы не можем видеть атомную структуру и как идентифицируются элементы? Первоначально он появился на Quora: , сети обмена знаниями, где на интересные вопросы отвечают люди с уникальным пониманием .
Ответ Мэтта Харбоуи, главного архитектора решений, на Quora:
Большинство атомных свойств было выяснено путем тщательных химических экспериментов и нескольких научных аксиом, восходящих к работам Далтона и Лавуазье. Но эти светила также допускали поразительные ошибки в суждениях. Давайте рассмотрим эти аксиоматические утверждения и то, что мы хотим продемонстрировать:
Но эти светила также допускали поразительные ошибки в суждениях. Давайте рассмотрим эти аксиоматические утверждения и то, что мы хотим продемонстрировать:
Аксиома 1: Одинаковые вещи равны друг другу.
Аксиома 2: Материя не создается и не уничтожается.
Теория: Вся материя состоит из смеси неделимых веществ, называемых атомами.
Хотя аксиома 2 больше не верна в субатомной физике, на атомном и химическом уровне это аксиома. Аксиомы – это утверждения фактов, которые сложнее доказать, чем опровергнуть, поэтому, если вы не согласны с тем, что вышеприведенные аксиомы верны, нет смысла говорить об этом дальше, поскольку вы не принимаете основополагающую логику химии.
Было показано, что вода образуется, когда все, что содержит два моль сожженных атомов водорода, при полном сгорании в богатой кислородом среде образует 18 граммов воды.См .: Крот (единица).
Первая таблица относительной атомной массы (атомного веса) была опубликована Джоном Далтоном (1766–1844) в 1805 году на основе системы, в которой относительная атомная масса водорода была определена как 1.
Эти относительные атомные массы были основаны на стехиометрические пропорции химических реакций и соединений, факт, который в значительной степени способствовал их принятию: химику не нужно было подписываться под атомной теорией (недоказанная гипотеза в то время), чтобы использовать таблицы на практике.Это привело бы к некоторой путанице между атомными массами (продвигаемой сторонниками атомной теории) и эквивалентными весами (продвигаемыми ее противниками и которые иногда отличались от относительных атомных масс на целочисленный коэффициент), которая сохранялась на протяжении большей части девятнадцатого века.
Вот проблема: твердые вещества относительно легко взвешиваются, но при правильных условиях вода, кислород, углекислый газ и водород являются газами, и их не так легко взвесить. Более того, все они имеют разную плотность при разных температурах, поэтому объем – плохой показатель для атомов – он не зависит от количества молекул и не является коллигативным свойством. Что еще хуже, любой эксперимент будет подвержен экспериментальной ошибке, поэтому любые отношения, которые немного отклоняются – скажем, отношение 15 атомов водорода к 8 атомам кислорода, измеренное экспериментом из-за диффузии водорода через контейнер, который вы пытаетесь удерживать его – образует очень сложную структуру для воды, что до смешного неверно.
Что еще хуже, любой эксперимент будет подвержен экспериментальной ошибке, поэтому любые отношения, которые немного отклоняются – скажем, отношение 15 атомов водорода к 8 атомам кислорода, измеренное экспериментом из-за диффузии водорода через контейнер, который вы пытаетесь удерживать его – образует очень сложную структуру для воды, что до смешного неверно.
Вы могли заметить, что, хотя моль чаще всего ассоциируется с водородом, все вычисления атомного веса в настоящее время производятся относительно углерода.Для этого есть очень веская причина; углерод не димеризуется или полимеризуется легко или «необратимо», поэтому углерод – это и атом, и молекула, и ради того, чтобы «с чего-то начать», углерод имеет массу 12 граммов на моль. Он сгорает, часто полностью, в атмосфере, содержащей кислород, что также является удобной отправной точкой, поскольку кислород легко образует соединения с большинством атомных элементов. Фактически:
Йенс Якоб Берцелиус (1779–1848) сыграл важную роль в определении относительных атомных масс с постоянно возрастающей точностью.
Он также был первым химиком, который использовал кислород в качестве стандарта, к которому относились другие массы. Кислород является полезным стандартом, поскольку, в отличие от водорода, он образует соединения с большинством других элементов, особенно с металлами. Однако он решил зафиксировать атомную массу кислорода равной 100, но это нововведение не прижилось.
Помните, прежде чем у вас появилась теория атомов, существенным открытием было то, что существует большое количество неделимых соотношений между обеими сторонами реакций, которые должны завершиться.Полностью сожгите углерод в кислороде, и образуется углекислый газ. Взвесьте мелкодисперсное чистое железо, дайте ему полностью заржаветь, и вес ржавчины увеличится на ровную долю кислорода. Вес ржавчины увеличивается за счет рациональной доли кислорода, так что 102 г железа всегда увеличивается до 160 г ржавчины. Кроме того, используя углерод (древесный уголь), вы можете обратить реакцию вспять и снова образовать металлическое железо.
Природные минералы железа представляют собой смеси железа и нежелательных примесей или пустой породы.Эти примеси обычно удаляются путем «шлакования» в процессе плавки.
Шлак был удален ликвацией, то есть твердая пустая порода была преобразована в жидкий шлак. Следовательно, процесс плавки должен осуществляться при температуре или выше температуры, при которой шлак является достаточно текучим, чтобы его можно было удалить из руды.
Плавка может проводиться в печах различных типов, и условия внутри печи могут отличаться, что влияет на морфологию, химический состав и микроструктуру шлака.Возьмем, к примеру, шаровую печь и доменную печь – два распространенных метода плавки чугуна. В процессе цветения было получено твердое состояние железа. Это связано с тем, что процесс вспенивания проводился при температуре выше, чем температура, при которой чистый оксид железа может быть восстановлен до металлического железа, но ниже температуры плавления металлического железа; следовательно, был получен твердый металлический железо.
Доменные печи использовались для производства жидкого чугуна.
Ни одна экспериментальная реакция не «доказывает» атомы, как и все эксперименты.Но после измерения, преобразования, окисления, восстановления и преобразования целого ряда металлов друг в друга с использованием всевозможных очищенных веществ, вы начинаете выравнивать различные соотношения. Даже несмотря на то, что любой один эксперимент дал бы слегка ошибочные результаты, объединение нескольких экспериментов и выполнение множества разных, которые были подвержены различным видам ошибок, помогли устранить слабые места любого данного отношения.
Таким образом, химия в огромном долгу перед алхимией. Несмотря на странные и часто иррациональные причины превращения неблагородных металлов, таких как железо или свинец, в золото, алхимики состряпали сокровищницу возможных химических реакций: сложите эти два вместе и сделайте это, и вуаля! Отчасти как продукт разнообразного собрания алхимии, химия сегодня часто преподается в стиле поваренной книги с бестиарием имен изобретателей. Но в конце концов, эти отношения стало легче выразить в виде матрицы атомных (то есть по одному) неделимых и неразрушимых элементарных объектов, и началась современная химическая практика.
Но в конце концов, эти отношения стало легче выразить в виде матрицы атомных (то есть по одному) неделимых и неразрушимых элементарных объектов, и началась современная химическая практика.
Для получения дополнительной информации посмотрите мою статью здесь: Все ли атомы являются элементами?
Этот вопрос изначально появился на Quora. Задайте вопрос, получите отличный ответ. Учитесь у экспертов и получайте доступ к инсайдерским знаниям. Вы можете подписаться на Quora в Twitter, Facebook и Google+. Дополнительные вопросы:
Ученые открыли новый способ получения воды
На знакомой школьной демонстрации химии инструктор сначала использует электричество для разделения жидкой воды на составляющие газы, водород и кислород.Затем, комбинируя два газа и зажигая их искрой, инструктор с громким хлопком превращает газы обратно в воду.
Ученые из Университета Иллинойса открыли новый способ получения воды, причем без хлопка. Они не только могут производить воду из маловероятных исходных материалов, таких как спирты, их работа также может привести к созданию лучших катализаторов и менее дорогих топливных элементов.
Они не только могут производить воду из маловероятных исходных материалов, таких как спирты, их работа также может привести к созданию лучших катализаторов и менее дорогих топливных элементов.
«Мы обнаружили, что нетрадиционные гидриды металлов можно использовать для химического процесса, называемого восстановлением кислорода, который является неотъемлемой частью процесса производства воды», – сказал Захария Хайден, докторант и ведущий автор статьи, принятой для публикации в Журнал Американского химического общества .
Молекула воды (официально известная как монооксид дигидрогена) состоит из двух атомов водорода и одного атома кислорода. Но нельзя просто взять два атома водорода и наклеить их на атом кислорода.Фактическая реакция образования воды немного сложнее: 2h3 + O2 = 2h3O + Energy.
На английском языке уравнение гласит: Чтобы получить две молекулы воды (h3O), две молекулы двухатомного водорода (h3) должны быть объединены с одной молекулой двухатомного кислорода (O2).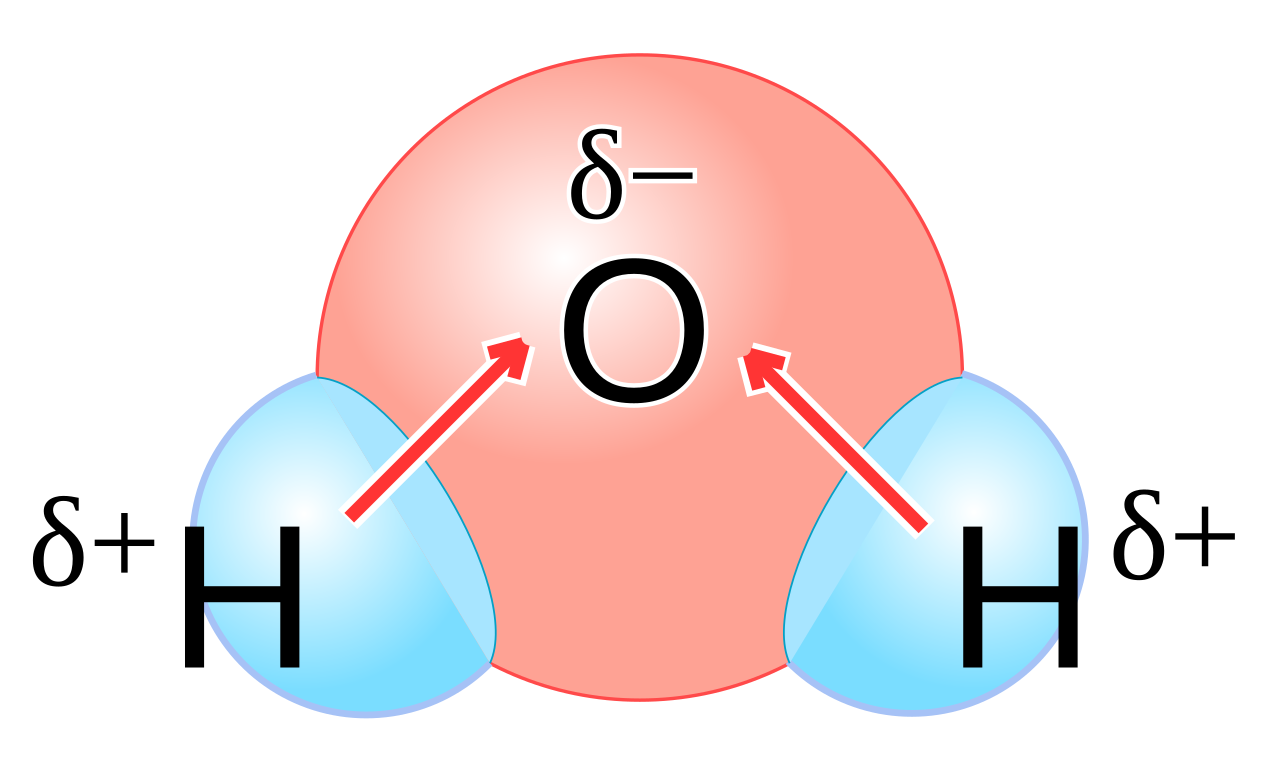 Энергия будет высвобождена в процессе.
Энергия будет высвобождена в процессе.
«Эта реакция (2h3 + O2 = 2h3O + Energy) известна уже два столетия, но до сих пор никто не заставлял ее работать в гомогенном растворе», – сказал Томас Раухфус, член правления I.профессор химии и автор статьи.
Хорошо известная реакция также описывает то, что происходит внутри водородного топливного элемента.
В типичном топливном элементе двухатомный газообразный водород входит с одной стороны элемента, а двухатомный кислород – с другой стороны. Молекулы водорода теряют свои электроны и становятся положительно заряженными в результате процесса, называемого окислением, в то время как молекулы кислорода получают четыре электрона и становятся отрицательно заряженными в результате процесса, называемого восстановлением.Отрицательно заряженные ионы кислорода объединяются с положительно заряженными ионами водорода, образуя воду и выделяя электрическую энергию.
«Трудная сторона» топливного элемента – это реакция восстановления кислорода, а не реакция окисления водорода, – сказал Раухфусс. «Однако мы обнаружили, что новые катализаторы восстановления кислорода могут также привести к новым химическим средствам окисления водорода».
«Однако мы обнаружили, что новые катализаторы восстановления кислорода могут также привести к новым химическим средствам окисления водорода».
Раухфус и Хайден недавно исследовали относительно новое поколение катализаторов гидрирования с переносом для использования в качестве нетрадиционных гидридов металлов для восстановления кислорода.
В своей статье JACS исследователи сосредотачиваются исключительно на окислительной способности катализаторов гидрогенизации переноса на основе иридия в гомогенном неводном растворе. Они обнаружили, что комплекс иридия действует как на окисление спиртов, так и на восстановление кислорода.
«Большинство соединений реагируют либо с водородом, либо с кислородом, но этот катализатор реагирует с обоими», – сказал Хайден. «Он реагирует с водородом с образованием гидрида, а затем реагирует с кислородом с образованием воды; и делает это в гомогенном неводном растворителе.”
Новые катализаторы могут привести в конечном итоге к разработке более эффективных водородных топливных элементов, что существенно снизит их стоимость, сказал Хайден.
Источник: Иллинойсский университет в Урбана-Шампейн.
Исследователи открыли новый способ производства водорода с помощью микроволн.
Ссылка : Ученые открыли новый способ получения воды (31 октября 2007 г.) получено 5 июня 2021 г. с https: // физ.org / news / 2007-10-science.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, никакие часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
Знания о воде – BWT
Кто открыл воду?
Химик Генри Кавендиш (1731 – 1810) открыл состав воды, когда он экспериментировал с водородом и кислородом и смешал эти элементы вместе, чтобы создать взрыв (кислородно-водородный эффект).В 1811 году итальянский врач Амедео Авогадро наконец нашел формулу h3O для воды.
Хотя вода имеет простую молекулярную структуру, тем не менее, она обладает уникальными физическими свойствами. Это единственный элемент, который существует на нашей планете в твердом, жидком и газообразном агрегатном состоянии. Именно эти особые свойства делают воду такой завораживающей и важной для всех существ. Вода в 775 раз превышает плотность воздуха. Этот факт вызывает эффект «плавучести», который позволяет нам – и большинству млекопитающих – плавать.
Многие вещества расширяются при нагревании и в то же время уменьшают свою плотность; наоборот, они увеличивают свою плотность при охлаждении. Когда жидкость охлаждается, более холодная часть опускается на дно. В процессе замерзания воды все наоборот. Вода достигает максимальной плотности при 4 градусах Цельсия, что составляет ровно 0,999973 кг / л. Лед весит 0,91 кг / л – поэтому айсберги плавают. Это также объясняет, почему бутылки с замороженной водой взрываются и почему рыба может выжить в замерзшем озере.Они живут на дне, где вода наиболее тяжелая, так как температура там примерно 4 градуса по Цельсию.
Вода – очень плохой проводник тепла. Это свойство имеет огромное значение для глобального климата. Вода может накапливать много тепла, которое затем снова выделяется в холодное время года. Однако в теплое время года он предотвращает чрезмерное нагревание. Таким образом, вода смягчает разницу температур.
При испарении одного кубического сантиметра воды (при прибл.100 градусов Цельсия), его объем расширяется до 1243 кубических сантиметров (давление пара) – процесс, который лег в основу конструкции паровой машины; эта машина в конечном итоге привела к промышленной революции.
Физические и химические свойства воды делают ее универсальным растворителем и транспортным средством, которое интегрировано во все природные циклы, как микро-, так и макроскопические. Например, без воды не было бы циркуляции азота или фосфора – обоих основных элементов в биосфере – поскольку нет возможности для переноса соответствующих ионов.
Вода может растворять соли и кормить ими растения в растворенном виде. Затем растения используют эти ионы в качестве питательных веществ и выделяют в атмосферу воду, в которой они не нуждаются для метаболизма азота. Этот малый круговорот воды так же важен, как и большой – без него и, следовательно, без воды не было бы жизни.
Молекула воды
Вода представляет собой химическое соединение и полярную молекулу, которая является жидкостью. при стандартной температуре и давлении.Он имеет химическое формула H 2 O, означающая, что одна молекула воды состоит из двух атомов водорода и одного атома кислорода. Воды встречается почти повсюду на земле и требуется всем известная жизнь. Около 70% поверхности Земли покрыто вода. Вода, как известно, существует в форме льда на нескольких других тела в солнечной системе и за ее пределами, и доказательство того, что оно существует (или существовали) в жидкой форме где-либо, кроме Земли, быть убедительным доказательством внеземной жизни.
Общие
Вода в твердом состоянии называется льдом; газообразное состояние известно как водяной пар (или пар). В единицы температуры (ранее градус Цельсия, а теперь Кельвина) определяются в терминах тройной точки вода, 273,16 К (0,01 ° С) и 611,2 Па, температура и давление, при котором сосуществуют твердая, жидкая и газообразная вода. в равновесии.Вода проявляет очень странное поведение, включая образование таких состояний, как стекловидный лед, некристаллическое (стеклообразное) твердое состояние воды.
При температурах выше 647 К и давлениях выше 22,064 МПа, совокупность молекул воды предполагает сверхкритическое состояние , при котором жидко-подобные кластеры плавают в пределах парообразная фаза.
Путь жидкости для воды является мерой количества жидкости. вода в столбе воздуха.
Диполярная природа молекулы воды
Важной особенностью молекулы воды является ее полярная природа. В молекула воды образует угол с атомами водорода на кончики и кислород в макушке. Поскольку кислород имеет более высокое электроотрицательность, чем у водорода, сторона молекулы с атомом кислорода имеет частичный отрицательный заряд. Молекула с такой разностью зарядов называется диполем.Заряд различия заставляют молекулы воды притягиваться к каждому другие (относительно положительные области, привлекающие относительно отрицательные области) и другим полярным молекулам. Это притяжение известно как водород. склеивание.
водородная связь между двумя молекулами воды
Это относительно слабое (по сравнению с ковалентными связями внутри молекула воды) притяжение приводит к физическому такие свойства, как относительно высокая температура кипения, потому что необходимо много тепловой энергии, чтобы расщепить водород связи между молекулами.Например, сера – это элемент ниже кислорода в периодической таблице и его эквивалентное соединение, сероводород (H 2 S) не содержит водорода связей, и хотя его молекулярная масса в два раза больше, чем у воды, это газ при комнатной температуре. Дополнительная связь между молекулы воды также придают жидкой воде большую удельную теплоемкость.
Водородная связь также придает молекулам воды необычное поведение при замерзании.Как и большинство других материалов, жидкость с понижением температуры уплотняется. Однако в отличие от большинство других материалов при охлаждении почти до точки замерзания наличие водородных связей означает, что молекулы, поскольку они перестраиваются, чтобы минимизировать свою энергию, образуют структуру это на самом деле имеет более низкую плотность: следовательно, твердая форма, лед, будет плавать в воде. Другими словами, вода расширяется как он замерзает (большинство других материалов сжимаются при затвердевании).Жидкая вода достигает максимальной плотности при температуре 4 ° С. Это имеет интересное последствие для жизни в воде. зимой. Вода, охлажденная на поверхности, становится более плотной и раковины, образуя конвекционные потоки, которые охлаждают всю воду тела, но когда температура воды в озере достигает 4 ° C, вода на поверхности по мере дальнейшего охлаждения становится на менее плотной и остается поверхностным слоем, который в конечном итоге образует лед.Поскольку нисходящая конвекция холоднее вода блокируется изменением плотности, любое большое тело вода, замерзшая зимой, будет иметь большую часть воды жидкость при 4 ° C под ледяной поверхностью, позволяя рыбе выживать. Это один из основных примеров тонко настроенного физические свойства, поддерживающие жизнь на Земле, которая используется как аргумент в пользу антропного принципа.
Другой Следствием этого является то, что лед тает, если приложить достаточное давление.
Структура воды и льдаВыше показано сравнение бок о бок шириной 10 ангстрем. Это ясно показывает, что лед занимает больше места из-за водородной связи, которая возникает при изменении состояния с жидкого на твердое. Во льду Ih каждая вода образует четыре водородные связи с расстоянием O — O 2,76 ангстрем до ближайшего кислородного соседа. Из-за упорядоченной структуры льда в данном пространстве объема меньше h30 молекул.
Вода в качестве растворителя
Вода также является хорошим растворителем благодаря своей полярности. Растворитель свойства воды жизненно важны в биологии, потому что многие биохимические реакции происходят только в водных растворах (например, реакции в цитоплазме и крови). Кроме того, вода используется для транспортировки биологических молекул.
Когда ионное или полярное соединение попадает в воду, оно окружается молекулами воды.Относительно небольшой размер молекул воды обычно позволяет много молекул воды, чтобы окружить одну молекулу растворенного вещества . Частично отрицательные диполи воды притягиваются к положительно заряженным компонентам растворенное вещество, и наоборот для положительных диполей.
Как правило, ионные и полярные вещества, такие как кислоты, спирты, и соли легко растворимы в воде, а неполярные вещества например жиры и масла нет.Неполярные молекулы остаются вместе в воде, потому что она энергетически более благоприятна для молекулы воды к водородной связи друг с другом, чем участвовать во взаимодействиях Ван-дер-Ваальса с неполярными молекулами.
Примером ионного растворенного вещества является поваренная соль; натрий хлорид NaCl разделяется на катионы Na + и Cl – анионы , каждый из которых окружен молекулами воды.Затем ионы легко уносятся от своих кристаллических решетка в раствор. Пример неионного растворенного вещества: столовый сахар. Водородная связь диполей воды с диполями области молекулы сахара и позволяют переносить прочь в раствор.
Сплоченность и поверхностное натяжение
Прочные водородные связи придают воде высокую когезионную способность и, следовательно, поверхностное натяжение.Это очевидно, когда небольшое количество воды попадает на нерастворимую поверхность и вода остается вместе как капли. Эта особенность важна когда вода проходит через ксилему вверх по стеблям растений; сильные межмолекулярные притяжения удерживают толщу воды вместе, и предотвратить напряжение, вызванное транспирацией. Другие жидкости с более низким поверхностным натяжением будут иметь более высокое склонность к “разрыву”, образованию вакуумных или воздушных карманов и рендерингу сосуд ксилемы не работает.
Электропроводность
Чистая вода – хороший изолятор (плохой проводник), это означает, что он плохо проводит электричество. Так как вода является таким хорошим растворителем, однако часто в ней есть растворенное в нем растворенное вещество, чаще всего соль. Если в воде есть такие примеси, то он может намного лучше проводить электричество, поскольку примеси, такие как соль, содержат свободные ионы в водной раствор, по которому может течь электрический ток.
Электролиз
Воду можно разделить на составные элементы, водород. и кислород, пропуская через него ток. Этот процесс называется электролизный . Молекулы воды естественно диссоциировать на ионы H + и OH – , которые притягиваются к катоду и аноду соответственно. На катоде два иона H + захватывают электроны. и образуют газ H 2 .На аноде четыре иона OH – объединяются и выделяют газ O 2 , молекулярную воду, и четыре электрона. Газы подняли пузырьки на поверхность, где их можно собрать.
Реакционная способность
По химическому составу вода амфотерна: может действовать как кислота. или база. Иногда используется термин гидроксиковая кислота . используется, когда вода действует как кислота в химической реакции.При pH 7 (нейтральный) концентрация гидроксид-ионов (OH –) совпадает с таковой гидроксония (H 3 O + ) или ионы водорода (H + ) ионы. Если равновесие нарушается, раствор становится кислым (более высокая концентрация ионов гидроксония) или основного (более высокая концентрация гидроксида ионы).
Вода может действовать как кислота. или основание в реакциях.Согласно системе Бренстеда-Лоури, кислота определяется как разновидность, которая отдает протон (ион H +) в реакции, и основание как единое целое который получает протон. При реакции с более сильной кислотой вода действует как основание; при взаимодействии с более слабой кислотой действует как кислота. Например, он получает ион H + из HCl в равновесии:
HCl + H 2 O —> H 3 O + + Cl –
Здесь вода действует как основание, получая ион H +.Кислота отдает ион H +, и вода тоже может это делать, например, в реакции с аммиаком, Nh4:
NH 3 + H 2 O —> NH 4 + + OH –
pH на практике
В Теоретически чистая вода имеет pH 7. На практике чистую воду очень трудно производить. Вода, оставленная на воздухе в течение любого периода времени, быстро растворяется. углекислый газ, образующий раствор угольной кислоты с предельным значением pH ~ 5.7 (ссылка: Kendall, J. (1916), Journal of the American Chemical Society 38 (11): 2460-2466).
Очищение вода
Очищенная вода необходима для многих промышленных применений, а также по расходу. Людям нужна вода, которая не содержать слишком много соли или других примесей. Общие примеси включают химические вещества или вредные бактерии.Некоторые растворенные вещества приемлемо и даже желательно для улучшения ощущаемого вкуса. Вода, пригодная для питья, называется питьевой. вода .
Шесть популярных методов вода очищающая:
- Фильтрация : вода проходит через сито, улавливающее мелкие частицы. Чем плотнее размер ячейки сита, тем меньше должны быть частицы, чтобы пройти через.Фильтрации недостаточно, чтобы полностью очищать воду, но часто это необходимый первый шаг, поскольку такие частицы могут мешать более тщательному методы очистки.
- Кипячение : Вода нагревается до кипения. точка достаточно длинная, чтобы инактивировать или убить микроорганизмы которые обычно живут в воде комнатной температуры. В областях где вода «жесткая» (содержит растворенный кальций соли), при кипячении разлагается бикарбонат-ион, в результате чего в некоторой части (но не во всем) осаждаемого растворенного кальция в виде карбоната кальция.Это так называемый «мех», который накапливается на элементах чайника и т. д. в жесткой воде области. За исключением кальция кипячение не дает удалить растворенные вещества с более высокой температурой кипения, чем вода, и фактически увеличивает их концентрацию (из-за воды теряется как пар)
- Угольный фильтрующий : Уголь, форма углерода с большой площадью поверхности из-за его режима препарат, адсорбирует многие соединения, в том числе некоторые токсичные соединения.Вода пропускается через активированный уголь удалить такие загрязнения. Этот метод чаще всего используется в бытовых фильтрах для воды и аквариумах. Семья фильтры для питьевой воды иногда также содержат серебро, следовые количества ионов серебра, обладающих бактерицидным действием.
- Дистилляция : Дистилляция включает кипячение вода для производства водяного пара. Тогда водяной пар поднимается на охлаждаемую поверхность, где может снова конденсироваться в жидкость и собираться.Потому что растворенные вещества не обычно испаряются, они остаются в кипящем растворе. Даже дистилляция не очищает воду полностью, потому что загрязняющих веществ с аналогичными точками кипения и капель неиспарившейся жидкости, переносимой паром. Тем не мение, Чистая вода 99,9% может быть получена путем дистилляции.
- Обратный осмос : Механическое давление применяется к нечистому раствору, чтобы протолкнуть чистую воду полупроницаемая мембрана.Срок обратного осмоса , потому что нормальный осмос приведет к перемещению чистой воды в другом направлении, чтобы разбавить примеси. Обеспечить регресс осмос теоретически является наиболее тщательным методом крупномасштабного возможна очистка воды, но идеально полупроницаемая мембраны сложно создать. на бирже хроматография : В этом случае вода пропускается через заряженную колонку смолы, имеющую боковые цепи, которые улавливают ионы кальция, магния и других тяжелых металлов.В во многих лабораториях этот метод очистки заменил дистилляции, так как она обеспечивает большой объем очень чистого поливать быстрее и с меньшим потреблением энергии, чем другие процессы. Очищенная таким образом вода называется деионизированной . вода .
Пустая трата воды
Расточительная вода – это злоупотребление водой, т.е. используя его без надобности.Пример – использование воды, особенно вода, очищенная до безопасных для человека стандартов питья, в ненужном орошении. Также в домах вода может быть потрачено впустую, если унитаз смывается без надобности или бак утечки. Загрязнение воды может быть самым большим разовое злоупотребление водой. В той мере, в какой загрязняющее вещество ограничивает другие способы использования воды, она становится пустой тратой ресурса, независимо от выгод для загрязнителя.
Мифология
Вода – один из четырех классических элементов наряду с огонь, земля и воздух, и считался илем, или основным материал вселенной. Вода считалась холодной и влажной. В теории четырех телесных жидкостей вода ассоциировалась с мокротой. Вода также была одним из пяти элементов в Китайский даосизм наряду с землей, огнем, деревом и металлом.
Вода права и развитие
Доклад ЮНЕСКО о мировом развитии водных ресурсов (WWDR, 2003 г.) из его Программа оценки водных ресурсов мира указывает, что в следующие 20 лет мир столкнется с беспрецедентной нехваткой питьевой воды. Количество воды, доступной каждому прогнозируется снижение на 30%. Причины – заражение, глобальное потепление и политические проблемы.Более 2,2 миллиона люди умерли в 2000 году от болезней, связанных с употреблением загрязненной воды. В 2004 году британская благотворительная организация WaterAid сообщил, что каждые 15 секунд умирает ребенок из-за легкого предотвратимые болезни, связанные с водой. большие глобальные диспропорции в необработанном объеме доступных вода: от 10 м3 на человека в год в Кувейте до 812,121 м³ во Французской Гвиане.Однако более богатые страны, такие как Кувейт легче справляется с низкой доступностью воды. в Водное право США разделено на две правовые доктрины: прибрежные права на воду, используемые в восточной и южной штаты, где есть изобилие воды и присвоение доктрина (или доктрина Колорадо), используемая в засушливых западных состояния.
.