Фреоны — Экологические термины и определения
хладоны
хлорфторуглеводороды (ХФУ) — высоколетучие, химически инертные у земной поверхности вещества, широко применяемые в быту и в производстве в качестве хладагентов (в холодильниках, кондиционерах, рефрижераторах) пенообразователей, распылителей в аэрозольных упаковках и т.д. Были синтезированы в 30-х годах, но стали широко применяться в промышленном производстве лишь с начала 60-х годов. Фреоны, поднимаясь в верхние слои атмосферы, подвергаются фотохимическому разложению с образованием соединений, интенсивно разрушающих озон. Чрезмерное применение фреонов, как полагают, привело к истощению озонового экрана. Кроме того, фреоны играют значительную роль в создании “парникового эффекта”.
Источник: Словарь экологических терминов и определений на Gufo.me
Значения в других словарях
- ФРЕОНЫ — ФРЕОНЫ — то же, что хладоны. Большой энциклопедический словарь
- фреоны — -ов, мн. (ед. фреон, -а, м.). Газообразные или жидкие продукты (фторорганические или фторхлорорганические соединения), применяемые как рабочее вещество холодильных машин. Малый академический словарь
- фреоны — ФРЕОНЫ, то же, что хладоны. Химическая энциклопедия
- Фреоны — Хладоны, фторсодержащие насыщенные углеводороды (главным образом производные метана и этана), используемые как хладагенты в холодильных машинах (См. Холодильная машина). Кроме атомов фтора, в молекулах Ф. содержатся обычно атомы хлора, реже — брома. Большая советская энциклопедия

Фреоны и их воздействие на человека
Во время ходовых испытаний на атомной субмарине
“Нерпа” произошло несанкционированное срабатывание
автоматизированной системы пожаротушения и выброс фреона,
используемого в системе. Жертвами аварии стали 20 человек –
трое военнослужащих и 17 гражданских специалистов.
В 1928 году американский химик корпорации
“Дженерал Моторс” (“General Motors Research”)
Томас Мидглей младший (Thomas Midgley, Jr.) впервые выделил и
синтезировал в своей лаборатории химическое соединение, названное
впоследствии “фреон” (от латинского frigor – холод). Позже была
синтезирована целая группа подобных соединений; для их обозначения
использовалась латинская буква R и цифровой код.
Фреоны (другое их название – хлорфторуглероды)
представляет собой бесцветные газы или жидкости, без запаха, как
правило, хорошо растворимые в органических растворителях, а также
во многих смазочных маслах и практически нерастворимые в воде.
Фреоны – это смесь метана и этана, в которых атомы водорода
замещаются атомами фтора и хлора.
Известно более 40 различных фреонов, большинство из
которых выпускается промышленностью. Среди них существует несколько
типов фреона, отличающихся химическими формулами и физическими
свойствами.
Наиболее распространены следующие соединения:
- трихлорфторметан (t кипения – 23,8°C) – Фреон R-11;
- дифтордихлорметан (t кипения – 29,8°C) – Фреон R-12
- трифторхлорметан (t кипения – 81,5°C) – Фреон R-13;
- тетрафторметан (t кипения – 128°C) – Фреон R-14;
- дифторхлорметан ( t кипения – 40,8°C) – Фреон R-22;
- хлорофторокарбонат (t кипения – 51,4°C) – Фреон R-410A.
Благодаря своим термодинамическим свойствам, фреоны
нашли широкое практическое применение как хладоносители в холодильных
машинах, в кондиционерах, в парфюмерии и медицине для создания
аэрозолей. Все хладагенты, используемые в бытовых приборах, являются
негорючими и безвредными для людей веществами. Помимо использования в
качестве хладоносителей, фреоны применяют в качестве пропелантов, для
тушения пожаров (например, фреон 13В1). В промышленности чаще всего
используются фреоны R-12, R-22, R-134a, R-407C, R-410A.
В 1987 году в соответствии с Программой ООН по окружающей
среде (ЮНЕП) вступил в действие “Монреальский протокол по веществам,
разрушающим озоновый слой”, предусматривающий постепенное сокращение
производства и потребления ряда хлорфторуглеродов. В частности в
соответствии с этим протоколом фреон R-12 (как наиболее способствующий
разрушению озонового слоя) и R-22, а также другие фреоны, разрушающие
озоновый слой, перестали применяться в бытовой технике. Однако они
продолжают применяться при тушении пожаров.
По шкале “вредности” фреонов Хладон 22 (Фреон 22)
относится к веществам 4-го класса опасности. Эти вещества обладают
наркотическим действием, вызывает слабость, переходящую в возбуждение,
спутанность сознания, сонливость, при больших концентрациях – удушье.
При попадании на кожу жидкий фреон может вызвать “обморожение”
(пузыри, некроз).
Фреоны очень инертны в химическом отношении, поэтому они
не горят на воздухе, взрывобезопасны даже при контакте с открытым
пламенем. Однако при нагревании фреонов свыше 250 °C образуются весьма
ядовитые продукты, например фосген СОСl2, который в годы первой мировой
войны использовался как боевое отравляющее вещество.
Под действием температур свыше 400 °C фреон может
разлагаться с образованием высокотоксичных продуктов: тетрафторэтилена
(4-ый класс опасности), хлористого водорода (2-ой класс опасности),
фтористого водорода (1-ый класс опасности).
При определении токсической опасности хладонов учитываются
два основных аспекта: токсичность самого хладона и токсичность продуктов
его разложения. Степень разложения хладонов при тушении пожара в
значительной мере зависит от фазы развития пожара и времени подачи
хладона. Использование хладонов при тушении пожаров практически безопасно,
так как огнетушащие концентрации по хладонам 23, 318 и 218 на порядок
меньше смертельных концентраций при длительности воздействия до 4 часов.
Термическому разложению подвергаются примерно 5% массы
хладона, поданного на тушение пожара. Поэтому токсичность среды,
образующейся при тушении пожара хладонами, будет намного ниже
токсичности продуктов пиролиза и разложения.
Токсичность существенно зависит также от степени очистки
фреонов от примесей химических веществ, загрязняющих основное вещество
при производственных процессах, которые представляют наибольшую опасность.
При температурах 180-380°С и выше за счет термоокислительной деструкции
фреонов в окружающую среду выделяются сопутствующие примеси: фтороводород,
тетрафторэтилен, 2-трифторметил, пентафторпропен и пр., которые определяют
картину интоксикации.
По токсикокинетике хладоны аналогичны инертным газам. Лишь
при длительном вдыхании хладоны низких концентраций могут оказывать
неблагоприятное влияние на сердечно-сосудистую, центральную нервную
системы, легкие. При ингаляционном воздействии высоких концентраций
хладонов токсический эффект – кислородное голодание – развивается в
результате вытеснения кислорода. Время безопасного воздействия хладонов
R-125, R-227еа и др. при концентрациях в атмосфере закрытых помещений
9-10.5% составляет 5 минут.
RIAN.RU
Фреоны и их воздействие на человека
Известно более 40 различных фреонов, большинство из которых выпускается промышленностью. Среди них существует несколько типов фреона, отличающихся химическими формулами и физическими свойствами.
Наиболее распространены следующие соединения:
трихлорфторметан (t кипения ‑ 23,8°C) — Фреон R-11, Фреон‑11, Хладон‑11
дифтордихлорметан (t кип. — 29,8°C) — Фреон R-12, Фреон‑12, Хладон‑12
трифторхлорметан (t кип. — 81,5°C) — Фреон R-13, Фреон‑13, Хладон‑13
тетрафторметан (t кип. — 128°C) — Фреон R-14, Фреон‑14, Хладон‑14
дифторхлорметан ( t кип — 40,8°C) — Фреон R-22, Фреон‑22, Хладон‑22
Благодаря своим термодинамическим свойствам, фреоны нашли широкое практическое применение как хладоносители в холодильных машинах, в кондиционерах, в парфюмерии и медицине для создания аэрозолей. Все хладагенты, используемые в бытовых приборах, являются негорючими и безвредными для людей веществами. Помимо использования в качестве хладоносителей, фреоны применяют в качестве пропелантов, для тушения пожаров (например, фреон 13В1). В промышленности чаще всего используются фреоны R-12, R-22, R-134a, R‑407C, R‑410A.
В 1987 году в соответствии с Программой ООН по окружающей среде (ЮНЕП) вступил в действие “Монреальский протокол по веществам, разрушающим озоновый слой”, предусматривающий постепенное сокращение производства и потребления ряда хлорфторуглеродов. В частности в соответствии с этим протоколом фреон R-12 (как наиболее способствующий разрушению озонового слоя) и R-22, а также другие фреоны, разрушающие озоновый слой, перестали применяться в бытовой технике. Однако они продолжают применяться при тушении пожаров.
По шкале “вредности” фреонов Хладон 22 (Фреон 22) относится к веществам 4‑го класса опасности. Эти вещества обладают наркотическим действием, вызывает слабость, переходящую в возбуждение, спутанность сознания, сонливость, при больших концентрациях ‑ удушье. При попадании на кожу жидкий фреон может вызвать “обморожение” (пузыри, некроз).
Фреоны очень инертны в химическом отношении, поэтому они не горят на воздухе, взрывобезопасны даже при контакте с открытым пламенем. Однако при нагревании фреонов свыше 250 °C образуются весьма ядовитые продукты, например фосген СОСl2, который в годы первой мировой войны использовался как боевое отравляющее вещество.
Под действием температур свыше 400 °C фреон может разлагаться с образованием высокотоксичных продуктов: тетрафторэтилена (4‑й класс опасности), хлористого водорода (2‑й класс опасности), фтористого водорода (1‑й класс опасности).
При определении токсической опасности хладонов учитываются два основных аспекта: токсичность самого хладона и токсичность продуктов его разложения. Степень разложения хладонов при тушении пожара в значительной мере зависит от фазы развития пожара и времени подачи хладона. Использование хладонов при тушении пожаров практически безопасно, так как огнетушащие концентрации по хладонам 23, 318 и 218 на порядок меньше смертельных концентраций при длительности воздействия до 4 часов.
Термическому разложению подвергаются примерно 5% массы хладона, поданного на тушение пожара. Поэтому токсичность среды, образующейся при тушении пожара хладонами, будет намного ниже токсичности продуктов пиролиза и разложения.
Токсичность существенно зависит также от степени очистки фреонов от примесей химических веществ, загрязняющих основное вещество при производственных процессах, которые представляют наибольшую опасность. При температурах 180‑380°С и выше за счет термоокислительной деструкции фреонов в окружающую среду выделяются сопутствующие примеси: фтороводород, тетрафторэтилен, 2‑трифторметил, пентафторпропен и пр., которые определяют картину интоксикации.
По токсикокинетике хладоны аналогичны инертным газам. Лишь при длительном вдыхании хладоны низких концентраций могут оказывать неблагоприятное влияние на сердечно‑сосудистую, центральную нервную системы, легкие. При ингаляционном воздействии высоких концентраций хладонов токсический эффект ‑ кислородное голодание ‑ развивается в результате вытеснения кислорода. Время безопасного воздействия хладонов R-125, R-227еа и др. при концентрациях в атмосфере закрытых помещений 9‑10,5% составляет 5 минут.
Материал подготовлен на основе информации открытых источников
Озоновая дыра — Википедия
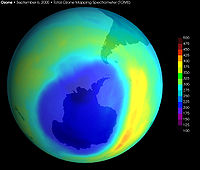
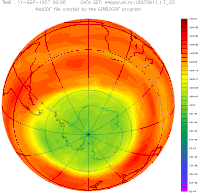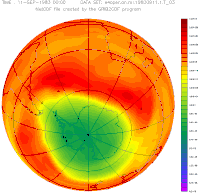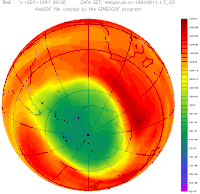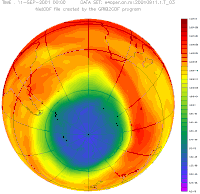 Антарктическая озоновая дыра в сентябре, с 1957 года по 2001
Антарктическая озоновая дыра в сентябре, с 1957 года по 2001Озо́новая дыра́ — это локальное падение концентрации озона в озоновом слое Земли. По общепринятой в научной среде теории, во второй половине XX века всё возрастающее воздействие антропогенного фактора в виде выделения хлор- и фторсодержащих фреонов привело к значительному утончению озонового слоя, см., например, доклад Всемирной метеорологической организации[1]:
Эти и другие недавно полученные научные данные укрепили вывод предыдущих оценок в том, что совокупность научных доказательств свидетельствует о том, что наблюдаемая потеря озона в средних и высоких широтах в основном обусловлена антропогенными хлор- и бромсодержащими соединениями
Оригинальный текст (англ.)
These and other recent scientific findings strengthen the conclusion of the previous assessment that the weight of scientific evidence suggests that the observed middle- and high-latitude ozone losses are largely due to anthropogenic chlorine and bromine compounds
Для определения границ озоновой дыры выбран минимальный уровень содержания озона в атмосфере в 220 единиц Добсона.
Площадь озоновой дыры над Антарктикой составляла в 2018 году в среднем 22,8 млн квадратных километров (в 2010—2017 годах среднегодовые величины колебались от 17,4 до 25,6 млн квадратных километров, в 2000—2009 годах — от 12,0 до 26,6 млн квадратных километров, в 1990—1999 годах — от 18,8 до 25,9 млн квадратных километров).[2]
Озоновая дыра диаметром свыше 1000 км впервые была обнаружена в 1985 году на Южном полушарии, над Антарктидой, группой британских учёных: Дж. Шанклин (англ.), Дж. Фармен (англ.), Б. Гардинер (англ.), опубликовавших соответствующую статью в журнале Nature. Каждый август она появлялась, а в декабре — январе прекращала своё существование. Над Северным полушарием в Арктике осенью и зимой существуют многочисленные озоновые мини-дыры. Площадь такой дыры не превышает 2 млн км², время её жизни — до 7 суток
В результате отсутствия солнечного излучения, во время полярных ночей озон не образуется. Нет ультрафиолета — нет озона. Имея большую массу, молекулы озона опускаются к поверхности Земли и разрушаются, так как неустойчивы при нормальном давлении.
Роуланд и Молина предположили, что атомы хлора могут вызвать разрушение больших количеств озона в стратосфере. Их выводы были основаны на аналогичной работе Пауля Джозефа Крутцена и Харольда Джонстоуна, которые показали, что оксид азота (II) (NO) может ускорять разрушение озона.
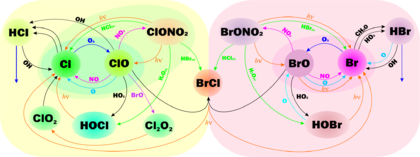 Схема реакции галогенов в стратосфере, включающая реакции галогенов с озоном
Схема реакции галогенов в стратосфере, включающая реакции галогенов с озономК уменьшению концентрации озона в атмосфере ведёт совокупность факторов, главными из которых является гибель молекул озона в реакциях с различными веществами антропогенного и природного происхождения, отсутствие солнечного излучения в течение полярной зимы, особо устойчивый полярный вихрь, который препятствует проникновению озона из приполярных широт, и образование полярных стратосферных облаков (ПСО), поверхность частиц которого катализируют реакции распада озона. Эти факторы особенно характерны для Антарктики, в Арктике полярный вихрь намного слабее ввиду отсутствия континентальной поверхности, температура выше на несколько градусов, чем в Антарктике, а ПСО менее распространены, к тому же имеют тенденцию к распаду в начале осени. Будучи химически активными, молекулы озона могут реагировать со многими неорганическими и органическими соединениями. Главными веществами, вносящими вклад в разрушение молекул озона, являются простые вещества (водород, атомы кислорода, хлора, брома), неорганические (хлороводород, монооксид азота) и органические соединения (метан, фторхлор- и фторбромфреоны, которые выделяют атомы хлора и брома). В отличие, например от гидрофторфреонов, которые распадаются до атомов фтора, которые, в свою очередь, быстро реагируют с водой, образуя стабильный фтороводород. Таким образом, фтор не участвует в реакциях распада озона. Йод также не разрушает стратосферный озон, так как иодсодержащие органические вещества почти полностью расходуются ещё в тропосфере. Основные реакции, вносящие вклад в разрушение озона, приведены в статье про озоновый слой.
Ослабление озонового слоя усиливает поток ультрафиолетовой солнечной радиации, проникающей в океанские воды, что ведет к увеличению смертности среди морских животных и растений[4][5].
Хотя человечеством были приняты меры по ограничению выбросов хлор- и бромсодержащих фреонов путём перехода на другие вещества, например фторсодержащие фреоны[6], процесс восстановления озонового слоя займёт несколько десятилетий. Прежде всего, это обусловлено огромным объёмом уже накопленных в атмосфере фреонов, которые имеют время жизни десятки и даже сотни лет. Поэтому затягивания озоновой дыры не стоит ожидать ранее 2048 года.[7] По данным профессора Сьюзан Соломон, с 2000 по 2015 озоновая дыра над Антарктидой уменьшилась примерно на площадь Индии.[8] По данным НАСА, в 2000 году среднегодовая площадь озоновой дыры над Антарктидой составила 24,8 млн кв. км, в 2015 году — 25,6 млн кв. км, в 2019 — 9,3 млн кв. км[9].
Существует несколько широко распространённых мифов касательно образования озоновых дыр. Несмотря на свою ненаучность, они часто появляются в СМИ[10][неавторитетный источник?] — иногда по неосведомлённости, иногда поддерживаемые сторонниками теорий заговоров. Ниже перечислены некоторые из них.
Озоновая дыра над Антарктидой существует уже давно[править | править код]
Систематические научные наблюдения за озоновым слоем Антарктиды ведутся с 20-х годов XX века, но только во второй половине 70-х было обнаружено образование «устойчивой» Антарктической озоновой дыры, причем быстрые темпы её развития (увеличение размеров и снижение средней концентрации озона в границах дыры) в 80-е и 90-е годы вызвали панические опасения того, что точка невозврата в степени разрушающего антропогенного воздействия на озоновый слой уже пройдена.
Основными разрушителями озона являются фреоны[править | править код]
Это утверждение справедливо для средних и высоких широт. В остальных хлорный цикл ответственен только за 15—25 % потерь озона в стратосфере. При этом необходимо отметить, что 80 % хлора имеет антропогенное происхождение[11] (подробнее про вклад различных циклов см. ст. озоновый слой). То есть вмешательство человека сильно увеличивает вклад хлорного цикла. И при имевшейся тенденции к увеличению производства фреонов до вступления в действие Монреальского протокола (10 % в год) от 30 до 50 % общих потерь озона в 2050 году обуславливалось бы воздействием фреонов.[12] До вмешательства человека процессы образования озона и его разрушения находились в равновесии. Но фреоны, выбрасываемые при человеческой деятельности, сместили это равновесие в сторону уменьшения концентрации озона. Что же касается полярных озоновых дыр, то здесь ситуация совершенно иная. Механизм разрушения озона в принципе отличается от более высоких широт, ключевой стадией является превращение неактивных форм галогенсодержащих веществ в оксиды, которая протекает на поверхности частиц полярных стратосферных облаков. И в результате практически весь озон разрушается в реакциях с галогенами, за 40—50 % ответственен хлор и порядка 20—40 % — бром.[13]
Позиция компании DuPont[править | править код]
Компания DuPont после обнародования данных об участии фреонов в разрушении стратосферного озона восприняла эту теорию в штыки и потратила миллионы долларов на кампанию в прессе по защите фреонов. Председатель DuPont писал в статье в журнале Chemical Week от 16 июля 1975 года, что теория разрушения озона — это научная фантастика, вздор, не имеющий смысла[14]. Кроме DuPont целый ряд компаний во всём мире производил и производит различные типы фреонов без отчисления лицензионных платежей[15].
Фреоны слишком тяжелы, чтобы достигать стратосферы[править | править код]
 вертикальное распределение фреона CFC-11
вертикальное распределение фреона CFC-11 
Иногда утверждается, что так как молекулы фреонов намного тяжелее азота и кислорода, то они не могут достигнуть стратосферы в значительных количествах. Однако атмосферные газы перемешиваются полностью, а не стратифицируются или сортируются по весу. Оценки требуемого времени для диффузионного расслоения газов в атмосфере требуют времён порядка тысяч лет. Конечно, в динамической атмосфере это невозможно. Процессы вертикального массопереноса, конвекции и турбулентности полностью перемешивают атмосферу ниже турбопаузы намного быстрее. Поэтому даже такие тяжёлые газы, как инертные или фреоны, равномерно распределяются в атмосфере, достигая в том числе и стратосферы. Экспериментальные измерения их концентраций в атмосфере подтверждают это, см. например справа график распределения фреона CFC-11 по высоте. Также измерения показывают, что требуется порядка пяти лет для того чтобы газы, выделившиеся на поверхности Земли, достигли стратосферы, см. второй график справа. Если бы газы в атмосфере не перемешивались, то такие тяжёлые газы из её состава, как аргон и углекислый газ, образовывали бы на поверхности Земли слой в несколько десятков метров толщиной, что сделало бы поверхность Земли необитаемой. Но это не так. И криптон с атомарной массой 84, и гелий с атомарной массой 4, имеют одну и ту же относительную концентрацию, что около поверхности, что до 100 км высоты. Конечно, всё вышесказанное справедливо только для газов, которые относительно стабильны, как фреоны или инертные газы. Вещества, которые вступают в реакции, а также подвергаются различным физическим воздействиям, скажем, растворяются в воде, имеют зависимость концентрации от высоты.
Основные источники галогенов природные, а не антропогенные[править | править код]
 Источники хлора в стратосфере
Источники хлора в стратосфереЕсть мнение, что природные источники галогенов, например вулканы или океаны, более значимы для процесса разрушения озона, чем произведённые человеком. Не подвергая сомнению вклад природных источников в общий баланс галогенов, необходимо отметить, что в основном они не достигают стратосферы ввиду того, что являются водорастворимыми (в основном хлорид-ионы и хлороводород) и вымываются из атмосферы, выпадая в виде дождей на землю. Также природные соединения менее устойчивы, чем фреоны, например метилхлорид имеет атмосферное время жизни всего порядка года, по сравнению с десятками и сотнями лет для фреонов. Поэтому их вклад в разрушении стратосферного озона довольно мал. Даже редкое по своей силе извержение вулкана Пинатубо в июне 1991 года вызвало падение уровня озона не за счёт высвобождаемых галогенов, а за счёт образования большой массы сернокислых аэрозолей, поверхность которых катализировала реакции разрушения озона. К счастью, уже через три года практически вся масса вулканических аэрозолей была удалена из атмосферы. Таким образом, извержения вулканов являются сравнительно краткосрочными факторами воздействия на озоновый слой, в отличие от фреонов, которые имеют времена жизни в десятки и сотни лет.[16]
Озоновая дыра должна находиться над источниками фреонов[править | править код]
 Динамика изменения размера озоновой дыры и концентрации озона в Антарктике по годам
Динамика изменения размера озоновой дыры и концентрации озона в Антарктике по годамМногие не понимают, почему озоновая дыра образуется в Антарктике, когда основные выбросы фреонов происходят в Северном полушарии. Дело в том, что фреоны хорошо перемешаны в тропосфере и стратосфере. Ввиду малой реакционной способности они практически не расходуются в нижних слоях атмосферы и имеют срок жизни в несколько лет или даже десятилетий. Будучи очень летучими молекулярными соединениями, они сравнительно легко достигают верхних слоёв атмосферы.
Сама Антарктическая «озоновая дыра» существует не круглогодично. Она появляется в конце зимы — начале весны (август-сентябрь) и проявляется в заметном снижении средней концентрации озона внутри обширной географической области. Причины, по которой озоновая дыра образуется в Антарктике, связаны с особенностями местного климата. Низкие температуры антарктической зимы приводят к образованию полярного вихря. Воздух внутри этого вихря движется в основном по замкнутым траекториям вокруг Южного полюса и слабо перемешивается с воздухом других широт. В это время полярная область не освещается Солнцем, и в отсутствие ультрафиолетового облучения озон не образуется, а, накопленный до этого, разрушается (как в результате взаимодействий с другими веществами и частицами, так и самопроизвольно, поскольку молекулы озона нестабильны). С приходом полярного дня количество озона постепенно увеличивается и снова выходит к нормальному уровню. То есть колебания концентрации озона над Антарктикой — сезонные.
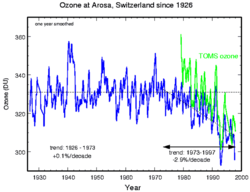
Но если проследить усреднённую в течение каждого года динамику изменения концентрации озона и размера озоновой дыры в течение последних десятилетий, то имеется выраженная тенденция к падению средней концентрации озона в пределах огромной географической области.
- ↑ Scientific Assessment of Ozone Depletion: 2006 (англ.). Дата обращения 13 декабря 2007. Архивировано 16 февраля 2012 года.
- ↑ Изменение озоновой дыры по данным НАСА
- ↑ Озоновая дыра / А. М. Звягинцев // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- ↑ Озоновая дыра влияет на обитателей морей.
- ↑ Ozone hole UV impacting marine life: study (англ.) (неопр.) ?. The University of Western Australia (25 July 2012). Дата обращения 23 января 2018.
- ↑ Production, Sales, and Atmospheric Release of Fluorocarbons throught 2004 (англ.) (недоступная ссылка). Дата обращения 6 июля 2007. Архивировано 16 февраля 2012 года.
- ↑ Paul Newman. Recovery of the Antarctic Ozone Hole (англ.) (недоступная ссылка). Дата обращения 4 июля 2007. Архивировано 3 октября 2006 года.
- ↑ Озоновая дыра над Антарктикой начала затягиваться — BBC Русская служба
- ↑ [1] Данные НАСА
- ↑ И.К.Ларин. Озоновый слой и климат Земли. Ашипки ума и их исправление. (рус.) (недоступная ссылка). Дата обращения 3 июля 2007. Архивировано 6 марта 2001 года.
- ↑ Osterman, G. B.; Salawitch, R. J.; Sen, B.; Toon, G. C.; Stachnik, R. A.; Pickett, H. M.; Margitan, J. J.; Blavier, J.-F.; Peterson, D. B. Balloon-Borne Measurements of Stratospheric Radicals and their Precursors Implications for the Production and Loss of Ozone // Geophys. Res. Lett. — 1997. — Т. 24, № 9. — С. 1107–1110..
- ↑ National Academy of Sciences. Галогенуглеводороды: воздействие на стратосферный озон = Halocarbons: Effects on Stratospheric Ozone. — 1976.
- ↑ Stratospheric Ozone. An Electronic Textbook (англ.). Дата обращения 4 июля 2007. Архивировано 3 ноября 2003 года.
- ↑ Jeff Masters, Climate of Fear (англ.). Дата обращения 13 декабря 2007. Архивировано 16 февраля 2012 года.
- ↑ John R. Hess. R-12 Retrofitting: Are we really doing it because DuPont’s patent for Freon® ran out? (англ.). Дата обращения 6 июля 2007. Архивировано 16 февраля 2012 года.
- ↑ Myth: Volcanoes and the Oceans are Causing Ozone Depletion (англ.)
что такое в Экологическом словаре
Смотреть что такое ФРЕОНЫ в других словарях:
ФРЕОНЫ
хладоны, фторсодержащие насыщенные углеводороды (главным образом производные метана и этана), используемые как хладагенты в холодильных машинах… смотреть
ФРЕОНЫ
ФРЕОНЫ, х л а д о н ы, фторсодержащие насыщенные углеводороды (гл. обр. производные метана и этана), используемые как хладагенты в холодильных машина… смотреть
ФРЕОНЫ
– (ХЛАДОНЫ) хлорфторуглеводороды (ХФУ) – высоколетучие, химически инертные у земной поверхности вещества, широко применяемые в быту и в производстве в качестве хладагентов (в холодильниках, кондиционерах, рефрижераторах) пенообразователей, распылителей в аэрозольных упаковках и т. д. Были синтезированы в 30-х годах, но стали широко применяться в промышленном производстве лишь с начала 60-х годов. Фреоны, поднимаясь в верхние слои атмосферы, подвергаются фотохимическому разложению с образованием соединений, интенсивно разрушающих озон. Чрезмерное применение фреонов, как полагают, привело к истощению озонового экрана. Кроме того, фреоны играют значительную роль в создании “парникового эффекта”…. смотреть
ФРЕОНЫ
фрео́ны хладоны – органические соединения, фтор- и фторхлорпронзводные простейших алифатических углеводородов; газообразные или жидкие продукты; получ… смотреть
ФРЕОНЫ
1) Орфографическая запись слова: фреоны2) Ударение в слове: фре`оны3) Деление слова на слоги (перенос слова): фреоны4) Фонетическая транскрипция слова … смотреть
ФРЕОНЫ
корень – ФРЕОН; окончание – Ы; Основа слова: ФРЕОНВычисленный способ образования слова: Бессуфиксальный или другой∩ – ФРЕОН; ⏰ – Ы; Слово Фреоны содерж… смотреть
ФРЕОНЫ
-ов, мн. (ед. фрео́н, -а, м.).Газообразные или жидкие продукты (фторорганические или фторхлорорганические соединения), применяемые как рабочее веществ… смотреть
ФРЕОНЫ
Ударение в слове: фре`оныУдарение падает на букву: оБезударные гласные в слове: фре`оны
ФРЕОНЫ
используется как хладагент в климатических установках(холодильники, кондиционеры). При испарении во внутреннем блоке хладагент забирает тепло из окружающей среды, при конденсации отдает его обратно…. смотреть
ФРЕОНЫ
фре’оны, -ов, ед. ч. фре’он, -а
ФРЕОНЫ
фреоны фре`оны, -ов, ед. фре`он, -а
ФРЕОНЫ
ФРЕОНЫ – то же, что хладоны.
ФРЕОНЫ
ФРЕОНЫ , то же, что хладоны.
Значение качественного фреона для экологии
В настоящее время одним из самых лучших хладагентов является R134a. Как это ни удивительно, он имеет нулевой потенциал разрушения озонового слоя. Это большое достижение в мире хладагентов – вещество, которое абсолютно не вредит экологии. Трудно переоценить всю важность этого достижения науки, ведь сегодня функционируют миллионы производственных площадок, очень плохо сказывающихся на здоровье окружающей среды. Есть столько установок и аппаратов, которых трудно назвать безвредными. Но ученые стараются усовершенствовать уже существующие изобретения таким образом, чтобы те вещи, без которых жизнь в данный момент невозможна, были безопасными.
Применение фреона R134a очень тесно связано с нашей обыденной жизнью. Он активно участвует в работе транспортных систем кондиционирования воздуха, причем, подразумевается не только коммерческие автомобили, но и частные транспортные средства. Фреон R134a является активным работником самых обычных холодильников, которые принято называть бытовыми. Тех холодильников, что стоят у нас с вами дома. Продажа фреона R404a осуществляется практически для любых систем кондиционирования воздуха. Такой надежный элемент работы систем пригодится везде.
Очень важно, чтобы был не только хороший фреон, но и компрессорное масло. Фреон R134a не содержит хлор и для него нужно специальное масло. Качественные компрессорные масла не должны входить в конфликт с фреоном на химическом уровне. В противном случае, холодильная установка не будет функционировать так, как следует. На сайтах нередко предлагают минеральные масла, но нужно понимать, что они подходят не для любого фреона. Для хладагентов, не разрушающих озоновый слой, очень хорошо подходят холодильные масла, что были разработаны на основе особых синтетических эфиров.
Теперь вы понимаете, что фреон R134a представляет собой отличный выбор для производителей. Его антагонистом является фреон R22. Это пример устаревшего фреона, который весьма вреден для окружающей среды. Поскольку в Европе и США его производство было прекращено, фреон R22 – цена больших перемен в мире фреонов. Он стоит весьма недорого, так как пытается задержаться на рынке за счет удобного для покупателя ценника. Надо сказать, что данный хладагент до сих пор изготавливается в России, хотя холодильное оборудование с этим фреоном перестало ввозится в РФ с 2011 года.
Экологическая безопасность фреонов
На саммите 1992 года в Рио-де-Жанейро глобальное потепление было признано главной опасностью для человечества. Не случайно проблеме озоновых дыр и парниковых эффектов уделяется такое пристальное внимание. По мнению О.Б. Цветкова, ученогохолодильщика, для решения этих проблем необходимо учесть все первопричины возникновения данной проблемы [1]. С 1997 года в штате Оригон было запрещено использование пропеллентов в парфюмерии и фармакологии. По опубликованным метеорологами в 70-е и 80-е годы прошлого столетия материалам, количество озона в Антарктиде снизилось на треть. Концентрация окиси хлора в стратосфере составляла на два порядка выше в Антарктиде, чем в средних широтах. Было подтверждено также предположение химиков М. Молины и Ф. Роуленда, что в стратосфере хлор из молекулы фреона окисляется, превращая озон в кислород. Были учтены и носители атомов хлора – фреоны. В конце 1980-х ходов было подписано Монреальское соглашение о регулировании выбросов хлорфторуглеводородов (ХФУ).
С развитием производства персональных компьютеров появились миниатюрные
микросхемы и микрочипы, для очистки которых использовались фреоны, в основном фреон
113. Кроме того, газообразные фреоны использовались в домашних холодильниках, в
контейнерах для пищевых продуктов, в системах быстрого питания, в химчистках. Военные использовали фреоны как средство пожаротушения и т.д. Для сравнения: холодильная техника на этом фоне потребляла лишь 5-6% всех фреонов. Только в 1986 году было произведено 1 млн. 300 тыс. тонн фреонов, львиная доля которых приходилась на хлорфторуглероды (ХФУ (CFC) и ГХФУ(HCFC). Из них 75% шло на устранение потерь хладоагентов.
К озоноразрушающим веществам (ОРВ) относятся фреоны, содержащие хлор и бром: R11, R12, R21, R21, R22, R13, R113, R114, R115, R502, R142b, R12B2, R114B2, R114B2, R141b, и др. Все эти фреоны обладают в разной степени озоноразрушающим действием. Например, для R11, R12 потенциал разрушения озонового слоя (ОDP) составляет 1,00 и
0,055 соответственно, а у бромированных фреонов ОDP в десять и более раз выше. Таким образом, если один атом хлора превращает в кислород 105 молекул озона, то атом брома – миллион.
Вместе с тем, озоносберегающие холодильные агенты, синтезированные в последнее
десятилетие 20-го века, имеют нулевое значение ОDP. К ним относятся: R134a, R125, их смеси с озонобезопасными фреонами R32, R143a, R23, R152a. Среди смесей особое значение имеют R404A, R407C, R410A, R507, R508.
В качестве переходных хладоагентов, в некоторой степени заменяющих ОРВ в
существующих холодильных машинах, можно отнести отечественные смеси: С1, СМ1, С10М1, Экохол, С10М1, С10М1В (За рубежом они известны как R401A, R401B, R402A, R406A.
В настоящее время новые перспективы появились у диоксида углерода. Конечно, цикл
на СО2 является не самым лучшим с позиций термодинамики. Однако, он не имеет конкурентов по эколого-энергетическим показателям: не горюч, взрывобезопасен, экологичен и компактен. При грамотном учете пожарои взрывобезопасности большое будущее принадлежит углеводородам: смесям изобутана с пропаном, изобутана.
Другим направлением, позволяющим снизить выбросы хладагентов а атмосферу, является использование природных хладагентов. Аммиак является лучшим природным хладагентом по своим теплофизическим параметрам. Конкурентов аммиаку в области промышленного применения не было даже в годы «победного шествия» фреонов. Сегодня аммиак широко используется в транспортных установках, в том числе на флоте, в коммерческих холодильных установках, в тепловых насосах. Аммиачные холодильные системы, разработанные в последнее десятилетие, соответствуют самым высоким стандартам безопасности [2]. В.И. Позняком и др. изучалась возможность создания взрывобезопасных смесевых хладагентов на основе аммиака. Исследовалась флегматизация аммиака с фреонами, изучались свойства таких смесей как: аммиак/вохдух/R 125; аммиак/вохдух/R
227еа; аммиак/вохдух/ R 134а. Потери аммиака составляют менее 1% в год (сравните – в старых системах – 5-10%). Объем ежегодного оборота аммиака составляет более 3 миллиардов тонн. Человек в процессе жизнедеятельности производит около 17 граммов аммиака в сутки, корова – 1 тонну в год. Промышленным способом получают около 150 миллионов тонн аммиака, из которых в качестве хладагента используется только полмиллиона тонн.
Хорошие перспективы также у комбинированного варианта с использованием аммиака и углекислого газа. Также очевидно, что прекрасным хладагентом в системах кондиционирования воздуха является вода.
По прогнозам Всемирной метеорологической организации, наша атмосфера нагреется на 2 градуса до конца этого столетия. Сегодня следует более взвешенно относиться к имеющимся хладоагентам и системам, снижая их эмиссию, повышая энергетическую эффективность, осваивая новые поколения холодильных установок.
ЛИТЕРАТУРА
1. Цветков, О.Б. Холодильные агенты: ХХ век и великая холодильная революция./
О.Б. Цветков // Холодильная техника. 2000. С. 7-9.
2. Гидрофторуглероды в индустрии холода после 2012 года / Позняк В.И. [и др.] Холодильная техника. — 2012. № 3. С.32-34.
Материал взят из книги Инженерное дело