Гальваническая коррозия алюминия
Следует подчеркнуть, что стойкость алюминия и алюминиевых сплавов к нормальным условиях окружающей среды является очень высокой. Главным источником защиты от коррозии является прочная, самовосстанавливающаяся оксидная пленка, которая всегда присутствует на алюминии в условиях окружающей воздушной атмосферы (рисунок 1).
Рисунок 1 – Естественная защита алюминия от коррозии – поверхностная оксидная пленка [4]
Основные типы коррозии алюминия
Для коррозии алюминия характерны следующие основные типы [4]:
- Общая коррозия
- Щелевая коррозия
- Фреттиниг-коррозия
- Коррозия под напряжением
- Гальваническая коррозия
- Точечная (питтинговая) коррозия
- Межзеренная коррозия
- Подповерхностная коррозия
Рисунок 2 – Общая коррозия алюминия: растворение естественной оксидной пленки
растворами сильных щелочей и некоторых кислот [4]
Рисунок 3 – Щелевая коррозия алюминия [4]
Рисунок 4 – Фреттинг-коррозия алюминия: взаимное трение двух алюминиевых компонентов
в условиях шероховатого контакта [4]
Рисунок 5 – Коррозия алюминиевых сплавов под напряжением: при некоторых условиях
в сплавах Al-Cu, Al-Mg, Al-Zn-Mg [4]
Рисунок 6 – Гальваническая коррозия алюминиевого сплава
происходит в условиях его мокрого или влажного контакта
с другим, более “благородным” металлом, таким как медь [4]
Рисунок 7 – Питтинговая (точечная) коррозия алюминия
под воздействием хлоридных ионов [4]
Рисунок 8 – Межзеренная коррозия и подповерхностная коррозия [4]
В зависимости от условий окружающей среды, нагружения и функционального назначения детали любой из видов коррозии может явиться причиной преждевременного разрушения. Кроме того, неправильное применение алюминиевых деталей и изделий может усугублять коррозионные процессы.
Кроме того, неправильное применение алюминиевых деталей и изделий может усугублять коррозионные процессы.
Гальваническая коррозия алюминия
Наиболее частые ошибки проектирования алюминиевых конструкций связаны с гальванической коррозией. Гальваническая или электрохимическая коррозия происходит, когда два разнородных металла образуют электрическую цепь, замыкаемую жидким или пленочным электролитом или коррозионной средой. В этих условиях разность потенциалов между разнородными металлами создает электрический ток, проходящий через электролит, который (ток) и приводит к коррозии в первую очередь анода или менее благородного металла из этой пары.
Сущность гальванической коррозии
Когда два различных металла находятся в прямом контакте с электропроводящей жидкостью, то опыт показывает, что один из них может корродировать, то есть подвергаться коррозии. Это называют гальванической коррозией.
Другой металл не будет корродировать, наоборот, он будет защищен от этого вида коррозии.
Этот вид коррозии отличается от тех видов коррозии, которые могли бы возникнуть, если бы оба эти металлы были помещены раздельно в ту же самую жидкость. Гальваническая коррозия может случиться с любым металлом, как только два различных металла будут находиться в контакте в электропроводящей жидкости.
Внешний вид гальванической коррозии
Внешний вид гальванической коррозии является очень характерным. Эта коррозия не раскидывается по всей поверхности изделия, как это бывает с точечной – питтинговой – коррозий. Гальваническая коррозия плотно локализована в зоне контакта алюминия с другим металлом. Коррозионное воздействие на алюминий имеет равномерный характер, он развивается в глубь в виде кратеров, которые имеют более или менее округлую форму [3[.
Все алюминиевые сплавы подвергаются идентичной гальванической коррозии [3].
Принцип батареи
Гальваническая коррозия работает как батарея, которая состоит из двух электродов:
- катода, где происходит реакция восстановления
- анода, где происходит реакция окисления.

Эти два электрода погружены в проводящую жидкость, которая называется электролитом. Электролит – это обычно разбавленный кислотный раствор, например, серной кислоты, или соляной раствор, например, сульфат меди. Эти два электрода соединены снаружи электрической цепью, которая обеспечивает циркуляцию электронов. Внутри жидкости передача электрического тока происходит путем перемещения ионов. Жидкость, таким образом, обеспечивает ионное электрическое соединение (рисунок 9).
Рисунок 9 – Принцип гальванической ячейки [3]
Рисунок 1 показывает ячейку, в которой электролитом является раствор серной кислоты. Серная кислота полностью диссоциирована в воде (поскольку является сильной кислотой) путем образования ионов Н+, которые определяют кислотность среды. Происходит следующая электрохимическая реакция [3]:
- цинковый анод окисляется:
Zn → Zn2+ + 2e−
на медном катоде восстанавливаются протоны Н+:
2Н+ + 2e− → Н2
Полная реакция имеет вид:
Zn + H2O → Zn(OH)2 + H2
Эта ячейка производит электричество за счет потребления цинка, который выделяется в виде гидроксида цинка Zn(OH)
Для работы ячейки необходимо одновременное выполнение трех условий:
- два различных металла, которые образуют два электрода;
- присутствие электролита;
- непрерывность всей электрической цепочки.
Если хотя бы одно из этих условий не выполняется, например, если нарушается электрический контакт, то ячейка не будет производить электричество, и окисления на аноде не будет происходить (также как и восстановления на катоде).
Условия для гальванической коррозии
Гальваническая коррозия основана на том же самом принципе и для того, чтобы она происходила необходимо одновременное выполнение следующих трех условий [3]:
- различные типы металлов;
- присутствие электролита;
- электрический контакт между двумя металлами.
Различные типы металлов
Для любых металлов, которые относятся к различным их типам, гальваническая коррозия является возможной. Металл с электроотрицательным потенциалом (или более электроотрицательный металл, если они оба электроотрицательные) действует как анод.
Тенденцию различных металлов образовывать гальванические пары и направленность электрохимического действия в различных коррозионных средах (морской воде, тропическом климате, промышленной атмосфере и т.д.) показывают в так называемых гальванических рядах. Чем далее удалены друг от друга металлы в этих рядах, тем более серьезной может быть электрохимическая коррозия. В разных коррозионных средах эти последовательности металлов могут быть разными (рисунок 10).
Присутствие электролита
Область контакта должна быть смочена водным раствором, чтобы обеспечивать ионную электропроводимость. В противном случае отсутствует возможность для гальванической коррозии.
Электрический контакт между металлами
Электрический контакт между металлами может происходить или путем прямого контакта между двумя металлами, или через крепежное соединение, например, болт.
Рисунок 10 [1]
Как видно из графиков рисунка 10 алюминий и его сплавы становятся анодами в гальванических ячейках с большинством металлов, и алюминий корродирует, как говорят, жертвенно и защищает от коррозии другой металл гальванической пары.![]()
Только магний и цинк, включая и оцинкованную сталь, являются более анодными и поэтому, сами подвергаясь коррозии, защищают от нее алюминий.
Алюминий и кадмий вообще имеют почти одинаковые электродные потенциалы и поэтому ни алюминий, ни кадмий не подвергаются гальванической коррозии. К сожалению, кадмий признан весьма токсичным и все реже применяется, а во многих странах просто запрещен, как антикоррозионная защита.
Гальванические пары
Относительное расположение двух металлов или сплавов в гальваническом ряду указывает только возможность гальванической коррозии, если различие их гальванических потенциалов является достаточно большим. Больше этот ряд ничего не говорит, и особенно ничего – о скорости или интенсивности гальванической коррозии. Она может быть нулевой или несущественной или даже незаметной. Ее интенсивность зависит от типов металлов, которые входят в контакт – гальванической пары.
Пара: алюминий – нелегированная сталь
В строительных конструкциях алюминиевые детали, которые открыты для воздействия климатических и погодных воздействий, могут соединяться винтами из обычной стали.
Это явление имеет следующее объяснение:
- на поверхностях контакта образуются пленки с продуктами коррозии – ржавчины на стали и оксида алюминия на алюминии, которые и замедляют электрохимические реакции.
Пара: алюминий – оцинкованная сталь
Судя по гальваническому ряду, цинк является более электроотрицательным, чем алюминий. Крепеж из оцинкованной стали может, поэтому, применяться для соединения и сборки конструкций из алюминиевых сплавов. Надо помнить, что когда цинковое покрытие станет слишком изношенным, чтобы защищать сталь и алюминий, наступает предыдущий сценарий контакта между алюминием и голой сталью [3] .
Пара: алюминий – нержавеющая сталь
Хотя и существует большая разность потенциалов между нержавеющей сталью и алюминиевыми сплавами – около 650 мВ, очень редко можно увидеть гальваническую коррозию на алюминии в контакте с нержавеющей сталью. Поэтому алюминиевые конструкции очень часто собираются с применением болтов и винтов из нержавеющей стали [3].
Пара: алюминий – медь
Контакт между алюминиевыми сплавами и медью, а также медными сплавами (бронза, латунь) приводит к совершенно незначительной гальванической коррозии алюминия под воздействием атмосферных условий. Тем не менее, рекомендуется обеспечивать электрическую изоляцию между этими двумя металлами, чтобы локализовать коррозию алюминия.
Необходимо отметить, что продуктом коррозии меди является, так называемая, патина. Эта патина – голубовато-зеленый налет на меди, который состоит в основном из карбоната меди. Эта патина химически воздействует на алюминий и может восстанавливаться с образованием малых частиц меди. Эти медные частицы, в свою очередь, могут вызывать локальную питтинговую коррозию алюминия [3].
Эти медные частицы, в свою очередь, могут вызывать локальную питтинговую коррозию алюминия [3].
Ближе к контакту – больше коррозия
Ускоренная гальваническая коррозия обычно наиболее интенсивна вблизи мест соединения двух металлов; с удалением от мест соединения ее интенсивность уменьшается. Существенное влияние на скорость коррозии оказывает величина отношения площади поверхности катода, контактирующей с электролитом, к площади незащищенной поверхности анода. Желательно иметь малое отношение площади катода к площади анода.
Как избежать гальванической коррозии
- Выбирать в пару алюминию или его сплаву металл, который как можно более ближе к нему в гальваническом ряду для рассматриваемой коррозионной среды (см. рисунок 10).
- Применять «катодный» крепеж. Избегать комбинаций с неблагоприятным (большим) отношением площадей катода к аноду (рисунок 3).
- Обеспечивать полную электрическую изоляцию двух соединяемых металлов. Это может быть выполнено с помощью изолирующих прокладок, втулок, шайб и т.
 п. (рисунок 12).
п. (рисунок 12). - Если применяется окраска, всегда нужно красить катод. Если покрасить только анод, любая царапина на нем даст неблагоприятное отношение поверхностей катода к аноду и приведет к коррозии царапины.
- Увеличивать толщину анода или устанавливать в соединение заменяемые массивные прокладки из анодного металла.
- По возможности размещать гальванический контакт вне коррозионной среды.
- Избегать резьбовых соединений из металлов, образующих гальваническую пару. Заменять их паяными или сварными соединениями.
- Если возможно, применять ингибиторы коррозии, например, в системах с циркуляцией жидкости, которая может играть роль электролита для гальванической коррозии.
- В случаях, когда металлы должны оставаться в электрическом контакте через наружную электрическую цепь, нужно разнести их как можно дальше друг от друга для увеличения сопротивления жидкой цепи (электролита).
- При необходимости и там, где это возможно, применять катодную защиту с цинковым или магниевым жертвенными анодами.

- В наиболее агрессивных средах только цинк, кадмий и магний могут быть в контакте с алюминием без возникновения гальванической коррозии. Заметим, что применение кадмиевых покрытий в значительной степени ограничено из-за их экологической небезопасности.
Рисунок 11 [1]
Рисунок 12 [1]
Источники:
- TALAT 5104.
- Corrosion of Aluminum and Aluminum Alloys. Edited by J.R. Davis. – ASM International, 1999.
- Corrosion of Aluminium / Christian Vargel – ELSEVIER, 2004
- TALAT 1252
Гальванические пары металлов
Задать вопрос
раздел статьи
оглавление
контакты
Обучение и техническая поддержка для проектировщика на Prof-il.ru
Вы здесь:
оглавление//
гальванические пары металлов
Гальванические пары металлов
Атмосферная коррозионная стойкость алюминия обьясняется наличием оксидной пленки, образующейся сразу после взаимодействия металла с кислородом воздуха (Литер. : В.Ф. Хенли “Анодное оксидирование алюминия и его сплавов”).
: В.Ф. Хенли “Анодное оксидирование алюминия и его сплавов”).
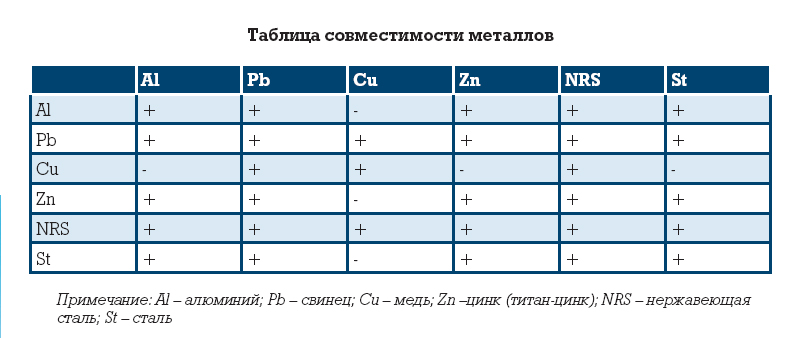
Табл. 1 Совместимость металлов и сплавов
С – совместимые
Н – несовместимые
П – совместимые при пайке, но несовместимые при непосредственном соприкосновении, так как образуют гальваническую пару
ПОС – припой оловянно-свинцовый
Сталь – нелегированная
Пример нежелательных гальванических пар:
1 ПАРА: алюминий и все сплавы на его основе не рекомендуется и недопустимо сочетать:
– с медью и ее сплавами
– с серебром
– с золотом
– с платиной
– с палладием
– с родием
– с оловом
– с никелем
– с хромом
2 ПАРА: алюминий и все сплавы на его основе не рекомендуется и недопустимо сочетать:
– с титаном и с его сплавами
3 ПАРА: магниево-алюминиевые сплавы не рекомендуется и недопустимо сочетать:
– с хромом
– со свинцом
– со сталью легированной и нелегированной
– с медью
– с серебром
– с золотом
– с платиной
– с палладием
– с родием
– с оловом
– с никелем
4 ПАРА: цинк и его сплавы не рекомендуется и недопустимо сочетать:
– с медью и ее сплавами
– с серебром
– с золотом
– с платиной
– с палладием
– с родием
5 ПАРА: никель и хром не рекомендуется и недопустимо сочетать:
– с медью и ее сплавами
– с серебром
– с золотом
– с платиной
– с палладием
– с родием
6 ПАРА: сталь нелегированная, олово, свинец, кадмий не рекомендуется и недопустимо сочетать:
– с серебром
– с золотом
– с платиной
– с палладием
– с родием
Рисунок 1 – Гальваническая коррозия двух деталей из разнородных металлов
Гальваническая коррозия более активного металла начинается в тот момент, когда две или более детали из разнородных металлов, имеющие взаимный контакт (благодаря обычному соприкосновению, или же посредством проводника) помещаются в электролит (любую жидкость, проводящую электричество).![]() Электролитом может быть что угодно, за исключением химически чистой воды. Не только соленая морская, но и обычная вода из-под крана благодаря наличию минеральных веществ является превосходным электролитом, и с ростом температуры электропроводность ее только растет.
Электролитом может быть что угодно, за исключением химически чистой воды. Не только соленая морская, но и обычная вода из-под крана благодаря наличию минеральных веществ является превосходным электролитом, и с ростом температуры электропроводность ее только растет.
Катод — электрод, на котором происходит процесс восстановления, а анод — это электрод, где протекают окислительные процессы.
Ряд активности металлов (электрохимический ряд напряжений металлов)
1 – Активные металлы
2 – Металлы средней активности
3 – Неактивные металлы
Химическая коррозия – металлы защищают себя оксидной пленкой на своей поверхности, является ли она самовосстанавливающейся, вот вопрос, как в случае алюминия, нержавеющей стали, цветных металлов или же как у стали отделяется.
Рис 2 – многослойная панель на основе сотового или гофро алюминия “Perfaten”
Рис 3 – угловое соединение многослойной панели
Статья “Алюминиевая кассета”, ссылка
Рис 4 – структура многослойной панели
Размеры: H= от 6 до 50мм. наверх
наверх
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник: http://prof-il.ru
Защита соединений алюминий-медь HVAC/R
Защита алюминий-медь HVAC
В отрасли HVAC/Холодильного оборудования многие компоненты переходят с меди на алюминий. Причины? Алюминий менее дорог по весу, более устойчив к коррозии, весит меньше и поддерживает скорость теплопередачи, аналогичную меди.
Эти алюминиевые детали соединяются с остальными компонентами HVAC/R с помощью пайки. Соединения алюминий-медь можно припаивать сплавами Lucas-Milhaupt AL 802 или AL 718 с флюсовой сердцевиной Handy One®. Флюс в этих паяльных стержнях не вызывает коррозии, и его не нужно удалять из соединения после пайки.
Однако влажная среда, в которой используются блоки HVAC/R, может привести к гальванической коррозии соединения алюминия с медью. Поэтому суставы необходимо беречь. Давайте рассмотрим эту проблему и возможные решения.
Гальваническая коррозия
Каждый металл или проводящий материал имеет разный гальванический потенциал. Если два металла с разными потенциалами соприкоснуться друг с другом в присутствии электролита, между ними будет протекать ток. Тогда обратный ток будет течь через электролит от менее благородного металла к более благородному. В среде HVAC/R дождь и конденсат действуют как электролит в процессе коррозии, обеспечивая соединение для запуска потока электронов между медными и алюминиевыми трубками.
Если два металла с разными потенциалами соприкоснуться друг с другом в присутствии электролита, между ними будет протекать ток. Тогда обратный ток будет течь через электролит от менее благородного металла к более благородному. В среде HVAC/R дождь и конденсат действуют как электролит в процессе коррозии, обеспечивая соединение для запуска потока электронов между медными и алюминиевыми трубками.
Менее благородный материал становится анодом, а более благородный – катодом. Менее благородный материал жертвует собой ради более благородного; в этом случае алюминий приносится в жертву, а медь остается неповрежденной. Когда в паяных соединениях участвуют разнородные материалы, находящиеся в прямом контакте, всегда учитывайте возможность гальванической коррозии.
Скорость коррозии напрямую зависит от разницы потенциалов между двумя материалами и окружающей средой. Согласно Справочнику по пайке алюминиевых сплавов: скорость коррозии паяного алюминиевого соединения, полностью лишенного флюса, в присутствии влаги, напрямую связана с разностью потенциалов раствора, которая может существовать между участвующими сплавами. Чем ниже разность потенциалов, тем ниже скорость коррозии. Различия потенциалов менее 0,013 вольта обычно считаются незначительными. Пример гальванической диаграммы для электролита морской воды показан на рисунке 1. Диаграмма используется только в иллюстративных целях.
Чем ниже разность потенциалов, тем ниже скорость коррозии. Различия потенциалов менее 0,013 вольта обычно считаются незначительными. Пример гальванической диаграммы для электролита морской воды показан на рисунке 1. Диаграмма используется только в иллюстративных целях.
Рисунок 1: Гальваническая диаграмма. Самые благородные материалы (слева) выживают. Наименее благородные материалы (справа) приносятся в жертву. В HVAC/R алюминий жертвует (коррозирует), чтобы медь выжила (осталась незатронутой коррозионной средой). Цинк может пожертвовать, чтобы сохранить как алюминий, так и медь.
Источник: Atlas Steels, температура морской воды и окружающей среды. Защитные покрытия
Производители предотвращают гальваническую коррозию, изолируя соединения алюминия и меди от окружающей среды. Есть несколько продуктов, которые хорошо работают, даже если они не созданы специально для этой отрасли. Производители «нестандартно мыслили», чтобы найти следующие решения:
- ZRC® Cold-Galvanized Compound (zrcworldwide.
 com) — это цинковое покрытие, наносимое распылением или кистью. Поскольку цинк не очень благородный металл, он действует как анод, который жертвует собой, чтобы спасти как алюминий, так и медь в условиях гальванической коррозии.
com) — это цинковое покрытие, наносимое распылением или кистью. Поскольку цинк не очень благородный металл, он действует как анод, который жертвует собой, чтобы спасти как алюминий, так и медь в условиях гальванической коррозии.
- Permatex® Spray Sealant Leak Repair (permatex.com) — этот продукт предназначен для устранения утечек в автомобильных двигателях, но его также можно использовать для герметизации соединений медь-алюминий от окружающей среды. При распылении на поверхность стыка образует воздухонепроницаемое резиновое уплотнение над паяным соединением.
- Термоусадочная трубка 3MTM EPS-300 (3M.com) — эта трубка предназначена для защиты электрических компонентов и жгутов проводов от окружающей среды. Это резиновая трубка, которая сжимается при нагревании. Как только трубка усаживается на поверхность соединения меди с алюминием, она выделяет расплавленный клей, который дополнительно защищает поверхность от коррозии.
ЗАКЛЮЧЕНИЕ:
В отрасли HVAC/R многие компоненты переходят с меди на алюминий. Эти алюминиевые детали обычно соединяются с медными компонентами холодильного оборудования и могут быть спаяны припоем Lucas-Milhaupt AL 802 или AL 718 с порошковой проволокой. Однако соединения должны быть защищены от гальванической коррозии в среде HVAC/R с помощью решений, включающих цинковое покрытие ZRC, воздухонепроницаемое резиновое уплотнение Permatex или термоусадочную трубку 3M.
Эти алюминиевые детали обычно соединяются с медными компонентами холодильного оборудования и могут быть спаяны припоем Lucas-Milhaupt AL 802 или AL 718 с порошковой проволокой. Однако соединения должны быть защищены от гальванической коррозии в среде HVAC/R с помощью решений, включающих цинковое покрытие ZRC, воздухонепроницаемое резиновое уплотнение Permatex или термоусадочную трубку 3M.
Спасибо, что присоединились к нам сегодня! Lucas-Milhaupt занимается предоставлением экспертной информации для улучшения пайки; Пожалуйста, не стесняйтесь поделиться этой записью в блоге с коллегами. Демонстрацию соединения алюминия с медью смотрите в нашем видео. Как всегда, обращайтесь к Lucas-Milhaupt, когда мы можем быть вам полезны.
Гальваническая коррозия алюминиево-медных модельных сплавов
%PDF-1.4
%
1 0 объект
>
эндообъект
10 0 объект
/Заголовок
/Предмет
/Автор
/Режиссер
/Ключевые слова
/ Дата создания (D: 20230703084937-00’00’)
/ModDate (D:20130329134637+01’00’)
>>
эндообъект
2 0 объект
>
эндообъект
3 0 объект
>
эндообъект
4 0 объект
>
эндообъект
5 0 объект
>
эндообъект
6 0 объект
>
эндообъект
7 0 объект
>
транслировать
Acrobat Distiller 7.