Коагуляция воды
Слово «коагуляция» латинского происхождения и означает свертывание.
Коагуляцией называется процесс укрупнения коллоидных частиц, завершающийся выпадением вещества в осадок, удаляемый осаждением или фильтрованием.
Коллоидные растворы отличаются высокой устойчивостью, потому что коллоидные частицы обладают одноименным электрическим зарядом и взаимно отталкиваются, что препятствует их укрупнению. Для устранения этого препятствия в обрабатываемую воду, содержащую обычно отрицательно заряженные коллоидные частицы, вводят искусственно созданные коллоидные частицы, имеющие положительный электрический заряд. Эти реагенты называют коагулянтами. Их взаимодействие приводит к взаимному притяжению, нейтрализации зарядов и укрупнению частиц.
К положительно заряженным коллоидам
относятся гидраты окислов металлов, из
которых наибольшее применение получили
гидраты окислов алюминия Al(OH)
Для получения этих коллоидов в воду вводят хорошо растворимые соли этих металлов, которые в результате гидролиза образуют малорастворимые гидраты окислов, выпадающие в виде коллоидных частиц с положительным зарядом.
На химводоочистках в качестве коагулянтов применяют сернокислое железо Fe(SO4) 7H2O и сернокислый алюминий Al2(SO4)3 18H2O, дозируемые в обрабатываемую воду в виде разбавленных растворов 5-10% концентрации.
Процесс образования коллоидов можно представить в виде двух последовательных стадий:
растворение и электролитическая диссоциация солей алюминия и железа
Al2(SO4)3 = 2Al3++3SO42-
FeSO4 = Fe2+
+SO42-гидролиз солей:
а) сернокислого алюминия
в молекулярном виде
Al2(SO4)3 + 6H2O = 2Al(OH)3 + 3 H2SO4
в ионно-молекулярном виде
2Al3+ + 3SO42- + 6H2O = 2Al(OH)3 + 6H+ + 3SO42-
исключив из уравнения те ионы, которые не изменяются в ходе реакций, получим
2Al3+ + 6H2O = 2Al(OH)3 + 6H+
б) сернокислого железа
в молекулярном виде
FeSO4 + 2 Н2О = Fe(OH)2 + H2SO4
Fe2++ SO42- + 2 Н2О = Fe(OH)2 + 2H+ + SO42-
в сокращенном виде
Fe2++2 Н2О = Fe(OH)2 + 2H+
гидрат закиси
При взаимодействии с кислородом, растворенным в воде, гидрат закиси железа переходит в гидрат окиси железа, выпадающий в виде хлопьев:
4 Fe(OH)2 + О2 + 2Н2О = 4 Fe(OH)3
гидрат окиси
Образование гидроокисей алюминия и железа связано с появлением в воде катионов водорода, которые связываются с присутствующими в природной воде бикарбонатными анионами с образованием воды и углекислого газа
H+ + = Н2СО3 = Н2О + СО2↑
Следовательно,
при коагуляции щелочность воды
уменьшается. Поэтому в тех случаях,
когда щелочность обрабатываемой воды
недостаточна, ее необходимо подщелачивать
во избежание получения после коагуляции
кислой воды.
Поэтому в тех случаях,
когда щелочность обрабатываемой воды
недостаточна, ее необходимо подщелачивать
во избежание получения после коагуляции
кислой воды.
Известкование воды производится в тех случаях, когда необходимо снизить щелочность исходной воды.
При известковании в воду дозируют 0,1% раствор известкового молока Са(ОН)2. Для приготовления известкового молока гасят известь
СаО + Н2О = Са(ОН)2
Известковое молоко подается в осветлитель-отстойник, где перемешивается с обрабатываемой водой
Са(НСО3)2 + Са(ОН)2 = 2СаСО3↓+ 2Н2
Mg(HCO3)2 + Са(ОН)2 = Mg(OH)2↓ + 2CaCO3↓ + 2Н2О
Кроме того, СО2, растворенный в воде, также связывается известковым молоком
Са(ОН)2 + СО2 = CaCO3↓ + Н2О
Вывод: при известковании снижается
карбонатная жесткость, щелочность воды,
частично удаляется углекислый газ,
уменьшается сухой остаток, так как CaCO3 и Mg(OH)2 выпадают в осадок.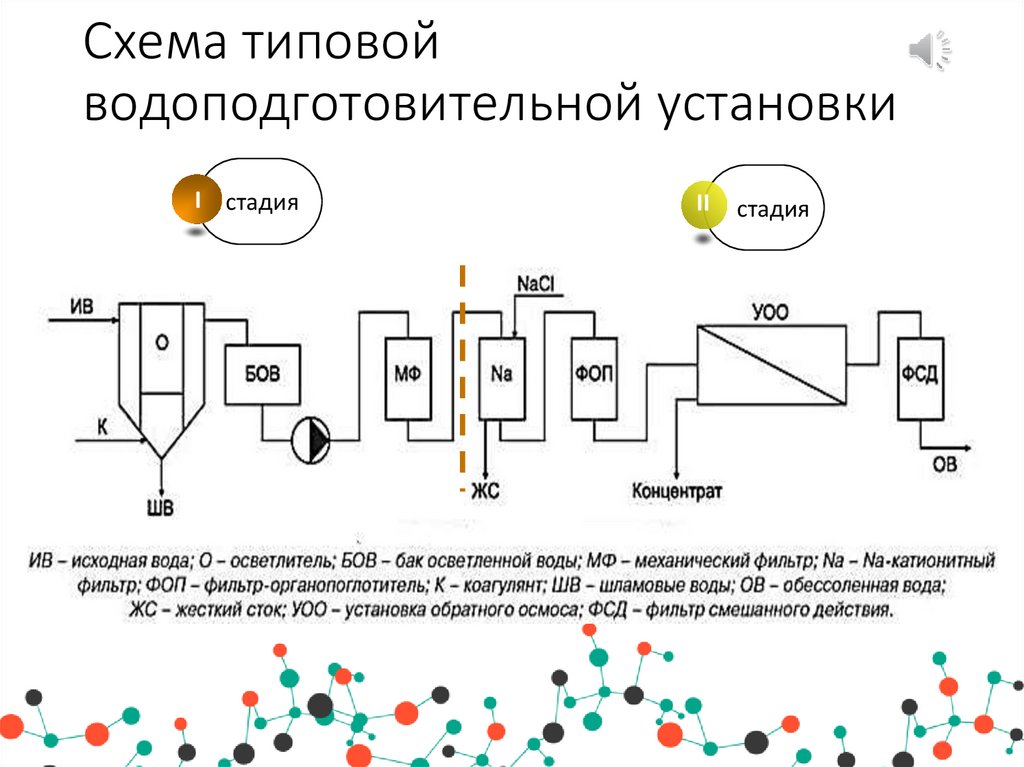
Известкование и коагуляцию проводят в специальных осветлителях-отстойниках, а затем воду подают в осветлительный (механический) фильтр.
Жесткость воды: способы умягчения и технологические схемы | C.O.K. archive | 2004
Роль воды в жизни и быту человека, в промышленности и сельском хозяйстве трудно переоценить. Об этом достаточно подробно сказано в статье [1]. Здесь мы остановимся на понятии «жесткость воды» — оно широко используется и в быту, и в промышленности.
4. Характеристики и свойства жесткой воды К слабодиссоциирующим основаниям относятся гидроксиды кальция и магния. Поскольку в жесткой воде содержатся ионы Са2+ и Mg2+, они участвуют в реакции гидролиза — взаимодействия с продуктами диссоциации воды: ~1~(3) В результате в растворе появляется избыточный водородный ион и жесткая вода «подкисляется», рН (отрицательный логарифм концентрации водородного иона) при этом снижается по сравнению с нейтральным и становится меньше 7..jpg) Чем выше ОЖ воды, тем ниже значение рН. К слабодиссоциирующим кислотам относится угольная кислота. Вода с карбонатной жесткостью содержит ионы НСО3 – и СО3 2–, а они участвуют в реакции гидролиза — взаимодействия с продуктами диссоциации воды: ~2~(4) В результате в растворе появляется избыточный гидроксильный ион, и вода с карбонатной жесткостью становится «щелочной», рН при этом повышается по сравнению с нейтральным и становится больше 7. Чем выше КЖ воды, тем выше значение рН. Обычно в воде общая и карбонатная жесткость встречаются одновременно, но не всегда равны друг другу. Как следствие рН такой воды будет выше или ниже 7 в зависимости от соотношения карбонатной и общей жесткости. Важной характеристикой воды является так называемая «щелочность», под которой понимают количество кислоты, способное нейтрализовать все анионы, придающие воде щелочность. На практике щелочность совпадает с карбонатной жесткостью, т.к. в результате химической реакции карбонатов и гидрокарбонатов с кислотой образуется угольная кислота, легко разлагающаяся на воду и летучее СО2.
Чем выше ОЖ воды, тем ниже значение рН. К слабодиссоциирующим кислотам относится угольная кислота. Вода с карбонатной жесткостью содержит ионы НСО3 – и СО3 2–, а они участвуют в реакции гидролиза — взаимодействия с продуктами диссоциации воды: ~2~(4) В результате в растворе появляется избыточный гидроксильный ион, и вода с карбонатной жесткостью становится «щелочной», рН при этом повышается по сравнению с нейтральным и становится больше 7. Чем выше КЖ воды, тем выше значение рН. Обычно в воде общая и карбонатная жесткость встречаются одновременно, но не всегда равны друг другу. Как следствие рН такой воды будет выше или ниже 7 в зависимости от соотношения карбонатной и общей жесткости. Важной характеристикой воды является так называемая «щелочность», под которой понимают количество кислоты, способное нейтрализовать все анионы, придающие воде щелочность. На практике щелочность совпадает с карбонатной жесткостью, т.к. в результате химической реакции карбонатов и гидрокарбонатов с кислотой образуется угольная кислота, легко разлагающаяся на воду и летучее СО2.

 При соотношении [HCO3 –]: [h3CO3] в диапазоне 1:100–100:1 бикарбонатная буферность обеспечивает изменения рН раствора в диапазоне 4,37–8,37. Аналогично при отношении [CO3 2–]: [HCO3 –] в диапазоне 1:100–100:1 карбонатная буферность обеспечивает изменение рН раствора в диапазоне 8,25–12,25. Растворимость СО2 в жесткой воде в диапазоне изменения рН = 6–8,5 определяется в том числе величиной карбонатной жесткости (КЖ) и может быть рассчитана по аппроксимационному уравнению с ошибкой s = ±0,02 мгэкв/л: ~7~ Коэффициент множественной корреляции R2 = 0,9906. Уравнение показывает, что растворимость углекислоты растет линейно с ростом КЖ. Это значит, что жесткая и очень жесткая вода при охлаждении в градирне достаточно интенсивно поглощает углекислоту из воздуха, что затем приводит к отложениям карбоната кальция на поверхностях теплообмена. А подпитка градирни (восполнение потерь воды за счет испарения) и постоянный контакт с воздухом — бесконечный источник образования карбонатной накипи. Логичным техническим решением в данном случае могла бы быть очистка подпиточной воды от Са2+ и Mg2+ (снижение ОЖ).
При соотношении [HCO3 –]: [h3CO3] в диапазоне 1:100–100:1 бикарбонатная буферность обеспечивает изменения рН раствора в диапазоне 4,37–8,37. Аналогично при отношении [CO3 2–]: [HCO3 –] в диапазоне 1:100–100:1 карбонатная буферность обеспечивает изменение рН раствора в диапазоне 8,25–12,25. Растворимость СО2 в жесткой воде в диапазоне изменения рН = 6–8,5 определяется в том числе величиной карбонатной жесткости (КЖ) и может быть рассчитана по аппроксимационному уравнению с ошибкой s = ±0,02 мгэкв/л: ~7~ Коэффициент множественной корреляции R2 = 0,9906. Уравнение показывает, что растворимость углекислоты растет линейно с ростом КЖ. Это значит, что жесткая и очень жесткая вода при охлаждении в градирне достаточно интенсивно поглощает углекислоту из воздуха, что затем приводит к отложениям карбоната кальция на поверхностях теплообмена. А подпитка градирни (восполнение потерь воды за счет испарения) и постоянный контакт с воздухом — бесконечный источник образования карбонатной накипи. Логичным техническим решением в данном случае могла бы быть очистка подпиточной воды от Са2+ и Mg2+ (снижение ОЖ).
 Из свойств солей, обуславливающих жесткость воды, естественно вытекают методы ее умягчения, аппаратурные решения и технологические схемы. 5.1. Термическое умягчение воды Растворимость малорастворимых солей жесткости падает с ростом температуры раствора. Лет тридцать назад автору этой статьи при составлении патентных обзоров попадалось довольно много патентов, в которых предлагалось нагреть жесткую воду, заставить кристаллизоваться (выпасть в осадок) соли жесткости, а умягченную таким образом воду использовать в технологическом процессе. Действительно, нагревая до 120–200°С очень жесткую воду, например, с общей жесткостью 17 мгэкв/л, и заставляя карбонат кальция выпадать в осадок, можно снизить как карбонатную, так и общую жесткость в 620–3700 раз. Технико-экономические проблемы, которые при этом надо решать: . дешевое тепло; . быстрая кристаллизация карбоната кальция желательно в объеме раствора; . фильтрация осадка; . очистка поверхностей оборудования для термического умягчения воды от карбоната кальция.
Из свойств солей, обуславливающих жесткость воды, естественно вытекают методы ее умягчения, аппаратурные решения и технологические схемы. 5.1. Термическое умягчение воды Растворимость малорастворимых солей жесткости падает с ростом температуры раствора. Лет тридцать назад автору этой статьи при составлении патентных обзоров попадалось довольно много патентов, в которых предлагалось нагреть жесткую воду, заставить кристаллизоваться (выпасть в осадок) соли жесткости, а умягченную таким образом воду использовать в технологическом процессе. Действительно, нагревая до 120–200°С очень жесткую воду, например, с общей жесткостью 17 мгэкв/л, и заставляя карбонат кальция выпадать в осадок, можно снизить как карбонатную, так и общую жесткость в 620–3700 раз. Технико-экономические проблемы, которые при этом надо решать: . дешевое тепло; . быстрая кристаллизация карбоната кальция желательно в объеме раствора; . фильтрация осадка; . очистка поверхностей оборудования для термического умягчения воды от карбоната кальция. 5.2. Химическое умягчение воды На ТЭЦ воду, заполняющую теплотрассы и являющуюся теплоносителем, умягчают до содержания солей жесткости 1,1–1,5 мгэкв/л. Чаще всего применяются два метода химического умягчения: известковый и известково-содовый [4], [5]. Другие методы умягчения, описанные в литературе, применяются гораздо реже. Сущность химических методов очистки заключается в переводе ионов Са2+ и Мg2+ в соединения с ограниченной растворимостью: карбонат кальция СаСО3 и гидроксид магния Мg(ОН)2. Критериями выбора конкретного метода очистки раствора являются общая жесткость сырой (неумягченной) воды, стоимость и доступность осадительных реагентов, возможность использования коагулянтов или флокулянтов. Известковый метод (очистка суспензией гидроксида кальция, известковым молоком) применяется для умягчения «довольного жесткой» воды (см. табл. 1) и предусматривает образование гидроксида магния в соответствии с химической реакцией: Мg2+ + 2OH– = Mg(OH)2↓. (5) Знак ↓ указывает, что данное соединение выпадает в осадок.
5.2. Химическое умягчение воды На ТЭЦ воду, заполняющую теплотрассы и являющуюся теплоносителем, умягчают до содержания солей жесткости 1,1–1,5 мгэкв/л. Чаще всего применяются два метода химического умягчения: известковый и известково-содовый [4], [5]. Другие методы умягчения, описанные в литературе, применяются гораздо реже. Сущность химических методов очистки заключается в переводе ионов Са2+ и Мg2+ в соединения с ограниченной растворимостью: карбонат кальция СаСО3 и гидроксид магния Мg(ОН)2. Критериями выбора конкретного метода очистки раствора являются общая жесткость сырой (неумягченной) воды, стоимость и доступность осадительных реагентов, возможность использования коагулянтов или флокулянтов. Известковый метод (очистка суспензией гидроксида кальция, известковым молоком) применяется для умягчения «довольного жесткой» воды (см. табл. 1) и предусматривает образование гидроксида магния в соответствии с химической реакцией: Мg2+ + 2OH– = Mg(OH)2↓. (5) Знак ↓ указывает, что данное соединение выпадает в осадок. При этом образование карбоната кальция с последующей кристаллизацией возможно при наличии карбонатной жесткости. При постоянном произведении растворимости [3] за счет смещения равновесия по уравнению (5) поступающее с известковым молоком избыточное количество ионов кальция приводит к кристаллизации карбоната кальция Са2+ + СО3 2– = СаСО3↓. (6) В методе скрыт парадокс: известковое молоко поставляет в жесткую воду гидроксид-ион, осаждающий магний. При этом к воде добавляется дополнительное количество иона кальция, осаждающего карбонат-ион, но загрязняющего при передозировке воду кальцием. Дозировка известкового молока становится проблемой, т.к. зависит от КЖ исходной воды (величина переменная, зависящая от углекислотного равновесия) и от ее ОЖ. Передозировка известкового молока приводит к тем же последствиям, что и недостача. Известково-содовый метод применяется для умягчения «жесткой» и «очень жесткой» воды (см. табл. 1~8~), когда общая жесткость существенно превышает карбонатную. В этом методе очистки гидроксид магния и карбонат кальция образуются по тем же ионно-молекулярным уравнениям (5) и (6).
При этом образование карбоната кальция с последующей кристаллизацией возможно при наличии карбонатной жесткости. При постоянном произведении растворимости [3] за счет смещения равновесия по уравнению (5) поступающее с известковым молоком избыточное количество ионов кальция приводит к кристаллизации карбоната кальция Са2+ + СО3 2– = СаСО3↓. (6) В методе скрыт парадокс: известковое молоко поставляет в жесткую воду гидроксид-ион, осаждающий магний. При этом к воде добавляется дополнительное количество иона кальция, осаждающего карбонат-ион, но загрязняющего при передозировке воду кальцием. Дозировка известкового молока становится проблемой, т.к. зависит от КЖ исходной воды (величина переменная, зависящая от углекислотного равновесия) и от ее ОЖ. Передозировка известкового молока приводит к тем же последствиям, что и недостача. Известково-содовый метод применяется для умягчения «жесткой» и «очень жесткой» воды (см. табл. 1~8~), когда общая жесткость существенно превышает карбонатную. В этом методе очистки гидроксид магния и карбонат кальция образуются по тем же ионно-молекулярным уравнениям (5) и (6). Этот метод позволяет более глубоко очистить раствор от кальция и магния, но вынуждает при этом затрачивать дорогостоящую кальцинированную соду на очистку от кальция, внесенного в раствор вместе с известковым молоком. Сложность решаемой задачи — химического умягчения природного раствора от загрязняющих примесей — заключается в том, что это многостадийный процесс, на каждой стадии которого протекает столько реакций (процессов), сколько в исходном растворе загрязняющих примесей. И даже больше. Естественно, что все процессы, запускаясь независимо, тем не менее взаимосвязаны. При этом у каждой реакции, у каждого процесса своя скорость протекания, своя температурная зависимость. Если к этому добавить, что все сведения о растворимости, влиянии температуры, константах реакциях и др., приведенные в справочниках, получены в равновесных условиях и системах, состоящих, как правило, только из двух компонентов— растворителя и растворенного вещества, а на практике приходится иметь дело с принципиально неравновесными процессами и многокомпонентными растворами, то точное описание и расчет химического умягчения воды кажется в принципе невозможным.
Этот метод позволяет более глубоко очистить раствор от кальция и магния, но вынуждает при этом затрачивать дорогостоящую кальцинированную соду на очистку от кальция, внесенного в раствор вместе с известковым молоком. Сложность решаемой задачи — химического умягчения природного раствора от загрязняющих примесей — заключается в том, что это многостадийный процесс, на каждой стадии которого протекает столько реакций (процессов), сколько в исходном растворе загрязняющих примесей. И даже больше. Естественно, что все процессы, запускаясь независимо, тем не менее взаимосвязаны. При этом у каждой реакции, у каждого процесса своя скорость протекания, своя температурная зависимость. Если к этому добавить, что все сведения о растворимости, влиянии температуры, константах реакциях и др., приведенные в справочниках, получены в равновесных условиях и системах, состоящих, как правило, только из двух компонентов— растворителя и растворенного вещества, а на практике приходится иметь дело с принципиально неравновесными процессами и многокомпонентными растворами, то точное описание и расчет химического умягчения воды кажется в принципе невозможным. Перечислим стадии химического умягчения воды и протекающие на каждой стадии процессы. Добавление к жесткой воде осадительных реагентов запускает химические реакции (5) и (6). Образование новых веществ в системе — гидроксида магния и карбоната кальция — создает пересыщение по этим веществам, запускает процессы зародышеобразования новых фаз (кристаллических гидрооксида магния, карбоната кальция) и роста образующихся кристаллов, т.е. процессы кристаллизации. Если в раствор добавляют коагулянт — соли железа или алюминия, идут процессы окисления двухвалентного железа до трехвалентного, гидролиза ионов с образованием гидроксидов железа или алюминия, их кристаллизация. Как только появляется твердая поверхность, аморфная или кристаллическая, на ней адсорбируются ионы, молекулы воды и содержащиеся в растворе примеси. Образуется двойной электрический слой. Знак и величина двойного электрического слоя определяется свободной поверхностной энергией поверхности конкретной частицы, составом окружающей ее среды, концентрацией и сродством ионов и молекул к данной поверхности.
Перечислим стадии химического умягчения воды и протекающие на каждой стадии процессы. Добавление к жесткой воде осадительных реагентов запускает химические реакции (5) и (6). Образование новых веществ в системе — гидроксида магния и карбоната кальция — создает пересыщение по этим веществам, запускает процессы зародышеобразования новых фаз (кристаллических гидрооксида магния, карбоната кальция) и роста образующихся кристаллов, т.е. процессы кристаллизации. Если в раствор добавляют коагулянт — соли железа или алюминия, идут процессы окисления двухвалентного железа до трехвалентного, гидролиза ионов с образованием гидроксидов железа или алюминия, их кристаллизация. Как только появляется твердая поверхность, аморфная или кристаллическая, на ней адсорбируются ионы, молекулы воды и содержащиеся в растворе примеси. Образуется двойной электрический слой. Знак и величина двойного электрического слоя определяется свободной поверхностной энергией поверхности конкретной частицы, составом окружающей ее среды, концентрацией и сродством ионов и молекул к данной поверхности. Двойной электрический слой является движущей силой процесса коагуляции. Коагуляция приводит к слипанию разнородных частиц в крупные агрегаты — флокулы. После этого суспензия, состоящая из флокул, готова к разделению на твердую и жидкую фазу, что и реализуется в гравитационном поле отстаиванием — осветлением. Каждый из перечисленных процессов протекает со своей скоростью, по-своему реагирует на температуру. Все перечисленные процессы запускаются независимо, но взаимосвязаны через концентрацию отдельных компонентов, через балансы прихода-расхода, тепломассообмен. В результате, одним из важнейших факторов управления системой является гидродинамика — интенсивность перемешивания компонентов. Обычно на ТЭС (и на АЭС тоже) используется технологическая схема химического умягчения воды, в которой все вышеописанные многочисленные и взаимосвязанные процессы осуществляются в нижней части осветлителя —аппарата, предназначенного для гравитационного разделения твердой и жидкой фаз. Естественно, что такое техническое решение очень усложняет задачу производственного персонала по управлению процессом умягчения.
Двойной электрический слой является движущей силой процесса коагуляции. Коагуляция приводит к слипанию разнородных частиц в крупные агрегаты — флокулы. После этого суспензия, состоящая из флокул, готова к разделению на твердую и жидкую фазу, что и реализуется в гравитационном поле отстаиванием — осветлением. Каждый из перечисленных процессов протекает со своей скоростью, по-своему реагирует на температуру. Все перечисленные процессы запускаются независимо, но взаимосвязаны через концентрацию отдельных компонентов, через балансы прихода-расхода, тепломассообмен. В результате, одним из важнейших факторов управления системой является гидродинамика — интенсивность перемешивания компонентов. Обычно на ТЭС (и на АЭС тоже) используется технологическая схема химического умягчения воды, в которой все вышеописанные многочисленные и взаимосвязанные процессы осуществляются в нижней части осветлителя —аппарата, предназначенного для гравитационного разделения твердой и жидкой фаз. Естественно, что такое техническое решение очень усложняет задачу производственного персонала по управлению процессом умягчения. На рис. 1 ~9~ приведена схема установки по химическому умягчению воды, разработанная автором этой статьи, опытно-промышленная проверка которой выполнена на Кременчугской ТЭС. В разработке сделана попытка разделить по возможности отдельные процессы, протекающие при химическом умягчении воды, за счет удаления их из нижней части осветлителя и перенос в каскад статических реакторов-смесителей [6]. В разработке использованы некоторые технические решения, применяемые на Западе в химической промышленности и на ТЭС. Например, конструкция осветлителя, который поставляли на рынок французская фирма DEGREMONT и акционерное общество «ЭНСО-Гутцейт» (Финляндия) еще в 80-х годах ХХ столетия. Поступающая на химическое умягчение вода без предварительной дегазации (насосы могут подсасывать воздух) проходит магнито-гидродинамический (МГД) резонатор 6, каскад реакторов 7, в каждый из которых подается определенное количество осадительного реагента, обеспечивается определенная интенсивность перемешивания и время пребывания образующейся суспензии.
На рис. 1 ~9~ приведена схема установки по химическому умягчению воды, разработанная автором этой статьи, опытно-промышленная проверка которой выполнена на Кременчугской ТЭС. В разработке сделана попытка разделить по возможности отдельные процессы, протекающие при химическом умягчении воды, за счет удаления их из нижней части осветлителя и перенос в каскад статических реакторов-смесителей [6]. В разработке использованы некоторые технические решения, применяемые на Западе в химической промышленности и на ТЭС. Например, конструкция осветлителя, который поставляли на рынок французская фирма DEGREMONT и акционерное общество «ЭНСО-Гутцейт» (Финляндия) еще в 80-х годах ХХ столетия. Поступающая на химическое умягчение вода без предварительной дегазации (насосы могут подсасывать воздух) проходит магнито-гидродинамический (МГД) резонатор 6, каскад реакторов 7, в каждый из которых подается определенное количество осадительного реагента, обеспечивается определенная интенсивность перемешивания и время пребывания образующейся суспензии. Естественно, что сильнокислый коагулянт — сернокислое железо —подается в последний по ходу движения жидкости реактор-смеситель. Тем самым предотвращается нецелесообразное расходование известкового молока и повышается точность дозировки коагулянта. Как следствие, только на этом достигается экономия осадительных реагентов. Образовавшаяся суспензия вместе с воздухом поступает через струйный насос 3 в камеру воздухоотделения и созревания флокул 4, которая встроена в осветлитель 2. Воздух отделяется и удаляется через воздухоотделитель 1. Потоки в камере созревания флокул направлены так, что мелкие частицы в принципе не могут попасть на слив осветлителя. Крупные флокулы, накопленные в нижней части камеры созревания, создают шламовый фильтр, растут за счет мелких частиц и выводятся по мере укрупнения под действием силы тяжести в донную часть осветлителя. Накапливающийся шлам выводится самотеком в шламонакопитель. Умягченная вода, профильтровавшись через слой крупных флокул в донной части осветлителя, поднимается к переливу в его верхней части и далее поступает в сборник осветленной и умягченной воды.
Естественно, что сильнокислый коагулянт — сернокислое железо —подается в последний по ходу движения жидкости реактор-смеситель. Тем самым предотвращается нецелесообразное расходование известкового молока и повышается точность дозировки коагулянта. Как следствие, только на этом достигается экономия осадительных реагентов. Образовавшаяся суспензия вместе с воздухом поступает через струйный насос 3 в камеру воздухоотделения и созревания флокул 4, которая встроена в осветлитель 2. Воздух отделяется и удаляется через воздухоотделитель 1. Потоки в камере созревания флокул направлены так, что мелкие частицы в принципе не могут попасть на слив осветлителя. Крупные флокулы, накопленные в нижней части камеры созревания, создают шламовый фильтр, растут за счет мелких частиц и выводятся по мере укрупнения под действием силы тяжести в донную часть осветлителя. Накапливающийся шлам выводится самотеком в шламонакопитель. Умягченная вода, профильтровавшись через слой крупных флокул в донной части осветлителя, поднимается к переливу в его верхней части и далее поступает в сборник осветленной и умягченной воды. Такая технология позволяет увеличить производительность осветлителя в два раза, снизить расход реагентов, повысить качество очистки, уменьшить объем жидких стоков, удаляемых из химцеха ТЭС в виде шлама. Но без МГДрезонатора в голове процесса эксплуатация этой технологической схемы невозможна: кристаллизующийся карбонат кальция будет откладываться на стенках статических реакторов-смесителей и трубопровода, увеличивая их гидравлическое сопротивление и затрудняя эксплуатацию. Если из этой схемы удалить МГД-резонатор, каскад статических реакторовсмесителей и внутреннюю «начинку» осветлителя, то мы вернемся к традиционной схеме химического умягчения воды, применяемой на всех ТЭС и АЭС Советского Союза и стран СНГ. 5.3. Безреагентная водоподготовка Безреагентная водоподготовка, или магнитная обработка воды, или магнитогидродинамический резонанс [1, 3] известен с 1936 г. Этот метод предотвращения отложений накипи на теплообменных поверхностях без нагрева не умягчает воду в том смысле, что не снижает ее карбонатную и общую жесткость.
Такая технология позволяет увеличить производительность осветлителя в два раза, снизить расход реагентов, повысить качество очистки, уменьшить объем жидких стоков, удаляемых из химцеха ТЭС в виде шлама. Но без МГДрезонатора в голове процесса эксплуатация этой технологической схемы невозможна: кристаллизующийся карбонат кальция будет откладываться на стенках статических реакторов-смесителей и трубопровода, увеличивая их гидравлическое сопротивление и затрудняя эксплуатацию. Если из этой схемы удалить МГД-резонатор, каскад статических реакторовсмесителей и внутреннюю «начинку» осветлителя, то мы вернемся к традиционной схеме химического умягчения воды, применяемой на всех ТЭС и АЭС Советского Союза и стран СНГ. 5.3. Безреагентная водоподготовка Безреагентная водоподготовка, или магнитная обработка воды, или магнитогидродинамический резонанс [1, 3] известен с 1936 г. Этот метод предотвращения отложений накипи на теплообменных поверхностях без нагрева не умягчает воду в том смысле, что не снижает ее карбонатную и общую жесткость. Но поскольку умягчение воды не является самоцелью и метод МГД-резонанса решает главную задачу умягчения — предотвращение карбонатных отложений — о нем не стоит забывать. Главные его преимущества перед известными методами умягчения воды — дешевизна и простота в эксплуатации. МГД-резонатор надо только смонтировать и настроить. Он не требует никаких эксплуатационных затрат. Механизм предотвращения накипеобразования на теплообменных поверхностях с помощью магнитной обработки— магнитогидродинамического резонанса — сводится к инициированию в воде структурной перестройки, фазового перехода второго рода (ФП2). В результате карбонат кальция, который обычно кристаллизуется в кристаллографической модификации кальцит, начинает кристаллизоваться в модификации арагонит. Арагонит не откладывается на теплообменных поверхностях. Более того, если отложения кальцита промывать «омагниченной водой», он переходит в арагонит, отложения разрыхляются, отслаиваются от поверхности и уносятся потоком воды. 5.4.
Но поскольку умягчение воды не является самоцелью и метод МГД-резонанса решает главную задачу умягчения — предотвращение карбонатных отложений — о нем не стоит забывать. Главные его преимущества перед известными методами умягчения воды — дешевизна и простота в эксплуатации. МГД-резонатор надо только смонтировать и настроить. Он не требует никаких эксплуатационных затрат. Механизм предотвращения накипеобразования на теплообменных поверхностях с помощью магнитной обработки— магнитогидродинамического резонанса — сводится к инициированию в воде структурной перестройки, фазового перехода второго рода (ФП2). В результате карбонат кальция, который обычно кристаллизуется в кристаллографической модификации кальцит, начинает кристаллизоваться в модификации арагонит. Арагонит не откладывается на теплообменных поверхностях. Более того, если отложения кальцита промывать «омагниченной водой», он переходит в арагонит, отложения разрыхляются, отслаиваются от поверхности и уносятся потоком воды. 5.4. Глубокое умягчение ионным обменом Во многих промышленных котельных умягчение воды до норм, предъявляемых к воде теплосетей, оказывается недостаточным, если вода используется для питания котлов высокого давления, работающих при давлениях свыше 70×105 Па = 70 атм. Напомним, что это соответствует температурам кипения воды свыше 285°С. В этом случае воду деминерализуют — подвергают глубокому умягчению, удаляя не только ОЖ и КЖ, но и значительную часть примесей. Давно и широко для этих целей применяется многоступенчатый ионный обмен на базе использования синтетических органических катионообменных и анионообменных смол. В зависимости от приходящих с водой загрязнений и желаемого качества очищенной воды используют ионообменные смолы различного типа и в разных комбинациях. 5.4.1. Общие представления об ионообменных смолах Промышленная деминерализация стала возможной только с развитием массового производства синтетических смол и появлением в продаже широкого ассортимента ионообменных смол.
Глубокое умягчение ионным обменом Во многих промышленных котельных умягчение воды до норм, предъявляемых к воде теплосетей, оказывается недостаточным, если вода используется для питания котлов высокого давления, работающих при давлениях свыше 70×105 Па = 70 атм. Напомним, что это соответствует температурам кипения воды свыше 285°С. В этом случае воду деминерализуют — подвергают глубокому умягчению, удаляя не только ОЖ и КЖ, но и значительную часть примесей. Давно и широко для этих целей применяется многоступенчатый ионный обмен на базе использования синтетических органических катионообменных и анионообменных смол. В зависимости от приходящих с водой загрязнений и желаемого качества очищенной воды используют ионообменные смолы различного типа и в разных комбинациях. 5.4.1. Общие представления об ионообменных смолах Промышленная деминерализация стала возможной только с развитием массового производства синтетических смол и появлением в продаже широкого ассортимента ионообменных смол. Широко применявшиеся уже 40–50 лет назад ионообменные сорбенты— иониты — представляют собой твердые, нерастворимые, ограниченно набухающие в воде вещества. В основе этих ионообменных материалов лежит каркас (матрица), несущий положительный или отрицательный заряд, и подвижный противоион, заряд которого компенсирует заряд каркаса. Этот подвижный противоион как раз и способен извлечь из раствора ион такого же заряда и обменяться с ним. По знаку заряда обменивающихся ионов иониты делят на катиониты, аниониты и амфолиты. По химической природе каркаса — на неорганические, органические и минерально-органические. Иониты могут быть природными (например, цеолиты, целлюлоза, древесина, торф) и синтетическими (силикагель, алюмогель, сульфоуголь). Наиболее важными в технологии глубокого умягчения воды в последние десятилетия следует признать синтетические ионообменные смолы, ионообменные полимеры. Ионообменные смолы могут быть сильно-, среднеи слабокислыми, а также сильно-, среднеи слабоосновными.
Широко применявшиеся уже 40–50 лет назад ионообменные сорбенты— иониты — представляют собой твердые, нерастворимые, ограниченно набухающие в воде вещества. В основе этих ионообменных материалов лежит каркас (матрица), несущий положительный или отрицательный заряд, и подвижный противоион, заряд которого компенсирует заряд каркаса. Этот подвижный противоион как раз и способен извлечь из раствора ион такого же заряда и обменяться с ним. По знаку заряда обменивающихся ионов иониты делят на катиониты, аниониты и амфолиты. По химической природе каркаса — на неорганические, органические и минерально-органические. Иониты могут быть природными (например, цеолиты, целлюлоза, древесина, торф) и синтетическими (силикагель, алюмогель, сульфоуголь). Наиболее важными в технологии глубокого умягчения воды в последние десятилетия следует признать синтетические ионообменные смолы, ионообменные полимеры. Ионообменные смолы могут быть сильно-, среднеи слабокислыми, а также сильно-, среднеи слабоосновными. Ионообменные сорбенты, регенерирующиеся серной кислотой и обменивающиеся на катионы раствора, относятся к сильнокислым катионообменным смолам. Анионная смола с сильным сродством к анионам угольной и кремниевых кислот обычно называется сильноосновной анионообменной смолой. Промышленность выпускает разновидности сильноосновных анионообменных смол с высоким сродством к анионам сильных кислот: сульфатам (SO4 2–), хлоридам (Cl–), нитратам (NO3 – ), фосфатам (PO4 3–) и так далее. Их называют слабоосновными анионообменными смолами. Слабоосновные смолы не удаляют анионы угольной и кремниевых кислот, т.к. это могут делать сильноосновные смолы. И объяснение этому надо искать в разделе 3.2. этой статьи. Дело в том, что угольная и кремниевые кислоты относятся к очень слабодиссоциирующим веществам. Сродство к протону (Н+) у них гораздо выше, чем к органической матрице анионообменной смолы. Поэтому такие аниониты не используются поодиночке в производстве глубоко-умягченной воды для котлов высокого давления.
Ионообменные сорбенты, регенерирующиеся серной кислотой и обменивающиеся на катионы раствора, относятся к сильнокислым катионообменным смолам. Анионная смола с сильным сродством к анионам угольной и кремниевых кислот обычно называется сильноосновной анионообменной смолой. Промышленность выпускает разновидности сильноосновных анионообменных смол с высоким сродством к анионам сильных кислот: сульфатам (SO4 2–), хлоридам (Cl–), нитратам (NO3 – ), фосфатам (PO4 3–) и так далее. Их называют слабоосновными анионообменными смолами. Слабоосновные смолы не удаляют анионы угольной и кремниевых кислот, т.к. это могут делать сильноосновные смолы. И объяснение этому надо искать в разделе 3.2. этой статьи. Дело в том, что угольная и кремниевые кислоты относятся к очень слабодиссоциирующим веществам. Сродство к протону (Н+) у них гораздо выше, чем к органической матрице анионообменной смолы. Поэтому такие аниониты не используются поодиночке в производстве глубоко-умягченной воды для котлов высокого давления. Для регенерации слабоосновных смол применяется каустик более низкой концентрации. Это позволяет регенерировать их совместно с сильноосновными смолами для повышения экономичности работы анионообменного оборудования. Слабоосновная смола всегда загружается в емкость последней: в донную часть — сильноосновной анионит, над ним — слабоосновной. Размещая слабоосновную смолу в верхней части анионообменного слоя, удается использовать ее ионообменную емкость и при этом быть уверенным, что сильноосновная смола удалит анионы угольной и кремниевых кислот. Емкости с катионитом и анионитом в технологической схеме глубокого умягчения соединены трубопроводом так, чтобы поток из катионообменного аппарата вошел в вершину анионообменного аппарата, а выход от анионообменного аппарата направлялся в емкость умягченной воды или в аппараты тонкой очистки. На рис. 2 ~10~ представлена схема установки по глубокому умягчению (деминерализации) воды. 5.4.2. Сильнокислый катионит Сильнокислый катионит регенерируется серной кислотой (можно использовать и соляную кислоту, но окончательный выбор диктуется ценой).
Для регенерации слабоосновных смол применяется каустик более низкой концентрации. Это позволяет регенерировать их совместно с сильноосновными смолами для повышения экономичности работы анионообменного оборудования. Слабоосновная смола всегда загружается в емкость последней: в донную часть — сильноосновной анионит, над ним — слабоосновной. Размещая слабоосновную смолу в верхней части анионообменного слоя, удается использовать ее ионообменную емкость и при этом быть уверенным, что сильноосновная смола удалит анионы угольной и кремниевых кислот. Емкости с катионитом и анионитом в технологической схеме глубокого умягчения соединены трубопроводом так, чтобы поток из катионообменного аппарата вошел в вершину анионообменного аппарата, а выход от анионообменного аппарата направлялся в емкость умягченной воды или в аппараты тонкой очистки. На рис. 2 ~10~ представлена схема установки по глубокому умягчению (деминерализации) воды. 5.4.2. Сильнокислый катионит Сильнокислый катионит регенерируется серной кислотой (можно использовать и соляную кислоту, но окончательный выбор диктуется ценой). Когда жесткая вода проходит через аппарат, наполненный сильнокислым катионитом, водородный ион — протон, являющийся подвижным противоионом в этом виде смолы, замещается на Ca2+, Mg2+, Fe2+ или Fe3+ и другие катионы, которые могут присутствовать в воде. Анионы, которые присутствуют в умягчаемой воде, с этим типом смолы не обмениваются и остаются в растворе. Протон (Н+), попадая в воду, придает ей кислую реакцию (см. раздел 3.1.), достигающую 2,0–3,0 единиц pH. Поэтому, аппарат, наполненный сильнокислым катионитом, соединительный трубопровод, емкости и запорную арматуру гуммируют, т.е. покрывают антикоррозионным слоем резины. В обменных процессах играют роль два фактора: . концентрация обменивающегося иона, как со стороны раствора, так и со стороны смолы; . способность к обмену иона, присутствующего в умягчаемой воде. По способности к обмену с сильно кислым катионитом можно выстроить катионы в следующий ряд: 1. водород; 2. кальций; 3. магний; 4. калий; 5. натрий. В принципе, просматривается закономерность — чем больше радиус иона, тем выше его способность к обмену с протоном смолы.
Когда жесткая вода проходит через аппарат, наполненный сильнокислым катионитом, водородный ион — протон, являющийся подвижным противоионом в этом виде смолы, замещается на Ca2+, Mg2+, Fe2+ или Fe3+ и другие катионы, которые могут присутствовать в воде. Анионы, которые присутствуют в умягчаемой воде, с этим типом смолы не обмениваются и остаются в растворе. Протон (Н+), попадая в воду, придает ей кислую реакцию (см. раздел 3.1.), достигающую 2,0–3,0 единиц pH. Поэтому, аппарат, наполненный сильнокислым катионитом, соединительный трубопровод, емкости и запорную арматуру гуммируют, т.е. покрывают антикоррозионным слоем резины. В обменных процессах играют роль два фактора: . концентрация обменивающегося иона, как со стороны раствора, так и со стороны смолы; . способность к обмену иона, присутствующего в умягчаемой воде. По способности к обмену с сильно кислым катионитом можно выстроить катионы в следующий ряд: 1. водород; 2. кальций; 3. магний; 4. калий; 5. натрий. В принципе, просматривается закономерность — чем больше радиус иона, тем выше его способность к обмену с протоном смолы. Если в жесткой воде одновременно присутствуют вышеперечисленные ионы в одинаковых концентрациях, то в первую очередь с подвижным противоионом Н+ свежерегенерированного сильного катионита начнет обмениваться Са2+, причем каждый ион кальция заменит в катионите два иона водорода. Если концентрация Са2+ снизится до некоторого порогового предела, наступит очередь Mg2+ и какой-то период оба эти иона будут обмениваться с протоном смолы на равных. Как правило, ионообменные аппараты представляют собой вертикальный цилиндр, заполненный смолой. Вода на умягчение поступает в верхнюю часть аппарата, омывая слои смолы и постепенно освобождаясь от ионов жесткости. Если бы мы отобрали пробы воды по высоте «сверху вниз» ионообменного аппарата, заполненного сильнокислым катионитом, то мы бы наблюдали постепенное уменьшение в воде концентрации Са2+, затем Mg2+ и так далее в соответствии с вышеприведенным рядом. Но при этом в растворе все время увеличивалась бы кислотность или, что тоже самое, снижался рН.
Если в жесткой воде одновременно присутствуют вышеперечисленные ионы в одинаковых концентрациях, то в первую очередь с подвижным противоионом Н+ свежерегенерированного сильного катионита начнет обмениваться Са2+, причем каждый ион кальция заменит в катионите два иона водорода. Если концентрация Са2+ снизится до некоторого порогового предела, наступит очередь Mg2+ и какой-то период оба эти иона будут обмениваться с протоном смолы на равных. Как правило, ионообменные аппараты представляют собой вертикальный цилиндр, заполненный смолой. Вода на умягчение поступает в верхнюю часть аппарата, омывая слои смолы и постепенно освобождаясь от ионов жесткости. Если бы мы отобрали пробы воды по высоте «сверху вниз» ионообменного аппарата, заполненного сильнокислым катионитом, то мы бы наблюдали постепенное уменьшение в воде концентрации Са2+, затем Mg2+ и так далее в соответствии с вышеприведенным рядом. Но при этом в растворе все время увеличивалась бы кислотность или, что тоже самое, снижался рН. Из вышесказанного естественно вытекает и метод контроля «срабатываемости» смолы в ионообменном аппарате. Как только в воде на выходе из аппарата появятся ионы жесткости или прекратится снижение рН, его надо переключать в режим регенерации смолы. Помня о буферности воды с карбонатной жесткостью (см. раздел 4.1.) следует отметить, что рН воды на выходе из ионообменного аппарата может и не достигать минимальных значений 3 или 2. В воде с карбонатной жесткостью критерием окончания процесса обмена подвижных протонов смолы служит рН = 4,3 или изменение окраски индикаторов: бромфенолового синего с синей на желтую; метилового оранжевого с желтой на красную; бромкрезолового зеленого с синей на желтую. Нельзя допускать полного истощения обменной емкости сильнокислого катионита, т.к. тогда потребуется его двойная по продолжительности регенерация, а также из-за того, что в котлы высокого давления совершенно недопустимо попадание солей жесткости из-за потери контроля над качеством умягчения питательной воды.
Из вышесказанного естественно вытекает и метод контроля «срабатываемости» смолы в ионообменном аппарате. Как только в воде на выходе из аппарата появятся ионы жесткости или прекратится снижение рН, его надо переключать в режим регенерации смолы. Помня о буферности воды с карбонатной жесткостью (см. раздел 4.1.) следует отметить, что рН воды на выходе из ионообменного аппарата может и не достигать минимальных значений 3 или 2. В воде с карбонатной жесткостью критерием окончания процесса обмена подвижных протонов смолы служит рН = 4,3 или изменение окраски индикаторов: бромфенолового синего с синей на желтую; метилового оранжевого с желтой на красную; бромкрезолового зеленого с синей на желтую. Нельзя допускать полного истощения обменной емкости сильнокислого катионита, т.к. тогда потребуется его двойная по продолжительности регенерация, а также из-за того, что в котлы высокого давления совершенно недопустимо попадание солей жесткости из-за потери контроля над качеством умягчения питательной воды.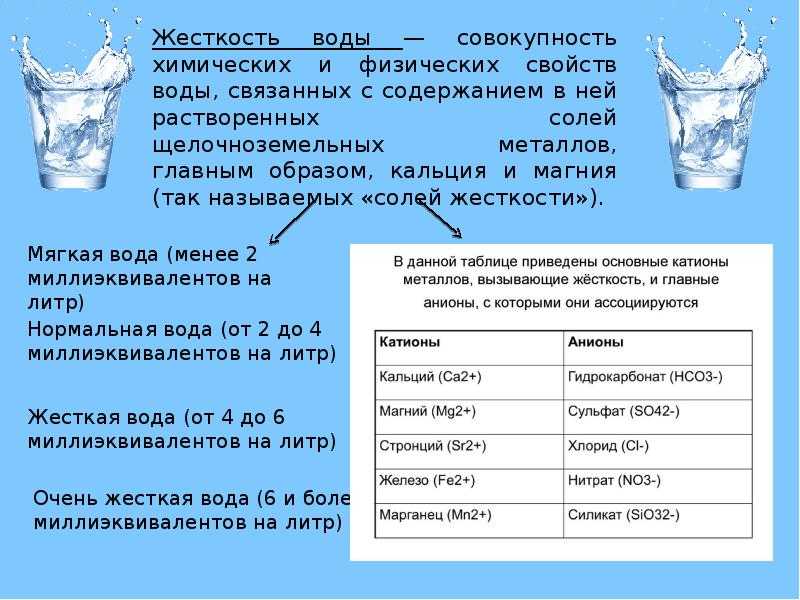 При проектировании технологической линии по глубокому умягчению воды производительность установки рассчитывают исходя из обменной емкости анионообменной смолы. И этому есть две причины. Первая: обменная емкость анионитов заметно ниже, чем обменная емкость катионитов. Эта проблема в принципе решается увеличением объема и соответственно размера загрузки анионообменного аппарата, но такое решение возможно только в узких пределах. Вторая: недопустимо попадание в котел высокого давления кремниевых кислот, очистку от которых обеспечивают аниониты. Хотя попадание в котел кремниевых кислот менее критично, чем попадание солей жесткости, лучше сознательно заложить в проект «резерв» по производительности установки глубокого умягчения воды, чем поставить под угрозу надежность работы котлов высокого давления. 5.4.3. Снижение щелочности Одной из неприятных составляющих воды, используемой как источник подпитки котлов, является щелочность. Под общей щелочностью воды понимают сумму концентраций ионов CO3 2–, НCO3 – и ОН–, т.
При проектировании технологической линии по глубокому умягчению воды производительность установки рассчитывают исходя из обменной емкости анионообменной смолы. И этому есть две причины. Первая: обменная емкость анионитов заметно ниже, чем обменная емкость катионитов. Эта проблема в принципе решается увеличением объема и соответственно размера загрузки анионообменного аппарата, но такое решение возможно только в узких пределах. Вторая: недопустимо попадание в котел высокого давления кремниевых кислот, очистку от которых обеспечивают аниониты. Хотя попадание в котел кремниевых кислот менее критично, чем попадание солей жесткости, лучше сознательно заложить в проект «резерв» по производительности установки глубокого умягчения воды, чем поставить под угрозу надежность работы котлов высокого давления. 5.4.3. Снижение щелочности Одной из неприятных составляющих воды, используемой как источник подпитки котлов, является щелочность. Под общей щелочностью воды понимают сумму концентраций ионов CO3 2–, НCO3 – и ОН–, т.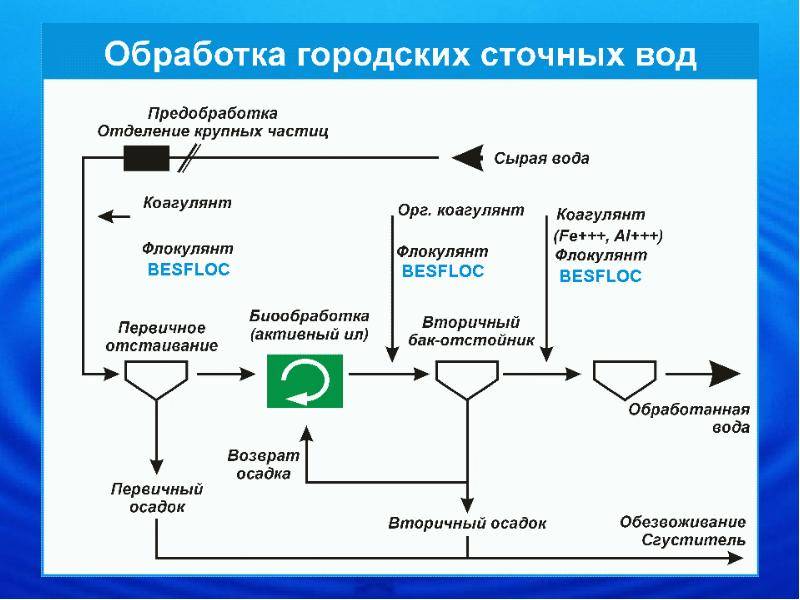 е. всего того, что реагирует с сильной кислотой, а точнее с Н+. Особые неприятности доставляет карбонатная составляющая или карбонатная жесткость. Как только сырая вода в технологической схеме умягчения прошла через стадию катионирования, Са2+ или Mg2+ обмениваются на H+, и в потоке воды появляется слабодиссоциирующие карбонат, гидрокарбонат-ионы и угольная кислота h3CO3. Эта кислота очень неустойчива. Она очень быстро разлагается на диоксид углерода (CO2) и воду. По этой причине во многие технологические схемы глубокого умягчения включают аппарат, называемый декарбонизатором. Его размещают после ионообменных аппаратов, заполненных катионитом. Декарбонизатор представляет собой емкость, заполненную насадкой или кольцами Рашига на поддерживающей решетке. Поток воздуха от вентилятора, проходя через насадку, поднимается в верхнюю часть емкости — декарбонизатор. Вместе с ним из потока воды после аппарата с сильнокислым катионитом уносится и диоксид углерода. Вода после декарбонизатора обычно содержит 0,2 мгэкв/л CO2.
е. всего того, что реагирует с сильной кислотой, а точнее с Н+. Особые неприятности доставляет карбонатная составляющая или карбонатная жесткость. Как только сырая вода в технологической схеме умягчения прошла через стадию катионирования, Са2+ или Mg2+ обмениваются на H+, и в потоке воды появляется слабодиссоциирующие карбонат, гидрокарбонат-ионы и угольная кислота h3CO3. Эта кислота очень неустойчива. Она очень быстро разлагается на диоксид углерода (CO2) и воду. По этой причине во многие технологические схемы глубокого умягчения включают аппарат, называемый декарбонизатором. Его размещают после ионообменных аппаратов, заполненных катионитом. Декарбонизатор представляет собой емкость, заполненную насадкой или кольцами Рашига на поддерживающей решетке. Поток воздуха от вентилятора, проходя через насадку, поднимается в верхнюю часть емкости — декарбонизатор. Вместе с ним из потока воды после аппарата с сильнокислым катионитом уносится и диоксид углерода. Вода после декарбонизатора обычно содержит 0,2 мгэкв/л CO2. Декарбонизацию кислого потока можно также осуществить, пропуская кислый раствор через сильноосновной анионит, регенерируемый каустиком. 5.4.4. Слабокислый катионит Некоторые типы вод с высокой общей и карбонатной жесткостью целесообразно обработать вначале слабокислым катионитом. Он удалит Ca2+, Mg2+, Na+, а выделившийся при этом ион водорода переведет присутствующий в воде карбонат-ион в гидрокарбонат-ион, т.е. в HCO3 –. Из-за того, что большинство промышленных источников водоснабжения содержат определенное количество некарбонатной жесткости (CaSO4, CaCl2 и т.д.), необходимо вслед за аппаратом с слабокислым катионитом размещать аппарат с сильнокислым катионитом, чтобы достичь полного удаления общей жесткости. Слабокислый и сильнокислый катиониты можно размещать в разных ионообменных аппаратах, но можно и как два отдельных слоя в одном аппарате. Эффективность регенерации слабокислого катионита очень высока по сравнению с регенерацией сильнокислого катионита. Следовательно, появляется возможность использовать поток после регенерации сильного катионита для регенерации слабого.
Декарбонизацию кислого потока можно также осуществить, пропуская кислый раствор через сильноосновной анионит, регенерируемый каустиком. 5.4.4. Слабокислый катионит Некоторые типы вод с высокой общей и карбонатной жесткостью целесообразно обработать вначале слабокислым катионитом. Он удалит Ca2+, Mg2+, Na+, а выделившийся при этом ион водорода переведет присутствующий в воде карбонат-ион в гидрокарбонат-ион, т.е. в HCO3 –. Из-за того, что большинство промышленных источников водоснабжения содержат определенное количество некарбонатной жесткости (CaSO4, CaCl2 и т.д.), необходимо вслед за аппаратом с слабокислым катионитом размещать аппарат с сильнокислым катионитом, чтобы достичь полного удаления общей жесткости. Слабокислый и сильнокислый катиониты можно размещать в разных ионообменных аппаратах, но можно и как два отдельных слоя в одном аппарате. Эффективность регенерации слабокислого катионита очень высока по сравнению с регенерацией сильнокислого катионита. Следовательно, появляется возможность использовать поток после регенерации сильного катионита для регенерации слабого. При размещении слабокислотного и сильнокислотного катионита в одной и той же емкости, последний размещают в нижней части аппарата, т.к. удельный вес у него выше, чем у слабокислого. Это будет препятствовать смешиванию слоев при обратной промывке и взрыхлении. Обычно, слабокислый катионит в процессе обмена выделяет 40–60 % кислоты (Н+) за один цикл. Двухслойное заполнение слабым и сильным катионитом не применяется в котлах высокого давления из-за присутствия натрия в потоке, если регенерацию одного из катионитов ведут раствором хлорида натрия. При регенерации слабокислого катионита серной кислотой необходимо строго контролировать концентрацию серной кислоты (Н2SO4) и следить за тем, чтобы она не превысила 0,7 %. Более высокая концентрация серной кислоты приведет к вытеснению Ca2+ из смолы, что вызовет кристаллизацию и осаждение сульфата кальция — гипса (CaSO4). Гипс нерастворим во многих концентрированных кислотах. Удалять его из смолы придется только механически. Осаждение гипса неприемлемо и с эксплуатационной точки зрения, т.
При размещении слабокислотного и сильнокислотного катионита в одной и той же емкости, последний размещают в нижней части аппарата, т.к. удельный вес у него выше, чем у слабокислого. Это будет препятствовать смешиванию слоев при обратной промывке и взрыхлении. Обычно, слабокислый катионит в процессе обмена выделяет 40–60 % кислоты (Н+) за один цикл. Двухслойное заполнение слабым и сильным катионитом не применяется в котлах высокого давления из-за присутствия натрия в потоке, если регенерацию одного из катионитов ведут раствором хлорида натрия. При регенерации слабокислого катионита серной кислотой необходимо строго контролировать концентрацию серной кислоты (Н2SO4) и следить за тем, чтобы она не превысила 0,7 %. Более высокая концентрация серной кислоты приведет к вытеснению Ca2+ из смолы, что вызовет кристаллизацию и осаждение сульфата кальция — гипса (CaSO4). Гипс нерастворим во многих концентрированных кислотах. Удалять его из смолы придется только механически. Осаждение гипса неприемлемо и с эксплуатационной точки зрения, т. к. это повышает гидравлическое сопротивление оборудования. 5.4.5. Сильноосновный анионит Задачей сильноосновного анионита является удаление слабодиссоциирующих кислот: кремниевых (h3SiO3 и h5SiO4) и угольной (h3CO3). Кроме того, сильноосновный анионит удаляет анионы сильных кислот в потоке, выходящем из катионообменных аппаратов: сульфаты (SO4 2+), хлориды Cl– и другие анионы. Подвижным противоионом сильноосновного анионита является OH–, который при регенерации извлекается анионитом из каустика (NaOH). В рабочем цикле гидроксильный ион OH–, вытесняясь из анионита кремниевыми или угольной кислотами и нейтрализуясь в потоке после катионообменных аппаратов водородным ионом (см. уравнение (2), образует воду. Электропроводность воды обеспечивают катионы и анионы. В чистой воде концентрация их как продуктов диссоциации воды (см. раздел 3.1.) всего 0,0000001 моль/л. Как следствие, электропроводность воды, вытекающей из аппарата, заполненного сильноосновным анионитом, очень низкая — около 1,9 микросименс.
к. это повышает гидравлическое сопротивление оборудования. 5.4.5. Сильноосновный анионит Задачей сильноосновного анионита является удаление слабодиссоциирующих кислот: кремниевых (h3SiO3 и h5SiO4) и угольной (h3CO3). Кроме того, сильноосновный анионит удаляет анионы сильных кислот в потоке, выходящем из катионообменных аппаратов: сульфаты (SO4 2+), хлориды Cl– и другие анионы. Подвижным противоионом сильноосновного анионита является OH–, который при регенерации извлекается анионитом из каустика (NaOH). В рабочем цикле гидроксильный ион OH–, вытесняясь из анионита кремниевыми или угольной кислотами и нейтрализуясь в потоке после катионообменных аппаратов водородным ионом (см. уравнение (2), образует воду. Электропроводность воды обеспечивают катионы и анионы. В чистой воде концентрация их как продуктов диссоциации воды (см. раздел 3.1.) всего 0,0000001 моль/л. Как следствие, электропроводность воды, вытекающей из аппарата, заполненного сильноосновным анионитом, очень низкая — около 1,9 микросименс. Именно поэтому любые скачки электропроводности будут свидетельствовать о проскоках катионов в аппаратах, предшествующих анионообменному. Сильноосновные аниониты характеризуют двумя обменными емкостями: солевой и общей. Так называемая солевая емкость определяется способностью удалять угольную и кремневые кислоты. Общая емкость является суммой солевой обменной емкости анионита и его обменной емкостью по отношению к SO4 2–, Cl–, NO3 – и другим анионам. Вода многих источников водоснабжения содержит органику. Сильноосновные аниониты адсорбируют из воды органические загрязнения. Поверхностные воды известны своей склонностью содержать железо-органические соединения. Эти соединения проскакивают через катионит, т.к. железо в них содержится не в ионной форме. Когда они достигают анионита, анионообменная смола адсорбирует целиком железо-органический комплекс. Он не удаляется в процессе регенерации, но занимает место, которое обычно занимают другие ионы. Конечный результат — уменьшение обменной емкости анионита.
Именно поэтому любые скачки электропроводности будут свидетельствовать о проскоках катионов в аппаратах, предшествующих анионообменному. Сильноосновные аниониты характеризуют двумя обменными емкостями: солевой и общей. Так называемая солевая емкость определяется способностью удалять угольную и кремневые кислоты. Общая емкость является суммой солевой обменной емкости анионита и его обменной емкостью по отношению к SO4 2–, Cl–, NO3 – и другим анионам. Вода многих источников водоснабжения содержит органику. Сильноосновные аниониты адсорбируют из воды органические загрязнения. Поверхностные воды известны своей склонностью содержать железо-органические соединения. Эти соединения проскакивают через катионит, т.к. железо в них содержится не в ионной форме. Когда они достигают анионита, анионообменная смола адсорбирует целиком железо-органический комплекс. Он не удаляется в процессе регенерации, но занимает место, которое обычно занимают другие ионы. Конечный результат — уменьшение обменной емкости анионита. Аниониты адсорбируют также другие формы органики в процессе регенерации. Адсорбирующаяся органика не только занимает обменные места, но также реагирует со смолой, меняя ее свойства. Такое видоизменение проявляется в снижении солевой емкости сильнокислых анионитов. По существу, анионит начинает терять свою способность удалять кремниевые и угольную кислоты, но демонстрирует увеличение обменной емкости при удалении анионов сильных кислот. Конечным результатом в системе водоподготовки для котлов высокого давления будет постоянное сокращение пробега между регенерациями, потому что концентрация кремниевых кислот в потоке, вытекающем из сильноосновного анионита, является главным контролируемым параметром. Анионообменная смола может также задерживать микробиологические загрязнения. Хорошо растут на анионите грибы. Обработка раствором формальдегида — один из методов стерилизации анионитового участка технологической схемы. 5.4.6. Слабоосновный анионит Слабоосновный анионит не в состоянии удалять ионы слабодиссоциирующих кислот — кремниевых и угольной.
Аниониты адсорбируют также другие формы органики в процессе регенерации. Адсорбирующаяся органика не только занимает обменные места, но также реагирует со смолой, меняя ее свойства. Такое видоизменение проявляется в снижении солевой емкости сильнокислых анионитов. По существу, анионит начинает терять свою способность удалять кремниевые и угольную кислоты, но демонстрирует увеличение обменной емкости при удалении анионов сильных кислот. Конечным результатом в системе водоподготовки для котлов высокого давления будет постоянное сокращение пробега между регенерациями, потому что концентрация кремниевых кислот в потоке, вытекающем из сильноосновного анионита, является главным контролируемым параметром. Анионообменная смола может также задерживать микробиологические загрязнения. Хорошо растут на анионите грибы. Обработка раствором формальдегида — один из методов стерилизации анионитового участка технологической схемы. 5.4.6. Слабоосновный анионит Слабоосновный анионит не в состоянии удалять ионы слабодиссоциирующих кислот — кремниевых и угольной. Однако он имеет высокую обменную емкость по отношению к анионам сильных кислот: SO4 2–, Cl–, NO3 – и т.д. Слабоосновный анионит может заменить сильноосновный в технологических схемах, включающих декарбонизатор, а также в тех случаях, когда содержание кремниевых кислот не играет решающей роли. Возможно совместное использование двух анионитов — слабоосновного и сильноосновного, в одном аппарате. Такой вариант рекомендуется в технологических схемах, в которых отсутствует декарбонизатор после узла катионирования. В этом случае слабоосновный анионит загружают поверх сильноосновного анионита. В течение рабочего цикла следует позаботиться о том, чтобы в процессе обратной промывки эти две смолы не смешались. В конце рабочего цикла удельный вес слабоосновного и сильноосновного анионита почти одинаков, но после регенерации ощутимо отличается. Именно поэтому слабоосновный анионит следует размещать сверху — над сильноосновным. В технологическом плане преимуществами такого размещения являются: во-первых, поток от катионитового блока попадает сначала на анионит с большой обменной емкостью; во-вторых, слабоосновные смолы также как и сильноосновный анионит поглощают органику, но органика, поглощенная ими, удаляется уже при обычной регенерации.
Однако он имеет высокую обменную емкость по отношению к анионам сильных кислот: SO4 2–, Cl–, NO3 – и т.д. Слабоосновный анионит может заменить сильноосновный в технологических схемах, включающих декарбонизатор, а также в тех случаях, когда содержание кремниевых кислот не играет решающей роли. Возможно совместное использование двух анионитов — слабоосновного и сильноосновного, в одном аппарате. Такой вариант рекомендуется в технологических схемах, в которых отсутствует декарбонизатор после узла катионирования. В этом случае слабоосновный анионит загружают поверх сильноосновного анионита. В течение рабочего цикла следует позаботиться о том, чтобы в процессе обратной промывки эти две смолы не смешались. В конце рабочего цикла удельный вес слабоосновного и сильноосновного анионита почти одинаков, но после регенерации ощутимо отличается. Именно поэтому слабоосновный анионит следует размещать сверху — над сильноосновным. В технологическом плане преимуществами такого размещения являются: во-первых, поток от катионитового блока попадает сначала на анионит с большой обменной емкостью; во-вторых, слабоосновные смолы также как и сильноосновный анионит поглощают органику, но органика, поглощенная ими, удаляется уже при обычной регенерации. Это помогает защищать сильноосновную смолу от необратимого органического загрязнения. Мы описали особенности эксплуатации смол в рабочем цикле процесса глубокого умягчения сырой воды. Кроме того, рабочий цикл предусматривает стадии: промывки смолы при выводе ее на регенерацию, собственно регенерации, медленной и быстрой промывки после регенерации и взрыхления смолы. 5.4.7. Затраты на деминерализацию и регенерацию В современных технологических схемах глубокого умягчения предусматривается автоматическое переключение последовательности выполнения операций при работе и регенерации деминерализующей системы. Некоторые операторы требуют, чтобы в процессе регенерации было предусмотрено ручное управление каждой операцией. Это страхует от ситуаций, когда сбой в автоматизированном управлении последовательностью операций мог бы направить использованный раствор после регенерации в голову процесса, вместо того, чтобы направить его в стоки. Начальные затраты на установку глубокого умягчения весьма высоки.
Это помогает защищать сильноосновную смолу от необратимого органического загрязнения. Мы описали особенности эксплуатации смол в рабочем цикле процесса глубокого умягчения сырой воды. Кроме того, рабочий цикл предусматривает стадии: промывки смолы при выводе ее на регенерацию, собственно регенерации, медленной и быстрой промывки после регенерации и взрыхления смолы. 5.4.7. Затраты на деминерализацию и регенерацию В современных технологических схемах глубокого умягчения предусматривается автоматическое переключение последовательности выполнения операций при работе и регенерации деминерализующей системы. Некоторые операторы требуют, чтобы в процессе регенерации было предусмотрено ручное управление каждой операцией. Это страхует от ситуаций, когда сбой в автоматизированном управлении последовательностью операций мог бы направить использованный раствор после регенерации в голову процесса, вместо того, чтобы направить его в стоки. Начальные затраты на установку глубокого умягчения весьма высоки. В процессе эксплуатации (за вычетом оплаты труда операторов) основными затратами являются стоимость смол и реагентов. Смолы стоят очень дорого, при этом наиболее высокая цена у анионитов. Замена анионита в аппарате, содержащем 8,5 м3 смолы, может достигать $ 40 тыс. только для одного типа смолы. Стоимость затрат на восполнения смолы в процессе эксплуатации за счет ее разрушения, потерь при обратных промывках и т.д. оценивается в 3 % в год. В большинстве случаев для регенерации ионообменных смол применяется серная кислота концентрацией 96–97% и 50% каустик. Серная кислота стоит приблизительно $ 50 за тонну, а каустик приблизительно $ 120 за тонну. Количество кислоты и каустика, используемые на одну регенерацию, изменяются в зависимости от обменной емкости смолы. Типичные затраты на регенерацию катионита: 0,07–0,12 т серной кислоты концентрацией 96–97 % на 1 м3 смолы. Порядок затрат на регенерацию сильноосновных анионитов: 0,14–0,20 т 50% каустика на 1 м3 смолы. При проектировании установки глубокого умягчения изготовители за единицу размера единицы оборудования выбирают такой, чтобы рабочий цикл производства качественной деминерализованной воды составлял приблизительно 24 часа.
В процессе эксплуатации (за вычетом оплаты труда операторов) основными затратами являются стоимость смол и реагентов. Смолы стоят очень дорого, при этом наиболее высокая цена у анионитов. Замена анионита в аппарате, содержащем 8,5 м3 смолы, может достигать $ 40 тыс. только для одного типа смолы. Стоимость затрат на восполнения смолы в процессе эксплуатации за счет ее разрушения, потерь при обратных промывках и т.д. оценивается в 3 % в год. В большинстве случаев для регенерации ионообменных смол применяется серная кислота концентрацией 96–97% и 50% каустик. Серная кислота стоит приблизительно $ 50 за тонну, а каустик приблизительно $ 120 за тонну. Количество кислоты и каустика, используемые на одну регенерацию, изменяются в зависимости от обменной емкости смолы. Типичные затраты на регенерацию катионита: 0,07–0,12 т серной кислоты концентрацией 96–97 % на 1 м3 смолы. Порядок затрат на регенерацию сильноосновных анионитов: 0,14–0,20 т 50% каустика на 1 м3 смолы. При проектировании установки глубокого умягчения изготовители за единицу размера единицы оборудования выбирают такой, чтобы рабочий цикл производства качественной деминерализованной воды составлял приблизительно 24 часа. В некоторых случаях предусматривается сдвоенная технологическая схема, что дает возможность использовать каждую технологическую линию: одна — в работе, а другая — на регенерации. В остальных случаях в технологической схеме предусматриваются резервуары для хранения глубоко умягченной воды. Обычно полный цикл регенерации и промывки занимает несколько часов. Объем резервуара для хранения деминерализованной воды выбирается в зависимости от часовой потребности в питательной воде для котлов высокого давления (производительности) и с учетом времени регенерации смолы в установке глубокого умягчения. 5.5. Фильтрование или обратный осмос Использование для очистки воды явлений осмоса или фильтрования через пористую перегородку с размером пор порядка молекулы началось в 60-х годах ХХ века. Особенно перспективным именно для очистки воды оказался обратный осмос. Однако применение этой технологии в быту стало возможным относительно недавно благодаря совершенствованию процесса, конструкции аппаратов и резкому снижению себестоимости обратноосмотических мембран.
В некоторых случаях предусматривается сдвоенная технологическая схема, что дает возможность использовать каждую технологическую линию: одна — в работе, а другая — на регенерации. В остальных случаях в технологической схеме предусматриваются резервуары для хранения глубоко умягченной воды. Обычно полный цикл регенерации и промывки занимает несколько часов. Объем резервуара для хранения деминерализованной воды выбирается в зависимости от часовой потребности в питательной воде для котлов высокого давления (производительности) и с учетом времени регенерации смолы в установке глубокого умягчения. 5.5. Фильтрование или обратный осмос Использование для очистки воды явлений осмоса или фильтрования через пористую перегородку с размером пор порядка молекулы началось в 60-х годах ХХ века. Особенно перспективным именно для очистки воды оказался обратный осмос. Однако применение этой технологии в быту стало возможным относительно недавно благодаря совершенствованию процесса, конструкции аппаратов и резкому снижению себестоимости обратноосмотических мембран. В мире ежегодно устанавливаются десятки тысяч таких систем, и альтернативы им пока нет. Качество же очищенной обратноосмотическим методом воды просто поражает — свободный хлор, механические частицы, привкусы и запахи, токсичные органические вещества, тяжелые металлы, одноклеточные микроорганизмы удаляются на 96–100 %. Единственная претензия к обратному осмосу как к одному из методов умягчения питьевой воды — слишком глубокая очистка от карбонатной и общей щелочности. Осмосом называется самопроизвольный переход вещества через полупроницаемую мембрану, разделяющую два раствора с различной концентрацией или раствор и чистый растворитель. В общем случае растворенное вещество из раствора с высокой концентрацией пытается перейти в раствор с низкой концентрацией. Если повысить давление в растворе с низкой концентрацией, то поток растворенного вещества прекратится. Разность давлений, прекращающая переток вещества (фильтрацию) через мембрану, называется осмотическим давлением. Осмотические явления чрезвычайно распространены в растительном и животном мире.
В мире ежегодно устанавливаются десятки тысяч таких систем, и альтернативы им пока нет. Качество же очищенной обратноосмотическим методом воды просто поражает — свободный хлор, механические частицы, привкусы и запахи, токсичные органические вещества, тяжелые металлы, одноклеточные микроорганизмы удаляются на 96–100 %. Единственная претензия к обратному осмосу как к одному из методов умягчения питьевой воды — слишком глубокая очистка от карбонатной и общей щелочности. Осмосом называется самопроизвольный переход вещества через полупроницаемую мембрану, разделяющую два раствора с различной концентрацией или раствор и чистый растворитель. В общем случае растворенное вещество из раствора с высокой концентрацией пытается перейти в раствор с низкой концентрацией. Если повысить давление в растворе с низкой концентрацией, то поток растворенного вещества прекратится. Разность давлений, прекращающая переток вещества (фильтрацию) через мембрану, называется осмотическим давлением. Осмотические явления чрезвычайно распространены в растительном и животном мире. Осмос обеспечивает проникновение питательных веществ в клетку и вывод в межклеточную среду продуктов жизнедеятельности. Благодаря осмотическому давлению живая клетка имеет форму. Если живую клетку поместить в концентрированный раствор соли, она погибнет от избытка проникшей в нее соли. Обратным осмосом называют метод разделения растворов. Если раствор (очищаемую воду) подать под давлением 3–8 МПа на полупроницаемую мембрану, то вода профильтруется через поры, а растворенное вещество останется. Эффективность обратного осмоса оценивают по селективности мембраны — способности удерживать ионы и молекулы разного размера, а также по удельной производительности единицы поверхности. Сегодня синтезированы полимерные мембраны с широким диапазоном размеров пор и высокой механической прочностью. Так, комплектация мембранного аппарата набором мембран с уменьшающимся по ходу движения жидкости размером пор обеспечивает получение из многокомпонентного раствора органических и неорганических соединений особо чистую воду.
Осмос обеспечивает проникновение питательных веществ в клетку и вывод в межклеточную среду продуктов жизнедеятельности. Благодаря осмотическому давлению живая клетка имеет форму. Если живую клетку поместить в концентрированный раствор соли, она погибнет от избытка проникшей в нее соли. Обратным осмосом называют метод разделения растворов. Если раствор (очищаемую воду) подать под давлением 3–8 МПа на полупроницаемую мембрану, то вода профильтруется через поры, а растворенное вещество останется. Эффективность обратного осмоса оценивают по селективности мембраны — способности удерживать ионы и молекулы разного размера, а также по удельной производительности единицы поверхности. Сегодня синтезированы полимерные мембраны с широким диапазоном размеров пор и высокой механической прочностью. Так, комплектация мембранного аппарата набором мембран с уменьшающимся по ходу движения жидкости размером пор обеспечивает получение из многокомпонентного раствора органических и неорганических соединений особо чистую воду. 5.6. Примеры использования умягчения для подготовки питьевой воды Хотя умягчение в основном используется в промышленности для получения кондиционной воды в системах производства тепла и пара, тем не менее, бывают случаи, когда приходится применять умягчение при производстве питьевой воды. 5.6.1. Завод по обработке воды в городе Афины (штат Огайо, США) Завод предназначен для переработки 26 500 м3 сырой воды в сутки. Технологическая схема завода показана на рис. 3 ~11~. Вода закачивается в аэратор 1 — аппарат производительностью 670 м3/ч для принудительной продувки воздуха через воду. Кислород воздуха окисляет железо и марганец, а сам воздух удаляет газы, которые могут содержаться в воде. Затем вода поступает в седиментационный бассейн 2 (отстойник), объемом 350 м3, где приблизительно за 30 минут оседают взвешенные твердые частицы. Вода из седиментационного бассейна 2 перетекает самотеком через серию быстрых песочных фильтров 3. Это дает возможность дополнительно удалить взвешенные, в частности, окислы железа и марганца.
5.6. Примеры использования умягчения для подготовки питьевой воды Хотя умягчение в основном используется в промышленности для получения кондиционной воды в системах производства тепла и пара, тем не менее, бывают случаи, когда приходится применять умягчение при производстве питьевой воды. 5.6.1. Завод по обработке воды в городе Афины (штат Огайо, США) Завод предназначен для переработки 26 500 м3 сырой воды в сутки. Технологическая схема завода показана на рис. 3 ~11~. Вода закачивается в аэратор 1 — аппарат производительностью 670 м3/ч для принудительной продувки воздуха через воду. Кислород воздуха окисляет железо и марганец, а сам воздух удаляет газы, которые могут содержаться в воде. Затем вода поступает в седиментационный бассейн 2 (отстойник), объемом 350 м3, где приблизительно за 30 минут оседают взвешенные твердые частицы. Вода из седиментационного бассейна 2 перетекает самотеком через серию быстрых песочных фильтров 3. Это дает возможность дополнительно удалить взвешенные, в частности, окислы железа и марганца. Фильтры 3 состоят из слоя песка толщиной 0,6 м и слоев гравия различного размера, служащего опорой песочному фильтру. Профильтрованная вода поступает на стадию ионообменного умягчения 4. Для этой цели используются минеральные адсорбенты — цеолиты, в которых ионы кальция и магния извлекаются из воды за счет обменной адсорбции (см. раздел 5.4.1.). Затем вода с условно нулевой жесткостью смешивается с отфильтрованной водой (общая жесткость 15 гэкв/л) в смесителекондиционере питьевой воды 5 для того, чтобы получить конечную жесткость 7,5 мгэкв/л. Воду с доведенной до нормы общей жесткостью стабилизируют по рН 50 % каустиком, который добавляется из расчета 3,0 мг/л. Дезинфекцию воды осуществляют газообразным хлором, доводя его содержание в воде до 0,8 мг/л. Приготовленную таким образом питьевую воду хранят в концевых колодцах чистой воды 7. Концевые колодцы представляют собой емкости общим объемом 4500 м3. Из этих колодцев чистой воды два насоса производительностью 600 м3/ч и один производительностью 950 м3/ч перекачивают воду в емкости и резервуары, размещенные по всему городу.
Фильтры 3 состоят из слоя песка толщиной 0,6 м и слоев гравия различного размера, служащего опорой песочному фильтру. Профильтрованная вода поступает на стадию ионообменного умягчения 4. Для этой цели используются минеральные адсорбенты — цеолиты, в которых ионы кальция и магния извлекаются из воды за счет обменной адсорбции (см. раздел 5.4.1.). Затем вода с условно нулевой жесткостью смешивается с отфильтрованной водой (общая жесткость 15 гэкв/л) в смесителекондиционере питьевой воды 5 для того, чтобы получить конечную жесткость 7,5 мгэкв/л. Воду с доведенной до нормы общей жесткостью стабилизируют по рН 50 % каустиком, который добавляется из расчета 3,0 мг/л. Дезинфекцию воды осуществляют газообразным хлором, доводя его содержание в воде до 0,8 мг/л. Приготовленную таким образом питьевую воду хранят в концевых колодцах чистой воды 7. Концевые колодцы представляют собой емкости общим объемом 4500 м3. Из этих колодцев чистой воды два насоса производительностью 600 м3/ч и один производительностью 950 м3/ч перекачивают воду в емкости и резервуары, размещенные по всему городу.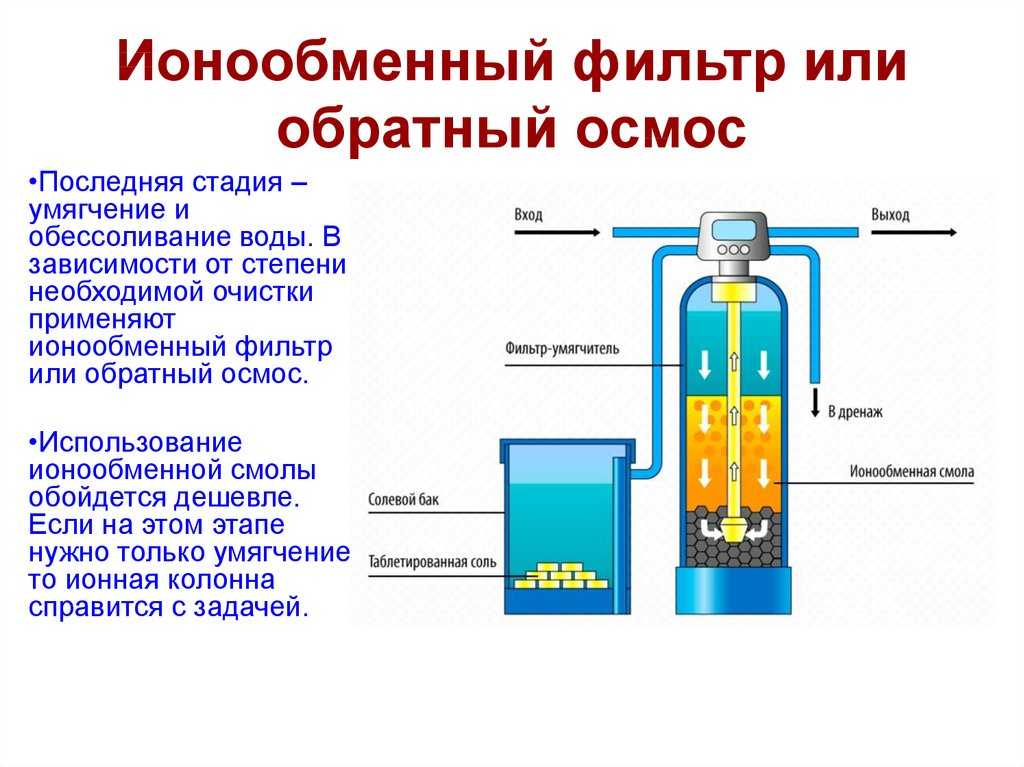 Общая емкость резервуаров составляет 26 000 м3. 5.6.2. Обратноосмотические системы компании UNIFILTER На российском рынке успешно работает компания UNIFILTER (www.unifilter.ru), предлагающая полный спектр фильтров и систем водоочистки для квартир, домов, дач, офисов, ресторанов, баров, гостиниц, мини-производств и т.д. Компактные бытовые системы этой компании предназначены для установки под кухонную мойку. Система состоит из блока обратного осмоса, накопительного бака для чистой воды и элементов, необходимых для подключения системы к водопроводу и канализации. Система ставится на доочистку воды, уже очищенной до уровня технической, т.е. предназначеной для подключения к трубопроводу технической воды. Выпускаются обратноосмотические системы из 3-х, 4-х и 5-и ступеней, но собственно обратноосмотическая мембрана находится только в одной из них. Остальные являются ступенями предварительной очистки. Если водоснабжение дома обеспечивается из городской водопроводной сети, то достаточно использовать только 3-ступенчатую обратноосмотическую систему очистки питьевой воды.
Общая емкость резервуаров составляет 26 000 м3. 5.6.2. Обратноосмотические системы компании UNIFILTER На российском рынке успешно работает компания UNIFILTER (www.unifilter.ru), предлагающая полный спектр фильтров и систем водоочистки для квартир, домов, дач, офисов, ресторанов, баров, гостиниц, мини-производств и т.д. Компактные бытовые системы этой компании предназначены для установки под кухонную мойку. Система состоит из блока обратного осмоса, накопительного бака для чистой воды и элементов, необходимых для подключения системы к водопроводу и канализации. Система ставится на доочистку воды, уже очищенной до уровня технической, т.е. предназначеной для подключения к трубопроводу технической воды. Выпускаются обратноосмотические системы из 3-х, 4-х и 5-и ступеней, но собственно обратноосмотическая мембрана находится только в одной из них. Остальные являются ступенями предварительной очистки. Если водоснабжение дома обеспечивается из городской водопроводной сети, то достаточно использовать только 3-ступенчатую обратноосмотическую систему очистки питьевой воды.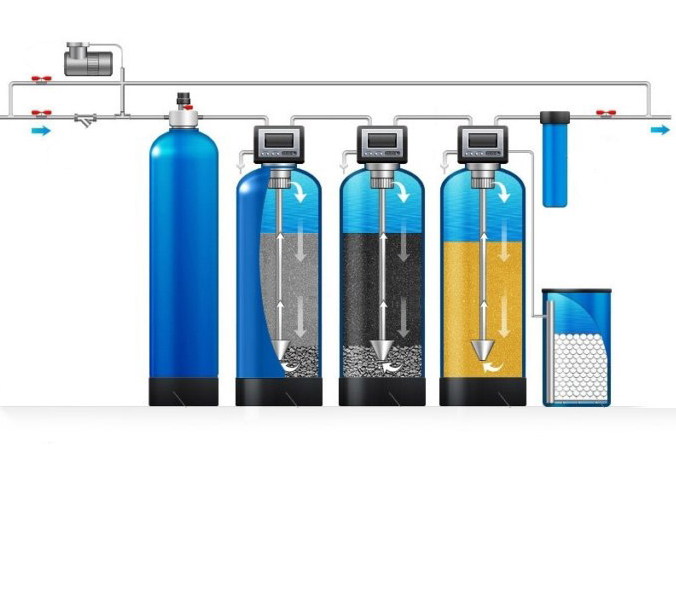 Литература 1. В.А. Присяжнюк «С.О.К.», 2004, №4, стр. 14–29. 2. Химический энциклопедический словарь. М., «Советская Энциклопедия», 1983. 3. В.А. Присяжнюк «С.О.К.», 2003, №10, стр. 26–30. 4. А.А. Фурман, С.С. Шрайбман. Приготовление и очистка рассола. М.: «Химия», 1966. 5. А.А. Громогласов, А.Ф. Копылов, А.П. Пильщиков, Водоподготовка: процессы и аппараты, М.: «Энергоатомиздат», 199О. 6. В.П. Миненко, В.А. Присяжнюк и др. Статический смеситель-реактор. Авт. свид. СССР N848049 от 03.05.78. М. Кл. 3 С 01 F 5/00. Опубликовано 23.07.1981. Бюл. №27.
Литература 1. В.А. Присяжнюк «С.О.К.», 2004, №4, стр. 14–29. 2. Химический энциклопедический словарь. М., «Советская Энциклопедия», 1983. 3. В.А. Присяжнюк «С.О.К.», 2003, №10, стр. 26–30. 4. А.А. Фурман, С.С. Шрайбман. Приготовление и очистка рассола. М.: «Химия», 1966. 5. А.А. Громогласов, А.Ф. Копылов, А.П. Пильщиков, Водоподготовка: процессы и аппараты, М.: «Энергоатомиздат», 199О. 6. В.П. Миненко, В.А. Присяжнюк и др. Статический смеситель-реактор. Авт. свид. СССР N848049 от 03.05.78. М. Кл. 3 С 01 F 5/00. Опубликовано 23.07.1981. Бюл. №27.Проведение коагуляции и известкования | Наладка и обслуживание установки химического обессоливания воды
- Подробности
- Категория: Генерация
- генерация
- ТЭС
- эксплуатация
- ремонт
- ввод в работу
- вода
Содержание материала
- Наладка и обслуживание установки химического обессоливания воды
- Сведения об исходной воде и ее качестве
- Влияние качества исходной воды на выбор схемы
- Описание схемы обессоливающей установки
- Проведение пуско-наладочных работ
- Прием из монтажа осветлителя, баков, осветлительного фильтра
- Прием из монтажа ионитовых фильтров, декарбонизатора, дозировочных устройств
- Опробование оборудования, установки
- Пуск, наладка и организация эксплуатации водоподготовительной установки
- Химический контроль при проведении пусконаладочных работ
- Загрузка и подготовка к работе осветлительных фильтров
- Загрузка и подготовка к работе катионитовых фильтров
- Загрузка и подготовка к работе анионитовых фильтров
- Известкование и коагуляция воды в осветлителях
- Коагулянтов хозяйство и дозировка коагулянта, извести
- Проведение коагуляции и известкования
- Применение флокулянтов
- Неполадки в работе осветлится, определение концентрации известкового молока
- Коагуляция воды сернокислым алюминием
- Пуск и наладка, работа, эксплуатация осветлителя
- Опыты по коагуляции в лабораторных условиях
- Определение весовой и объемной концентрации шлама в осветлителе
- Обслуживание осветлительных фильтров
- Эксплуатация осветлительных фильтров
- Эксплуатация Н-катионитовых фильтров и кислотного хозяйства
- Н-катионитовые фильтры I ступени
- Н-катионитовые фильтры II и III ступеней
- Последовательная регенерация Н-катионитовых фильтров
- Предвключенные фильтры, кислотное хозяйство, расчет дозировки серной кислоты
- Обслуживание и эксплуатация фильтров активированного угля
- Эксплуатация анионитовых фильтров и щелочного хозяйства
- Эксплуатация анионитовых фильтров I ступени
- Эксплуатация сильноосновных анионитовых фильтров II и III ступеней
- Проведение последовательной регенерации анионитовых фильтров
- Щелочное хозяйство, расчет количества едкого натра
- Ориентировочный объем оперативного химического контроля на обессоливающей установке
- Нейтрализация кислых сбросных вод
- Обслуживание водоподготовительного оборудования с противокоррозионным покрытием
- Хранение ионообменных материалов, литература
Страница 16 из 39
- Перед пуском в работу осветлителя, как указывалось выше, в лаборатории производится анализ исходной воды и подбор дозировок реагентов.
 Количество 100%-ной извести, необходимой для умягчения воды, может быть рассчитано по формуле
Количество 100%-ной извести, необходимой для умягчения воды, может быть рассчитано по формуле
где G — количество 100 »/о-ной извести, кг/ч;
— жесткость карбонатная, мг-экв/кг·,
Нщ — жесткость магниевая, мг-экв/кг;
Исо — содержание свободной углекислоты в исходной воде, мг-экв/кг·, Нкоаг—дозировка коагулянта, мг-экв/кг\
Н«ас — избыточная щелочность, обычно ее принимают равной 0,3— 0,4 мг-экв/кг·,
Q — производительность водоподготовительной установки. м3/ч.
Зная содержание СаО в технической извести, можно легко рассчитать ее часовой расход. Дозировка раствора извести уточняется при проведении пуско-наладочных работ. - После подбора дозировок готовятся рабочие растворы извести и коагулянта, определяются их концентрации и производится регулировка дозаторов. Необходимую интенсивность перемешивания воды с реагентами находят последовательным опробованием подводящих сопл с различным диаметром выходных сечений на подводе воды в осветлитель.

- По окончании подготовительных работ осветлитель включают в эксплуатацию. Для этого подогретую воду подают в конус осветлителя с регулированием производительности по расходомеру. После этого включаются в работу дозаторы извести и коагулянта.
- Контроль дозировки ведется по расходу реагентов и по качеству воды в осветлителе. Работа дозаторов при необходимости корректируется в соответствии с анализами проб воды. При пуске незаполненного водой осветлителя его работа нарушается в связи с тем, что водой захватывается большое количество воздуха. Воздух производит интенсивное взмучивание и вынос образующейся взвеси, что препятствует образованию шламового фильтра. Поэтому в течение некоторого времени (примерно 2 ч после пуска) выходящая из осветлителя вода бывает мутной. После заполнения осветлителя начинается нормальное накопление шлама и работа осветлителя улучшается.
- После того как осветлитель начнет выдавать хорошо осветленную воду, работа дозаторов контролируется 1—2 раза в смену и, кроме того, всякий раз при значительном изменении производительности водоподготовительной установки (более чем на 15—20%).
 Определение концентрации реагентов и качества известкованно-коагулированной воды из осветлителя производится по общему для всей установки графику.
Определение концентрации реагентов и качества известкованно-коагулированной воды из осветлителя производится по общему для всей установки графику. - Все работающие осветлители должны быть равномерно загружены. Подача воды на осветлители регулируется с помощью задвижек и расходомеров, установленных на линиях подачи исходной воды на соответствующий осветлитель. Разверка распределения воды по отдельным осветлителям свыше 10% считается недопустимой.
- Время пребывания воды в осветлителе должно быть не менее 2 ч (оно определяет производительность осветлителя данного объема). Колебания температуры доп\стимы в пределах ±1°С (§ 433 ПТЭ).
- Во время эксплуатации осветлителей необходимо следить за чистотой их кольцевых сборных желобов и верхней дренажной решетки (см. рис. 3). Кольцевой сборный желоб и верхнюю дренажную решетку следует раз в месяц чистить щеткой* и промывать из брандспойта. Желательно 2 раза в год останавливать и очищать весь осветлитель.
- Частота удаления шлама из осветлителя (периодическая продувка из грязевика и конуса осветлителя) и величина непрерывной продувки шламоуплотнителя устанавливаются опытным путем для каждого времени года в зависимости от изменения качества воды.

- Высота шламового фильтра определяется при проведении пуско-наладочных работ. В зависимости от качества воды в разное время года высота шламового фильтра может несколько изменяться. Ориентировочно можно принять, что верхняя граница шламового фильтра находится на уровне верхних шламоотводных окон центральной шламоотводной трубы. Выше шламового фильтра находится слой осветленной воды: чем выше высота этого слоя, тем более надежной является работа осветлителя. Для осветлителя типа ЦНИИ-1 толщину слоя осветленной воды можно принять равной примерно 2 м.
- Контроль качества шлама производится отбором его через пробоотборочные точки I, II. Ill, V (см. рис. 3) в прозрачную склянку. Чтобы избежать засорения шламом пробоотборных трубок, верхние участки их, расположенные внутри осветлителя, лучше выполнять в виде крючков с открытым срезом, направленным вниз. Отобранный шлам должен иметь зернистую структуру, быстро оседать. Появление слизистого, бесструктурного шлама свидетельствует о неудовлетворительном проведении процесса известкования и коагуляции.

- Считается, что количество воды, выдаваемой шламоуплотнителем составляет 12—15% от количества воды, выдаваемой осветлителем, на практике же обычно эта величина составляет 4—6%. Количество выдаваемой шламоуплотнителем воды регулируется с помощью задвижки 8 (см. рис. 3). По прозрачности она не должна отличаться от воды, выдаваемой осветлителем. Появление в этой воде шлама свидетельствует о начавшемся засорении шламоуплотнителя.
- Результатом проведения известкования и коагуляции должно быть снижение окисляемости на 60—80% от первоначальной, а также снижение содержания кремнекислоты в среднем на 20—50% **. Щелочность известкованно-коагулированной воды до и после осветлительного фильтра не должна отличаться больше чем на 0,15 мг-экв/кг. Большая разность щелочности свидетельствует о нестабильности обработанной воды. т. е. о неудовлетворительном протекании процесса обработки ее.
- После окончания пусконаладочных работ проводится испытание осветлителя — определяется его максимальная производительность.

- В тех случаях, когда осветлитель приходится останавливать в резерв, на время, измеряемое несколькими часами, целесообразно его отключать не полностью, а перевести на минимальную производительность, с тем, чтобы по возможности замедлить оседание шлама. Если же осветлитель отключается на длительное время, шлам лучше выдувать, так как он оседает и «поднять» его при последующем пуске осветлителя очень трудно, а иногда и вовсе невозможно. В этом случае лучше снова накопить шлам, причем для ускорения этого процесса можно прибегнуть к перепусканию шлама из действующего осветлителя во вновь включаемый. Для этого дренажи осветлителей соединяются с помощью гибкого рукава, открываются дренажные задвижки, после чего происходит перетекание шлама из одного осветлителя в другой.
- При останове осветлителя отключают дозаторы коагулянта и известкового молока, закрывают задвижки на линии додачи исходной воды на осветлитель и на линии выдачи осветленной воды. Затем осветлитель опорожняют, открывая задвижки на линиях периодической и непрерывной продувки.

* При защите внутренних поверхностей осветлителя антикоррозионными покрытиями пользоваться металлической щеткой не рекомендуется.
** Снижение содержания кремнекислоты в известкованной воде зависит от начального содержания в воде катиона магния.
- Назад
- Вперёд
- Назад
- Вперёд
- Вы здесь:
- Главная
- Архив
- Генерация
- Применение фторсодержащих ПАВ для повышения надежности работы турбоагрегатов
Еще по теме:
- Возможность эксплуатации котла ТП-170 на пониженных параметрах перегретого пара
- Опыт эксплуатации рассолодобычных скважин на территориях ТЭС
- Борьба с накипеобразованием в теплообменниках
- Особенности эрозионного износа рабочих лопаток теплофикационных паровых турбин
- Обоснование способа ремонта эрозионно-изношенных паротурбинных лопаток
1.
 7: Смягчение извести — Workforce LibreTexts
7: Смягчение извести — Workforce LibreTexts- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 5729
- John Rowe
- College of the Canyons via ZTC Textbooks
Цели обучения
- Описать жесткую и мягкую воду
- Объясните жесткость воды
- Объяснить мягкую воду
- Описание размягчения известью
Жесткость воды технически обусловлена катионами двухвалентных металлов, которые способны реагировать с мылом с образованием осадков и с некоторыми анионами, присутствующими в воде, с образованием накипи. Кальций и магний обычно являются единственными катионами, присутствующими в значительных концентрациях. Жесткость обычно считается выражением общей концентрации ионов кальция и магния, присутствующих в воде. Если какие-либо ионы металлов присутствуют в значительных количествах, их следует учитывать при определении жесткости.
Жесткость обычно считается выражением общей концентрации ионов кальция и магния, присутствующих в воде. Если какие-либо ионы металлов присутствуют в значительных количествах, их следует учитывать при определении жесткости.
Жесткая вода – это вода с высоким содержанием ионов кальция и магния. Вода считается жесткой, если ее жесткость превышает типичную жесткость воды в данном регионе. Жесткая вода определяется как вода с жесткостью более 100 мг/л по карбонату кальция.
Жесткость – это характеристика воды, обусловленная солями кальция и магния, такими как бикарбонаты, карбонаты, сульфаты, хлориды и нитраты. Чрезмерная жесткость воды нежелательна, так как она вызывает образование мыльного творога, повышенное использование мыла, отложение накипи в котлах, повреждения в некоторых промышленных процессах, а также вызывает неприятный привкус в питьевой воде.
Кальциевую жесткость вызывают ионы кальция (Ca+2). Магниевая жесткость обусловлена ионами магния (Mg+2). Общая жесткость – это сумма жесткостей, вызванных ионами кальция и магния. Карбонатная жесткость обусловлена присутствующей в воде щелочностью вплоть до общей жесткости. Это значение обычно меньше общей жесткости. Некарбонатная жесткость – это часть общей жесткости, превышающая щелочность.
Карбонатная жесткость обусловлена присутствующей в воде щелочностью вплоть до общей жесткости. Это значение обычно меньше общей жесткости. Некарбонатная жесткость – это часть общей жесткости, превышающая щелочность.
Щелочность – это способность воды или сточных вод нейтрализовать кислоты. Эта способность обусловлена содержанием в воде карбонатов, бикарбонатов, гидроксидов, а иногда и боратов, силикатов и фосфатов. Щелочность выражается в мг/л эквивалентного карбоната кальция. Щелочность – это не то же самое, что pH, потому что вода не обязательно должна быть сильно щелочной, чтобы иметь высокую щелочность. Щелочность — это мера того, сколько кислоты нужно добавить в жидкость, чтобы понизить pH до 4,5.
Карбонат кальция представляет собой выражение концентрации определенных компонентов в воде с точки зрения их эквивалентного значения по отношению к карбонату кальция.
Растворенные в воде минералы вызывают трудности при стирке и мытье посуды в домашнем хозяйстве. Эти ионы вызывают образование покрытия внутри водонагревателя, похожего на покрытие в чайнике после многократного использования.
Эти ионы вызывают образование покрытия внутри водонагревателя, похожего на покрытие в чайнике после многократного использования.
Жесткость сокращает срок службы тканей, стираемых в жесткой воде. Накипь или творог могут застрять в волокнах ткани и привести к тому, что они потеряют свою мягкость и эластичность.
В промышленности твердость может вызвать большие проблемы. На многие процессы влияет жесткость используемой воды. Промышленные предприятия, использующие котлы для обработки пара или тепла, должны удалять жесткость своей подпиточной воды, помимо того, что сделали бы водоочистные сооружения. Причина в том, что минералы оседают на трубах котла и образуют накипь. Эта накипь образует изоляционный барьер, препятствующий надлежащей теплопередаче, что приводит к чрезмерному потреблению энергии котлом.
Помимо устранения жесткости воды, другие преимущества умягчения включают:
- Удаление железа и марганца
- Борьба с коррозией при достижении надлежащей стабилизации воды
- Дезинфекция из-за высоких значений pH при использовании извести
- Уменьшение вкуса и запаха
- Снижение общего содержания твердых веществ в процессе обработки известью
- Удаление радиоактивности
Некоторые из возможных ограничений умягчения включают следующее:
- Остаточный свободный хлор представляет собой преимущественно гипохлорит при уровне pH выше 7,5 и менее эффективен
- Затраты и выгоды должны быть тщательно взвешены, чтобы оправдать смягчение
- Окончательная утилизация технологических отходов
- Уровни pH, связанные с умягчающим химическим осаждением тригалометановой фракции в очищенной воде, могут повышаться
- Производство агрессивной воды, которая может вызвать коррозию ионов металлов из трубопроводов распределительной системы.
 Жесткая вода не вызывает коррозии трубы. Чрезмерно жесткая вода может привести к образованию накипи на внутренней стороне труб и ограничению потока.
Жесткая вода не вызывает коррозии трубы. Чрезмерно жесткая вода может привести к образованию накипи на внутренней стороне труб и ограничению потока.
Решение об умягчении воды остается за каждым сообществом, потому что умягчение осуществляется в основном в качестве обслуживания клиентов. Жесткая вода не оказывает вредного воздействия на здоровье, но может вызвать несколько нежелательных побочных эффектов:
- Со временем моющее средство, потребляемое жесткой водой, может стать дорогостоящим.
- Проблемы с накипью на приспособлениях будут более заметными
- Срок службы некоторых видов тканей сократится при многократной стирке в жесткой воде. Кроме того, остатки могут оставаться на одежде, создавая грязный вид.
Для умягчения воды используются два распространенных метода. Это химическое осаждение (кальцинированная известь) и ионный обмен. Ионообменное умягчение применяется для воды с высокой негазированной жесткостью и общей жесткостью не более 350 мг/л.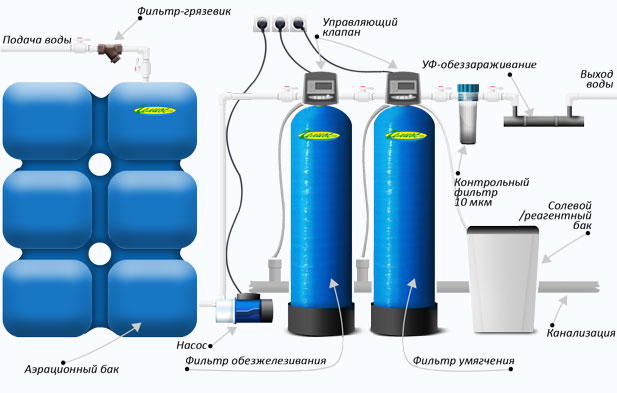 Этот метод умягчения может производить воду с нулевой жесткостью, в отличие от умягчения известью, при котором нулевая жесткость не может быть достигнута.
Этот метод умягчения может производить воду с нулевой жесткостью, в отличие от умягчения известью, при котором нулевая жесткость не может быть достигнута.
Ионообменное умягчение также устраняет некарбонатную жесткость без добавления кальцинированной соды, которая требуется при умягчении известью. Ионный обмен является неселективным методом умягчения. Этот метод удаляет общую жесткость, которая является суммой карбонатной и некарбонатной жесткости.
Ограничение процессов ионообменного умягчения включает увеличение содержания натрия в умягченной воде, если ионообменник регенерируется хлоридом натрия. Уровень натрия не должен превышать 20 мг/л в очищенной воде из-за потенциально вредного воздействия на людей, предрасположенных к гипертонии. Окончательная утилизация отработанного солевого раствора и промывочной воды из умягчителей может стать серьезной проблемой для многих установок.
Жесткость обусловлена присутствием в воде катионов двухвалентных металлов. Жесткость – это фактор, обычно измеряемый титрованием.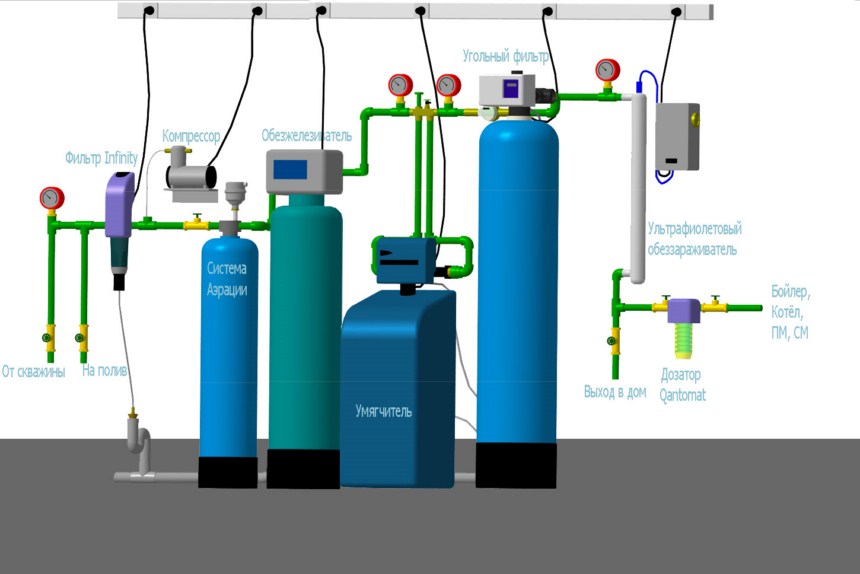 Отдельные двухвалентные катионы можно измерить в лаборатории с помощью атомно-абсорбционного спектрофотометра для точной работы. Жесткость обычно указывается в эквиваленте карбоната кальция. Эта процедура позволяет операторам комбинировать или суммировать жесткость, вызванную кальцием и магнием, и сообщать об общей жесткости.
Отдельные двухвалентные катионы можно измерить в лаборатории с помощью атомно-абсорбционного спектрофотометра для точной работы. Жесткость обычно указывается в эквиваленте карбоната кальция. Эта процедура позволяет операторам комбинировать или суммировать жесткость, вызванную кальцием и магнием, и сообщать об общей жесткости.
- Кальциевая жесткость, мг/л s CaCO3 = (кальций, мг/л) (эквивалентная масса CaCO3)/(эквивалентная масса кальция)
- Эквивалентная масса кальция = атомная масса/валентность
Чтобы выразить жесткость воды по магнию в эквиваленте карбоната кальция:
- Жесткость по магнию, мг/л в пересчете на CaCO3 = (магний, мг/л) (эквивалентный вес CaCO3)/(эквивалентный вес магния)
При очистке воды важно значение pH. pH воды можно увеличить или уменьшить путем добавления определенных химических веществ, используемых для обработки воды. Во многих случаях влияние добавления одного химического вещества на pH нейтрализуется добавлением другого химического вещества. При умягчении воды с помощью химических процессов осаждения, таких как умягчение извести и соды, pH должен быть повышен до 11, чтобы произошла желаемая химическая реакция. Уровни углекислого газа, ионов бикарбоната и ионов карбоната в воде очень чувствительны к pH.
При умягчении воды с помощью химических процессов осаждения, таких как умягчение извести и соды, pH должен быть повышен до 11, чтобы произошла желаемая химическая реакция. Уровни углекислого газа, ионов бикарбоната и ионов карбоната в воде очень чувствительны к pH.
Стабильность очищенной воды определяется путем измерения pH и расчета индекса Ланжелье. Этот показатель отражает равновесный рН воды по отношению к кальцию и щелочности.
- Индекс Ланжелье (LI) = pH – pH, где…
- pH = фактический pH воды
- рН = рН, при котором вода с такой же щелочностью и содержанием кальция просто насыщается карбонатом кальция
Отрицательный индекс Ланжелье указывает на коррозионную активность воды, а положительный индекс указывает на образование накипи в воде. После того, как вода была умягчена, очищенная вода, подаваемая потребителям, должна быть стабильной, что означает, что вода не должна быть коррозионно-активной и не образующей накипи.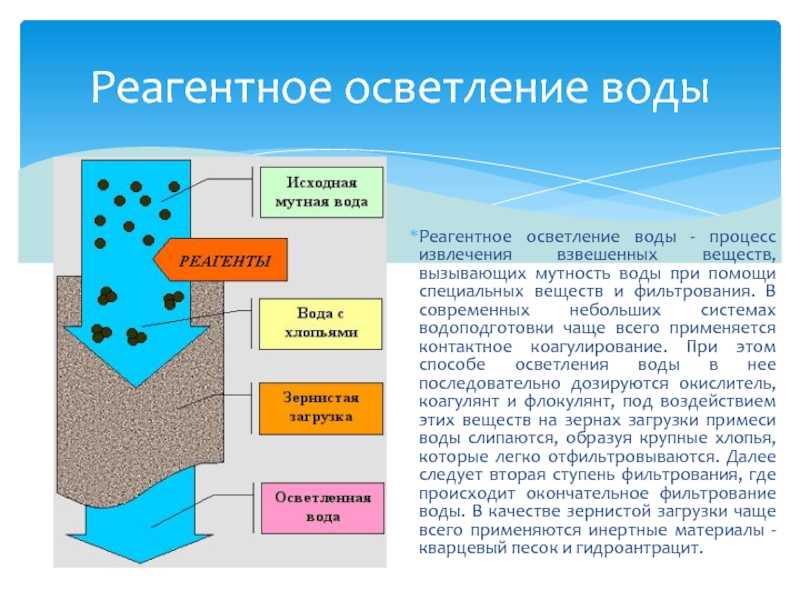
Щелочность
Щелочность – это способность воды нейтрализовать кислоты. Эта способность обусловлена содержанием в воде карбоната, бикарбоната, гидроксида, бората, силиката и фосфата. Щелочность выражается в мг/л эквивалентного карбоната кальция. Щелочность не то же самое, что рН.
Щелочность измеряется в лаборатории путем добавления растворов цветовых индикаторов. Затем щелочность определяется количеством кислоты, необходимой для достижения конечной точки титрования для определенного изменения цвета. Конечная точка P (фенолфталеин) составляет pH 8,3. Когда pH ниже 8,3, щелочность P отсутствует. Когда pH выше 8,3, присутствует щелочность P. При pH выше 8,3 двуокись углерода отсутствует, поэтому при наличии щелочности P в воде нет двуокиси углерода. Кроме того, гидроксидная и карбонатная щелочность отсутствует при рН ниже 8,3.
Взаимосвязь между различными компонентами щелочности, такими как бикарбонат, карбонат и гидроксид, может быть основана на щелочности P (фенолфталеин) и T (общий или метиловый оранжевый).
Когда pH меньше 8,3, вся щелочность находится в бикарбонатной форме и обычно называется естественной щелочностью. Когда pH выше 8,3, щелочность может состоять из бикарбоната, карбоната и гидроксида. По мере увеличения pH щелочность постепенно переходит в карбонатную и гидроксидную формы.
Общая щелочность представляет собой сумму бикарбонатов, карбонатов и гидроксидов. Каждое из этих значений может быть определено путем измерения щелочности P и T в лаборатории. Щелочность выражается в мг/л в эквиваленте карбоната кальция.
Умягчение
Жесткость не полностью удаляется методами химического осаждения, используемыми на водоочистных сооружениях. Жесткость не может быть снижена до нуля с помощью метода химического осаждения для умягчения воды. Воду, имеющую жесткость 150 мг/л в виде карбоната кальция или выше, обычно обрабатывают для снижения жесткости до 80–9.0 мг/л при использовании умягчения в качестве опции водоподготовки.
Минимальная жесткость, которая может быть достигнута в процессах умягчения извести и кальцинированной соды, составляет от 30 до 40 мг/л в пересчете на карбонат кальция. Независимо от способа умягчения воды потребитель обычно получает купажированную воду с жесткостью 80-90 мг/л в виде карбоната кальция при использовании умягчения на водоочистных сооружениях.
Независимо от способа умягчения воды потребитель обычно получает купажированную воду с жесткостью 80-90 мг/л в виде карбоната кальция при использовании умягчения на водоочистных сооружениях.
Известково-содовое умягчение дает дополнительные преимущества в дополнение к умягчению воды. К преимуществам относятся:
- Удаление железа и марганца
- Восстановление твердых веществ
- Удаление и инактивация бактерий и вирусов в условиях высокого pH, используемых при лечении
- Борьба с коррозией и образованием накипи с помощью надлежащей стабилизации очищенной воды
- Удаление избытка фтора
Ограничения процесса умягчения извести и соды включают:
- Невозможность удалить всю жесткость
- Для максимальной эффективности затрат, устранения жесткости и стабильности воды оператор должен осуществлять высокий уровень контроля.
- Удаление цвета может быть затруднено процессом размягчения из-за высокого уровня pH
- Образуется большое количество шлама, с которым необходимо обращаться и утилизировать приемлемым образом.

Chemical Reaction
При химическом осаждении ионы, вызывающие жесткость, превращаются в нерастворимые формы. Кальций и магний становятся менее растворимыми по мере увеличения рН. Кальций и магний могут быть удалены из воды в виде нерастворимых осадков при высоких уровнях рН.
Добавление извести в воду увеличивает концентрацию гидроксида, что приводит к увеличению pH. Добавление извести к воде также преобразует щелочность из бикарбонатной формы в карбонатную, что приводит к осаждению кальция в виде карбоната кальция. По мере добавления в воду дополнительной извести щелочность фенолфталеина увеличивается до уровня, при котором появляется гидроксид, что позволяет магнию осаждаться в виде гидроксида магния.
После процесса химического умягчения pH становится высоким, и вода становится перенасыщенной избытком едкой щелочи в форме гидроксида или карбоната. Углекислый газ можно использовать для снижения едкости и склонности воды к образованию накипи перед фильтрацией.
Углекислый газ можно использовать для снижения едкости и склонности воды к образованию накипи перед фильтрацией.
Химические реакции, происходящие в воде в процессе химического осаждения, зависят от того, является ли удаляемая жесткость карбонатной или некарбонатной. Карбонатная жесткость, временная жесткость, устраняется только известью. Для устранения некарбонатной жесткости, постоянной жесткости требуется известь и кальцинированная сода.
Химикаты
Известь, используемая в процессе химического умягчения осадков, может быть гашеной известью, (Ca(OH)2, гидроксидом кальция или оксидом кальция, CaO. Гашеную известь можно использовать непосредственно. Оксид кальция или негашеную известь необходимо сначала Этот процесс включает добавление оксида кальция в воду и ее нагревание, чтобы вызвать гашение, то есть образование гидроксида кальция (Ca(OH)2) перед использованием. Небольшие предприятия обычно используют гашеную известь. Крупные предприятия считают более экономичным используйте негашеную известь (CaO) и гасите ее на месте.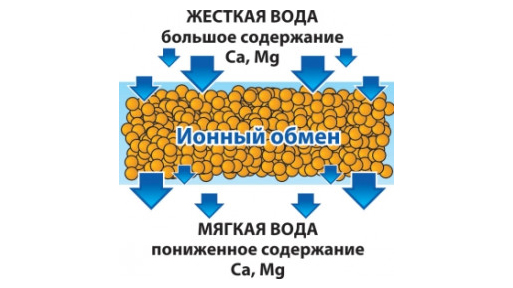
Применение извести для устранения карбонатной жесткости также удаляет углекислый газ. Углекислый газ не влияет на жесткость, и его не нужно удалять. Однако диоксид углерода будет потреблять часть используемой извести, что необходимо учитывать при дозировании.
При добавлении извести в воду углекислый газ, присутствующий в воде, превращается в карбонат кальция при добавлении достаточного количества извести. При добавлении извести бикарбонат кальция будет осаждаться в виде карбоната кальция. Для удаления бикарбоната кальция и магния необходимо использовать избыток извести.
Жесткость карбоната магния требует добавления извести и кальцинированной соды, Na2CO3.
Основными продуктами химических реакций процесса умягчения извести и соды являются карбонат кальция и гидроксид магния. Очищенная вода была химически изменена и больше не является стабильной из-за изменений pH и щелочности. Умягченная известково-кальцинированной водой вода обычно перенасыщена карбонатом кальция.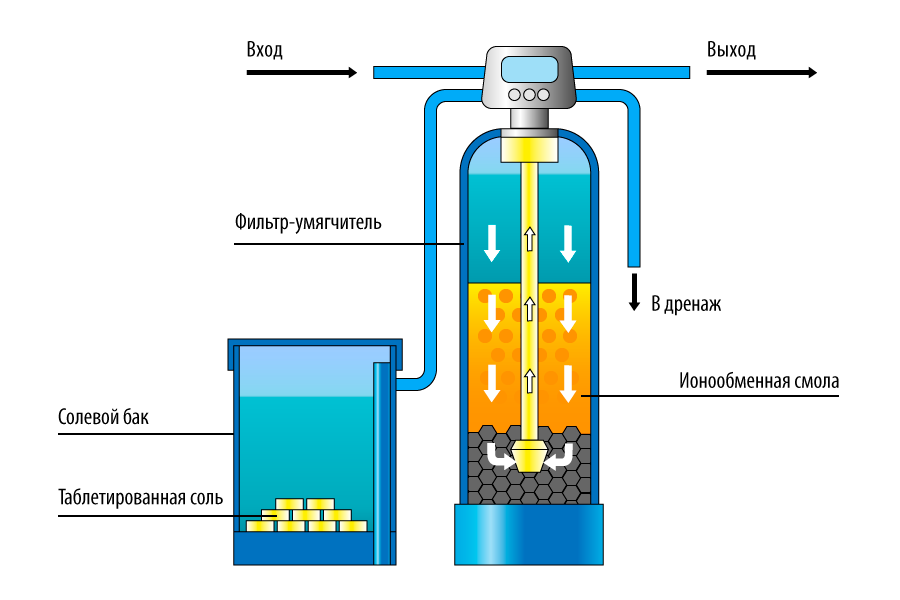 Степень нестабильности и избытка карбоната кальция зависит от степени умягчения воды. Жесткость карбоната кальция устраняется при более низком pH, чем жесткость карбоната магния. Если практикуется максимальное удаление карбонатной жесткости, так что для удаления жесткости карбоната магния требуется высокий рН, вода будет перенасыщена карбонатом кальция и гидроксидом магния. В этих условиях в фильтрах и трубопроводах будет происходить отложение осадков.
Степень нестабильности и избытка карбоната кальция зависит от степени умягчения воды. Жесткость карбоната кальция устраняется при более низком pH, чем жесткость карбоната магния. Если практикуется максимальное удаление карбонатной жесткости, так что для удаления жесткости карбоната магния требуется высокий рН, вода будет перенасыщена карбонатом кальция и гидроксидом магния. В этих условиях в фильтрах и трубопроводах будет происходить отложение осадков.
Добавление избытка извести для устранения жесткости карбоната магния приводит к перенасыщению и остатку извести, что приводит к pH около 10,9. Избыток извести называется едкой щелочностью, так как он повышает рН. Если затем снизить рН, произойдет лучшее осаждение карбоната кальция и гидроксида магния. Щелочность также будет снижена. Этот процесс обычно осуществляется путем закачки углекислого газа в воду. Это добавление к очищенной воде называется повторной карбонизацией.
Повторная карбонизация может проводиться в два этапа.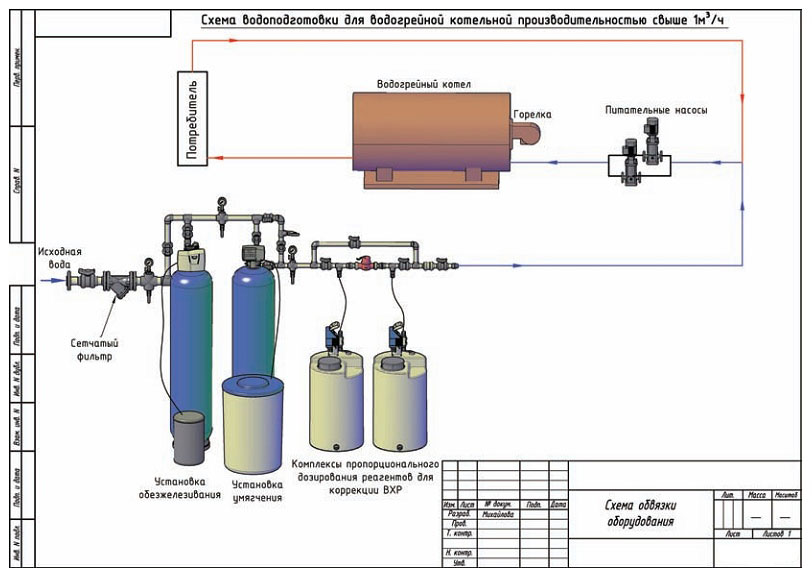 Первое добавление диоксида углерода должно следовать за добавлением избытка извести, чтобы снизить рН примерно до 10,4 и способствовать осаждению карбоната кальция и гидроксида магния. Второе добавление углекислого газа после обработки устраняет некарбонатную жесткость. рН снижается примерно до 9,8, что способствует осаждению. Выполняя повторную карбонизацию перед фильтрацией, можно предотвратить или свести к минимуму накопление избытка извести и осадков карбоната кальция и гидроксида магния в фильтрах.
Первое добавление диоксида углерода должно следовать за добавлением избытка извести, чтобы снизить рН примерно до 10,4 и способствовать осаждению карбоната кальция и гидроксида магния. Второе добавление углекислого газа после обработки устраняет некарбонатную жесткость. рН снижается примерно до 9,8, что способствует осаждению. Выполняя повторную карбонизацию перед фильтрацией, можно предотвратить или свести к минимуму накопление избытка извести и осадков карбоната кальция и гидроксида магния в фильтрах.
При повторной карбонизации следует соблюдать осторожность. Подача избыточного количества углекислого газа может не привести к снижению жесткости, так как осадки карбоната кальция возвращаются в раствор и вызывают карбонатную жесткость.
Альтернативным методом умягчения кальцинированной извести и соды является использование гидроксида натрия (NaOH), который называется едким натром. Химические реакции с использованием каустической соды показывают, что при удалении углекислого газа и карбонатной жесткости образуется карбонат натрия (кальцинированная сода), который вступает в реакцию с удалением некарбонатной жесткости. Гидроксид натрия заменяет кальцинированную соду и часть извести для устранения карбонатной жесткости. Использование каустической соды может иметь несколько преимуществ, включая стабильность при хранении, меньшее образование осадка и простоту обращения.
Гидроксид натрия заменяет кальцинированную соду и часть извести для устранения карбонатной жесткости. Использование каустической соды может иметь несколько преимуществ, включая стабильность при хранении, меньшее образование осадка и простоту обращения.
Смягчение ионным обменом
Электрически заряженные атомы или молекулы известны как ионы. В процессах ионообменной обработки используются специальные смолы для удаления из воды заряженных неорганических загрязнителей, таких как мышьяк, хром, нитраты, кальций, радий, уран и избыток фтора. Когда исходная вода проходит через ряд шариков смолы, она обменивает свои заряженные загрязнители на безвредные заряженные ионы, хранящиеся на поверхности смолы. Загрязнения накапливаются на смолах и должны периодически очищаться раствором, перезаряжающим сменные ионы.
Ионообменная смола бывает двух видов: катионообменные смолы, которые заменяют катионы, такие как кальций, магний и радий, и анионообменные смолы, которые используются для удаления анионов, таких как нитраты, арсенаты, арсениты или хроматы.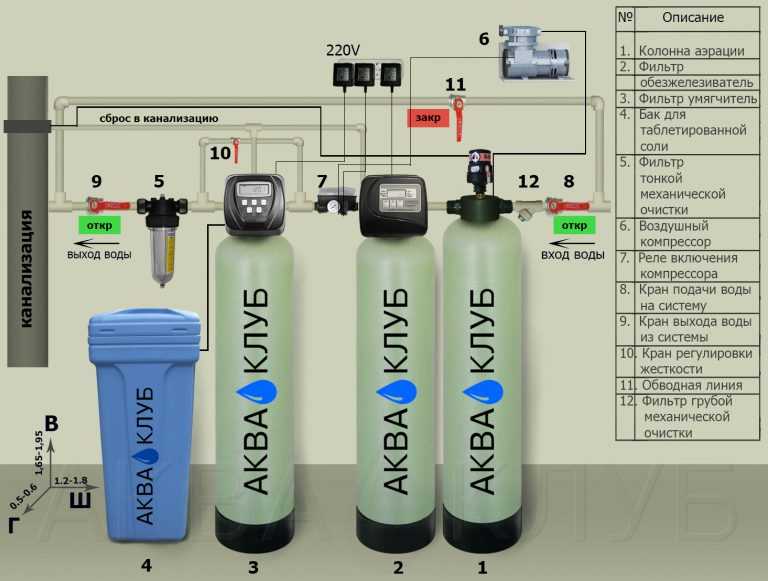 Каждый тип смолы обычно регенерируется раствором соли (хлорид натрия). В случае катионитов ион натрия вытесняет катион с места обмена, а в случае анионитов ион хлорида вытесняет анион с места обмена. Как правило, катиониты более устойчивы к загрязнению, чем аниониты. Смолы могут быть разработаны так, чтобы отдавать предпочтение определенным ионам, чтобы процесс можно было легко адаптировать к широкому спектру различных загрязнителей. Этот процесс обработки лучше всего работает с водой, не содержащей частиц, потому что частицы могут накапливаться на смоле и ограничивать ее эффективность.
Каждый тип смолы обычно регенерируется раствором соли (хлорид натрия). В случае катионитов ион натрия вытесняет катион с места обмена, а в случае анионитов ион хлорида вытесняет анион с места обмена. Как правило, катиониты более устойчивы к загрязнению, чем аниониты. Смолы могут быть разработаны так, чтобы отдавать предпочтение определенным ионам, чтобы процесс можно было легко адаптировать к широкому спектру различных загрязнителей. Этот процесс обработки лучше всего работает с водой, не содержащей частиц, потому что частицы могут накапливаться на смоле и ограничивать ее эффективность.
Ионный обмен — это обычная система очистки воды, которую можно масштабировать, чтобы она соответствовала очистным сооружениям любого размера. Он также может быть приспособлен для обработки воды на уровне точки потребления и точки входа.
Активированный оксид алюминия
Обработка активированным оксидом алюминия используется для привлечения и удаления загрязняющих веществ, таких как мышьяк и фторид, которые имеют отрицательно заряженные ионы. Активированный оксид алюминия (оксид алюминия) обычно помещают в канистры, через которые пропускается исходная вода для очистки. Ряд таких канистр может быть соединен вместе, чтобы соответствовать требованиям к объему воды в любой конкретной системе.
Активированный оксид алюминия (оксид алюминия) обычно помещают в канистры, через которые пропускается исходная вода для очистки. Ряд таких канистр может быть соединен вместе, чтобы соответствовать требованиям к объему воды в любой конкретной системе.
Поскольку глинозем поглощает загрязняющие вещества, он теряет способность очищать воду. Поэтому необходимо тщательно контролировать качество очищенной воды, чтобы гарантировать замену картриджей до того, как они потеряют эффективность очистки. Кроме того, на емкость оксида алюминия сильно влияет рН воды. Более низкие значения pH действуют лучше. Во многих системах для решения этой задачи используется предварительная обработка кислотой.
Качество исходной воды является важным фактором для систем с активированным оксидом алюминия. Средство для обработки будет притягивать загрязняющие вещества, а также другие отрицательно заряженные ионы, содержащиеся в исходной воде. Эта характеристика может ограничивать способность глинозема притягивать и удалять целевые загрязнения.
Технология активированного глинозема может быть дорогостоящей, а ее стоимость связана с удалением загрязненной воды, которая образуется, когда глинозем очищается от загрязняющих веществ и перезаряжается для будущего использования. Крупномасштабные системы с активированным оксидом алюминия также требуют высокого уровня опыта эксплуатации и технического обслуживания и, следовательно, относительно редки. Небольшие системы более распространены и могут быть адаптированы к конкретным требованиям к объему воды.
Смешивание
Ионообменные умягчители производят воду с нулевой жесткостью. Воду с нулевой жесткостью нельзя направлять в распределительную систему. Вода с нулевой жесткостью вызывает коррозию и со временем будет разрушать стальные трубы в системе и вызывать проблемы с красной водой.
На большинстве умягчительных установок стоки с нулевой жесткостью из умягчителей смешиваются с отфильтрованной водой с известной концентрацией жесткости. Некоторое количество воды, которое производит завод, не проходит процесс умягчения. Эта вода имеет известную концентрацию жесткости и смешивается в различных пропорциях со стоками умягчителя для достижения желаемого уровня жесткости готовой воды.
Эта вода имеет известную концентрацию жесткости и смешивается в различных пропорциях со стоками умягчителя для достижения желаемого уровня жесткости готовой воды.
Смешивание воды очень просто и обычно контролируется клапаном и счетчиком. Оператор регулирует точное количество галлонов в минуту, минуя умягчитель, для получения желаемой жесткости.
Контрольные вопросы
- Опишите жесткую и мягкую воду.
- Объясните жесткость воды.
- Объясните, что такое мягкая вода.
- Описание размягчения известью
Контрольные вопросы
- ________ обычно считается выражением общей концентрации ионов кальция и магния, присутствующих в воде.
- Мягкость
- Твердость
- Стабилизация
- Щелочность
- ________ — способность воды или сточных вод нейтрализовать кислоты.
 Эта способность обусловлена содержанием в воде карбонатов, бикарбонатов, гидроксидов, а иногда и боратов, силикатов и фосфатов.
Эта способность обусловлена содержанием в воде карбонатов, бикарбонатов, гидроксидов, а иногда и боратов, силикатов и фосфатов.- Мягкость
- Твердость
- Стабилизация
- Щелочность
- ______выражается в мг/л эквивалента карбоната кальция.
- Мягкость
- Твердость
- Стабилизация
- Щелочность
- В дополнение к удалению жесткости воды, что из следующего не является преимуществом умягчения?
- Удаление железа и марганца
- Борьба с коррозией при достижении надлежащей стабилизации воды
- Дезинфекция из-за высоких значений pH при использовании извести
- Производство агрессивной воды, которая может вызвать коррозию ионов металлов из трубопроводов системы распределения
- Что из следующего не является типичным ограничением умягчения?
- Остаточный свободный хлор представляет собой преимущественно гипохлорит при уровне pH выше 7,5
- Удаление радиоактивности
- Удаление технологических отходов
- При уровнях pH, связанных с размягчением, химическое осаждение тригалометана
- Фракция в очищенной воде может увеличиваться
- _________ применяется для умягчения воды с высокой негазированной жесткостью, общая жесткость которой не превышает 350 мг/л.

- Лайм
- Известь-кальцинированная сода
- Гидроксид кальция
- Ионообменное умягчение
- Ограничение ________ процессов включает увеличение содержания натрия в умягченной воде, если ионообменник регенерируется хлоридом натрия. Уровень натрия не должен превышать 20 мг/л в очищенной воде из-за потенциально вредного воздействия на людей, предрасположенных к гипертонии.
- Лайм
- Известь-кальцинированная сода
- Гидроксид кальция
- Ионообменное умягчение
- Первичными продуктами химических реакций известково-содового умягчения являются _______ и __________.
- Гидроксид кальция, гидроксид магния
- Карбонат кальция, карбонат магния
- Карбонат кальция, гидроксид магния
- Гидроксид кальция, карбонат магния
- Электрически заряженные атомы или молекулы известны как ______.

- Катионы
- Анионы
- электронов
- ионов
- Смолы обычно регенерируют с помощью _______.
- Хлорид натрия
- Калий хлорид
- Хлорид железа
- Соляная кислота
- Обработка активированным оксидом алюминия используется для привлечения и удаления ______, содержащих отрицательно заряженные ионы. Активированный оксид алюминия (оксид алюминия) обычно помещают в канистры, через которые пропускается исходная вода для очистки. Ряд таких канистр может быть соединен вместе, чтобы соответствовать требованиям к объему воды в любой конкретной системе.
- Железо и магний
- Магний и кальций
- Нитраты и нитриты
- Мышьяк и фтор
- Ионообменные умягчители производят воду с нулевой жесткостью.
 Воду с нулевой жесткостью нельзя направлять в распределительную систему. Вода с нулевой жесткостью ___________.
Воду с нулевой жесткостью нельзя направлять в распределительную систему. Вода с нулевой жесткостью ___________.- Жесткая вода
- Агрессивная вода
- Вода, образующая накипь
- Черная вода
- На большинстве установок по умягчению стоки с нулевой жесткостью из умягчителей смешиваются с отфильтрованной водой с известной концентрацией жесткости в процессе, называемом ______.
- Смешивание
- Консервация
- Окисление
- Ничего из вышеперечисленного
- Кальциевую жесткость вызывают ионы кальция (Ca+2). Магниевая жесткость обусловлена ионами магния (Mg+2). Общая жесткость – это сумма жесткостей, вызванных ионами кальция и магния. Карбонатная жесткость обусловлена наличием в воде _______ до полной жесткости.
- Мягкость
- Твердость
- Стабильность
- Щелочность
Эта страница под названием 1. 7: Lime Softening распространяется по лицензии CC BY, ее автор, ремикс и/или куратор — Джон Роу (ZTC Textbooks) .
7: Lime Softening распространяется по лицензии CC BY, ее автор, ремикс и/или куратор — Джон Роу (ZTC Textbooks) .
- Наверх
- Была ли эта статья полезной?
- Тип изделия
- Раздел или Страница
- Автор
- Джон Роу
- Лицензия
- СС BY
- Программа OER или Publisher
- Колледж Каньонов – Программа нулевой стоимости учебников
- Теги

Влияние отклонений притока на дозу полимерного коагулянта при умягчении теплой известью синтетической пластовой воды САГД
. 2021 15 июля; 200:117202.
doi: 10.1016/j.waters.2021.117202. Epub 2021 5 мая.
Лу Чжан 1 , Динеш Мишра 2 , Кайлун Чжан 2 , Василий Пердикакис 3 , Давид Перницкий 4 , Цинъе Лу 5
Принадлежности
- 1 Кафедра химической и нефтяной инженерии, Университет Калгари, Калгари, Альберта, T2N 1N4, Канада; Stantec Consulting Inc.
 , 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада.
, 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада. - 2 Факультет химической и нефтяной инженерии, Университет Калгари, Калгари, Альберта, T2N 1N4, Канада.
- 3 Suncor Energy, 150 6 Avenue, SW, Калгари, Альберта, T2P 3E3, Канада.
- 4 Stantec Consulting Inc., 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада.
- 5 Факультет химической и нефтяной инженерии, Университет Калгари, Калгари, Альберта, T2N 1N4, Канада. Электронный адрес: [email protected].
- PMID: 34015576
- DOI:
10.
 1016/j.waters.2021.117202
1016/j.waters.2021.117202
Лу Чжан и др. Вода Res. .
. 2021 15 июля; 200:117202.
doi: 10.1016/j.waters.2021.117202. Epub 2021 5 мая.
Авторы
Лу Чжан 1 , Динеш Мишра 2 , Кайлун Чжан 2 , Василий Пердикакис 3 , Давид Перницкий 4 , Цинъе Лу 5
Принадлежности
- 1 Кафедра химической и нефтяной инженерии, Университет Калгари, Калгари, Альберта, T2N 1N4, Канада; Stantec Consulting Inc.
 , 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада.
, 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада. - 2 Факультет химической и нефтяной инженерии, Университет Калгари, Калгари, Альберта, T2N 1N4, Канада.
- 3 Suncor Energy, 150 6 Avenue, SW, Калгари, Альберта, T2P 3E3, Канада.
- 4 Stantec Consulting Inc., 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада.
- 5 Факультет химической и нефтяной инженерии, Университет Калгари, Калгари, Альберта, T2N 1N4, Канада. Электронный адрес: [email protected].
- PMID: 34015576
- DOI:
10.
 1016/j.waters.2021.117202
1016/j.waters.2021.117202
Абстрактный
Умягчение теплой известью обычно используется для снижения жесткости, содержания кремнезема и небольшой доли органических веществ в попутной воде с помощью гравитационного дренажа с паром (SAGD) за счет добавления извести, кальцинированной соды, MgO, коагулянта и флокулянта. Мы сообщаем о систематическом исследовании влияния химии растворов на потребность в эпихлоргидрин-диметиламиновом коагулянте для обработки синтетической пластовой воды SAGD. Концентрации магния, кальция, бикарбоната натрия, глины (имитирующие взвешенные вещества), метасиликата натрия (представляющие кремнезем) и гуминовой кислоты (имитирующие растворенные органические вещества) варьировали для изучения их влияния на потребность в коагулянте. Также изучалось влияние концентрации извести, кальцинированной соды и MgO на потребность в коагулянте. В исследованном диапазоне концентраций доза коагулянта линейно увеличивалась с увеличением концентрации гуминовой кислоты (Y коагулянта = 29 + 0,703X HA ) и кремнезема (Y коагулянт = 52 + 0,537X кремнезема ), и незначительно возрастала с увеличением концентрации извести и кальцинированной соды, но оставалась практически неизменной с увеличением концентрации растворенных твердость, глина или MgO. Наблюдения коррелировали с пониманием электрокинетических свойств частиц CaCO 3 и Mg(OH) 2 при размягчении известью. Полученные данные позволяют оценить дозу коагулянта на месте и оптимизировать процесс.
Наблюдения коррелировали с пониманием электрокинетических свойств частиц CaCO 3 и Mg(OH) 2 при размягчении известью. Полученные данные позволяют оценить дозу коагулянта на месте и оптимизировать процесс.
Ключевые слова: дзета-потенциал; коагуляция; паровой гравитационный дренаж; размягчение теплой известью.
Copyright © 2021. Опубликовано Elsevier Ltd.
Похожие статьи
Электрокинетическое исследование частиц карбоната кальция и гидроксида магния при размягчении извести.
Чжан Л., Мишра Д., Чжан К., Пердикакис Б., Перницкий Д., Лу К. Чжан Л. и др. Вода Res. 2020 1 ноября; 186:116415. doi: 10.1016/j.waters.2020.116415. Epub 2020 8 сентября. Вода Res. 2020. PMID: 32927423
Очистка паровой гравитационной дренажной воды с использованием низкой дозы коагулянта и окисления по Фентону.

Аль-Асад А., Хусейн М.М. Аль-Асад А. и др. Экологические технологии. 2014 авг; 35 (13-16): 16:30-8. doi: 10.1080/09593330.2013.877086. Экологические технологии. 2014. PMID: 24956753
Извлечение побочных продуктов из концентрата обратного осмоса регенерированной воды с использованием обработки известью и кальцинированной содой.
Мохаммадесмаили Ф., Бадр М.К., Аббасзадеган М., Фокс П. Мохаммадесмаили Ф. и др. Водная среда Res. 2010 г., апрель; 82(4):342-50. дои: 10.2175/106143009×12487095236919. Водная среда Res. 2010. PMID: 20432652
Удаление стронция из питьевой воды путем обычной обработки и умягчения извести в лабораторных исследованиях.
О’Доннелл А.Дж., Литл Д.А., Хармон С.
 , Ву К., Чайт Х., Дионисиу Д.Д.
О’Доннелл А.Дж. и соавт.
Вода Res. 2016 15 окт;103:319-333. doi: 10.1016/j.waters.2016.06.036. Epub 2016 21 июня.
Вода Res. 2016.
PMID: 27475121
Бесплатная статья ЧВК.
, Ву К., Чайт Х., Дионисиу Д.Д.
О’Доннелл А.Дж. и соавт.
Вода Res. 2016 15 окт;103:319-333. doi: 10.1016/j.waters.2016.06.036. Epub 2016 21 июня.
Вода Res. 2016.
PMID: 27475121
Бесплатная статья ЧВК.Новый экологически чистый метод эффективного управления процессом умягчения известковой воды.
Остовар М., Амири М. Остовар М. и соавт. Водная среда Res. 2013 г., декабрь 85(12):2285-93. дои: 10.2175/106143013×13807328848333. Водная среда Res. 2013. PMID: 24597044
Посмотреть все похожие статьи
термины MeSH
вещества
Качество извести, необходимое для очистки воды
Лицензионное соглашение ASTM
ВАЖНО – ВНИМАТЕЛЬНО ПРОЧИТАЙТЕ ЭТИ УСЛОВИЯ ПЕРЕД ЗАГРУЗКОЙ ЭТОГО ДОКУМЕНТА. Загружая документ ASTM, вы заключаете договор и признаете, что
у вас есть
читать
настоящего Лицензионного соглашения, что вы понимаете его и соглашаетесь соблюдать его
условия.
Если вы не согласны с условиями настоящего Лицензионного соглашения, немедленно покиньте эту страницу.
без
скачивание
документ ASTM.
Загружая документ ASTM, вы заключаете договор и признаете, что
у вас есть
читать
настоящего Лицензионного соглашения, что вы понимаете его и соглашаетесь соблюдать его
условия.
Если вы не согласны с условиями настоящего Лицензионного соглашения, немедленно покиньте эту страницу.
без
скачивание
документ ASTM.
Пожалуйста, нажмите здесь , чтобы просмотреть лицензионное соглашение для образовательных учреждений.
Собственность. Этот документ защищен авторским правом ASTM International (ASTM), 100
Барр Харбор Драйв, Западный Коншохокен, Пенсильвания, 19428-2959, США. Все права защищены. Вы (Лицензиат) не имеете прав собственности или других прав на Документ ASTM.
Это не продажа; все права, право собственности и интересы в документе ASTM (как в электронном файле
и печатная копия) принадлежат ASTM.
Вы не можете удалять или скрывать уведомление об авторских правах или другие уведомления, содержащиеся в ASTM.
Документ.
Все права защищены. Вы (Лицензиат) не имеете прав собственности или других прав на Документ ASTM.
Это не продажа; все права, право собственности и интересы в документе ASTM (как в электронном файле
и печатная копия) принадлежат ASTM.
Вы не можете удалять или скрывать уведомление об авторских правах или другие уведомления, содержащиеся в ASTM.
Документ.
Ограниченная лицензия. ASTM предоставляет вам ограниченную лицензию без права передачи следующим образом:
Право на загрузку электронного файла настоящего документа ASTM для временного хранения на одном
компьютер для просмотра и/или печати одной копии документа ASTM
для отдельных
использовать.
Ни электронный файл, ни одиночная распечатка не могут быть воспроизведены каким-либо образом. Кроме того, электронный файл не может распространяться где-либо еще по компьютерным сетям или
в противном случае.
То есть электронный файл нельзя отправить по электронной почте, скачать на диск, скопировать на другой жесткий диск.
диск или иным образом общий доступ. Одна печатная копия может быть распространена только среди других
сотрудники для их внутреннего использования в вашей организации; его нельзя копировать.
Этот документ ASTM не может быть продан или перепродан, сдан в аренду, сдан в аренду, одолжен или
сублицензия. Абонент будет нести ответственность за весь контроль доступа и безопасность
меры, необходимые для того, чтобы IP-адреса Абонента не использовались для
получать доступ к журналам, кроме авторизованных Пользователей.
Кроме того, электронный файл не может распространяться где-либо еще по компьютерным сетям или
в противном случае.
То есть электронный файл нельзя отправить по электронной почте, скачать на диск, скопировать на другой жесткий диск.
диск или иным образом общий доступ. Одна печатная копия может быть распространена только среди других
сотрудники для их внутреннего использования в вашей организации; его нельзя копировать.
Этот документ ASTM не может быть продан или перепродан, сдан в аренду, сдан в аренду, одолжен или
сублицензия. Абонент будет нести ответственность за весь контроль доступа и безопасность
меры, необходимые для того, чтобы IP-адреса Абонента не использовались для
получать доступ к журналам, кроме авторизованных Пользователей.
ASTM International предоставляет Подписчику и Авторизованному Пользователи у Абонента Авторизованы
Сайт , онлайн-доступ к журналу ASTM, для которого Подписчик поддерживает текущую
подписка
к печатной или онлайн-версии. Этот грант распространяется только на Подписчика и таких Уполномоченных
Пользователи индивидуально и не могут быть переданы или распространены на других. Для перепечатки А.
журнальную статью, пожалуйста, свяжитесь со службой поддержки клиентов ASTM, 100 Barr Harbour Dr., PO Box C700, West
Коншохокен, Пенсильвания 19428, тел.: 610-832-9555; факс: 610-832-9585; Эл. адрес: [email protected]
Этот грант распространяется только на Подписчика и таких Уполномоченных
Пользователи индивидуально и не могут быть переданы или распространены на других. Для перепечатки А.
журнальную статью, пожалуйста, свяжитесь со службой поддержки клиентов ASTM, 100 Barr Harbour Dr., PO Box C700, West
Коншохокен, Пенсильвания 19428, тел.: 610-832-9555; факс: 610-832-9585; Эл. адрес: [email protected]
Проверка: ASTM имеет право проверять соблюдение настоящей Лицензии.
Соглашение за свой счет и в любое время в течение обычного рабочего дня. Для этого
ASTM привлечет независимого консультанта при условии соблюдения соглашения о конфиденциальности для рассмотрения
использование вами документов ASTM. Вы соглашаетесь разрешить доступ к вашей информации и компьютерным системам
для этой цели.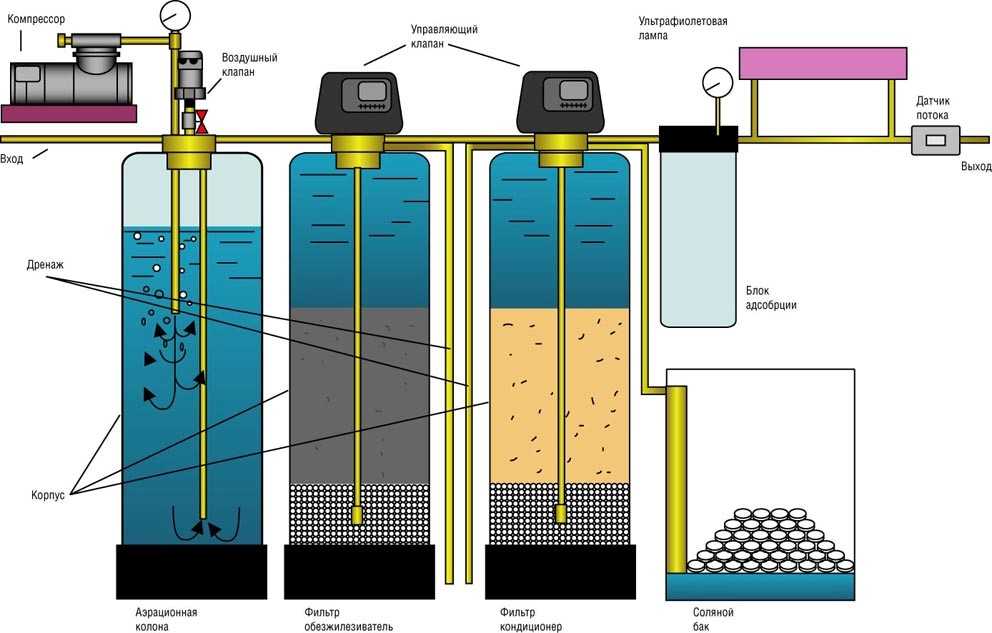 Проверка будет проводиться с уведомлением не менее чем за 15 дней в обычное время.
в рабочее время и таким образом, чтобы необоснованно не мешать вашей деятельности. Если
проверка выявляет нелицензионное использование документов ASTM, вы должны возместить ASTM расходы
понесенные при проверке и возмещении ASTM за любое нелицензионное использование. Вызывая эту процедуру,
ASTM не отказывается от каких-либо прав на обеспечение соблюдения настоящего Соглашения или на защиту своей интеллектуальной собственности.
собственности иными способами, разрешенными законом.
Проверка будет проводиться с уведомлением не менее чем за 15 дней в обычное время.
в рабочее время и таким образом, чтобы необоснованно не мешать вашей деятельности. Если
проверка выявляет нелицензионное использование документов ASTM, вы должны возместить ASTM расходы
понесенные при проверке и возмещении ASTM за любое нелицензионное использование. Вызывая эту процедуру,
ASTM не отказывается от каких-либо прав на обеспечение соблюдения настоящего Соглашения или на защиту своей интеллектуальной собственности.
собственности иными способами, разрешенными законом.
Пароли. Вы должны немедленно уведомить ASTM о любом известном или предполагаемом
несанкционированное использование вашего пароля или любое известное или предполагаемое нарушение безопасности, в том числе
потеря, кража или несанкционированное раскрытие вашего пароля или любой несанкционированный доступ или использование
документа ASTM. Вы несете единоличную ответственность за сохранение конфиденциальности ваших
пароль и для обеспечения санкционированного доступа и использования документа ASTM.
Вы несете единоличную ответственность за сохранение конфиденциальности ваших
пароль и для обеспечения санкционированного доступа и использования документа ASTM.
Определения. Для целей настоящей Лицензии авторизованный сайт является
локализованный сайт
(одно географическое местоположение), находящееся под единым управлением в одном месте. Для
Подписчик с местонахождением более чем в одном городе, каждый город считается отдельным сайтом.
Для Подписчика, имеющего несколько местоположений в одном городе, каждое место считается
другой сайт. (Если вам нужен онлайн-доступ к нескольким сайтам, свяжитесь с Кэти
Hooper, ASTM International, по адресу [email protected] или по телефону: 610-832-9.634). Авторизованный
Пользователь означает
только сотрудники, преподаватели, сотрудники и студенты, официально связанные с Подписчиком в
Авторизованный сайт, а также лица, имеющие законный доступ к фондам и объектам библиотеки.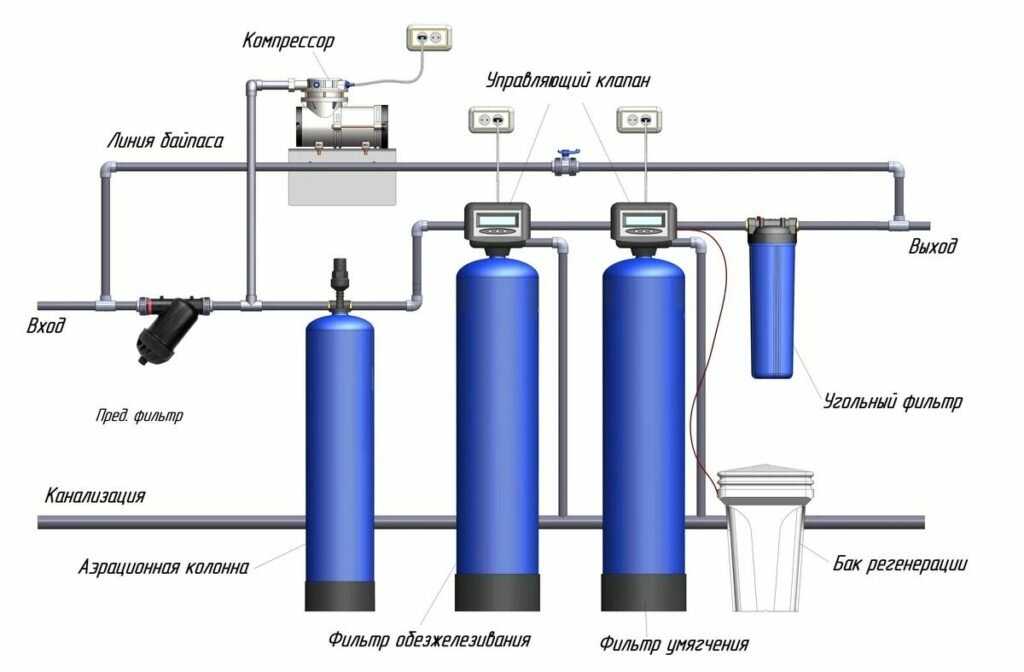 на Авторизованном сайте, используя IP-адрес в диапазоне, указанном в подписке.
Авторизованными пользователями могут быть лица, удаленные от физического местонахождения Абонента, доступ которых
администрируемых с Авторизованного объекта, но не лица, находящиеся на удаленных объектах или в кампусах с отдельными
администрации. Например, сотрудник Абонента может считаться
Авторизованный пользователь при доступе к сети Абонента из дома или во время поездки в другую
город; однако сотрудники филиала или объекта в другом городе не считаются
Авторизованные пользователи. Подписчик — физическое или юридическое лицо, подписавшееся на
журнал ASTM
и согласился с условиями этой ограниченной лицензии.
на Авторизованном сайте, используя IP-адрес в диапазоне, указанном в подписке.
Авторизованными пользователями могут быть лица, удаленные от физического местонахождения Абонента, доступ которых
администрируемых с Авторизованного объекта, но не лица, находящиеся на удаленных объектах или в кампусах с отдельными
администрации. Например, сотрудник Абонента может считаться
Авторизованный пользователь при доступе к сети Абонента из дома или во время поездки в другую
город; однако сотрудники филиала или объекта в другом городе не считаются
Авторизованные пользователи. Подписчик — физическое или юридическое лицо, подписавшееся на
журнал ASTM
и согласился с условиями этой ограниченной лицензии.
Прекращение. Настоящее Соглашение действует до момента расторжения. Вы можете расторгнуть настоящее Соглашение в любое время путем
уничтожение всех копий (печатных, цифровых или на любом носителе) документа ASTM (журнала).
Вы можете расторгнуть настоящее Соглашение в любое время путем
уничтожение всех копий (печатных, цифровых или на любом носителе) документа ASTM (журнала).
Применимое право, место проведения, юрисдикция. Настоящее Соглашение должно толковаться и толковаться в соответствии с законодательством Содружество Пенсильвании. Лицензиат соглашается подчиняться юрисдикции и месту проведения в штате и федеральные суды Пенсильвании для разрешения любых споров, которые могут возникнуть в связи с настоящим Соглашением. Ты также соглашаетесь отказаться от любых претензий на неприкосновенность, которыми вы можете обладать.
Интеграция. Настоящее Соглашение представляет собой полное соглашение между вами и ASTM в отношении его предмета. Это
заменяет все предыдущие или одновременные устные или письменные сообщения, предложения,
заявлений и гарантий и имеет преимущественную силу над любыми противоречащими или дополнительными условиями любого
цитата, заказ, подтверждение или другое сообщение между сторонами, относящееся к его предмету
вопрос в течение срока действия настоящего Соглашения. Никакие изменения настоящего Соглашения не будут иметь обязательной силы,
если они не оформлены в письменной форме и не подписаны уполномоченным представителем каждой из сторон.
Никакие изменения настоящего Соглашения не будут иметь обязательной силы,
если они не оформлены в письменной форме и не подписаны уполномоченным представителем каждой из сторон.
Отказ от гарантии. Если не указано иное в настоящем Соглашении, все явные или подразумеваемые условия, заявления и гарантии, включая любые подразумеваемые гарантии товарного состояния, пригодности для определенной цели или ненарушение прав, за исключением случаев, когда эти отказы считаются юридически недействительным.
Ограничение ответственности. В той мере, в какой это не запрещено законом, ASTM ни при каких обстоятельствах не будет нести ответственность за любые потери, повреждения, утерю
данных или за особый, косвенный, косвенный или штрафной ущерб, независимо от того,
теория ответственности, возникающая в связи с использованием или загрузкой ASTM
Документ.
 Количество 100%-ной извести, необходимой для умягчения воды, может быть рассчитано по формуле
Количество 100%-ной извести, необходимой для умягчения воды, может быть рассчитано по формуле
 Определение концентрации реагентов и качества известкованно-коагулированной воды из осветлителя производится по общему для всей установки графику.
Определение концентрации реагентов и качества известкованно-коагулированной воды из осветлителя производится по общему для всей установки графику.
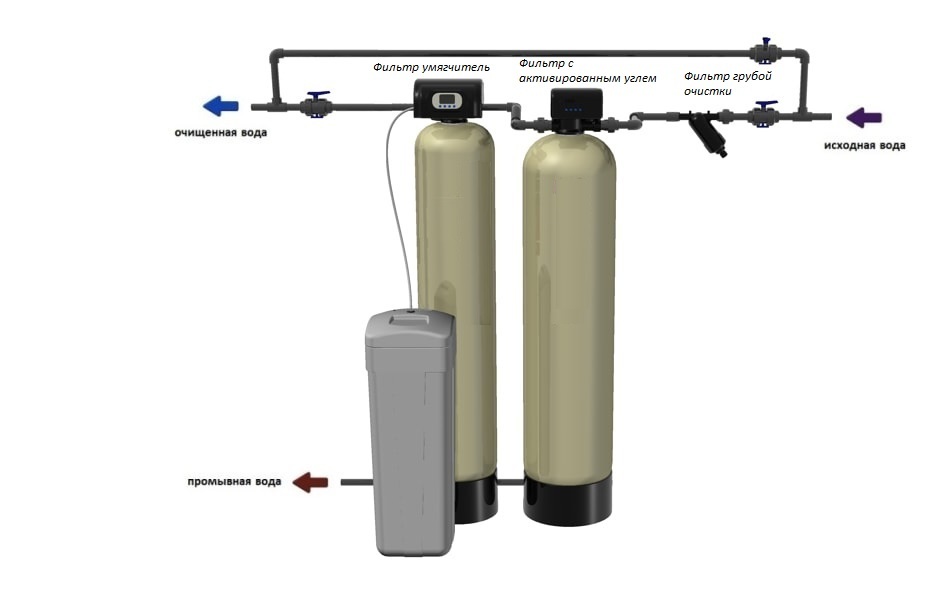

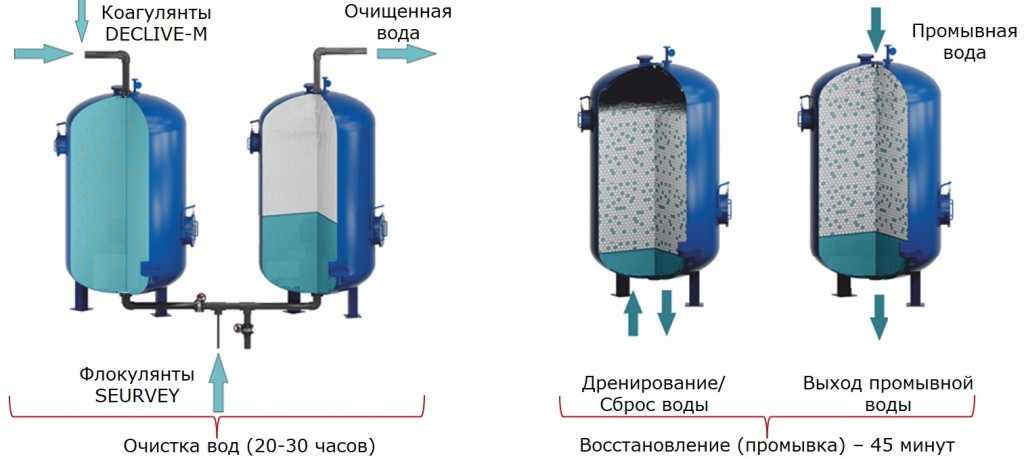
 Жесткая вода не вызывает коррозии трубы. Чрезмерно жесткая вода может привести к образованию накипи на внутренней стороне труб и ограничению потока.
Жесткая вода не вызывает коррозии трубы. Чрезмерно жесткая вода может привести к образованию накипи на внутренней стороне труб и ограничению потока.
 Эта способность обусловлена содержанием в воде карбонатов, бикарбонатов, гидроксидов, а иногда и боратов, силикатов и фосфатов.
Эта способность обусловлена содержанием в воде карбонатов, бикарбонатов, гидроксидов, а иногда и боратов, силикатов и фосфатов.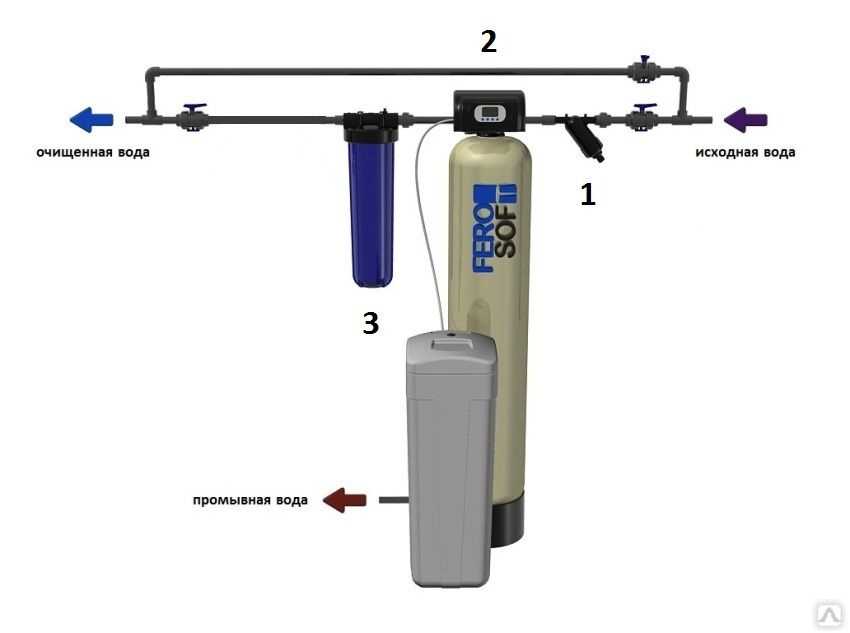

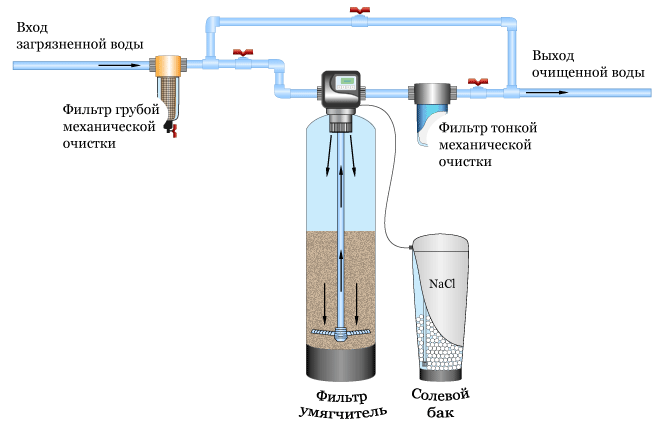 Воду с нулевой жесткостью нельзя направлять в распределительную систему. Вода с нулевой жесткостью ___________.
Воду с нулевой жесткостью нельзя направлять в распределительную систему. Вода с нулевой жесткостью ___________.
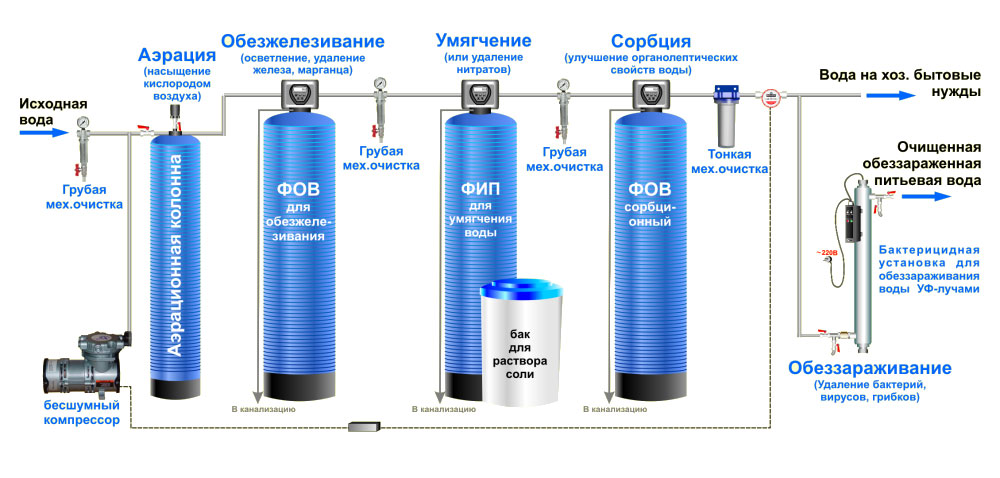 , 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада.
, 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада. 1016/j.waters.2021.117202
1016/j.waters.2021.117202 , 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада.
, 200-325 25 Street, SE, Калгари, Альберта, T2A 7H8, Канада. 1016/j.waters.2021.117202
1016/j.waters.2021.117202
 , Ву К., Чайт Х., Дионисиу Д.Д.
О’Доннелл А.Дж. и соавт.
Вода Res. 2016 15 окт;103:319-333. doi: 10.1016/j.waters.2016.06.036. Epub 2016 21 июня.
Вода Res. 2016.
PMID: 27475121
Бесплатная статья ЧВК.
, Ву К., Чайт Х., Дионисиу Д.Д.
О’Доннелл А.Дж. и соавт.
Вода Res. 2016 15 окт;103:319-333. doi: 10.1016/j.waters.2016.06.036. Epub 2016 21 июня.
Вода Res. 2016.
PMID: 27475121
Бесплатная статья ЧВК.