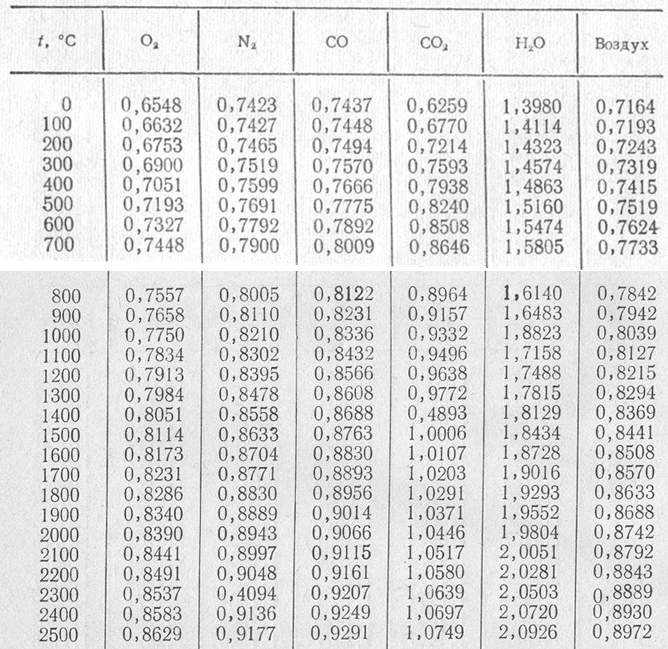
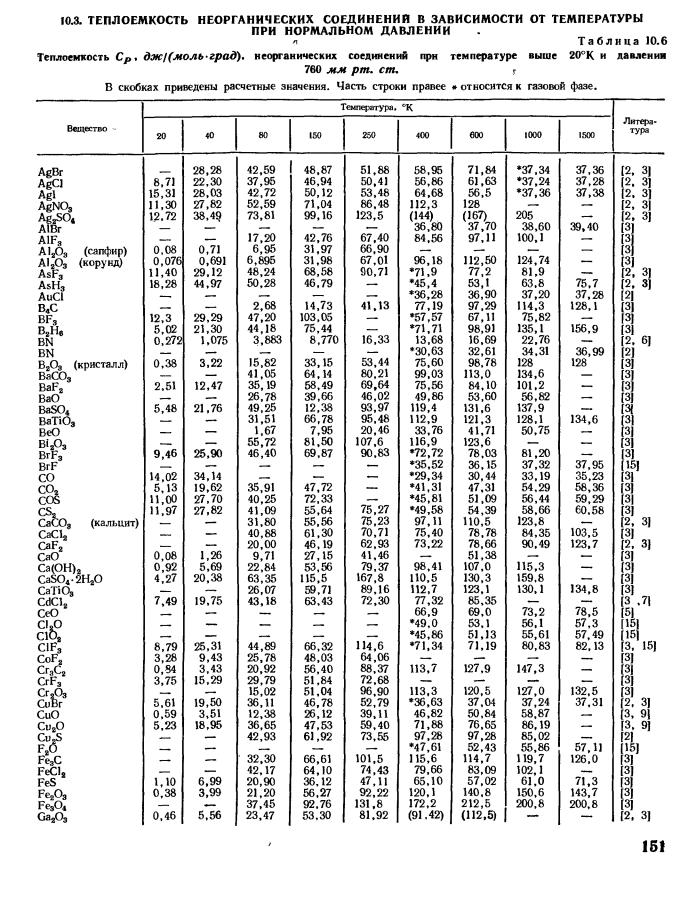
Массовая, объемная и мольная теплоемкости
Содержание:
Массовая, объемная и мольная теплоемкости
- При расчете удельной теплоемкости можно измерить в различных единицах количество материала, которому присвоена удельная теплоемкость W. Теплоемкость, соответствующая 1 кг вещества, называется массовой теплоемкостью Дж кг град. Теплоемкость, представляющая собой количество газа, занимающего объем, I л. Она называется объемной теплоемкостью C Дж м3 град.
Очевидно, наивысшая температура точки будет в том случае, когда будут предотвращены потери тепла с обратных сторон зеркала и когда на поверхности, подверженной солнечному излучению, отсутствует теплопроводность или конвекция. Людмила Фирмаль
Так как в пространстве объемом 1 м3 в зависимости от температуры
и давления помещается разное количество газа, то при установке объемной
теплоемкости необходимо указать, при каких условиях будет приниматься
количество газа, заполняющего 1 м3.
- Так как при нормальных физических условиях 1 м3 содержит определенное количество газа, то объемная теплоемкость и объем. При этих условиях фактически распределяются на вполне определенное количество массы, эквивалентное плотности газа при нормальных условиях ОКГ- если Q представляет собой количество тепла на 1 кмоль вещества, то теплоемкость называется молярной БФ. Города. Существует простая зависимость между теплоемкостью и J kg deg, C j l deg и si J kmol deg. В обычном состоянии в 1 Г3, газ в ОО кг включен, поэтому в обычном состоянии, 1 кг газа занимает объем Г3.Так… С cp0 — J1 и М Г рад. 4.5 с — с-ОП Дж кг веса хороший.
Интересно также вычислить, до какой температуры можно нагреть точку, расположенную в положении изображения Солнца, с помощью солнечного коллектора при оптимальных условиях.Людмила Фирмаль
Масса газа в 1 кмоль равна р кг Р-относительная молекулярная масса газа, а при нормальных условиях она принимает ID 22,4 м3 по закону Абу-хадро… pc 22,4 C Дж кмоль-град 4,7 ы Дж кг град 4.8 С 22 4 Дж Ост — 4 9 Вместо указания Cf. Name ПК используется больше often. It можно рассматривать как единичный символ молярной теплоемкости, так и как произведение молекулярной массы р и массовой теплоемкости С.
Если умножить уравнение манера 4.4 на молекулярную массу p, то получится ПЦР — и 8314 Дж кмоль-Град, 4. 10 где молярная теплоемкость газа при постоянном давлении равна J кмоль-град rg,, — молярная теплоемкость газа при постоянном объеме при j кмоль-град R-A1-Универсальная Газовая Постоянная j кмоль-в град.
Смотрите также:
4 Теплоемкость газов
4.1 Основные определения. Массовая, объемная и молярная теплоемкости
Если
к рабочему телу в каком-либо процессе
подвести теплоту или отвести от него
теплоту, то это приведет к изменению
его температуры.
Отношение количества теплоты подведенной к рабочему телу (или отведенной от рабочего тела) в данном процессе к изменению его температуры называется теплоемкостью тела (системы тел):
[Дж/К], (4.1)
где dQ – элементарное количество теплоты; dT – элементарное изменение температуры.
Количество теплоты, подведенное к рабочему телу (или отведенное от рабочего тела) в каком-либо процессе х, для изменения его температуры на определенное количество градусов зависит от количества рабочего тела. В зависимости от количественной единицы рабочего тела, к которому подводится теплота, в термодинамике различают массовую /удельную/, объемную и мольную теплоемкости
Удельная /массовая/ теплоемкость сх – это теплоемкость, отнесенная к единице массы рабочего тела:
[Дж/кгК]. (4.2)
(4.2)
Объемная теплоемкость c‘х – это теплоемкость, отнесенная к единице объема рабочего тела при нормальных физических условиях (Р = 101325 Па и Т = 273,15 К):
[Дж/м3К]. (4.3)
Мольная
[Дж/кмольК] (4.4)
где n – количество газа в молях.
Между указанными теплоемкостями существует следующая связь:
, (4.5)
где v0 – удельный объем при нормальных физических условиях; – молярная масса.
Изменение
температуры рабочего тела при одном и
том же количестве сообщаемой теплоты
зависит от процесса, в котором подводится
теплота, поэтому теплоемкость является
функцией процесса. Т.е. одно и то же
рабочее тело в зависимости от процесса
требует для своего нагрева на один
градус различное количество теплоты.
Численно величина с изменяется отдо.
Т.е. одно и то же
рабочее тело в зависимости от процесса
требует для своего нагрева на один
градус различное количество теплоты.
Численно величина с изменяется отдо.
4.2 Теплоемкость при постоянном давлении и при постоянном объеме. Уравнение Майера.
Как было отмечено ранее, теплоемкость зависит от характера термодинамического процесса, при котором подводится или отводится теплота, поэтому при экспериментальном определении ее значения обычно используют два термодинамических процесса: v = const и P = const. Значения теплоемкостей сv и cp для различных веществ сведены в таблицы и имеются в справочной литературе.
Известно, что (см. уравнение 4.1). Тогда для изохорного процесса:
(4.6)
Подведенная при постоянном объеме теплота, когда dl=0, расходуется только на изменение внутренней энергии du, поскольку в соответствии с первым законом термодинамики
 (4.7)
(4.7)Тогда, в соответствии с (4.7) имеем:
. (4.8)
Для изобарного процесса:
. (4.9)
При P = const некоторое количество теплоты идет также на совершение работы, поэтому для изменения температуры рабочего тела на 1К при P = const требуется большее количество теплоты, чем при v = const и, следовательно, cpсv.
Исходя из уравнений (4.7, 4.8, 4.9) и , имеем:
. (4.10)
Так как из уравнения состояния , то для идеального газа далее получаем:
.
Или:
.
(4.11)
Выражение
(4.11) называют уравнением
Майера.
Т.е. для изменения температуры рабочего тела в интервале температур от дов изобарном процессе 1-2Р (рис. 4.1) требуется большее количество теплоты, чем в изохорном процессе 1-2v. Это видно из изображения процессов в -диаграмме. Площадь, ограниченная кривой процесса и осью абсцисс, представляет собой количество теплоты, участвующей в процессе, и, т.е. пл.12ps2ps1 12vs2vs1
Рис. 4.1. К вычислению количества теплоты в термодинамическом процессе
В термодинамике часто используется отношение теплоемкости при постоянном давлении и постоянном объеме:
. (4.12)
С учетом изложенного выше, первый закон термодинамики может быть представлен в виде:
,
или
. (4.13)
(4.13)
В упрощенных расчетах используются постоянные значения мольных теплоемкостей, не зависящих от температуры (табл. 4.1).
Постоянные значения мольных теплоемкостей и показатель адиабаты
Таблица 4.1 – Постоянные значения мольных теплоемкостей
Атомность газа | Мольная теплоемкость, кДж/мольК | ||
Одноатомный | 12,5 | 20,8 | 1,67 |
Двухатомный | 20,8 | 29,1 | 1,4 |
Многоатомный | 25,0 | 33,3 | 1,33 |
Теплоемкости cp и сv не зависят ни от объема, ни от давления,
а являются однозначной функцией
температуры c = (T).
Отношение количества теплоты, подведенной или отведенной в данном процессе, к соответствующему изменению температурыназывается средней теплоемкостью тела в данном процессех:
.
Индекс т означает medium – средняя.
Предел, к которому стремится средняя теплоемкость при называется истинной теплоемкостью тела в данном процессех:
. (4.14)
В таблице 4.2 приведена классификация различных видов теплоемкости в зависимости от единиц количества вещества (массовые, объемные и мольные), температуры (истинные и средние) и процесса (изохорные и изобарные).
Классификация теплоемкостей
Таблица 4.2
Теплоемкость | Массовая, кДж/(кгК) | Объемная, кДж/(м3К) | Мольная, кДж/(мольК) | |||
истинная | средняя | истинная | средняя | истинная | средняя | |
Изохорная | ||||||
Изобарная | ||||||
Для многих теплотехнических расчетов зависимость принимают линейной так, что
. {T_2} C \mathrm{d}T.$$
{T_2} C \mathrm{d}T.$$
где $Q$ – количество теплоты процесса; $T_1$ и $T_2$ – температуры начала и конца процесса.
Удельной теплоёмкостью называется теплоёмкость, отнесённая к единичному количеству вещества. Количество вещества может быть измерено в килограммах, кубических метрах и молях. В зависимости от того, к какой количественной единице относится теплоёмкость, различают массовую, объёмную и молярную теплоёмкость.
Массовая удельная теплоёмкость $c$, также называемая просто удельной теплоёмкостью — это количество теплоты, которое необходимо подвести к единице массы вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на килограмм на кельвин (Дж·кг−1·К−1). Массовая удельная теплоёмкость связана с теплоемкостью тела следующим соотношением:
$$C = m·c.$$где $m$ – масса тела.
Молярная теплоёмкость $c_μ$ — это количество теплоты, которое необходимо подвести к 1 молю вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на моль на кельвин (Дж·моль−1·К−1). Массовая и киломольнаятеплоемкости связаны между собой следующей зависимостью:
В СИ измеряется в джоулях на моль на кельвин (Дж·моль−1·К−1). Массовая и киломольнаятеплоемкости связаны между собой следующей зависимостью:
где $\mu$ – молярная масса вещества.
Объёмная теплоёмкость $c′$ — это количество теплоты, которое необходимо подвести к единице объёма вещества, чтобы нагреть его на единицу температуры. В СИ измеряется в джоулях на кубический метр на кельвин (Дж·м−3·К−1). Киломольная и объемная теплоемкости связаны между собой следующей зависимостью:
$$c′ = \frac{c_μ}{22.4}.$$где $22.4$ – объем киломоля любого идеального газа в нормальных физических условиях (следствие из закона Авогадро), м3н /кмоль.
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа). {n} r_i·c_{μi}.$$
{n} r_i·c_{μi}.$$
В этих выражениях $g_i$, $r_i$ – соответственно массовая и объемная доля $i$-го компонента газовой смеси; $c_i$, $c′_i$, $c_{μi}$ – соответственно массовая, объемная и киломольная теплоемкость $i$-го компонента; $c_{см}$, $c′_{см}$, $c_{μсм}$ – соответственно массовая, объемная и киломольная теплоемкость газовой смеси; $i$ – номер компонента смеси; $n$ – число компонентов смеси.
Переход вещества из одного агрегатного состояния в другое сопровождается скачкообразным изменением теплоёмкости в конкретной для каждого вещества температурной точке превращения — температура плавления (переход твёрдого тела в жидкость), температура кипения (переход жидкости в газ) и, соответственно, температуры обратных превращений: замерзания и конденсации.
Теплоемкость газа и газовой смеси.
Теплоемкость газов
Понятие о теплоемкости
Замысловатый термин “теплоемкость” не что иное, как способность тела расходовать внешнюю тепловую энергию для повышения внутренней кинетической энергии собственных молекул, т. е. повышать температуру при подводе тепла извне.
Как мы уже знаем из предыдущих статей, повышение температуры любого вещества сопровождается увеличением кинетической энергии его частиц, скорость которых начинает возрастать. Этот процесс неизбежно сопровождается уменьшением внутренней потенциальной энергии молекул тела, поскольку они слабее взаимодействуют посредством гравитационных и электромагнитных полей (в первую очередь из-за увеличения расстояния между ними).
Различные вещества способны по-разному “впитывать” внешнюю энергию. Чтобы нагреть до определенной температуры, например, 1 кг нержавеющей стали, необходимо затратить значительно больше тепла, чем для нагрева 1 кг чугуна.
Подобный факт наталкивает на мысль о введении понятия некоторой способности материальных тел “захватывать” и “впитывать” поступающее от окружающей среды тепло. Именно этим физическим свойством материальных тел является теплоемкость.
Чтобы повысить температуру единицы количества вещества на dT, необходимо сообщить ему теплоту dq.
Отношение c = dq/dT называют удельной теплоемкостью вещества.
Удельная теплоемкость показывает, какое количество теплоты необходимо подвести к единице вещества, чтобы нагреть его на 1К (один градус Кельвина).
В зависимости от выбранной единице количества вещества различают массовую (отнесенную к 1 кг), киломольную (отнесенную к 1 кмолю) и объемную (отнесенную к 1 м3) удельные теплоемкости.
Удельная теплоемкость газа зависит от способа подвода к нему теплоты. Очевидно, что на основании определения теплоемкости и уравнения первого закона термодинамики можно записать:
c = dq/dT = (du + pdv)/dT = du/dT + pdv/dT.
Величину pdv/dT называют удельной работой. Она показывает, какую работу совершает единица количества газа при повышении его температуры на 1К.
Если при подводе теплоты к газу занимаемый им объем остается постоянным (v = const), то dv = 0 и удельная теплоемкость cv = du/dT, откуда du = cvdT.
Если же при подводе к газу теплоты его давление остается неизменным (p = const), то удельная теплоемкость будет равна:
cp = cv + pdv/dT. (1)
Следовательно, удельная теплоемкость при постоянном давлении больше удельной теплоемкости при постоянном объеме на удельную работу.
Если продифференцировать уравнение состояния pv = RT при p = const, получим выражение удельной работы для идеальных газов:
dA = pdv/dT = R. (2)
Эта формула позволяет уяснить физический смысл газовой постоянной. Газовая постоянная R – это работа, совершаемая единицей количества газа при нагревании на 1К, если теплота подводилась при постоянном давлении.
Подставив в уравнение (1) значение удельной газовой постоянной из формулы (2), получим уравнение Майера:
cv – cp = R.
Для идеального газа значения cp и cv постоянны, поэтому и отношение cp/cv = k тоже является величиной постоянной.
Нагревая идеальный газ от температуры T1 до T2 при постоянном объеме, необходимо подвести количество теплоты, равное:
qv = cv(T1 – T2),
а для нагревания при постоянном давлении:
qp = cp(T1 – T2).
***
Зависимость теплоемкости от температуры
Удельная теплоемкость реальных газов в отличие от идеальных газов зависит от давления и температуры. Зависимостью удельной теплоемкости от давления в практических расчетах можно пренебречь. Но зависимость удельной теплоемкости от температуры необходимо учитывать, поскольку она очень существенна.
Исследования показывают, что удельная теплоемкость реальных газов является сложной функцией температуры:
c = f(T).
Из этого следует, что в различных температурных интервалах для нагревания единицы количества газа на 1К требуется разное количество теплоты.
Однако, если выбрать достаточно узкий температурный интервал, то для него можно принять удельную теплоемкость постоянной. Очевидно, что если этот температурный интервал стремится к нулю, удельная теплоемкость соответствует истинной удельной теплоемкости при данной температуре:
c = lim Δq/ΔT при Т стремящемся к нулю, или c = dq/dT, откуда
dq = cdT.
Чтобы определить количество теплоты, необходимое для нагревания газа от T1 до T2, необходимо проинтегрировать полученную дифференциальную зависимость.
При практическом решении теплотехнических задач пользуются понятием средней удельной теплоемкости в заданном температурном интервале.
Средняя удельная теплоемкость (cm) газа в некотором интервале температур – это количество теплоты, которое необходимо подвести к газу или отвести от него, чтобы изменить температуру на 1К в данном температурном интервале.
***
Удельная теплоемкость газовой смеси
Под удельной массовой теплоемкостью ссм газовой смеси понимают количество теплоты, необходимое для нагревания 1 кг смеси на 1К. Очевидно, что это количество теплоты можно получить путем суммирования количества теплоты, необходимое для нагревания каждого компонента, входящего в состав смеси:
ссм = Σ cimi,
где:
ci – удельная массовая теплоемкость i-го компонента смеси;
mi – массовая доля этого компонента в смеси.
Аналогично можно определить удельную объемную теплоемкость газовой смеси – как сумму удельных объемных теплоемкостей ее компонентов. Удельная киломольная теплоемкость смеси газов определяется по формуле:
Удельная киломольная теплоемкость смеси газов определяется по формуле:
μсм ссм = Σ μiciri,
где: μi – молекулярная масса компонента смеси; ri – объемная доля компонента в составе смеси.
***
Термодинамические процессы
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине “Основы гидравлики и теплотехники”
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине “Основы гидравлики и теплотехники” (в формате Word):
Скачать календарно-тематический план
по учебной дисциплине “Основы гидравлики и теплотехники” (в формате Word):
Главная страница
Дистанционное образование
Специальности
Учебные дисциплины
Олимпиады и тесты
ТЕПЛОЕМКОСТЬ МОЛЬНАЯ, МАССОВАЯ И ОБЪЕМНАЯ
ТЕПЛОЕМКОСТЬ МОЛЬНАЯ, МАССОВАЯ И ОБЪЕМНАЯ
2 сентября, 2012 adminТеплоемкостью называется количество тепла, необходимое для нагревания единицы массы вещества на 1 °С. За единицу массы вещества в технических расчетах принимают 1 кмоль, 1 кг и 1 м3 при нормальных условиях (для газов). В соответствии с этим различают теплоемкость мольную, массовую и объемную. Массовая теплоемкость с равна мольной цс, деленной на молекулярный вес данного вещества М. Объемная теплоемкость С таза іраівна мольной теплоемкости, деленной на объем 1 моля идеального газа в кубометрах при нормальных условиях [41], т. е. на 22,41. Следовательно, імольная, массовая и объемная теплоемкости газов связаны уравнением
За единицу массы вещества в технических расчетах принимают 1 кмоль, 1 кг и 1 м3 при нормальных условиях (для газов). В соответствии с этим различают теплоемкость мольную, массовую и объемную. Массовая теплоемкость с равна мольной цс, деленной на молекулярный вес данного вещества М. Объемная теплоемкость С таза іраівна мольной теплоемкости, деленной на объем 1 моля идеального газа в кубометрах при нормальных условиях [41], т. е. на 22,41. Следовательно, імольная, массовая и объемная теплоемкости газов связаны уравнением
Цс=сМ = С-22,41.
Отсюда объемная теплоемкость газообразных продуктов сгорания топлива
C=cAf/22,41.
Теплоемкость газа зависит от того, в каких условиях осуществляется его нагревание (или охлаждение) — при постоянном давлении или при постоянном объеме. При нагревании газа при постоянном давлении затрачивается энергия на расширение газа. Вследствие этого теплоемкость при постоянном давлении больше теплоемкости при постоянном объеме [41].
Подсчитывая эффективность использования топлива в печах и котлах, обычно попользуют значения теплоемкости при постоянном давлении. Средняя теплоемкость — количество тепла, необходимое для изменения температуры единицы массы (или объема) вещества на 1 град в заданном температурном интервале, т. е. от ti до tz-
Средняя теплоемкость — количество тепла, необходимое для изменения температуры единицы массы (или объема) вещества на 1 град в заданном температурном интервале, т. е. от ti до tz-
Теплоемкость возрастает с повышением температуры, поэтому при нагреве воздуха или топлива от температуры ti до температуры tz истинная теплоемкость при температуре tz больше истинной теплоемкости при температуре U, а средняя теплоемкость от ti до tz больше истинной теплоемкости при температуре t, но меньше истинной теплоемкости при температуре t2. При охлаждении продуктов сгорания от температу,- ры t до температуры t% средняя теплоемкость в интервале температур от t до t2 меньше истинной теплоемкости при начальной температуре t и больше истинной теплоемкости при конечной температуре h. При определении эффективности использования топлива и подсчетах располагаемого тепла продуктов сгорания обычно применяют средние теплоемкости.
Комментирование и размещение ссылок запрещено.
| АБС пластик | 1300…2300 |
| Аглопоритобетон и бетон на топливных (котельных) шлаках | 840 |
| Алмаз | 502 |
| Аргиллит | 700…1000 |
| Асбест волокнистый | 1050 |
| Асбестоцемент | 1500 |
| Асботекстолит | 1670 |
| Асбошифер | 837 |
| Асфальт | 920…2100 |
| Асфальтобетон | 1680 |
| Аэрогель (Aspen aerogels) | 700 |
| Базальт | 850…920 |
| Барит | 461 |
| Береза | 1250 |
| Бетон | 710…1130 |
| Битумоперлит | 1130 |
| Битумы нефтяные строительные и кровельные | 1680 |
| Бумага | 1090…1500 |
| Вата минеральная | 920 |
| Вата стеклянная | 800 |
| Вата хлопчатобумажная | 1675 |
| Вата шлаковая | 750 |
| Вермикулит | 840 |
| Вермикулитобетон | 840 |
| Винипласт | 1000 |
| Войлок шерстяной | 1700 |
| Воск | 2930 |
| Газо- и пенобетон, газо- и пеносиликат, газо- и пенозолобетон | 840 |
| Гетинакс | 1400 |
| Гипс формованный сухой | 1050 |
| Гипсокартон | 950 |
| Глина | 750 |
| Глина огнеупорная | 800 |
| Глинозем | 700…840 |
| Гнейс (облицовка) | 880 |
| Гравий (наполнитель) | 850 |
| Гравий керамзитовый | 840 |
| Гравий шунгизитовый | 840 |
| Гранит (облицовка) | 880…920 |
| Графит | 708 |
| Грунт влажный (почва) | 2010 |
| Грунт лунный | 740 |
| Грунт песчаный | 900 |
| Грунт сухой | 850 |
| Гудрон | 1675 |
| Диабаз | 800…900 |
| Динас | 737 |
| Доломит | 600…1500 |
| Дуб | 2300 |
| Железобетон | 840 |
| Железобетон набивной | 840 |
| Зола древесная | 750 |
| Известняк (облицовка) | 850…920 |
| Изделия из вспученного перлита на битумном связующем | 1680 |
| Ил песчаный | 1000…2100 |
| Камень строительный | 920 |
| Капрон | 2300 |
| Карболит черный | 1900 |
| Картон гофрированный | 1150 |
| Картон облицовочный | 2300 |
| Картон плотный | 1200 |
| Картон строительный многослойный | 2390 |
| Каучук натуральный | 1400 |
| Кварц кристаллический | 836 |
| Кварцит | 700…1300 |
| Керамзит | 750 |
| Керамзитобетон и керамзитопенобетон | 840 |
| Кирпич динасовый | 905 |
| Кирпич карборундовый | 700 |
| Кирпич красный плотный | 840…880 |
| Кирпич магнезитовый | 1055 |
| Кирпич облицовочный | 880 |
| Кирпич огнеупорный полукислый | 885 |
| Кирпич силикатный | 750…840 |
| Кирпич строительный | 800 |
| Кирпич трепельный | 710 |
| Кирпич шамотный | 930 |
| Кладка «Поротон» | 900 |
| Кладка бутовая из камней средней плотности | 880 |
| Кладка газосиликатная | 880 |
| Кладка из глиняного обыкновенного кирпича | 880 |
| Кладка из керамического пустотного кирпича | 880 |
| Кладка из силикатного кирпича | 880 |
| Кладка из трепельного кирпича | 880 |
| Кладка из шлакового кирпича | 880 |
| Кокс порошкообразный | 1210 |
| Корунд | 711 |
| Краска масляная (эмаль) | 650…2000 |
| Кремний | 714 |
| Лава вулканическая | 840 |
| Латунь | 400 |
| Лед из тяжелой воды | 2220 |
| Лед при температуре 0°С | 2150 |
| Лед при температуре -100°С | 1170 |
| Лед при температуре -20°С | 1950 |
| Лед при температуре -60°С | 1700 |
| Линолеум | 1470 |
| Листы асбестоцементные плоские | 840 |
| Листы гипсовые обшивочные (сухая штукатурка) | 840 |
| Лузга подсолнечная | 1500 |
| Магнетит | 586 |
| Малахит | 740 |
| Маты и полосы из стекловолокна прошивные | 840 |
| Маты минераловатные прошивные и на синтетическом связующем | 840 |
| Мел | 800…880 |
| Миканит | 250 |
| Мипора | 1420 |
| Мрамор (облицовка) | 880 |
| Настил палубный | 1100 |
| Нафталин | 1300 |
| Нейлон | 1600 |
| Неопрен | 1700 |
| Пакля | 2300 |
| Парафин | 2890 |
| Паркет дубовый | 1100 |
| Паркет штучный | 880 |
| Паркет щитовой | 880 |
| Пемзобетон | 840 |
| Пенобетон | 840 |
| Пенопласт ПХВ-1 и ПВ-1 | 1260 |
| Пенополистирол | 1340 |
| Пенополистирол «Пеноплекс» | 1600 |
| Пенополиуретан | 1470 |
| Пеностекло или газостекло | 840 |
| Пергамин | 1680 |
| Перекрытие армокерамическое с бетонным заполнением без штукатурки | 850 |
| Перекрытие из железобетонных элементов со штукатуркой | 860 |
| Перекрытие монолитное плоское железобетонное | 840 |
| Перлитобетон | 840 |
| Перлитопласт-бетон | 1050 |
| Перлитофосфогелевые изделия | 1050 |
| Песок для строительных работ | 840 |
| Песок речной мелкий | 700…840 |
| Песок речной мелкий (влажный) | 2090 |
| Песок сахарный | 1260 |
| Песок сухой | 800 |
| Пихта | 2700 |
| Пластмасса полиэфирная | 1000…2300 |
| Плита пробковая | 1850 |
| Плиты алебастровые | 750 |
| Плиты древесно-волокнистые и древесно-стружечные (ДСП, ДВП) | 2300 |
| Плиты из гипса | 840 |
| Плиты из резольноформальдегидного пенопласта | 1680 |
| Плиты из стеклянного штапельного волокна на синтетическом связующем | 840 |
| Плиты камышитовые | 2300 |
| Плиты льнокостричные изоляционные | 2300 |
| Плиты минераловатные повышенной жесткости | 840 |
| Плиты минераловатные полужесткие на крахмальном связующем | 840 |
| Плиты торфяные теплоизоляционные | 2300 |
| Плиты фибролитовые и арболит на портландцементе | 2300 |
| Покрытие ковровое | 1100 |
| Пол гипсовый бесшовный | 800 |
| Поливинилхлорид (ПВХ) | 920…1200 |
| Поликарбонат (дифлон) | 1100…1120 |
| Полиметилметакрилат | 1200…1650 |
| Полипропилен | 1930 |
| Полистирол УПП1, ППС | 900 |
| Полистиролбетон | 1060 |
| Полихлорвинил | 1130…1200 |
| Полихлортрифторэтилен | 920 |
| Полиэтилен высокой плотности | 1900…2300 |
| Полиэтилен низкой плотности | 1700 |
| Портландцемент | 1130 |
| Пробка | 2050 |
| Пробка гранулированная | 1800 |
| Раствор гипсовый затирочный | 900 |
| Раствор гипсоперлитовый | 840 |
| Раствор гипсоперлитовый поризованный | 840 |
| Раствор известково-песчаный | 840 |
| Раствор известковый | 920 |
| Раствор сложный (песок, известь, цемент) | 840 |
| Раствор цементно-перлитовый | 840 |
| Раствор цементно-песчаный | 840 |
| Раствор цементно-шлаковый | 840 |
| Резина мягкая | 1380 |
| Резина пористая | 2050 |
| Резина твердая обыкновенная | 1350…1400 |
| Рубероид | 1500…1680 |
| Сера | 715 |
| Сланец | 700…1600 |
| Слюда | 880 |
| Смола эпоксидная | 800…1100 |
| Снег лежалый при 0°С | 2100 |
| Снег свежевыпавший | 2090 |
| Сосна и ель | 2300 |
| Сосна смолистая 15% влажности | 2700 |
| Стекло зеркальное (зеркало) | 780 |
| Стекло кварцевое | 890 |
| Стекло лабораторное | 840 |
| Стекло обыкновенное, оконное | 670 |
| Стекло флинт | 490 |
| Стекловата | 800 |
| Стекловолокно | 840 |
| Стеклопластик | 800 |
| Стружка деревянная прессованая | 1080 |
| Текстолит | 1470…1510 |
| Толь | 1680 |
| Торф | 1880 |
| Торфоплиты | 2100 |
| Туф (облицовка) | 750…880 |
| Туфобетон | 840 |
| Уголь древесный | 960 |
| Уголь каменный | 1310 |
| Фанера клееная | 2300…2500 |
| Фарфор | 750…1090 |
| Фибролит (серый) | 1670 |
| Циркон | 670 |
| Шамот | 825 |
| Шифер | 750 |
| Шлак гранулированный | 750 |
| Шлак котельный | 700…750 |
| Шлакобетон | 800 |
| Шлакопемзобетон (термозитобетон) | 840 |
| Шлакопемзопено- и шлакопемзогазобетон | 840 |
| Штукатурка гипсовая | 840 |
| Штукатурка из полистирольного раствора | 1200 |
| Штукатурка известковая | 950 |
| Штукатурка известковая с каменной пылью | 920 |
| Штукатурка перлитовая | 1130 |
| Штукатурка фасадная с полимерными добавками | 880 |
| Шунгизитобетон | 840 |
| Щебень и песок из перлита вспученного | 840 |
| Щебень из доменного шлака, шлаковой пемзы и аглопорита | 840 |
| Эбонит | 1430 |
| Эковата | 2300 |
| Этрол | 1500…1800 |
Теплоемкость массовая – Справочник химика 21
Температура, Молярная теплоемкость, Массовая теплоемкость.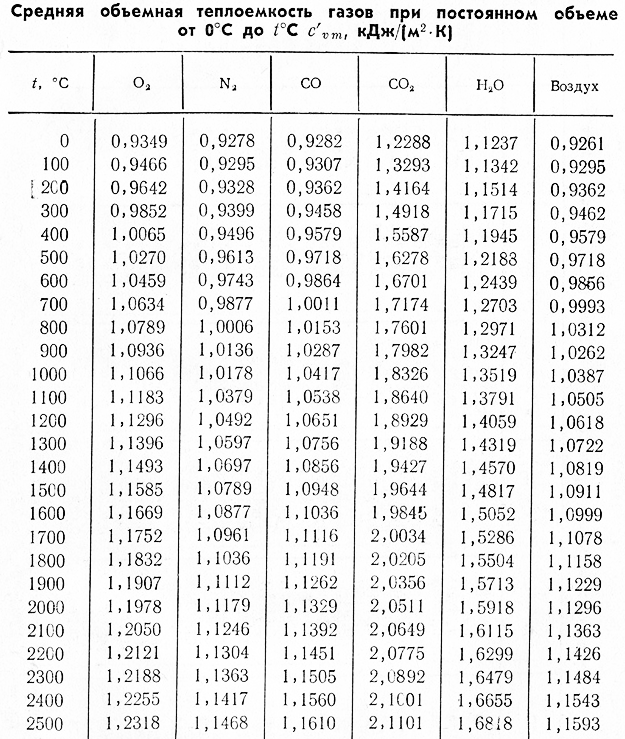 Объемная теплоемкость, [c.314]
Объемная теплоемкость, [c.314]Удельная теплоемкость (массовая) [c.753]
Удельные теплоемкости (массовые) вещества с мольной массой М [c.129]
Объем … Удельная теплоемкость (массовая). ….. [c.263]
Количество тепла Энтальпия, теплоты фазовых превращений, теплоты реакций Теплоемкость массовая [c.188]
При расчетах тепловых балансов производственных процессов, как правило, пользуются табличными величинами средних теплоемкостей веществ от О до f С. Точное значение средней теплоемкости для любых пределов температуры вычисляют, используя математическую зависимость истинной теплоемкости (массовой, молярной и др.) от температуры. Эта зависимость выражается степенными рядами двух видов [c.28]
Теплоемкость массовая (удельная) кДж/(кг-К) 1 ккал/(кг-К) = 4,187 кДж/(кг-К) [c.520]
Удельную теплоемкость обычно называют просто теплоемкостью Количество газа может быть измерено в кг, м и молях сообразно этому различают и три вида теплоемкостей массовую, объемную и мольную В расчетные уравнения, которыми пользуются в технике пыле- и золоулавливания, входит, как правило, массовая теплоемкость Ср (тепловые процессы в газоочистных аппаратах можно рассматривать, как протекающие при постоянном давлении). [c.30]
[c.30]
Теплоемкость массовая Ср Дж/(моль-К) кДж/(кг-К) кал/(моль-К) ккал/(кг-К) 4.187 4.187 [c.8]
Теплоемкость массовая ккал/(кг- С) Дж/(кг-К) 4187 [c.279]
При этом параметры обрабатываемого материала и начальные параметры обрабатывающего газового потока обусловлены технологическими требованиями и являются, таким образом, заданными (управляемыми) параметрами. Введение этих условий в математическое описание тепломассообменных процессов и приводит к установлению представлений о режиме тепломассообменного уравнения (автогенерации теплового КПД) по соотношению теплоемкостей (массовых расходов) потоков. Этот режим был установлен и частично подробно исследован В. Г. Лисиенко [10.1, 10.21]. Наиболее характерным явлением, вытекающим из закономерностей режима тепломассообменного управления, является связь отношений массовых расходов теплоемкостей потоков в соответствии с физико-химическим тепловым КПД (см. также гл. 4, формулы (4.71) и (4.72)) [c.305]
4, формулы (4.71) и (4.72)) [c.305]
Удельные теплоемкости массовая 1 ккал/(кг-град) объемная ккал/ м -град) [c.734]
Удельные теплоемкости массовая 1 ккал/(кг-град) объемная 1 ккал/(м -град) Коэффициенты теплопроводности 1 ккал/(м-ч-град) [c.739]
Средние во времени температуры соответственно греющего и нагреваемого теплоносителей на выходе из регенератора и /2— температуры соответственно греющего и нагреваемого теплоносителей на входе в регенератор и Ж2 полные теплоемкости массового расхода ССр, С-массовый расход теплоносителя, Ср — удельная теплоемкость тг — коэффициент аккумуляции на- [c.191]
В тепловых расчетах часто пользуются понятием полной теплоемкости массового расхода теплоносителя в единицу времени, определяемой выражением [c.443]
Последнее уравнение указывает на то, что отношение изменений температур однофазных теплоносителей обратно пропорционально отношению их расходных теплоемкостей (или водяных эквивалентов).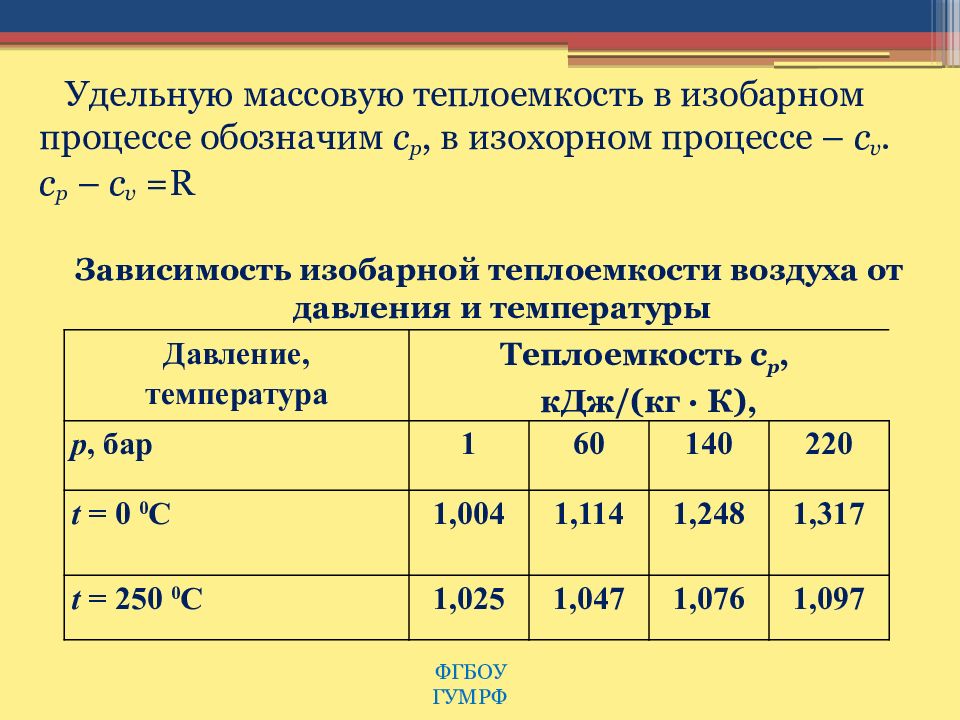 Нетрудно видеть, что при изменении агрегатного состояния теплоносителя температура его сохраняется постоянной и Ы будет равно нулю. Следовательно, для такого теплоносителя теплоемкость массового расхода С=СХ . [c.443]
Нетрудно видеть, что при изменении агрегатного состояния теплоносителя температура его сохраняется постоянной и Ы будет равно нулю. Следовательно, для такого теплоносителя теплоемкость массового расхода С=СХ . [c.443]
При этом известными являются следующие величины поверхность теплообмена f, коэффициент теплопередачи к, теплоемкости массовых расходов теплоносителей С1 и Сг и начальные температуры t и / г. Искомыми величинами являются конечные температуры и “г и количество переданного тепла С. [c.449]
Случай, когда j= i= , т. е. теплоемкости массовых расходов теплоносителей численно одинаковы. Для этого случая уравнения (19-24) и (19-25) упрощаются и принимают вид [c.452]
В практике часто встречаются случаи, когда теплоемкость массового расхода первичного или вторичного теплоносителя С1 или Сг— бесконечно большая величина (процесс передачи теплоты в парогенераторах, испарителях, конденсаторах различных типов и пр. ). В этих условиях температура одного из теплоносителей остается постоянной по всей поверхности, а противоточная и прямоточная схемы движения становятся равноценными. [c.452]
). В этих условиях температура одного из теплоносителей остается постоянной по всей поверхности, а противоточная и прямоточная схемы движения становятся равноценными. [c.452]
Если теплоемкость массового расхода первичного теплоносителя С, = оо, а вторичного Сг, то из (19-14) получаем формулу для расчета изменения температуры вторичного теплоносителя вдоль поверхности [c.452]
Удельная теплоемкость (массовая, мольная) Ср Дж г- К- [c.7]
Теплоемкость массовая (удельная) ,кДж/(кг.К) 1 ккал/(кг. К) = 4,187 кДж/(кг К) [c.520]
В случае изменения удельных теплоемкостей с температурой в уравнение (а) нужно подставлять среднеинтегральные значения С1 и Са в интервалах температур, от до Г. Часто удобно оперировать не удельными, а полными теплоемкостями массовых расходов теплоносителей в единицу времени, называемыми водяными эквивалентами. Обозначив Wl и СаСа = Wi, перепишем уравнение (а) [c. 341]
341]
Полная теплоемкость массового расхода теплоиосителя в единицу времени, называемая водяным эквивалентом, определяется выражением [c.260]
Характер изменения температур теплоносителей вдоль поверхности Фудет определяться схемой движения и соотношением теплоемкостей. массовых расходов теплоносителей С1 н Сг (водяных эквивалентов). [c.446]
В зависимости от этого получаются четыре пары кривых изменения температуры вдоль поверхиости теплообмена (рис. 19-2). Здесь по оси абсцисс отложена поверхность теплообмена Р, а по оси ординат — температура теплоносителей. В соответствии с уравнением (19-6) на рис. 19-2 показано, что большее изменение температуры будет у теплоносителя с меяьшей теплоемкостью массового расхода. [c.446]
При равенстве теплоемкостей массовых расходов теплоносителей в случае противотока ( Ш=0) из формулы (19-14) следует, что температурный напор вдоль поверхности теплообмена сохраняет постоянное значение, т. е. Д[c.448]
е. Д[c.448]
В тепловых расчетах часто используют упомянутую ркпее величину С1Ср= , Вт/К, называемую водяным эквивалентом и являющуюся полной теплоемкостью массового расхода хладагента, не изменяющего в процессе теплообмена своего агрегатного состояния. [c.44]
Теплоемкость и удельная теплоемкость
- Определите тепловую мощность.
- Определите удельную теплоемкость.
- Выполните расчеты с учетом удельной теплоемкости.
Какой бассейн прогреется быстрее?
Если плавательный бассейн и болот, заполненные водой с одинаковой температурой, будут подвергаться одинаковому подаче тепловой энергии, то в детском бассейне температура наверняка повысится быстрее, чем в плавательном бассейне.Теплоемкость объекта зависит как от его массы, так и от его химического состава. Из-за своей гораздо большей массы плавательный бассейн с водой имеет большую теплоемкость, чем ведро с водой.
Теплоемкость и удельная теплоемкость
Различные вещества по-разному реагируют на тепло. Если металлический стул стоит на ярком солнце в жаркий день, он может стать довольно горячим на ощупь. Вода с одинаковой массой на одном и том же солнце не станет почти такой же горячей. Мы бы сказали, что вода имеет высокую теплоемкость (количество тепла, необходимое для повышения температуры объекта на 1 ° C.) Вода очень устойчива к перепадам температуры, а металлы – нет. Удельная теплоемкость вещества – это количество энергии, необходимое для повышения температуры 1 грамма вещества на 1 ° C. В таблице ниже приведены значения удельной теплоты некоторых распространенных веществ. Символ удельной теплоемкости: c p , с индексом p, обозначающим тот факт, что удельная теплоемкость измеряется при постоянном давлении. Единицами измерения удельной теплоемкости могут быть джоули на грамм на градус (Дж / г ° C) или калории на грамм на градус (кал / г ° C).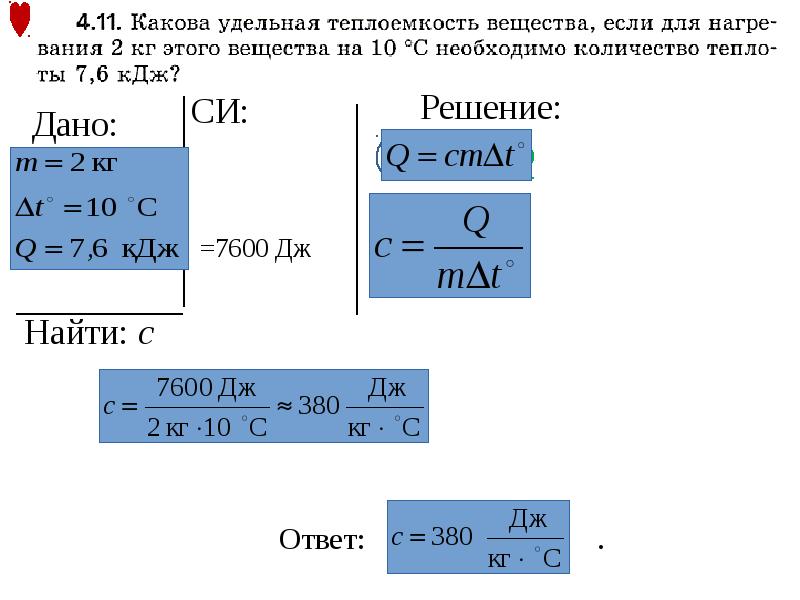 В этом тексте для удельной теплоемкости будет использоваться Дж / г ° C.
В этом тексте для удельной теплоемкости будет использоваться Дж / г ° C.
| Вещество | Удельная теплоемкость (Дж / г ° C) |
| Вода (л) | 4,18 |
| Вода (и) | 2,06 |
| Вода (г) | 1,87 |
| Аммиак (г) | 2,09 |
| Этанол (л) | 2,44 |
| Алюминий (и) | 0.897 |
| Углерод, графит (ы) | 0,709 |
| Медь (и) | 0,385 |
| Золото | 0,129 |
| Утюг (ы) | 0,449 |
| Выводы | 0,129 |
| Ртуть (л) | 0,140 |
| Серебро | 0,233 |
Обратите внимание, что вода имеет очень высокую удельную теплоемкость по сравнению с большинством других веществ. Вода обычно используется в качестве охлаждающей жидкости для оборудования, поскольку она способна поглощать большое количество тепла (см. , таблица выше). Прибрежный климат намного более умеренный, чем внутренний климат из-за наличия океана. Вода в озерах или океанах поглощает тепло из воздуха в жаркие дни и отдает его обратно в воздух в прохладные дни.
Вода обычно используется в качестве охлаждающей жидкости для оборудования, поскольку она способна поглощать большое количество тепла (см. , таблица выше). Прибрежный климат намного более умеренный, чем внутренний климат из-за наличия океана. Вода в озерах или океанах поглощает тепло из воздуха в жаркие дни и отдает его обратно в воздух в прохладные дни.
Рисунок 17,5
Эта электростанция в Западной Вирджинии, как и многие другие, расположена рядом с большим озером, поэтому воду из озера можно использовать в качестве охлаждающей жидкости.Прохладная вода из озера закачивается в растение, а более теплая вода выкачивается из растения и возвращается в озеро.
Резюме
- Определены теплоемкость и удельная теплоемкость.
Практика
Вопросы
Посмотрите видео и ответьте на вопросы ниже
- Что было в первом воздушном шаре?
- Что было в аэростате отправки?
- Почему не лопнул первый воздушный шар?
- Почему лопнул второй воздушный шар?
Обзор
Вопросы
- Что такое тепловая мощность?
- Что такое удельная теплоемкость?
- У вас есть 10-граммовый кусок алюминия и 10-граммовый кусок золота, стоящие на солнце.
 Какой металл сначала нагреется на десять градусов?
Какой металл сначала нагреется на десять градусов? - У вас есть 20-граммовый кусок алюминия и 40-граммовый кусок алюминия, лежащие на солнце. Какая часть поднимется на десять градусов первой?
- теплоемкость: Количество тепла, необходимое для повышения температуры объекта на 1 ° C.
- удельная теплоемкость: Количество энергии, необходимое для повышения температуры 1 грамма вещества на 1 ° C.
Список литературы
- Бассейн: Пользователь: Mhsb / Wikimedia Commons; Детский бассейн: Пользователь: Aarchiba / Википедия.Бассейн: http://commons.wikimedia.org/wiki/File:Freshwater_swimming_pool.jpg; Детский бассейн: http://commons.wikimedia.org/wiki/File:Wading-pool.jpg.
- Пользователь: Raeky / Wikimedia Commons. http://commons.wikimedia.org/wiki/File:Mount_Storm_Power_Plant,_Areial.jpg.
[/ hidden-answer
]5.2: Теплоемкость – Chemistry LibreTexts
Теплоемкость
Теплоемкость вещества описывает, как его температура изменяется при поглощении или выделении тепла, это способность вещества удерживать тепло. Это уравнение связывает поглощенное (или потерянное) тепло с изменением температуры
Это уравнение связывает поглощенное (или потерянное) тепло с изменением температуры
\ [\ Delta q = q _ {\ text {передано}} = q = C \ Delta T \]
Обратите внимание, что это тепло q – это количество тепла, передаваемого объекту или от объекта при изменении его температуры, и мы называем его q, а не (\ Delta q \). Это не полная тепловая энергия объекта.
Преобразование приведенного выше уравнения дает определение теплоемкости объекта \ [C = \ frac {q (J)} {\ Delta T (K)} \]
Это важное уравнение, поскольку оно связывает тепло, теряемое или получаемое объектом, с изменением его температуры.Вещество с небольшой теплоемкостью не может удерживать много тепловой энергии и поэтому быстро нагревается. Следует отметить, что скорость теплопередачи (как быстро что-то нагревается или остывает) зависит от разницы температур. Так как тепло передается от горячего объекта (который охлаждает) к холодному объекту (который нагревает), разница температур уменьшается, а скорость теплопередачи замедляется и, наконец, прекращается, когда они достигают той же температуры. Теплоемкость вещества зависит как от материала, из которого оно сделано, так и от массы вещества.
Теплоемкость вещества зависит как от материала, из которого оно сделано, так и от массы вещества.
Примечание. Вышеупомянутое уравнение можно определить по единицам Емкости (энергия / температура). То есть, если у константы есть единицы, переменные должны соответствовать друг другу в уравнении, которое дает одни и те же единицы. Таким образом, C равняется чему-то с энергией в числителе и температурой в знаменателе. Теперь вам нужно руководствоваться здравым смыслом, поскольку мы добавляем тепло, а не работаем, и добавление тепла изменяет температуру, но не влияет на температуру. Таким образом, правая часть – это ΔT, а не T.
Упражнение \ (\ PageIndex {1} \)
Теплоемкость серебряного кольца 10,0 г составляет 2,36 Дж / o C.
- Преобразуйте это значение в единицы Дж / К.
- Преобразуйте это значение в единицы кал / o C.
- Ответьте на
2,36 Дж / К, это то же значение, потому что знаменатель равен \ (Дельта Т \), а не Т.

- Ответ б
0.564кал / o C.
Удельная теплоемкость
Удельная теплоемкость – это теплоемкость на грамм вещества. Это значение зависит от природы химических связей в веществе и его фазы.
\ [q = mc \ Delta T \]
или
\ [c = \ frac {q (J)} {m (g) \ Delta T (K)} \]
Примечание. Заглавная «\ (C \)» – это Теплоемкость объекта, строчная буква «\ (c \)» – это удельная теплоемкость вещества.Теплоемкость объекта из чистого вещества составляет:
\ [C = mc \]
Если материал объекта однороден по составу, вы можете использовать удельную теплоемкость этого материала для расчета теплоемкости объекта. Таким образом, удвоение массы объекта удваивает его теплоемкость, но не меняет его удельную теплоемкость.
Упражнение \ (\ PageIndex {2} \)
В упражнении \ (\ PageIndex {1} \) мы увидели, что серебряное кольцо весом 10,0 г имеет тепловую емкость 2. 36J / o C, какова удельная теплоемкость серебра?
36J / o C, какова удельная теплоемкость серебра?
- Ответ
Предполагая, что кольцо изготовлено из чистого серебра, удельная теплоемкость серебра составляет 0,236 Дж / г o C.
Совет: использование единиц константы в уравнении идентификации
Следует отметить, что, как и для теплоемкости, единицы удельной теплоемкости должны соответствовать единицам уравнения, и поэтому вы можете рассчитать уравнение из единиц, если вы понимаете, что J – это единица энергии ( мы говорим о тепле, а не о работе), g – это единица массы, а ° C – это единица измерения температуры, хотя здесь это означает изменение температуры (ΔT). Видео \ (\ PageIndex {1} \) показывает, как мы можем использовать единицы измерения константы для определения уравнения.
Видео \ (\ PageIndex {1} \): 5’32 “YouTube об использовании констант для определения уравнений, связанных с теплоемкостью и фазовыми изменениями (https://youtu. be/mWj9pHQOyIc). ПРИМЕЧАНИЕ: в этом видео значения из \ (\ Delta H_v \) предназначены для воды, поэтому мы используем молярную массу воды, чтобы связать их. Некоторые из этих значений приведены в таблице 5.3.1.
be/mWj9pHQOyIc). ПРИМЕЧАНИЕ: в этом видео значения из \ (\ Delta H_v \) предназначены для воды, поэтому мы используем молярную массу воды, чтобы связать их. Некоторые из этих значений приведены в таблице 5.3.1.Является ли удельная теплоемкость экстенсивным или интенсивным свойством?
Удельная теплоемкость высокая и не зависит от количества, но теплоемкость большая, поэтому два грамма жидкой воды имеют удвоенную теплоемкость 1 грамм, но удельная теплоемкость, теплоемкость на грамм, то же самое, 4.184 (Дж / г , К). Таким образом, можно использовать таблицу удельной теплоемкости, основанную на типе материала, чтобы мы могли рассчитать теплоемкость объекта. Обратите внимание, что теплоемкость зависит от фазы вещества.
 193,” “4.184,” “2.376,” “2.093 (at –10 °C), ” “1.864,” “1.040,” “1.007,” “0.918.” “0.897,” “0.853,” “0.522,” “0.449,” “0.385,” “0.130,” “0.129,” and “0.712.””>
193,” “4.184,” “2.376,” “2.093 (at –10 °C), ” “1.864,” “1.040,” “1.007,” “0.918.” “0.897,” “0.853,” “0.522,” “0.449,” “0.385,” “0.130,” “0.129,” and “0.712.””>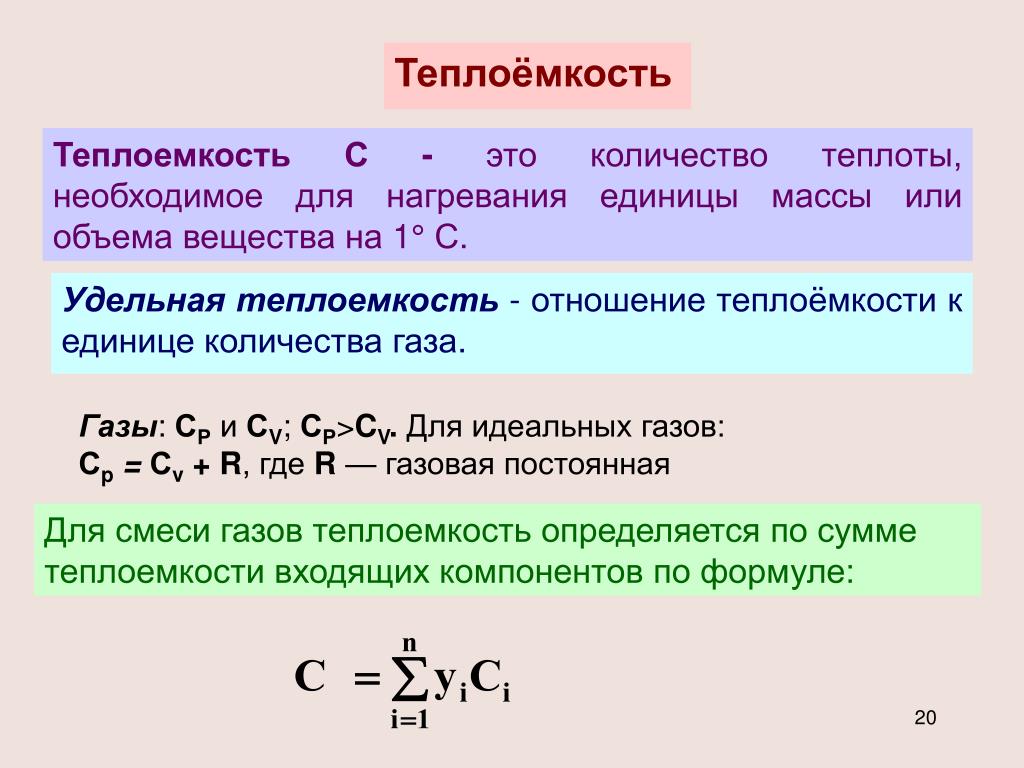 193
193 864
864 129
129Примечание. Металлы обладают низкой теплоемкостью и, следовательно, подвергаются быстрому повышению температуры при воздействии тепла.
Упражнение \ (\ PageIndex {3} \)
Если вы добавите одинаковое количество тепла к равной массе жидкой воды, твердого золота и твердого железа, какая из них будет иметь самую высокую температуру?
- Ответ
Solid Gold.Все они имеют одинаковую массу и подвергаются одинаковому воздействию тепла. Таким образом, тот, у кого самая низкая удельная теплоемкость, будет иметь самую высокую температуру.
 Обладает наименьшей устойчивостью к изменению температуры при воздействии тепла. Если вы когда-нибудь с золотым браслетом лезли в духовку, чтобы взять еду, возможно, вы испытали низкую удельную теплоемкость золота. Металлы обладают низкой теплоемкостью и, следовательно, подвергаются быстрому повышению температуры при воздействии тепла.
Обладает наименьшей устойчивостью к изменению температуры при воздействии тепла. Если вы когда-нибудь с золотым браслетом лезли в духовку, чтобы взять еду, возможно, вы испытали низкую удельную теплоемкость золота. Металлы обладают низкой теплоемкостью и, следовательно, подвергаются быстрому повышению температуры при воздействии тепла.
Пример \ (\ PageIndex {1} \)
Какова конечная температура, если 100.oC \ nonumber \]
Видео \ (\ PageIndex {2} \): 1’18 “Пример решения YouTube \ (\ PageIndex {2} \) (https://youtu.be/4hKfm4B-C6o).Удельная теплоемкость может использоваться для идентификации неизвестного вещества
Удельная теплоемкость – это физическое свойство материала, из которого состоит вещество, которое может использоваться для идентификации вещества, так же как плотность может помочь идентифицировать несжимаемое вещество, такое как твердое или жидкое. Следует отметить, что два вещества могут иметь одинаковую удельную теплоемкость, так же как два вещества могут иметь одинаковую плотность, но, например, если теплоемкость прозрачной жидкости не равна 1 кал / г o C, вещество может не быть чистой водой.
Пример \ (\ PageIndex {2} \)
У вас есть неизвестный металл, который представляет собой Al, Cu, Ag или Fe, и вы хотите его идентифицировать. При добавлении 51,26 Дж к 10,0 г металла его температура повышается на 22 o ° C
.Решение
Рассчитайте удельную теплоемкость и сравните ее с данными в таблице Таблица \ (\ PageIndex {1} \). Металл – серебро, и эта проблема решена в Video \ (\ PageIndex {3} \)
. Видео \ (\ PageIndex {3} \): 1’12 “YouTube использует расчет удельной теплоемкости для идентификации металла (https: // youtu.be / duAzx66-0TI)Упражнение \ (\ PageIndex {4} \)
Можете ли вы использовать удельную теплоемкость, чтобы отличить свинец от золота?
- Ответ
Нет, золото имело удельную теплоемкость 0,129 Дж / г при o C и свинец 0,128 Дж / г o C. Положение тысячных долей не определено, поэтому до трех значащих цифр вы не можете различить эти два образца.
 (вы сообщаете все достоверные и первые неопределенные, поэтому, если у вас есть измерение 0.128, вы не совсем уверены в значении 0,008.
(вы сообщаете все достоверные и первые неопределенные, поэтому, если у вас есть измерение 0.128, вы не совсем уверены в значении 0,008.
Удельная теплоемкость – обзор
2.31.2.2.1 Линейное сканирование
Наиболее распространенным режимом работы DSC является нагрев или охлаждение с постоянной скоростью. Основным результатом такого эксперимента является график зависимости скорости теплового потока от времени. Если температура позиции образца известна, то данные также могут быть представлены как зависимость скорости теплового потока от температуры. (Следует знать, что обычно измеряется температура около образца, а не температура самого образца.) На рисунке 2 показан типичный пример.
Рис. 2. Температурный профиль и измеренная скорость теплового потока для (а) пустых кастрюль, (б) калибровочного стандарта сапфира (31,3 мг) и (в) изначально аморфного ПЭЭК (29 мг). Скорость нагрева β = 20 K мин -1 .
Из кривых теплового потока, показанных на Рис. 2 , удельную теплоемкость c p (T) можно получить следующим образом:
[8] cp (T) = cp, сапфир (T) msapphireβmsampleβΦsample (T) −Φempty (T) Φsapphire (T) −Φempty (T) = K (T) Φsample (T) −Φempty (T) msampleβ
с
K (T) = cp, сапфир (T) msapphireβΦsapphire (T) −Φempty (T)
, где K ( T ) – это зависящий от температуры калибровочный коэффициент, который можно сохранить для использования в будущем.Здесь все измерения собираются с одинаковой скоростью сканирования. Изотермы в начале и в конце сканирования используются для корректировки небольших изменений тепловых потерь между измерениями пустого, сапфирового и образца путем совмещения этих частей кривых. Небольшие изменения потерь неизбежны, потому что термические свойства, такие как теплопроводность, образцов различны. С другой стороны, проверка скорости теплового потока на изотермах позволяет нам проверить правильность размещения и тепловые контакты всех частей измерительной системы, перемещаемых во время смены образца.В частности, изотерма высоких температур не должна слишком сильно отличаться между последовательными измерениями.
С другой стороны, проверка скорости теплового потока на изотермах позволяет нам проверить правильность размещения и тепловые контакты всех частей измерительной системы, перемещаемых во время смены образца.В частности, изотерма высоких температур не должна слишком сильно отличаться между последовательными измерениями.
Удельная теплоемкость – это наиболее полезная величина, доступная от DSC, поскольку она напрямую связана со свойствами образца и, согласно уравнениям [1] – [5], напрямую связана со стабильностью и порядком. Тем не менее, часто отображается только скорость теплового потока, полученная в результате измерения одного образца. Есть несколько причин, по которым это не следует отображать:
- 1.
Каждый график теплового потока требует указания эндотермического или экзотермического направления, поскольку направление графика не стандартизировано.
- 2.
Кривые, измеренные при разных скоростях сканирования, сравнить непросто.

- 3.
Если не разделить на массу образца, кривые для разных образцов нельзя сравнивать.
- 4.
Если измерения пустой чаши не вычитаются, кривые могут быть искривленными, и построение базовой линии для интегрирования пиков может быть затруднено.
- 5.
Если калибровочный коэффициент теплового потока K ( T ) зависит от температуры, полученная теплота плавления и другие подобные параметры могут быть ошибочными.
Выполнение поправок (3) – (5) дает удельную теплоемкость, заданную уравнением [8]. Поскольку большинство программных пакетов DSC включают определение удельной теплоемкости в соответствии с уравнением [8], настоятельно рекомендуется определять удельную теплоемкость, а не представлять кривые расхода тепла. Несмотря на то, что представление данных об удельной теплоемкости предпочтительнее, могут быть причины не делать этого. Нормализация кривой теплового потока по скорости сканирования и массе образца может привести к «измерениям псевдо c p », которые можно использовать для определения зависящей от температуры кристалличности и других величин, как показано в ссылке 8. Но есть еще один очень веский аргумент в пользу представления удельной теплоемкости, а не «псевдо c p » или скорости теплового потока. Для более чем 200 полимеров данные об удельной теплоемкости от 0 до 1000 К доступны в банке данных ATHAS (ATHAS-DB). 36 Данные можно использовать для сравнения результатов измерений в стекловидном или жидком состоянии с рекомендованными значениями. Это позволяет легко проверить качество измеренных данных, хотя следует иметь в виду, что точность рекомендованных данных банка данных составляет всего около 6%. Рисунок 3 показывает удельную теплоемкость (согласно уравнению [8]), рассчитанную по данным, приведенным в Рисунок 2 .
Но есть еще один очень веский аргумент в пользу представления удельной теплоемкости, а не «псевдо c p » или скорости теплового потока. Для более чем 200 полимеров данные об удельной теплоемкости от 0 до 1000 К доступны в банке данных ATHAS (ATHAS-DB). 36 Данные можно использовать для сравнения результатов измерений в стекловидном или жидком состоянии с рекомендованными значениями. Это позволяет легко проверить качество измеренных данных, хотя следует иметь в виду, что точность рекомендованных данных банка данных составляет всего около 6%. Рисунок 3 показывает удельную теплоемкость (согласно уравнению [8]), рассчитанную по данным, приведенным в Рисунок 2 .
Рис. 3. Зависимость удельной теплоемкости от температуры для исходного аморфного образца ПЭЭК. Данные из Рисунок 2 . Справочные данные (прямые) для полностью аморфного (жидкого) и кристаллического (твердого) ПЭЭК доступны в ATHAS-DB. 36
Воспроизведено с разрешения Schick, C. Anal. Биоанал. Chem. 2009 , 395 , 1589–1611. 35
Anal. Биоанал. Chem. 2009 , 395 , 1589–1611. 35 Более подробное обсуждение оценки кривых, показанных на Рис. 3 , приведено в ссылке 35.
Помимо измерений сканирования при нагревании, DSC позволяет охлаждение в широком диапазоне скоростей охлаждения. В зависимости от прибора и интересующего диапазона температур скорость охлаждения может достигать 750 K мин -1 (HyperDSC ™ PerkinElmer, США). 20,37–39 Но обычно диапазон температур для контролируемого охлаждения с максимальной скоростью ограничен.Измерения, выполняемые в широком диапазоне скоростей нагрева или охлаждения, требуют оптимизации условий эксперимента. Масса образца должна масштабироваться обратно пропорционально скорости сканирования. При низких скоростях, когда тепловая задержка не является проблемой, масса образца должна быть большой, чтобы иметь хорошее отношение сигнал / шум. При высоких скоростях, когда сигналы большие, масса образца должна быть небольшой, чтобы минимизировать тепловой поток к образцу, который пропорционален скорости и вызывает тепловую задержку. Проблемы, связанные с термической задержкой, температурной калибровкой и воспроизводимостью в экспериментах ДСК с быстрым сканированием, были интенсивно изучены, и были даны соответствующие рекомендации. 37,40,41 На рисунке 4 показаны кривые охлаждения в области кристаллизации полиэтилена низкой плотности (ПЭ). При скоростях выше 200 K мин -1 контролируемое охлаждение до 100 ° C было невозможно из-за ограниченной охлаждающей способности используемого механического промежуточного охладителя. Если требуется более высокая скорость охлаждения, следует использовать жидкий азот. Для более низких скоростей сканирования, показанных на рис. 4 , масса образца должна быть достаточно большой, чтобы обеспечить хорошее отношение сигнал / шум.Для более высоких скоростей большой образец (4 мг) вызывает некоторую тепловую задержку, как обсуждается в учебниках и ссылках 37, 40 и 42. Это также видно по уширению пика кристаллизации при 20 K мин -1 по сравнению с с образцом 0,4 мг при той же скорости охлаждения.
Проблемы, связанные с термической задержкой, температурной калибровкой и воспроизводимостью в экспериментах ДСК с быстрым сканированием, были интенсивно изучены, и были даны соответствующие рекомендации. 37,40,41 На рисунке 4 показаны кривые охлаждения в области кристаллизации полиэтилена низкой плотности (ПЭ). При скоростях выше 200 K мин -1 контролируемое охлаждение до 100 ° C было невозможно из-за ограниченной охлаждающей способности используемого механического промежуточного охладителя. Если требуется более высокая скорость охлаждения, следует использовать жидкий азот. Для более низких скоростей сканирования, показанных на рис. 4 , масса образца должна быть достаточно большой, чтобы обеспечить хорошее отношение сигнал / шум.Для более высоких скоростей большой образец (4 мг) вызывает некоторую тепловую задержку, как обсуждается в учебниках и ссылках 37, 40 и 42. Это также видно по уширению пика кристаллизации при 20 K мин -1 по сравнению с с образцом 0,4 мг при той же скорости охлаждения. Данные, представленные на рис. 4 , предоставляют информацию о кинетике кристаллизации и могут быть проанализированы с использованием различных кинетических моделей. 43–48
Данные, представленные на рис. 4 , предоставляют информацию о кинетике кристаллизации и могут быть проанализированы с использованием различных кинетических моделей. 43–48
Рис. 4. Кривые охлаждения в области кристаллизации полиэтилена низкой плотности.Образцы имеют массу 4 мг в алюминиевом поддоне 25 мг для скоростей охлаждения до -20 K мин -1 и массу 0,4 мг в алюминиевой фольге 2 мг для более высоких скоростей охлаждения. Теплоемкость отложена вниз.
Данные PerkinElmer Pyris 1 DSC. Воспроизведено с разрешения Schick, C. Anal. Биоанал. Chem. 2009 , 395 , 1589–1611. 35 Как показано на рис. 4 , DSC имеет широкий динамический диапазон, который может быть расширен по крайней мере на 1 порядок в сторону более низких скоростей; таким образом он покрывает 3 порядка величины.Расширение на несколько порядков в сторону более высоких скоростей обсуждается в разделе 2.31.3.2. Возможность достаточно быстрого охлаждения образца позволяет нам изучать формирование структуры в ситуациях, далеких от равновесия, таких как «квазиизотермическая кристаллизация при глубоком переохлаждении».
Поскольку тепло и температура связаны с одним и тем же – кинетической энергией атомов в объекте, как мы можем описать эту взаимосвязь? Если к объекту добавить тепло, его температура повысится.Если отвести тепло, его температура снизится. Если объект имеет большую массу, для повышения его температуры на такую же величину потребуется больше тепла, чем для объекта с меньшей массой. Эти утверждения можно резюмировать математически, используя новую физическую константу, удельную теплоемкость : | |||||||||||||||||||||||||||||||||||||
| теплоемкость = | Как рассчитать | ||||||||||||||||||||||||||||||||||||
где q – добавленное или отведенное тепло в Дж, ΔT – изменение температуры в ºC, а m – масса в граммах.Удельная теплоемкость выражается в Дж / гºC. У разных веществ разная теплоемкость. В таблице справа перечислены удельные теплоемкости некоторых распространенных веществ.
Знание о теплоемкости позволяет ответить на вопросы, касающиеся тепла и температуры. 1. Определите систему и окружение. 2. Определите и обозначьте все виды энергии и работы, которые входят в систему или покидают ее. 3. Предскажите, какие единицы должны быть в вашем ответе. 4. Угадайте примерный размер своего ответа. Вы можете использовать эти прогнозы, чтобы оценить точность своего ответа, когда закончите. Сколько тепла требуется для нагрева кастрюли с водой (5.00 x 10 2 г) от 25,0 до 100,0 ºC? Шаг 1: Определите систему и окружение. Напишите свой ответ в поле ниже, затем нажмите кнопку «Проверить». | |||||||||||||||||||||||||||||||||||||
Теперь сравните свой ответ с приведенным ниже. Пожалуйста, введите свой ответ в поле слева. | |||||||||||||||||||||||||||||||||||||
Поскольку вода меняет температуру и больше всего меняется, это лучший выбор для системы. | |||||||||||||||||||||||||||||||||||||
Шаг 2: Определите и назначьте знаки для всех видов энергии и работы, которые входят в систему или покидают ее. Напишите свой ответ в поле ниже, затем нажмите кнопку «Проверить». | |||||||||||||||||||||||||||||||||||||
Теперь сравните свой ответ с приведенным ниже. Пожалуйста, введите свой ответ в поле слева. | |||||||||||||||||||||||||||||||||||||
Энергия поступает в систему в виде тепла.Имеет положительный знак. Никакая другая энергия или работа не входит в систему или покидает ее. | |||||||||||||||||||||||||||||||||||||
Шаг 3: Предскажите, какие единицы должны быть в вашем ответе. В вопросе требуется количество тепла, поэтому ответ должен быть количеством энергии в джоулях. Шаг 4. Предскажите примерный размер своего ответа. Вода имеет очень высокую теплоемкость, около 4 Дж / гºC. Следовательно, ответ должен быть примерно 4 • 500 • 75 = 150 000 Дж. Какое изменение температуры в системе? Нажмите на правильный ответ ниже. | |||||||||||||||||||||||||||||||||||||
| 25 ºC | 75 ºC | 100 ºC | |||||||||||||||||||||||||||||||||||
Правильно! Помните, DT = T final – T начальный . | |||||||||||||||||||||||||||||||||||||
Какова масса нагреваемого вещества? Введите массу в поле ниже и нажмите кнопку «Проверить». | |||||||||||||||||||||||||||||||||||||
Теперь сравните свой ответ с приведенным ниже. Пожалуйста, введите свой ответ в поле слева. | |||||||||||||||||||||||||||||||||||||
Масса указана как 500 г. | |||||||||||||||||||||||||||||||||||||
Какова теплоемкость нагреваемого вещества? Введите свой ответ в поле ниже и нажмите кнопку «Проверить». | |||||||||||||||||||||||||||||||||||||
Теперь сравните свой ответ с приведенным ниже. Пожалуйста, введите свой ответ в поле слева. | |||||||||||||||||||||||||||||||||||||
Теплоемкость жидкой воды указана в таблице выше. Это 4,184 Дж / г ºC. | |||||||||||||||||||||||||||||||||||||
Сколько тепла требуется для повышения температуры объекта с учетом введенных вами массы и теплоемкости? Введите свой ответ в поле ниже и нажмите кнопку «Обзор ответов», когда закончите. | |||||||||||||||||||||||||||||||||||||
Верный! Для нагрева воды с 25 до 100 ºC требуется 157 000 Дж тепла. Ваш ответ численно правильный, но в нем неправильное количество значащих цифр. Попробуй еще раз. Не забудьте указать единицы измерения в своем ответе. Это неверно. Пожалуйста, попробуйте еще раз. Для нагрева воды с 25 до 100 ºC требуется 157 000 Дж тепла. | |||||||||||||||||||||||||||||||||||||
Теплоемкость
Теплоемкость – C – характеристика объекта – количество тепла, необходимое для изменения его температуры на один градус.
- Теплоемкость выражается в единицах энергии на градус.
Количество тепла, подаваемого для обогрева объекта, может быть выражено как:
Q = C dt (1)
где
Q = количество подаваемого тепла (Дж, БТЕ)
C = теплоемкость системы или объекта (Дж / K, Btu / o F)
dt = изменение температуры (K, C ° , o F)
Единица СИ для теплоемкости – Дж / К (джоуль на кельвин).В английской системе это британские термические единицы на фунт на градус Фаренгейта (Btu / o F). В некоторых случаях вместо J. используются кДж или кал и ккал.
Никогда не используйте табличные значения теплоемкости без проверки единицы фактических значений!
Удельная теплоемкость ( c ) – количество тепла, необходимое для изменения температуры единицы массы вещества на один градус. Удельная теплоемкость – более общий термин для обозначения того же самого.
Тепло, подводимое к массе, может быть выражено как
dQ = mc dt (1)
, где
dQ = подводимое тепло (Дж, кДж БТЕ)
m = масса единицы ( г, кг, фунт)
c = удельная теплоемкость (Дж / г К, кДж / кг o C, кДж / кг K, БТЕ / фунт o F)
dt = изменение температуры (K, C ° , o F)
(1) можно передать для выражения удельной теплоемкости как:
c = dQ / m dt (1b)
Пример: Удельная теплоемкость железа равна 0.45 Дж / (г · К), что означает, что требуется 0,45 Дж тепла, чтобы поднять один грамм железа на один градус Кельвина.
Скачать и распечатать Подаваемое тепло в зависимости от удельной теплоты и изменения в диаграмме температур
Удельная теплоемкость газов
Существует два определения удельной теплоемкости паров и газов: / δT) p – Удельная теплоемкость при постоянном давлении (Дж / г · К)
c v = (δh / δT) v – Удельная теплоемкость при постоянном объеме (Дж / г · K)
Для твердые тела и жидкости, c p = c v
Воспользуйтесь ссылками, чтобы просмотреть табличных значений удельной теплоемкости газов, обычных жидкостей и жидкостей, пищевых продуктов и продуктов питания, металлов и полуметаллов, обычных твердых веществ и других обычных веществ.
Газовая постоянная
Индивидуальная газовая постоянная R может быть выражена как
R = c p – c v (2)
Отношение удельной теплоемкости
Коэффициент удельной теплоемкости выражается как
k = c p / c v (3)
Молярная теплоемкость ( C p ) – это количество тепла, необходимое для повышения температуры одного моля вещества на один градус при постоянном давлении.
Выражается в джоулях на моль на градус Кельвина (или Цельсия), Дж / (моль К) .
Пример: Молярная теплоемкость железа составляет 25,10 Дж / (моль К), что означает, что требуется 25,10 Дж тепла, чтобы поднять 1 моль железа на 1 градус Кельвина.
Табличные значения молярной теплоемкости, C p, множества органических и неорганических веществ можно найти в стандартных энтальпиях образования, свободной энергии Гиббса образования, энтропии и молярной теплоемкости органических веществ и стандартном состоянии и энтальпия образования, свободная энергия Гиббса образования, энтропия и теплоемкость вместе с ΔH ° f , ΔG ° f и S ° для тех же веществ при 25 ° C.
Преобразование между удельной теплоемкостью и молярной теплоемкостью
Удельную теплоемкость можно рассчитать из молярной теплоемкости, и наоборот:
c p = C p / M и
C p = c p . M
где
c p = удельная теплоемкость
C p = молярная теплоемкость
M = молярная масса фактического вещества (г / моль).
Пример: Метанол (с молекулярной формулой Ch4OH) имеет молярную теплоемкость, C p , 81,1 Дж / (моль K). Какова удельная теплоемкость c p ?
Сначала мы вычисляем (или находим) молярную массу метанола: 1 * 12,01 г / моль C + 4 * 1,008 г / моль H + 1 * 16,00 г / моль O = 32,04 г / моль CH 3 OH
Тогда удельная теплоемкость метанола равна: c p = 81,8 Дж / (моль · K) / 32,04 г / моль = 2.53 Дж / (г · К)
Преобразование между часто используемыми единицами измерения
Пример – Нагрев алюминия
2 кг алюминия нагревается от 20 o C до 100 o C . Удельная теплоемкость алюминия составляет 0,91 кДж / кг 0 C , а необходимое тепло можно рассчитать как
dQ = (2 кг) (0,91 кДж / кг 0 C) ((100 o C) – (20 o C))
= 145.6 (кДж)
Пример – вода для отопления
Один литр воды нагревается от 0 o C до кипения 100 o C . Удельная теплоемкость воды составляет 4,19 кДж / кг 0 C , а необходимое количество тепла можно рассчитать как
dQ = (1 литр) (1 кг / литр) (4,19 кДж / кг 0 C) (( 100 o C) – (0 o C))
= 419 (кДж)
= 419 (кВт · ч) (1/3600 ч / с)
= 0.12 кВтч
Расчет теплоемкости Учебник по химии
Пожалуйста, не блокируйте рекламу на этом сайте.
Без рекламы = для нас нет денег = для вас нет бесплатных вещей!
Удельная теплоемкость
Если вы осторожно нагреете воду с помощью источника тепла, например, горелки Бунзена, температура воды повысится.
Энергия, поставляемая горелкой Бунзена, заставляет молекулы воды двигаться быстрее, увеличивая их кинетическую энергию.
Мы можем измерить результат этой повышенной кинетической энергии как повышение температуры.
Количество энергии, поглощаемой молекулами воды для увеличения их кинетической энергии, называется «тепловой энергией». 3
Тепловая энергия частиц воды q пропорциональна изменению температуры ΔT.
ΔT = конечная температура – начальная температура
q ∝ ΔT
Это означает, что если вы используете ту же массу воды, но удвоите тепловую энергию (q), то изменение температуры (ΔT) также удвоится.
Аналогичным образом, если вы уменьшите вдвое тепловую энергию (q), то изменение температуры (ΔT) также уменьшится вдвое.
Вы также можете нагреть «холодную» воду, добавив в нее немного «горячей» воды.
Представьте, что у вас есть стакан с водой, содержащий 100 г воды с температурой 25,0 ° C.
Что произойдет с температурой воды, если вы добавите 10 г кипятка (100 ° C)?
Тепло перейдет от горячей воды к холодной. 4
Кинетическая энергия молекул «горячей» воды будет уменьшаться, а кинетическая энергия молекул «холодной» воды будет увеличиваться, пока все молекулы воды не будут иметь одинаковую среднюю кинетическую энергию. 5
Поскольку температура является мерой средней кинетической энергии всех молекул воды, мы находим, что температура воды станет постоянной.
В этом примере будет достигнута постоянная температура 6 31,8 ° C.
Изменение температуры ΔT равно
ΔT = конечная температура – начальная температура = 31,8 – 25,0 = 6,8 ° C
Теперь представьте, что вы повторяете эксперимент, но на этот раз с использованием 20 г кипятка.
Какая будет конечная температура воды?
И снова тепло перейдет от горячей воды к холодной, горячая вода охладится, а холодная вода нагреется до тех пор, пока во всем объеме воды не будет достигнута постоянная температура.
Но на этот раз температура будет выше, 37,5 ° C.
Изменение температуры ΔT равно
ΔT = конечная температура – начальная температура = 37,5 – 25,0 = 12,5 ° C
Добавление большей массы горячей воды к той же массе холодной воды приводит к еще большему повышению температуры.
Это говорит нам о том, что количество тепловой энергии, которая может быть передана от горячего вещества к холодному, зависит от массы используемого вещества.
Тепловая энергия (q) пропорциональна массе используемого вещества (m) и изменению температуры (ΔT):
q ∝ м × ΔT
Мы могли бы превратить это соотношение в математическое уравнение, используя коэффициент пропорциональности.
Пусть C будет константой пропорциональности, тогда:
q = C × м × ΔT
Давайте посмотрим, что произойдет с этой константой пропорциональности C, когда мы изменим вещество, используемое для нагрева воды.
Что произошло бы с температурой 100 г воды при начальной температуре 25,0 ° C, если бы мы добавили 20 г другого вещества вместо воды, скажем, 20 г металлической меди при 100 ° C?
Тепло перейдет от горячей меди к более холодной воде, медь остынет, а вода будет нагреваться, пока не будет достигнута постоянная температура.
Конечная температура воды составляет всего 26,5 ° C, что ниже температуры при добавлении 20 г воды!
Изменение температуры ΔT равно
ΔT = конечная температура – начальная температура = 26.5 – 25,0 = 1,5 ° С
Для равных масс горячей воды и горячей меди при одинаковой температуре горячая вода может передавать больше тепловой энергии холодной воде, чем горячая медь. 7
То есть значение коэффициента пропорциональности C для воды больше, чем для меди.
Термин, который используется для описания этой способности (или способности) передавать тепловую энергию, – «теплоемкость».
При сравнении масс граммов веществ, эта «теплоемкость» обозначается как удельная теплоемкость .
Итак, удельная теплоемкость воды больше удельной теплоемкости меди.
Удельная теплоемкость обозначена символом C г (считайте «г» граммами, то есть массой).
Теперь мы можем заменить коэффициент пропорциональности (C) в приведенном выше математическом уравнении на удельную теплоемкость (C г ):
q = C г × м × ΔT
Мы можем изменить это уравнение, разделив обе части уравнения на m × ΔT:
| q м × ΔT | = | C г × |
| q м × ΔT | = | C г |
Теперь, если я хочу сравнить удельную теплоемкость различных веществ, мне нужно поддерживать постоянную массу, скажем, 1 грамм, и я бы использовал достаточно тепловой энергии, чтобы вызвать изменение температуры на 1 ° C (или 1K),
Подставляя эти значения в уравнение:
| q 1 × 1 | = | C г |
| г | = | C г |
То есть удельная теплоемкость вещества – это энергия (q), необходимая для повышения температуры 1 грамма вещества на 1 ° C (или 1K)!
Различные вещества имеют разную удельную теплоемкость.Удельная теплоемкость некоторых веществ приведена в таблице ниже: 8
| Удельная теплоемкость некоторых веществ | |||
|---|---|---|---|
| Элементы | C г (J K -1 г -1 или J ° C -1 г -1 ) | Соединения | C г (J K -1 г -1 или J ° C -1 г -1 ) |
| алюминий | C г = 0.90 | вода (жидкость) | C г = 4,18 |
| углерод | C г = 0,72 | этанол (жидкость) | C г = 2,44 |
| медь | C г = 0,39 | серная кислота (жидкость) | C г = 1,42 |
| свинец | C г = 0,13 | хлорид натрия (твердый) | C г = 0.85 |
| ртуть (жидкость) | C г = 0,14 | гидроксид калия (твердый) | C г = 1,18 |
Из приведенной выше таблицы видно, что удельная теплоемкость меди составляет 0,39 Дж ° C -1 г -1 , в то время как удельная теплоемкость воды намного выше, 4,18 Дж ° C -1 г – 1 .
Требуется 0,39 Дж энергии, чтобы изменить температуру 1 грамма металлической меди на 1 ° C (или 1 K).
Требуется 4,18 Дж энергии, чтобы изменить температуру 1 грамма жидкой воды на 1 ° C (или 1 K).
Удельная теплоемкость, C г , как описано выше, полезно, потому что мы можем легко измерить массу многих веществ.
Однако, когда мы смотрим на таблицу значений, некоторые из этих значений кажутся нелогичными.
Почему требуется 0,13 Дж энергии для повышения температуры 1 г свинца на 1 ° C, но почти в 7 раз больше энергии для повышения температуры 1 г алюминия на 1 ° C?
И почему углерод должен иметь более высокую теплоемкость, чем металлическая медь или свинец?
Возможно, сравнение по массе – не лучший вариант…..
Молярная теплоемкость
Одинаковые массы разных веществ содержат разное количество «частиц» (атомов, ионов или молекул).
Химики используют «моль» как меру «количества» вещества, потому что моль чистого вещества всегда содержит одинаковое количество частиц (число Авогадро, N A = 6,02 × 10 23 ).
Масса 1 моля чистого вещества равна его относительной молекулярной массе, выраженной в граммах:
масса 1 моля = относительная молекулярная масса в граммах
Напомним, что удельная теплоемкость – это энергия, необходимая для повышения температуры 1 грамма вещества на 1 ° C (или 1 K).
пример: C г для металлической меди, Cu (s) , составляет 0,39 Дж ° C -1 г -1
Если мы хотим найти теплоемкость 1 моля вещества, нам нужно умножить удельную теплоемкость C г на относительную молекулярную массу (M r ) или молярную массу (M) вещества:
теплоемкость 1 моля = M r × C (г)
или
теплоемкость 1 моля = M × C (г)
Величина «M × C г » называется молярной теплоемкостью и обозначается символом C n (n – символ, используемый для молей).
Молярная теплоемкость вещества – это энергия, необходимая для повышения температуры 1 моль вещества на 1 ° C (или 1K).
Например, удельная теплоемкость металлической меди: C г = 0,39 Дж ° C -1 г -1
Относительная атомная масса меди из Периодической таблицы: M r = 63,55
Молярная теплоемкость металлической меди = C г × M r = 0.39 × 63,55 = 24,8 Дж ° C -1 моль -1
Вы можете выполнить этот расчет самостоятельно для каждого из веществ, перечисленных в таблице удельной теплоемкости выше.
Вы можете сравнить свои расчеты с расчетами, приведенными в таблице молярных теплоемкостей, приведенной ниже:
| Молярная теплоемкость некоторых веществ | |||
|---|---|---|---|
| Элементы | C n (Дж K -1 моль -1 или Дж ° C -1 моль -1 ) | Соединения | C n (J K -1 моль -1 или J ° C -1 моль -1 ) |
| ртуть | C n = 28.1 | серная кислота (жидкость) | C n = 139 |
| свинец | C n = 27,0 | вода | C n = 75 |
| медь | C n = 24,8 | гидроксид калия (твердый) | C n = 66 |
| алюминий | C n = 24,3 | хлорид натрия (твердый) | C n = 50 |
| углеродистый | C n = 8.6 | этанол (этиловый спирт) | C n = 22 |
Эта таблица позволяет сравнивать теплоемкости одного и того же количества частиц, то есть 1 моль, разных веществ.
Мы обнаружили, что молярная теплоемкость металлов очень похожа, в то время как молярная теплоемкость углерода намного ниже.
Требуется около 25 Дж энергии, чтобы поднять температуру 1 моля металла на 1 ° C (или 1 K), но требуется всего около 9 Дж энергии, чтобы поднять температуру 1 моля углерода на 1 ° C ( или 1 К).
Мы могли бы написать новое уравнение для расчета количества тепла, необходимого (q) для повышения температуры (ΔT) количества вещества в молях (n):
q = C n × n × ΔT
Сноски
1. Поскольку деления шкалы температур по шкале Цельсия и Кельвина одинаковы, и поскольку здесь нас не интересует ни начальная, ни конечная температура, а только разница между ними, можно увидеть, что разница в 1 ° C такая же, как разница в 1 К.
Тщательные эксперименты показывают, что удельная теплоемкость вещества сама по себе является функцией температуры, поэтому в девятнадцатом веке был установлен стандарт, то есть теплоемкость – это тепло, необходимое для повышения температуры 1 г воды с 14,5 °. С до 15,5 ° С.
2. В 1960 году Генеральная конференция мер и весов согласовала единую версию метрической системы.
Единицы в этой системе известны как единицы СИ (Systèm International d’Unités).
Семь базовых единиц составляют основу системы СИ:
| Физическая величина | Название единицы | Обозначение |
|---|---|---|
| масса | килограмм | кг |
| длина | метр | м |
| время | секунда | с |
| электрический ток | ампер | A |
| температура | кельвин | K |
| сила света | кандела | кд |
| количество вещества | моль | моль |
Производные единицы основаны на вышеуказанных единицах СИ.
Единицей силы является ньютаун (Н), это производная единица, 1 Н = 1 кг мс -2
Единица измерения энергии также является производной единицей, джоуль (Дж), 1 Дж = 1 Н m = 1 кг m 2 s -2
Электрические измерения обладают большей точностью, чем калориметрические измерения, как описано в этом обсуждении, поэтому джоуль также можно определить как вольт-кулон.
3. Тепло или тепловая энергия – это энергия, непосредственно передаваемая от одного объекта к другому.
Тепло – это энергия в пути, такое вещество, как вода при постоянной температуре, не имеет «теплосодержания», но имеет «энергосодержание».
Энергетическая составляющая вещества складывается из кинетической энергии (движения) его частиц и потенциальной энергии, такой как запасенная химическая потенциальная энергия в его химических связях.
Температура – это мера средней кинетической энергии частиц.
4. Тепло всегда течет от «горячего» к «холодному».
В 1803 году, через 4 года после его смерти, была опубликована работа Джозефа Блэка по калориметрии (измерению изменений температуры).
В нем он показал, что равенство температуры не означает, что существует также «равенство тепла» в различных веществах.
Он исследовал способность к теплу или количество тепла, необходимое для повышения температуры различных тел на заданное количество градусов.
Объясняя свои эксперименты, он относился к теплу как к веществу, которое может течь от одного тела к другому.
5. Частицы не будут иметь точно такую же кинетическую энергию. Существует распределение кинетических энергий для частиц, поэтому мы говорим о «средней» кинетической энергии частиц в системе.
6. Это называется тепловым равновесием.
7. Точнее сказать, что теплоемкость – это способность вещества передавать тепло другому веществу, поскольку тепло – это энергия в пути.
То есть теплоемкость – это способность или способность вещества передавать тепло другому веществу.
Но поскольку слово емкость обычно понимается как «сдерживание», например мерная колба на 250 мл имеет емкость 250 мл, мы часто думаем, что теплоемкость вещества – это его способность удерживать тепловую энергию.
Мы не можем на самом деле относиться к «теплу» как к аккумулированному, то есть тепло может поглощаться молекулами для увеличения их кинетической энергии, но оно не «накапливается», потому что оно проделало работу по ускорению частиц.
Тепловая энергия может «храниться» как потенциальная энергия в химических связях, если происходит химическая реакция, но в этих примерах это не так.
8. Значения удельной теплоемкости относятся к условиям постоянного атмосферного давления.
Как рассчитать теплоемкость
Обновлено 26 марта 2020 г.
Автор: Кевин Бек
Проверено: Lana Bandoim, B.S.
Если вы наблюдаете, как поверхность замерзшего пруда медленно тает в нетипично теплый зимний полдень, и наблюдаете, как то же самое происходит на поверхности близлежащей большой ледяной лужи, вы можете заметить, что лед в каждой из них, кажется, трансформируется в воду примерно с такой же скоростью.
Но что, если бы весь солнечный свет, падающий на открытую поверхность пруда, размером может быть акр, был одновременно сфокусирован на поверхности лужи?
Ваша интуиция, вероятно, подсказывает вам, что не только поверхность лужи очень быстро растает в воду, но и вся лужа может даже почти мгновенно превратиться в водяной пар, минуя жидкую фазу, чтобы стать водянистым газом. Но почему с точки зрения физики это должно быть?
Та же самая интуиция, вероятно, подсказывает вам, что существует взаимосвязь между теплотой, массой и изменением температуры льда, воды или того и другого.
Как оказалось, дело обстоит именно так, и идея распространяется также на другие вещества, каждое из которых имеет различную «сопротивляемость» теплу, что проявляется в различных изменениях температуры в ответ на заданное количество добавленного тепла. Эти идеи объединяются, чтобы предложить концепции удельной теплоемкости , и теплоемкости .
Что такое тепло в физике?
Тепло – одна из, казалось бы, бесчисленных форм величины, известной в физике как энергия. Энергия выражается в единицах силы, умноженной на расстояние, или в ньютон-метрах, но обычно это называется джоуль (Дж).В некоторых приложениях стандартная единица измерения – 4,18 Дж; в третьих правит btu, или британская тематическая единица.
Тепло имеет тенденцию «перемещаться» из более теплых областей в более прохладные, то есть в области, в которых в настоящее время меньше тепла. Хотя тепло невозможно удержать или увидеть, изменения его величины можно измерить по изменению температуры.
Температура – это мера средней кинетической энергии набора молекул, например стакана с водой или емкости с газом.Добавление тепла увеличивает эту молекулярную кинетическую энергию и, следовательно, температуру, а уменьшение ее снижает температуру.
Что такое калориметрия?
Почему джоуль равен 4,18 калории? Поскольку калория (кал), хотя и не является единицей тепла в системе СИ, является производной от метрических единиц и в некотором смысле является фундаментальной: это количество тепла , необходимое для повышения одного грамма воды при комнатной температуре на 1 К или 1 градус. ° C. (Изменение на 1 градус по шкале Кельвина идентично изменению на 1 градус по шкале Цельсия; однако эти два смещения смещены примерно на 273 градуса, так что 0 K = 273.15 ° C.)
- «Калорийность» на этикетках продуктов – это килокалория (ккал), что означает, что банка сладкой газировки объемом 12 унций содержит около 150 000 настоящих калорий.
То, что можно определить экспериментально, используя воду или какое-либо другое вещество, состоит в том, чтобы поместить заданную массу в контейнер, добавить заданное количество тепла, не позволяя какому-либо веществу или теплу уйти из-под воды. сборки и измерьте изменение температуры.
Так как вы знаете массу вещества и можете предположить, что тепло и температура одинаковы во всем, вы можете простым делением определить, сколько тепла изменит единицу количества, например, 1 грамм, на ту же температуру.
Объяснение уравнения теплоемкости
Формула теплоемкости бывает разных форм, но все они сводятся к одному и тому же основному уравнению:
Это уравнение просто утверждает, что изменение тепла Q замкнутой системы (жидкость, газ или твердого материала) равна массе m образца, умноженной на изменение температуры ΔT, умноженное на параметр C, называемый удельной теплоемкостью , или просто удельной теплоемкостью . Чем выше значение C, тем больше тепла может поглотить система, поддерживая такое же повышение температуры.
Что такое удельная теплоемкость?
Теплоемкость – это количество тепла, необходимое для повышения температуры объекта на определенную величину (обычно на 1 К), поэтому в системе СИ используются Дж / К. Предмет может быть однородным, а может и не быть. Было бы возможно приблизительно определить теплоемкость смеси веществ, таких как грязь, если бы вы знали ее массу и измеряли изменение ее температуры в ответ на нагревание в каком-либо герметичном устройстве.
Более полезной величиной в химии, физике и технике является удельная теплоемкость C , измеренная в единицах тепла на единицу массы.Единицами удельной теплоемкости обычно являются джоули на грамм-кельвин или Дж / г⋅К, хотя килограмм (кг) является единицей массы в системе СИ. Одна из причин, по которой удельная теплоемкость полезна, заключается в том, что если у вас есть известная масса однородного вещества и его теплоемкость, вы можете судить о его пригодности для использования в качестве «поглотителя тепла», чтобы избежать риска возгорания в определенных экспериментальных ситуациях.
Вода действительно обладает очень высокой теплоемкостью. Учитывая, что человеческое тело должно выдерживать добавление или вычитание значительного количества тепла из-за меняющихся условий Земли, это будет основным требованием любого биологического объекта, который состоит в основном из воды, как и почти все существенные живые существа.
Теплоемкость и удельная теплоемкость
Представьте себе спортивный стадион, вмещающий 100 000 человек, и другой стадион, расположенный в городе, на 50 000 человек. С первого взгляда видно, что абсолютная «вместимость» первого стадиона вдвое больше, чем второго. Но также представьте, что второй стадион построен таким образом, что он занимает только 1/4 объема первого.
Если вы проведете алгебру, вы обнаружите, что на меньшем стадионе фактически в два раза больше людей на единицу площади , чем на большом, что дает ему вдвое большее значение «конкретного места».
В рамках этой аналогии представьте отдельных зрителей как единицы тепла одинаковой величины, втекающие на стадион и выходящие из него. В то время как более крупный стадион может удерживать в два раза больше «тепла», меньший стадион фактически имеет вдвое большую вместимость для «хранения» этой версии «тепла» на единицу площади.
Если предполагается, что каждая секция одинакового размера на обоих стадионах будет производить одинаковое количество мусора после игры, когда она заполнена, независимо от того, сколько людей она вмещает, тогда меньшая часть будет вдвое эффективнее для уменьшения помета особей. зрителей; Считайте это вдвое более устойчивым к повышению температуры на единицу добавленного тепла.
Отсюда вы можете видеть, что если два объекта с одинаковой удельной теплоемкостью имеют разные массы, то у большего из них будет большая теплоемкость на величину, которая зависит от того, насколько он массивнее. При сравнении объектов разной массы и разной теплоемкости ситуация усложняется.
 Людмила Фирмаль
Людмила Фирмаль Какой металл сначала нагреется на десять градусов?
Какой металл сначала нагреется на десять градусов?
 Обладает наименьшей устойчивостью к изменению температуры при воздействии тепла. Если вы когда-нибудь с золотым браслетом лезли в духовку, чтобы взять еду, возможно, вы испытали низкую удельную теплоемкость золота. Металлы обладают низкой теплоемкостью и, следовательно, подвергаются быстрому повышению температуры при воздействии тепла.
Обладает наименьшей устойчивостью к изменению температуры при воздействии тепла. Если вы когда-нибудь с золотым браслетом лезли в духовку, чтобы взять еду, возможно, вы испытали низкую удельную теплоемкость золота. Металлы обладают низкой теплоемкостью и, следовательно, подвергаются быстрому повышению температуры при воздействии тепла.  (вы сообщаете все достоверные и первые неопределенные, поэтому, если у вас есть измерение 0.128, вы не совсем уверены в значении 0,008.
(вы сообщаете все достоверные и первые неопределенные, поэтому, если у вас есть измерение 0.128, вы не совсем уверены в значении 0,008.

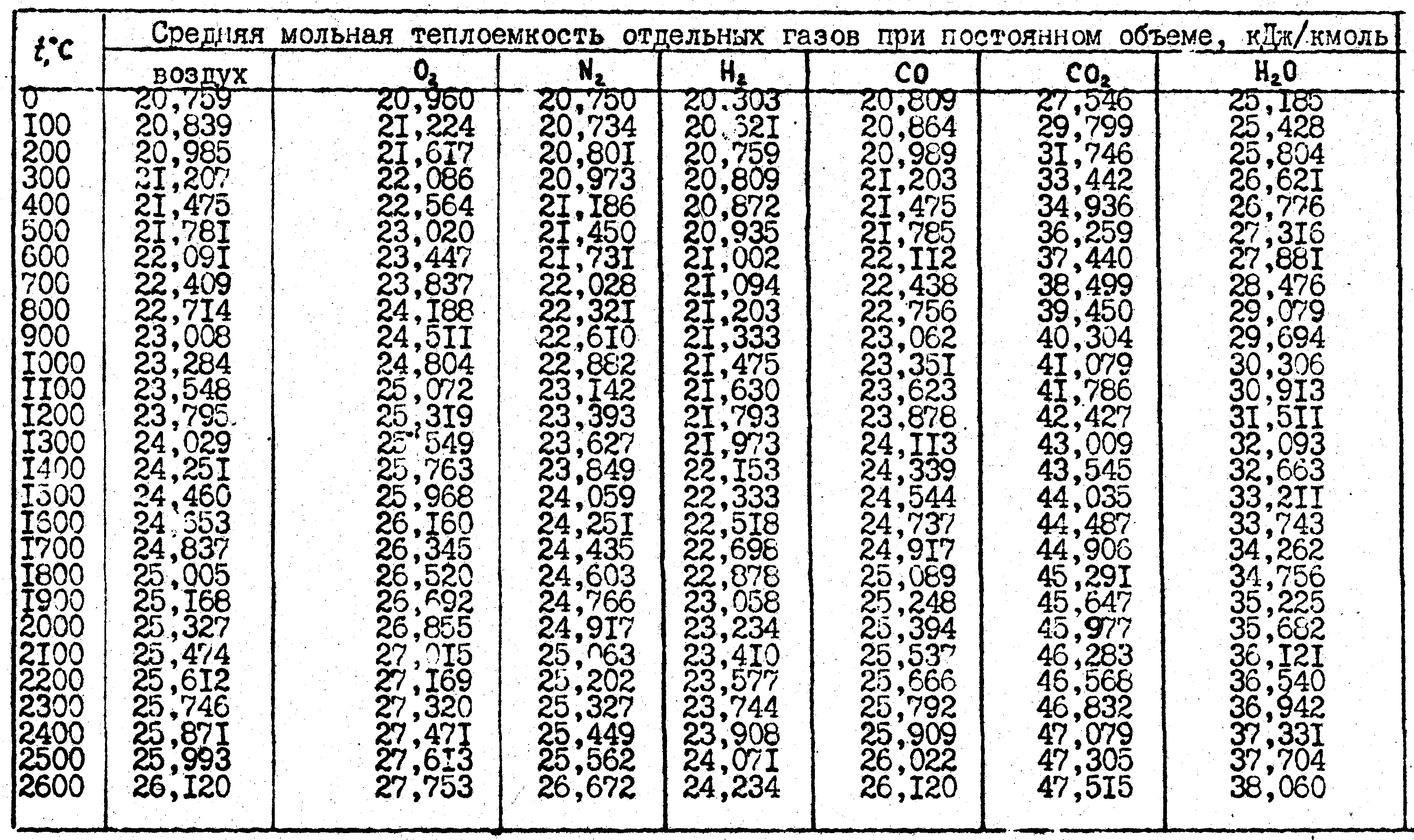 Однако сначала пора добавить еще два шага, которым нужно следовать при решении задач термодинамики.
Однако сначала пора добавить еще два шага, которым нужно следовать при решении задач термодинамики.