Мембранный бак (гидроаккумулятор) Wester WAV 150 0-14-1160 (Россия)
| Объем, л | 150 |
| Назначение | для водоснабжения |
| Расположение | вертикальный |
| Монтаж | напольный |
| Материал корпуса | сталь углеродистая |
| Тип мембраны | сменная мембрана |
| Диаметр подключения, дюйм | 1″ НР |
| Заводская настройка давления, бар | |
| Максимальное рабочее давление, бар | 10 |
| Рабочая температура, °C | +1. ..+100 ..+100 |
| Габариты | |
| – диаметр, мм | 495 |
| – высота, мм | 1 059 |
| Масса брутто, кг | 25,31 |
Расширительный бак для систем водоснабжения производства Wester серии WAV со сменной мембраной.
Эластичная мембрана выполнена из материала EPDM – этиленпропиленовой резины , которую отличает высокая прочность и долговечность.
Необходим для установки в системах холодного и горячего водоснабжения.
Производит компенсацию расширения при повышении температуры, обеспечивает постоянное давление в системе, защищает от гидравлического удара.
Встраивается при помощи резьбового соединения. Имеет дополнительный штуцер (нар.-вн. 3/4″ х 1/2″), куда можно установить манометр или другие устройства, либо заглушку.
Располагается вертикально на стойках.
Материалы для скачивания :
- РУКОВОДСТВО ПО МОНТАЖУ НАСОСЫ WCP ( 2.017мб. PDF )
- ИНСТРУКЦИЯ НАСОСЫ WPE ( 0.648мб. PDF )
- РУКОВОДСТВО ПО МОНТАЖУ НАСОСЫ WCP 130 ( 2.013мб. PDF )
- ИНСТРУКУЦИЯ БОЙЛЕРЫ WHU
( 0.
 859мб. PDF )
859мб. PDF ) - СЕРТИФИКАТ КОЛЛЕКТОРЫ WESTER и АКВАТЕК
все для воды ( 0.619мб. PDF ) - ПАСПОРТ РАСШИРИТЕЛЬНЫЕ БАКИ WRV 8-1000 ( 0.464мб. PDF )
- ПАСПОРТ РАСШИРИТЕЛЬНЫЕ БАКИ WRV 1500-10000 ( 0.305мб. PDF )
- ПАСПОРТ РАСШИРИТЕЛЬНЫЕ БАКИ WRV 8-10000 (16
бар) ( 0. 529мб. PDF )
529мб. PDF ) - ПАСПОРТ ГИДРОАККУМУЛЯТОРЫ WAV и WAO 8-1000 ( 0.86мб. PDF )
- ПАСПОРТ ГИДРОАККУМУЛЯТОРЫ WAV и WAO
1500-10000 ( 0.415мб. PDF ) - ПАСПОРТ ГИДРОАККУМУЛЯТОРЫ WAV и WAO 8-10000
(16 бар) ( 1.061мб. PDF ) - ПАСПОРТ ГИДРОАККУМУЛЯТОРЫ WAV и WAO Premium
( 0.
 735мб. PDF )
735мб. PDF ) - ПАСПОРТ ГИДРОАККУМУЛЯТОРЫ WDV Premium
гелио ( 0.241мб. PDF ) - ПАСПОРТ КРАНЫ ГАЗОВЫЕ Wester W100 ( 2.811мб. PDF )
- ПАСПОРТ РАДИАТОРЫ ПАНЕЛЬНЫЕ WESTER ( 4.942мб. PDF )
- СЕРТИФИКАТ РАДИАТОРЫ ПАНЕЛЬНЫЕ WESTER ( 0.569мб. PDF )
- ДЕКЛАРАЦИЯ НАСОСЫ WESTER_ АКВАТЕК
( 3.
 228мб. PDF )
228мб. PDF ) - СЕРТИФИКАТ НАСОСЫ ЦИРКУЛЯЦИОННЫЕ
WESTER_ АКВАТЕК ( 1.28мб. PDF ) - СЕРТИФИКАТ НАСОСНЫЕ СТАНЦИИ AQUA BOOSTER,
ДРЕНАЖНЫЕ НАСОСЫ WESTER_ AQUATECH_АКВАТЕК ( 3.811мб. PDF ) - СЕРТИФИКАТ WHU_WHZ_12.02.2023г. ( 0.814мб. PDF )
- ИНСТРУКЦИЯ БОЙЛЕРЫ Wester WHZ_2021
( 6.
 374мб. PDF )
374мб. PDF ) - СЕРТИФИКАТ БАКИ МЕМБРАННЫЕ Wester
(МеталлоФорм)_26.01.2027г. ( 1.64мб. PDF ) - Сертификаты производителя
Wester WRV 200 л мембранные расширительные баки. Цены, отзывы, описание > Каталог оборудования > Санкт-Петербург
Каталог Оборудование для котельных Мембранные расширительные баки Для отопления Россия Wester WRV
Код товара:
38359
Артикул производителя:
WRV200(top)
Гарантия:
1 год
Производитель:
Wester
4. 5
(оценок: 36)
5
(оценок: 36)
Товар снят с продажи!
Есть близкий* аналог данного товара:
114463 Мембранные расширительные баки Stout STH-0006-000200 200 л , арт.производителя STH-0006-000200
* подбирались нашим специалистом
Напечатать
Добавить в закладки
Добавить в сравнения
Имеются в наличии аналоги данного оборудования
Подробнее
Нужен совет? Позвоните нам!
+7 (812) 401-66-22 (многоканальный) или
+7 (800) 333-56-06 (бесплатный по России)
Заказать обратный звонок
Основные характеристики оборудования Мембранные расширительные баки Wester WRV 200 л
Вид оборудования:
мембранные расширительные баки
Назначение:
для отопления
Давление:
16 бар
Происхождение бренда:
Россия
Диаметр :
590 мм
Диаметр подключения :
32 мм
Высота :
1120 мм
Ширина :
590 мм
Глубина :
590 мм
Объем :
200 л
Вес :
36 кг
Габариты (ШxВxГ) :
590x1120x590 мм
Информация об оборудовании Мембранные расширительные баки Wester WRV 200 л
- Описание
- Габаритный чертеж 0
- Документация 4
- Отзывы 0
Бак мембранный для отопления WRV 300 литров; Макс. давление – 10 бар
давление – 10 бар
Мембранные расширительные баки Wester WRV предназначены для компенсации температурных расширений теплоносителя в замкнутых системах отопления. Объем баков от 8 л до 5000 л. Модели WRV 50-150 выполнены на опорах. Баки свыше 750 литров комплектуются манометрами.
Технические особенности:
- Баки изготовлены из высокопрочной стали и рассчитаны на многолетнюю эксплуатацию
- Внешняя сторона бака покрыта эпоксилолиэфирной краской
- Мембрана выполнена из специальной резины EPDM
- Баки снабжены двумя штуцерами: для присоединения трубопровода системы отопления и для поддержания давления внутри самого бака
Габаритный чертеж временно отсутствует
Проспект
Технический паспорт
Сертификат соответствия
Санитарно-эпидемиологическое заключение
Аналоги данного оборудования
Наиболее близкие* аналоги из нашего ассортимента
* аналоги подбирались нашим специалистом
Код товара: 114463
Артикул: STH-0006-000200
Мембранные расширительные баки Stout STH-0006-000200 200 л
20 664
Купить в 1 клик
В наличии 3 шт
С этим товаром покупают
Вместе с этим товаром наши клиенты покупали данное оборудование, возможно оно понадобится и Вам.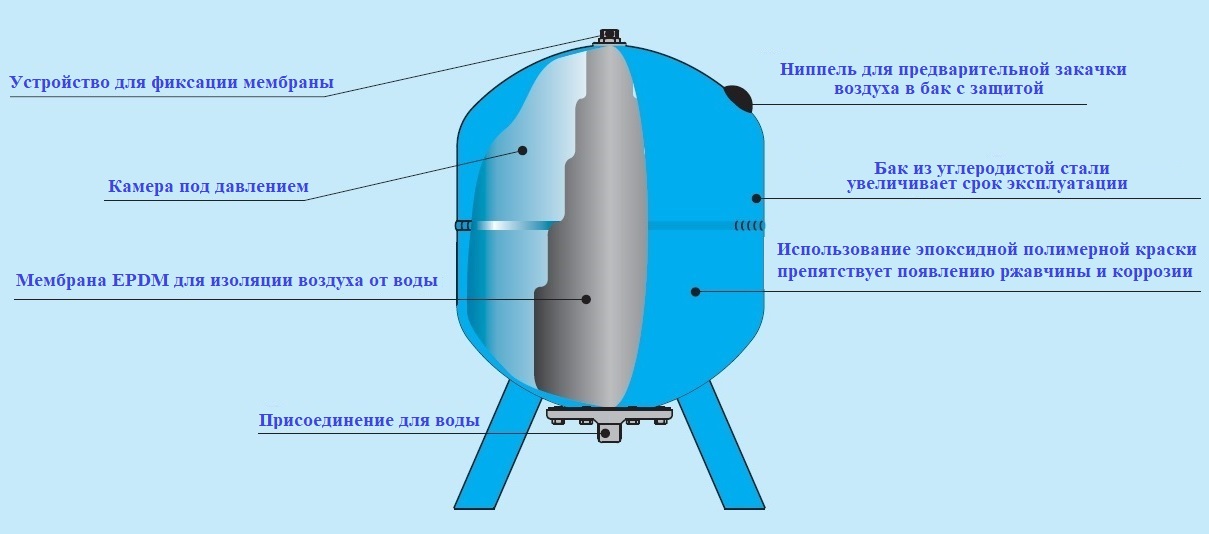
Код товара: 30011
Артикул: 1513028
Тройники Sanha 5130 ВП равнопроходные Dn 28 х 28 х 28
493
Купить в 1 клик
В наличии 46 шт
Код товара: 25657
Артикул: PA37012P
Полипропиленовые трубы Pro Aqua армированные стекловолокном RUBIS SDR 6 32 мм
165
Купить в 1 клик
В наличии 700 м
{{/if}} {{if IsHit}}
ХИТ
{{/if}} {{if IsNova}}
NEW
{{/if}}
{{/if}}${Name}
{{if RemovedAll || UnknownPriceAll}}
{{if RemovedAll}}
Снят с продажи
{{else}}
Стоимость по запросу
{{/if}}
{{else}}
{{if ModelPrice. PriceOne}}
{{if !ModelPrice.Undefined}}
${ModelPrice.PriceMin}
{{else}}
Стоимость по запросу
{{/if}}
{{else}}
${ModelPrice.PriceMin} – ${ModelPrice.PriceMax}
{{/if}}
{{/if}}
PriceOne}}
{{if !ModelPrice.Undefined}}
${ModelPrice.PriceMin}
{{else}}
Стоимость по запросу
{{/if}}
{{else}}
${ModelPrice.PriceMin} – ${ModelPrice.PriceMax}
{{/if}}
{{/if}}
{{if StockMainEnable}} на складе {{/if}}
Системы перекачки мокрых резервуаров | Thermo Fisher Scientific
Влажный перенос является наиболее распространенной и традиционной стратегией вестерн-блоттинга благодаря своей эффективности и производительности. Мы предлагаем три системы перекачки баков, которые сводят к минимуму требуемый объем буфера перекачки.
Мембраны для переноса Буферы для переноса
- Системы для влажного переноса
- Модуль Mini Blot
- Модуль XCell II Blot
- SureLock Tandem
Midi B Лот Модуль - Заказ
информация - Документы
Какая система перекачки с мокрым баком подходит именно вам?
| Модуль мини-блоттинга | XCell II Blot Module | SureLock Tandem Midi Blot Module | |
|---|---|---|---|
| Емкость | 1 мини-гель на модуль блота; 1–2 модуля блоттинга на бак | 1–2 мини-геля на модуль блота; 1 модуль блоттинга на бак | 1 миди-гель на модуль блота, 1-2 модуля блота на резервуар |
| Требования к буферу для переноса | 220 мл на блот | 800 мл | 300 мл на блот |
| Время переноса | 60 мин | 60-120 мин | 30 мин |
| Область блоттинга | 9 x 9 см | 9 x 9 см | 9,2 x 14,4 см |
| Совместимый блок питания | Источники питания PowerEase Touch, системы Owl, для других систем, использующих адаптеры питания Novex (кат. № ZA10001) № ZA10001) | Источники питания PowerEase Touch, системы Owl, для других систем, использующих адаптеры питания Novex (кат. № ZA10001) | Блоки питания PowerEase Touch или системы Owl |
| Необходимое оборудование | Mini Gel Tank | XCell SureLock Mini-Cell или XCell II Mini-Cell 90 031 | Тандемный миди-бак с гелем SureLock: вместимость до 2 блоттинга |
Удобный, надежный западный трансфер
Два мини-модуля для блоттинга помещаются в мини-бак с гелем и предназначены для простого и удобного переноса вестернов.
- Универсальная модульная конструкция — позволяет устанавливать модули в любую камеру резервуара, упрощая настройку переноса
- Уникальная прокладка — помогает предотвратить утечку буфера, поэтому во время настройки западного переноса не возникает беспорядка
- 1/2-дюймовая буферная камера — требуется вдвое меньше стандартного объема буферов для переноса на основе метанола
- Стандартный 60-минутный протокол переноса — ускоряет ваш западный рабочий процесс, чтобы вы могли быстрее получать результаты
- Прочные электроды, прочные стальные пластины — для высокоэффективных и надежных западных переводов
Пример условий перевода
| Тип геля | Мембрана | Напряжение | Пусковой ток (мА) | Конечный ток (мА) | Время работы |
|---|---|---|---|---|---|
| Болт Бис-Трис Плюс 4-12% (МЭС) | Нитроцеллюлоза | 9 0030 10160 | 60 | 60 | |
| ПВДФ | 20 | 340 | 130 | 60 | |
| NuPAGE 4-12% Бис-Трис (МЭС) | Нитроцеллюлоза | 10 | 160 | 60 | 60 |
| ПВДФ | 20 | 390 | 130 | 60 | |
| Novex 4 -20% Трис-глицин (денатурированный) | Нитроцеллюлоза | 10 | 70 | 50 | 60 |
| ПВДФ | 20 | 160 | 100 | 60 | |
| NuPAGE 3-8% Tri s Ацетат (денатурированный) | Нитроцеллюлоза | 10 | 150 | 50 | 60 |
| ПВДФ | 20 | 380 | 130 | 60 900 31 | |
| Novex 10-20% Tricine | Нитроцеллюлоза | 10 | 70 | 60 | 60 |
| ПВДФ | 20 | 180 | 150 | 60 |
* Текущее значение s представляют значения при работе с одним гелем и могут варьироваться в зависимости от используемого источника питания.
Видео с инструкциями
Как выполнить вестерн-блот-перенос с использованием модуля Mini Blot Invitrogen
Узнайте, как выполнить вестерн-блот-перенос с помощью модуля Mini Blot в Mini Gel Tank.
Как разделить белки с помощью сборного геля SDS-PAGE Invitrogen
Узнайте, как разделить белки с помощью сборного геля Invitrogen Bolt Bis-Tris Plus SDS-PAGE и мини-гелевого резервуара.
Начните работу с приветственными пакетами модуля Mini Bolt
Блот-модуль XCell II позволяет легко переносить белки или нуклеиновые кислоты из мини-гелей в мембраны. Он идеально вписывается в мини-ячейки XCell SureLock и XCell II вместо узла сердцевины из геля/буфера. Для западного, южного и северного переноса требуется менее 200 мл буфера переноса. Прочные платинированные электроды из титана и нержавеющей стали создают однородное электрическое поле без зажимов или шарнирных держателей геля. Максимальный размер пятна составляет 9 см x 9 см.
Пример условий перевода
| Тип геля | Мембрана | Буфер для переноса | Условия переноса | Ожидаемый ток | Время работы | Трис-глицин | Нитроцеллюлоза или ПВДФ | Трис-глицин Буфер для переноса с 20% метанола. 1X Transfer Buffer должен иметь pH 8,3 перед добавлением SDS или метанола. | 25 В постоянное | 100 мА | 1-2 часа |
|---|---|---|---|---|---|---|
| Tricine | Нитроцеллюлоза или PVDF | Tris-Glycine Transfer Buffer с 20% метанола. 1X Transfer Buffer должен иметь pH 8,3 перед добавлением SDS или метанола. | 25 В пост. Буфер для переноса s-Tris с 10 % метанола и антиоксидантом для уменьшенных образцов | 30 В, константа | Начало: 170 мА Конец: 100 мА | 1 час |
| Трис-ацетат | Нитроцеллюлоза или ПВДФ | Бис-трис буфер для переноса с 10 % метанола и антиоксидантом для уменьшенных образцов | 30 В, постоянный | 9003 0 Начало: 200 мА Конец: 180 мА60 | ||
| IEF | Нитроцеллюлоза или ПВДФ | 0,7 % уксусная кислота, pH 3,0 | 10 В пост.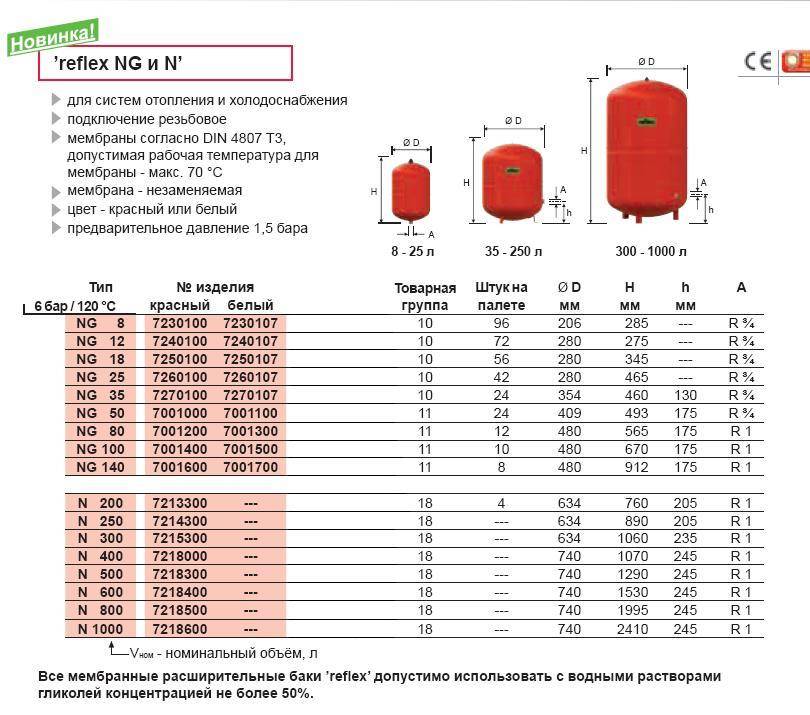 0031 0031 | |||
| Замедление TBE, TBE-мочевины и DAN | Нейлон | 45 мМ Трис, 45 мМ борная кислота, 1 мМ ЭДТА | 30 В постоянное | Начало: 360 мА Конец: 270 мА | 1-2 часа | 9 0038
Ожидаемый ток указан в таблице ниже для передачи одного геля. Если вы переносите два геля в модуль блоттинга, ожидаемый ток удвоится.
Для ночного блоттинга перенос при постоянном напряжении 10–15 В.
Узнайте, как использовать модуль блоттинга XCell II
Узнайте, как выполнить перенос мокрого резервуара с помощью модуля блоттинга XCell II в баке SureLock с помощью этого подробное пошаговое видео.
Узнайте, как запустить гель с помощью системы XCell SureLock
Посмотрите это пошаговое видео о том, как запустить сборный элемент NuPAGE в резервуаре SureLock.
Удобный и надежный влажный перенос миди-гелей
Если ваш рабочий процесс вестерн-блоттинга требует более высокой пропускной способности, миди-гели Invitrogen позволяют загружать до 26 образцов на гель. Вы можете использовать резервуар для геля SureLock Tandem Midi Gel Tank для запуска до 2 высокоэффективных гелей Midi Invitrogen и переноса их на мембраны в одном резервуаре с помощью модуля SureLock Tandem Midi Blot. Два тандемных миди-блот-модуля SureLock помещаются в инновационный двойной резервуар для геля SureLock Tandem Midi и предназначены для простого переноса геля при комнатной температуре. Для переноса геля требуется всего 300 мл буфера, содержащего метанол, что снижает затраты на буфер и опасную утилизацию.
Вы можете использовать резервуар для геля SureLock Tandem Midi Gel Tank для запуска до 2 высокоэффективных гелей Midi Invitrogen и переноса их на мембраны в одном резервуаре с помощью модуля SureLock Tandem Midi Blot. Два тандемных миди-блот-модуля SureLock помещаются в инновационный двойной резервуар для геля SureLock Tandem Midi и предназначены для простого переноса геля при комнатной температуре. Для переноса геля требуется всего 300 мл буфера, содержащего метанол, что снижает затраты на буфер и опасную утилизацию.
- Тандемный миди-гелевый резервуар SureLock 2-в-1 — нет необходимости приобретать отдельный резервуар для переноса в западном направлении
- Перенос при комнатной температуре — экономия времени, планирования и беспорядка, необходимых для предварительного охлаждения с другими системами буферы, замораживание пакетов со льдом или приготовление ледяных бань
- 300 мл на объем буфера для переноса геля — меньший требуемый объем буфера для переноса снижает потребление реагентов и затраты на опасную утилизацию
- Быстро и эффективно — 30-минутный перенос без ущерба для производительности
- Простота в использовании — удобные инструкции по сборке блотов напечатаны на дополнительном лотке для переноса
- Прочные электродные пластины — для высокоэффективного и надежного вестерн-переноса
9000 3
Начните работу с приветственным пакетом модуля Midi Blot
| Приветственный набор SureLock Tandem Midi, нитроцеллюлоза |
|---|
Включает:
|
Стабильные и надежные результаты вестерн-блоттинга
При использовании с высокопроизводительными сборными миди-гелями Invitrogen вы можете положиться на тандемный миди-гелевый резервуар SureLock и модуль миди-блоттинга для получения последовательных высокопроизводительных вестерн-блоттингов. Миди-гели Invitrogen обеспечивают воспроизводимое высокоэффективное разделение белков, что приводит к получению четких полос с хорошим разрешением на прямых дорожках, а модуль тандемного миди-блоттинга SureLock обеспечивает надежный однородный перенос белков через гель.
Чтобы продемонстрировать однородность переноса через мембрану модуля тандемного миди-блоттинга SureLock, гель NuPAGE 4-12% Bis-Tris Midi был загружен повторяющимися разведениями лизата E. coli в диапазоне 2-0,25 мкг и SeeBlue Plus2 Pre -окрашенный белковый стандарт. Проводили электрофорез и гель переносили на 0,45 мкм PVDF-мембрану. Результаты показаны на Рисунок 1 .
Проводили электрофорез и гель переносили на 0,45 мкм PVDF-мембрану. Результаты показаны на Рисунок 1 .
A
BРис. 1. Равномерный перенос с использованием бака с гелем SureLock Tandem Midi Gel Tank. Нормализация общего белка переносимых белков показывает равномерный перенос по блоту.
A. ПВДФ-блот, помеченный реагентом без окрашивания. В гель NuPAGE 4-12% Bis-Tris Midi наносили повторяющиеся разведения лизата E. coli в диапазоне от 2 до 0,25 мкг и предварительно окрашенный белковый стандарт SeeBlue Plus2 на дорожках 1-2 и 19-20. Гель подвергли электрофорезу с использованием подвижного буфера MES в резервуаре для геля SureLock Tandem Midi. Белки из геля переносили на мембраны 0,45 мкм PVDF при постоянном напряжении 25 В в течение 30 минут с использованием модуля тандемного миди-блоттинга SureLock. После переноса белки на мембране были помечены в соответствии с протоколом реагента для мечения белков без окрашивания для мембран среднего размера. Изображение было получено с использованием iBright Imager с эпи-настройкой No-Stain Membrane (возбуждение 455-485 нм и эмиссия 565-615 нм). Поскольку предварительно окрашенный белковый стандарт SeeBlue Plus2 уже помечен, не все его белковые полосы можно пометить реагентом без окрашивания, и поэтому не все они видны на этом изображении.
Изображение было получено с использованием iBright Imager с эпи-настройкой No-Stain Membrane (возбуждение 455-485 нм и эмиссия 565-615 нм). Поскольку предварительно окрашенный белковый стандарт SeeBlue Plus2 уже помечен, не все его белковые полосы можно пометить реагентом без окрашивания, и поэтому не все они видны на этом изображении.
B. Линейность денситометрического сигнала в зависимости от белковой нагрузки. Интенсивность денситометрического сигнала определялась для каждой дорожки. Технические повторы (n=4) были усреднены и построены для определения линейной регрессии для всего диапазона концентраций (R2=0,9994). Столбики погрешностей представляют собой стандартное отклонение.
Рекомендуемые условия передачи
Рекомендуемые условия переноса для всех сборных миди-гелей Invitrogen:
| Постоянное напряжение (В) | Время (мин) |
|---|---|
| 25 | 30 |
Системы мокрого переноса
Какая система перекачки с мокрым баком подходит именно вам?
| Модуль мини-блоттинга | Блот-модуль XCell II | Тандемный миди-блот-модуль SureLock | |
|---|---|---|---|
| Емкость | 1 мини-гель на модуль блота; 1–2 модуля блоттинга на бак | 1–2 мини-геля на модуль блота; 1 модуль блота на бак | 1 миди-гель на модуль блота, 1-2 модуля блота на бак |
| Требования к буферу для переноса | 220 мл на блот | 800 мл 900 31 | 300 мл на блот |
| Время передачи | 60 мин | 60-120 мин | 30 мин |
| Область для блоттинга | 9 x 9 см | 9 x 9 см | 9,2 x 14,4 см |
| Совместимый блок питания | Блоки питания PowerEase Touch, системы Owl, для других систем, использующих Адаптеры блоков питания Novex (кат. № ZA10001) № ZA10001) | Блоки питания PowerEase Touch, системы Owl, для других систем, использующих адаптеры блоков питания Novex (кат. № ZA10001) | Блоки питания PowerEase Touch или системы Owl |
| Необходимое оборудование | Mini Gel Tank | XCell SureLock Mini-Cell или XCell II Mini-Cell | SureLock Tandem Midi Gel Tank: вместимость до 2 модулей блоттинга |
Модуль Mini Blot
Удобный, надежный западный трансфер
Два мини-модуля для блоттинга помещаются в мини-бак с гелем и предназначены для простого и удобного переноса вестернов.
- Универсальная модульная конструкция — позволяет устанавливать модули в любую камеру резервуара, упрощая настройку переноса
- Уникальная прокладка — помогает предотвратить утечку буфера, поэтому при настройке западного переноса не возникнет беспорядка
- 1/2-дюймовая буферная камера — требуется половина стандартного объема буферов для переноса на основе метанола
- Стандартный 60-минутный протокол переноса — ускоряет ваш западный рабочий процесс, чтобы вы могли быстрее получать результаты
- Прочные электроды, прочные стальные пластины — для высокоэффективных и надежных западных переводов
Пример условий перевода
| Тип геля | Мембрана | Напряжение | Пусковой ток (мА) | Конечный ток (мА) | Время работы | 90 038
|---|---|---|---|---|---|
| Болт Бис-Трис Плюс 4-12% (МЭС) | Нитроцеллюлоза | 10 | 160 | 60 | 60 |
| ПВДФ | 20 | 340 | 130 | 60 | |
| NuPAGE 4-12% Bis-Tris (MES) | Нитроцеллюлоза | 10 | 160 | 60 | 60 |
| ПВДФ | 20 | 390 | 130 | 60 | |
| Novex 4-20% Трис-глицин (денатурированный) | Нитроцеллюлоза | 10 | 70 | 50 | 60 |
| ПВДФ | 20 | 160 | 100 | 60 900 31 | |
| NuPAGE 3-8% трис ацетат (денатурированный) | Нитроцеллюлоза | 10 | 150 | 50 | 60 |
| ПВДФ | 20 | 380 | 130 | 60 | Novex 10-20% Tricine | Нитроцеллюлоза | 10 | 70 | 60 | 60 |
| ПВДФ | 20 | 180 | 150 900 31 | 60 |
* Текущие показания представляют значения при работе с одним гелем и могут варьироваться в зависимости от источника питания. быть использованным.
быть использованным.
Видео с инструкциями
Как выполнить вестерн-блот-перенос с использованием модуля Mini Blot Invitrogen
Узнайте, как выполнить вестерн-блот-перенос с помощью модуля Mini Blot в Mini Gel Tank.
Как разделить белки с помощью сборного геля SDS-PAGE Invitrogen
Узнайте, как разделить белки с помощью сборного геля Invitrogen Bolt Bis-Tris Plus SDS-PAGE и мини-гелевого резервуара.
Начните работу с приветственными пакетами модуля Mini Bolt
Модуль XCell II Blot
Блот-модуль XCell II позволяет легко переносить белки или нуклеиновые кислоты из мини-гелей в мембраны. Он идеально подходит для XCell SureLock 9.0325 и мини-ячейки XCell II вместо узла ядра геля/буфера. Для западного, южного и северного переноса требуется менее 200 мл буфера переноса. Прочные платинированные электроды из титана и нержавеющей стали создают однородное электрическое поле без зажимов или шарнирных держателей геля. Максимальный размер пятна составляет 9 см x 9 см.
Максимальный размер пятна составляет 9 см x 9 см.
Пример условий перевода
| Тип геля | Мембрана | Буфер для переноса | Условия переноса | Ожидаемый ток | Время работы |
|---|---|---|---|---|---|
| Трис-глицин | Нитроцеллюлоза или ПВДФ | Трис-глицин Буфер для переноса с 20% метанола. 1X Transfer Buffer должен иметь pH 8,3 перед добавлением SDS или метанола. | 25 В постоянное | 100 мА | 1-2 часа |
| Трицин | Нитроцеллюлоза или ПВДФ | Трис-Гли Cine Transfer Buffer с 20% метанола. 1X Transfer Buffer должен иметь pH 8,3 перед добавлением SDS или метанола. | 25 В постоянное | Пуск: 100 мА | 1-2 часа |
| Бис-Трис | Нитроцеллюлоза или ПВДФ | Бис – Трис-буфер для переноса с 10 % метанола и антиоксидантом для уменьшенных образцов | 30 В, константа | Начало: 170 мА Конец: 100 мА | 1 час |
| Трис-ацетат | Нитроцеллюлоза или ПВДФ образцы | 30 В пост. | Начало: 200 мА Конец: 180 мА | 60 | |
| IEF | Нитроцеллюлоза или ПВДФ | 0,7% уксусная кислота, pH 3.0 | 10 В постоянное | Пуск: 65-85 мА | 60 |
| Замедление TBE, TBE-мочевины и DAN | Нейлон | 45 мМ трис, 45 мМ борная кислота, 1 мМ ЭДТА | 30 В, постоянный | 9003 0 Начало: 360 мА Конец: 270 мА1-2 час |
Ожидаемый ток, указанный в таблице ниже, рассчитан на передачу одного геля. Если вы переносите два геля в модуль блоттинга, ожидаемый ток удвоится.
Для ночного блоттинга перенос при постоянном напряжении 10–15 В.
Узнайте, как использовать модуль блоттинга XCell II
Узнайте, как выполнить перенос мокрого резервуара с помощью модуля блоттинга XCell II в резервуаре SureLock с помощью этого подробное пошаговое видео.
Узнайте, как запустить гель с помощью системы XCell SureLock
Посмотрите это пошаговое видео о том, как запустить сборный элемент NuPAGE в резервуаре SureLock.
Модуль миди-блоттинга SureLock Tandem
Удобный и надежный влажный перенос миди-гелей
Если ваш рабочий процесс вестерн-блоттинга требует более высокой пропускной способности, миди-гели Invitrogen позволяют загружать до 26 образцов на гель. Вы можете использовать резервуар для геля SureLock Tandem Midi Gel Tank для запуска до 2 высокоэффективных гелей Midi Invitrogen и переноса их на мембраны в одном резервуаре с помощью модуля SureLock Tandem Midi Blot. Два тандемных миди-блот-модуля SureLock помещаются в инновационный двойной резервуар для геля SureLock Tandem Midi и предназначены для простого переноса геля при комнатной температуре. Для переноса геля требуется всего 300 мл буфера, содержащего метанол, что снижает затраты на буфер и опасную утилизацию.
- Тандемный миди-гелевый резервуар SureLock 2-в-1 — нет необходимости приобретать отдельный резервуар для переноса в западном направлении
- Перенос при комнатной температуре — экономия времени, планирования и беспорядка, необходимых для предварительного охлаждения с другими системами буферы, замораживание пакетов со льдом или приготовление ледяных бань
- 300 мл на объем буфера для переноса геля — меньший требуемый объем буфера для переноса снижает потребление реагентов и затраты на опасную утилизацию
- Быстро и эффективно — 30-минутный перенос без ущерба для производительности
- Простота в использовании — удобные инструкции по сборке блотов напечатаны на дополнительном лотке для переноса
- Прочные электродные пластины — для высокоэффективного и надежного вестерн-переноса
9000 3
Начните работу с приветственным пакетом модуля Midi Blot
| Приветственный набор SureLock Tandem Midi, нитроцеллюлоза |
|---|
Включает:
|
Стабильные и надежные результаты вестерн-блоттинга
При использовании с высокопроизводительными сборными миди-гелями Invitrogen вы можете положиться на тандемный миди-гелевый резервуар SureLock и модуль миди-блоттинга для получения последовательных высокопроизводительных вестерн-блоттингов. Миди-гели Invitrogen обеспечивают воспроизводимое высокоэффективное разделение белков, что приводит к получению четких полос с хорошим разрешением на прямых дорожках, а модуль тандемного миди-блоттинга SureLock обеспечивает надежный однородный перенос белков через гель.
Чтобы продемонстрировать однородность переноса через мембрану модуля тандемного миди-блоттинга SureLock, гель NuPAGE 4-12% Bis-Tris Midi был загружен повторяющимися разведениями лизата E. coli в диапазоне 2-0,25 мкг и SeeBlue Plus2 Pre -окрашенный белковый стандарт. Проводили электрофорез и гель переносили на 0,45 мкм PVDF-мембрану. Результаты показаны на Рисунок 1 .
Проводили электрофорез и гель переносили на 0,45 мкм PVDF-мембрану. Результаты показаны на Рисунок 1 .
A
BРис. 1. Равномерный перенос с использованием бака с гелем SureLock Tandem Midi Gel Tank. Нормализация общего белка переносимых белков показывает равномерный перенос по блоту.
A. ПВДФ-блот, помеченный реагентом без окрашивания. В гель NuPAGE 4-12% Bis-Tris Midi наносили повторяющиеся разведения лизата E. coli в диапазоне от 2 до 0,25 мкг и предварительно окрашенный белковый стандарт SeeBlue Plus2 на дорожках 1-2 и 19-20. Гель подвергли электрофорезу с использованием подвижного буфера MES в резервуаре для геля SureLock Tandem Midi. Белки из геля переносили на мембраны 0,45 мкм PVDF при постоянном напряжении 25 В в течение 30 минут с использованием модуля тандемного миди-блоттинга SureLock. После переноса белки на мембране были помечены в соответствии с протоколом реагента для мечения белков без окрашивания для мембран среднего размера. Изображение было получено с использованием iBright Imager с эпи-настройкой No-Stain Membrane (возбуждение 455-485 нм и эмиссия 565-615 нм). Поскольку предварительно окрашенный белковый стандарт SeeBlue Plus2 уже помечен, не все его белковые полосы можно пометить реагентом без окрашивания, и поэтому не все они видны на этом изображении.
Изображение было получено с использованием iBright Imager с эпи-настройкой No-Stain Membrane (возбуждение 455-485 нм и эмиссия 565-615 нм). Поскольку предварительно окрашенный белковый стандарт SeeBlue Plus2 уже помечен, не все его белковые полосы можно пометить реагентом без окрашивания, и поэтому не все они видны на этом изображении.
B. Линейность денситометрического сигнала в зависимости от белковой нагрузки. Интенсивность денситометрического сигнала определялась для каждой дорожки. Технические повторы (n=4) были усреднены и построены для определения линейной регрессии для всего диапазона концентраций (R2=0,9994). Столбики погрешностей представляют собой стандартное отклонение.
Рекомендуемые условия передачи
Рекомендуемые условия переноса для всех сборных миди-гелей Invitrogen:
| Постоянное напряжение (В) | Время (мин) |
|---|---|
| 25 | 30 |
Информация для заказа
Документы
Ресурсы
Загрузить: Техническое руководство по электрофорезу в белковом геле
Доступ: Протоколы, советы и рекомендации, а также устранение неполадок при электрофорезе
Только для исследовательских целей. Не для использования в диагностических процедурах.
Не для использования в диагностических процедурах.
Дополнение: вестерн-блоттинг
Введение
Вестерн-блоттинг — это метод, используемый для разделения белков по размеру с последующим обнаружением с использованием антител, специфичных к интересующему белку. В этом протоколе описываются основные этапы лизиса клеток, определения общей концентрации белка в лизате, запуска готового геля SDS-PAGE и иммуноблоттинга.
Совместное использование ускоряет науку. Мы считаем, что предоставление полной информации о наших протоколах поддерживает воспроизводимость и ускоряет науку. Здесь мы перечисляем конкретное оборудование, реагенты и методы, которые мы используем в нашей лаборатории в Addgene. Оборудование и реагенты других поставщиков должны давать аналогичные результаты при использовании этих протоколов. Однако имейте в виду, что может потребоваться корректировка протокола для учета небольших различий между продуктами. Addgene не поддерживает и не рекомендует конкретные продукты или оборудование. Включение этой информации исключительно для прозрачности, предназначенной для поддержки воспроизводимости в науке.
Включение этой информации исключительно для прозрачности, предназначенной для поддержки воспроизводимости в науке.
Общие указания
Процентное содержание акриламида варьируется в гелях SDS-PAGE. Используйте более низкое процентное содержание акриламида при иммуноблотинге белков с высокой молекулярной массой и более высокое процентное содержание акриламида при иммуноблотинге белков с низкой молекулярной массой.
В этом протоколе используется устройство для сухого переноса, но его можно адаптировать для влажного и полусухого способов переноса.
Последнее обновление: 24 января 2022 г.
Хронология рабочего процесса
- День 1: Подготовка лизатов, проведение SDS-PAGE, перенос, блокирование, инкубация с первичными антителами
- День 2: Инкубация со вторичным антителом
Видео
Посмотрите это обучающее видео, чтобы узнать, как использовать вестерн-блоттинг для визуализации белка из клеток или образцов тканей.
Оборудование
- Микроцентрифуга
- Одноканальная пипетка 0,5–10 мкл
- Одноканальная пипетка 2–20 мкл
- Одноканальная пипетка 20–200 мкл
- Одноканальная пипетка 200–1000 мкл
- Контроллер пипетки
- Наконечники для пипеток и пипетки
- Спектрофотометр
- Тепловой блок
- Камера мини-гелевого резервуара
- Блок питания
- Устройство для переноса геля iBlot 2
- Ролик
- Шпатель
- Платформенный шейкер
- Холодильная камера
- Гелевый имидж-сканер
- Морозильная камера -80 °C
Реагенты
- 1X ПБС
- Буфер для лизиса, например, буфер для лизиса RIPA
- Микроцентрифужные пробирки
- Анализ BCA, Thermo Fisher 23227
- β-меркаптоэтанол
- 4-кратный буфер для загрузки белка
- Сборный гель SDS-PAGE
- Рабочий буфер SDS-PAGE
- Предварительно окрашенная белковая лестница
- Этанол
- iBlot 2 PVDF Mini Stack, Thermo Fisher IB24002
- 20X ТБС
- Твин-20
- Молоко сухое обезжиренное
- 96-луночный планшет для микротитрования
- Хемилюминесцентная подложка
- Полиэтиленовая пленка
- Первичное антитело
- Вторичное антитело
- Деионизированная вода
Перед запуском
Обратитесь к инструкциям производителя для получения дополнительной информации, относящейся к вашему антителу, такой как идеальный блокирующий буфер и оптимальные концентрации антител. Рассмотрите возможность титрования антител, чтобы определить оптимальную дозу.
Рассмотрите возможность титрования антител, чтобы определить оптимальную дозу.
Вторичные антитела должны соответствовать виду хозяина первичного антитела. Например, используйте вторичные антимышиные антитела для первичных антител, выработанных у мыши.
Процедура
Раздел 1: клетки лизиса
- Центрифуга 5 x 10 6 клетки для 5 мин при 100 x г .
- Аккуратно удалите супернатант.
- Ресуспендируйте клеточный осадок в 1 мл 1X PBS и перенесите в микроцентрифужную пробирку.
- Центрифуга для 5 мин при 100 x г .
- Осторожно удалите супернатант.
- Ресуспендируйте клеточный осадок в соответствующем объеме буфера для холодного лизиса.
*Pro-Tip* Объем лизирующего буфера зависит от размера клеточного осадка, но обычно составляет от 250–1000 мкл .

*Pro-Tip* Идеальный буфер для лизиса зависит от локализации интересующего белка в клетке. Буфер RIPA подходит для большинства белков, но для трудно экстрагируемых белков, таких как белки в ядре, могут потребоваться более строгие буферы и стадия обработки ультразвуком.
- Инкубировать на льду в течение 30 мин .
- Лизат отцентрифугировать на 15 мин при 14 000 x г при 4 °C .
- Перенесите супернатант в чистую микроцентрифужную пробирку.
- Лизат следует использовать немедленно или хранить при температуре -80 °C до готовности к использованию.
Раздел 2. Определение концентрации общего белка и подготовка лизата для SDS-PAGE
- Определите концентрацию белка, используя набор для анализа BCA компании Pierce или другой предпочтительный метод определения белка.

- Приготовьте 50:1 разведение реагента А к реагенту В для анализа ВСА.
- Приготовьте серийные разведения стандарта BSA в диапазоне 0–2000 мкг/мл .
- В двух повторностях разбавьте 10 мкл стандартных, пустых образцов и образцов лизата в 200 мкл реагента BCA в 96-луночном микротитрационном планшете.
- Инкубировать в течение 30 мин при 37 °C .
- Определить поглощение при 590 нм .
- Рассчитайте среднее поглощение дубликатов образцов на пластине.
- Вычтите среднее поглощение бланка из всех образцов.
- Постройте стандартную кривую стандартной концентрации БСА в зависимости от абсорбции.
- Экстраполируйте общую концентрацию белка в образце из стандартной кривой.

- Определите объем образца, необходимый для загрузки эквивалентного количества общего белка для каждого образца.
*Pro-Tip* Идеальная общая загруженность белком зависит от образца и целевого белка, но обычно составляет 10–50 мкг . Если содержание белка в образце низкое, вам потребуется загрузить большее количество общего белка.
- Подготовьте образец к загрузке следующим образом:
- Добавьте 10% об./об. β-меркаптоэтанола к буферу для загрузки белка 4X.
- Разбавьте 4X буфер загрузки белка в образце до 1X .
- Прокипятить образцы для 10 мин при 100 °C .
Раздел 3: SDS-СТРАНИЦА
- Приготовьте сборный гель следующим образом:
- Достаньте гель из пластиковой упаковки.

- Снимите ленту и пластиковую расческу.
- Промойте лунки деионизированной водой 3x .
- Аккуратно встряхивайте гель между мытьями, чтобы удалить остатки воды.
- Загрузите гель в камеру резервуара с гелем SDS-PAGE.
- Закройте зажим.
- Подготовьте рабочий буфер 1X следующим образом:
*Pro-Tip* Различные емкости с гелем SDS-PAGE будут иметь различную ориентацию геля. См. инструкции для вашего конкретного резервуара.
- Разбавьте 25 мл рабочего буфера 20X до 500 мл деионизированной водой. Хорошо перемешать.

Раздел 4: Сухой перенос
- Замачивание геля для 15 мин в 20% этаноле в деионизированной воде.
- Чтобы приготовить 20% этанол, разбавьте 2 мл этанола в 8 мл деионизированной воды и хорошо перемешайте.
- Распечатайте стопку переноса iBlot 2 PVDF Mini.

- Отложите верхнюю стопку в сторону и выбросьте белый разделитель.
- Держите нижний стек в пластиковом лотке.
- Поместите нижний стек на промокательную поверхность.
- Совместите электрические контакты на промокательной поверхности устройства для переноса геля iBlot 2.
- Смочите гель перед запуском в деионизированной воде и поместите его на передающую мембрану нижнего стека.
- Замочите кусок фильтровальной бумаги iBlot в деионизированной воде.
- Поместите предварительно смоченную фильтровальную бумагу iBlot на гель и удалите пузырьки воздуха валиком.
- Поместите Top Stack на предварительно смоченную фильтровальную бумагу.

- Удалите пузырьки воздуха с помощью валика.
- Поместите впитывающую прокладку поверх верхней стопки так, чтобы электрические контакты совпадали с соответствующими электрическими контактами на промокательной поверхности устройства для переноса геля iBlot 2.
- Закройте крышку устройства.
- Выберите нужный метод и убедитесь, что параметры указаны верно.
- Перенос для 5–6 мин для белков <30 кДа.
- Перенос для 8–10 мин для белков >150 кДа.
Раздел 5: Блокировка
- Приготовьте 1X TBST следующим образом:
- 25 мл 20X TBS
- 2,5 мл твин-20
- 472,5 мл деионизированной воды
- Хорошо перемешать
- Разбавьте 5% вес/объем обезжиренного молока в 1X TBST.

- Пример: 5 г обезжиренного молока в 100 мл 1X TBST.
*Pro-Tip* Идеальный блокирующий буфер зависит от антител. Перед проведением эксперимента ознакомьтесь с информацией производителя.
Раздел 6: Инкубация антител
- Разбавьте первичное антитело до желаемой концентрации в блокирующем буфере.
*Pro-Tip* Оптимальная концентрация зависит от антител, но обычно составляет 1–10 мкг/мл.

- Инкубируйте мембрану в течение ночи в первичных антителах при 90 568 4 °C 90 570 на качающейся платформе.
*Pro-Tip* Время инкубации с первичными антителами можно сократить до 2 ч at RT , но может привести к более неспецифическому связыванию.
- Промойте мембрану 3x для 5 мин в 1X TBST при RT на платформе для встряхивания.
- Разбавьте вторичное антитело, конъюгированное с пероксидазой хрена, до нужной концентрации в блокирующем буфере.
*Pro-Tip* Оптимальная концентрация зависит от антител, но обычно составляет 1–10 мкг/мл.
- Инкубируйте мембрану со вторичным антителом в течение 60 мин при RT на платформе для встряхивания.

- Промойте мембрану 3x для 5 мин в 1X TBST при RT на платформе для встряхивания.
- Подготовьте субстрат для хемилюминесценции, смешав реагент A 1:1 с реагентом B.
- Аккуратно инкубируйте мембрану в хемилюминесцентном реагенте в течение 90 568 5 мин 90 570 при 90 568 RT 90 570 .
- Накройте мембрану прозрачным пластиком и используйте гелевый имидж-сканер с обнаружением хемилюминесценции или темную комнату для обнаружения полос.
Советы и способы устранения неполадок
Оптимальный буфер для лизиса зависит от типа образца и локализации интересующего белка в клетке. Возможно, вам придется попробовать различные буферы для лизиса, чтобы найти лучший для вашей цели.

 859мб. PDF )
859мб. PDF ) 529мб. PDF )
529мб. PDF ) 735мб. PDF )
735мб. PDF ) 228мб. PDF )
228мб. PDF ) 374мб. PDF )
374мб. PDF )










