Теплоемкость воздуха: таблица
Теплоемкость как физическая величина показывает количество тепловой энергии, которое необходимо для изменения температуры рабочего тела, в данном случае, воздуха, на один градус. Теплоемкость воздуха непосредственно зависит от температуры и давления. При этом для исследования разных видов теплоемкости могут применяться различные методы.
Математически теплоемкость воздуха выражается как отношение количества тепла к приращению его температуры. Теплоемкость тела, имеющего массу 1 кг, принято называть удельной. Молярная теплоемкость воздуха – теплоемкость одного моля вещества. Обозначается теплоемкость – Дж/К. Молярная теплоемкость соответственно Дж/(моль*К).
Теплоемкость можно считать физической характеристикой какого-либо вещества, в данном случае воздуха, в том случае, если измерение проводится в постоянных условиях. Чаще всего подобные измерения проводятся при постоянном давлении. Так определяется изобарная теплоемкость воздуха. Она возрастает с увеличение температуры и давления, а также является линейной функцией данных величин. В этом случае изменение температуры происходит при постоянном давлении. Для расчета изобарной теплоемкости необходимо определить псевдокритическую температуру и давление. Она определяется с использованием справочных данных.
В этом случае изменение температуры происходит при постоянном давлении. Для расчета изобарной теплоемкости необходимо определить псевдокритическую температуру и давление. Она определяется с использованием справочных данных.
Теплоемкость воздуха. Особенности
Воздух представляет собой газовую смесь. При их рассмотрении в термодинамике приняты следующие допущения. Каждый газ в составе смеси должен быть равномерно распределен по всему объемы. Таким образом, объем газа равен объему всей смеси. Каждый газ в составе смеси обладает своим парциальным давлением, которое он оказывает на стенки сосуда. Каждый из компонентов газовой смеси должен иметь температуру, равную температуре всей смеси. При этом сумма парциальных давлений всех компонентов равняется давлению смеси. Расчет теплоемкости воздуха выполняется на основе данных о составе газовой смеси и теплоемкости отдельных компонентов.
Теплоемкость неоднозначно характеризует вещество. Из первого закона термодинамики можно сделать вывод, что внутренняя энергия тела изменяется не только в зависимости от количества полученного тепла, но и от совершенной телом работы. При различных условиях протекания процесса теплопередачи, работа тела может различаться. Таким образом, одинаковое сообщенное телу количество теплоты, может вызвать различные по значению изменения температуры и внутренней энергии тела. Эта особенность характерна только для газообразных веществ. В отличие от твердых и жидких тел, газообразные вещества, могут сильно изменять объем и совершать работу. Именно поэтому теплоемкость воздуха определяет характер самого термодинамического процесса.
При различных условиях протекания процесса теплопередачи, работа тела может различаться. Таким образом, одинаковое сообщенное телу количество теплоты, может вызвать различные по значению изменения температуры и внутренней энергии тела. Эта особенность характерна только для газообразных веществ. В отличие от твердых и жидких тел, газообразные вещества, могут сильно изменять объем и совершать работу. Именно поэтому теплоемкость воздуха определяет характер самого термодинамического процесса.
Однако при постоянном объеме воздух не совершает работу. Поэтому изменение внутренней энергии пропорционально изменению его температуры. Отношение теплоемкости в процессе с постоянным давлением, к теплоемкости в процессе с постоянным объемом является частью формулы адиабатного процесса. Оно обозначается греческой литерой гамма.
Из истории
Термины «теплоемкость» и «количество теплоты» не очень удачно описывают свою суть. Связано это с тем, что они пришли в современную науку из теории теплорода, которая была популярна в восемнадцатом веке. Последователи этой теории рассматривали теплоту как некое невесомое вещество, которое содержится в телах. Это вещество не может быть ни уничтожено, ни создано. Охлаждение и нагревание тел объясняли уменьшением или увеличением содержания теплорода соответственно. Со временем эта теория была признана несостоятельной. Она не могла объяснить, почему одинаковое изменение внутренней энергии какого-либо тела получается при передаче ему разного количества теплоты, а также зависит от совершаемой телом работы.
Последователи этой теории рассматривали теплоту как некое невесомое вещество, которое содержится в телах. Это вещество не может быть ни уничтожено, ни создано. Охлаждение и нагревание тел объясняли уменьшением или увеличением содержания теплорода соответственно. Со временем эта теория была признана несостоятельной. Она не могла объяснить, почему одинаковое изменение внутренней энергии какого-либо тела получается при передаче ему разного количества теплоты, а также зависит от совершаемой телом работы.
лабораторная работа 209
Лабораторная работа № 209
ОПРЕДЕЛЕНИЕ ОТНОШЕНИЯ ТЕПЛОЕМКОСТЕЙ ВОЗДУХА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ И ПОСТОЯННОМ ОБЪЕМЕ
Цель работы: определить методом Клемана-Дезорма отношение теплоемкостей воздуха при постоянном давлении и постоянном объеме.
Приборы и принадлежности:
стеклянный баллон,
насос Камовского,
U–образный водяной манометр,
соединительные
шланги.
1. ТЕПЛОЕМКОСТЬ ИДЕАЛЬНОГО ГАЗА
В молекулярной физике термодинамическое состояние газа характеризуется параметрами состояния: давлением Р, объемом V, температурой Т
(1)
где R – молярная газовая постоянная, m – масса одного моля газа.
Теплоемкостью вещества называется величина, равная количеству теплоты, которое нужно сообщить веществу, чтобы изменить его температуру на один градус. Математически это определение записывается следующим образом:
где dQ – бесконечно малое
количество теплоты, при сообщении которого изменяется температура вещества на
dT. Теплоемкость вещества
измеряется в Дж/K.
Теплоемкость вещества
измеряется в Дж/K.
На практике часто пользуются понятиями удельной и молярной теплоемкостей вещества. Удельная теплоемкость – теплоемкость единицы массы вещества, т.е. она равна количеству теплоты, которое нужно сообщить единице массы вещества, чтобы изменить его температуру на один градус:
Молярная теплоемкость – теплоемкость одного моля вещества, т.е. она равна количеству теплоты, которое нужно сообщить одному молю вещества, чтобы изменить его температуру на один градус:
где – количество молей вещества (понятие идеального газа и моля вещества см. в лаб. раб. № 201).
Удельная и молярная теплоемкости связаны соотношением
Величина теплоемкости
газа зависит от условий, при которых он нагревается. Выясним эту зависимость,
воспользовавшись уравнением состояния (1) и первым законом термодинамики,
который можно сформулировать следующим образом: количество теплоты dQ, сообщаемое термодинамической системе (в нашем случае воздуху), расходуется на увеличение внутренней
энергии dU и на совершение системой
работы dA против внешних сил. Математическая запись первого закона
термодинамики:
Выясним эту зависимость,
воспользовавшись уравнением состояния (1) и первым законом термодинамики,
который можно сформулировать следующим образом: количество теплоты dQ, сообщаемое термодинамической системе (в нашем случае воздуху), расходуется на увеличение внутренней
энергии dU и на совершение системой
работы dA против внешних сил. Математическая запись первого закона
термодинамики:
(2)
где dU – бесконечно малое изменение внутренней энергии системы; dQ, dA – соответственно, бесконечно малая теплота, подводимая к системе и элементарная работа.
Тогда теплоемкость вещества равна
(3)
Из уравнения (3) видно, что теплоемкость имеет
различные значения в зависимости от способа нагревания газа, т. к. одному и
тому же значению dT могут
соответствовать различные значения dU и dA. Элементарная работа в
газовом процессе равна
к. одному и
тому же значению dT могут
соответствовать различные значения dU и dA. Элементарная работа в
газовом процессе равна
(4)
Рассмотрим основные процессы, протекающие в идеальном газе при изменении температуры, когда количество вещества остается неизменным.
Если нагревание производится при постоянном объеме, то газ не совершает работы над внешними телами и, следовательно, вся теплота идет на приращение внутренней энергии газа:
при .
Тогда молярная теплоемкость газа при постоянном объеме равна:
(5)
Если нагревание происходит при постоянном давлении, то теплота, сообщаемая газу, идет и на изменение внутренней энергии газа и на совершение газом работы против внешних сил:
при
В этом случае молярная теплоемкость газа при постоянном давлении равна:
(6)
Дифференцируя уравнение (1), получим:
(7)
но если Р = const, тогда
(8)
С учетом (8), (4) и (5) уравнение (6) запишется:
(9)
Из формулы (9) следует, что СР > CV на величину R, которая равна работе,
совершаемой молем идеального газа при повышении его температуры на один
градус при постоянном давлении.
Необходимо отметить, что соотношение (9) справедливо только для идеального газа. Отношение теплоемкостей
(10)
представляет собой характерную для каждого газа величину, которая называется постоянной адиабаты.
2. УРАВНЕНИЕ АДИАБАТЫ ИДЕАЛЬНОГО ГАЗА
Процесс, протекающий в термодинамической системе без теплообмена с внешней средой, называется адиабатическим. Первый закон термодинамики для идеального газа в этом случае будет иметь вид:
т.к. dQ = 0 или, используя (2) и (5), запишем
(11)
Разделив уравнение (7) на (11) и учитывая формулу (9), получим:
или
(12)
где Интегрируя и потенцируя формулу (12), получим уравнение адиабаты идеального газа в переменных Р и V:
(13)
Полученное выражение есть
уравнение газового состояния при адиабатическом процессе, называемое также уравнением Пуассона.
3. ВНУТРЕННЯЯ ЭНЕРГИЯ И ЧИСЛО СТЕПЕНЕЙ СВОБОДЫ
МОЛЕКУЛ ИДЕАЛЬНОГО ГАЗА
Из молекулярно-кинетической теории идеального газа следует, что средняя кинетическая энергия молекулы равна
где k – постоянная Больцмана, Т – термодинамическая температура, i – число степеней свободы молекулы газа.
Числом степеней свободы i называют наименьшее
число независимых координат, с помощью которых можно однозначно определить
положение тела в пространстве. Силы, ограничивающие движение тела, называются связями. Если тело движется без
связей, то такое движение тела называется свободным.
Так, свободное положение в пространстве материальной точки полностью
определяется заданием значений трех ее координат (например, х, y, z – в декартовой системе
координат). В соответствии с этим материальная точка имеет три степени
свободы ( i = 3). Если эта точка
движется по некоторой поверхности, то она обладает двумя степенями свободы.
В соответствии с этим материальная точка имеет три степени
свободы ( i = 3). Если эта точка
движется по некоторой поверхности, то она обладает двумя степенями свободы.
Абсолютно твердое тело
имеет шесть степеней свободы (i = 6). Для определения его
положения в пространстве нужно задать три координаты его центра масс (х,y,z), два угла (например, q и
j), указывающих
направление какой-либо оси, проходящей через центр масс тела и, наконец, угол
y, определяющий направление
второй, связанной с телом оси, перпендикулярной к первой. Степени свободы х, y, z называются поступательными. Изменение любого из
углов q, j, y при неизменном положении центра масс
обуславливается вращением тела, в связи с чем, соответствующие степени
свободы называются вращательными.
Следовательно, из шести степеней свободы абсолютно твердого тела три являются
поступательными и три – вращательными.
Молекулу одноатомного газа можно рассматривать как материальную точку, поэтому число степеней свободы одноатомной молекулы равно трем. Молекулы, состоящие из двух, трех и большего числа атомов не могут быть уподоблены материальным точкам. «Жесткая» молекула двухатомного газа в первом приближении представляет собой два жестко связанных атома, находящихся на некотором расстоянии друг от друга (см. рис. 1а).
Такая молекула напоминает
гимнастическую гантель с невесомой ручкой, обладающую тремя степенями свободы
поступательного движения относительно осей х, y, z,
и двумя степенями свободы вращательного движения вокруг осей х и z. Вращение вокруг третьей
оси y рассматривать не нужно,
т.к. момент инерции атомов относительно этой оси ничтожно мал, а,
следовательно, ничтожно мала и кинетическая энергия молекулы, связанная с
этим вращением.
Трехатомные и более сложные молекулы подобно абсолютно твердому телу обладают тремя степенями свободы поступательного движения и тремя степенями свободы вращательного движения (рис. 1b).
Если атомы в молекуле совершают еще и колебания, то кроме кинетической энергии необходимо учитывать потенциальную энергию взаимодействия этих атомов, и как показывает опыт, средняя потенциальная энергия атомов равна их средней кинетической энергии. Тогда полную энергию, приходящуюся на одну колебательную степень свободы, можно считать равной удвоенной ее кинетической энергии. Поэтому при учете колебательных степеней свободы необходимо энергию молекулы увеличивать на величину kT, а число i соответственно на два. В случае молекулы, состоящей из N-атомов, число степеней свободы равно
При этом iпост = 3.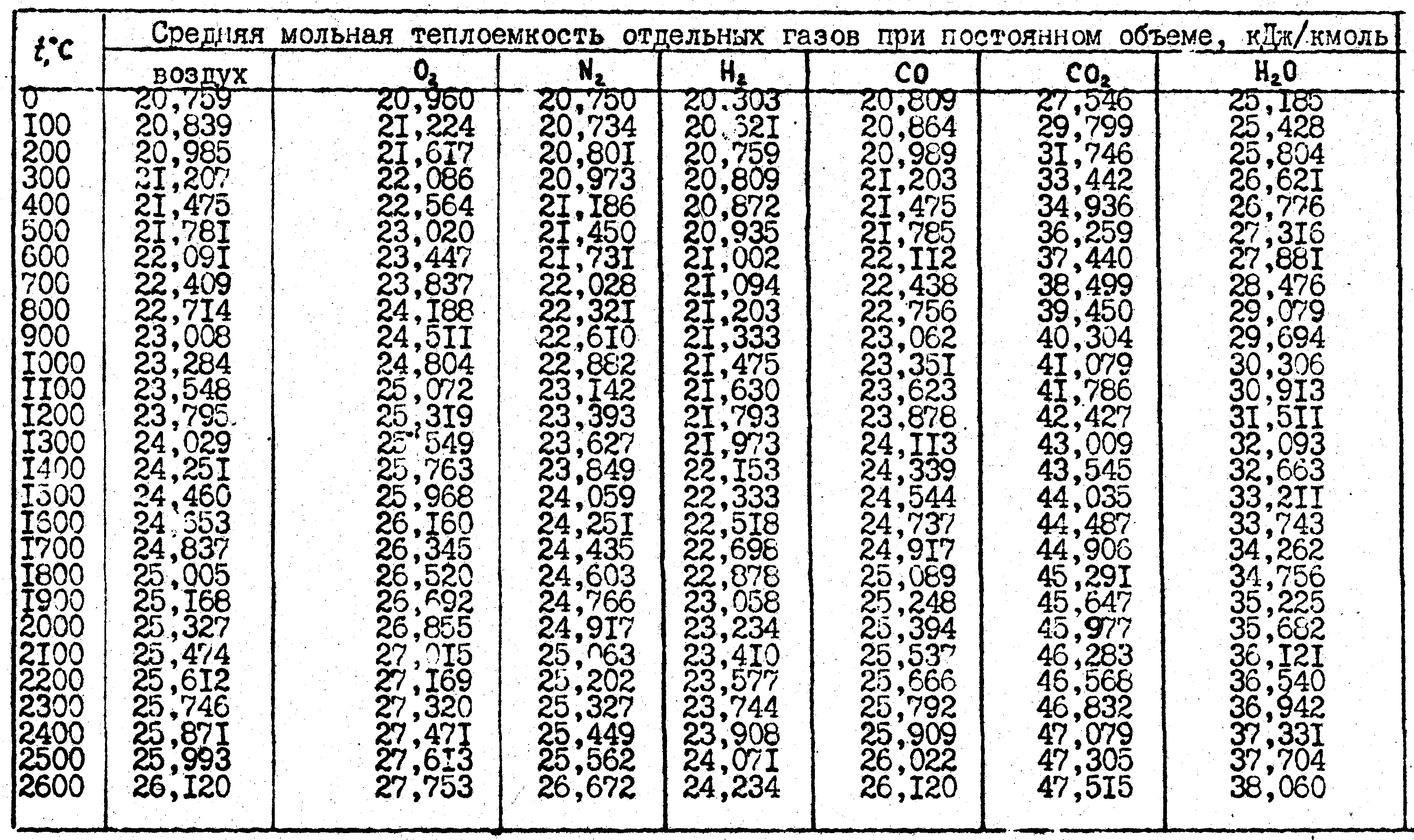 Для линейной молекулы iвращ = 2, iкол = 3N –
5. Для всех других молекул iвращ = 3, iкол = 3N –
6.
Для линейной молекулы iвращ = 2, iкол = 3N –
5. Для всех других молекул iвращ = 3, iкол = 3N –
6.
Так как молекулы идеального газа не взаимодействуют между собой, то внутреннюю энергию идеального газа массы m можно найти, умножив среднюю кинетическую энергию одной молекулы на число молекул:
т.к. где NA – число Авогадро, а R = kNA.
Сравнение этого выражения с формулой (5) дает, что молярная теплоемкость идеального газа при постоянном объеме равна:
Приняв во внимание формулу (9), найдем молярную теплоемкость идеального газа при постоянном давлении:
Т. о., постоянная адиабаты для идеального газа
выражается формулой:
о., постоянная адиабаты для идеального газа
выражается формулой:
(14)
Соотношение (14) позволяет по значению g оценить число степеней свободы молекул газа.
4. ОПИСАНИЕ РАБОЧЕЙ УСТАНОВКИ И
МЕТОДА ИЗМЕРЕНИЙ
Величину g, т.е. отношение теплоемкости
СP газа при постоянном
давлении к его теплоемкости СV при постоянном объеме
можно определить с помощью прибора Клемана-Дезорма, состоящего из стеклянного
баллона 1; крана 2, позволяющего изолировать или
сообщать баллон с атмосферой; крана 3, разобщающего баллон и насос;
насоса 4, служащего для создания в баллоне избыточного давления; U-образного водяного
манометра 5, служащего для регистрации разности между давлением воздуха
в баллоне и атмосферным давлением.
Рис. 2.
В роли крана 2 используется пробка, перекрывающая отверстие в крышке баллона.
Закрывают плотно пробку 2 и открывают кран 3. Небольшими порциями с помощью насоса 4 накачивают воздух в баллон до некоторого давления. Затем с помощью крана 3 разобщают баллон с насосом. Если повышение давления было произведено достаточно быстро, манометрический столбик жидкости не сразу займет окончательное положение, т.к. сжатие воздуха было близким к адиабатическому, и, следовательно, температура его повысилась. Окончательная разность уровней в манометре (h) установится только тогда, когда температура воздуха внутри сосуда сравняется благодаря теплопроводности стенок с температурой окружающего воздуха.
Обозначим через Т1 абсолютную температуру окружающего воздуха и через Р1 – давление газа внутри сосуда, тогда после накачки воздуха
(15)
где – избыточное
давление воздуха в баллоне над внешним – атмосферным Р0, обусловленное накачкой
воздуха.
Пусть параметры Т1, V1 и Р1 характеризуют состояние газа, которое будем называть первым состоянием (состояние 1, см. рис. 3). Здесь V1 – объем той массы m воздуха, которая при любых протекающих в баллоне процессах остается постоянной.
Газовые законы обычно применяются для расчетов изменений, происходящих с газом, масса которого остается постоянной. В нашем же случае часть воздуха выходит из баллона при сообщении его с атмосферой. Поэтому все дальнейшие рассуждения относятся не ко всему воздуху в баллоне, а лишь к той его части, которая все время присутствует в баллоне и остается в нем после его разобщения с атмосферой в точке 3 (рис. 3). Остальная часть воздуха может рассматриваться как поршень, который выдвигается из баллона при расширении.
Если теперь быстро
открыть пробку 2, то воздух в сосуде будет расширяться адиабатически, пока
давление его не сделается равным атмосферному Р0; при этом он охладится до температуры Т2. Это будет второе
состояние газа (состояние 2).
Это будет второе
состояние газа (состояние 2).
Изменение состояния газа графически можно изобразить адиабатой (1 ® 2). Для данной массы газа m согласно уравнению Пуассона (13) можно записать соотношение
(16)
Если сразу после открывания снова закрыть пробку 2, то давление внутри сосуда начнет возрастать от Р0 до Р2 вследствие того, что охладившийся при расширении воздух в сосуде станет снова нагреваться. Возрастание давления, которое происходит при постоянном объеме, прекратится, когда температура воздуха в сосуде сравняется с температурой окружающей среды (Т3 = Т1). Получим третье состояние газа (состояние 3).
Обозначим давление
воздуха в сосуде в этот момент через Р2
и соответствующее избыточное давление, которое установилось в сосуде при
нагревании воздуха от температуры Т2
до комнатной температуры Т1
через . Тогда
Тогда
(17)
Начальное 1 и конечное 3 состояния газа массы m наблюдаются при одинаковой температуре (Т3 = Т1), т.е. кривая 1-3 является изотермой. Поэтому на основании закона Бойля-Мариотта можно записать:
(18)
Возведя обе части уравнения (18) в степень g, получим
(19)
После того как уравнение (19) разделим на уравнение (16) и результат прологарифмируем, путем простых преобразований получим:
(20)
Поскольку и малы по сравнению с атмосферным давлением , то
и
можно разложить в ряд Тейлора по малым параметрам, ограничившись двумя первыми членами:
(21)
Подставляя (21) в (20), получим
(22)
Избыточное давление, определяемое по манометру, можно выразить соотношением
где h
– разность уровней жидкости в манометре, a – постоянный для данного
манометра коэффициент, зависящий от плотности жидкости и от площади сечения
трубок манометра. Тогда можно записать, что
Тогда можно записать, что
а
Подставив значения и в (22), получим формулу, удобную для расчета постоянной адиабаты
(23)
5. ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ И ОБРАБОТКА
РЕЗУЛЬТАТОВ ИЗМЕРЕНИЙ
Перед тем как выполнять работу, проверьте, чтобы уровень воды в трубках U-образного манометра при открытой пробке 2 находился на половине высоты манометра. Если воды мало, долейте, попросив мерный стакан у лаборанта.
1. Пробкой 2 перекрыть отверстие в крышке баллона и открыть кран 3, соединяющий баллон с насосом 4.
2. Вращая рукоятку насоса, осторожно накачивают воздух в баллон так,
чтобы разность уровней жидкости в трубках U-образного манометра составила 25 – 30 см.
Вращая рукоятку насоса, осторожно накачивают воздух в баллон так,
чтобы разность уровней жидкости в трубках U-образного манометра составила 25 – 30 см.
3. Закрыть кран 3, разобщающий баллон и насос. Подождать 2-3 мин. пока жидкость не перестанет перетекать из одной трубки манометра в другую. При накачивании сжатый воздух в баллоне нагревается, поэтому необходимо выждать некоторое время, пока благодаря теплообмену температура в баллоне не станет равной комнатной. По шкале манометра измерьте установившуюся в конце изохорного охлаждения (состояние 1, см. рис. 3) разность уровней жидкости в обоих коленах манометра h1.
4.
На 2-3 секунды вынимают
пробку 2 в крышке баллона и выпускают из него часть воздуха. В
первые доли секунды происходит адиабатическое расширение газа (переход 1®2). Пробку быстро ставят
на место, плотно закрывая баллон. Выждав 1-2 мин. пока газ, охлажденный при
адиабатическом расширении, нагреется до комнатной температуры, измеряют
разность уровней жидкости в коленах манометра h2 в конце изохорного нагревания (состояние 3, см.
рис. 3).
Пробку быстро ставят
на место, плотно закрывая баллон. Выждав 1-2 мин. пока газ, охлажденный при
адиабатическом расширении, нагреется до комнатной температуры, измеряют
разность уровней жидкости в коленах манометра h2 в конце изохорного нагревания (состояние 3, см.
рис. 3).
5. По формуле (23) вычисляют значение g.
6. Опыт повторяют 8 – 10 раз, причем для каждого опыта рассчитывают свое значение g, затем находят среднее арифметическое значение искомой величины по формуле:
где N – число измерений.
7. Вычисляют абсолютную Dg и относительную Е погрешности результата, исходя из истинного значения искомой величины:
и
Данные результатов
измерений и вычислений занесите в таблицу.
Таблица результатов
|
№ опыта |
h1 |
h2 |
g |
|
gтеор. |
Dg |
Е |
|
|
м |
м |
|
|
|
|
% |
|
|
|
|
|
|
1,4 |
|
|
6. ВОПРОСЫ ДЛЯ ДОПУСКА К РАБОТЕ
ВОПРОСЫ ДЛЯ ДОПУСКА К РАБОТЕ
- Какова цель работы?
- Опишите устройство рабочей установки и ход эксперимента.
3. Какой процесс называется адиабатическим? Какие условия соответствуют осуществлению адиабатического процесса на данной установке?
7. ВОПРОСЫ ДЛЯ ЗАЩИТЫ РАБОТЫ
1. Что называют удельной теплоемкостью вещества? Молярной теплоемкостью? Какая связь между ними?
2. Сформулируйте первый закон термодинамики.
3. Чему равны молярные теплоемкости идеальных газов при изопроцессах?
4. Докажите, что СР > CV.
5. Получите уравнение Пуассона для адиабатического процесса.
6. Что называется числом степеней свободы?
7. Запишите выражение для внутренней энергии идеального газа и поясните
его.
Запишите выражение для внутренней энергии идеального газа и поясните
его.
8. Используя уравнение Пуассона, выведите рабочую формулу для расчета постоянной адиабаты g.
9. Из каких процессов состоит рабочий цикл, осуществляемый на данной установке при выполнении работы? Начертите график цикла.
Удельная теплоемкость газов
Удельная теплоемкость газовУдельная теплоемкость газов обычно выражается в молярной удельной нагревает. Для одноатомного идеального газа вся внутренняя энергия выражается в форме кинетической энергии, и кинетическая теория дает выражение для этой энергии, связанное с кинетической температурой. Выражение для внутренней энергии равно . Для газов определены две удельные теплоемкости, одна для постоянного объема ( С В ) и
один для постоянного давления ( C P ).
Дальнейшее применение закона идеального газа и первого закона дает соотношение
Отношение удельных теплоемкостей γ = C P /C V является фактором адиабатических процессов двигателя и определения скорости звука в газе. Это отношение γ = 1,66 для идеального одноатомного газа и γ = 1,4 для воздуха, который является преимущественно двухатомным газом. | Индекс Концепции газового закона Концепции кинетической теории | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
 Для процесса постоянного объема с одноатомным идеальным газом первый закон термодинамики дает:
Для процесса постоянного объема с одноатомным идеальным газом первый закон термодинамики дает:
 Можно ожидать, что это даст C V = 5/2 R, что подтверждается примерами, подобными азоту и кислороду. Нелинейная многоатомная молекула сможет вращаться вокруг трех перпендикулярных осей, что, как ожидается, даст
С В = 3R. Наблюдаемое отклонение от этого значения указывает на необходимость учета колебательных степеней свободы для полного описания удельных теплоемкостей газов.
Можно ожидать, что это даст C V = 5/2 R, что подтверждается примерами, подобными азоту и кислороду. Нелинейная многоатомная молекула сможет вращаться вокруг трех перпендикулярных осей, что, как ожидается, даст
С В = 3R. Наблюдаемое отклонение от этого значения указывает на необходимость учета колебательных степеней свободы для полного описания удельных теплоемкостей газов. Отход от этой модели в случае нелинейных многоатомных молекул свидетельствует о колебательном участии.
Отход от этой модели в случае нелинейных многоатомных молекул свидетельствует о колебательном участии. Потребовалось развитие квантовой теории, чтобы показать, что двухатомный водород с его крошечной инерцией вращения требует большого количества энергии для возбуждения своего первого квантового состояния возбужденного молекулярного вращения. Поскольку он не мог получить такое количество энергии при низких температурах, он вел себя как одноатомный газ.
Потребовалось развитие квантовой теории, чтобы показать, что двухатомный водород с его крошечной инерцией вращения требует большого количества энергии для возбуждения своего первого квантового состояния возбужденного молекулярного вращения. Поскольку он не мог получить такое количество энергии при низких температурах, он вел себя как одноатомный газ. Мы делаем это в этом разделе. Сначала мы исследуем процесс, в котором система имеет постоянный объем, затем сопоставляем его с системой при постоянном давлении и показываем, как связаны их удельные теплоемкости.
Мы делаем это в этом разделе. Сначала мы исследуем процесс, в котором система имеет постоянный объем, затем сопоставляем его с системой при постоянном давлении и показываем, как связаны их удельные теплоемкости.
 Кроме того, поскольку идеальный газ расширяется против постоянного давления,
Кроме того, поскольку идеальный газ расширяется против постоянного давления,
 6: Теплоемкость идеального газа распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.
6: Теплоемкость идеального газа распространяется под лицензией CC BY 4.0 и была создана, изменена и/или курирована OpenStax посредством исходного контента, который был отредактирован в соответствии со стилем и стандартами платформы LibreTexts; подробная история редактирования доступна по запросу.