Метод – кристаллизация – Большая Энциклопедия Нефти и Газа, статья, страница 2
Cтраница 2
Метод Кристаллизации из раствора в расплаве охватывает системы, в которых примесь составляет не менее 6 % основного состава кристаллизуемого вещества, и позволяет проводить кристаллизацию в более низкотемпературной области. Сложный химический состав и присутствие в исходных компонентах слюдяной шихты, особенно в природном калиевом полевом шпате, многочисленных примесей делает благоприятным использование особенностей метода кристаллизации из раствора-расплава. Явления расслаивания и улетучивания компонентов во фторсиликатном расплаве, а также накопление легкоплавких фторидов к концу кристаллизации приводят к выделению кристаллов слюды в значительном интервале температур, что характерно для растворов-расплавов. [16]
Метод кристаллизации основан на том, что при понижении температуры растворимость твердого вещества в каком-либо растворителе или смеси растворителей уменьшается.
Метод кристаллизации под давлением, разработанный А. А. Бочваром и А. Г. Спасским [53, 54], основан на том, что при повышенном давлении ( 0 4 – 0 5 МН / м2), создаваемом над кристаллизующимся в литейной форме расплавом, в растворенном состоянии может остаться больше газов, чем при атмосферном давлении. [18]
Метод кристаллизации применяется для выделения из смесей определенного компонента или группы компонентов, имеющих наиболее высокие температуры плавления. [19]
Метод кристаллизации применяется для выделения из нефтяных фракций индивидуальных углеводородов или групп углеводородов ( например, нормальных алканов), имеющих наиболее высокие температуры кристаллизации. Температура кристаллизации зависит от размеров молекул и, в еще большей степени, от симметрии молекул углеводородов.
Метод кристаллизации белков основан на достижении критической точки начала осаждения белка из раствора сульфата аммония при медленном повышении температуры. Однако не всякий кристаллический белок является гомогенным, поскольку при одной и той же концентрации раствора сульфата аммония могут кристаллизоваться близкие по размерам и массе разные белки. [21]
Методом кристаллизации возможно извлечение из растворов, оставшихся после электролиза меди, / до 85 % растворенного в них цинка. [22]
| Распределение радия после осаждения бромида. [23] |
Этот метод кристаллизации был исследован следующим образом. Растворы нитрата бария, пересыщенные до различных степеней при 0 С и содержавшие индикаторные количества радия, энергично перемешивались в течение нескольких минут; за это время кристаллизация проходила полностью. [24]
Этот метод кристаллизации основан на образовании пересыщенных растворов путем добавления веществ, понижающих растворимость кристаллизанта.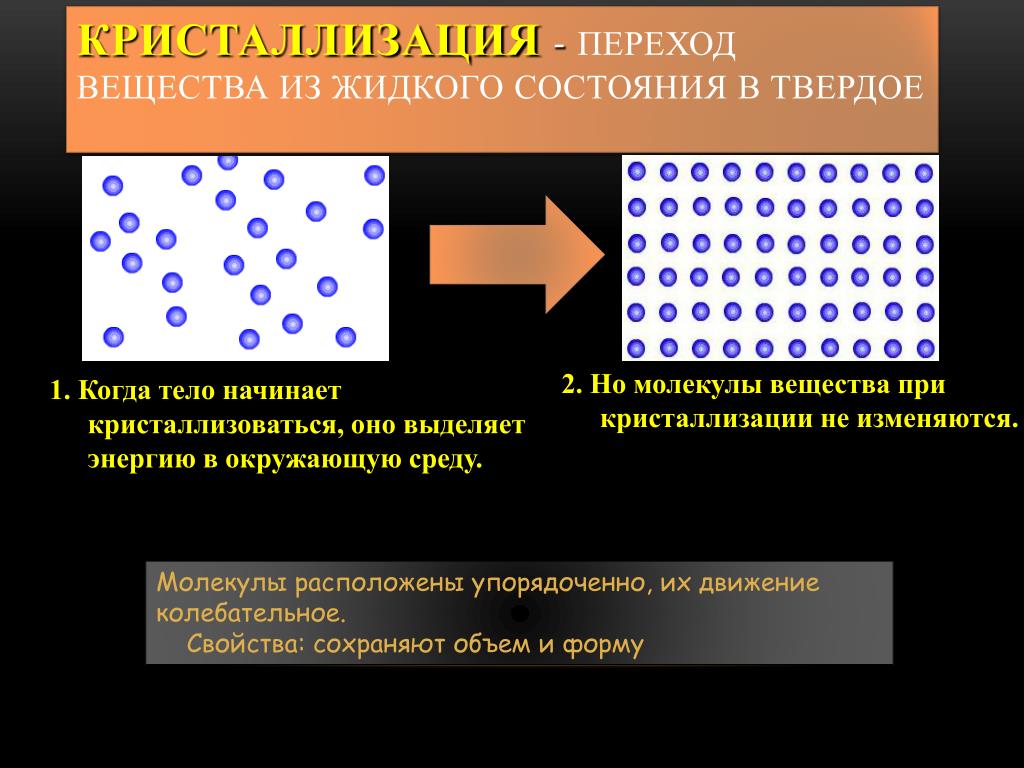 [25]
[25]
Этот метод кристаллизации применяется для веществ, растворимость которых резко уменьшается с понижением температуры. [26]
Вообще метод кристаллизации в движении получает все большее распространение в химич. [27]
Этот метод кристаллизации широко используется для выделения растворенных веществ из различных водных растворов. Его проводят в двух вариантах. [28]
Использован метод комплексной кристаллизации с разработкой технологии всех операций. Структурное совершенство полученных слитков CdSnAs2 контролировали. Измерены электрические свойства кристаллов. [29]
Вариант метода кристаллизации, использованный Пастером в его классической работе по разделению о, L-ВИННОЙ кислоты, ограничен очень небольшим числом случаев. Возможность его применения связана с образованием индивидуальных кристаллов каждого энантиомера. Так, если кристаллизацию смешанной натрий-аммониевой соли винной кислоты проводить ниже 27 С, то вместо обычной рацемической соли образуется смесь кристаллов о – и ь-солей. [30]
[30]
Страницы: 1 2 3 4
Перекристаллизация
- Подробности
- Опубликовано 14 Сентябрь 2013
- Автор: Administrator
Перекристаллизация – один из самых эффективных методов очистки твердых соединений. Этот метод основан на различной растворимости химических соединений в горячем и холодном растворителе (изогидрическая кристаллизация) или на изменении концентрации раствора (изотермическая кристаллизация).
Растворимость большинства органических соединений существенно зависит от температуры растворителя: с увеличение температуры – увеличивается растворимость. В итоге в горячем растворителе удается растворить большее количества вещества, чем может содержать тот же самый растворитель при низкой температуре. И, при охлаждении, из насыщенного при высокой температуре раствора выпадает “лишнее” вещество.
Вещества различные по структуре (особенно, полярности) имеют различную растворимость в растворителях (см. Как выбрать растворитель для кристаллизации). Поэтому, в большинстве случаев, удается получать насыщенный раствор лишь по одному компоненту – как следствие именно этот компонент и выделяется при кристаллизации, а другие – остаются в растворенном виде.
Как выбрать растворитель для кристаллизации). Поэтому, в большинстве случаев, удается получать насыщенный раствор лишь по одному компоненту – как следствие именно этот компонент и выделяется при кристаллизации, а другие – остаются в растворенном виде.
Процесс кристаллизации идет на “зародышах” кристаллов (микротрещины посуды, пылинки и т.п.) и при достаточно медленной скорости процесса (см. Быстрая или медленная кристаллизация, Техники выращивания монокристалла для РСА) приводит к монокристаллам индивидуального соединения, характеризующегося особым физическим свойством – Температурой плавления.
Температура плавления – диапазон температуры от начала до полного расплавления вещества при нагревании. Измерение температуры плавления вещества, строение которого уже было ранее установлено, может быть использована для однозначного подтверждения его структуры:
-
Измерить температуру плавления соединения (см.

-
Сравнить полученное значение со значением в справочной литературе для этого соединения (методика реакции, спецификация на упаковке, базы данных, например, Beilstein database).
Химики наиболее часто используют следующие типы перекристаллизации:
-
Перекристаллизация из одного растворителя
-
Перекристаллизация из смеси растворителей
-
Выпаривание части растворителя
-
Высаливание
-
Осаждение
-
Использование аппарата Сокслета (страница в разработке)
-
Особое место занимают Техники выращивания монокристалла для рентгеноструктурного анализа (РСА).
Часто, даже при правильно проведенной перекристаллизации (см. Видеоурок Перекристаллизация) кристаллы не выпадают.
По применению — МЕТТЛЕР ТОЛЕДО
Лабораторное взвешивание
Измерение плотности с помощью лабораторных весов, подготовка проб для титрования, тестирование выбросов — гравиметрическое определение твердых частиц, определение нелетучих остатков — гравиметрическое определение содержания NVR, определение содержания влаги, остатка пестицидов Тестирование – подготовка точных стандартов, разработка рецептур и производство точных рецептур, элементный анализ CHNSO – подготовка проб, анализ следовых количеств металлов: подготовка проб и стандартов, подготовка буферов – решения, расчет и решение общих проблем, подготовка культуральных сред, статистический контроль качества в лабораториях, Автоматическое дозирование растворителя, Автоматическое дозирование порошка, Заполнение капсул, Высокопроизводительные эксперименты (HTE) — роботизированная подготовка проб, хроматографический анализ — подготовка проб и стандартов, ситовой анализ
Лабораторные аналитические приложения
Приложения для термического анализа, определения температуры плавления и каплепадения, титрования, измерения pH, определения содержания влаги, измерения плотности, определения показателя преломления, УФ/видимого излучения
Приложения AutoChem
Химический синтез, кристаллизация и осаждение, разработка и масштабирование химических процессов, безопасность химических процессов, технологическая аналитическая технология (PAT), распределение частиц по размерам, размер частиц в рецептурах, параллельный синтез, ферментация и биотехнология, проточная химия, рамановская спектроскопия, FTIR-спектроскопия
Приложения для анализа технологических процессов
Биотехнологические и гигиенические процессы, химические процессы, анализ технологических и складских газов, очистка воды (Thornton), применение сточных вод, производство перчаток
Промышленные приложения для взвешивания
Дозирование, составление рецептуры, взвешивание в опасных зонах, взвешивание в движении, контрольное взвешивание с превышением/недостатком, простое взвешивание, статистический процесс и контроль качества, валидация, весоизмерительная ячейка/бункер, взвешивание в бункерах и емкостях, взвешивание во влажных зонах, почтовые приложения, покраска – Смесительные весы, Автоматическое определение веса, Перевалка сыпучих материалов, Контроль качества в процессе производства, Калибровка приборов/расходомеров, Высокоточное взвешиваниеПриложения для транспорта и логистики
Взвешивание грузовых автомобилей, взвешивание на железнодорожном транспорте, планирование упаковки и загрузки, складские весы, возврат доходов, отгрузка и декларирование, сортировка и отслеживание Проверка качества содержимого и упаковки, отслеживание и сериализация, статистический процесс и контроль качества, приложения для проверки этикеток
Розничная торговля
Свежие продукты, прилавок со свежими продуктами, подсобное помещение, пекарня, касса, специальность
Кристаллизация: определение, процесс, использование, примеры
Определение кристаллизации
Кристаллизация – это естественный процесс, происходящий при затвердевании материалов из жидкости , или когда они осаждаются из жидкости или газа. Это может быть вызвано физическими изменениями, такими как изменение температуры, или химическими изменениями, такими как изменение кислотности. Кристаллизация — это процесс, определяемый размером и формой вовлеченных молекул, а также их химическими свойствами. Кристаллы могут быть образованы из одного вида атомов, разных видов ионов или даже больших молекул, таких как белки. Некоторым крупным молекулам сложнее пройти процесс кристаллизации, потому что их внутренняя химия не очень симметрична или взаимодействует сама с собой, чтобы избежать кристаллизации.
Это может быть вызвано физическими изменениями, такими как изменение температуры, или химическими изменениями, такими как изменение кислотности. Кристаллизация — это процесс, определяемый размером и формой вовлеченных молекул, а также их химическими свойствами. Кристаллы могут быть образованы из одного вида атомов, разных видов ионов или даже больших молекул, таких как белки. Некоторым крупным молекулам сложнее пройти процесс кристаллизации, потому что их внутренняя химия не очень симметрична или взаимодействует сама с собой, чтобы избежать кристаллизации.
Наименьшая единица кристалла называется элементарной ячейкой . Это базовое образование атомов или молекул, к которым могут присоединяться дополнительные единицы. Вы можете думать об этом как о детском строительном блоке, к которому можно прикрепить другие блоки. Кристаллизация происходит так, как если бы вы прикрепляли эти блоки во всех направлениях. Некоторые материалы образуют кристаллы различной формы, что объясняет большие различия в форме, размере и цвете различных кристаллов.
Процесс кристаллизации
Зародышеобразование
Первым этапом процесса кристаллизации является зародышеобразование . Первые атомы в массе, сформировавшие кристаллическую структуру, становятся центром, и вокруг этого ядра организуется больше атомов . Когда это происходит, вокруг ядра собирается больше элементарных ячеек, формируется небольшой затравочный кристалл . Процесс зародышеобразования чрезвычайно важен при кристаллизации, так как ядро кристалла будет определять структуру всего кристалла. Несовершенства ядра и затравочного кристалла могут привести к радикальным перестройкам по мере того, как кристалл продолжает формироваться. Нуклеация происходит в переохлажденная жидкость или пересыщенный растворитель .
Переохлажденная жидкость — это любая жидкость, которая находится на грани перехода в твердое состояние. Для того, чтобы это произошло, должно сформироваться начальное ядро. Именно вокруг этого ядра будет продолжаться процесс кристаллизации. В охлаждающей жидкости ядро образуется, когда атомы или молекулы больше не имеют кинетической энергии, чтобы отскакивать друг от друга. Вместо этого они начинают взаимодействовать друг с другом и образуют устойчивые кристаллические образования. Чистые элементы обычно образуют кристаллическую структуру, в то время как более крупные молекулы могут с трудом кристаллизоваться при нормальных температурах и давлениях.
В охлаждающей жидкости ядро образуется, когда атомы или молекулы больше не имеют кинетической энергии, чтобы отскакивать друг от друга. Вместо этого они начинают взаимодействовать друг с другом и образуют устойчивые кристаллические образования. Чистые элементы обычно образуют кристаллическую структуру, в то время как более крупные молекулы могут с трудом кристаллизоваться при нормальных температурах и давлениях.
В перенасыщенном растворе растворитель, содержащий желаемый кристалл, находится на пределе. По мере понижения температуры или изменения кислотности изменяется растворимость атомов или молекул в растворе, и растворитель может удерживать меньшее их количество. В таком виде они «выпадают» из раствора, сталкиваясь друг с другом. Это также вызывает зародышеобразование и последующую кристаллизацию.
Рост кристаллов
Поскольку другие молекулы и атомы окружают ядро, они ответвляются от уже установленной симметрии, добавляя к затравочному кристаллу. Этот процесс может происходить очень быстро или очень медленно, в зависимости от условий. Вода может кристаллизоваться в лед за считанные минуты, в то время как для формирования «типичных» геологических кристаллов, таких как кварц и алмазы, требуются тысячелетия. Основное образование, образующееся вокруг ядра, определяет всю кристаллическую структуру. Эта разница в формировании объясняет различия в кристаллах, от уникальности снежинки до чистоты алмаза.
Вода может кристаллизоваться в лед за считанные минуты, в то время как для формирования «типичных» геологических кристаллов, таких как кварц и алмазы, требуются тысячелетия. Основное образование, образующееся вокруг ядра, определяет всю кристаллическую структуру. Эта разница в формировании объясняет различия в кристаллах, от уникальности снежинки до чистоты алмаза.
Кристаллы могут принимать лишь несколько геометрических форм. Они определяются связями и взаимодействиями вовлеченных молекул. Различные формы вызваны разными углами связи атомов, основанными на исходном ядре. Примеси в растворе или материале приведут к отклонению от типичного рисунка. Как видно из снежинок, даже крошечные примеси в ядре приводят к совершенно новым и уникальным узорам.
Лабораторное использование кристаллизации
Кристаллизация — распространенный и полезный лабораторный метод. Его можно использовать для очистки веществ и в сочетании с передовыми методами визуализации, чтобы понять природу кристаллизующихся веществ. При лабораторной кристаллизации вещество можно растворить в соответствующем растворителе. Тепло и изменения кислотности могут способствовать растворению материала. Когда эти условия меняются местами, материалы в растворе выпадают в осадок с разной скоростью. Если условия контролируются должным образом, можно получить чистые кристаллы желаемого вещества.
При лабораторной кристаллизации вещество можно растворить в соответствующем растворителе. Тепло и изменения кислотности могут способствовать растворению материала. Когда эти условия меняются местами, материалы в растворе выпадают в осадок с разной скоростью. Если условия контролируются должным образом, можно получить чистые кристаллы желаемого вещества.
Усовершенствованный метод визуализации, называемый кристаллографией , рентгеновские лучи или другие высокоэнергетические лучи и частицы могут проходить сквозь кристаллическую структуру чистого вещества. Хотя это не создает видимого изображения, лучи и частицы преломляются в определенных узорах. Эти закономерности можно обнаружить с помощью специальной проявляющей бумаги или электронных детекторов. Затем узор можно проанализировать с помощью математики и компьютеров, и можно сформировать модель кристалла. Дифракционные картины создаются, когда частицы или лучи перенаправляются плотными электронными облаками внутри кристаллической структуры. Эти плотные области представляют собой атомы и связи, присутствующие в кристалле, образовавшиеся во время кристаллизации. С помощью этого метода ученые могут распознать практически любое вещество по его кристаллической форме.
Эти плотные области представляют собой атомы и связи, присутствующие в кристалле, образовавшиеся во время кристаллизации. С помощью этого метода ученые могут распознать практически любое вещество по его кристаллической форме.
Примеры кристаллизации
Человеческая шкала времени
Для образования кристаллов может потребоваться огромное количество времени или они могут образоваться быстро. Ученым удалось изучить кристаллизацию, потому что в природе существует множество явлений, при которых кристаллизация происходит быстро. Как уже говорилось, лед и снежинки — прекрасные примеры кристаллизации воды. Еще один интересный пример — кристаллизация меда. Когда пчелы отрыгивают мед в соты, это жидкость. Со временем молекулы сахара в меде начинают образовывать кристаллы в результате процесса кристаллизации, описанного выше. Если у вас есть старая бутылка из-под меда, загляните внутрь. Вероятно, в жидкости будут маленькие кристаллы сахара. Если хотите ускорить процесс, поставьте мед в холодильник. Охлаждение жидкости снижает растворимость сахара в жидкости, и он быстро образует кристаллы.
Охлаждение жидкости снижает растворимость сахара в жидкости, и он быстро образует кристаллы.
Геологическая шкала времени
Хотя процесс аналогичен, время, необходимое для образования таких вещей, как кварц, рубин и гранит, намного больше. Эти кристаллы образуются под чрезвычайно высоким давлением в земной коре и магме. Хотя процесс кристаллизации тот же, требуется много времени, чтобы условия и атомы объединились правильным образом для кристаллизации. Эти процессы можно воспроизвести в лаборатории за более короткое время, создав идеальные условия для кристаллизации. Лаборатории также могут выращивать затравочные кристаллы, которые могут быть введены для значительного ускорения одновременного производства больших партий кристаллов.
В несколько более короткие промежутки времени минеральные отложения, такие как сталактиты и сталагмиты, также образуются в процессе кристаллизации. Когда маленькие капли воды падают на эти кристаллы, содержащиеся в них минералы интегрируются в уже существующую кристаллическую структуру, и вода стекает.
Викторина
1. Некоторые ученые утверждают, что кристаллы — это форма жизни. Какое из следующих утверждений поддерживает эту идею?
A. Кристаллы могут свободно перемещаться
B. Благодаря кристаллизации кристаллы собираются и растут естественным образом.
C. Кристаллы — это разумные существа с нервной системой. Кристаллизация — это процесс, который происходит естественным образом и во многом напоминает растущую клетку. Хотя это намного проще, рост кристаллов связан с набором правил, вытекающих из химических свойств вовлеченных молекул.
2. Что из перечисленного НЕ является кристаллом?
A. Драгоценный камень рубин
B. Золотой слиток
C. Гелий
Ответ на вопрос № 2
C верно. Очевидно, газ не может образовать кристалл. На самом деле, гелий должен быть переохлажден, прежде чем он превратится в жидкость.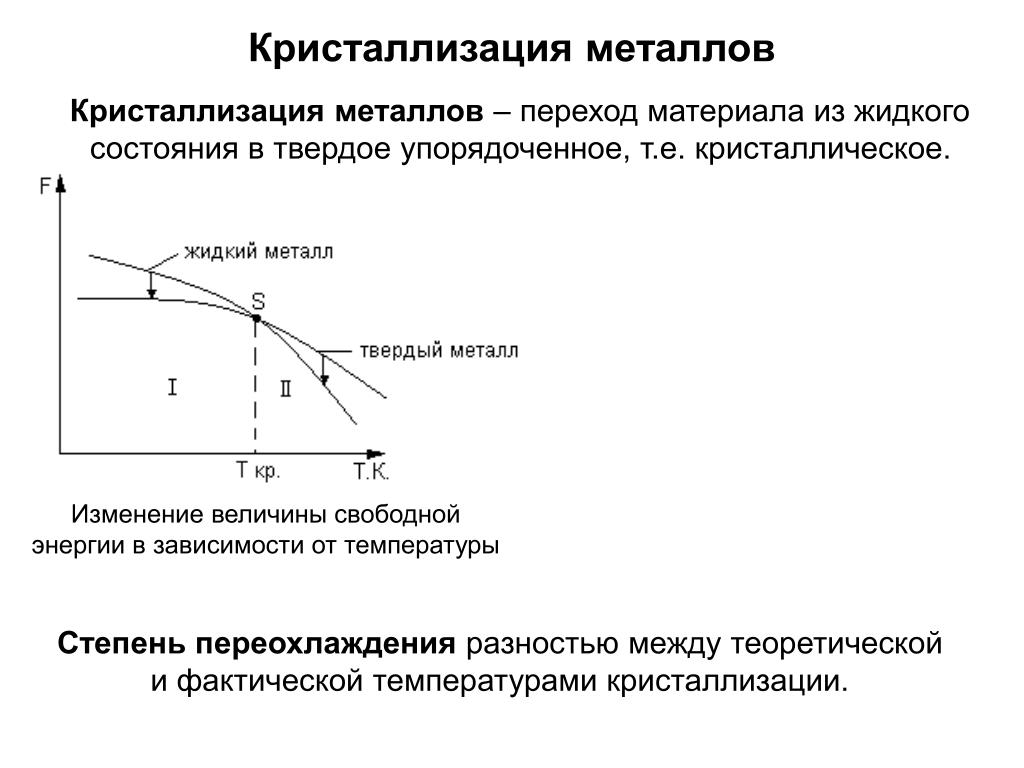 Молекулы движутся слишком быстро, чтобы сформировать стабильную и правильную структуру. Большинство других веществ в твердой форме представляют собой кристаллы, за некоторыми исключениями. К ним относятся такие вещи, как стекло, которое не образует регулярной структуры. Вместо кристаллизации такие материалы, как стекло и прозрачный пластик, замерзают, прежде чем можно будет установить структуру.
Молекулы движутся слишком быстро, чтобы сформировать стабильную и правильную структуру. Большинство других веществ в твердой форме представляют собой кристаллы, за некоторыми исключениями. К ним относятся такие вещи, как стекло, которое не образует регулярной структуры. Вместо кристаллизации такие материалы, как стекло и прозрачный пластик, замерзают, прежде чем можно будет установить структуру.
3. Вы берете морскую воду из океана. Вы наливаете его в плоскую кастрюлю и оставляете на солнце. Когда вода испарится, на дне кастрюли начнут образовываться маленькие кристаллы. Что происходит?
A. Ничего, они были до
B. По мере испарения воды присутствующие кристаллы становятся более заметными
C. По мере испарения воды соли кристаллизуются из раствора
Ответ к вопросу №3
C правильно. Чем меньше воды в кастрюле, тем выше концентрация соли. Когда уровень соли превышает то, что может удержать вода, она начинает выпадать из раствора и начинается процесс кристаллизации.
