Оксиды азота (NOx) Различные составы и номенклатуры / химия | Thpanorama
оксиды азота они представляют собой газообразные неорганические соединения, которые содержат связи между атомами азота и кислорода. Его группа химическая формула НЕТх, показывая, что оксиды имеют разные пропорции кислорода и азота.
Азот возглавляет группу 15 таблицы Менделеева, тогда как группа кислорода 16; оба элемента являются членами периода 2. Эта близость является причиной того, что связи N-O являются ковалентными в оксидах. Таким образом, связи в оксидах азота являются ковалентными.
Все эти связи могут быть объяснены с использованием теории молекулярной орбитали, которая раскрывает парамагнетизм (электрон, неспаренный на последней молекулярной орбитали) некоторых из этих соединений. Из них наиболее распространенными соединениями являются оксид азота и диоксид азота..
Молекула на верхнем изображении соответствует угловой структуре в газовой фазе диоксида азота (NO2). В отличие от оксида азота (NO) имеет линейную структуру (с учетом sp-гибридизации для обоих атомов).
В отличие от оксида азота (NO) имеет линейную структуру (с учетом sp-гибридизации для обоих атомов).
Оксиды азота – это газы, образующиеся в результате многих видов деятельности человека, от вождения автомобиля или курения сигарет до промышленных процессов в качестве загрязняющих отходов. Однако NO естественным образом образуется в результате ферментативных реакций и молний во время гроз: N2(г) + О2(г) => 2НО (г)
Высокие температуры лучей разрушают энергетический барьер, который предотвращает протекание этой реакции в нормальных условиях. Какой энергетический барьер? Это образовано тройной связью N≡N, что делает N-молекулу2 инертный газ из атмосферы.
индекс
- 1 Числа окисления для азота и кислорода в их оксидах
- 2 Различные формулировки и номенклатуры
- 2.1 Закись азота (N2O)
- 2.2 Оксид азота (NO)
- 2.3 Триоксид азота (N2O3)
- 2.4 Диоксид и тетроксид азота (NO2, N2O4)
- 2.5 Пентоксид азота (N2O5)
- 3 Ссылки
Электронная конфигурация для кислорода [He] 2s22р4, требуется всего два электрона, чтобы завершить октет своей валентной оболочки; то есть он может получить два электрона и иметь степень окисления, равную -2.
С другой стороны, электронная конфигурация для азота [He] 2s22р3, возможность получить до трех электронов для заполнения своего валентного октета; например, в случае аммиака (NH3) имеет степень окисления, равную -3. Но кислород гораздо более электроотрицателен, чем водород, и «заставляет» азот делиться своими электронами.
Сколько электронов может разделить азот с кислородом? Если вы поделитесь электронами своей валентной оболочки один за другим, вы достигнете предела в пять электронов, что соответствует степени окисления +5.
Следовательно, в зависимости от того, сколько связей он образует с кислородом, степень окисления азота варьируется от +1 до +5..
Различные формулировки и номенклатурыОксиды азота в порядке возрастания степени окисления азота:
– N2Или закись азота (+1)
– NO, оксид азота (+2)
– N2О3, триоксид азота (+3)
– НЕТ2, диоксид азота (+4)
– N2О5, пентоксид азота (+5)
Закись азота (N2O)
Закись азота (или широко известный как веселящий газ) представляет собой бесцветный газ со слабым сладким запахом и мало реактивным. Это может быть визуализировано как молекула N2 (синие сферы), который добавил атом кислорода на одном конце. Он готовится путем термического разложения нитратных солей и используется в качестве анестезирующего и обезболивающего средства..
Это может быть визуализировано как молекула N2 (синие сферы), который добавил атом кислорода на одном конце. Он готовится путем термического разложения нитратных солей и используется в качестве анестезирующего и обезболивающего средства..
Азот имеет степень окисления +1 в этом оксиде, что означает, что он не очень окислен и его потребность в электронах не является убедительной; однако вам нужно всего лишь получить два электрона (по одному на каждый азот), чтобы стать стабильным молекулярным азотом.
В основных и кислых растворах реакции:
N2O (г) + 2H+(ac) + 2e– => N2(г) + Н2O (l)
N2O (г) + H2O (l) + 2e– => N2(г) + 2OH–(Aq)
Эти реакции, хотя и термодинамически благоприятны для образования стабильной молекулы N2, происходят медленно, и реагенты, которые дарят пару электронов, должны быть очень сильными восстановителями.
Оксид азота (NO)Этот оксид состоит из бесцветного, реактивного и парамагнитного газа. Как и закись азота, он имеет линейную молекулярную структуру, но с большой разницей, что связь N = O также имеет характер тройной связи..
Как и закись азота, он имеет линейную молекулярную структуру, но с большой разницей, что связь N = O также имеет характер тройной связи..
NO быстро окисляется в воздухе с образованием NO2, и, таким образом, генерировать более стабильные молекулярные орбитали с более окисленным атомом азота (+4).
2NO (г) + O2(г) => 2НЕТ2(G)
Биохимические и физиологические исследования стоят за доброкачественной ролью этого оксида в живых организмах..
Он не может образовывать N-N-связи с другой молекулой NO из-за делокализации неспаренного электрона на молекулярной орбитали, который направлен больше на атом кислорода (из-за его высокой электроотрицательности). Противоположное происходит с NO2, которые могут образовывать газообразные димеры.
Триоксид азота (N2О3)Пунктирные линии структуры указывают на резонанс двойной связи. Как и все атомы, они имеют sp-гибридизацию2, молекула плоская, и молекулярные взаимодействия достаточно эффективны, чтобы триоксид азота мог существовать в виде синего твердого вещества при температуре ниже -101ºC. При более высоких температурах он плавится и диссоциирует на NO и NO2.
При более высоких температурах он плавится и диссоциирует на NO и NO2.
Почему это диссоциировано? Поскольку числа окисления +2 и +4 более стабильны, чем +3, последние присутствуют в оксиде для каждого из двух атомов азота. Это, опять же, может быть объяснено стабильностью молекулярных орбиталей в результате диспропорции.
На изображении, левая сторона N2О3 соответствует NO, а правая сторона к NO2. Логично, что это происходит путем слияния предыдущих оксидов при очень низких температурах (-20ºC). N2О3 ангидрид азотной кислоты (HNO2).
Диоксид и тетроксид азота (NO2, N2О4)НЕТ2 это коричневый или коричневый газ, реактивный и парамагнитный. Поскольку он имеет неспаренный электрон, он димеризуется (связывается) с другой газообразной молекулой NO2 с образованием четырехокиси азота, бесцветного газа, устанавливая баланс между двумя химическими веществами:
2NO2(G) N2О4(G)
Это ядовитый и универсальный окислитель, способный диспропорционировать в своих окислительно-восстановительных реакциях в ионах (оксоанионах). 2– и НЕТ3– (генерирующий кислотный дождь), или в НЕТ.
2– и НЕТ3– (генерирующий кислотный дождь), или в НЕТ.
Точно так же НЕТ2 участвует в сложных атмосферных реакциях, вызывающих изменения концентрации озона (ИЛИ3) на земных уровнях и в стратосфере.
Пентоксид азота (N2О5)При увлажнении образуется HNO3, и при более высоких концентрациях кислоты кислород в основном протонируется с частичным положительным зарядом -O+-H, ускорение окислительно-восстановительных реакций
ссылки- askIITians. ((2006-2018)). askIITians. Получено 29 марта 2018 года у AskIITians: askiitians.com
- Энциклопедия Британика, Инк. (2018). Энциклопедия Британика. Получено 29 марта 2018 г. из Британской энциклопедии: britannica.com
- Токс Таун. (2017). Токс Таун. Получено 29 марта 2018 года из города Токс: toxtown.nlm.nih.gov
- Профессор Патриция Шапли.
 (2010). Оксиды азота в атмосфере. Университет Иллинойса. Получено 29 марта 2018 г. из: butane.chem.uiuc.edu
(2010). Оксиды азота в атмосфере. Университет Иллинойса. Получено 29 марта 2018 г. из: butane.chem.uiuc.edu - Дрожь и Аткинс. (2008). Неорганическая химия в Элементы группы 15. (Четвертое издание. С. 361-366). Mc Graw Hill
Измерение химии масла: нитрование, окисление и сульфирование
Измерение химии масла: нитрование, окисление и сульфирование- Контакты
В процессе эксплуатации смазка контактируем с воздухом, теплом, коррозионными веществами, подвергается давлению и другим факторам, которые вызывают химические изменения в масле. Изменение в химии масла может повлиять на способность смазки выполнять свою работу (например, если основные присадки были исчерпаны). Со временем эти химические реакции могут привести к накоплению вредных побочных продуктов разложения, таких как слабые органические кислоты. Анализ химии масла всегда включает окисление, а также может включать нитрование и сульфатирование в зависимости от применения.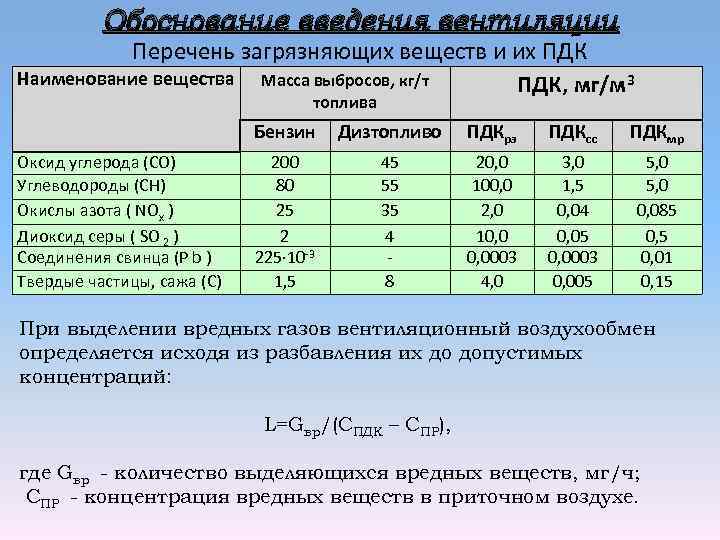 В некоторых случаях масла также могут быть протестированы для проверки на истощение конкретных присадок, таких как противоизносная присадка ZDDP.
В некоторых случаях масла также могут быть протестированы для проверки на истощение конкретных присадок, таких как противоизносная присадка ZDDP.
Эти оксиды азота взаимодействуют со смазкой, создавая органические нитраты или растворимые/нерастворимые азотистые соединения. Нитрование может вызвать преждевременное ухудшение моторного масла. Общие причины нитрования включают неэффективный выхлоп продуктов сгорания, неправильное соотношение воздух-топливо, низкую рабочую температуру и утечку поршневых уплотнений.
ОКИСЛЕНИЕ — Окисление масла происходит в присутствии воздуха (кислорода) и тепла. Атмосферный кислород реагирует с углеводородами в масле с образованием карбоновых кислот. Эти кислоты слабы, но со временем их концентрация может стать достаточно высокой, чтобы вызвать сильную коррозию деталей машин.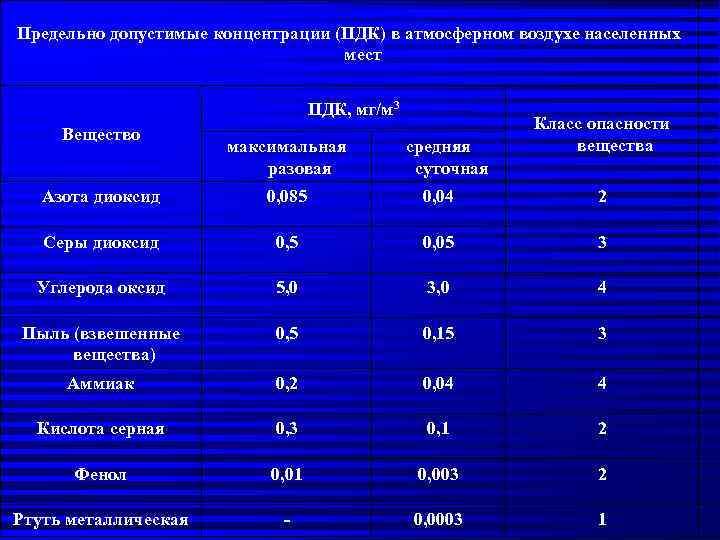
СУЛЬФИРОВАНИЕ — Реакция между кислородом, водой и серой из дизельного топлива или базового масла под воздействием тепла может приводить к образованию сернистых соединений, в том числе кислот на основе серы. Большую часть времени эти сернистые соединения удалются через выхлоп, но некоторые могут оставаться и проникать в полость двигателя. Сульфатирование происходит, когда эти кислоты реагируют либо с присадками в масле, либо с базовым маслом. При более низкой рабочей температуре, например, при запуске, кислоты могут конденсироваться и легче контактировать с маслом.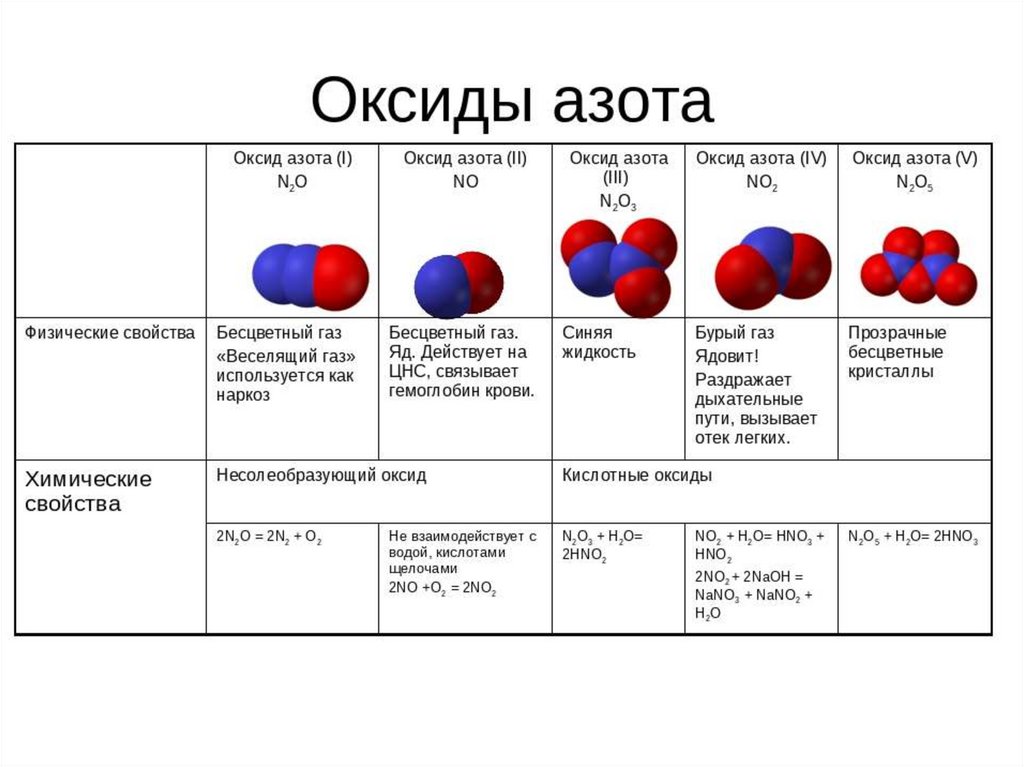
Руководство для начинающих по NOX, NO и NO2 в качестве загрязняющих веществ воздуха
Блог
Руководство для начинающих по NOX, NO и NO2 AS AIR Загрязняющие вещества
Подробности статьи
Последний обновление
09 декабря 2021
Опубликованный
13 декабря 2018 г.
Категория
На открытом воздухе
Знакомство с семейством оксидов азота: NOX, NO и NO2
Знакомство с азотом, обычно обозначаемым просто химическим символом N. Когда два атома азота соединяются вместе, они образуют газообразный азот ( N 2 ). Газообразный азот не имеет запаха, цвета и вкуса. Он негорюч и не поддерживает горение. Интересный факт: азот составляет 78% атмосферы Земли. Вы, наверное, помните, как в школе узнавали о круговороте азота и о том, как он важен для всей жизни на Земле.
Познакомьтесь с кислородом, другом азота ( O ), высокореактивным неметаллом, окислителем, который легко образует оксиды с большинством элементов и других соединений. При нормальном давлении и температуре молекулы кислорода связываются с образованием дикислорода ( O 2 ), который присутствует в атмосфере.
Кислород является третьим по распространенности элементом во Вселенной и, конечно же, имеет решающее значение для нашего дальнейшего существования. Интересный факт: самый распространенный цвет полярного сияния (бледный желтовато-зеленый) в северном сиянии создается молекулами кислорода, находящимися примерно в 60 милях над землей. Как это круто!
Когда азот встречается с кислородом
При комнатной температуре азот является очень неактивным газом, можно сказать, домоседом. Но между этими двумя может пролететь искра. В присутствии молнии или искры азот соединяется с кислородом, образуя несколько различных оксидов.
Оксид азота или оксид азота (NO) и диоксид азота (NO 2 ) являются наиболее распространенными. NO и NO 2 представляют собой два вида газов и называются оксидами азота (NO x ). Молекулы NO x содержат атомы азота и кислорода.
В чем разница между NOX, NO и NO2?
Оксиды азота (NO x ) — это собирательный термин, используемый для обозначения монооксида азота (оксид азота или NO) и диоксида азота (NO 2 )
Монооксид азота (NO) — бесцветный газ и один из основных оксидов азота один из нескольких оксидов азота.
Источники NOX – NO и NO2
Теперь, когда вы официально ознакомились с NO x , NO и NO 2 – как образуются оксиды азота и откуда они берутся?
Оксиды азота образуются в результате реакции газов азота и кислорода в воздухе во время горения, особенно при высоких температурах. При нормальных температурах газообразные кислород и азот не реагируют вместе.
Оксиды азота естественным образом образуются при ударе молнии. Вспышка молнии может достигать температуры примерно 30 000 кельвинов (53 540 градусов по Фаренгейту). Вы спросите, сколько раз молния ударяет в землю? Каждую секунду на поверхность Земли ударяет около 100 молний. В сутках 86 400 секунд, а в году 365 дней — посчитайте сами… скажем так, это много.
В крупных городах оксиды азота образуются при сжигании топлива в мобильных и стационарных источниках. При сгорании бензина в автомобилях в атмосферу выбрасываются оксиды азота (мобильный источник). Стационарные выбросы происходят от угольных электростанций, котлов электростанций.
NOX может происходить из природных, биогенных и промышленных источников
Естественные источники: В основном грозы из-за сильного нагрева молнии. Лесной пожар является еще одним природным источником.
Биогенный: Сельскохозяйственное удобрение и использование азотфиксирующих растений (путем азотфиксации микроорганизмами).
Промышленные источники: Тепловой № x , топливный № x и подсказка № x .
Тепловой NO x – наиболее подходящий источник сжигания природного газа
Топливо NO x – транспортное топливо оценивается как 54% от NO x , вызванный человеком
Подсказка NO x – происходит на ранней стадии сгорания, образуя фиксированные формы азота (такие как NH…и т.д.), которые могут окисляться до NO
производимые выбросы, NOx из природных источников обычно находятся на высоте более 5 км. Искусственные выбросы в результате сжигания ископаемого топлива либо из стационарных источников (24%), либо из мобильных источников (49%), как правило, обнаруживаются рядом с источниками на приповерхностной высоте, где они могут оказывать значительное воздействие на здоровье.
Воздействие NOX на человека и окружающую среду
Как присутствие оксидов азота влияет на меня? Есть ли какие-либо неблагоприятные последствия для моего здоровья и стоит ли мне беспокоиться?
Оксиды азота (NO x ) реагируют с образованием смога и кислотных дождей. NO x реагирует с аммиаком, влагой и другими соединениями с образованием паров азотной кислоты и связанных с ними частиц. Воздействие NO x на здоровье человека включает повреждение легочной ткани, проблемы с дыханием и респираторными заболеваниями.
NO x реагирует с аммиаком, влагой и другими соединениями с образованием паров азотной кислоты и связанных с ними частиц. Воздействие NO x на здоровье человека включает повреждение легочной ткани, проблемы с дыханием и респираторными заболеваниями.
Оксид азота (NO) не считается опасным для здоровья при обычных условиях окружающей среды. Однако избыток оксида азота и его продуктов может вызывать респираторные заболевания, гематологические побочные эффекты, нарушения обмена веществ, низкое кровяное давление, тошноту, рвоту и диарею.
Двуокись азота (NO 2 ) в высоких концентрациях вызывает воспаление дыхательных путей. Вдыхание высоких концентраций NO 2 может повысить вероятность возникновения респираторных заболеваний: свистящее дыхание, кашель, простуда, грипп и бронхит. Люди с астмой склонны к более интенсивным приступам. Длительное воздействие высоких уровней NO 2 может вызвать необратимые повреждения дыхательной системы.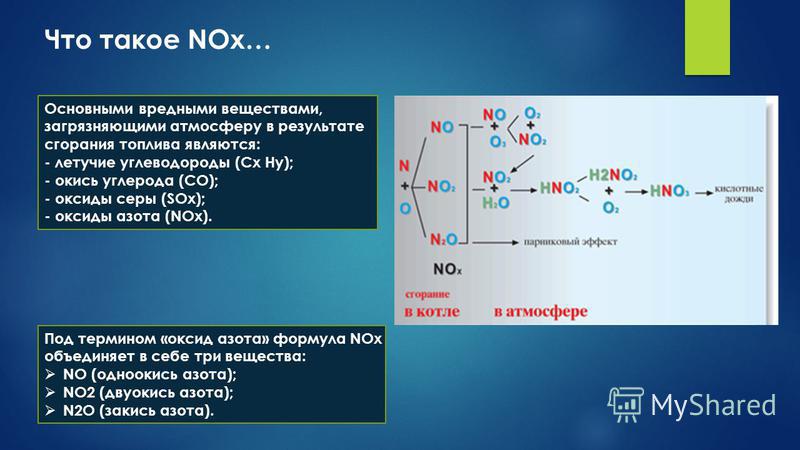
Влияет ли это на окружающую среду?
Высокие уровни NOx могут оказывать негативное воздействие на растительность, делая ее более восприимчивой к болезням и повреждениям от заморозков. Когда NOx вступает в реакцию с другими загрязняющими веществами в присутствии солнечного света, он образует озон. Озон в высоких концентрациях также повреждает растительность.
NO2 и загрязнение воздуха
Что такое загрязнение воздуха и является ли NO 2 загрязнителем воздуха?
Загрязнение воздуха происходит при попадании в атмосферу газов, частиц пыли, паров или запахов, которые оказывают вредное или ядовитое воздействие. The common air pollutants are (also known as criteria pollutants):
Nitrogen dioxide (NO 2 )
Particulate matter (PM 10 and PM 2.5 )
Ozone (O 3 )
Окись углерода (CO)
Двуокись серы (SO 2 )
Что вызывает NO 2 загрязнение воздуха?
Количество оксидов азота, выбрасываемых в атмосферу в качестве загрязнения воздуха из обоих техногенных источников, может быть весьма значительным. В основном он производится дорожным движением и производством энергии.
В основном он производится дорожным движением и производством энергии.
В то время как NO 2 является первичным загрязнителем, он также является компонентом вторичных загрязнителей, образующихся в результате химической реакции. Наиболее распространенным является озон. Фотохимический смог, наиболее распространенный в солнечных и сухих местах, образуется, когда NO 2 при сгорании газа подвергается воздействию солнечного света, расщепляется и выделяет ион кислорода (O).
Высвобожденный O соединяется с молекулой кислорода (O 2 ), образуя озон (O 3 ). Озон является одним из основных вторичных загрязнителей. Вы можете прочитать больше об озоновом загрязнении в нашем блоге: Почему у меня проблема с озоновым загрязнением (и что я могу с этим поделать)?
Внутренний № 2 Уровни являются результатом как внутренних, так и наружных источников. В помещении NO 2 производится невентилируемыми обогревателями и газовыми плитами, высокие уровни наружного воздуха NO 2 , возникающие из-за местного движения и других источников возгорания, могут влиять на уровни внутри помещений.
Безопасен ли воздух, которым мы дышим? Должны ли мы быть обеспокоены?
Загрязнение воздуха является серьезной проблемой, и мы все должны быть обеспокоены. Всемирная организация здравоохранения (ВОЗ) оценивает 4,2 миллиона смертей ежегодно в результате воздействия загрязнения атмосферного (наружного) воздуха и 3,8 миллиона смертей ежегодно в результате воздействия дыма от грязных кухонных плит и топлива в домохозяйствах. Во всем мире больше смертей в год связано с загрязнением воздуха, чем с автомобильными авариями.
NO 2 является как первичным, так и вторичным загрязнителем. Загрязнение воздуха влияет на всех, но некоторые из нас более восприимчивы, чем другие: дети и пожилые люди, люди с заболеваниями легких и сердца, люди, работающие и занимающиеся спортом на открытом воздухе.
Как проверить чистоту воздуха на улице? Важно ли контролировать NO2 в окружающем воздухе?
Для борьбы с серьезными последствиями для здоровья важно больше узнать о загрязнении воздуха, например, о районах высокой концентрации, элементах состава и причинах. Чтобы получить эту информацию, необходимо провести всесторонний мониторинг качества воздуха с использованием устройств мониторинга воздуха, таких как показано ниже. Они могут быть портативными, идеальными для проверки очагов загрязнения или личного воздействия, или стационарными мониторами, которые непрерывно измеряют воздух, чтобы вы знали, когда NO 2 высокие уровни. Оба измеряют воздух в режиме реального времени, предоставляя вам точные показания для принятия обоснованных решений.
Чтобы получить эту информацию, необходимо провести всесторонний мониторинг качества воздуха с использованием устройств мониторинга воздуха, таких как показано ниже. Они могут быть портативными, идеальными для проверки очагов загрязнения или личного воздействия, или стационарными мониторами, которые непрерывно измеряют воздух, чтобы вы знали, когда NO 2 высокие уровни. Оба измеряют воздух в режиме реального времени, предоставляя вам точные показания для принятия обоснованных решений.
Портативные мониторы для измерения NO2
Портативные мониторы для измерения NO2
Кто такое Aeroqual?
Aeroqual производит датчики и оборудование для контроля качества воздуха. Наши портативные мониторы — это простые инструменты для компаний и сообществ, которые могут использовать даже обычные люди — измерение воздуха не обязательно должно быть сложной задачей. Мониторинг NO 2 и других загрязнителей прост как 1-2-3. Ознакомьтесь с нашими портативными мониторами качества наружного воздуха, чтобы узнать больше.
Если вы хотите узнать больше о мониторах качества наружного воздуха Aeroqual, свяжитесь с нами, чтобы рассказать нам больше о ваших требованиях к мониторингу воздуха.
Сопутствующие продукты
Серия 500 – Портативный монитор качества воздуха
Комплект для проверки качества наружного воздуха (Pro)
AQM 65 Станция мониторинга окружающего воздуха
Aeroqual Cloud – Программное обеспечение для мониторинга качества воздуха
7Мониторинг Air00 made Оксиды азота (NOx) | Информационная система загрязнения воздуха
Источники
Оксиды азота образуются в процессе горения частично из соединений азота в топливе, но в основном в результате прямого соединения атмосферного кислорода и азота в пламени. Оксиды азота образуются естественным путем при ударе молнии, а также в небольшой степени в результате микробных процессов в почвах.
Источники выбросов и тенденции
Искусственные выбросы оксидов азота преобладают в общих выбросах в Европе, при этом выбросы Великобритании составляют около 2,2 млн тонн NO 2 каждый год. Из них около четверти приходится на электростанции, половину — на автомобили, а остальное — на другие промышленные и бытовые процессы сжигания. В отличие от выбросов двуокиси серы, выбросы оксидов азота в Великобритании сокращаются медленно, поскольку стратегии контроля выбросов для стационарных и мобильных источников компенсируются увеличением количества автотранспортных средств.
Из них около четверти приходится на электростанции, половину — на автомобили, а остальное — на другие промышленные и бытовые процессы сжигания. В отличие от выбросов двуокиси серы, выбросы оксидов азота в Великобритании сокращаются медленно, поскольку стратегии контроля выбросов для стационарных и мобильных источников компенсируются увеличением количества автотранспортных средств.
Выбросы при производстве электроэнергии – Выбросы NOx при производстве электроэнергии довольно постоянны с 1970 и далее до 1990 года. В начале 1990-х годов возросшее использование газа в производстве электроэнергии заменило уголь и нефть (DECC, 2009). Более чистое топливо и более современные электростанции привели к значительному сокращению выбросов NOx в этом секторе до 2000 года. С 2000 года абсолютный уровень газа, используемого для производства электроэнергии, оставался довольно постоянным, а возросший спрос удовлетворялся за счет угольных электростанций. С 2006 года использование угля (и общее количество топлива, используемого для производства электроэнергии) существенно сократилось (DECC, 2009). ).
).
Выбросы NOx от автомобильного транспорта – сектор автомобильного транспорта внес значительный вклад в тенденцию к снижению выбросов в Великобритании. Выбросы от автомобильного транспорта в настоящее время вносят наибольший вклад в общий объем выбросов в Великобритании, на долю которого в 2010 году приходилось около 33% (Defra, 2011). Первые бензиновые автомобили с трехкомпонентными катализаторами были представлены в 1992 году, что привело к значительному сокращению выбросов NOx. Ограничения выбросов для дизельных автомобилей и легковых автомобилей вступили в силу в 1993/94. Ограничения на выбросы от большегрузных транспортных средств (HGV) впервые вступили в силу в 1988 году, что привело к постепенному снижению уровня выбросов по мере появления в парке новых большегрузных автомобилей. Введение этих стандартов оказало существенное влияние на выбросы NOx в секторе автомобильного транспорта по сравнению с 1990-ми годами (RoTAP, 2012).
Дополнительную информацию и данные о выбросах можно найти по адресу: http://naei. defra.gov.uk/overview/pollutants?pollutant_id=6
defra.gov.uk/overview/pollutants?pollutant_id=6
Химия атмосферы и перенос
Основным загрязняющим веществом, выбрасываемым напрямую, является оксид азота (NO) вместе с небольшой долей диоксида азота (NO 2 ). NO окисляется озоном в атмосфере в течение десятков минут с образованием NO 2 . В воздухе сельской местности, вдали от источников NO, большая часть оксидов азота в атмосфере находится в форме NO 2 . NO и NO2 вместе известны как NO x , поскольку в течение дня они быстро превращаются друг в друга. № 2 расщепляется УФ-светом с образованием NO и атома O, который соединяется с молекулярным кислородом (O 2 ) с образованием озона (O 3 ). Следовательно, в течение дня NO, NO 2 и озон находятся в квазиравновесии, которое зависит от количества солнечного света. В конце концов, NO 2 окисляется до азотной кислоты (HNO 3 , пар), которая поглощается непосредственно землей, превращается в частицы, содержащие нитраты, или растворяется в каплях облаков. Ночью различные процессы окисления превращают NO 2 к нитратам.
Ночью различные процессы окисления превращают NO 2 к нитратам.
Хотя азотная кислота быстро абсорбируется при контакте с поверхностями (капли облаков, почва или растительность), другие оксиды азота удаляются довольно медленно и могут перемещаться на многие сотни километров до их окончательного превращения в азотную кислоту или нитраты. Следовательно, выбросы в одной стране будут оседать в других. Великобритания экспортирует около трех четвертей своих выбросов NO X (RoTAP, 2012).
Измеренные концентрации NO 2 показывают преобладание транспортных средств и городских источников с самыми большими концентрациями в крупных агломерациях и вблизи сети автомагистралей, при этом среднегодовые концентрации превышают 10 частей на миллиард в этих районах.
Воздействие на экосистему
Вполне вероятно, что наиболее сильное воздействие выбросов оксидов азота в Великобритании связано с их вкладом в общее осаждение азота. Однако прямое воздействие газообразных оксидов азота также может быть важным, особенно в районах, близких к источникам (например, обочинам дорог).
 (2010). Оксиды азота в атмосфере. Университет Иллинойса. Получено 29 марта 2018 г. из: butane.chem.uiuc.edu
(2010). Оксиды азота в атмосфере. Университет Иллинойса. Получено 29 марта 2018 г. из: butane.chem.uiuc.edu