ФизХим_лаборат – Стр 3
сказывается внесение в почву органических, минеральных, орга- но-минеральных и бактериальных удобрений. Иными словами, растворы — наиболее распространенные системы в природе, и потому учение о растворах является важным разделом физической химии.
Буферными растворами называются водные растворы веществ, которые сохраняют определенное значение рН, практически не изменяющееся при добавлении небольших количеств кислот, солей или оснований и при разбавлении в 2–5 раз.
Способность буферных систем противостоять изменениям рН среды получила название буферного действия. По химическому составу буферные системы могут быть представлены:
-многокомпонентными растворами из слабых кислот и их солей;
-слабыми основаниями и их солями;
-смесями солей многоосновных кислот;
-растворами высокомолекулярных полиэлектролитов, таких как гуминовые кислоты, белки и др.
Пример:
аммиачный буферный раствор (основной): Nh5OH + Nh5Cl; фосфатный буферный раствор (рН около 7): Na2HPO4 + Nah3PO4; гидрокарбонатный буферный раствор (кислый): Н2СО3 + NaHCO3;
ацетатный буферный раствор (кислый): СН3СООН + Ch4COONa. Величина рН кислой буферной системы вычисляется по фор-
Величина рН кислой буферной системы вычисляется по фор-
муле
рН = – lgКдис(кисл) – lgСкисл + lgСсоли, | (4.1) |
где Кдис(кисл) – константа диссоциации слабой кислоты;
Скисл и Ссоли – концентрации кислоты и соли в буферном растворе.
Величина рН основной буферной системы вычисляется по
формуле |
|
рН = 14 + lgКдис(осн) + lgСосн – lgСсоли, | (4.2) |
где Кдис(осн) – константа диссоциации слабого основания; |
|
Сосн и Ссоли – концентрации основания и соли в буферном растворе.
В случае равных концентраций компонентов при образовании
21
буферного раствора величину концентрации можно заменить на объемы этих компонентов.
Величина рН буферного раствора зависит от константы диссоциации слабого электролита и объемных соотношений компонентов. Варьируя количеством слабого и сильного электролитов, можно приготовить буферные растворы с определенными значениями рН. Для практических целей составлены специальные таблицы рН буферных растворов при различных соотношениях компонентов для наиболее часто применяемых буферных систем и таблицы для приготовления универсальных буферных смесей. Приготовленный буферный раствор сохраняет исходное значение рН при разбавлениях и добавлениях некоторых количеств кислот или оснований.
Варьируя количеством слабого и сильного электролитов, можно приготовить буферные растворы с определенными значениями рН. Для практических целей составлены специальные таблицы рН буферных растворов при различных соотношениях компонентов для наиболее часто применяемых буферных систем и таблицы для приготовления универсальных буферных смесей. Приготовленный буферный раствор сохраняет исходное значение рН при разбавлениях и добавлениях некоторых количеств кислот или оснований.
Рассмотрим механизм буферного действия, т. е. сохранения исходного значения рН буферной среды в этих условиях на примере ацетатного буферного раствора.
1.При разбавлении буферной системы водой в равных долях уменьшаются концентрации уксусной кислоты и ацетата натрия (соли), а отношение между ними не изменяется. Поэтому величина рН буферного раствора не изменяется при разведении в 2–5 раз.
2.Добавление к ацетатной буферной системе ионов Н+ в виде раствора НСl вызывает смещение равновесия диссоциации слабо-
го электролита – СН3СООН в сторону ассоциации. Поэтому аце- тат-ионы соли взаимодействуют с добавленными ионами Н+ и
Поэтому аце- тат-ионы соли взаимодействуют с добавленными ионами Н+ и
образуют дополнительное количество молекул СН3СООН до установления исходной рН:
СН3СООН СН3СОО– + H+.
Буферное действие проявляется до тех пор, пока не израсходуются ацетат-ионы.
3.Добавление к ацетатной буферной системе (кислая среда)
гидроксильных ионов в виде раствора NaOH вызывает реакцию нейтрализации с ионами водорода, имеющимися в растворе: H+ + OH – h3O, что приводит к уменьшению равновесной концентрации водородных ионов. Поэтому происходит смещение в ионизационном равновесии уксусной кислоты в сторону диссоциации до восстановления исходной рН:
22
СН3СООН СН3СОО– + H+.
Буферное действие будет проявляться до тех пор, пока не продиссоциируют все молекулы уксусной кислоты.
Таким образом, за пределами некоторых количеств вводимых веществ с кислыми или основными свойствами происходит резкое изменение рН буферной системы, что указывает на прекращение буферного действия.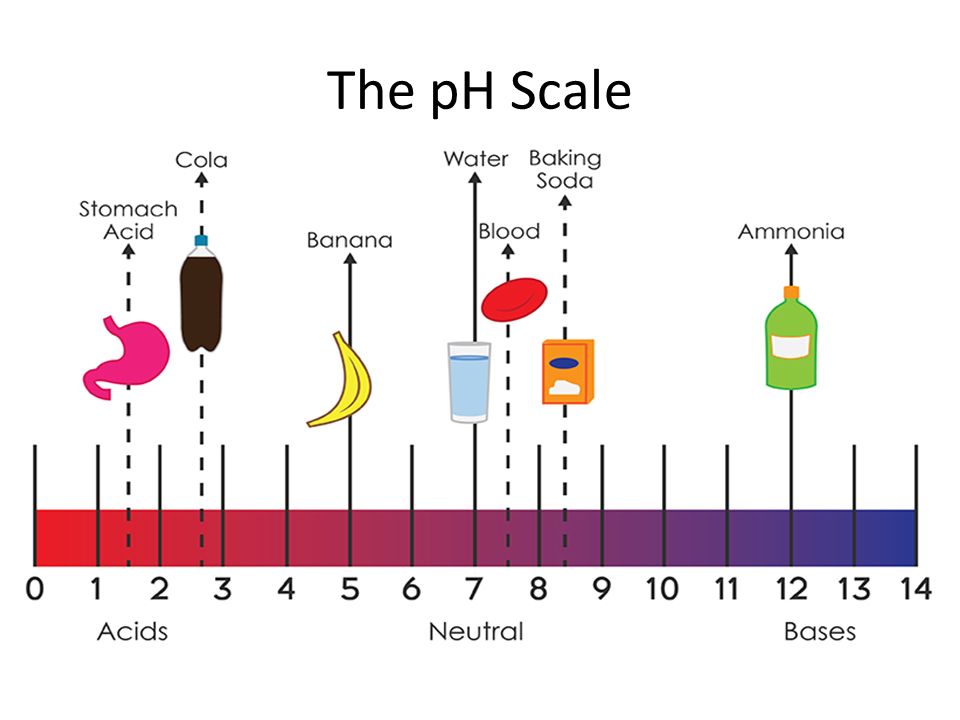
Буферное действие количественно может выражаться в виде буферной ёмкости (β). Это количество эквивалентов сильной кислоты или щелочи, которое необходимо добавить к 1 л буферной системы, чтобы изменить величину рН на единицу:
| СТ | VT | , | (4.3) | ||
VБ | рН | |||||
|
|
| ||||
где СТ – нормальная концентрация добавленной сильной кислоты или щелочи;
VT – объем добавленной сильной кислоты или щелочи, мл; VБ – объем буферной системы, мл;
рН – величина изменения рН буферной системы при титровании, которая может колебаться от 0,5 до 1,0.
Величина буферной ёмкости зависит от концентрации компонентов раствора и соотношения этих концентраций.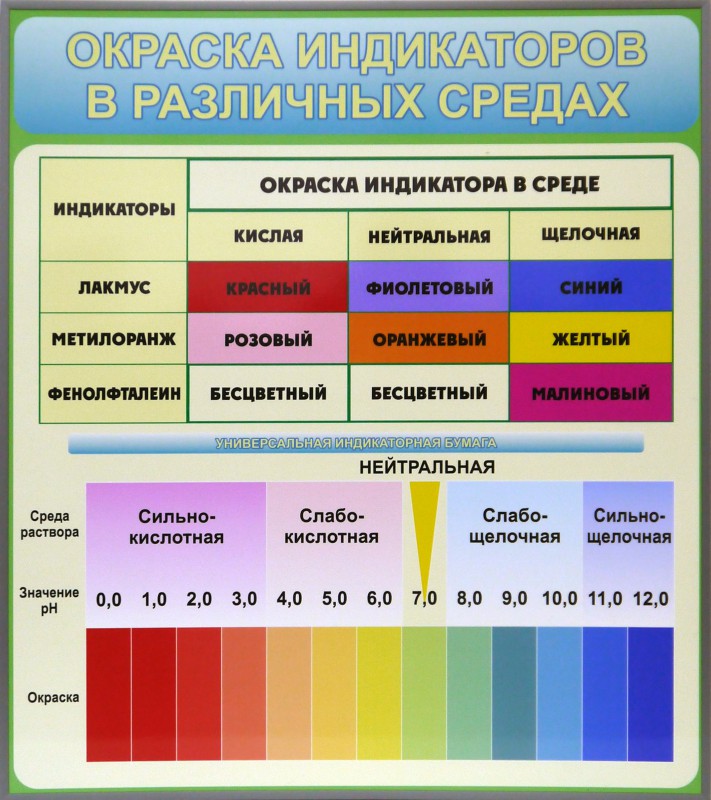 С увеличением концентрации компонентов буферная емкость возрастает. Наибольшей величиной буферной емкости обладают буферные системы при равных концентрациях компонентов:
С увеличением концентрации компонентов буферная емкость возрастает. Наибольшей величиной буферной емкости обладают буферные системы при равных концентрациях компонентов:
Скисл (или Сосн ) = Ссоли.
Ход работы
Опыт 1. Приготовление буферных систем
Втри стаканчика отмерить 0,1 н. раствора уксусной кислоты
иуксуснокислого натрия в количествах, указанных в таблице 3.
Таблица 3 – Строение и свойства исследуемых буферных систем
Номера | Объем | Объем | Объем буфер- | рН | рН |
стаканчика | Ch4COOН, мл | Ch4COONa, мл | ного р-ра, мл | теорет. | экспер. |
1 | 1,5 | 13,5 | 15 |
|
|
2 | 7,5 | 7,5 | 15 |
|
|
3 | 13,5 | 1,5 | 15 |
|
|
23
Вычислить величину рН каждой буферной системы и внести в таблицу 3. Определить величины рН всех буферных систем с помощью рН-метра (потенциометрический метод).
Определить величины рН всех буферных систем с помощью рН-метра (потенциометрический метод).
Совпали ли теоретически рассчитанные значения рН буферных растворов с экспериментально измеренными?
Опыт 2. Разбавление буферного раствора
Взять буферный раствор в стаканчике 2 (рН известна), разбавить водой в два раза (15 мл Н2О), размешать и измерить величину рН на рН-метре. Затем разбавить исходную буферную систему в три раза (еще 15 мл Н2О), измерить величину рН.
Таблица 4 – Влияние разбавления на буферную систему
Исходное рН | рН после разбавления | ||
1:1 | 1:2 | ||
| |||
|
|
| |
Изменилось ли значение рН буферного раствора и почему?
Опыт 3. Действие кислот и щелочей на буферные растворы
Взять стаканчик 1 из опыта 1, содержащий раствор с наибольшей величиной рН, прилить 5 капель 0,1 н. НСl, размешать, измерить величину рН и сравнить ее с исходным значением.
НСl, размешать, измерить величину рН и сравнить ее с исходным значением.
Взять стаканчик 3 из опыта 1, содержащий раствор с наименьшей величиной рН, прилить 5 капель 0,1 н. NaOH, размешать, измерить величину рН и сравнить ее с исходным значением.
Аналогично провести эксперименты с 15 мл Н2О с добавлением равных количеств капель растворов НСl и NaOH. Данные занести в таблицу 5 и сделать выводы.
Таблица 5 – Свойства буферных растворов
Исследуемый | Исходное рН | рН после добавле- | рН после добавле- | |
раствор | ния НСl | ния NaOH | ||
| ||||
Раствор 1 |
|
| – | |
Раствор 3 |
| – |
| |
Н2О |
|
|
|
Изменились ли значения рН буферных растворов после при-
24
бавления кислоты и щелочи? Сравнить эти изменения с чистой водой.
Опыт 4. Измерение буферной ёмкости
Приготовить в двух стаканчиках буферные растворы объемом по 15 мл в следующих соотношениях компонентов:
1-й раствор – 11 мл 0,1 н. СН3СООН и 4 мл 0,1 н. Ch4COONa; 2-й раствор – 4 мл 0,1 н. Ch4COOH и 11 мл 0,1 н. Ch4COONa.
Измерить рН-метром величины рН, затем приливать по 1 мл из бюретки 0,1 н. раствор NaOH, перемешивать и измерять величины рН до тех пор, пока значение рН не увеличится на 0,5 и более, но не превысит 1,0 от исходного значения рН. Вычислить величины буферных ёмкостей и сделать выводы относительно зависимости величины ёмкости от концентрации компонентов буферной системы.
Таблица 6 – Определение буферной емкости буферных растворов
Растворы | Исходное | Объем прили- | рН после при- | Буферная емкость | |
рН | той NaOH, мл | ливания NaOH | β, мэкв/л | ||
| |||||
|
|
|
|
| |
1 |
|
|
|
| |
2 |
|
|
|
|
В каком растворе буферная емкость выше и почему?
Опыт 5. Измерение буферных свойств почвенной вытяжки
Измерение буферных свойств почвенной вытяжки
Взять 5 г почвы, поместить в колбу с плотной пробкой и залить 200 мл воды. Смесь почвы и воды встряхивать 5–10 мин, дать отстояться и профильтровать через бумажный фильтр. Взять 50 мл фильтрата, перенести в стаканчик и измерить рН на рН- метре. Провести измерение буферной емкости аналогично предыдущему опыту. В случае кислой среды – титрование провести 0,1 н. раствором NaOH, при щелочной среде – 0,1 н. раствором HCl и вычислить буферную емкость.
Таблица 7 – Буферная емкость почвенной вытяжки
Тип | Исходное | Объем прилитого | рН после | Буферная ем- |
почвы | рН | электролита, мл | приливания | кость β, мэкв/л |
|
|
|
|
|
Высоко ли значение буферной емкости почвенной вытяжки
25
по сравнению с растворами предыдущего опыта? Вывод. Выводы делать после каждого опыта.
Выводы делать после каждого опыта.
Контрольные вопросы
1.Дать определение буферных систем, буферного действия. Привести примеры по составу буферных растворов.
2.Что такое ионное произведение воды, водородный и гидроксильный показатели?
3.Привести формулы для расчета рН кислых и основных буферных растворов.
4.Пояснить механизм буферного действия при введении Н+ и ОН– -ионов.
5.Дать определение буферной емкости, записать формулу для ее вычисления по результатам измерения.
6.Как можно повлиять на величину буферной емкости растворов?
7.Биологическое значение буферных систем почвенных растворов, соков растений, крови.
8.Какими методами определяется рН раствора? Необходимо ли при этом поддерживать постоянную температуру и почему?
9.Какова роль концентрации ионов Н+ в биологических процессах?
Контрольные задачи
(Константы диссоциации веществ даны в приложении 3)
1.Вычислить рН буферного раствора, содержащего 60 мл 0,05 н. раствора Nh5Cl и 40 мл 0,1 н. раствора Nh5OН.
раствора Nh5Cl и 40 мл 0,1 н. раствора Nh5OН.
2.Вычислить рН раствора, если в 2 л раствора содержится 23 г НСООН и 21 г НСООК.
3.Определить [H+] и рН раствора, состоящего из слабого основания (пиридина) и его хлорида, если концентрации
компонентов в растворе соответственно равны 0,1 и 0,06 моль/л, Кдис(пиридина) = 1,6∙10–5.
4.Вычислить рН буферного раствора, содержащего по 20 мл 0,01 н. растворов Nh5Cl и Nh5OН.
5.Определить объем 0,1 н. раствора уксусной кислоты, который следует прибавить к 40 мл 0,1 н. раствора ацетата
26
натрия, чтобы получить буферный раствор со значением
рН = 5,05.
6.Вычислить рН буферного раствора, содержащего в 0,5 л раствора 1,5 моля гидроксида аммония и 2,5 моля хлорида аммония.
7.Рассчитать рН ацетатного буферного раствора, в 700 мл которого содержится 0,2 моля уксусной кислоты и 0,3 моля ацетата натрия.
8.При добавлении к 50 мл ацетатного буферного раствора 10 мл 0,01 н. раствора NaOH рН изменился на 0,8. Определить буферную емкость данного раствора.
Определить буферную емкость данного раствора.
9.Какой объем децимолярного раствора HCl необходимо прилить к 60 мл аммиачного буфера, чтобы рН изменился на 1 (буферная емкость составляет 5 мэкв/л)?
10.Как изменится рН гидрокарбонатного буферного раствора, если к 100 мл его с β = 4 мэкв/л добавить 5 мл 0,1 н. раствора NaOH?
ЛАБОРАТОРНАЯ РАБОТА № 4
ИЗУЧЕНИЕ КОЛЛИГАТИВНЫХ СВОЙСТВ РАЗБАВЛЕННЫХ РАСТВОРОВ ЭЛЕКТРОЛИТОВ
Цель работы. Ознакомиться с основными свойствами растворов. Определить «кажущуюся» степень диссоциации сильного электролита.
Основные понятия. Раствор, степень диссоциации, изотонический коэффициент.
Оборудование. Электроплитка, термометры, колба, пробка с обратным холодильником, кристаллизатор, весы.
Реактивы. NaCl тв.
Краткие теоретические положения
Раствором называется однофазная система, образованная двумя или более компонентами и способная в известных пределах к непрерывному изменению состава.
Свойства растворов, которые не зависят от природы растворенного вещества, а определяются числом частиц в растворе,
называются коллигативными свойствами. К
К
27
ним относят осмотическое давление, понижение давления насыщенного пара над раствором, а также повышение температуры кипения и понижение температуры замерзания растворов.
Если к растворителю с температурой кипения T0 прибавить нелетучее вещество, то давление пара понизится. Чтобы этот раствор закипел, т.е. чтобы давление пара над раствором стало равным внешнему давлению, его следует нагреть до более высокой температуры T1, чем чистый растворитель. Повышение температуры кипения Ткип = T1 – T0 можно рассчитать по закону Рауля, согласно которому
Ткип = Eэб∙Сm, | (5.1) |
где Ткип – повышение температуры кипения; |
|
Сm – моляльная концентрация раствора; Eэб – эбулиоскопическая константа.
Закон Рауля для случая замерзания раствора записывается
аналогично: |
|
Тзам = Eкр∙Сm, | (5. |
где Eкр – криоскопическая константа.
Eэб и Eкр – коэффициенты пропорциональности, численное значение которых зависит от природы растворителя.
В таблице 8 приведены значения этих констант для некоторых растворителей.
Таблица 8 – Значения криоскопической и эбулиоскопической констант некоторых растворителей
Растворитель | Eкр | Eэб | Растворитель | Eкр | Eэб |
Вода | 1,85 | 0,52 | Ацетон | 2,40 | 1,48 |
Бензол | 5,10 | 2,57 | Уксусная кислота | 3,90 | 3,10 |
Циклогексан | 20,20 | 2,75 | Фенол | 7,30 | 3,60 |
Законы Рауля справедливы для растворов неэлектролитов. Если растворенное вещество является электролитом и распадается в растворе на ионы, то число частиц в растворе увеличивается. Поэтому в растворах электролитов понижение давления насыщенного пара, понижение температуры замерзания, повышение температуры кипения больше, чем в растворе неэлектролитов с той же моляльной концентрацией.
Если растворенное вещество является электролитом и распадается в растворе на ионы, то число частиц в растворе увеличивается. Поэтому в растворах электролитов понижение давления насыщенного пара, понижение температуры замерзания, повышение температуры кипения больше, чем в растворе неэлектролитов с той же моляльной концентрацией.
28
Для разбавленных растворов электролитов закон Рауля принимает вид
Ткип = i∙Eэб∙Сm ; Тзам = i∙Eкр∙Сm, (5.3)
где i – изотонический коэффициент Вант-Гоффа.
По этим уравнениям для слабых электролитов можно вычислить изотонический коэффициент i, следовательно, и степень
диссоциации α, так как |
|
| |||
| i 1 |
| , | (5.4) | |
n 1 | |||||
|
|
| |||
где n – число частиц, на которые распадается электролит при диссоциации.
Для сильных электролитов можно вычислить только «кажущуюся» степень диссоциации αкаж, так как степень диссоциации сильных электролитов в разбавленных растворах равна 1 и, казалось бы, что i = n. Но в действительности i < n, так как между ионами в растворе существует электростатическое взаимодействие.
Ход работы
Перед началом работы рассчитать и приготовить 5- и 1- моляльные растворы поваренной соли.
Опыт 1. Определение температуры кипения воды и 5- моляльного раствора поваренной соли
Задание выполняется на установке (рисунок 5).
1 |
|
|
|
|
|
| |
|
| 2 |
| Рисунок 5. Схема установки для определения | |||
|
|
|
|
|
| ||
|
|
|
|
|
| температуры кипения растворов: | |
|
|
|
|
|
| ||
3 |
| 1 | – обратный холодильник; | ||||
|
|
|
|
|
| 2 | – термометр; |
|
|
|
|
|
| 3 | – тонкостенная коническая колба; |
|
|
|
|
|
| 4 | – электроплитка |
|
|
|
|
| 4 | ||
|
|
|
|
| |||
В колбу налить 100 мл дистиллированной воды и бросить несколько кусочков битого стекла или фарфора для равномерного кипения раствора. Включить электроплитку. Проследить за процессом нагрева воды до кипения. Через 2-3 мин после начала ки-
Включить электроплитку. Проследить за процессом нагрева воды до кипения. Через 2-3 мин после начала ки-
29
пения записать температуру, которую показывает термометр. Измеренную температуру кипения воды сопоставить с таковой при нормальных условиях.
Аналогично определить температуру кипения 5-моляльного раствора поваренной соли. По полученным данным рассчитать «кажущуюся» степень ионизации поваренной соли в воде. Данные занести в таблицу 9.
Таблица 9 – Эбулиоскопическое определение кажущейся степени диссоциации соли
Ткип (Н2О) | Ткип (р-ра NaCl) | ∆Ткип | i | αкаж |
|
|
|
|
|
Опыт 2. Определение температуры замерзания воды и 1- моляльного раствора поваренной соли
Задание выполняется на установке (рисунок 6).
3
Рисунок 6. Схема установки для определения 2 температуры замерзания растворов:
1 – кристаллизатор с охлаждающей смесью;
2 – стакан с водой или раствором;
13 – термометр
Вкристаллизаторе приготовить охлаждающую смесь, состоящую из снега (льда) и поваренной соли в пропорциях: 3-5 столовых ложек соли на 5-8 ложек снега (льда). В стакан налить 10 мл дистиллированной воды и поместить его в охлаждающую смесь. Помешивая воду термометром (осторожно, чтобы не разбить термометр), определить температуру замерзания воды.
В стакан налить 10 мл дистиллированной воды и поместить его в охлаждающую смесь. Помешивая воду термометром (осторожно, чтобы не разбить термометр), определить температуру замерзания воды.
Температурой замерзания считать ту, которую покажет термометр после появления первых кристалликов льда в замораживаемой жидкости. Измеренную температуру замерзания воды сопоставить с таковой при нормальных условиях.
Аналогично определить температуру замерзания 1- моляльного раствора поваренной соли. По полученным данным
30
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
01.04.201511.72 Mб76Учебное пособие по гидравлике.doc
- #
01.04.201520.81 Mб137Учебное пособие по Н.Г.doc
- #
14.03.20166.18 Mб43Учебное пособие по Н.Г.pdf
- #
01.04.20156.54 Mб220Учебное пособие по начертательной геометрии.
 pdf
pdf - #
20.09.2019178.18 Кб1Федя записка.doc
- #
14.03.20161.16 Mб36ФизХим_лаборат.pdf
- #
14.03.2016656.06 Кб15ФизХим_лекции.pdf
- #
14.03.2016762.72 Кб5ФизХим_приборы.pdf
- #
14.03.2016556.6 Кб9ФизХим_рабочая тетрадь.pdf
- #
14.03.2016946.16 Кб29ФизХим_решен_задач.pdf
- #
01.04.2015164.46 Кб38Философия к семинарам для бакалавров.doc
Почему буферные растворы препятствуют изменению pH раствора Что является основным доказательством того
Почему буферные растворы препятствуют изменению pH раствора? Что является основным доказательством того, что данный раствор проявляет буферное действие? Каково биологическое значение буферных смесей? Приведите примеры буферных растворов, встречающихся в живых организмах. Рассчитайте pH буферного раствора по данным таблицы (концентрация кислоты и соли одинаковы) или соотношение объемов растворов кислоты и соли (концентрации равные) в буферной смеси с величинами pH, представленными в таблице.
Рассчитайте pH буферного раствора по данным таблицы (концентрация кислоты и соли одинаковы) или соотношение объемов растворов кислоты и соли (концентрации равные) в буферной смеси с величинами pH, представленными в таблице.
№ задачи
Буферная смесь
Количество кислоты, мл
Количество соли, мл
pH буферной смеси
64 ацетатная
? 4 4,33
Решение:
Растворы, содержащие одновременно какую-либо слабую кислоту и ее соль или какое-либо слабое основание, и его соль и оказывающие буферное действие, называют буферными растворами. Буферные растворы можно рассматривать как смеси электролитов, имеющих одноименные ионы. Присутствие в растворе слабой кислоты или слабого основания и их солей уменьшает влияние разбавления или действия других кислот и оснований на pH раствора.
Такими буферными растворами являются следующие смеси: Ch4COOH + Ch4COONa, Nh5OH + Nh5Cl, Na2CO3 + NaHCO3 и др.
В смесях водных растворов слабых кислот и их солей, а также в смесях слабых оснований и их солей концентрации ионов водорода и гидроксила зависят не от абсолютных количеств, а от соотношений кислоты или основания и их солей. Это значит, что величина [H+] в таких смесях не зависит от разбавления смеси. В самом деле, если подобную смесь разбавить в 10 раз, то в 10 раз уменьшится концентрация компонентов смеси, а соотношение кислоты или основания и их солей не изменится и величина [H+] останется постоянной. Свойство некоторых растворов сохранять неизменной концентрацию ионов водорода при разбавлении, а также, что будет показано ниже, при добавлении к ним небольших количеств сильных кислот или щелочей, известно под названием буферного действия.
Это значит, что величина [H+] в таких смесях не зависит от разбавления смеси. В самом деле, если подобную смесь разбавить в 10 раз, то в 10 раз уменьшится концентрация компонентов смеси, а соотношение кислоты или основания и их солей не изменится и величина [H+] останется постоянной. Свойство некоторых растворов сохранять неизменной концентрацию ионов водорода при разбавлении, а также, что будет показано ниже, при добавлении к ним небольших количеств сильных кислот или щелочей, известно под названием буферного действия.
Действие буферных растворов основано на том, что отдельные компоненты буферных смесей связывают ионы водорода или гидроксила вводимых в них кислот или оснований с образованием слабых электролитов. Например, если к буферному раствору, содержащему слабую кислоту и соль этой кислоты, прибавить сильное основание, то произойдет реакция образования слабого электролита — воды:
Вместо израсходованных ионов водорода, вследствие последующей диссоциации кислоты, появляются новые ионы водорода. В результате прежняя концентрация ионов в буферном растворе восстановится до ее первоначального значения.
В результате прежняя концентрация ионов в буферном растворе восстановится до ее первоначального значения.
Если к указанной буферной смеси прибавить сильную кислоту,то произойдет реакция
то есть ионы, образующиеся при электролитической диссоциации соли, соединяясь с ионами водорода прибавленной кислоты, образуют молекулы слабой кислоты. Поэтому концентрация ионов водорода от прибавления сильной кислоты к буферной смеси тоже практически не изменится.
Доказательством того, что данный раствор является буферным, является то, что pH среды мало меняется при добавлении в раствор сильных кислот и щелочей.
В живых организмах буферные системы поддерживают постоянство рН в крови и тканях. В процессе обмена в живом организме образуются большие количества кислых продуктов. Так, в организме человека за сутки образуется такое количество различных кислот, которое эквивалентно 20—30 л однонормальной сильной кислоты. Сохранение постоянства реакции внутри организма обеспечивается наличием в нем мощных буферных систем.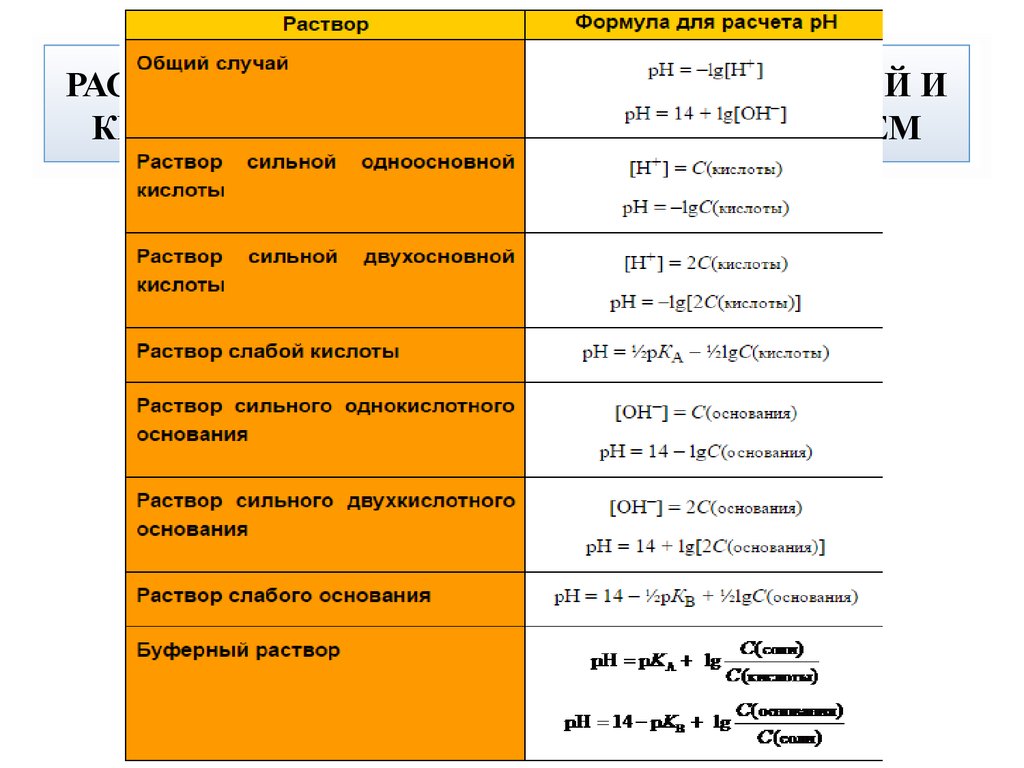 В организме человека особенно большую роль играют белковый, бикарбонатный и фосфатный буферы.
В организме человека особенно большую роль играют белковый, бикарбонатный и фосфатный буферы.
Буферной смесью крови является карбонатная смесь, состоящая из NaНСО3 и СО2, а также фосфатные смеси, состоящие из NaН2РО4 и Na2HPО4. Бикарбонатный буфер присутствует в крови также в довольно большой концентрации.
Наиболее мощными буферными системами крови являются так называемые гемоглобиновые буферы, которые составляют примерно 75% всей буферной емкости крови. Сущность действия этих буферных систем заключается в следующем: кислые продукты обмена веществ взаимодействуют с калиевой солью гемоглобина с образованием эквивалентного количества их калиевых солей и свободного гемоглобина, обладающего свойствами слабой органической кислоты. Таким образом, подкисления крови не происходит.
Углекислота, связанная с гемоглобином, в конечном итоге выделяется в воздух через легкие, однако сдвига рН крови в щелочную сторону не происходит, так как образующийся при этом оксигемоглобин значительно кислее гемоглобина.
Большое значение в поддержании постоянного рН внутри живых клеток имеет так называемый белковый буфер. Этот буфер состоит из протеина (Pt) и его соли, образованной сильным основанием Na или К. Компоненты этого буфера можно представить так: Pt—СООН — слабо диссоциирующая кислота, Pt—COONa — ее соль:
Рассчитайте соотношение объемов растворов кислоты и соли (концентрации равные) в буферной смеси с величиной pH, представленной в таблице.
№ задачи
Буферная смесь
Количество кислоты, мл
Количество соли, мл
pH буферной смеси
64 ацетатная
? 4 4,33
Решение:
pH ацетатного буферного раствора рассчитывается по формуле
,
где Ka – константа кислотной диссоциации уксусной кислоты
Ka = 4,76
На 0,37 объема раствора ацетата натрия взять 1 объем раствора кислоты. Так как объём раствора ацетата натрия 4 мл, то объём раствора уксусной кислоты равен 4/0,37 = 10,81 мл.
Ответ: V(Ch4COOH) = 10,81 мл.
Изменяется ли рН при разбавлении буфера?
PH буферного раствора не изменяется при разбавлении .
|
Полный ответ см. на сайте toppr.com
Как разбавление влияет на буферы?
Разбавление буферного раствора уменьшит его буферную емкость.
Запрос на удаление |
Полный ответ см. на сайте toppr.com
Почему разбавляющий буфер не влияет на pH?
Даже если вы разбавите буфер, концентрация H не станет меньше, потому что кислота в буфере постепенно диссоциирует, чтобы сохранить ее (почти) идентичной. Это эффект кислотно-щелочного равновесия.
Запрос на удаление |
Посмотреть полный ответ на quora.com
Влияет ли разбавление на pH?
При разбавлении количества кислоты или основания в растворе не изменяются, увеличивается объем раствора, поэтому концентрация уменьшается. pH увеличивается при разбавлении раствора кислоты.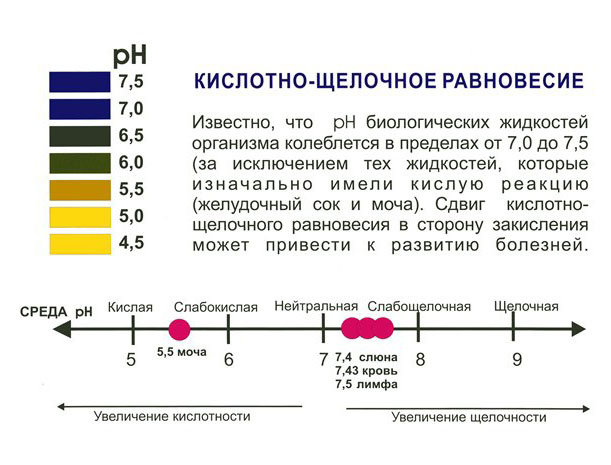
|
Полный ответ см. на сайте chemistryvce.weebly.com
Почему рН меняется после разбавления?
При разбавлении основания водой количество ионов ОН- в растворе в единице объема уменьшается. В результате снижается прочность основания и уменьшается рН раствора.
Запрос на удаление |
Посмотреть полный ответ на byjus.com
Как влияет добавление воды на pH буфера?
Почему pH увеличивается при разбавлении?
Разбавление кислоты снижает концентрацию ионов H+(aq), что увеличивает уровень pH раствора до 7, делая его менее кислым.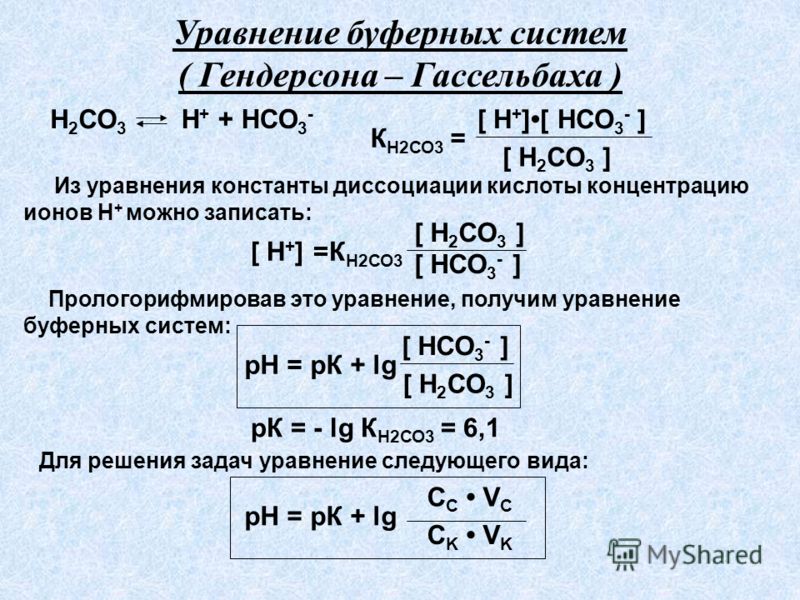
|
Полный ответ см. на сайте sciencing.com
Как определить рН буферного раствора после разбавления?
Не используйте уравнение pH=pKa+log([A-]/[HA]), имея в виду, что вы только что рассчитали новую концентрацию ([A-]/[HA]), поэтому просто замените его на 0,294, и вы должны получить новый рН должен быть 4,22 или 4,2.
Запрос на удаление |
Посмотреть полный ответ на chemistry.stackexchange.com
Снижает ли разбавляющее основание pH?
При разбавлении основного раствора добавлением к нему воды концентрация гидроксид-ионов уменьшается, а рН уменьшается.
Запрос на удаление |
См. полный ответ на aatbio.com
Оказывает ли разбавление водой небольшое влияние на pH буфера?
Разбавление водой не влияет на рН любого буфера. Это связано с тем, что рН буфера зависит от соотношения соли, кислоты или солевого основания, и разбавление не влияет на это соотношение.
Это связано с тем, что рН буфера зависит от соотношения соли, кислоты или солевого основания, и разбавление не влияет на это соотношение.
|
См. полный ответ на sarthaks.com
Как концентрация буфера влияет на рН?
Если в буфере больше основания, чем кислоты, больше OH 9Вероятно присутствие ионов 0072- и повышение pH. Если в буфере больше кислоты, чем основания, присутствует больше ионов H + , и pH падает. Когда концентрации A – и HA равны, концентрация H + равна K a (или эквивалентно pH = pK a ).
Запрос на удаление |
Полный ответ см. на сайте chemcollective.org
Что происходит с pH буферного раствора, когда его разбавляют в 10 раз?
pH буферного раствора остается неизменным при любом разбавлении.
Запрос на удаление |
См. полный ответ на сайте questionnut.com
полный ответ на сайте questionnut.com
Увеличивается ли рН при разбавлении кислоты?
При разбавлении кислого раствора водой концентрация ионов Н + уменьшается, а рН раствора увеличивается до 7.
Запрос на удаление |
Посмотреть полный ответ на bbc.co.uk
Что вы можете сказать о влиянии разбавления на pH буфера?
Как правило, разбавление НЕ влияет на рН. Почему это так? Если вы посмотрите на формулу буфера, pH = pKa + lg [соль]/[кислота], разбавление не влияет на соотношение [соль]/[кислота]. т. е. они разбавлены в той же степени, иначе их объем нейтрализуется.
Запрос на удаление |
Посмотреть полный ответ на mrkhemistry.com
Изменяется ли рН с концентрацией?
Если в раствор добавить кислоту, концентрация ионов водорода (кислотность) увеличится, а рН уменьшится.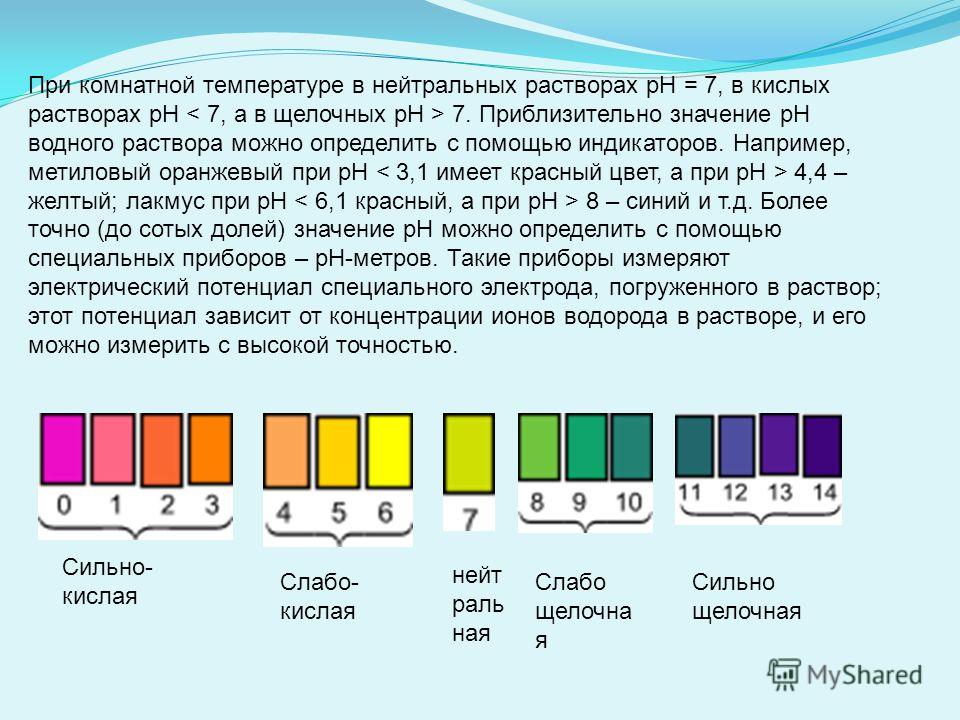
|
Полный ответ см. на pmel.noaa.gov
Что происходит, когда вы добавляете HCl в буферный раствор?
Когда к этой буферной системе добавляется HCl (сильная кислота), дополнительные ионы H+, добавленные в систему, поглощаются Nh4 с образованием Nh5+. Теперь, поскольку все дополнительные ионы H+ заперты и образовали более слабую кислоту, Nh5+, pH системы существенно не меняется.
Запрос на удаление |
Посмотреть полный ответ на westlab.com
Как изменяется рН при разбавлении раствора кислоты?
рН раствора кислоты увеличивается при его разбавлении за счет уменьшения концентрации ионов Н+.
Запрос на удаление |
Полный ответ см. на сайте toppr.com
Почему pH не меняется в буферном растворе?
Буферные растворы — это растворы, устойчивые к изменению pH при добавлении небольшого количества кислоты или основания.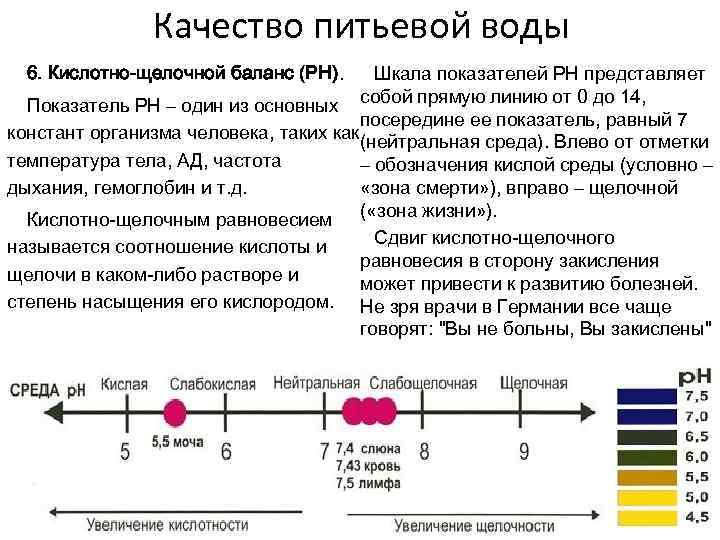 Это возможно, потому что они содержат кислотный компонент, HA, для нейтрализации OH 9.0072 – и основной компонент А – для нейтрализации ионов Н + . Поскольку K a является константой, то [H + ] будет напрямую зависеть от отношения [HA]/[A – ].
Это возможно, потому что они содержат кислотный компонент, HA, для нейтрализации OH 9.0072 – и основной компонент А – для нейтрализации ионов Н + . Поскольку K a является константой, то [H + ] будет напрямую зависеть от отношения [HA]/[A – ].
|
Полный ответ см. на butane.chem.uiuc.edu
Как настроить pH буфера?
Вы можете изменить рН буферного раствора, изменив соотношение кислоты и соли или выбрав другую кислоту и одну из ее солей. Примечание. Если у вас есть очень слабая кислота и одна из ее солей, это может привести к получению буферного раствора, который на самом деле является щелочным!
Запрос на удаление |
См. полный ответ на chemguide.co.uk
Как разбавление влияет на pH буфера, объясните с помощью уравнения Хендерсона-Хассельбаха?
Ответ и объяснение: Разбавление не влияет на pH раствора, потому что в него не добавляют кислоту или основание, которые либо снижают, либо увеличивают кислотные и основные компоненты буфера. Рассмотрим приведенное ниже уравнение Хендерсона-Хассельбаха для буфера, содержащего HA и A−. Смотрите полный ответ ниже.
Рассмотрим приведенное ниже уравнение Хендерсона-Хассельбаха для буфера, содержащего HA и A−. Смотрите полный ответ ниже.
|
См. полный ответ на сайте homework.study.com
Снижает ли буфер pH pH?
Буферы стабилизируют рН раствора в диапазоне концентраций ионов водорода и наиболее эффективны, когда рН раствора близок к рКа буфера. Буферная емкость также зависит от концентрации буфера. Буферы лучше всего работают в разных диапазонах pH.
Запрос на удаление |
Посмотреть полный ответ на cwsnaturally.com
Поддерживают ли буферы постоянный уровень pH?
Диапазон буфера — это диапазон рН, в котором буфер эффективно нейтрализует добавленные кислоты и основания, поддерживая при этом относительно постоянный рН.
Запрос на удаление |
См. полный ответ на chem.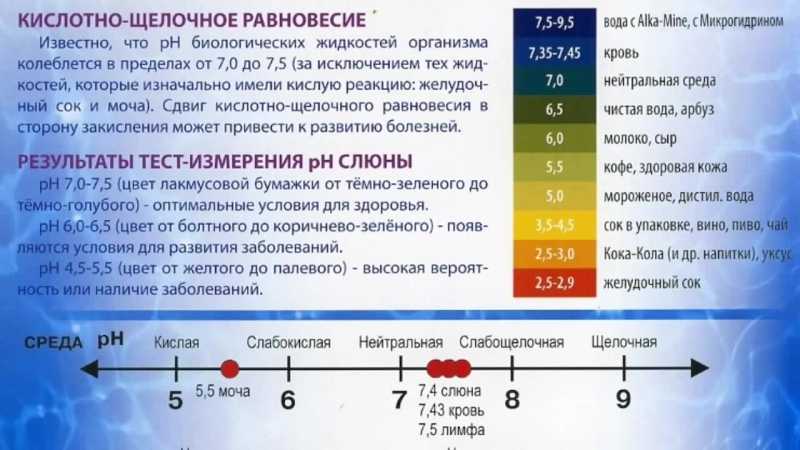 libretexts.org
libretexts.org
Как влияет рН разбавления и буферная емкость буферного раствора?
Строго говоря, разбавление влияет на pH буфера, поскольку влияет на положение равновесия HA+h3O-⇀↽-A-+h4O+. Однако эффект на самом деле очень мал, поэтому обычно говорят, что pH не меняется.
Запрос на удаление |
Посмотреть полный ответ на chemistry.stackexchange.com
Как влияет разбавление на pH основного раствора?
При разбавлении раствора щелочи концентрация гидроксид-ионов уменьшается. Это приводит к снижению рН щелочи до 7. Это делает раствор менее щелочным. Это означает, что pH уменьшается при разбавлении щелочного раствора.
Запрос на удаление |
Посмотреть полный ответ на vedantu.com
Как буферный раствор регулирует и поддерживает pH образца?
Буферные растворы поддерживают стабильный рН за счет нейтрализации добавленных кислот или оснований. Они состоят из слабой кислоты и сопряженного с ней основания, которые обмениваются протонами и гидроксид-ионами с образованием воды. Уравнение Хендерсона-Хассельбаха выражает рН как функцию РКа и отношения концентраций основания и кислоты.
Они состоят из слабой кислоты и сопряженного с ней основания, которые обмениваются протонами и гидроксид-ионами с образованием воды. Уравнение Хендерсона-Хассельбаха выражает рН как функцию РКа и отношения концентраций основания и кислоты.
|
Посмотреть полный ответ на сайте khanacademy.org
← Предыдущий вопрос
Что значит слизь для мальчика?
Следующий вопрос →
Используют ли профессионалы более короткие драйверы?
кислотно-щелочное – Влияет ли разбавление буфера на рН?
спросил
Изменено 2 года, 9 месяцев назад
Просмотрено 52к раз
$\begingroup$
Уравнение Хендерсона-Хассельбаха для $\mathrm{pH}$ буферного раствора моноосновной кислоты $\ce{HA}$ имеет вид
$$\mathrm{pH}=\mathrm pK_\mathrm a+\log{\frac{[\ce{A-}]}{[\ce{HA}]}}$$
Поскольку концентрация стоит как в числителе, так и в знаменателе дроби $\frac{[\ce{A-}]}{[\ce{HA}]}$, а $\mathrm pK_\mathrm a$ постоянна (при фиксированном температура), оказывается, что разбавление раствора чистым $\ce{h3O}$ не изменит $\mathrm{pH}$. Однако, поскольку
$$\mathrm{pH}=-\log{[\ce{H+}]}$$
количество вещества $\ce{H+}$ должно увеличиваться, чтобы $\mathrm{pH}$ оставался постоянным при разбавлении.
Однако, поскольку
$$\mathrm{pH}=-\log{[\ce{H+}]}$$
количество вещества $\ce{H+}$ должно увеличиваться, чтобы $\mathrm{pH}$ оставался постоянным при разбавлении.
Откуда берется этот дополнительный $\ce{H+}$? Я знаю, что разбавление кислоты вызывает ее диссоциацию в большей степени. Но в то же время вы бы разбавляли его сопряженное основание и заставляли бы его больше ассоциироваться, отменяя диссоциацию кислоты.
- кислотно-щелочной
- аналитическая химия
- ph
$\endgroup$
2
$\begingroup$
В уравнении Хендерсона-Хассельбаха $K_\mathrm{a}$ является произведением концентраций и считается константой.
На самом деле $K_\mathrm{a}$, определяемый как произведение концентраций, не является константой:
При разбавлении (уменьшении ионной силы) $\mathrm{p}K_\mathrm{ a}$ изменится, а значит, изменится и pH раствора.
 2)
2)