Сколько заправлять пропана в баллон в литрах и киллограммах
07.06.2023
Время чтения: минут
-
Оглавление статьи:
- Особенности конструкции баллона с пропаном
- Сколько пропана в баллоне 50 литров?
- Сколько кг пропана в баллонах разного объема?
- Сколько м3 пропана в баллонах разного объема?
- Сколько заправлять пропана в баллон?
- Правила безопасности использования пропановых баллонов
- Сколько стоит пропановый баллон и где его купить?
- Часто задаваемые вопросы
Баллоны с пропаном имеют различные применения в разных областях. Вот несколько основных причин, по которым они могут быть нужны:
- Используются в бытовых газовых плитах, грилях и кемпинговых плитах для приготовления пищи на открытом воздухе или в местах, где нет доступа к электричеству.
- В некоторых случаях пропановые баллоны могут использоваться для отопления помещений, особенно в местах, где нет централизованной системы отопления или электричества.

- Баллоны с пропаном могут применяться в системах водонагрева для обогрева воды в домах или других объектах.
- Пропановые баллоны могут использоваться для питания мобильных устройств, таких как генераторы и костровые печи, на кемпинге, пикниках, в походах и других отдаленных местах.
- В промышленности пропановые баллоны могут применяться в различных процессах, таких как пайка металла, нагрев, плавление и т.д.
- Пропановые баллоны используются в автономных газовых системах (ГБО) для автомобилей, работающих на пропане.
Баллоны с газом могут быть разного объема
Особенности конструкции баллона с пропаном
Пропановые баллоны — это металлические емкости, предназначенные для хранения и транспортировки пропана или смеси пропана и бутана под давлением. Они состоят из нескольких основных элементов.
Основной корпус баллона обычно изготовлен из высокопрочной стали или алюминия. Он способен выдерживать высокое давление газа, обеспечивая безопасность хранения и транспортировки.
На верхней части баллона располагается заправочный клапан, через который осуществляется заправка пропана. Клапан обычно имеет резьбовое соединение для подключения газового оборудования или регулятора давления.
Заправочный клапан часто закрывается защитным колпачком, который предотвращает случайное открытие клапана и обеспечивает дополнительную защиту от утечки газа.
На баллоне могут быть нанесены различные маркировки и метки, указывающие на тип газа, давление, емкость, сертификацию и другую информацию, необходимую для безопасного использования.
Пропановые баллоны обычно оснащены защитным клапаном, который регулирует давление внутри баллона. Если давление превышает допустимые пределы, защитный клапан автоматически срабатывает, выпуская излишнее давление и предотвращая возможные аварийные ситуации.
Баллоны имеют особую конструкцию для обеспечения безопасной эксплуатации
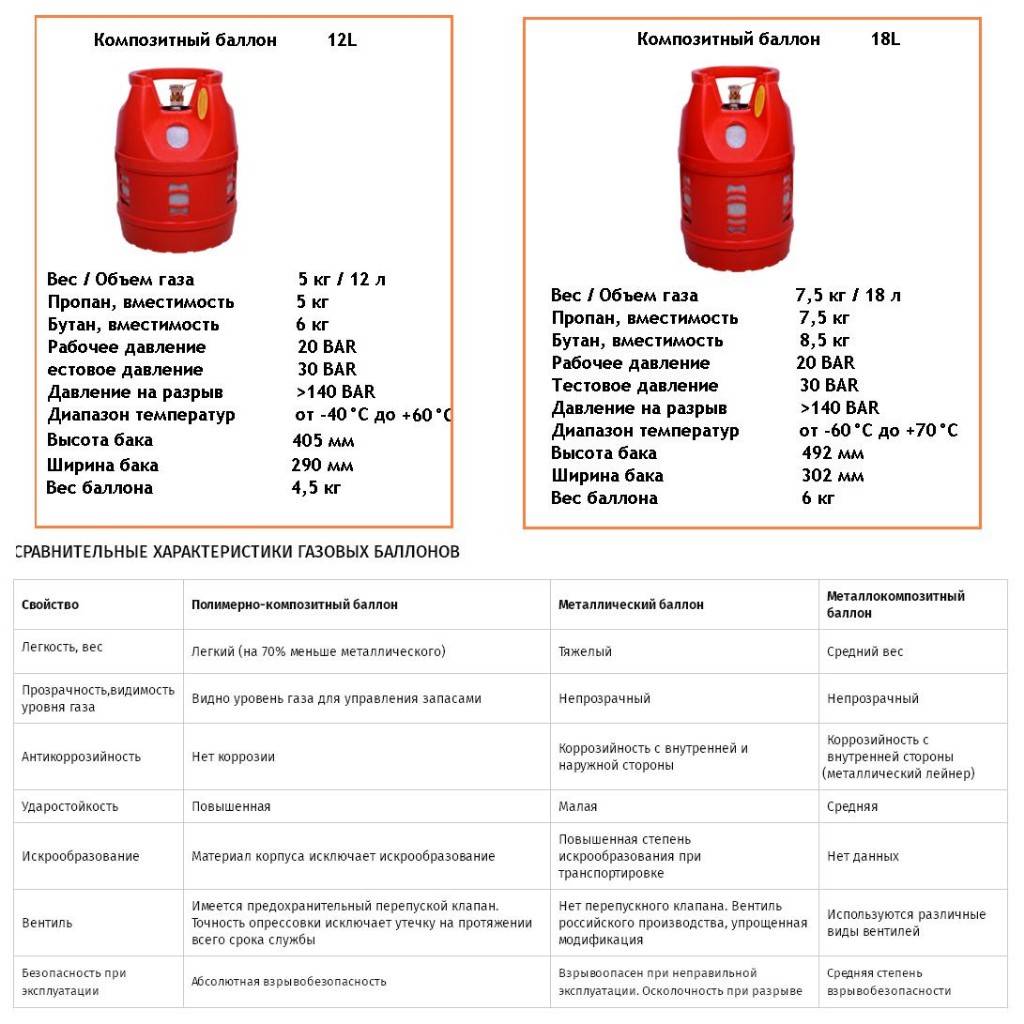
Сколько пропана в баллоне 50 литров?
Чтобы перевести объем пропана из литров в килограммы, необходимо знать плотность пропана при заданных условиях. Обычно пропан имеет плотность около 0,51 кг/л при нормальных условиях (температура 25°C и давление 1 атмосфера).
Обычно пропан имеет плотность около 0,51 кг/л при нормальных условиях (температура 25°C и давление 1 атмосфера).
Таким образом, для баллона вместимостью 50 литров, содержащего пропан, можно примерно ожидать массу газа около 21,68 кг, с учетом того, что баллон заполняется на 85 %.
Однако плотность пропана может незначительно варьироваться в зависимости от температуры и давления. Для получения точной информации о массе пропана в баллоне рекомендуется обратиться к производителю или поставщику пропана, так как они могут предоставить более точные данные для конкретного баллона и условий использования.
Сколько кг пропана в баллонах разного объема?
Чтобы определить примерную массу пропана в баллоне различного объема, воспользуемся плотностью пропана, равной примерно 0,51 кг/л при нормальных условиях (температура 25°C и давление 1 атмосфера).
Вот примерные значения для разных объемов баллонов с учетом того, что баллон заправляется на 85 %:
|
Объем баллона |
Масса пропана |
|
Баллон на 5 литров |
2 кг |
|
Баллон на 12 литров |
5,20 кг |
|
Баллон на 27 литров |
11,65 кг |
|
Баллон на 50 литров |
21,68 кг |
Сколько м3 пропана в баллонах разного объема?
Для определения объема пропана в баллонах разного объема, необходимо учесть, что пропан является сжимаемым газом и его объем зависит от давления и температуры. Обычно объем пропана измеряется в стандартных условиях (нормальных условиях), которые предполагают температуру 25°C и давление 1 атмосфера.
Обычно объем пропана измеряется в стандартных условиях (нормальных условиях), которые предполагают температуру 25°C и давление 1 атмосфера.
Вот примерные значения объема пропана в баллонах разного объема при нормальных условиях:
|
Объем баллона |
Кубометров газа |
Литров жидкого газа |
|
Баллон на 5 литров |
0,005 м3 |
4,25 |
|
Баллон на 12 литров |
0,012 м3 |
10,2 |
|
Баллон на 27 литров |
0,027 м3 |
22,9 |
|
Баллон на 50 литров |
0,05 м3 |
42,5 |
Сколько заправлять пропана в баллон?
Количество пропана, которое следует заправлять в баллон, зависит от его вместимости и требований безопасности. Обычно рекомендуется не заполнять баллон полностью, чтобы оставить некоторое пространство для расширения газа под воздействием температурных изменений.
Обычно рекомендуется не заполнять баллон полностью, чтобы оставить некоторое пространство для расширения газа под воздействием температурных изменений.
Стандартная практика состоит в заправке баллона на 80-85% его полной емкости. Это означает, что для баллона определенного объема (например, 5 литров, 12 литров, 27 литров или 50 литров) следует заправить его примерно на 4-4,2 литра, 9,6-10,2 литра, 21,6-22,95 литра или 40-42,5 литров соответственно.
Если вы не уверены, как правильно заправить баллон, рекомендуется обратиться к квалифицированному специалисту или поставщику пропана для получения конкретных рекомендаций.
Правила безопасности использования пропановых баллонов
Использование пропановых баллонов требует соблюдения определенных правил безопасности. Вот несколько основных рекомендаций:
- Баллоны с пропаном должны храниться и транспортироваться в вертикальном положении, укреплены в стабильном состоянии и защищены от физических повреждений, непосредственного солнечного света и высоких температур.

- Перед использованием необходимо визуально проверить баллон на наличие повреждений, трещин, протечек или иных неисправностей. Не использовать баллон, если он поврежден или старый.
- Правильно установите баллон на стабильной поверхности в соответствии с инструкциями производителя. При подключении баллона к газовому оборудованию используйте правильные соединительные трубки, арматуру и регуляторы давления, соответствующие требованиям безопасности и местным нормам.
- Обеспечьте хорошую вентиляцию в месте использования пропанового оборудования, особенно внутри помещений. Пропан является горючим газом и может вызывать опасность задыхания в случае недостатка воздуха или неправильной вентиляции.
- Соблюдайте предосторожность и правила пожарной безопасности при использовании пропанового оборудования. Держите баллоны и оборудование на безопасном расстоянии от источников тепла, открытого огня или возгораемых материалов.

- Будьте внимательны и осторожны при работе с пропановым оборудованием. Избегайте резких движений, не ставьте баллоны на горячие поверхности и не переворачивайте их.
При покупке пропанового баллона обязательно обращайтесь к лицензированным и надежным поставщикам, чтобы гарантировать качество и соответствие безопасности
Сколько стоит пропановый баллон и где его купить?
Стоимость пропановых баллонов может варьироваться в зависимости от месторасположения, поставщика и других факторов. Цены могут меняться со временем, поэтому рекомендуется обратиться к местным поставщикам пропана для получения актуальной информации о ценах.
Пропановые баллоны можно приобрести в различных местах, включая:
- Специализированные магазины: Есть магазины, которые специализируются на продаже газового оборудования и материалов, включая пропановые баллоны. Проверьте местные специализированные магазины в вашем регионе.
- Газовые компании: Крупные газовые компании, предоставляющие услуги по поставке пропана, могут также продавать пропановые баллоны.
 Обратитесь к специалистам компании “Еврогаз” для получения информации о покупке баллонов.
Обратитесь к специалистам компании “Еврогаз” для получения информации о покупке баллонов. - Интернет-магазины: Возможно приобрести пропановые баллоны через онлайн-магазины, которые специализируются на продаже газового оборудования и аксессуаров. При поиске в мнтернете обратите внимание на надежность и репутацию продавца.
Часто задаваемые вопросы
Сколько пропана в баллоне 50 литров?
Точное количество пропана в баллоне зависит от внешних факторов. При этом пропановый баллон объемом 50 литров содержит примерно 0,05 кубометров или 21,68 кг пропана.
Сколько заправлять пропана в баллон?
Для обеспечения безопасной эксплуатации рекомендуется заправляйть пропан в баллон на 80-85 % от его полной емкости.
ПОДЕЛИТЬСЯ:
Заправка бытовых пропановых баллонов 50 литров по выгодным ценам от Пропан Премиум
Заправка бытовых пропановых баллонов 50 литров по выгодным ценам от Пропан Премиум ПРОПАН ПРЕМИУМстоимость сжиженного углеводородного газа для газгольдера
Воспользуйтесь возможностью обсудить индивидуальные цены в зависимости от объема и удаленности пункта доставки!
цена сегодня тел: 8 (495) 999-68 -96
Объем | Стоимость | Место |
СПБТ более 6000 л. | Стоимость по запросу Цена на газ для газгольдера НЕСТАБИЛЬНА. Уточняйте у менеджера стоимость за литр газа | км |
| СПБТ более 4500 л. | Стоимость по запросу Цена на газ для газгольдера НЕСТАБИЛЬНА. Уточняйте у менеджера стоимость за литр газа | до 60 км |
| СПБТ от 2500л. – 4500 л. | Стоимость по запросу Цена на газ для газгольдера НЕСТАБИЛЬНА. Уточняйте у менеджера стоимость за литр газа | до 60 км |
| СПБТ от 2000л. до 2500 л. | Стоимость по запросу | до 60 км |
При заключении договора на поставку более 6000 литров – специальная цена обсуждается индивидуально тел: 8 (495) 999-68 -96 | ||
Менеджеры – 8(495) 960-03-23 cайт: www. | ||
Пропан ПремиумНужен пропан – значит Вам к нам!
Доставка газа,
заправка газгольдеров
Прием заказов ежедневно с 7:00 до 22:00
Время работы склада: пн-пт с 10:00 до 21:00
Время работы офиса: пн-пт с 9:00 до 18:00
Заказать заправку газгольдера
– 8(495)999-68-96
Заказать доставку баллонов с газом
– 8(495)661-22-00
Отправить заявку на электронную почту
[email protected]
Пункт самовывоза баллонов: г. Москва, Булатниковская улица, 22, строение 6
СДЕЛАЙТЕ ЗАПАСЫ ГАЗА В НЕСТАБИЛЬНОЕ ВРЕМЯ. СТОИМОСТЬ ГАЗА ИЗМЕНЧИВА, УСПЕЙТЕ ЗАПРАВИТЬ ГАЗГОЛЬДЕР ПО ВЫГОДНЫМ ЦЕНАМ КАЧЕСТВЕННЫМ ГАЗОМ С ВЫСОКИМ СОДЕРЖАНИЕМ ПРОПАНА, ЗАКАЗАВ У НАС СЕГОДНЯ ЗАПРАВКУ ГАЗГОЛЬДЕРА СЕРТИФИЦИРОВАННЫМ ПРОПАНОМ, ВЫ ЗНАЧИТЕЛЬНО СОКРАЩАЕТЕ СВОИ РАСХОДЫ. БУДЬТЕ С НАМИ НА СВЯЗИ, ЧТОБЫ ВОСПОЛЬЗОВАТЬСЯ ВОЗМОЖНОСТЬЮ ОБСУДИТЬ ИНДИВИДУАЛЬНУЮ ЦЕНУ НА ГАЗ! МЫ ВЫБИРАЕМ ТОЛЬКО КАЧЕСТВЕННЫЙ ГАЗ ДЛЯ ВАШЕЙ АВТОНОМНОЙ СИСТЕМЫ ГАЗИФИКАЦИИ! В ПРАЗДНИКИ И ВЫХОДНЫЕ МЫ С ВАМИ НА СВЯЗИ – ЗВОНИТЕ! ОБСУДИМ УДОБНОЕ ДЛЯ ВАС ВРЕМЯ ДОСТАВКИ! ЧЕМ БОЛЬШЕ ОБЪЕМ ПОСТАВКИ, ТЕМ ЦЕНА НА СЖИЖЕННЫЙ ГАЗ ДЕШЕВЛЕ! ОФОРМЛЯТЬ ЗАЯВКУ ЖЕЛАТЕЛЬНО ЗАРАНЕЕ, КОГДА ОСТАТОК ГАЗА В ГАЗГОЛЬДЕРЕ НЕ МЕНЕЕ 20%.
Стоимость по запросу
ЦЕНА НА ГАЗ ДЛЯ ГАЗГОЛЬДЕРАНЕСТАБИЛЬНА
уточняйте у менеджера
СТОИМОСТЬ ЗА ЛИТР ГАЗА
С УЧЕТОМ ДОСТАВКИ
Доставка газа в баллонах
Транспортировка баллонов
Шкафы для баллонов
Заправка газгольдеров
Автономная газификация
Оборудование для дома и дачи
Проекты частных домов
- Главная /
- Заправка баллонов пропаном /
- Баллон пропановый 50 литров
Источник 120000 литров 120 м3 б/у резервуар для хранения сжиженного нефтяного газа баллоны с пропаном 13020*3740*3240 мм на m.alibaba.com
Обзор
Детали
Отправить запрос
Чат сейчас
90 010 Trade AssuranceВстроенная служба защиты заказов на alibaba.com
Качество продукции Своевременная доставкаПодробнее о доставке и других торговых услугах.
Варианты
Номер модели: 1
CLW9633
Индивидуальные настройки
Индивидуальный логотип
1 шт. (MOQ)
(MOQ)
Индивидуальная упаковка
1 шт. (MOQ)
Графическая настройка
1 шт. (MOQ)
Дизайн корпуса в соответствии с вашим шасси 900 03
1 шт. (MOQ)
продукция ваше изображение автомобиля
1 шт. (MOQ)
| Порт: | главный порт Китая |
| Условия оплаты: | L/C, T/T | 9005 4
| Возможность поставки: | 200 комплектов в месяц |
| Размеры (Д*Ш*В): | 13020*3740*3240 |
| Гарантия на основные компоненты: | 1 год 9 0051 |
| Внешний материал: | углеродистая сталь |
| Основные преимущества: | Простота в эксплуатации |
| Вместимость: | Индивидуальные, 120 м3 |
| Рабочая температура (℃): 9005 1 | -50 – 50 ℃ |
| Максимальное рабочее давление (МПа) : | 1,61 МПа |
| Протокол испытаний оборудования: | Прилагается |
| Состояние: | Новый |
| Пропан | |
| Место происхождения: | Хубэй, Китай |
| Гарантия: | 1 год |
| Стандартный дизайн: | GB150 AMSE |
| Цвет: | дополнительно | 9005 4
| Объем (м³): | 100 |
| Расположение выставочного зала: | Нет |
| Материал: | Q345R |
| 1,61 | |
| Вес: | 36132 |
| Сертификация: | ISO9001 CCC CE ASME |
| Фирменное наименование: | CLW |
| Видео выходного контроля: | Прилагается | 900 54
| Тип: | Резервуар для хранения грунта |
| Применимые отрасли: | Гостиницы, производственные предприятия, фермы, розничная торговля, строительные работы, энергетика и горнодобывающая промышленность, рекламная компания |
| Основные компоненты: | 9 0050 Подшипник, Насос|
| Маркетинг Тип: | Обычный продукт |
| Наименование продукта: | Использованный баллон с пропаном |
| Среда: | LO2/LCO2/LAr/LN2 | 9005 4
| Внутренний материал: | Углеродистая сталь |
| Применение: | Хранение сжиженного нефтяного газа |
| Детали упаковки: | Обнаженная упаковка, макс. , погрузка в контейнер, судно Roro, судно , погрузка в контейнер, судно Roro, судно | 9 0054
Время выполнения заказа
15 дней
CNManufacturer≤4hВремя ответа
240,000$+5 Транзакции
100,0% Своевременная доставка
ChemTeam: Стехиометрия: Объем (газа) Примеры
ChemTeam: Стехиометрия: Объем (газа) ПримерыСтехиометрия
Объем-объем Примеры
(объем газа, а не раствора)
Датчики №1–10
Вернуться в меню стехиометрии
Краткое введение: Ключевым моментом, на который следует обратить внимание, являются условия температуры и давления. Если они остаются постоянными, вы можете обращаться с объемами так же, как с родинками. Это связано с тем, что в условиях постоянных Т и Р объемы прямо пропорциональны молям. Это обсуждается в нескольких решениях проблем ниже.
Хотя подавляющее большинство задач стехиометрии на основе объема сформулированы в терминах постоянных T и P, это не обязательно. Вы можете увидеть это в задачах 1b и 9 чуть ниже. Если у вас есть изменяющиеся условия T и P, вы, в общем, будете делать так:
Вы можете увидеть это в задачах 1b и 9 чуть ниже. Если у вас есть изменяющиеся условия T и P, вы, в общем, будете делать так:
(1) Преобразовать объемы в моли, используя PV = nRT и исходный набор T и P
(2) Используйте отношение и пропорцию для определения молей другого вещества, связанного с проблемой.
(3) Используйте PV = nRT с новыми T и P, а также молями вещества из шага 2. Вы рассчитаете новый объем.
Будьте готовы! Ваш учитель может показать ситуацию, когда T и P не меняются, а затем проверить ситуацию, когда T и P меняются.
Пример №1: Уравнение сгорания метана:
CH 4 + 2O 2 —> 2H 2 O + CO 2
(a) Если на СТП сжечь 50,0 л метана, какой объем двуокиси углерода будет произведен на СТП?
(b) Если сжечь 50,0 л метана на НТП, какой объем газообразной воды образуется на НТП?
Решение (а):
Поскольку все происходит в STP, объемы прямо пропорциональны молям используемого реагента и произведенного продукта. Почему? Рассмотрим PV = nRT. Перепишите это как:
Почему? Рассмотрим PV = nRT. Перепишите это как:
н/В = П/РТВсе в правой части постоянно, поэтому отношение n:V также должно быть постоянным. Это означает, что объем прямо пропорционален количеству молей газа.
Поскольку существует молярное соотношение 1:1 между CH 4 и CO 2 , ответ 50,0 л
Решение (б):
1) Используйте PV = nRT для определения молей метана:
(1,00 атм) (50,0 л) = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (298 К)n = 2,044665 моль
Примечание: в этой задаче я принимаю комнатную температуру равной 25,0 °C, поскольку RTP означает комнатную температуру и давление.
2) Используйте молярное соотношение метан:вода:
1 к 2 как 2,044665 моль к хх = 4,08933 моль произведенной воды
3) Используйте PV = nRT для расчета объема водяного пара при нормальных условиях:
(1,00 атм) (V) = (4,08933 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (273 K)В = 91,6 л (до трех цифр)
Пример #2: Учитывая следующее уравнение:
C(т) + 2H 2 (г) —> CH 4 (г)
Сколько литров водорода необходимо для производства 20,0 л метана?
Решение:
1) P и T не являются частью этой задачи:
Это потому, что в задаче вообще не упоминаются Т или Р.Мы должны считать их постоянными. Если мы предположим, что они изменились, но не знаем значений, проблема не может быть решена.
2) Сформулируйте гипотезу Авогадро (используя моли, а не молекулы):
Равные объемы газа при одинаковых температуре и давлении содержат одинаковое число молей
3) Укажите молярное соотношение водорода и метана:
2:1
4) Используйте соотношение и пропорцию:
2 моля водорода соответствует 1 молю метана, поскольку x литров водорода соответствует 20,0 л метанах = 40,0 л водорода
Пример #3: 2,35 л газообразного кислорода реагирует с 3,72 л газообразного водорода, образуя воду. Сколько литров лишнего реагента останется? Если бы на самом деле было произведено 2,50 л воды, каков был бы выход в процентах?
Решение:
1) Сбалансированное химическое уравнение:
2Н 2 + О 2 —> 2Н 2 О
2) Определите лимитирующий реагент:
кислород: 2,35/1 = 2,35
водород: 3,72/2 = 1,86Водород является лимитирующим реагентом.
Обратите внимание, что в задаче не упоминается ни температура, ни давление. Это означает, что все происходит при неизменной температуре и давлении. Следовательно, эти два значения остаются постоянными и выпадают из рассмотрения. Нам не нужны моли, потому что в ситуации постоянной температуры и давления объемы прямо пропорциональны количеству молей.
Кроме того, мы не можем даже вычислить моли, так как не знаем ни температуры, ни давления.
3) Использовать H 2 :O 2 молярное соотношение:
2 равно 1, как 3,72 равно xИспользуется 1,86 л кислорода.
2,35 − 1,86 = 0,49 л непрореагировавшего кислорода остается
4) Выход в процентах:
Производится 3,72 л воды.2,50 / 3,72 = 67,2%
Пример #4: Сколько воздуха необходимо (в м 3 , при 25,0 °C, 1,00 атм) для полного сжигания 10,0 молей пропана (C 3 H 8 ). Предположим, что воздух состоит из 21,0% O 2 .
Предположим, что воздух состоит из 21,0% O 2 .
Решение:
1) Сжигание пропана:
C 3 H 8 + 5O 2 —> 3CO 2 + 4H 2 O
2) Определить количество молей чистого кислорода, необходимое для сжигания 10,0 моль пропана:
1 соответствует 5, как 10,0 соответствует хx = 50,0 моль необходимого кислорода
3) Используйте PV = nRT для перевода молей кислорода в литры кислорода при условиях, указанных в задаче:
(1,00 атм) (V) = (50,0 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (298 К)В = 1222,694 л
4) Преобразовать в требуемый объем воздуха:
1222,694 л / 0,21 = 5822,35 л
5) Перевести в кубические метры:
5822,35 L = 5822,35 дм 31 м 3 = 1000 дм 3
(5822,35 дм 3 ) (1 м 3 / 1000 дм 3 ) = 5,82 м 3 (до трех знаков фиг.
)
Пример #5: Пропан (C 3 H 8 ) сгорает в кислороде с образованием углекислого газа и водяного пара. Какой объем углекислого газа образуется при потреблении 2,80 л кислорода.
Решение:
Поскольку T или P не указаны, мы предполагаем, что реакция происходит при постоянной температуре и давлении.Это означает, что коэффициенты сбалансированного уравнения представляют объемное соотношение, в котором реагируют вещества.
5 объемов O 2 произведут 3 объема CO 2
Отсюда находим:
5/3 равно 2,8/xх = 1,68 л
Если бы мы предположили, что Т и Р изменились в ходе реакции, мы не смогли бы решить задачу. Однако не делайте этого предположения. Ваш учитель был бы недоволен.
Пример #6: Метан горит по следующему уравнению:
CH 4 + 2O 2 —> CO 2 + 2H 2 O
Рассчитайте объем воздуха, необходимый для сжигания 10,0 л метана при одинаковых температуре и давлении. Предположим, что воздух содержит 20,0 процентов кислорода по объему.
Предположим, что воздух содержит 20,0 процентов кислорода по объему.
Решение:
Коэффициенты дают молярное соотношение, при котором реагируют метан и кислород при одинаковых Т и Р.1 соответствует 2, как 10.0 соответствует х
x = требуется 20,0 л чистого кислорода.
20,0 л / 0,20 = требуется 100,0 л воздуха.
Пример № 7: Монооксид азота реагирует с кислородом в соответствии с приведенным ниже уравнением:
2NO(г) + O 2 (г) —> NO 2 (г)
Сколько литров NO (реагирующего с избытком кислорода) требуется для получения 3,0 литров NO 2 ?
Решение:
1) Указать соответствующее соотношение объемов:
2:1
2) Напишите соотношение и пропорцию:
2 соответствует 1, а x соответствует 3,0 лx = 6,0 л NO требуется
К настоящему времени вы должны знать, что означает отсутствие упоминания о температуре или давлении для решения проблемы. (Подсказка: это означает, что они остаются постоянными на протяжении всей задачи, поэтому они выпадают из рассмотрения.)
(Подсказка: это означает, что они остаются постоянными на протяжении всей задачи, поэтому они выпадают из рассмотрения.)
Пример #8: Если стехиометрические количества X и Y поместить в герметичный гибкий контейнер с начальным объемом 30,0 л при STP, какой объем Z будет произведен? (X, Y и Z находятся в газообразном состоянии)
2X + Y —> Z
Решение:
Поскольку все они являются газами, молярное отношение равно объемному отношению:
2X + Y = 30,0 лX : Y = 2 : 1 = 20 л : 10 л
n(Y) = n(Z)
, следовательно, v(Y) = v(Z) = 10,0 л произведенного Z.
Пример #9: 200,0 литров H 2 , реагирующих при 25,0 °C и 751,0 торр, сколько потребуется литров O 2 при стандартной температуре?
Решение:
1) Уравнение:
2H 2 (ж) + O 2 (ж) —> 2H 2 O(л)
2) Используйте PV = nRT для расчета молей водорода:
(751,0 торр / 760,0 торр/атм) (200,0 л = (n) (0,08206 л атм моль¯ 1 К¯ 1 ) (298 К)n = 8,0818 моль
3) Используйте H 2 : O 2 молярное соотношение:
2 к 1 как 8,0818 мл к хх = 4,0409 моль О 2 требуется
4) Используйте PV = nRT для расчета необходимого объема O 2 при SPT:
(1,00 атм) (V) = (4,0409 моль) (0,08206 л атм моль¯ 1 K¯ 1 ) (273 К)В = 90,52 л
Пример #10: Готовят смесь, используя 12,0 л NH 3 и 12,0 л Cl 2 , оба измеряют при одинаковых условиях. Эти вещества реагируют по следующему уравнению:
Эти вещества реагируют по следующему уравнению:
2 НХ 3 (г) + 3 Cl 2 (г) —> N 2 (г) + 6 HCl (г)
Каков объем каждого газа после завершения реакции (NH 3 , Cl 2 , N 2 и HCl соответственно)? Предположим, что конечные объемы измеряются в идентичных условиях.
Решение:
1) Нужен лимитирующий реагент:
аммиак: 12/2 = 6
хлор: 12 / 3 = 4У нас есть победитель! хлор.
Помните, я могу обращаться с томами так же, как с кротами. Это связано с тем, что при постоянных T и P объемы прямо пропорциональны количеству молей.
2) Конечный объем аммиака:
2 равно 3, а x равно 12x = 8,0 л использованного аммиака
Остаточный объем 12,0 л − 8,0 л = 4,0 л
3) Конечный объем хлора:
Ноль!
4) Конечный объем азота:
3 соответствует 1, как 12 соответствует хх = 4,0 л
5) Конечный объем HCl:
3 соответствует 6, как 12 соответствует хх = 24,0 л
Пример бонуса: Сколько литров O 2 производятся (на НТП), когда достаточное количество KO 2 реагирует с 75,0 л двуокиси углерода при -25,0 °C и 215 кПа?
4КО 2 (с) + 2СО 2 (ж) —> 2К 2 СО 3 (с) + 3О 2 (ж)
Решение №1:
1) Определить, сколько молей СО 2 присутствует:
PV = нРТ(215 кПа) (75,0 л) = (n) (8,31447 л кПа/моль К) (248 К)
n = 7,820121 моль
2) Определить количество молей полученного O 2 :
2 7,820121 моль ––– = –––––––––– 3 х х = 11,73018 моль
3) Определить объем на STP:
PV = нРТ(101,325 кПа) (В) = (11,73018 моль) (8,31447 л кПа/моль К) (273 К)
В = 263 л (до трех знаков фиг.
)
Решение №2:
1) Определить объем CO 2 на СТП (используя комбинированный газовый закон):
Р 1 В 1 П 2 В 2 ––––– = ––––– Т 1 T 2
(215 кПа) (75,0 л) (101,325 кПа) (В 2 ) ––––––––––––––– = –––––––––––––––– 248 К 273 К В 2 = 175,1838 л
2) Определить объем O 2 , произведенный на СТП:
2 175.


 Обратитесь к специалистам компании “Еврогаз” для получения информации о покупке баллонов.
Обратитесь к специалистам компании “Еврогаз” для получения информации о покупке баллонов. propanpremium.ru e-mail: [email protected]
propanpremium.ru e-mail: [email protected] Мы должны считать их постоянными. Если мы предположим, что они изменились, но не знаем значений, проблема не может быть решена.
Мы должны считать их постоянными. Если мы предположим, что они изменились, но не знаем значений, проблема не может быть решена.
 )
) )
)