виды, истинная и средняя. Теплоемкость
смеси
Каждое тело обладает своей, присущей только этому телу теплоемкостью.
Теплоемкостью – называют количества теплоты, необходимое для изменения температуры тела на 1 градус.
Средняя и истинная теплоемкости.
[Cm] Средней в интервале температур Т1 и Т2 температурой тела называется количество теплоты q, необходимое для повышения температуры тела на 1 градус.
(9.7)
при << ,Cm следует к истинное с – эта формула определяет истинную теплообменность тела.
В практических расчетах гораздо удобнее пользоваться средней теплоемкостью (С).
Удельная
теплоемкость – для характеристики теплоемкости
различных веществ, для возможного
сравнения между собой и для технических
расчетов вели удельную теплоемкость.
Удельной теплоемкостью – называется количество теплоты, необходимое для изменения температурное единицы количества вещества на 1 градус.
В зависимости от выбранных единиц различают теплоемкости:
Удельную массовую:
(Дж/кг*град) (9.8)
Удельную объемную
(Дж/м3*град) (9.9)
Удельную мольную
(дж/моль*гр) (9.10)
Все 3 вида связанны следующей зависимостью:
Объемная с массовой С=с*р (9.11)
Массовая с мольной (9.12)
Мольная с объемной (9.13)
Q количество подведенной теплоты
Q=m*Cpm*(t2-t1)
(9. 14)
14)
При изохорном подогреве газа его объем не больше 1.Следовательно, он не совершает работу против внешних сил.
При изобарном подогреве газ расширяется, преодолевая внутреннюю силу, действующую на поршень, т.е. совершает работу.
Следовательно, при нагревании одного и того же газа до одинаковой температуры в одних условиях при изобарном процессе нужно затратить больше тепла, чем при изохорном.
Опыт
След. 2 случая нагрев и охлаждение.
изменяется состояние при постоянном объеме V=const
изменяется состояние при постоянном давлении p=const
Затрачиваемая на нагревание 1 кг газовой смеси, расходуется на нагрев и ее отдельных компонентов, находящихся в смеси, то температура смеси = сумме произведений температуры компонентов, состоящих в смеси, на массу и объемную доли:
Если составим смесь заданной по массе газа, то теплоемкость смеси определяется:
Cсм = с1g1 + c2g2 +…+cndn
кДж/ (моль·град) | Ккал/ (кмоль·град) | ||||
Одноатомные Двухатомный Трех- и много-атомные | 12,56 20,93 29,31 | 20,93 29,31 37,68 | 3 5 7 | 5 7 9 | 5. 7./5 9./7 |
Таблица 10.3.
Газ | Истинная теплоемкость при p=const, кДж/(моль·град) | Средняя теплоемкость p=const, кДж/(кмоль) |
N2 О2 H2 ∞ CO2 SO2 Воздух H2O | = 28,5372 + 0,005390t = 29,5802 + 0,006971t = 28,3446 + 0,003152t = 28,7395 + 0,005862t= 41,3697 + 0,014498t = 42,8728 + 0,013204t = 28,7558 + 0,005721t = 32,8367 + 0,011661t | 28,7340 + 0,002349 t 29,2080 + 0,004072t 28,7210 + 0,001201t 28,8563 + 0,002681t 38,3955 + 0,010584t 40,4386 + 0,009956t 28,8270 + 0,002708t 33,1494 + 0,005275t |
Таблица
10. 4.
4.
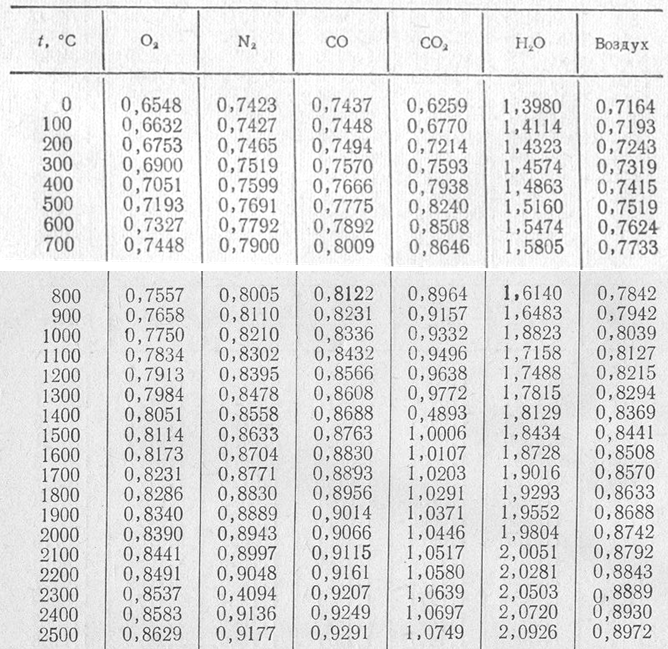
Массовая теплоемкость некоторых газов при постоянном (атмосферном) давлении в кДж/(кг · °C)
t, °C | Кислород О2 | Азот N2 | Водород H2 | Оксид угле-рода CO | Углекислый газ CO2 | Вода H2O | Метан CH4 | Воздух |
0 100 200 300 400 500 600 700 800 900 1000 1100 1200 1330 1440 1500 | 0,917 0,925 0,938 0,950 0,967 0,980 0,992 1,005 1,017 1,026 1,034 1,042 1,051 1,059 1,063 1,072 | 1,017 1,042 1,047 1,051 1,059 1,063 1,076 1,089 1,101 1,109 1,118 1,130 1,139 1,147 1,155 1,164 | 14,21 14,35 14,43 14,46 14,49 14,52 14,56 14,60 14,66 14,72 14,79 14,87 14,95 15,04 15,13 15,22 | 1,042 1,042 1,047 1,055 1,063 1,076 1,088 1,101 1,109 1,122 1,130 1,143 1,151 1,160 1,168 1,176 | 0,8205 0,8708 0,9127 0,9503 0,9838 1,013 1,042 1,066 1,088 1,126 1,143 1,160 1,172 1,185 1,197 | 1,855 1,867 1,888 1,913 1,938 1,968 2,001 2,030 2,064 2,097 2,131 2,164 2,194 2,227 2,257 2,286 | 2,190 2,471 2,800 3,206 3,650 4,104 4,545 4,991 ─ ─ ─ ─ ─ ─ ─ ─ | 1,005 1,005 1,013 1,017 1,030 1,038 1,051 1,063 1,072 1,084 1,093 1,101 1,109 1,118 1,126 1,130 |
Средняя теплоемкость – Большая Энциклопедия Нефти и Газа, статья, страница 3
Cтраница 3
Кривая зависимости поверхностного натяжения спирта от температуры. | Кривая зависимости поверхностного натяжения спирта от его содержания в водном растворе.
[31] | Кривая зависимости поверхностного натяжения спирта от его содержания в водном растворе.
[31] |
Средняя теплоемкость жидкого спирта для интервала температур от О до 98 по данным Блюмке равняется 0 68 ккал кг С. [32]
Средняя теплоемкость паров бензола в пределах температур 85 – 115 С ( при нормальном атмосферном давлении) равна 1 257 кдж / кг-град. [33]
Средняя теплоемкость сухих продуктов горения, ккал / ( м3 – град), сср. [34]
Средние теплоемкости упаренного раствора ННК и плава ННХК практически не зависят от температуры и равны: для упаренного раствора ННК в интервале температур 75 – 200 С СРо, – 0 534 ккал / кг град, для плава ННХК в интервале температур 75 – 150 С – Срй – 0 506 ккал / кг-град. [35]
Среднюю теплоемкость отбросных газов с а находим по принципу аддитивности, пренебрегая содержанием в смеси h3S, ПАУ. [36]
Среднюю теплоемкость дымовых газов приходится подсчитывать по принципу аддитивности. [37]
[37]
Средней теплоемкостью называется отношение количества теплоты, получаемой или отдаваемой телом, к изменению его температуры. [38]
Средней теплоемкостью называется теплоемкость в интервале температур Т2 – 7, она обозначается ст. При уменьшении разности температур средняя теплоемкость приближается к истинной. [39]
Средней теплоемкостью рабочего тела называется отношение количества теплоты, сообщаемой телу в заданном процессе, к изменению температуры при условии, что разность температур является конечной величиной. Величина теплоемкости зависит от температуры и давлений тела, его физических свойств и характера процесса. [40]
| Зависимости теплоты сгорания рабочей смеси от коэффициента избытка воздуха и коэффициента остаточных газов. [41] |
Средней теплоемкостью рабочего тела называется отношение количества теплоты, сообщаемой телу в заданном процессе, к изменению температуры при условии, что разность температур является конечной величиной. Величина теплоемкости зависит от температуры и давления тела, его физических свойств и характера процесса.
[42]
Величина теплоемкости зависит от температуры и давления тела, его физических свойств и характера процесса.
[42]
Зависимость средней теплоемкости от температуры для интервала комнатных, средних и высоких температур выражается эмпирическими уравнениями степенного ряда. [43]
Определение средней теплоемкости и энтальпии металлов осуществляется методом смешения [33, 36, 88, 114], который реализован в разнообразных экспериментальных установках в широком диапазоне температур. [44]
Значения средних теплоемкостей, приведенные в таблицах, действительны только для того интервала температур, который указан в таблице. [45]
Страницы: 1 2 3 4
Теплоемкость
Теплоемкость – Кл – характеристика объекта – количество теплоты, необходимое для изменения его температуры на один градус.
- Теплоемкость выражается в единицах энергии на градус.

Количество теплоты, переданной для нагрева объекта, может быть выражено как:
9000 2 V (2)0003Q = C dt (1)
, где
, где
подведенное количество теплоты,0019C = теплоемкость системы или объекта (Дж/К, БТЕ/ или F)
dt = изменение температуры (K, C ° , o F)99 Единицей теплоемкости в системе СИ является Дж/К (джоуль на кельвин). В английской системе единицами измерения являются британские тепловые единицы на фунт на градус Фаренгейта (Btu/ o F). В некоторых случаях вместо Дж используются кДж или кал и ккал.
Никогда не используйте табличные значения теплоемкости, не проверив единицы измерения фактических значений!
Удельная теплоемкость ( c ) — это количество тепла, необходимое для изменения температуры единицы массы вещества на один градус.Удельная теплоемкость является более распространенным термином для того же самого.
Тепло, поставляемое для массы, может быть выражена как
DQ = M C DT (1)
, где
DQ = тепло (J, KJ BTU)
0018 m = масса единицы (г, кг, фунт)
c = удельная теплоемкость (Дж/г К, кДж/кг o C, кДж/кг K, БТЕ/фунт o F)
dt = изменение температуры (K, C ° , o F)
(1) можно перевести в выражение удельной теплоемкости как: c/mQd
9
2 dt (1b)Пример: Удельная теплоемкость железа составляет 0,45 Дж/(г·К), что означает, что требуется 0,45 Дж тепла, чтобы поднять один грамм железа на один градус Кельвина.
Загрузите и распечатайте Подведенное тепло в зависимости от удельной теплоемкости и изменения температуры в диаграмме
Удельная теплоемкость газов
Существует два определения удельной теплоемкости для паров и газов:
c p / δT) p – Удельная теплоемкость при постоянном давлении (Дж/гK)
c v = ( δh / δT) v – Удельная теплоемкость при постоянном объеме (Дж/гK)
Для твердые и жидкие вещества, c p = c v
Воспользуйтесь ссылками, чтобы увидеть табличные значения удельной теплоемкости газов, обычных жидкостей и жидкостей, продуктов питания и пищевых продуктов, металлов и полуметаллов, обычных твердых тел и других обычных веществ.
Газовая константаИндивидуальная константа газа, R, может быть выражена как
R = C P – C V (2)
В (2)
Соотношение удельного тепла
Отношение удельного тепла выражается как
K = C P / C V (3)
02 Пример: Молярная теплоемкость железа равна 25,10 Дж/(моль·К), что означает, что требуется 25,10 Дж тепла, чтобы поднять 1 моль железа на 1 градус Кельвина. Преобразование удельной теплоемкости в молярную теплоемкость Удельную теплоемкость можно рассчитать из молярной теплоемкости и наоборот: С р = с р . M где c p = удельная теплоемкость C p = молярная теплоемкость M = молярная масса фактического вещества (г/моль). Пример: Метанол (с молекулярной формулой Ch4OH) имеет молярную теплоемкость C p , равную 81,1 Дж/(моль К). Сначала вычисляем (или находим) молярную массу метанола: 1*12,01 г/моль C + 4*1,008 г/моль H + 1*16,00 г/моль O = 32,04 г/моль CH 3 OH Тогда удельная теплоемкость метанола:
Molar Heat емкость C9013.
Molar Heat емкость (. C
Molar Heat Happ. p
Выражается в джоулях на моль на градус Кельвина (или Цельсия), Дж/(моль К) .
Табличные значения молярной теплоемкости, С р, многих органических и неорганических веществ можно найти в Стандартная энтальпия образования, Свободная энергия образования Гиббса, энтропия и молярная теплоемкость органических веществ и Стандартное состояние и энтальпия образования, свободная энергия Гиббса образования, энтропия и теплоемкость вместе с ΔH° f , ΔG° f и S° для тех же веществ при 25°C. Чему равна удельная теплоёмкость, c p ?
Чему равна удельная теплоёмкость, c p ?
- 1 BTU/LB M O F = 4186,8 J/кг K = 1 ккал/кг o C
- Определительный блок тепла
dQ = (2 кг) (0,91 кДж/кг 0 C) ((100 o C) – (20 O C))
= 145,6 (KJ)
Пример – нагреваная вода
Один литр из воды нагревается от 0 O C до кипения 100 O O C . С . Удельная теплоемкость воды составляет 4,19 кДж/кг 0 C , а необходимое количество тепла можно рассчитать как
С . Удельная теплоемкость воды составляет 4,19 кДж/кг 0 C , а необходимое количество тепла можно рассчитать как
dQ = (1 литр) (1 кг/литр) (4,19 кДж/кг 0 C) (( 100 O C) – (0 O C))
= 419 (KJ)
= 419 (KWS) (1/3600 H/с)
= 0,12 кВтч
- Аккумулирование энергии в нагретой воде – кВтч
Удельная теплоемкость обычных веществ
Удельная теплоемкость некоторых распространенных продуктов приведены в таблице ниже.
- Онлайн-конвертер единиц удельной теплоемкости
См. также табличные значения для газов, пищевых продуктов и пищевых продуктов, металлов и полуметаллов, обычных жидкостей и жидкостей и обычных твердых тел, а также значения молярной удельной теплоемкости для обычных органических и неорганических веществ вещества.
| Вещество | Удельная теплоемкость – c p – (J/kg C°) | ||
|---|---|---|---|
| Acetals | 1460 | ||
| Air, dry (sea level) | 1005 | ||
| Agate | 800 | ||
| Alcohol, ethyl | 2440 | ||
| Alcohol, metyl wood) | 2530 | ||
| Aluminum | 897 | ||
| Aluminum bronze | 436 | ||
| Alumina, AL 2 O 3 | 718 | ||
| Ammonia, liquid | 4700 | ||
| Ammonia, gas | 2060 | ||
| Antimony | 209 | ||
| Argon | 520 | ||
| Arsenic | 348 | ||
| Artificial wool | 1357 | ||
| Asbestos | 816 | ||
| Asphalt concrete (with aggregate) | 920 | ||
| Barium | 290 | ||
| Barytes | 460 | ||
| Beryllium | 1020 | ||
| Bismuth | 130 | ||
| Boiler scale | 800 | ||
| Кость | 440 | ||
| Бор | 960 | ||
| Нитрид бора 15 904 15 | |||
| Brass | 375 | ||
| Brick | 840 | ||
| Bronze | 370 | ||
| Brown iron ore | 670 | ||
| Cadmium | 234 | ||
| Calcium | 532 | ||
| Силикат кальция, CaSiO 3 | 710 | ||
| Целлюлоза, хлопок, древесная масса и регенерированная | 1300 – 1500 | ||
| Cellulose acetate, molded | 1260 – 1800 | ||
| Cellulose acetate, sheet | 1260 – 2100 | ||
| Cellulose nitrate, Celluloid | 1300 – 1700 | ||
| Chalk | 750 | ||
| Древесный уголь | 840 | ||
| Хром | 452 | ||
| Окись хрома | 750 | Песок 904,0415 | 1381 |
| Cobalt | 435 | ||
| Coke | 840 | ||
| Concrete | 880 | ||
| Constantan | 410 | ||
| Copper | 385 | ||
| Cork | 2000 | ||
| Алмаз (углерод) | 516 | ||
| Дюралий | 920 | ||
| Эмери | 5 | 60 | |
| Epoxy cast resins | 1000 | ||
| Fire brick | 880 | ||
| Fluorspar CaF 2 | 830 | ||
| Dichlorodifluoromethane R12, liquid | 871 | ||
| Dichlorodifluoromethane R12, пар | 595 | ||
| Лед (0 o C) | 2093 | ||
| Индийский каучук | 1250 | ||
| Glass, crown | 670 | ||
| Glass, pyrex | 753 | ||
| Glass-wool | 840 | ||
| Gold | 129 | ||
| Granite | 790 | ||
| Graphite (carbon) | 717 | ||
| Gypsum | 1090 | ||
| Helium | 5193 | ||
| Hydrogen | 14304 | ||
| Ice, snow (-5 o C) | 2090 | ||
| Ingot iron | 490 | ||
| Iodine | 218 | ||
| Iridium | 134 | ||
| Iron | 449 | ||
| Lead | 129 | ||
| Leather | 1500 | ||
| Limestone | 909 | ||
| Lithium | 3582 | ||
| Lucite | 1460 | ||
| Magnesia (Mangnesium oxide), MgO | 874 | ||
| Magnesium | 1050 | ||
| Magnesium alloy | 1010 | ||
| Manganese | 460 | ||
| Мрамор | 880 | ||
| Ртуть | 140 | ||
| Слюда | 880 | 0||
| 272 | |||
| Neon | 1030 | ||
| Nickel | 461 | ||
| Nitrogen | 1040 | ||
| Nylon-6 | 1600 | ||
| Nylon-66 | 1700 | ||
| Olive oil | 1790 | ||
| Osmium | 130 | ||
| Oxygen | 918 | ||
| Palladium | 240 | ||
| Paper | 1336 | ||
| Paraffin | 3260 | ||
| Peat | 1900 | ||
| Perlite | 387 | ||
| Phenolic cast resins | 1250 – 1670 | ||
| Phenol- формальдегидные формовочные смеси | 2500 – 6000 | ||
| Фосфорбонз | 360 | ||
| Фосфор | 800 | ||
| Pinchbeck | 380 | ||
| Pit coal | 1020 | ||
| Platinium | 133 | ||
| Plutonium | 140 | ||
| Polycarbonates | 1170 – 1250 | ||
| Polyethylene terephthalate | 1250 | ||
| Полиимидные ароматические соединения | 1120 | ||
| Натуральный полиизопреновый каучук | 1880 | ||
| Polyisoprene hard rubber | 1380 | ||
| Polymethylmethacrylate | 1500 | ||
Polypropylene | 1920 | ||
| Polystyrene | 1300 – 1500 | ||
| Polytetrafluoroethylene moulding compound | 1000 | ||
| Политетрафторэтилен (ПТФЭ) | 1172 | ||
| Полиуретановая литая жидкость | 1800 | ||
| Polyurethane elastomer | 1800 | ||
| Polyvinylchloride PVC | 840 – 1170 | ||
| Porcelain | 1085 | ||
| Potassium | 1000 | ||
| Potassium chloride | 680 | ||
| Pyroceram | 710 | ||
| Кварц, SiO 2 | 730 | ||
| Кварцевое стекло | 700 | ||
| Red metal | 381 | ||
| Rhenium | 140 | ||
| Rhodium | 240 | ||
| Rosin | 1300 | ||
| Rubidium | 330 | ||
| Salt, NaCl | 880 | ||
| Песок, кварц | 830 | ||
| Песчаник | 710 | ||
| Selenium | 330 | ||
| Silicon | 705 | ||
| silicon carbide | 670 | ||
| Silver | 235 | ||
| Slate | 760 | ||
| Sodium | 1260 | ||
| Почва сухая | 800 | ||
| Почва влажная | 1480 | ||
| 8 Сажа | 50415 | ||
| Snow | 2090 | ||
| Steatite | 830 | ||
| Steel | 490 | ||
| Sulfur, crystal | 700 | ||
| Tantalium | 138 | ||
| Tellurium | 201 | ||
| Торий | 140 | ||
| Древесина, ольха | 1400 | ||
| Древесина, ясень | 604 | 0415 | |
| Timber, birch | 1900 | ||
| Timber, larch | 1400 | ||
| Timber, maple | 1600 | ||
| Timber, oak | 2400 | ||
| Timber, pitchpine | 1300 | ||
| Timber, Pockwood | 2500 | ||
| Древесина, красная бич | 1300 | ||
| Тимбер, красная скова | |||
| Тимбер, красная сковорода | |||
. 0410 0410 | |||
| Timber, white pine | 1500 | ||
| Timber, walnut | 1400 | ||
| Tin | 228 | ||
| Titanium | 523 | ||
| Tungsten | 132 | ||
| Tungsten carbide | 171 | ||
| Уран | 116 | ||
| Ванадий | 500 | ||
| Вода чистая (жидкая)0031 o C) | 4182 | ||
| Water, vapor (27 o C) | 1864 | ||
| Wet mud | 2512 | ||
| Wood | 1300 – 2400 | ||
| Zinc | 388 |
- 1 calorie = 4.186 joules = 0.001 Btu/lb m o F
- 1 cal/gram C o = 4186 J/kg o C
- 1 Дж/кг С o = 10 -3 кДж/кг K = 10 -3 Дж/г С o = 10 -6 кДж/г С 9,02038 -4 БТЕ/(фунт м o F)
Для перевода единиц измерения используйте онлайн-конвертер единиц Удельная теплоемкость.
 /3
/3
 Удельная теплоемкость является более распространенным термином для того же самого.
Удельная теплоемкость является более распространенным термином для того же самого.