Отрицательные температуры и угроза замерзания воды в дачном водопроводе – Дневник злостного критика-рецидивиста
И вот, начались отрицательные температуры. Сегодня под утро обещают до -3, и уже сейчас на термометре 0.Выпал снег, и появилась угроза замерзания воды в садовом водопроводе:
Компостная куча и деревья в снегу:
Ветви ели и электрические провода в снегу:
Все сливают воду из летних водопроводов. Я пока не слил, и на то у меня есть две причины – побудительная и рассудительная. Побудительная – не хочется несколько дней до намеченного отъезда в город пользоваться холодным рукомойником. А рассудительная причина объясняет, почему этого можно действительно не делать.
Начну с того, что на даче я живу только в тёплое время года, когда температуры воздуха исключительно положительные. Дом у меня хотя и утеплённый, но по своим теплоизоляционным характеристикам не предназначен для зимнего проживания. Да, он утеплён слоями пенопласта и фольгированной изоляцией, но это утепление недостаточно для существенных температурных минусов.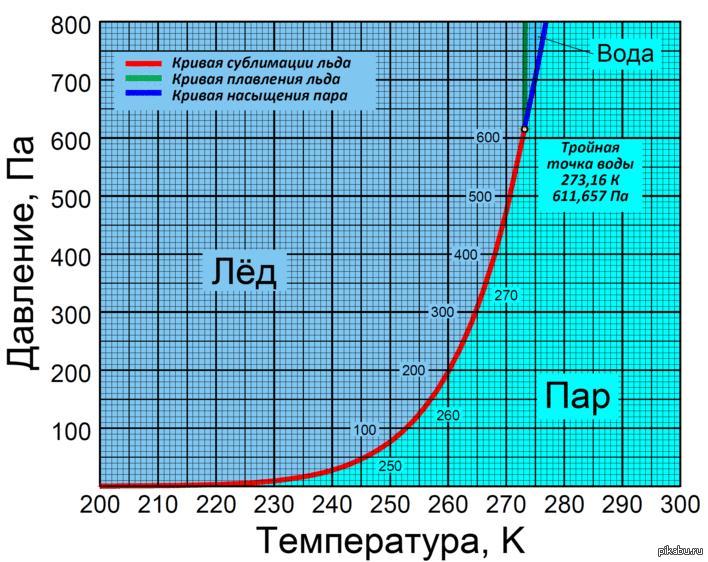 Поэтому и с водопроводом я особенно не стал заморачиваться. Погружной насос в колодце накачивает воду в гидроаккумулятор, находящийся в неотапливаемом хозблоке, по трубе ПНД диаметром 32 мм, а раздача на восемь точек на участке идёт трубами ПНД диаметром 25 мм. Трубы, где они не мешают, лежат прямо на поверхности земли, а в других местах просто слегка углублены в грунт.
Поэтому и с водопроводом я особенно не стал заморачиваться. Погружной насос в колодце накачивает воду в гидроаккумулятор, находящийся в неотапливаемом хозблоке, по трубе ПНД диаметром 32 мм, а раздача на восемь точек на участке идёт трубами ПНД диаметром 25 мм. Трубы, где они не мешают, лежат прямо на поверхности земли, а в других местах просто слегка углублены в грунт.
Из школьного курса физики я точно знаю, что точка перехода воды из жидкого состояния в твёрдое находится на отметке 0 градусов. Но что-то мне подсказывало, что температура замерзания воды в трубе будет немного ниже. Чётко объяснить причину такого ощущения я не мог, и полез в Интернет, чтобы узнать точно, при какой температуре вода в трубах реально замерзает. И действительно, я нашёл информацию, что для замерзания воды в трубе нужны температуры -5 – -7 градусов, стоящие в течение несколько дней! Не знаю, насколько это правда, но это означало, что, по крайней мере, одну ночь при температуре -3 водопровод точно должен выдержать.
То, что чёрная пластиковая труба ПНД идёт в верхнем плодородном слое земли, в котором продолжают происходить процессы гниения с непременным выделением тепла, внушает мне дополнительный оптимизм. Ну и, наконец, я особенно ничем не рискую – труба ПНД переносит достаточное количество циклов замерзания-оттаивания воды в ней. Максимум что может произойти – ослабнут фитинги, но их всегда можно подкрутить. Гидроаккумулятор стоит хоть в неотапливаемом, но закрытом помещении, что тоже должно способствовать его защите от небольшого минуса. В общем, я решил пока что воду не сливать. Хотя тревожат закрытые шаровые краны, те, что на улице. Пожалуй, это единственное слабое место. Если они не переживут ночь, придётся думать дальше. Но эксперимент есть эксперимент. Завтра отпишусь о результатах (если будет время в перерывах между проливами труб кипятком )))
P.S.: Знаю ещё, что не замерзает текущая вода. Видимо потому, что не успевает выстроится кристаллическая решётка. Ну и если речь о водопроводе, то новые порции воды всегда на несколько градусов теплее нуля. Так, на дне колодца температура воды около +4 градусов. Так что при экстремальном минусе можно немного приоткрыть краники на концах раздаточных водопроводных линий. Главное, чтобы вода в колодце не кончилась )))
Так, на дне колодца температура воды около +4 градусов. Так что при экстремальном минусе можно немного приоткрыть краники на концах раздаточных водопроводных линий. Главное, чтобы вода в колодце не кончилась )))
А вот статическое давление на температуру замерзания влияет очень слабо. Так, чтобы точку замерзания сместить на 1 градус ниже нуля, нужно 130 атмосфер. В водопроводе же всего около 3 атмосфер. Так что часто встречающийся в Интернете и безбожно растиражированный бред про незамерзающие из-за давления колонки в деревнях – полная чушь. В колонке выше глубины промерзания грунта воды просто нет. Она там появляется только при нажатии на рычаг, и стекает обратно при его отпускании. Чтобы убедиться в этом, достаточно посчитать количество времени, проходящее между нажатием на рычаг и появлением из колонки воды, или просто изучить конструкцию колонки в Интернете.
UPD 18.10.2014 18:10:
Отчитываюсь. Ночью было -1,5 градуса.
- Трубы ПНД диаметром 32 и 25 мм, проложенные просто по земле, а также слега присыпанные землёй не замёрзли.
 То же и с трубами рядом со стенами неотапливаемых помещений, расположенных у меня до высоты 150 см. То есть трубы ПНД никакие не замёрзли нигде несмотря на полное отсутствие в них движения воды.
То же и с трубами рядом со стенами неотапливаемых помещений, расположенных у меня до высоты 150 см. То есть трубы ПНД никакие не замёрзли нигде несмотря на полное отсутствие в них движения воды. - Закрытые шаровые краны 15 мм (1/2″) замёрзли, но их не порвало. Очень быстро оттаили после полива их сверху горячей водой.
- Узкие гибкие подводки и керамические краны рукомойника замёрзли, но тоже быстро оттаили после полива их сверху горячей водой.
- Гидроаккумулятор 50 литров в неотапливаемом помещении не замёрз.
- Температура в 30-литровом бойлере, установленном в неотапливаемом душе, за ночь упала с 75 до 45 градусов.

Сейчас температура держится у отметки -0,5 градусов. Ещё утром все шаровые краны и краны уличного умывальника я немножко приоткрыл, чтобы из них тоненькой струйкой сочилась вода. За день они не замёрзли. Надеюсь, что в таком режиме они переживут и ночь. Расход воды небольшой, колодец опустошиться не должен. О том, как система переживёт вторую ночь отрицательных температур, отпишусь завтра.
UPD 19.10.2014 02:10:
В общем, эксперимент пришлось прервать из-за отсутствия достаточного количества воды в колодце )))
У меня из 8 точек разбора воды 7 находятся на улице. Поскольку они все были приоткрыты во избежание порчи шаровых кранов, то за день они высосали у меня весь колодец! Осень была довольно сухая, и дебет колодца сейчас весьма низок. В итоге я слил таки всю воду из системы и вытащил насос.
В следующем году думаю докупить 15 метров ПНД 25 мм и пару шаровых, и разделить всю свою систему на 2 части – дом и всё остальное. При минусах буду сливать всё, кроме линии на дом. Если 7 струек выкачали колодец за 10 часов, то одна струйка выкачает его за 3 дня. Возможно, в этом случае дебет колодца будет достаточным для того, чтобы он успевал восполнять выкаченное. Вот так )
Если 7 струек выкачали колодец за 10 часов, то одна струйка выкачает его за 3 дня. Возможно, в этом случае дебет колодца будет достаточным для того, чтобы он успевал восполнять выкаченное. Вот так )
UPD 19.10.2014 17:10:
Интересное наблюдение. Ночью было -7,5 градусов. На бочках лёд около 2 сантиметров, причём и сверху, и на стенках. А вот на дне нет! Значит, тепло от земли идёт. Стало быть, правильно я водопровод по земле проложил, а не по забору. А ведь хотел по забору…
При какой температуре замерзает вода?
В моем детстве в магазинах мало чего было, а летом в жару очень хотелось мороженого. Я, как и многие советские детишки, в морозильной камере замораживал воду с разведенным вареньем, то и дело заглядывал, готово ли.
Еще тогда изучил, что лед получается при температуре ниже 0 градусов. Став старше, узнал, как проходит процесс замерзания, какая температура нужна для этого разным водным растворам.
При какой температуре замерзает вода
Вода – это самая загадочная субстанция на планете.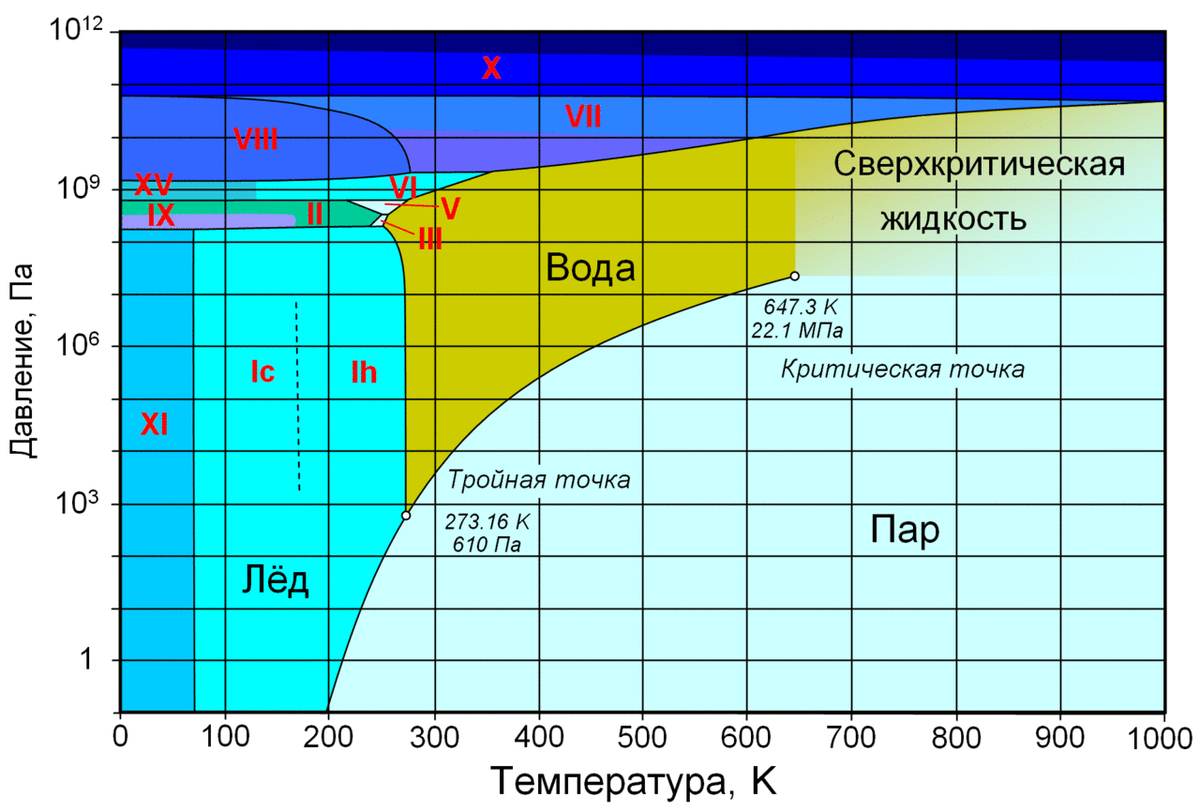 Она бывает разной:
Она бывает разной:
- пресной и питьевой;
- минеральной;
- морской и солоноватой;
- дистиллированной и деионизированной.
От ее состава как раз и зависит температура замерзания. Обычная питьевая вода превращается в лед при температуре 0 градусов по Цельсию.
Но если добавить в нее различные соли, сахар или спирт, тогда потребуется температура значительно ниже. Дистиллированная вода, в которой отсутствуют примеси, и вовсе замерзает, если охладить ее ниже -42 градусов, в обычном холодильнике такой опыт не получится. При давлении даже простая водопроводная вода начнет замерзать только при отметке -2 градуса, чем больше оно будет, тем ниже потребуется температура. Чтобы понять, отчего так происходит, надо поближе познакомиться с процессом замерзания.
Как замерзает вода
В обыкновенной воде есть микроскопические частички, это может быть пыль, глина, песок. При понижении температуры и достижении отметки в 0 градусов они становятся центрами, вокруг которых появляются кристаллы льда. Пузырьки воздуха, трещины на посуде тоже могут стать такими ядрами кристаллизации. Чем их больше, тем быстрее пойдет процесс.
Для воды с примесью соли и прочих добавок требуется больше времени для замерзания потому, что у нее высокая плотность, и чем она выше, тем дольше жидкость будет замерзать. Дистиллированную воду вообще невозможно заморозить в домашних условиях из-за отсутствия таких центров, если в ней нет пузырьков воздуха и трещинок на емкости, в которую она налита.
Может ли вода замерзнуть при положительной температуре
Мне известны 2 фактора, при которых лед образуется при плюсовых показателях температуры.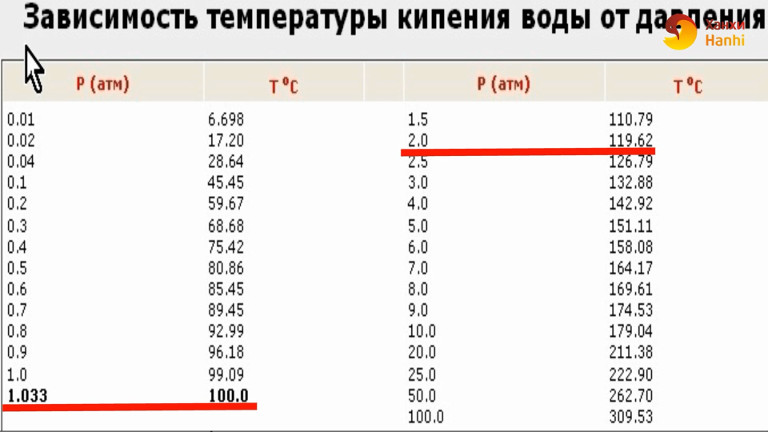 На высоте более 1000 км вода начинает замерзать уже при температуре +2 градуса.
На высоте более 1000 км вода начинает замерзать уже при температуре +2 градуса.
И совсем уж предстает загадочная картина, если в нее добавить каустическую соду. Чем выше концентрация, тем выше температура замерзания. Например, 44% раствор превратится в лед при температуре +7 градусов.
Загадки простой воды. Раритетные издания. Наука и техника
Всеволод Арабаджи
Вода вокруг нас
Воде принадлежит огромная роль в природе. В самом деле, ведь именно море явилось первой ареной жизни на Земле. Растворенные в морской воде аммиак и углеводы в контакте с некоторыми минералами при достаточно высоком давлении и воздействии мощных электрических разрядов могли обеспечить образование белковых веществ, на основе которых в дальнейшем возникли простейшие организмы. По мнению К.Э. Циолковского, водная среда способствовала предохранению хрупких и несовершенных вначале организмов от механического повреждения.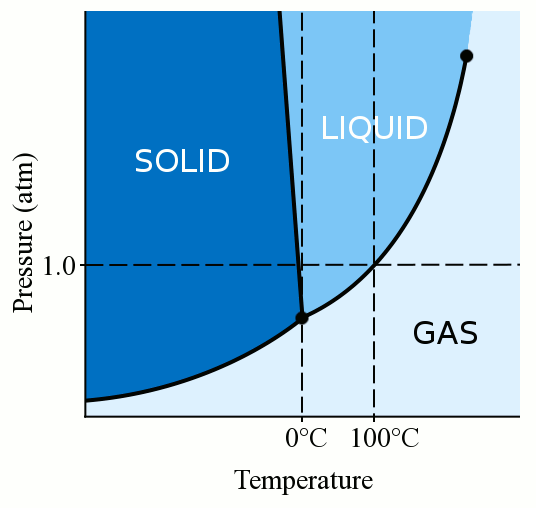 Суша и атмосфера стали впоследствии второй ареной жизни.
Суша и атмосфера стали впоследствии второй ареной жизни.
Можно сказать, что все живое состоит из воды и органических веществ. Без воды человек, например, мог бы прожить не более 2…3 дней, без питательных же веществ он может жить несколько недель. Для обеспечения нормального существования человек должен вводить в организм воды примерно в 2 раза больше по весу, чем питательных веществ. Потеря организмом человека более 10% воды может привести к смерти. В среднем в организме растений и животных содержится более 50% воды, в теле медузы ее до 96, в водорослях 95…99, в спорах и семенах от 7 до 15%. В почве находится не менее 20% воды, в организме же человека вода составляет около 65% (в теле новорожденного до 75, у взрослого 60%). Разные части человеческого организма содержат неодинаковое количество воды: стекловидное тело глаза состоит из воды на 99%, в крови ее содержится 83, в жировой ткани 29, в скелете 22 и даже в зубной эмали 0,2%.
В первичной водной оболочке земного шара воды было гораздо меньше, чем теперь (не более 10% от общего количества воды в водоемах и реках в настоящее время). Дополнительное количество воды появилось впоследствии в результате освобождения воды, входящей в состав земных недр. По расчетам специалистов, в составе мантии Земли воды содержится в 10…12 раз больше, чем в Мировом океане. При средней глубине в 4 км Мировой океан покрывает около 71% поверхности планеты и содержит 97,6% известных нам мировых запасов свободной воды. Реки и озера содержат 0,3% мировых запасов свободной воды.
Дополнительное количество воды появилось впоследствии в результате освобождения воды, входящей в состав земных недр. По расчетам специалистов, в составе мантии Земли воды содержится в 10…12 раз больше, чем в Мировом океане. При средней глубине в 4 км Мировой океан покрывает около 71% поверхности планеты и содержит 97,6% известных нам мировых запасов свободной воды. Реки и озера содержат 0,3% мировых запасов свободной воды.
Большими хранилищами влаги являются и ледники, в них сосредоточено до 2,1% мировых запасов воды. Если бы все ледники растаяли, то уровень воды на Земле поднялся бы на 64 м и около 1/8 поверхности суши было бы затоплено водой. В эпоху оледенения Европы, Канады и Сибири толщина ледяного покрова в горных местностях достигала 2 км. В настоящее время вследствие потепления климата Земли постепенно отступают границы ледников. Это обусловливает медленное повышение уровня воды в океанах.
Около 86% водяного пара поступает в атмосферу за счет испарения с поверхности морей и океанов и только 14% за счет испарения с поверхности суши.
Очень большое значение в жизни природы имеет то обстоятельство, что наибольшая плотность у воды наблюдается при температуре 4°C.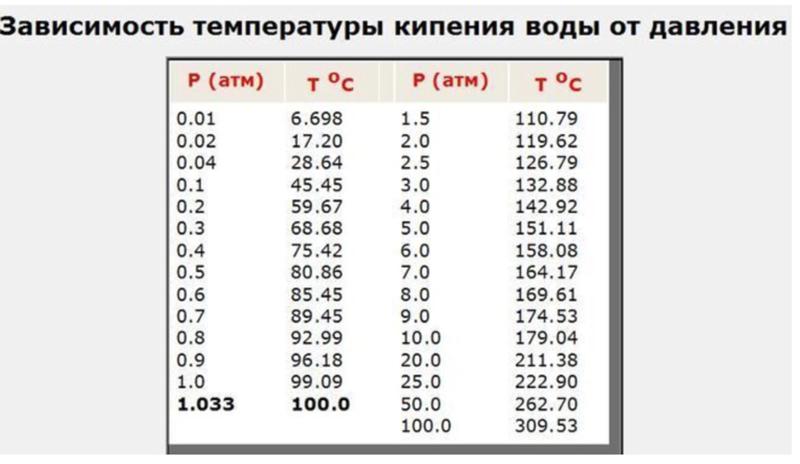
Вертикальное перемешивание морской воды осуществляется за счет действия ветра, приливов и изменения плотности по высоте. Ветровое перемешивание воды происходит в направлении сверху вниз, приливное – снизу вверх. Плотностное перемешивание возникает за счет охлаждения поверхностных вод. Ветровое и приливное перемешивания распространяются на глубину до 50 м, на больших глубинах может сказываться действие только плотностного перемешивания.
Интенсивность перемешивания придонных и поверхностных вод способствует их освежению, обогащению кислородом и питательными веществами, необходимыми для развития жизни. Растворенный в воде воздух всегда более богат кислородом, чем воздух атмосферный. Имеющийся в воде кислород оказывает благотворное влияние на развитие в ней жизненных процессов. За счет повышенного количества кислорода в растворенном воздухе погруженные в воду металлы усиленно подвергаются разрушению (коррозии).
Растворенный в воде воздух всегда более богат кислородом, чем воздух атмосферный. Имеющийся в воде кислород оказывает благотворное влияние на развитие в ней жизненных процессов. За счет повышенного количества кислорода в растворенном воздухе погруженные в воду металлы усиленно подвергаются разрушению (коррозии).
При замерзании чистая вода расширяется почти на 10%, у морского льда изменение объема происходит на меньшую величину. Поскольку вода при замерзании расширяется, увеличение внешнего давления понижает температуру ее замерзания; температура плавления льда, наоборот, повышается с давлением. В лабораторных условиях при давлении более 40 тыс. атмосфер можно получить лед, который будет плавиться при температуре 175°C. Теплоемкость и теплота плавления льда уменьшаются с температурой, теплопроводность же почти не зависит от температуры. Когда толщина льда на поверхности водоема достигает 15 см, он становится надежным теплоизолятором между водой и воздухом.
Морская вода замерзает при температуре – 1,91°C. При дальнейшем понижении температуры до – 8,2°C начинается осаждение сернокислого натрия, и только при температуре – 23°C из раствора выпадает хлористый натрий. Так как часть рассола при кристаллизации уходит изо льда, соленость его меньше солености морской воды. Многолетний морской лед настолько опресняется, что из него можно получать питьевую воду. Температура максимальной плотности морской воды ниже температуры замерзания. Это является причиной довольно интенсивной конвекции, охватывающей значительную толщу морской воды и затрудняющей замерзание. Теплоемкость морской воды стоит на третьем месте после теплоемкости водорода и жидкого аммиака.
При дальнейшем понижении температуры до – 8,2°C начинается осаждение сернокислого натрия, и только при температуре – 23°C из раствора выпадает хлористый натрий. Так как часть рассола при кристаллизации уходит изо льда, соленость его меньше солености морской воды. Многолетний морской лед настолько опресняется, что из него можно получать питьевую воду. Температура максимальной плотности морской воды ниже температуры замерзания. Это является причиной довольно интенсивной конвекции, охватывающей значительную толщу морской воды и затрудняющей замерзание. Теплоемкость морской воды стоит на третьем месте после теплоемкости водорода и жидкого аммиака.
Иногда вода замерзает при положительной температуре. Такое явление наблюдается в трубопроводах и почвенных капиллярах. В трубопроводах вода может замерзнуть при температуре +20°C. Объясняется это присутствием в воде метана. Поскольку молекулы метана занимают примерно в 2 раза больший объем, чем молекулы воды, они «расталкивают» молекулы воды, увеличивают расстояние между ними, что приводит к понижению внутреннего давления и повышению температуры замерзания.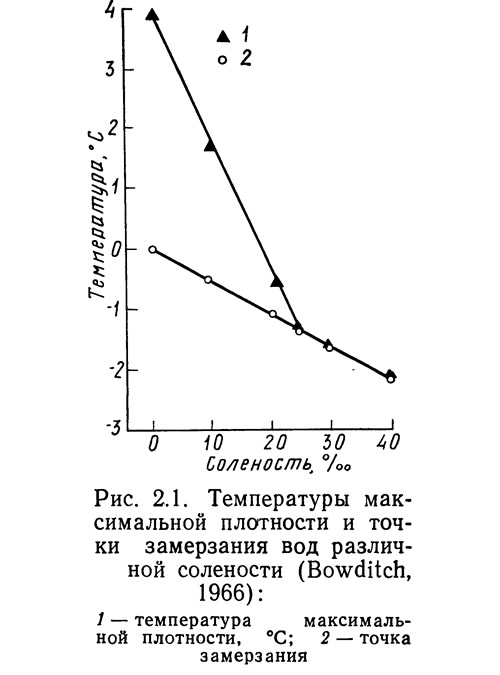 В почвенной влаге аналогичную роль выполняют молекулы белка. За счет влияния белковых молекул температура замерзания воды в почвенных капиллярах может возрасти до +4,4°C.
В почвенной влаге аналогичную роль выполняют молекулы белка. За счет влияния белковых молекул температура замерзания воды в почвенных капиллярах может возрасти до +4,4°C.
Снежинки, как правило, бывают в виде шести- и двенадцатилучевых звездочек, шестиугольных пластинок, шестигранных призм. При понижении температуры воздуха уменьшаются размеры образующихся кристаллов и возрастает разнообразие их форм. Особенности роста кристаллов в воздухе связаны с наличием в нем водяного пара.
Все знают, что сода в море соленая. Это зависит от концентрации растворенных в ней солей, но не всем известно, что в разных морях и океанах соленость воды неодинакова. Средняя соленость вод океана составляет 35%; соленость морской воды может изменяться от нуля вблизи мест впадения крупных рек до 40% в тропических морях. Вода для питья должна содержать менее 0,05% растворенных солей. Растения погибают при наличии в поливной воде в виде примеси более 0,25% солей.
Существующие в природе жидкости можно разделить на нормальные и ассоциированные.
Среди существующих в природе жидкостей вода обладает наибольшей теплоемкостью. Это предопределяет большое ее влияние на климат.
Известно, что молекулы, находящиеся на поверхности жидкости, имеют избыток потенциальной энергии и поэтому стремятся втянуться внутрь так, что при этом на поверхности остается минимальное количество молекул. За счет этого вдоль поверхности жидкости всегда действует сила, стремящаяся сократить поверхность. Это явление в физике получило название поверхностного натяжения жидкости.
Среди существующих в природе жидкостей поверхностное натяжение воды уступает только ртути. С поверхностным натяжением воды связано ее сильное смачивающее действие (способность «прилипать» к поверхности многих твердых тел). Кроме того, вода является универсальным растворителем. Теплота ее испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку.
С поверхностным натяжением воды связано ее сильное смачивающее действие (способность «прилипать» к поверхности многих твердых тел). Кроме того, вода является универсальным растворителем. Теплота ее испарения выше теплоты испарения любых других жидкостей, а теплота кристаллизации уступает лишь аммиаку.
В природе существует шесть изотопов кислорода. Три из них радиоактивны. Стабильными изотопами являются О16, О17 и О18. При испарении в водяной пар в основном переходит изотоп О16, неиспарившаяся же вода обогащается изотопами О17 и О18. В водах морей и океанов отношение О18 к О16 больше, чем в водах рек. В раковинах животных тяжелые изотопы кислорода встречаются чаще, чем в воде. Содержание изотопа О18 в атмосферном воздухе зависит от температуры. Чем выше температура воздуха, тем больше воды испаряется и тем большее количество О18 переходит в атмосферу. В период оледенений планеты содержание изотопа О18 в атмосфере было минимальным.
Как известно, молекула воды состоит из двух атомов водорода и одного атома кислорода. В составе обычной воды H2O имеется небольшое количество тяжелой воды D2O и совсем незначительное количество сверхтяжелой воды T2O. В молекулу тяжелой воды вместо обыкновенного водорода H – протия входит его тяжелый изотоп D – дейтерий, в состав молекулы сверхтяжелой воды входит еще более тяжелый изотоп водорода Т – тритий. В природной воде на 1 000 молекул H2O приходится две молекулы D2O и на одну молекулу T2O – 1019 молекул H2O.
Тяжелая вода D2O бесцветна, не имеет ни запаха, ни вкуса и живыми организмами не усваивается. Температура ее замерзания 3,8°C, температура кипения 101,42°C и температура наибольшей плотности 11,6°C. По гигроскопичности тяжелая вода близка к серной кислоте. Ее плотность на 10% больше плотности природной воды, а вязкость превышает вязкость природной воды на 20%. Растворимость солей в тяжелой воде примерно на 10% меньше, чем в обычной воде. Поскольку D2O испаряется медленнее легкой воды, в тропических морях и озерах ее больше, чем в водоемах полярных широт.
Поскольку D2O испаряется медленнее легкой воды, в тропических морях и озерах ее больше, чем в водоемах полярных широт.
Комбинируя различные сочетания изотопов водорода и стабильных изотопов кислорода, можно получить следующие разновидности молекул воды: H2O16, H2O17, H2O18, HDO16, HDO17, HDO18, D2O16, D2O17, D2O18, T2O16, T2O17, T2O18, THO16, THO17, THO18, TDO16, TDO17, TDO18. Если же использовать и нестабильные изотопы кислорода O14, O15 и O19, то всего можно получить 36 разновидностей воды. В природе чаще встречаются молекулы воды, построенные из наиболее распространенных изотопов. Молекул H2O16 в природной воде содержится 99,73%, молекул H2O18. ..0,2% и молекул H2O17…0,04%.
..0,2% и молекул H2O17…0,04%.
Рассмотрим некоторые наиболее важные оптические свойства воды и льда. Не все знают, что вода прозрачна только для видимых лучей и сильно поглощает инфракрасную радиацию. Поэтому на инфракрасных фотографиях водная поверхность всегда получается черной. При прохождении света через слой морской воды толщиной в 0,5 м поглощаются только инфракрасные лучи, ниже поглощаются последовательно красные, желтые, а затем и сине-зеленые тона. По наблюдениям из батискафа человеческий глаз может обнаружить присутствие солнечного света на глубине до 600…700 м. Эталоном прозрачности воды является Саргассово море. Белый диск в этом море виден на глубине до 66,5 м. Дальность видимости снизу вверх в приповерхностном слое моря составляет около 100 м.
Не весь солнечный свет поглощается водой. Вода отражает 5% солнечных лучей, в то время как снег – около 85%. Под лед океана проникает только 2% солнечного света.
Синий цвет чистой океанской воды объясняется избирательным поглощением и рассеянием света в воде. В условиях диффузного освещения морской поверхности вследствие преобладания при этом отраженного света море выглядит более серым. При наличии ряби и волнения насыщенность цвета увеличивается (с подветренной стороны более, чем с наветренной).
В условиях диффузного освещения морской поверхности вследствие преобладания при этом отраженного света море выглядит более серым. При наличии ряби и волнения насыщенность цвета увеличивается (с подветренной стороны более, чем с наветренной).
Существенную роль в жизни растений играют оптические свойства водяного пара. Дело в том, что водяной пар сильно поглощает инфракрасные лучи с длиной волны от 5,5 до 7 микрон, что важно для предохранения почвы от заморозков. Еще более действенным средством от заморозков является выпадение росы и образование тумана: конденсация влаги сопровождается выделением большого количества тепла, задерживающего дальнейшее охлаждение почвы.
Зная физические свойства воды и льда, человек давно использует их в своей практической деятельности. Так, например, иногда применяется прокладка голых электрических проводов прямо по льду, так как электропроводность сухого льда и снега весьма мала. Она во много раз меньше электропроводности воды. Различные примеси оказывают значительное влияние на электропроводность воды и почти не изменяют электропроводности льда.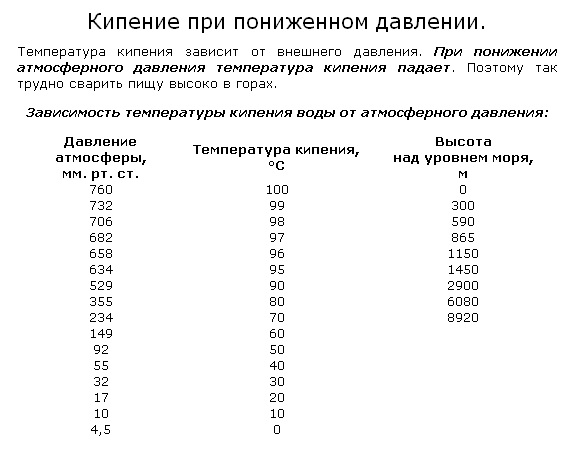 Электропроводность химически чистой воды обусловлена частичной диссоциацией молекулы воды на ионы H+ и OH–. Основное значение для электропроводности и воды и льда имеют перемещения ионов H+ («протонные перескоки»). Электропроводность химически чистой воды при 18°C равна 3,8·10–8 Ом–1·см–1 а электропроводность морской воды около 5·10–2 Ом–1·см–1. Электропроводность пресной природной воды может быть 1 000 раз меньше, чем морской. Это объясняется тем, что в воде морей и океанов растворено большее количество солей, чем в речной воде.
Электропроводность химически чистой воды обусловлена частичной диссоциацией молекулы воды на ионы H+ и OH–. Основное значение для электропроводности и воды и льда имеют перемещения ионов H+ («протонные перескоки»). Электропроводность химически чистой воды при 18°C равна 3,8·10–8 Ом–1·см–1 а электропроводность морской воды около 5·10–2 Ом–1·см–1. Электропроводность пресной природной воды может быть 1 000 раз меньше, чем морской. Это объясняется тем, что в воде морей и океанов растворено большее количество солей, чем в речной воде.
Существенную характеристику электрических свойств вещества дает относительная диэлектрическая проницаемость. У воды она имеет величину в пределах 79…81, у льда 3,26, у водяного пара 1,00705.
Без воды не было бы на Земле ни жизни, ни производства.
Судьбы и нравы рек
Оглавление
Текст издания:
Арабаджи Всеволод Исидорович. Загадки простой воды. М.: «Знание», 1973
Загадки простой воды. М.: «Знание», 1973
Дата публикации:
7 сентября 2001 года
От чего зависит кипение воды
Чтобы приготовить различные вкусные блюда, часто необходима вода, и, если ее нагревать, то она рано или поздно закипит. Каждый образованный человек при этом знает, что вода начинает кипеть при температуре, равной ста градусам Цельсия, и при дальнейшем нагревании ее температура не меняется. Именно это свойство воды используется в кулинарии. Однако далеко не всем известно, что это бывает не всегда так. Вода может закипать при разной температуре в зависимости от условий, в которых она находится. Давайте попробуем разобраться, от чего зависит температура кипения воды, и как это нужно использовать.
При нагревании температура воды приближается к температуре кипения, и по всему объему образуются многочисленные пузырьки, внутри которых находится водяной пар. Плотность пара меньше, чем плотность воды, поэтому сила Архимеда, действующая на пузырьки, поднимает их на поверхность. При этом объем пузырьков то увеличивается, то уменьшается, поэтому закипающая вода издает характерные звуки. Достигая поверхности, пузырьки с водяным паром лопаются, по этой причине кипящая вода интенсивно булькает, выпуская водяной пар.
При этом объем пузырьков то увеличивается, то уменьшается, поэтому закипающая вода издает характерные звуки. Достигая поверхности, пузырьки с водяным паром лопаются, по этой причине кипящая вода интенсивно булькает, выпуская водяной пар.
Температура кипения в явном виде зависит от давления, оказываемого на поверхность воды, что объясняется зависимостью давления насыщенного пара, находящегося в пузырьках, от температуры. При этом количество пара внутри пузырьков, а вместе с этим и их объем, увеличиваются до тех пор, пока давление насыщенного пара не будет превосходить давление воды. Это давление складывается из гидростатического давления воды, обусловленного гравитационным притяжением к Земле, и внешнего атмосферного давления. Поэтому температура кипения воды увеличивается при возрастании атмосферного давления и уменьшается при его уменьшении. Только в случае нормального атмосферного давления 760 мм.рт.ст. (1 атм.) вода кипит при 1000С. График зависимости температуры кипения воды от атмосферного давления представлен ниже:
Из графика видно, что если увеличить атмосферное давление до 1,45 атм, то вода будет кипеть уже при 1100С.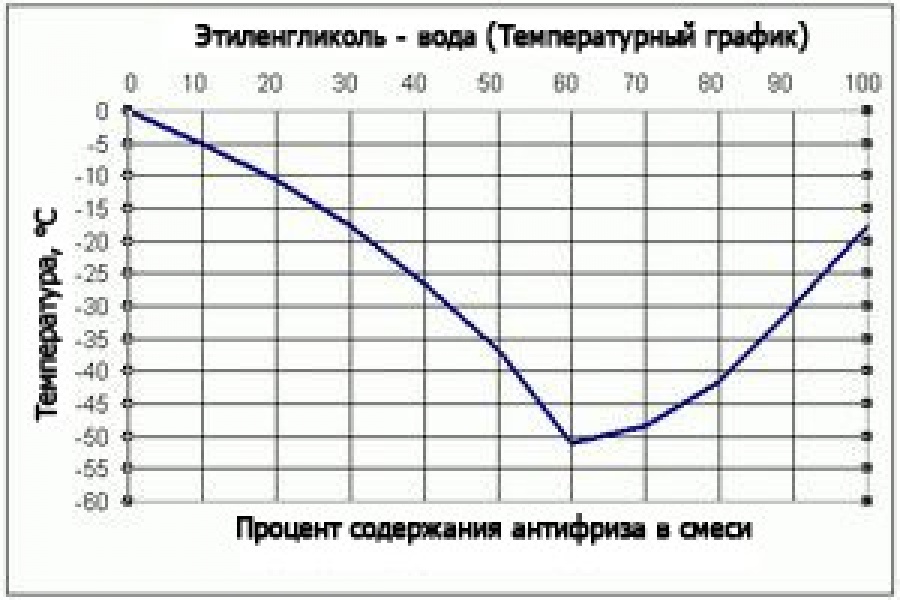 При давлении воздуха 2,0 атм. вода закипит при 1200С и так далее. Увеличение температуры кипения воды может быть использовано для ускорения и улучшения процесса приготовления горячих блюд. Для этого изобрели скороварки – кастрюли с особой герметично закрывающейся крышкой, снабженные специальными клапанами для регулирования температуры кипения. Из-за герметичности давление в них повышается до 2-3 атм., что обеспечивает температуру кипения воды 120-1300С. Однако при этом нужно помнить, что использование скороварок сопряжено с опасностью: пар, выходящий из них, имеет большое давление и высокую температуру. Поэтому нужно быть максимально осторожными, чтобы не получить ожог.
При давлении воздуха 2,0 атм. вода закипит при 1200С и так далее. Увеличение температуры кипения воды может быть использовано для ускорения и улучшения процесса приготовления горячих блюд. Для этого изобрели скороварки – кастрюли с особой герметично закрывающейся крышкой, снабженные специальными клапанами для регулирования температуры кипения. Из-за герметичности давление в них повышается до 2-3 атм., что обеспечивает температуру кипения воды 120-1300С. Однако при этом нужно помнить, что использование скороварок сопряжено с опасностью: пар, выходящий из них, имеет большое давление и высокую температуру. Поэтому нужно быть максимально осторожными, чтобы не получить ожог.
Обратный эффект наблюдается, если атмосферное давление понижается. В этом случае температура кипения тоже уменьшается, что и происходит при увеличении высоты над уровнем моря:
|
Высота над уровнем моря, м |
0 |
300 |
1000 |
2000 |
3000 |
4000 |
6000 |
8000 |
|---|---|---|---|---|---|---|---|---|
|
Атмосферное давление, Па |
101325,69 |
98066,50 |
88259,85 |
78453,20 |
68646,55 |
58839,90 |
49033,25 |
39226,60 |
|
Температура кипения воды |
100,0 |
99,09 |
96,18 |
92,99 |
89,45 |
85,45 |
80,86 |
75,42 |
В среднем, при подъеме на 300 м температура кипения воды уменьшается на 10С и достаточно высоко в горах опускается до 800С, что может привести к некоторым трудностям в приготовлении еды.
Если же дальше уменьшать давление, например, откачивая воздух из сосуда с водой, то при давлении воздуха 0,03 атм. вода будет кипеть уже при комнатной температуре, и это достаточно необычно, так как привычная температура кипения воды – 1000С.
Автор: Матвеев К.В., методист ГМЦ ДО г. Москвы
| | Навигация по справочнику TehTab.ru: главная страница / / Техническая информация / / Свойства рабочих сред / / Вода, лед и снег / / Зависимость температуры кипения воды от давления. 7- 310°C, 0,01-100 кгс/см2
| ||||||||||||||
| Нашли ошибку? Есть дополнения? Напишите нам об этом, указав ссылку на страницу. | |||||||||||||||
| TehTab.ru Реклама, сотрудничество: info@tehtab. | Обращаем ваше внимание на то, что данный интернет-сайт носит исключительно информационный характер. Информация, представленная на сайте, не является официальной и предоставлена только в целях ознакомления. Все риски за использование информаци с сайта посетители берут на себя. Проект TehTab.ru является некоммерческим, не поддерживается никакими политическими партиями и иностранными организациями. | ||||||||||||||
Ученые: полосы на Марсе остаются от потоков воды
Автор фото, AFP
Ученые, исследующие Марс, заявили, что темные полосы, появляющиеся на поверхности планеты в теплое время года, могут образовываться на месте периодических потоков воды в жидком состоянии.
На снимках со спутника НАСА на склонах гор видны характерные полосы, похожие на отложения солей.
В исследовании, проводившемся учеными из Технологического института Джорджии под руководством астронома Луджендры Оджи и опубликованном в журнале Nature Geoscience, отмечается, что эти данные могут означать, что на Марсе и сейчас может существовать в каких-то формах жизнь, так как наличие воды повышает вероятность существования примитивных форм, таких как микробы.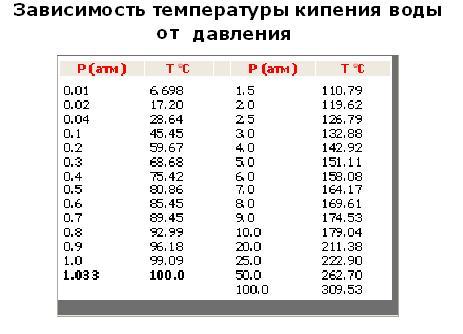
Есть ли жизнь на Марсе?
Ученые давно задаются вопросом, есть ли сейчас на Марсе вода в жидкой форме. Наблюдения и исследования на протяжении последних 15 лет застывших потоков солей позволяют высказать несколько предположений.
Космический орбитальный аппарат НАСА Mars Reconnaissance Orbiter имеет на своем борту аппарат Crism, способный определять химический состав материалов на поверхности планеты. Аппарат с четырех различных точек фиксирует направление движения солевых потоков на протяжении марсианского лета.
Crism определил, что эти потоки состоят из перхлората натрия, хлоратов и хлоридов, которые могут понизить температуру замерзания воды.
Учитывая, что температура на планете обычно значительно ниже нуля по Цельсию, можно предположить, что вода, в случае ее наличия, будет дольше пребывать в жидком состоянии из-за солей.
Ученые считают, что точкой замерзания может быть -80 градусов по Цельсию. А учитывая низкое атмосферное давление, кипение происходит при +10 градусах.
А учитывая низкое атмосферное давление, кипение происходит при +10 градусах.
Средняя температура на Марсе примерно -62 градуса, наивысшая температура летом может достигать 21 градуса. Ученые обратили внимание на то, что линии появляются именно тогда, когда условия достаточно теплые для существования воды в жидком состоянии.
Откуда следы?
В то же время пока непонятно, откуда появляется эта вода, оставившая соляные следы. Исследователи, используя данные орбитального аппарата, вращающегося в районе экватора, предполагают, что запасы воды могут залегать на большой глубине в виде льда.
Есть также предположение, что соли впитывают пары воды из атмосферы планеты.
И еще есть предположение, что некоторые водоносные слои поднимаются к поверхности. Места, где они предположительно могут быть, впрочем, не совпадают с теми местами, где возникают солевые потоки.
Ученые считают, что эти полосы могут возникать в различных частях планеты из различных источников воды.
Автор фото, AFP
Доктор Джо Михальски из лондонского Музея естественной истории говорит, что в случае, если будет подтверждено наличие на Марсе воды, можно надеяться и на обнаружение там каких-то форм жизни.
“На Земле даже в экстремально засушливых местах, если мы находим воду, мы находим и жизнь. Так что обнаружение воды на Марсе – это очень важное открытие”, – говорит ученый.
В то же время, если на Марсе есть вода, ученые должны решить, могут ли они отправлять в эти регионы планеты свои космические аппараты.
Эксперт британского космического агентства доктор Питер Грайндрод в интервью Би-би-си пояснил, что согласно общепринятым правилам, нельзя отправлять земные космические аппараты в те места, где может быть вода, а стало быть и формы жизни.
“Мы не можем обеспечить стерильность наших аппаратов, отправляющихся в космос, а значит, микробы с них могут попасть туда и представлять опасность для той жизни.
Кипение воды | Вода для Вас
Вода используется не только для питья. С ее помощью можно приготовить множество вкусных блюд. При нагревании жидкость закипает и именно этот эффект используется для приготовления пищи. Если температура достигает 100°С, вода начинает кипеть и последующее ее кипячение не меняет температуру. Наша компания специализируется на такой услуге, как доставка воды в баллонах 19 литров и дополнительных товаров в виде кулеров и помп жителям Щелково, Мытищ, Пушкино, Балашихи, Королева и Ивантеевки.
Достигая температуры кипения, на водной поверхности появляются пузырьки с водяным паром внутри. Из-за меньшей плотности пара, под действием архимедовой силы, происходит выталкивание пузырьков наверх. Достигая поверхности, пузырьки лопаются издавая характерный звук в виде бульканья.
Однако вода может закипать и при других температурах
На этот показатель влияют условия ее пребывания. Давление атмосферы на водную поверхность может изменять температуру кипения и при низком давлении пузырьки появляются до того как вода достигнет 100°С.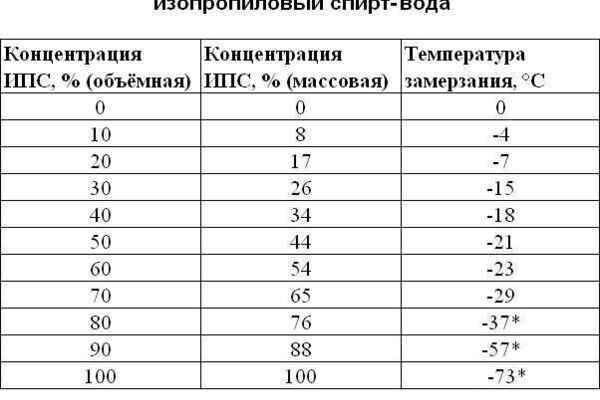 Такой эффект усложняет приготовление пищи и, к примеру, картофель высоко в горах сварить невозможно, так как для горной местности характерно низкое давление, которое уменьшает температуру кипения воды. При увеличении атмосферного давления вода будет закипать при большей температуре.
Такой эффект усложняет приготовление пищи и, к примеру, картофель высоко в горах сварить невозможно, так как для горной местности характерно низкое давление, которое уменьшает температуру кипения воды. При увеличении атмосферного давления вода будет закипать при большей температуре.
Кипение является сложным процессом
Различают четыре стадии кипения. Если взять открытый стеклянный сосуд с водой и нагревать его, то через время:
- дно сосуда и его стенки покроются мелкими пузырьками воздуха, которые можно будет также наблюдать и на поверхности;
- пузырьки с насыщенным паром становятся больше и они начинают выходить на поверхность. Если сверху вода еще не прогрелась, то пузырьки будут опускаться вниз, а затем опять устремляться обратно к поверхности;
- водная поверхность покроется множеством пузырьков, из-за чего вода даже на короткое время чуть помутнеет, но затем снова будет прозрачной. Такой процесс назвали “кипение белым ключом”;
- начинается сильное бурление, что вызвано лопанием большого количества пузырьков и даже могут иметь место брызги.
 Последнее говорит о том, что жидкость перекипела.
Последнее говорит о том, что жидкость перекипела.
В процессе кипения образуется большое количество пара из-за увеличения скорости выпаривания воды.
Если в воду добавить соль, то она закипит позже чем обычная пресная вода и температура кипения будет выше, а соответственно и энергии потребуется больше.
Человеку нужно ежедневно употреблять не менее 1,5 литров воды. Желательно, чтобы это была горная вода, насыщенная полезными элементами. Для этого можно воспользоваться услугой доставка воды.
12.09.2019
От чего зависит кипение воды
Чтобы приготовить различные вкусные блюда, часто необходима вода, и, если ее нагревать, то она рано или поздно закипит. Каждый из них при этом знает, что вода начинает кипеть при температуре, равной ста градусам Цельсия, и при нагревании ее температура не меняется. Именно это свойство воды используется в кулинарии. Однако далеко не всем известно, что это бывает не всегда так. Вода может закипать при разной температуре в зависимости от условий, в которых она находится. Давайте попробуем разобраться, от чего зависит температура кипения воды, и как это нужно использовать.
Давайте попробуем разобраться, от чего зависит температура кипения воды, и как это нужно использовать.
При нагревании температуры воды приближается к температуре кипения, и по всему объему образуются пузырьки, внутри которых находится водяной пар. Плотность пара меньше, чем плотность воды, поэтому сила Архимеда, действующая на пузырьки, поднимает их на поверхность. При этом объем пузырьков то увеличивается, то уменьшается, поэтому закипающая вода издает характерные звуки.Достигая поверхности, пузырьки с водяным паром лопаются, по этой причине кипящая вода интенсивно булькает, выпуская водяной пар.
Температура кипения в явном виде зависит от давления, вызывается зависимостью давления насыщенного пара, находящегося в пузырьках, от температуры. При этом количество пара внутри пузырьков, а вместе с этим и их объем, увеличиваются до тех пор, пока давление насыщенного пара не будет превосходить давление воды. Это давление складывается из гидростатического давления воды, вызываемого гравитационным притяжением к Земле, и внешнего притяжения атмосферного давления.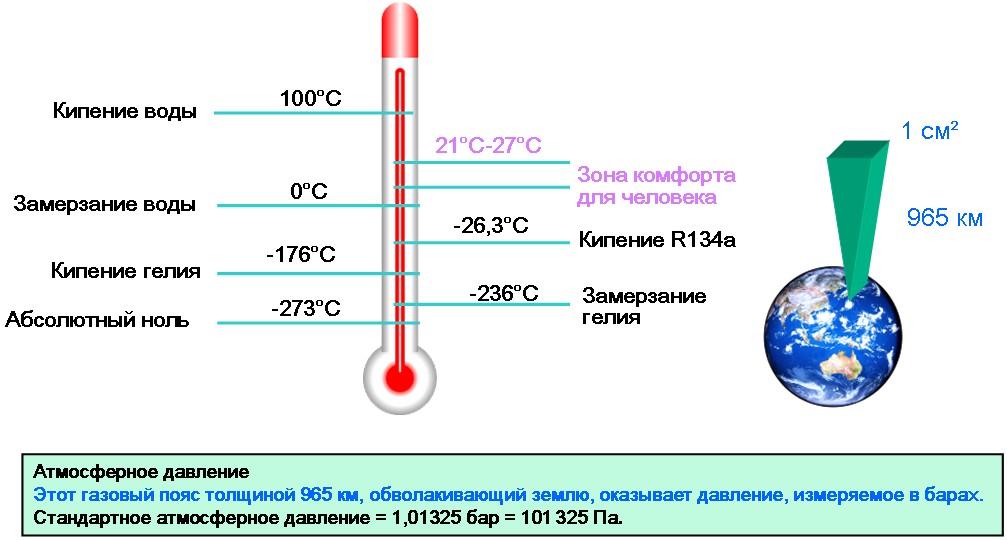 Поэтому температура кипения воды увеличивается при возрастании атмосферного давления и уменьшается при его уменьшении. Только в случае нормального атмосферного давления 760 мм.рт.ст. (1 атм.) Вода кипит при 100 0 С. График зависимости температуры кипения воды от атмосферного давления представлен ниже:
Поэтому температура кипения воды увеличивается при возрастании атмосферного давления и уменьшается при его уменьшении. Только в случае нормального атмосферного давления 760 мм.рт.ст. (1 атм.) Вода кипит при 100 0 С. График зависимости температуры кипения воды от атмосферного давления представлен ниже:
Из графика видно, что если увеличить атмосферное давление до 1,45 атм, то вода будет кипеть уже при 110 0 С. При давлении воздуха 2,0 атм. вода закипит при 120 0 С и так далее.Увеличение температуры кипения воды может быть использовано для ускорения и улучшения процесса приготовления горячих блюд. Для этого изобрели скороварки – кастрюли с особой герметично закрывающейся крышкой, снабженные специальными клапанами для регулирования температуры кипения. Из-за качества давление в них повышается до 2-3 атм., Что обеспечивает температуру кипения воды 120-130 0 С. Однако при этом нужно помнить, что использование скороварок сопряжено с опасностью: пар, выходящий из них, большое давление и высокая температура. Поэтому нужно быть максимально осторожными, чтобы не получить ожог.
Поэтому нужно быть максимально осторожными, чтобы не получить ожог.
Обратный эффект наблюдается, если атмосферное давление понижается. В этом случае температура кипения тоже уменьшается, что и происходит при увеличении высоты над уровнем моря:
Высота над уровнем моря, м | 0 | 300 | 1000 | 2000 | 3000 | 4000 | 6000 | 8000 |
|---|---|---|---|---|---|---|---|---|
Атмосферное давление, Па | 101325,69 | 98066,50 | 88259,85 | 78453,20 | 68646,55 | 58839,90 | 49033,25 | 39226,60 |
Температура кипения воды | 100,0 | 99,09 | 96,18 | 92,99 | 89,45 | 85,45 | 80,86 | 75,42 |
В среднем, при подъеме на 300 м температура кипения воды уменьшается на 1 0 С и достаточно высоко в горах опускается до 80 0 С, что может привести к некоторым трудностям в приготовлении еды.
Если же дальше уменьшать давление, например, откачивая воздух из сосуда с водой, то при давлении воздуха 0,03 атм. вода будет кипеть уже при комнатной температуре, и это достаточно необычно, так как привычная температура кипения воды – 100 0 С.
Автор: Матвеев К.В., методист ГМЦ ДО г. Москва. Москвы
Кипение воды | Вода для Вас
Вода используется не только для питья. С ее помощью можно приготовить множество вкусных блюд.При нагревании жидкость закипает и этот эффект используется для приготовления пищи. Если температура достигает 100 ° С, вода начинает кипеть и последующее ее кипячение не меняет температуру. Наша компания специализируется на таких услугах, как доставка воды в баллонах 19 литров и дополнительных товаров в виде кулеров, Мытищ, Пушкино, Балашихи, Королева и Ивантеевки.
Достигая температуры кипения, на водной поверхности появляются пузырьки с водяным паром внутри.Из-за архимедовой силы, происходит выталкивание пузырьков наверх. Достигая поверхности, пузырьки лопаются издавая характерный звук в виде бульканья.
Достигая поверхности, пузырьки лопаются издавая характерный звук в виде бульканья.
Однако вода может закипать и при других температурах
На этот показатель снизятся условия ее пребывания. Давление атмосферы на водную поверхность может температура кипения и при низком давлении пузырьки появляются до того как вода достигнет 100 ° С. Такой эффект усложняет приготовление пищи и, например, картофель высоко в горах сварить невозможно, снижает температуру кипения воды.При увеличении атмосферного давления вода будет закипать при большей температуре.
Кипение является сложным процессом
Различают четыре стадии кипения. Если взять открытый стеклянный сосуд с водой и нагревать его, то через время:
- дно сосуда и его стенки покроются мелкими пузырьками воздуха, которые можно будет также наблюдать и на поверхности;
- пузырьки с насыщенным паром становятся больше и начинают выходить на поверхность. Если сверху вода еще не прогрелась, то пузырьки будут опускаться вниз, а затем опять устремляться обратно к поверхности;
- водная поверхность покроется множеством пузырьков, из-за чего вода даже на короткое время чуть помутнеет, но снова будет прозрачной.
 Такой процесс назвали «кипение белым ключом»;
Такой процесс назвали «кипение белым ключом»; - начинается сильное бурление, вызвано лопанием большого количества пузырьков и даже могут иметь место брызги. Последнее говорит о том, что жидкость перекипела.
В процессе кипения образуется большое количество пара из-за увеличения скорости выпаривания воды.
Если в воду добавить соль, то она закипит позже, чем обычная пресная вода и температура кипения будет выше, а соответственно и энергии потребуется больше.
Человеку нужно ежедневно употреблять не менее 1,5 литров воды. Желательно, чтобы это была горная вода, насыщенная полезными элементами. Для этого можно воспользоваться услугами доставка воды.
12.09.2019незамерзающая вода в мерзлоте – Общество
Вода – основа жизни на нашей планете. Это все мы усвоили ещё в школе. Вода – самое распространённое на Земле химическое соединение. Около 95% её приходится на моря и океаны, менее 2% существуют в виде льдов и снега Арктики, Антарктики и высокогорных ледников, примерно столько же составляют грунтовые воды, примерно столько же воды находится в реках и озёрах и лишь совсем небольшая часть – это водяные пары в атмосфере (облака, тучи и туманы). Но очень редко люди вспоминают о том, что ещё некоторая часть воды (в основном, в виде льда) присутствует в вечной мерзлоте. Да, количество ее несущественно, по сравнению с водой в ледников, однако вполне сопоставимо с общей водой в реках нашей планеты.
Но очень редко люди вспоминают о том, что ещё некоторая часть воды (в основном, в виде льда) присутствует в вечной мерзлоте. Да, количество ее несущественно, по сравнению с водой в ледников, однако вполне сопоставимо с общей водой в реках нашей планеты.
Что ещё мы хорошо помним о воде из школьного курса, так это то, что пресная вода переходит в лёд при 0 о С. А если в воде растворить какие-нибудь, то замерзать она будет уже в спектре отрицательных температур.И чем выше минерализация этого раствора, тем ниже будет его температура замерзания. Поэтому логично предположить, что в мерзлоте, характеризующейся отрицательной температурой, не вся вода будет находиться в виде ледяных кристаллов. И это действительно так. В ней всегда существует незамёрзшая вода. Только увидеть эту незамёрзшую воду не вооружённым глазом можно далеко не всегда, потому что она существует не только на макро-, но и на микроуровне.
Температура замерзания воды в природных условиях зависит от соотношения и количества растворенных в ней веществ. Замерзание морской воды с солёностью, равной средней солёности Мирового океана (35 ‰), происходит при температуре около −1,8 ° C. Морская вода солёностью 10 замерзает при температуре 0,5 ° C, а солёностью 40 ‰ уже при температуре –2,2 ° C.
Замерзание морской воды с солёностью, равной средней солёности Мирового океана (35 ‰), происходит при температуре около −1,8 ° C. Морская вода солёностью 10 замерзает при температуре 0,5 ° C, а солёностью 40 ‰ уже при температуре –2,2 ° C.
Большие объёмы незамерзающей воды в мёрзлых толщах обычно приурочены к водонасыщенным грунтовым линзам и прослоям и имеют общее название – криопэги . И хотя существуют они столько же, сколько и вся мерзлота, специальное исследование началось относительно недавно, в середине XX века; тогда же появился и термин «криопэги».В ту пору геокриологов (называвшихся в те времена мерзлотоведами) шла бурная дискуссия по вопросам терминологических определений всего, что связано с вечной мерзлотой. Именно в этот период в научный обиход вошли определения «многолетне- и сезонномёрзлых» горных пород, как лёд. Породы же, не содержащие отрицательную температуру, стали называть «морозными». А горные породы с температурой ниже 0 ° С, насыщенные незамёрзшими солёными водами и рассолами, получили название «охлажденными». Но вот такие названия, как «мокроморозные породы» или «жидкая мерзлота», не прижились и оказались за бортом научной терминологии. Хотя по мнению некоторых учёных, например, Владимира Романовича Алексеева, доктора географических наук, профессора, работающего в Институте мерзлотоведения им. П.И. Мельникова СО РАН, термин «жидкая мерзлота» отражает самое главное – тепловое состояние вещества и его «консистенцию» – и вполне мог бы стать российским аналогом термина «криопэги».
Но вот такие названия, как «мокроморозные породы» или «жидкая мерзлота», не прижились и оказались за бортом научной терминологии. Хотя по мнению некоторых учёных, например, Владимира Романовича Алексеева, доктора географических наук, профессора, работающего в Институте мерзлотоведения им. П.И. Мельникова СО РАН, термин «жидкая мерзлота» отражает самое главное – тепловое состояние вещества и его «консистенцию» – и вполне мог бы стать российским аналогом термина «криопэги».
Криопэги – природные засолённые воды (рассолы), имеющие отрицательную температуру, но находящиеся в жидком состоянии. Чаще всего этот применяется к подземным природным водам, но может использоваться и в более широком смысле.
Первую развёрнутую класси отрицательно-температурных природных вод (криопэгов) ещё в 70-х годах прошлого века выдающийся гидрогеолог и мерзлотовед Нестор Иванович Толстихин. Им были выделены три главные категории криопэгов – озёрные, морские и подземные. Каждая из этих категорий подразделялась на более дробные единицы, что в совокупности давало представление о масштабности распространения криопэгов и их разнообразия на земном шаре.В последующие годы учёные продолжили работы над классификацией криопэгов, учитывающие основные идеи Н.И. Толстихина, разделяя их по времени существования и температуры, а также по положению вмещающей среды (горных пород, льдов и воды).
Каждая из этих категорий подразделялась на более дробные единицы, что в совокупности давало представление о масштабности распространения криопэгов и их разнообразия на земном шаре.В последующие годы учёные продолжили работы над классификацией криопэгов, учитывающие основные идеи Н.И. Толстихина, разделяя их по времени существования и температуры, а также по положению вмещающей среды (горных пород, льдов и воды).
И здесь мы хотели бы, обращаясь к названию нашей статьи, начать говорить о парадоксах. Первым из них, и наиболее очевидным для человека, изучавшего основы физики в средней школе, является наличие солёных вод во льдах .Мы знаем, что природный лёд обычно значительно чище, чем вода, из которой он образует, так как при кристаллизации воды в первую очередь в ажурную решётку выстраиваются молекулы воды, поэтому одиночные кристаллы льда должны быть ультрапресными, а из растаявшего льда получается самая чистая вода, лишённая примесей. Но что же происходит с механическими примесями и растворенными в замерзающей воде солями? Они отжимаются вовне растущими кристаллами льда. Так в формирующихся формах ледяных покровов появляется вода с повышенной минерализацией до рассолов в граммов один литр – криопэги, которые иногда образуют настоящие «залежи» солёных вод среди многометровых ледяных толщ.
Так в формирующихся формах ледяных покровов появляется вода с повышенной минерализацией до рассолов в граммов один литр – криопэги, которые иногда образуют настоящие «залежи» солёных вод среди многометровых ледяных толщ.
Морские криопэги существуют далеко за пределами распространения плавучих льдов (фото из открытых источников).
Ещё один парадокс – существование криопэгов в водной среде : солёные воды с температурой ниже 0 о С. Морские криопэги по общему объёму составляют значительную часть мирового океана и далеко за пределами распространения плавучих льдов. К районам с морскими криопэгами относится практически весь Северный Ледовитый океан, северные части Тихого и Атлантического океанов, конечно, океанические воды вокруг Антарктиды.Вероятно, более плотные солёные воды с температурой до –1,5 ° С течением времени по материковому склону на дно Мирового океана на глубину более 3 км и распространяются далеко от места своего формирования в сторону экватора. Учёные не исключают, что именно с этими морскими криопэгами, генетически занимается перестройкой течений в экваториальной части Тихого океана, влияющей на климат нашей планеты. Общая масса отрицательно-температурных морских вод не подсчитана, изучены законы их существования во времени и пространстве.Тем не менее, с уверенностью можно утверждать, что океаническая «жидкая мерзлота» по объёму в несколько раз свой континентальный аналог.
Учёные не исключают, что именно с этими морскими криопэгами, генетически занимается перестройкой течений в экваториальной части Тихого океана, влияющей на климат нашей планеты. Общая масса отрицательно-температурных морских вод не подсчитана, изучены законы их существования во времени и пространстве.Тем не менее, с уверенностью можно утверждать, что океаническая «жидкая мерзлота» по объёму в несколько раз свой континентальный аналог.
Подземные криопэги в толщах мёрзлых горных пород не столь грандиозны по объёму, как морские отрицательно-температурные воды, но могут конкурировать с криопэгами в поверхностных морских льдах. И именно о них нам хотелось бы поговорить более подробно в связи с их широким распространением в российской Арктике.
Распространение подземных криопэгов по площади совпадает с границами криолитозоны, а происхождение связано со следующими процессами:
– проникновением морских вод в толщу прибрежных горных пород;
– растворением солей, содержащихся в составе в составе вмещающих подземную воду горных пород;
– криогенным концентрированием (вымораживанием) веществ, растворенных в подземных водах процедур их промерзания.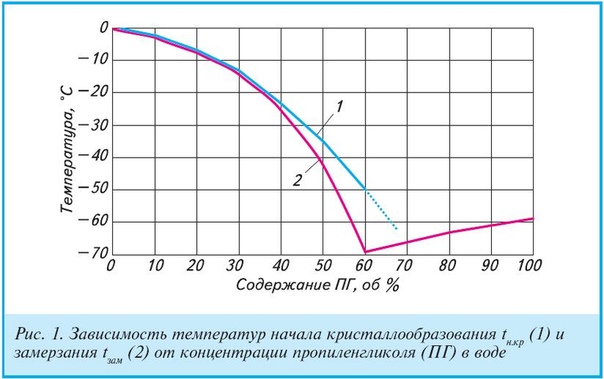
Морской тип засоления грунтов распространён по всему побережью Северного Ледовитого океана, как на арктических островах, так и на территории плейстоценовых морских трансгрессий на евразийском и северно-американском континентах. Здесь криопэги формируются при насыщении осадков морскими водами. При промерзании осадков часть солей из их поровых растворов отжималась вниз по разрезу по мере движения фронта промерзания горных пород и концентрировалась там, подвергаясь последующем неоднократным криогенным преобразованием (метаморфизации).Глубина залегания криопэгов в соответствии с мощностью криолитозоны сегодня может достигать нескольких сотен метров. Минерализация их непостоянна как по площади, так и по глубине, и может изменяться в широких пределах. Так, на полуострове Ямал она рассматривается от 5 до 150 г / л. Местоположение криопэгов также непостоянно – они могут мигрировать в толщах мёрзлых пород. А температура начала их замерзания может опускаться на несколько десятков градусов ниже 0 ° C.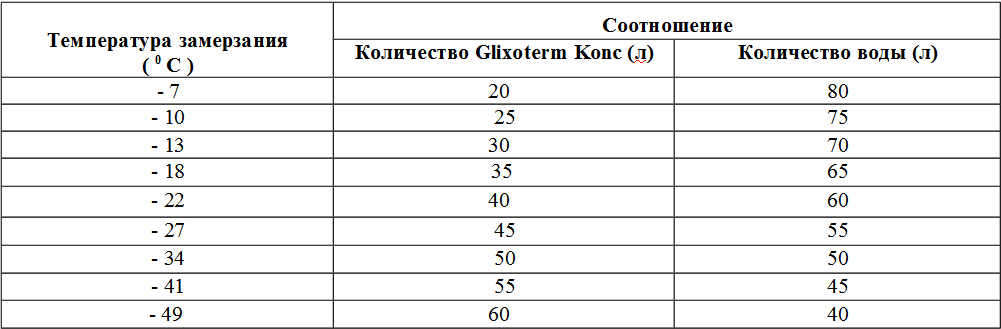 Характерной особенностью криопэгов является их способность охлаждать в процессе просачивания в нижние горизонты и тем самым низкую температуру окружающей среды, увеличенную мощность криолитозоны.
Характерной особенностью криопэгов является их способность охлаждать в процессе просачивания в нижние горизонты и тем самым низкую температуру окружающей среды, увеличенную мощность криолитозоны.
По температуре криопэги в природе могут разделяться на несколько категорий, от умеренно холодных (с температурой от 0 до -2 о С) до сверх-холодных (с температурой ниже -36 о С ). Криопэги не замерзают даже при низких температурах в результате высокой минерализации (до 200 – 300 г / л).
Целенаправленное изучение подземных криопэгов началось сравнительно недавно, в последние 40-50 лет.Выяснилось, что они оказывают негативное влияние на фундаменты инженерных сооружений, построенных на мерзлоте, и осложнения при разработке полезных ископаемых в арктическом регионе. Оказалось, что арктическая мерзлота изобилует солёными водами, которые могут встречаться в различных частях разреза криолитозоны: в верхнем сезоннопротаивающем слое (надмерзлотные криопэги), в нижележащей многолетнемерзлой толще (внутри- или межмерзлотные криопэги), в подмерзлотных водоносных горизонтах.
Да и сам человек сформирован криопэги там, где их ранее не было, и где остальная природная среда не готова к равновесию с внезапно возникшим новым элементом.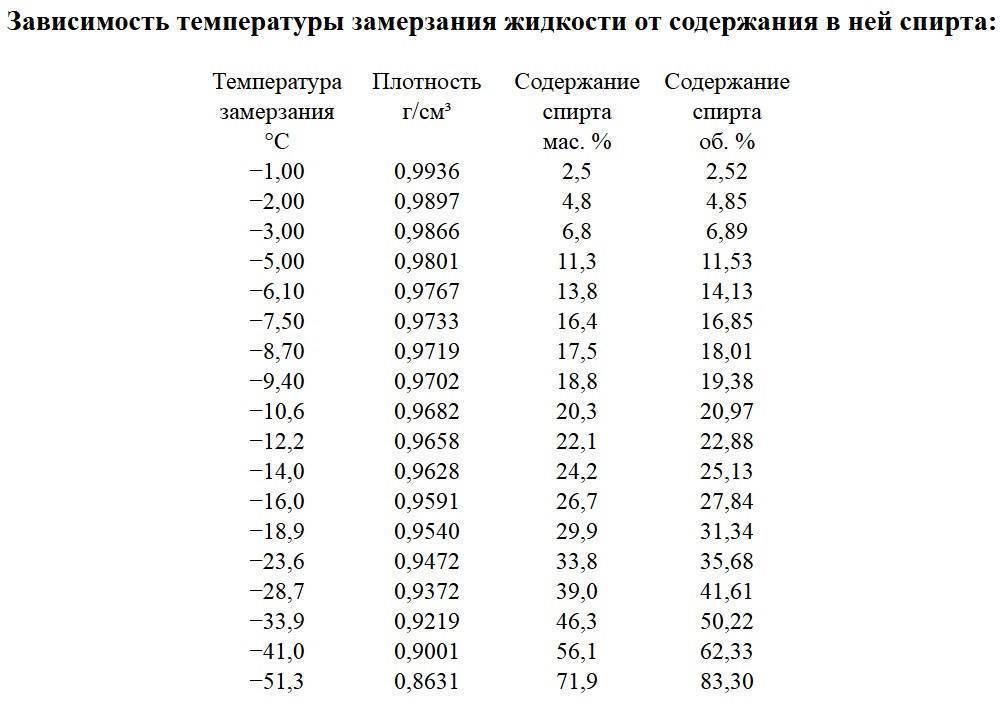 В отличие от первых природных криопэгов, формирующихся в течение сотен лет, техногенные криопеэги, увеличивающие в условиях интенсивной хозяйственной деятельности человека, а также химического загрязнения территории при сбросах бытовых и техногенных вод, могут образоваться в течение 10-15 лет.
В отличие от первых природных криопэгов, формирующихся в течение сотен лет, техногенные криопеэги, увеличивающие в условиях интенсивной хозяйственной деятельности человека, а также химического загрязнения территории при сбросах бытовых и техногенных вод, могут образоваться в течение 10-15 лет.
В криолитозоне различают естественные и техногенные криопэги.Естественные криопэги часто залегают ниже подошвы многолетнемёрзлых пород, но встречаются также в виде прослоев и линз внутри мерзлоты. Техногенные криопэги обычно залегают на небольших глубинах, исчисляемых первыми десятками метров от поверхности. Их минерализация может составлять от 1 до 10 г / л.
Глубоко залегающие межмерзлотные и подмерзлотные криопэги тоже могут начать «мстить» человеку за вмешательство в жизнь вечной мерзлоты. Например, проходку карьеров, вскрывающих криопэги невозможно, осуществить без откачки солёных вод.Вначальный период горных разработок часто сбрасывают в речную сеть, некогда славящуюся своей чистотой и ценными породами промысловых рыб, тем самым нанося невосполнимый урон природе. Позже стали строить специальные бассейны-накопители, однако из хранилища рассолов продолжались утечки сквозь плотину, аредко не случались и аварийные сбросы. Затем появилась идея закачивать дренажные рассолы в толщу вечной мерзлоты или подмерзлотные горизонты, поскольку в процессе разведочного бурения там фиксировались зоны повышенной проницаемости, которые могли служить коллекторами.Однако дренажные системы, закачанные в толщу горных пород, могли перемещаться обратно в горную рассадку, проникая через противофильтрационную завесу, откуда их снова приходилось откачивать, а потом находить новые резервуары для захоронения, как это было, например, в Якутии при разработке алмазов.
Позже стали строить специальные бассейны-накопители, однако из хранилища рассолов продолжались утечки сквозь плотину, аредко не случались и аварийные сбросы. Затем появилась идея закачивать дренажные рассолы в толщу вечной мерзлоты или подмерзлотные горизонты, поскольку в процессе разведочного бурения там фиксировались зоны повышенной проницаемости, которые могли служить коллекторами.Однако дренажные системы, закачанные в толщу горных пород, могли перемещаться обратно в горную рассадку, проникая через противофильтрационную завесу, откуда их снова приходилось откачивать, а потом находить новые резервуары для захоронения, как это было, например, в Якутии при разработке алмазов.
Выход захороненных рассолов сквозь противофильтрационную завесу карьера трубки «Мир». Фото отсюда .
А вот ещё один парадокс криопэгов: несмотря на высокую минерализацию и низкую отрицательную температуру, в криопэгах, оказывается, существует жизнь! Конечно, нам сразу вспоминаются морские криопэги. Да, условия жизни в холодных водах не очень благоприятны, однако морские экосистемы Арктики и Антарктики занимают одно из ведущих мест в структуре природных комплексов земного шара. Основу жизни в морских криопэгах составляет фито- и зоопланктон. Его активность зависит от продолжительности существования ледяного покрова: зимой продуктивность затухает, весной увеличивается.В Арктике относительно тёплое, хотя и короткое, лето приносит оживление и изобилие. Морская вода над континентальным арктическим шельфом в это время года кишит живыми существами. Они почти неразличимы человеческим глазом, но это не мешает им быть хорошей кормовой базой для рыб и птиц, китов и тюленей.
Да, условия жизни в холодных водах не очень благоприятны, однако морские экосистемы Арктики и Антарктики занимают одно из ведущих мест в структуре природных комплексов земного шара. Основу жизни в морских криопэгах составляет фито- и зоопланктон. Его активность зависит от продолжительности существования ледяного покрова: зимой продуктивность затухает, весной увеличивается.В Арктике относительно тёплое, хотя и короткое, лето приносит оживление и изобилие. Морская вода над континентальным арктическим шельфом в это время года кишит живыми существами. Они почти неразличимы человеческим глазом, но это не мешает им быть хорошей кормовой базой для рыб и птиц, китов и тюленей.
Но ещё более удивительным явлением представляется способность подземных криопэгов консервировать и длительное время жизнеспособные микроорганизмы в вечной мерзлоте! Учеными были обнаружены микробы в мёрзлых отложениях самого разного состава и происхождения, имеющих среднегодовую температуру до –18 ° С в Арктике и до –38 ° С в Антарктиде. Количество микроорганизмов в 1 г мёрзлой породы может изменяться от 100 тыс. до 100 млн., что на несколько порядков больше, чем во льду. Помимо бактерий, там могут встречаться водоросли, грибы и даже высшие растения. Примерно 20% микробных сообществ, выделенных из образцов мёрзлой породы, растут при температуре ниже –10 ° С, активны до –40 ° С, причём многие микроорганизмы выносят температуру –60 ° С и ниже. Видовой состав жизнеспособных существ в обособленных криопэгов, а также в мёрзлых грунтах, где их сохраняется при низких температурах во многом счёт плёнок незамёрзшей воды, условия распределения и индикаторные свойства микроорганизмов в настоящее время активно изучают российские и зарубежные учёные.Это обусловлено тем, что сообщества микроорганизмов, адаптированных к условиям жизни в вечной мерзлоте, могут нести информацию не только о её эволюции в четвертичный период, но и пролить свет на более отдаленные эпохи, вплоть до начала возникновения жизни на Земле.
Количество микроорганизмов в 1 г мёрзлой породы может изменяться от 100 тыс. до 100 млн., что на несколько порядков больше, чем во льду. Помимо бактерий, там могут встречаться водоросли, грибы и даже высшие растения. Примерно 20% микробных сообществ, выделенных из образцов мёрзлой породы, растут при температуре ниже –10 ° С, активны до –40 ° С, причём многие микроорганизмы выносят температуру –60 ° С и ниже. Видовой состав жизнеспособных существ в обособленных криопэгов, а также в мёрзлых грунтах, где их сохраняется при низких температурах во многом счёт плёнок незамёрзшей воды, условия распределения и индикаторные свойства микроорганизмов в настоящее время активно изучают российские и зарубежные учёные.Это обусловлено тем, что сообщества микроорганизмов, адаптированных к условиям жизни в вечной мерзлоте, могут нести информацию не только о её эволюции в четвертичный период, но и пролить свет на более отдаленные эпохи, вплоть до начала возникновения жизни на Земле.
В отложениях колымской низменности вскрыты линзы криопэгов с жизнеспособными редкими микроорганизмами, возраст которых составляет четверть миллиона лет. Справа стоит доктор геолого-минералогических наук Давид Гиличинский.Фото отсюда .
Справа стоит доктор геолого-минералогических наук Давид Гиличинский.Фото отсюда .
Сегодня изучением криопэгов занимаются учёные различных специальностей: геокриологи и инженеры-строители, геохимики и экологи, географы и гидрологи, биологи и почвоведы. И каждая научная дисциплина вносит свой вклад в эту парадоксальной «жидкой мерзлоты».
А мы, продолжая свой рассказ о незамерзающей воде, спустимся от макроуровня криопэгов на микроуровенькой фазе в монолитной и внешне достаточно прочной мёрзлой породе.
И здесь мы сталкиваемся с очередным парадоксом, заключающимся в том, что мёрзлая порода, имеющая температуру ниже 0 о С, кроме органо-минерального скелета и льда, всегда содержит в своём составе и какое-то количество незамёрзшей. То есть, при достижении грунтом отрицательной температуры, не вся вода в поровом пространстве температуры переходит в лёд – часть её остается в жидком состоянии. Это и есть так называемая незамёрзшая вода, количество зависит от величины отрицательной температуры и температуры, которая убывает с понижением.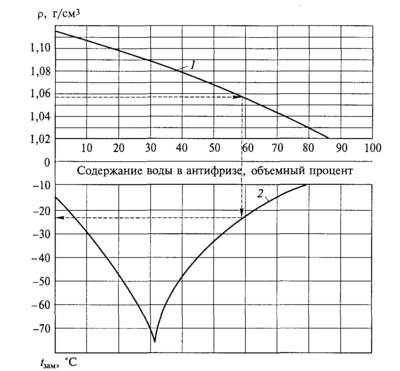 Здесь следует извлечь известный «принцип Цытовича» о равновесном состоянии воды и льда в мёрзлых грунтах, сформулированный ещё в середине ХХ века профессором Николаем Александровичем Цытовичем, специалистом в области механики мёрзлых грунтов. Суть этого принципа состоит в том, что содержание незамёрзшей воды в конкретном мёрзлом грунте является, при фиксированной отрицательной температуре, постоянной величиной.
Здесь следует извлечь известный «принцип Цытовича» о равновесном состоянии воды и льда в мёрзлых грунтах, сформулированный ещё в середине ХХ века профессором Николаем Александровичем Цытовичем, специалистом в области механики мёрзлых грунтов. Суть этого принципа состоит в том, что содержание незамёрзшей воды в конкретном мёрзлом грунте является, при фиксированной отрицательной температуре, постоянной величиной.
Количество незамёрзшей воды в грунте зависит от многих факторов и всего – от количества частиц и агрегатов, которые слагают скелет породы, а также от количества растворенных в поровом растворе солей.Известно, что грунтовая вода в поровом пространстве энергетически неоднородна. Различают свободную воду, которая практически не связана со скелетом, которая, в свою очередь, подразделяется на капиллярную и плёночную.
Свободная вода, которая содержит в трещиноватых скальных, крупнообломочных породах и песках, обладает обычными свойствами жидкой фазы – передвигается под действием силы тяжести, заполняет почти все крупные пустоты. Пресная свободная вода замерзает практически при 0 о С, однако ее геометрическое значение замерзания постепенно понижается.Теоретически температура грунтовой воды может понизиться до эвтектической (например, для NaCl она будет -21.2 о С), когда начинается выпадение солей из раствора.
Пресная свободная вода замерзает практически при 0 о С, однако ее геометрическое значение замерзания постепенно понижается.Теоретически температура грунтовой воды может понизиться до эвтектической (например, для NaCl она будет -21.2 о С), когда начинается выпадение солей из раствора.
Несколько усиленных связей с грунтом капиллярная вода, которая содержит в себе большей дисперсности (пылеватых и глинистых), передвигается и удерживается в них за счет капиллярного натяжения и силы тяжести, начинает вымерзать в зависимости от уменьшения размеров капилляров при температуре от -1 о С. до -12 о С и даже ниже.По своей природе капиллярная вода занимает промежуточное положение между свободной и внутренней. Она может относиться как к той, так и к другому, в зависимости от размера (диаметра) капилляра и, соответственно, силы взаимодействия с поверхностью скелета грунта.
Расположение различных категорий поровой воды относительно поверхности грунтовой частицы: 1 – минеральная частица; 2 – прочносвязанная вода; 3 – рыхл связанная вода; 4 – свободная вода.
Следующая по силе взаимодействия с грунтом – связанная вода, которая удерживается на грунтовых частицах за счёт поверхностной энергии этих частиц. Чем ближе молекула воды к частице грунта, тем сильнее она к ней притягивается за счёт водородных связей. Прочносвязанной водой являются первые несколько слоёв молекул на поверхности частиц или даже отдельные молекулы воды. Рыхлосвязанная вода образует плёнки, которые вымерзают в спектре отрицательных температур в зависимости от их толщины.Прочносвязанная вода имеет повышенную плотность и замерзает самой последней при очень низких отрицательных температурах – около -80 ° С. И если в реальности такие температуры для воздуха ещё возможны, например, в Антарктиде, то низкие значения температуры мёрзлых пород в естественной природе не существует (их можно смоделировать только в лабораторных условиях). Поэтому мы можем обоснованно утверждать, что в любых мёрзлых породах в Арктике на микроуровне всегда содержится какое-то количество незамёрзшей воды!
Основные компоненты мёрзлой породы: 1 – минеральные частицы; 2 – лёд; 3 – незамёрзшая вода.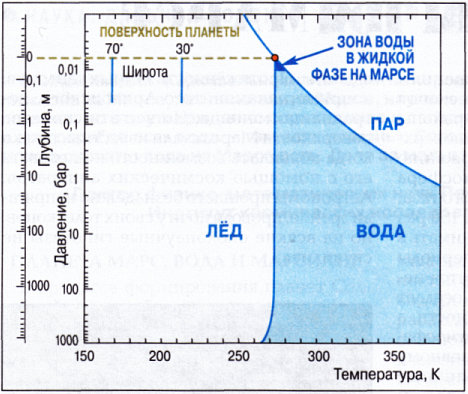
Тутости ради надо сказать, что всё справедливо основная часть воды в мёрзлых породах замерзает и присутствует в виде твёрдой фазы – льда, который является важнейшим породообразующим минералом в мёрзлой породе. Весь этот лёд принят называть подземным, независимо от образования его образования и характера залегания. Лёд может присутствовать в виде текстурообразующего не различимого невооруженным глазом льда-цемента, в виде отдельных визуально различимых включений (линз и прослоек), а также в виде крупных и даже гигантских пород и пластов.В любом виде кристаллов, либо в виде локализованных в порах, пустотах и карманах скоплений, обычно имеющих повышенную засолённость – это своего рода «криопэги в». миниатюре ».
Обнажение залежей подземного пластового льда (фото из открытых источников)
Итак, мы убедились в том, что в любом мёрзлой породе всегда присутствует какое-то количество незамёрзшей воды.И если бы не её наличие в мёрзлой породе, пусть даже в виде тонких плёнок, то свойства и поведение мёрзлых были несколькими иными, поскольку именно количество незамёрзшей воды влияет почти на все физические и механические свойства мёрзлых пород. Очевидно, что чем меньше становится количество незамёрзшей воды в мёрзлой породе, тем порода делается прочнее, что обычно происходит при понижении отрицательной температуры. Внешнее воздействие на мёрзлую породу, например, давление, может приводить к таянию льда, приводит к переходу части молекулы воды в более подвижное состояние, в результате чего плёнки незамёрзшей воды на поверхности минеральных частиц и кристаллов льда утолщаются.И мёрзлая порода начинает вести себя как более высокотемпературная и вязкая среда, приближаясь по своим механическим характеристикам к талой (немёрзлой) породе. При этом, если воздействие на мёрзлую породу, даже весьма существенно, она сопротивляется нагрузкам, как прочная скальная порода, поскольку плавление льда и сдвиг грунта по плёнкам незамёрзшей воды не успевают произойти. Но под воздействием длительной и возрастающей нагрузки в мёрзлых породах с течением времени начинают развиваться деформации и явление ползучести, когда порода проявляет пластические свойства и как бы течёт под нагрузкой, что может привести к потере прочности и полному её разрушению.
Очевидно, что чем меньше становится количество незамёрзшей воды в мёрзлой породе, тем порода делается прочнее, что обычно происходит при понижении отрицательной температуры. Внешнее воздействие на мёрзлую породу, например, давление, может приводить к таянию льда, приводит к переходу части молекулы воды в более подвижное состояние, в результате чего плёнки незамёрзшей воды на поверхности минеральных частиц и кристаллов льда утолщаются.И мёрзлая порода начинает вести себя как более высокотемпературная и вязкая среда, приближаясь по своим механическим характеристикам к талой (немёрзлой) породе. При этом, если воздействие на мёрзлую породу, даже весьма существенно, она сопротивляется нагрузкам, как прочная скальная порода, поскольку плавление льда и сдвиг грунта по плёнкам незамёрзшей воды не успевают произойти. Но под воздействием длительной и возрастающей нагрузки в мёрзлых породах с течением времени начинают развиваться деформации и явление ползучести, когда порода проявляет пластические свойства и как бы течёт под нагрузкой, что может привести к потере прочности и полному её разрушению. Эти реологические мёрзлых пород должны всегда учитываться при проектировании инженерных сооружений в Арктике и планировании хозяйственной деятельности на северных территориях. А основная причина всех этих проблем – уже знакомая нам незамёрзшая вода!
Эти реологические мёрзлых пород должны всегда учитываться при проектировании инженерных сооружений в Арктике и планировании хозяйственной деятельности на северных территориях. А основная причина всех этих проблем – уже знакомая нам незамёрзшая вода!
Мёрзлые грунты по своему агрегатному состоянию являются твёрдыми телами, однако наличие в них незамёрзшей воды и льда обусловливает проявление реологических свойств.
Реология – (от греческого “rheos” – течение) – наука об изменениях во времени напряжённо-деформированного состояния любой сплошной среды.
О незамерзающей воде в мёрзлых породах можно было бы рассказать ещё много интересного. Например, о том, что при вымерзании насыщенных солями водных плёнок на их месте образуются новые криогенные минералы. Или о том, как по неизолированным (сообщающимся друг с другом) рыхлым плёнкам незамёрзшей мигрируют ионы солей или микроорганизмы, и иногда на крупных расстояниях своего проникновения в плёночную воду. А ещё – о том, как высокое содержание незамёрзшей воды «стирает» разницу в показателе для талых и мёрзлых пород при интерпретации данных геофизических исследований (акустических, электрических), в результате чего невозможно границу между талыми и мёрзлыми породами.
А ещё – о том, как высокое содержание незамёрзшей воды «стирает» разницу в показателе для талых и мёрзлых пород при интерпретации данных геофизических исследований (акустических, электрических), в результате чего невозможно границу между талыми и мёрзлыми породами.
Мы вынуждены оставить за рамками ознакомительной статьи. И мы будем рады, если то немногое, что нам удалось рассказать, сможет пробудить читателя интерес к такому парадоксальному, на первый взгляд, явлению, присущему Арктике, как существование в мёрзлых породах незамерзающей.
Авторы: Чувилин Е.М., Соколова Н.С., Центр добычи углеводородов Сколтеха.
Градусы Фаренгейта конвертация
Фаренгейта
Единица:
Широкое использование:
- Шкалу Фаренгейта заменила шкалу Цельсия в большинстве стран во второй половине 20-го века, хотя шкала Фаренгейта остается официальной шкалой в Штатах, на Каймановых островах .

- Канада сохраняет шкалу Фаренгейта в качестве дополнительной, которую можно использовать в качестве шкалы Цельсия, а в Великобритании шкалой Фаренгейта сохраняет неофициально, особенно в плане выражения жаркой погоды (хотя холодная погода, как правило, выражается с помощью шкалы Цельсия).
Определение:
Шкала Фаренгейта является термодинамической температурной шкалой, где точка замерзания воды составляет 32 градусов по Фаренгейту (° F) и точка кипения 212 ° F (при нормальном атмосферном давлении). Это расстояние между точками кипения и замерзания воды ровно в 180 градусов. Таким образом, градус по шкале Фаренгейта равенство 1/180 от интервала между точками замерзания и кипения воды. Абсолютный ноль определен как -459,67 ° F.
Разница температуры в 1 ° F эквивалентна разнице температуры в 0,556 ° C.
Происхождение:
Названа в честь немецкого физика Даниеля Габриеля Фаренгейта (1686-1736), разработавшего эту шкалу в 1724 году. Фаренгейт был одним из, кто придумал использовать в термометрах ртуть. Он установил 0 градусов как стабильную температуру воды, льда и взятых в равных пропорциях. Затем 96 градусов – температуру «здорового человека при измерении термометром во рту или подмышкой».
Фаренгейт был одним из, кто придумал использовать в термометрах ртуть. Он установил 0 градусов как стабильную температуру воды, льда и взятых в равных пропорциях. Затем 96 градусов – температуру «здорового человека при измерении термометром во рту или подмышкой».
Вперед, температура замерзания воды была пересмотрена, как ровно 32 ° F, и нормальная температура человеческого тела, как 98,6 ° F
Распространенные ссылки:
- Температура Абсолютного Нуля, -459,67 ° F
- Температура замерзания воды, 32 ° F
- Температура теплого солнечного дня в умеренном климате, 72 ° F
- Нормальная температура человеческого тела, 98,6 ° F (при внутреннем измерении)
- Температура закипания воды, при давлении в 1 атмосферу, 212 ° F
Зависимость температуры кипения воды от высоты над уровнем моря
После создания пары калькуляторов на тему давления вообще (Конвертер единиц давления) и атмосферного давления в частности (Барометрическое нивелирование), захотелось узнать, как рассчитать температуру кипения воды в зависимости от высота.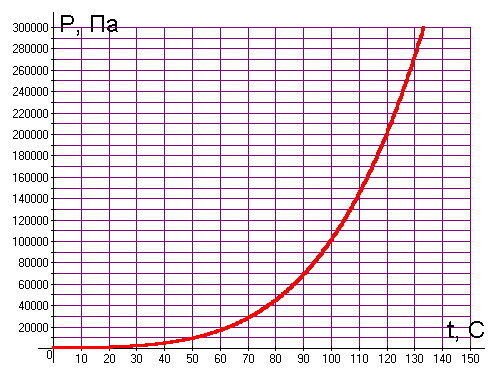 Я откуда-то знал, что на высоте вода кипит при температуре ниже 100 ° С – а вот при какой точно температуре она кипит – вопрос.
Я откуда-то знал, что на высоте вода кипит при температуре ниже 100 ° С – а вот при какой точно температуре она кипит – вопрос.
ча состоит из двух этапов – установить зависимость атмосферного давления от высоты и зависимость температуры кипения от давления. Начнем с последнего, как с более интересного.
Кипение представляет собой фазовый переход первого рода (вода сменяет агрегатное состояние из жидкого на газообразное).
Фазовый переход первого рода описывается уравнением Клапейрона:
,
где
– удельная теплота фазового перехода, которая численно равна количеству теплоты сообщаемой единице массы вещества для осуществления фазового перехода,
– температура фазового перехода,
– изменение удельного объема при переходе
Клаузиус упростил уравнение Клапейрона для случаев испарения и возгонки, предположив, что
- Пар подчиняется закону идеального газа
- Удельный объем жидкости много меньше удельного размера пара
Из пункта один следует, что состояние пара можно описать уравнением Менделеева-Клапейрона
,
а из пункта два – что удельным объемом жидкости можно пренебречь.
Таким образом, уравнение Клапейрона принимает вид
,
где удельный объем можно выразить через
,
и окончательно
разделяя переменные, получим
Проинтегрировав левую часть от до, а правую от до, т.е. от одной точки до другой точки, лежащей на линии равновесия жидкость-пар, получим уравнение
называемое уравнением Клаузиуса-Клапейрона.
Собственно, это и есть искомая зависимость температуры кипения от давления.
Проведем еще пару преобразований
,
здесь
– молярная масса воды, 18 г / моль
– универсальная газовая постоянная, 8.31 Дж / (моль × К)
– удельная теплота испарения воды 2.3 × 10 6 Дж / кг
Теперь осталось установить атмосферного давления от высоты. Здесь мы воспользуемся барометрической формулой (другой у нас все равно нет):
или
,
здесь
– молярная масса воздуха, 29 г / моль
– универсальная газовая постоянная, 8. 31 Дж / (моль × К)
31 Дж / (моль × К)
– ускорение силы тяжести, 9.81 м / (с × с)
– температура воздуха
Значения, относящиеся к воздуху, пометим индексом v, к воде – h
Приравняв и избавившись от экспонентов, получим
Ну и итоговая формула
На самом деле реальное давление воздуха следует считать барометрической формуле, так как при больших перепадах высот температуру воздуха нельзя считать постоянной. Кроме того, ускорение свободного падения зависит от географической широты, атмосферное давление – еще и от паров воды.То есть значение по этой формуле мы получим приближенное. Поэтому ниже я включил еще один калькулятор, который использует формулу для расчета температуры кипения в зависимости от давления воздуха в миллиметрах ртутного столба.
Калькулятор зависимости температуры кипения от высоты:
Зависимость температуры кипения воды от высоты над уровнем моря
(метры)
Температура воздуха (Цельсий)
Точность вычисленийЗнаков после запятой: 1
Температура кипения
content_copy Ссылка save Сохранить Виджет
Калькулятор зависимости температуры кипения от давления:
Зависимость температуры кипения воды от давления
Точность вычисленийЗнаков после запятой: 1
Температура кипения
content_copy Ссылка save Сохранить extension Виджет
Свойства пара / Техническая информация / Темп-ресурс
Свойства пара
Что это такое и как им пользоваться
Численные значения параметров теплоты, а также взаимосвязь между температурой и давлением, приведенные в настоящем Руководстве, взять из Таблицы “Свойства насыщенного пара”.
Применение применяемых терминов:
Насыщенный пар
Чистый пар, температура которого соответствует температуре воды при данном давлении.
Абсолютное давление
Абсолютное давление пара в барах (избыточное плюс атмосферное).
Зависимость между температурой и давлением
Каждому значению давления чистого пара соответствует определенная температура.Например: температура чистого пара при давлении 10 бар всегда равна 180 ° С.
Удельный объём пара
Масса пара, приходящаяся на единицу его объёма, кг / м3.
Теплота кипящей жидкости
Количество тепла, которое требуется для повышения температуры килограмма воды от 0 ° С до точки кипения при давлении и температуре, указанном в Таблице. Выражается в ккал / кг.
Скрытая температура парообразования
Количество тепла в ккал / кг, необходимое для превращения одного килограмма воды при температуре кипения в килограмм пара. При конденсации одного килограмма пара в килограмм воды высвобождает такое же самое количество теплоты. Как видно из Таблицы, для каждого сочетания давления и температуры этой теплоты будет разной.
При конденсации одного килограмма пара в килограмм воды высвобождает такое же самое количество теплоты. Как видно из Таблицы, для каждого сочетания давления и температуры этой теплоты будет разной.
Полная теплота насыщенного пара
Сумма теплоты кипящей жидкости и скрытой теплоты парообразования в ккал / кг. Она соответствует полной теплоте, содержится в паре с температурой выше 0 ° С.
Как пользоваться таблицами
Кроме определения зависимости между давлением и температурой пара, вы также можете вычислить количество пара, которое превратится в конденсат в любом теплообменнике, если известно передаваемое количество теплоты в ккал.Иначе, Таблицу можно использовать для определения количества переданного теплообменником теплоты.
1 | 2 | 3 | 4 | 5 | 6 | 7 |
Абсолют. Давление бар | Температура пара ° С | Уд.объем пара м3 / кг | Плотность пара кг / м3 | Теплота жидкости ккал / кг | Скрытая теплота парообра- зования ккал / кг | Полная теплота пара |
P | т | В | 7 | кв | r | Х = д + г |
0,010 | 7,0 | 129,20 | 0,007739 | 7,0 | 593,5 | 600,5 |
0,020 | 17,5 | 67,01 | 0,01492 | 17,5 | 587,6 | 605,1 |
0,030 | 24,1 | 45,67 | 0,02190 | 24,1 | 583,9 | 608,0 |
0,040 | 29,0 | 34,80 | 0,02873 | 28,9 | 581,2 | 610,1 |
0,050 | 32,9 | 28,19 | 0,03547 | 32,9 | 578,9 | 611,8 |
0,060 | 36,2 | 23,47 | 0,04212 | 36,2 | 577,0 | 613,2 |
0,070 | 39,0 | 20,53 | 0,04871 | 39,0 | 575,5 | 614,5 |
0,080 | 41,5 | 18,10 | 0,05523 | 41,5 | 574,0 | 615,5 |
0,090 | 43,8 | 16,20 | 0,06171 | 43,7 | 572,8 | 616,5 |
0,10 | 45,8 | 14,67 | 0,06814 | 45,8 | 571,8 | 617,6 |
0,20 | 60,1 | 7,650 | 0,1307 | 60,1 | 563,3 | 623,4 |
0,30 | 69,1 | 5,229 | 0,1912 | 69,1 | 558,0 | 627. |
0,40 | 75,9 | 3,993 | 0,2504 | 75,8 | 554,0 | 629,8 |
0,50 | 81,3 | 3,240 | 0,3086 | 81,3 | 550,7 | 632,0 |
0,60 | 86,0 | 2 732 | 0,3661 | 85,9 | 547,9 | 633,8 |
0,70 | 90,0 | 2,365 | 0,4229 | 89,9 | 545,5 | 635,4 |
0,80 | 93,5 | 2,087 | 0,4792 | 93,5 | 543,2 | 636,7 |
0,90 | 96,7 | 1,869 | 0,5350 | 96,7 | 541,2 | 637,9 |
1,00 | 99,6 | 1,694 | 0,5904 | 99,7 | 539,3 | 639,0 |
1,5 | 111,4 | 1,159 | 0,8628 | 111,5 | 531,8 | 643,3 |
2,0 | 120,2 | 0,8854 | 1,129 | 120,5 | 525,9 | 646,4 |
2,5 | 127,4 | 0,7184 | 1,392 | 127,8 | 521,0 | 648,8 |
3,0 | 133,5 | 0,6056 | 1,651 | 134,1 | 516,7 | 650,8 |
3,5 | 138,9 | 0,5240 | 1 908 | 139,5 | 512,9 | 652,4 |
4,0 | 143,6 | 0,4622 | 2,163 | 144,4 | 509,5 | 653,9 |
4,5 | 147,9 | 0,4138 | 2,417 | 148,8 | 506,3 | 655,1 |
5,0 | 151,8 | 0,3747 | 2,669 | 152,8 | 503,4 | 656,2 |
6,0 | 158,8 | 0,3155 | 3,170 | 160,1 | 498,0 | 658,1 |
7,0 | 164,9 | 0,2727 | 3,667 | 166,4 | 493,3 | 659,7 |
8,0 | 170,4 | 0,2403 | 4 162 | 172,2 | 488,8 | 661,0 |
9,0 | 175,4 | 0,2148 | 4 655 | 177,3 | 484,8 | 662,1 |
10 | 179,9 | 0,1943 | 5 147 | 182,1 | 481,0 | 663,1 |
11 | 184,1 | 0,1774 | 5 637 | 186,5 | 477,4 | 663,9 |
12 | 188,0 | 0,1632 | 6,127 | 190,7 | 473,9 | 664,6 |
13 | 191,6 | 0,1511 | 6 617 | 194,5 | 470,8 | 665,3 |
14 | 195,0 | 0,1407 | 7,106 | 198,2 | 467,7 | 665,9 |
15 | 198,3 | 0,1317 | 7 596 | 201,7 | 464,7 | 666,4 |
16 | 201,4 | 0,1237 | 8 085 | 205,1 | 461,7 | 666,8 |
17 | 204,3 | 0,1166 | 8,575 | 208,2 | 459,0 | 667,2 |
18 | 207,1 | 0,1103 | 9 065 | 211,2 | 456,3 | 667,5 |
19 | 209,8 | 0,1047 | 9 555 | 214,2 | 453,6 | 667,8 |
20 | 212,4 | 0,09954 | 10,05 | 217,0 | 451,1 | 668,1 |
25 | 223,9 | 0,07991 | 12,51 | 229,7 | 439,3 | 669,0 |
30 | 233,8 | 0,06663 | 15,01 | 240,8 | 428,5 | 669,3 |
40 | 250,3 | 0,04975 | 20,10 | 259,7 | 409,1 | 668,8 |
50 | 263,9 | 0,03943 | 25,36 | 275,7 | 391,7 | 667,4 |
60 | 275,6 | 0,03244 | 30,83 | 289,8 | 375,4 | 665,2 |
70 | 285,8 | 0,02737 | 36,53 | 302,7 | 359,7 | 662,4 |
80 | 295,0 | 0,02353 | 42,51 | 314,6 | 344,6 | 659,2 |
90 | 303,3 | 0,02050 | 48,79 | 325,7 | 329,8 | 655,5 |
100 | 311,0 | 0,01804 | 55,43 | 336,3 | 315,2 | 651,5 |
110 | 318,1 | 0,01601 | 62,48 | 346,5 | 300,6 | 647,1 |
120 | 324,7 | 0,01428 | 70,01 | 356,3 | 286,0 | 642,3 |
130 | 330,8 | 0,01280 | 78,14 | 365,9 | 271,1 | 637,0 |
140 | 336,6 | 0,01150 | 86,99 | 375,4 | 255,7 | 631,1 |
150 | 342,1 | 0,01034 | 96,71 | 384,7 | 239,9 | 624,6 |
200 | 365,7 | 0,005877 | 170,2 | 436,2 | 141,4 | 577,6 |
1 ккал = 4,186 кдж
1 кдж = 0,24 ккал
1 бар = 0,102 МПа
ПАР ВТОРИЧНОГО ВСКИПАНИЯ
Что такое пар вторичного вскипания:
Когда горячий конденсат или вода
из котла, находящиеся под определенным давлением, выпускаются в пространстве, где
действует меньшее давление, часть жидкости вскипает и превращается в так
называемый пар вторичного вскипания.
Почему он имеет важное значение:
Этот пар важен потому, что в нем содержится определенное количество теплоты, которая может быть определенное для повышения экономичности работы предприятия, т.к. в противном случае она будет безвозвратно потеряна. Однако, чтобы получить пользу от пара вторичного вскипания, нужно знать как в каком количестве он образует в конкретных условиях.
Как он образуется:
Если нагревать при атмосферном давлении, ее температура будет повышаться пока не достигнет 100 ° С – самой высокой температуры, при которой вода может существовать при давлении в виде жидкости.Дальнейшее добавление теплоты не повышает температуру воды, а превращает ее в пар.
Теплота, поглощенная водой в
процесса повышения температуры до точки кипения, называется физической теплотой
или тепло-содержание. Теплота, необходимая для превращения воды в пар, при
Температура точки кипения, называется скрытой теплотой парообразования. Единицей теплоты, в общем случае, является килокалория (ккал), которая равна
количеству тепла, необходимому для повышения температуры одного килограмма воды
на 1 ° С при атмосферном давлении.
Единицей теплоты, в общем случае, является килокалория (ккал), которая равна
количеству тепла, необходимому для повышения температуры одного килограмма воды
на 1 ° С при атмосферном давлении.
Однако, если воду нагревать при давления выше атмосферного, ее точка кипения будет выше 100 ° С, в силу чего увеличится также и количество необходимой физической теплоты. Чем выше давление, тем выше температура кипения воды и ее теплосодержание. Если давление понижается, то теплосодержание также уменьшается и температура кипения воды падает до температуры, новому значению давления. Это значит, что определенное количество физической теплоты высвобождается.Эта избыточная теплота будет поглощаться в форме скрытой теплоты парообразования, вызывая вскипание части воды и превращение ее в пар. Примером может быть выпуск конденсата из конденсатоотводчика или выпуск воды из котла при продувке. Количество образующегося при этом пара можно вычислить.
Конденсат при температуре пара 179,9
° C
и
давления 10 бар обладает теплотой в количестве 182, 1ккал / кг. См. Колонку 5
таблицы параметров пара. Если его выпускать в атмосферу, т.е. при абсолютном
давления 1 бар, теплосодержание конденсата сразу же упадет до 99,7 ккал / кг.
Избыток теплоты в количестве 82,3 ккал / кг вызов вторичное вскипание части
конденсата. Величину части конденсата в%, которая превратится в пар вторичного
вскипания, определить следующим образом:
См. Колонку 5
таблицы параметров пара. Если его выпускать в атмосферу, т.е. при абсолютном
давления 1 бар, теплосодержание конденсата сразу же упадет до 99,7 ккал / кг.
Избыток теплоты в количестве 82,3 ккал / кг вызов вторичное вскипание части
конденсата. Величину части конденсата в%, которая превратится в пар вторичного
вскипания, определить следующим образом:
Разделите разницу между теплосодержанием конденсата при большем и при меньшем давлениих на воздействие скрытой теплоты парообразования при меньшем давлении значении давления и умножьте результат на 100.
Выразив это в виде формулы, получим:
% пар вторичного вскипания
q1 = теплота конденсата при большем значении давления до его выпуска
q2 = теплота конденсата при меньшем значении давления, т.е. в пространстве, куда производится выпуск
г = скрытая теплота парообразования пара при меньшем значении давления, при в котором создается выпуск конденсата
% пара вторичного вскипания =
График 1.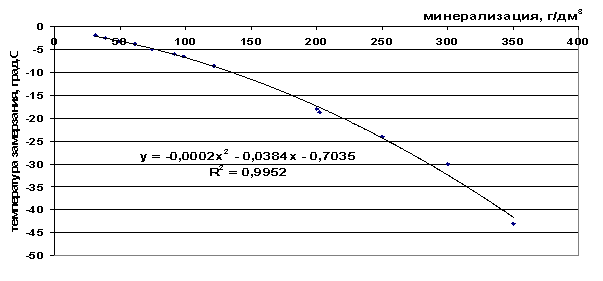
График 2.
Объем пара вторичного вскипания при выпуске одного кубического метра конденсата в систему с атмосферным давлением.
Для упрощения расчетов, на графике показано количество пара вторичного вскипания, которое будет образовываться, если выпуск конденсата будет производиться при разных давлениях на выходе
Влияние присутствия воздуха на температуру пара
Рис.1 пояс дает, к чему приводит присутствие воздуха в паропроводах, а в Таблице 1 и на Графике 1 вызвать снижение температуры пара от процентного содержания в нем воздуха при различных давлениях.
Влияние присутствия воздуха на теплопередачу
Воздух, обладая отличными
изоляционными свойствами, может образовать, по мереенсации пара,
своеобразное “покрытие” на поверхностях теплопередачи и значительно
понизить ее эффективность.
При определенных условиях, даже такое незначительное количество воздуха в паре как 0,5% по объему может меньшая эффективность тепло – передачи на 50%. См. Рис.1
СО 2 в газообразной , образовавшись в котле и перемещаясь вместе с паром, может растворится в конденсате, охлажденном ниже температуры пара, и образовать угольную кислоту. Эта кислота весьма агрессивна и в итоге “проест” трубопроводы и теплообменное оборудование.См. Рис.2. Если в систему попадает кислород, он может вызвать питтинговую чугунных и стальных поверхностей. См. Рис. 3.
Паровая камера со 100% содержание пара. Общее давление 10 бар. Давления пара 10 бар температура пара 180 ° С
Рис.1. Камера, в которой находится смесь пара и воздуха, передает только ту часть теплоты, которая соответствует парциальному давлению пара, а не полному давлению в ее полости.
Паровая камера с содержанием пара 90%
И воздуха 10%. Полное давление
10 бар. Давление
Полное давление
10 бар. Давление
Пара 9 бар, температура пара 175,4 ° С
Таблица 1.
Снижение температуры паро-воздушной смеси в зависимости от содержания воздуха | ||||
Давление | Температура насыщ.пара | Температура паро-воздушной смеси от к-ва воздуха в объему, ° С | ||
бар | ° С | 10% | 20% | 30% |
2 | 120,2 | 116.7 | 113,0 | 110,0 |
4 | 143,6 | 140,0 | 135,5 | 131,1 |
6 | 158. | 154,5 | 150,3 | 145,1 |
8 | 170,4 | 165,9 | 161,3 | 155,9 |
10 | 179.9 | 175,4 | 170,4 | 165,0 |
Свойства пара
Теплофизические свойства воды и водяного пара (программа расчета)
Методические указания по очистке и контролю возвратного конденсата (РД 34.37.515-93)
Точка кипения – Температура кипения
Температура, при которой превращается жидкость в пар
Температура кипения вещество представляет собой температуру, при которой давление пара из жидкости равно давлению окружающего жидкость и превращается в пар.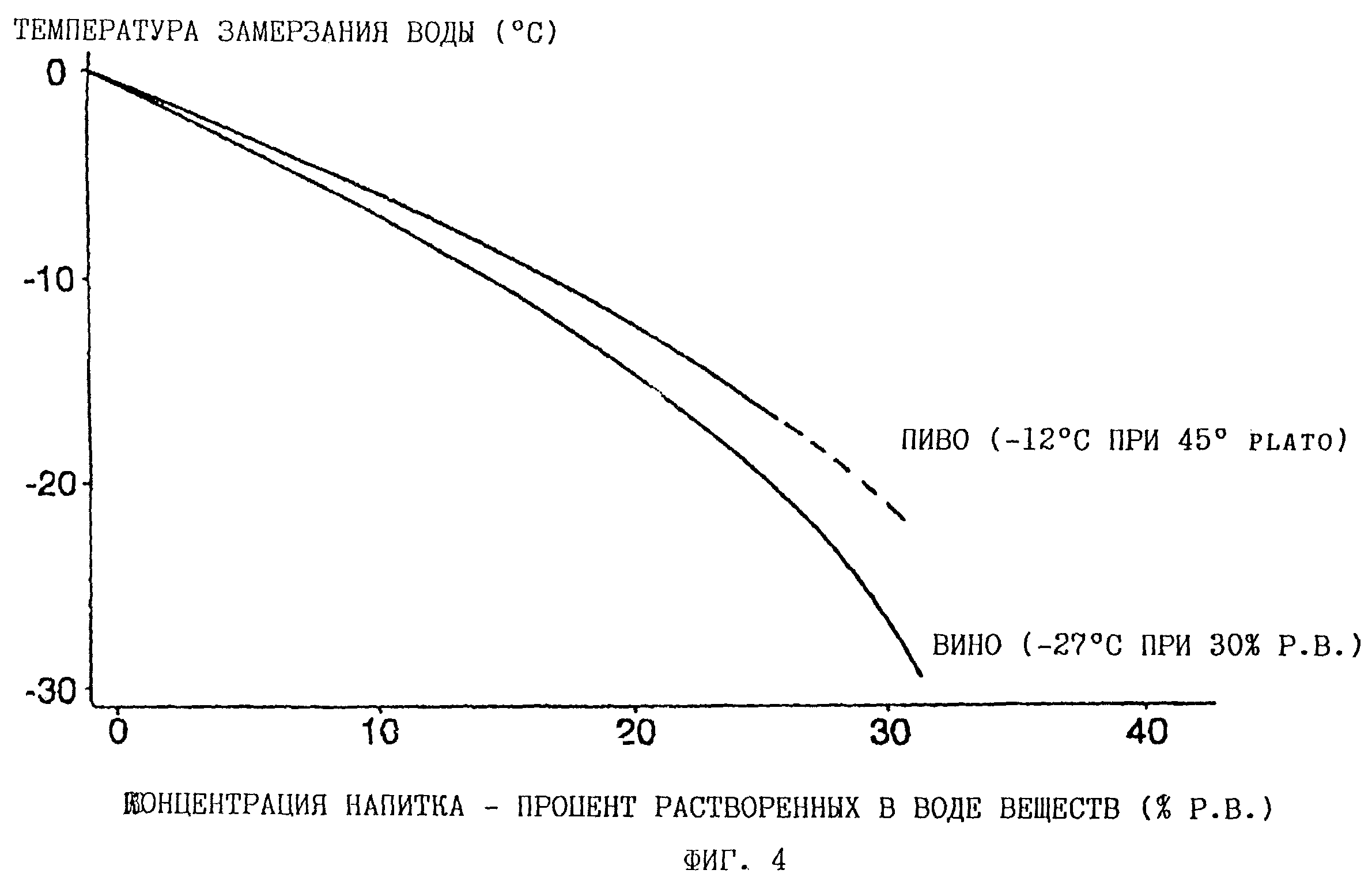
Температура кипения жидкости меняется в зависимости от давления окружающей среды. Жидкость в частичном вакууме имеет более низкую температуру кипения, чем когда жидкость при атмосферном давлении. Жидкость под высоким давлением имеет более высокую точку кипения, чем когда жидкость находится под атмосферным давлением. Например, вода закипает при температуре 100 ° C (212 ° F) на уровне моря и 93,4 ° C (200,1 ° F) на высоте 1905 метров (6250 футов). При заданном давлении разные жидкости будут кипеть при разных температурах.
Нормальная температура кипения (также называется атмосферный температурой кипения или температурой кипения при атмосферном давлении ) жидкость частным случаем, в которой давление пара жидкости равно определенное атмосферное давление на уровне моря, одной атмосферы. При этой температуре давление пара жидкости достаточным, чтобы преодолеть атмосферное давление и пузырькам пара образоваться внутри объема жидкости. Стандартная точка кипения была определена IUPAC с 1982 года, какова температура, при которой происходит кипение под давлением одного бара.
Теплота парообразования является энергией, необходимой для преобразования заданного количества (в мол, кг, фунт и т.д.) веществ из жидкости в газе при заданном давлении (часто при атмосферном давлении).
Жидкости могут превращаться в пар при температуре ниже их точек кипения в процессе испарения.Испарение – это поверхностное явление, при котором молекулы, расположенные у края жидкости, не обладают достаточным давлением жидкости этой стороны, уходят в среду в виде пара. С другой стороны, кипение – это процесс, при котором молекулы в любом месте жидкости улетучиваются, что приводит к образованию пузырьков пара внутри жидкости.
Температура и давление насыщения
Демонстрация более низкой точки кипения воды при более низком давлении, достигаемой с помощью вакуумного насоса. Насыщенная жидкость содержит столько же тепловой энергии, как это может без кипения (или, наоборот, насыщенный пар содержит как мало тепловую энергию, как это может без конденсации).
Температура насыщения означает Температура кипения . Температура насыщения – это температура для соответствующего давления насыщения, при которой жидкость переходит в свою паровую фазу. Можно сказать, что жидкость насыщена тепловая энергия.Любое добавление тепловой энергии приводит к фазовому переходу.
Если давление в системе остается постоянным (изобарическим), пар температура при насыщении начинает конденсироваться в жидкую фазу по мере удаления тепловой энергии (тепла). Точно так же жидкость при температуре и давлении будет кипеть в паровой фазу при приложении тепловой энергии.
Точка кипения соответствует температуре, при которой давление пара равно давлению окружающей среды.Таким образом, температура кипения зависит от давления. Точки кипения могут быть опубликованы в соответствии с NIST, стандартным давлением США 101,325 кПа (или 1 атм) или стандартным давлением IUPAC 100,000 кПа. На больших высотах, где атмосферное давление намного ниже, температура кипения также ниже. {- 1}}
{- 1}}
где:
- Т B {\ displaystyle T_ {B}} – температура кипения при интересующем давлении,
- р {\ displaystyle R} – постоянная идеального газа,
- п {\ displaystyle P} – давление пара жидкости при интересующем давлении,
- п 0 {\ displaystyle P_ {0}} – некоторое давление, соответствующее известному (обычно данные доступны при 1 атм или 100 кПа), Т 0 {\ displaystyle T_ {0}}
- Δ ЧАС vap {\ displaystyle \ Delta H _ {\ text {vap}}} – теплота испарения жидкости,
- Т 0 {\ displaystyle T_ {0}} это температура кипения,
- пер {\ displaystyle \ ln} это натуральный логарифм.
Давление насыщения – это давление для обеспечения температуры насыщения, при которой жидкость переходит в паровую фазу. Увеличивает насыщения.
Если температура в системе остается постоянной ( изотермическая система ), пар при давлении насыщения и температура начинается конденсироваться в жидкую фазкуюу по мере увеличения давления в системе. Аналогичным образом, жидкость под давлением насыщения и температурой будет иметь тенденцию мигать в его парообразной фазе при уменьшении давления в системе.
Аналогичным образом, жидкость под давлением насыщения и температурой будет иметь тенденцию мигать в его парообразной фазе при уменьшении давления в системе.
Есть два соглашения относительно стандартной точки кипения воды : Нормальная точка кипения составляет 99,97 ° C (211,9 ° F) при давлении 1 атм (то есть есть 101,325 кПа). Рекомендуемая ИЮПАК стандартная температура кипения воды при стандартном давлении 100 кПа (1 бар) составляет 99,61 ° C (211,3 ° F).Для сравнения: на вершине Эвереста, на высоте 8 848 м (29 029 футов), давление составляет около 34 кПа (255 торр), а температура кипения воды составляет 71 ° C (160 ° F). Температурная шкала Цельсия определялась до 1954 года двумя точками: 0 ° C определялась точкой замерзания воды, а 100 ° C определялась точкой кипения воды при стандартном атмосферном давлении.
Связь между нормальной температурой кипения и давлением пара жидкостей
График давления паров по лог-лингу для различных жидкостей Чем выше давление пара жидкости при данной температуре, тем ниже нормальная точка кипения (т. е. точка кипения при атмосферном давлении) жидкости.
е. точка кипения при атмосферном давлении) жидкости.
На диаграмме давления пара справа графики зависимости давления пара от температуры для различных жидкостей. Как видно из диаграмм, жидкости с самым высоким уровнем пара имеют самую низкую нормальную температуру кипения.
Например, при любой заданной температуре хлористый метил имеет самое высокое давление пара среди всех жидкостей в таблице. Он также имеет самую низкую нормальную точку кипения (-24,2 ° C), где кривая давление паров хлористого метила (синяя линия) пересекает горизонтальную линию давления в одну атмосферу (атм) абсолютного давления пара.
Критическая точка жидкости высокой температурой (и давления) он будет на самом деле кипеть при.
См. Также “Давление водяного пара”.
Свойства элементов
Элемент с самой низкой температурой кипения – гелий. Обе точки кипения рения и вольфрама превышают 5000 К при стандартном давлении; Точно измерить экстремальные температуры без предвзятости, в литературе указывается, что оба они имеют высокую температуру кипения.
Температура кипения как эталонное свойство чистого соединения
Как видно из приведенной выше диаграммы давления пара в зависимости от температуры для любого данного чистого химического соединения, его нормальная точка кипения может служить индикатором общей летучести этого соединения. У данного чистого соединения есть только одна нормальная точка кипения, если таковая имеется, и нормальная точка кипения и точка плавления может служить указанными физическими свойствами для этого соединения, перечисленными в справочниках.Чем выше нормальная точка кипения соединения, тем менее летучим это соединение в целом, и наоборот, чем ниже нормальная точка кипения соединения, тем более летучим это соединение в целом. Некоторые соединения разлагаются при более высоких температурах, прежде чем достижении своей нормальной точки кипения, а иногда даже до точки плавления. Для стабильного соединения точка кипения находится в диапазоне от тройной точки до критической точки в зависимости от внешнего давления. За пределами тройной точки нормальная точка кипения, если таковая имеется, выше точки плавления.За пределами критической точки жидкая и паровая фазы соединения сливаются в одну фазу, которую можно назвать перегретым газом. При любой заданной температуре, если нормальная точка кипения соединения ниже, то соединение обычно будет существовать в виде газа при атмосферном внешнем давлении. Если нормальная точка кипения соединения выше, то это может существовать в виде жидкости или твердого вещества при атмосферном атмосферном внешнем давлении и, таким образом, будет существовать в равновесии со паром (если летучим).В результате получается несколько соединений, соединяющихся, несмотря на их более высокую температуру кипения.
За пределами тройной точки нормальная точка кипения, если таковая имеется, выше точки плавления.За пределами критической точки жидкая и паровая фазы соединения сливаются в одну фазу, которую можно назвать перегретым газом. При любой заданной температуре, если нормальная точка кипения соединения ниже, то соединение обычно будет существовать в виде газа при атмосферном внешнем давлении. Если нормальная точка кипения соединения выше, то это может существовать в виде жидкости или твердого вещества при атмосферном атмосферном внешнем давлении и, таким образом, будет существовать в равновесии со паром (если летучим).В результате получается несколько соединений, соединяющихся, несмотря на их более высокую температуру кипения.
Как правило, с ионными связями возникают высокие температуры и кипения, если они не разлагаются до высоких температур. Многие металлы имеют высокие температуры кипения, но не все. В самом общем случае – при прочих равных факторах – в соединении с ковалентно связанными молекулами, когда размер молекулы (или молекулярная масса) увеличивается, нормальная точка кипения увеличивается. Когда размер молекулы становится размером с макромолекулу, соединение часто разлагается при высокой температуре до того, как будет достигнута точка кипения. Другой фактор, влияющий на нормальную температуру кипения соединения, – полярность его молекулы. По мере того, как полярность молекулы увеличивается, его нормальная точка кипения увеличивается, при равных условиях. Тесно способность молекулы образовывать жидкие соединения (в жидком состоянии), что затрудняет выход молекулы из жидкого состояния, таким образом, увеличивает нормальную точку зрения соединения.Простые карбоновые кислоты димеризуются, образуя водородные связи между молекулами. Незначительный фактор, влияющий на температуру кипения, – это форма молекулы. Делая формулы более компактной, как правило, немного понижает нормальную точку кипения по сравнению с эквивалентной молекулой с большей площадью поверхности.
Когда размер молекулы становится размером с макромолекулу, соединение часто разлагается при высокой температуре до того, как будет достигнута точка кипения. Другой фактор, влияющий на нормальную температуру кипения соединения, – полярность его молекулы. По мере того, как полярность молекулы увеличивается, его нормальная точка кипения увеличивается, при равных условиях. Тесно способность молекулы образовывать жидкие соединения (в жидком состоянии), что затрудняет выход молекулы из жидкого состояния, таким образом, увеличивает нормальную точку зрения соединения.Простые карбоновые кислоты димеризуются, образуя водородные связи между молекулами. Незначительный фактор, влияющий на температуру кипения, – это форма молекулы. Делая формулы более компактной, как правило, немного понижает нормальную точку кипения по сравнению с эквивалентной молекулой с большей площадью поверхности.
| Распространенное имя | н – бутан | изобутан |
|---|---|---|
| Название ИЮПАК | бутан | 2-метилпропан |
| Молекулярная форма | ||
| Точка кипения (° C) | -0,5 | -11,7 |
Большинство летучих соединений (где-то близко к окружающей среде) проходят через промежуточную жидкую фазу, через твердую фазу, чтобы в итоге перейти в паровую фазу.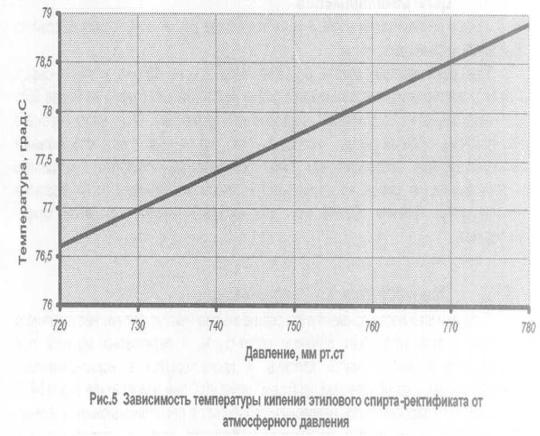 По сравнению с кипением сублимация – это физическое преобразование, которое происходит непосредственно в пар, что происходит в некоторых отдельных случаях, например, с диоксидом углерода при атмосферном давлении. Для таких соединений точка сублимации – это температура, при которой твердое тело, превращающееся в пар, имеет давление пара, равное внешнему внешнему виду.
По сравнению с кипением сублимация – это физическое преобразование, которое происходит непосредственно в пар, что происходит в некоторых отдельных случаях, например, с диоксидом углерода при атмосферном давлении. Для таких соединений точка сублимации – это температура, при которой твердое тело, превращающееся в пар, имеет давление пара, равное внешнему внешнему виду.
Примеси и смеси
В предыдущем разделе были рассмотрены температуры кипения чистых соединений.На давление влияет пар примесей (растворенных веществ) или других смешиваемых соединений, причем степень воздействия зависит от примесей или других соединений. Присутствие нелетучих примесей, таких как соли или соединения, летучесть которых ниже, чем у основного компонента, снижает его мольную долю и летучесть раствор и, таким образом, повышает нормальную точку кипения пропорционально растворенных веществ.Этот эффект называется повышением точки кипения . Как распространенный пример, соленая вода кипит при более высокой температуре, чем чистая вода.
В других смесях смешиваемых соединений (компонентов) может быть два или более компонентов с различными летучестью, каждый из которых имеет свою собственную точку кипения чистого компонента при любом заданном давлении. Присутствие других летучих компонентов в смеси влияет на давление пара и, следовательно, на точки кипения и точки росы всех компонентов в смесях.Точка росы – это температура, при которой пар конденсируется в жидкость. Более того, при любой заданной температуре состав от большинства таких случаев. Чтобы проиллюстрировать эти эффекты между летучими компонентами в смесях, обычно используется диаграмма точки кипения . Дистилляция – это процесс кипения и [обычно] конденсации, в которой используются различные в составе жидкой фазы и пар фаз.
Смотрите также
Рекомендации
внешние ссылки
.
 То же и с трубами рядом со стенами неотапливаемых помещений, расположенных у меня до высоты 150 см. То есть трубы ПНД никакие не замёрзли нигде несмотря на полное отсутствие в них движения воды.
То же и с трубами рядом со стенами неотапливаемых помещений, расположенных у меня до высоты 150 см. То есть трубы ПНД никакие не замёрзли нигде несмотря на полное отсутствие в них движения воды. 01
01 ru
ru Последнее говорит о том, что жидкость перекипела.
Последнее говорит о том, что жидкость перекипела.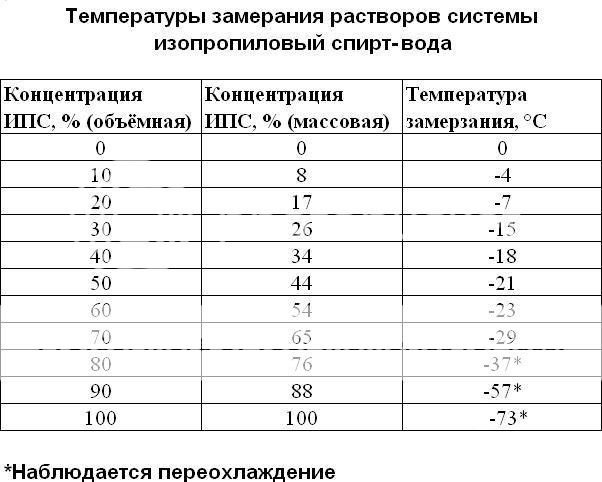 Такой процесс назвали «кипение белым ключом»;
Такой процесс назвали «кипение белым ключом»;
 1
1 8
8