Плотность воздуха, его удельная теплоемкость, вязкость и другие физические свойства: таблицы при различных температурах
Рассмотрены основные физические свойства воздуха: плотность воздуха, его динамическая и кинематическая вязкость, удельная теплоемкость, теплопроводность, температуропроводность, число Прандтля и энтропия. Свойства воздуха даны в таблицах в зависимости от температуры при нормальном атмосферном давлении.
Плотность воздуха в зависимости от температуры
Представлена подробная таблица значений плотности воздуха в сухом состоянии при различных температурах и нормальном атмосферном давлении. Чему равна плотность воздуха? Аналитически определить плотность воздуха можно, если разделить его массу на объем, который он занимает при заданных условиях (давление, температура и влажность). Также можно вычислить его плотность по формуле уравнения состояния идеального газа. Для этого необходимо знать абсолютное давление и температуру воздуха, а также его газовую постоянную и молярный объем. Это уравнение позволяет вычислить плотность воздуха в сухом состоянии.
На практике, чтобы узнать какова плотность воздуха при различных температурах
| t, °С | ρ, кг/м3 | t, °С | ρ, кг/м3 | t, °С | ρ, кг/м3 | t, °С | ρ, кг/м3 |
|---|---|---|---|---|---|---|---|
| -50 | 1,584 | 20 | 1,205 | 150 | 0,835 | 600 | 0,404 |
| -45 | 1,549 | 30 | 1,165 | 160 | 0,815 | 650 | 0,383 |
| -40 | 1,515 | 40 | 1,128 | 170 | 0,797 | 700 | 0,362 |
| -35 | 1,484 | 50 | 1,093 | 180 | 0,779 | 750 | 0,346 |
| -30 | 1,453 | 60 | 1,06 | 190 | 0,763 | 800 | 0,329 |
| -25 | 1,424 | 70 | 1,029 | 200 | 0,746 | 850 | 0,315 |
| -20 | 1,395 | 80 | 1 | 250 | 0,674 | 900 | 0,301 |
| -15 | 1,369 | 90 | 0,972 | 300 | 0,615 | 950 | 0,289 |
| -10 | 1,342 | 100 | 0,946 | 350 | 0,566 | 1000 | 0,277 |
| -5 | 1,318 | 110 | 0,922 | 400 | 0,524 | 1050 | 0,267 |
| 0 | 1,293 | 120 | 0,898 | 450 | 0,49 | 1100 | 0,257 |
| 10 | 1,247 | 130 | 0,876 | 500 | 0,456 | 1150 | 0,248 |
| 15 | 1,226 | 140 | 0,854 | 550 | 0,43 | 1200 | 0,239 |
При 25°С воздух имеет плотность 1,185 кг/м3. При нагревании плотность воздуха снижается — воздух расширяется (его удельный объем увеличивается). С ростом температуры, например до 1200°С, достигается очень низкая плотность воздуха, равная 0,239 кг/м3, что в 5 раз меньше ее значения при комнатной температуре. В общем случае, снижение плотности газов при нагреве позволяет проходить такому процессу, как естественная конвекция и применяется, например, в воздухоплавании.
Если сравнить плотность воздуха относительно плотности воды, то воздух легче на три порядка — при температуре 4°С плотность воды равна 1000 кг/м3, а плотность воздуха составляет 1,27 кг/м3. Необходимо также отметить значение плотности воздуха при нормальных условиях. Нормальными условиями для газов являются такие, при которых их температура равна 0°С, а давление равно нормальному атмосферному. Таким образом, согласно таблице, плотность воздуха при нормальных условиях (при НУ) равна 1,293 кг/м3.
Динамическая и кинематическая вязкость воздуха при различных температурах
При выполнении тепловых расчетов необходимо знать значение вязкости воздуха (коэффициента вязкости) при различной температуре. Эта величина требуется для вычисления числа Рейнольдса, Грасгофа, Релея, значения которых определяют режим течения этого газа. В таблице даны значения коэффициентов динамической μ и кинематической ν вязкости воздуха в диапазоне температуры от -50 до 1200°С при атмосферном давлении.
Коэффициент вязкости воздуха с ростом его температуры значительно увеличивается. Например, кинематическая вязкость воздуха равна 15,06·10-6 м2
При нагревании воздуха увеличиваются значения как кинематической, так и динамической вязкости. Эти две величины связаны между собой через величину плотности воздуха, значение которой уменьшается при нагревании этого газа. Увеличение кинематической и динамической вязкости воздуха (как и других газов) при нагреве связано с более интенсивным колебанием молекул воздуха вокруг их равновесного состояния (согласно МКТ).
| t, °С | μ·106, Па·с | ν·106, м2/с | t, °С | μ·106, Па·с | ν·106, м2/с | t, °С | μ·106, Па·с | ν·106, м2/с |
|---|---|---|---|---|---|---|---|---|
| -50 | 14,6 | 9,23 | 70 | 20,6 | 20,02 | 350 | 31,4 | 55,46 |
| -45 | 14,9 | 9,64 | 80 | 21,1 | 21,09 | 400 | 33 | 63,09 |
| -40 | 15,2 | 10,04 | 90 | 21,5 | 22,1 | 450 | 34,6 | 69,28 |
| -35 | 15,5 | 10,42 | 100 | 21,9 | 23,13 | 500 | 36,2 | 79,38 |
| -30 | 15,7 | 10,8 | 110 | 22,4 | 24,3 | 550 | 37,7 | 88,14 |
| -25 | 16 | 11,21 | 120 | 22,8 | 25,45 | 600 | 39,1 | 96,89 |
| -20 | 16,2 | 11,61 | 130 | 23,3 | 26,63 | 650 | 40,5 | 106,15 |
| -15 | 16,5 | 12,02 | 140 | 23,7 | 27,8 | 700 | 41,8 | 115,4 |
| -10 | 16,7 | 12,43 | 150 | 24,1 | 28,95 | 750 | 43,1 | 125,1 |
| -5 | 17 | 12,86 | 160 | 24,5 | 30,09 | 800 | 44,3 | 134,8 |
| 0 | 17,2 | 13,28 | 170 | 24,9 | 31,29 | 850 | 45,5 | 145 |
| 10 | 17,6 | 14,16 | 180 | 25,3 | 32,49 | 900 | 46,7 | 155,1 |
| 15 | 17,9 | 14,61 | 190 | 25,7 | 33,67 | 950 | 47,9 | 166,1 |
| 20 | 18,1 | 15,06 | 200 | 26 | 34,85 | 1000 | 49 | 177,1 |
| 30 | 18,6 | 16 | 225 | 26,7 | 37,73 | 1050 | 50,1 | 188,2 |
| 40 | 19,1 | 16,96 | 250 | 27,4 | 40,61 | 1100 | 51,2 | 199,3 |
| 50 | 19,6 | 17,95 | 300 | 29,7 | 48,33 | 1150 | 52,4 | 216,5 |
| 60 | 20,1 | 18,97 | 325 | 30,6 | 51,9 | 1200 | 53,5 | 233,7 |
Примечание: Будьте внимательны! Вязкость воздуха дана в степени 106.
Удельная теплоемкость воздуха при температуре от -50 до 1200°С
Представлена таблица удельной теплоемкости воздуха при различных температурах. Теплоемкость в таблице дана при постоянном давлении (изобарная теплоемкость воздуха) в интервале температуры от минус 50 до 1200°С для воздуха в сухом состоянии. Чему равна удельная теплоемкость воздуха? Величина удельной теплоемкости определяет количество тепла, которое необходимо подвести к одному килограмму воздуха при постоянном давлении для увеличения его температуры на 1 градус. Например, при 20°С для нагревания 1 кг этого газа на 1°С в изобарном процессе, требуется подвести 1005 Дж тепла.
Удельная теплоемкость воздуха увеличивается с ростом его температуры. Однако, зависимость массовой теплоемкости воздуха от температуры не линейная. В интервале от -50 до 120°С ее величина практически не меняется — в этих условиях средняя теплоемкость воздуха равна 1010 Дж/(кг·град). По данным таблицы видно, что значительное влияние температура начинает оказывать со значения 130°С. Однако, температура воздуха влияет на его удельную теплоемкость намного слабее, чем на вязкость. Так, при нагреве с 0 до 1200°С теплоемкость воздуха увеличивается лишь в 1,2 раза – с 1005 до 1210 Дж/(кг·град).
Следует отметить, что теплоемкость влажного воздуха выше, чем сухого. Если сравнить теплоемкость воды и воздуха, то очевидно, что вода обладает более высоким ее значением и содержание воды в воздухе приводит к увеличению удельной теплоемкости.
| t, °С | Cp, Дж/(кг·град) | t, °С | Cp, Дж/(кг·град) | t, °С | Cp, Дж/(кг·град) | t, °С | Cp, Дж/(кг·град) |
|---|---|---|---|---|---|---|---|
| -50 | 1013 | 20 | 1005 | 150 | 1015 | 600 | 1114 |
| -45 | 1013 | 30 | 1005 | 160 | 1017 | 650 | 1125 |
| -40 | 1013 | 40 | 1005 | 170 | 1020 | 700 | 1135 |
| -35 | 1013 | 50 | 1005 | 180 | 1022 | 750 | 1146 |
| -30 | 1013 | 60 | 1005 | 190 | 1024 | 800 | 1156 |
| -25 | 1011 | 70 | 200 | 1026 | 850 | 1164 | |
| -20 | 1009 | 80 | 1009 | 250 | 1037 | 900 | 1172 |
| -15 | 1009 | 90 | 1009 | 300 | 1047 | 950 | 1179 |
| -10 | 1009 | 100 | 1009 | 350 | 1058 | 1000 | 1185 |
| -5 | 1007 | 110 | 1009 | 400 | 1068 | 1050 | 1191 |
| 0 | 1005 | 120 | 1009 | 450 | 1081 | 1100 | 1197 |
| 10 | 1005 | 130 | 1011 | 500 | 1093 | 1150 | 1204 |
| 15 | 1005 | 140 | 1013 | 550 | 1104 | 1200 | 1210 |
Теплопроводность, температуропроводность, число Прандтля воздуха
В таблице представлены такие физические свойства атмосферного воздуха, как теплопроводность, температуропроводность и его число Прандтля в зависимости от температуры. Теплофизические свойства воздуха даны в интервале от -50 до 1200°С для сухого воздуха. По данным таблицы видно, что указанные свойства воздуха существенно зависят от температуры и температурная зависимость рассмотренных свойств этого газа различна.
Теплопроводность воздуха λ при повышении температуры увеличивается во всем диапазоне, достигая при 1200°С величины 0,0915 Вт/(м·град). Другие теплофизические свойства воздуха такие, как его температуропроводность a и число Прандтля Pr, по-разному реагируют на изменение температуры. Температуропроводность, как и вязкость воздуха сильно зависит от температуры и при нагревании, например с 0 до 1200°С, ее значение увеличивается почти в 17 раз.
Число Прандтля воздуха слабо зависит от температуры и при нагревании этого газа его величина сначала снижается до величины 0,674, а затем начинает расти, и при температуре 1200°С достигает значения 0,724.
| t, °С | λ·102, Вт/(м·град) | а·106, м2/с | Pr | t, °С | λ·102, Вт/(м·град) | а·106, м2/с | Pr |
|---|---|---|---|---|---|---|---|
| -50 | 2,04 | 12,7 | 0,728 | 170 | 3,71 | 45,7 | 0,682 |
| -40 | 2,12 | 13,8 | 0,728 | 180 | 3,78 | 47,5 | 0,681 |
| -30 | 2,2 | 14,9 | 0,723 | 190 | 3,86 | 49,5 | 0,681 |
| -20 | 2,28 | 16,2 | 0,716 | 200 | 3,93 | 51,4 | 0,68 |
| -10 | 2,36 | 17,4 | 0,712 | 250 | 4,27 | 61 | 0,677 |
| 0 | 2,44 | 18,8 | 0,707 | 300 | 4,6 | 71,6 | 0,674 |
| 10 | 2,51 | 20 | 0,705 | 350 | 4,91 | 81,9 | 0,676 |
| 20 | 2,59 | 21,4 | 0,703 | 400 | 5,21 | 93,1 | 0,678 |
| 30 | 2,67 | 22,9 | 0,701 | 450 | 5,48 | 104,2 | 0,683 |
| 40 | 2,76 | 24,3 | 0,699 | 500 | 5,74 | 115,3 | 0,687 |
| 50 | 2,83 | 25,7 | 0,698 | 550 | 5,98 | 126,8 | 0,693 |
| 60 | 2,9 | 27,2 | 0,696 | 600 | 6,22 | 138,3 | 0,699 |
| 70 | 2,96 | 28,6 | 0,694 | 650 | 6,47 | 150,9 | 0,703 |
| 80 | 3,05 | 30,2 | 0,692 | 700 | 6,71 | 163,4 | 0,706 |
| 90 | 3,13 | 31,9 | 0,69 | 750 | 6,95 | 176,1 | 0,71 |
| 100 | 3,21 | 33,6 | 0,688 | 800 | 7,18 | 188,8 | 0,713 |
| 110 | 3,28 | 35,2 | 0,687 | 850 | 7,41 | 202,5 | 0,715 |
| 120 | 3,34 | 36,8 | 0,686 | 900 | 7,63 | 216,2 | 0,717 |
| 130 | 3,42 | 38,6 | 0,685 | 950 | 7,85 | 231,1 | 0,718 |
| 140 | 3,49 | 40,3 | 0,684 | 1000 | 8,07 | 245,9 | 0,719 |
| 150 | 3,57 | 42,1 | 0,683 | 1100 | 8,5 | 276,2 | 0,722 |
| 160 | 3,64 | 43,9 | 0,682 | 1200 | 9,15 | 316,5 | 0,724 |
Будьте внимательны! Теплопроводность воздуха в таблице указана в степени 102. Не забудьте разделить на 100! Температуропроводность воздуха указана в степени 106. Допускается интерполяция значений физических свойств воздуха в приведенных таблицах.
Энтропия сухого воздуха
В таблице представлены значения такого теплофизического свойства воздуха, как удельная энтропия. Значения энтропии даны для сухого воздуха в размерности кДж/(кг·град) в зависимости от температуры и давления. Удельная энтропия указана в таблице в интервале температуры от -50 до 50°С при давлении воздуха от 90 до 110 кПа. Следует отметить, что при нормальном атмосферном давлении (101,325 кПа) и температуре, например 30°С, удельная энтропия воздуха равна 0,1044 кДж/(кг·град).
Источники:
- Михеев М.А., Михеева И.М. Основы теплопередачи.
- Богданов С.Н., Бурцев С.И., Иванов О.П., Куприянова А.В. Холодильная теника. Кондиционирование воздуха. Свойства веществ: Справ./ Под ред. С.Н. Богданова. 4-е изд., перераб. и доп. — СПб.: СПбГАХПТ, 1999.- 320 с.
Объёмная теплоёмкость — Википедия
Материал из Википедии — свободной энциклопедии
Объёмная теплоёмкость характеризует способность данного объёма данного конкретного вещества увеличивать свою внутреннюю энергию при изменении температуры вещества (подразумевая отсутствие фазового перехода). Равна отношению теплоёмкости данного образца вещества C{\displaystyle C} к его объему V{\displaystyle V}:
- c′=C/V{\displaystyle c’=C/V}
или иначе говоря, это теплоёмкость единицы объёма данного вещества. Подразумевается, что вещество однородно. Используется понятие объёмной теплоёмкости главным образом применительно к твёрдым телам и жидкостям, поскольку они имеют достаточно слабо изменяющуюся в зависимости от изменения внешних условий плотность. Для газа плотность очень сильно меняется в зависимости от температуры и давления, что означает, что даже вполне конкретный газ не имеет определённой объёмной теплоёмкости, то есть даже определённому газу определённое значение объёмной теплоёмкости можно приписать лишь при строго определённых давлении и температуре; на практике же вследствие этого понятие объёмной теплоёмкости применяется достаточно редко.
Объёмная теплоёмкость отличается от удельной теплоёмкости, которая характеризует способность единицы массы данного вещества увеличивать свою внутреннюю энергию при изменении температуры. Можно преобразовать удельную теплоёмкость в объёмную путём умножения удельной теплоёмкости на плотность вещества:[1]
- c′=ρc.{\displaystyle c’=\rho c.}
Дюлонг и Пти в 1818 году предсказали, что величина ρc[2] должна быть постоянной для всех твёрдых веществ. В 1819 году они обнаружили, что наибольшим постоянством обладали теплоёмкости твёрдых тел, определяемые предполагаемым весом атомов вещества (закон Дюлонга — Пти). Это теплоёмкость, приходящаяся на единицу атомного веса, которая близка в тому, чтобы быть постоянной для твёрдых тел. Иными словами, теплоёмкость, приходящаяся на один атом, а значит, и приходящаяся на единицу количества вещества, примерно постоянна для твёрдых тел. Теплоёмкость «на объёмной основе» фактически изменяется от примерно 1,2 до 4,5 МДж/(м³·K). Это варьирование объёмной теплоёмкости определяется различиями в физических размерах атомов (если бы все атомы имели одинаковый размер, то два типа теплоёмкости (молярная и объёмная) были бы эквивалентны). Для жидкостей объёмная теплоёмкость лежит в пределах от 1,3 до 1,9 МДж/(м³·K).
Для одноатомных газов (например, для аргона) при комнатной температуре и постоянном объёме, объёмная теплоёмкость равна около 0,5 кДж/(м³K).
При более высоких значениях объёмной теплоёмкости системе требуется больше времени для достижения термодинамического равновесия.
С объёмной теплоёмкостью связано понятие тепловой инерции материала, которая может быть определена по формуле:
- I=kρc,{\displaystyle I={\sqrt {k\rho c}},}
где
- k — теплопроводность,
- ρ — плотность материала,
- c — удельная теплоёмкость материала
- (произведение ρc{\displaystyle \rho c} представляет собой объёмную теплоёмкость).
Значения объёмной теплоёмкости некоторых веществ[править | править код]
| Вещество | Объёмная теплоёмкость кДж·дм−3·K−1) |
|---|---|
| асфальт | 1,2 |
| полнотелый кирпич | 1,344 |
| силикатный кирпич | 1,7 |
| бетон | 1,7 |
| кронглас (стекло) | 1,709 |
| флинт (стекло) | 2,1 |
| оконное стекло | 2,1 |
| гранит | 2,1 |
| гипс | 2,507 |
| мрамор, слюда | 2,4 |
| песок | 1,2 |
| сталь | 3,713 |
| почва | 0,80 |
| древесина | 1 |
| вода | 4,2 |
Физические свойства воздуха :: HighExpert.RU
Воздух – это смесь различных газов (% по объему): азот — 78,03; кислород — 20,95; озон и другие инертные газы: аргон, гелий, неон, криптон, ксенон, радон — 0,94; углекислый газ — 0,03; водяной пар — 0,05. Содержание углекислого газа в атмосферном воздухе принимается равным (% по объему): в сельской местности — 0,03, в городах — 0,04—0,07. Содержание водяных паров в воздухе зависит от его температуры. Озон присутствует в лесном, горном и морском воздухе. Наружный воздух загрязняется отходящими от промышленных предприятий вредными для здоровья человека газами и пылью.
Плотность воздуха при нормальном атмосферном давлении 101,325 кПа (1 атм) и различной температуре
| Температура воздуха | Плотность воздуха, ρ |
| оС | кг/м3 |
| -20 | 1,395 |
| 0 | 1,293 |
| 5 | 1,269 |
| 10 | 1,247 |
| 15 | 1,225 |
| 20 | 1,204 |
| 25 | 1,184 |
| 30 | 1,165 |
| 40 | 1,127 |
| 50 | 1,109 |
| 60 | 1,060 |
| 70 | 1,029 |
| 80 | 0,9996 |
| 90 | 0,9721 |
| 100 | 0,9461 |
Динамическая и кинематическая вязкость воздуха при нормальном атмосферном давлении и различной температуре
| Температура воздуха | Динамическая вязкость воздуха, μ | Кинематическая вязкость воздуха, ν |
| оС | (Н • c / м2) x 10-5 | (м2 / с) x 10-5 |
| -20 | 1,63 | 1,17 |
| 0 | 1,71 | 1,32 |
| 5 | 1,73 | 1,36 |
| 10 | 1,76 | 1,41 |
| 15 | 1,80 | 1,47 |
| 20 | 1,82 | 1,51 |
| 25 | 1,85 | 1,56 |
| 30 | 1,86 | 1,60 |
| 40 | 1,87 | 1,66 |
| 50 | 1,95 | 1,76 |
| 60 | 1,97 | 1,86 |
| 70 | 2,03 | 1,97 |
| 80 | 2,07 | 2,07 |
| 90 | 2,14 | 2,20 |
| 100 | 2,17 | 2,29 |
Основные физические своqства воздуха при различной температуре
| Температура | Плотность, ρ | Удельная теплоёмкость, Cp | Теплопроводность, λ | Кинематическая вязкость, ν | Коэффициент температурного линейного расширения, α | Число Прандтля, Pr |
| оС | кг/м3 | кДж / (кг • К) | Вт / (м • К) | (м2 / с) x 10-6 | (1 / K) x 10-3 | – |
| 0 | 1,293 | 1,005 | 0,0243 | 13,30 | 3,67 | 0,715 |
| 20 | 1,205 | 1,005 | 0,0257 | 15,11 | 3,43 | 0,713 |
| 40 | 1,127 | 1,005 | 0,0271 | 16,97 | 3,20 | 0,711 |
| 60 | 1,067 | 1,009 | 0,0285 | 18,90 | 3,00 | 0,709 |
| 80 | 1,000 | 1,009 | 0,0299 | 20,94 | 2,83 | 0,708 |
| 100 | 0,946 | 1,009 | 0,0314 | 23,06 | 2,68 | 0,703 |
Формулы физических свойств воздуха
При проведении инженерных расчетов удобнее использовать приближённые формулы для определения физических свойств воздуха⋆:
Плотность воздуха
[ кг/м3 ]Теплоёмкость воздуха
⋆ [ Дж/(кг • К) ]Теплопроводность воздуха
⋆ [ Вт/(м • K) ]Динамическая вязкость воздуха
⋆ [ Па • c ]Кинематическая вязкость воздуха
⋆ [ м2/с ]Температуропроводность воздуха
⋆ [ м2/с ]Число Прандтля воздуха
[ – ]⋆ Приближённые формулы физических свойств воздуха получены авторами настоящего сайта.
Размерность величин: температура – К (Кельвин).
Приближённые формулы действительны в диапазоне температур воздуха от 273 К до 473 К.
Теплоёмкость — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 декабря 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 декабря 2019; проверки требует 1 правка.Теплоёмкость — количество теплоты, поглощаемой телом в процессе нагревания на 1 кельвин. Более точно, теплоёмкость — физическая величина, определяемая как отношение количества теплоты δQ{\displaystyle \delta Q}, поглощаемой термодинамической системой при бесконечно малом изменении её температуры T{\displaystyle T}, к величине этого изменения dT{\displaystyle \mathrm {d} T}[1][2][3][4][5]:
- C=δQdT.{\displaystyle C={\delta Q \over \mathrm {d} T}.}
Малое количество теплоты обозначается δQ{\displaystyle \delta Q} (а не dQ{\displaystyle \mathrm {d} Q}), чтобы подчеркнуть, что это не дифференциал параметра состояния (в отличие, например, от dT{\displaystyle \mathrm {d} T}), а функция процесса. Поэтому и теплоёмкость — это характеристика процесса перехода между двумя состояниями термодинамической системы[6], которая зависит и от пути процесса (например, от проведения его при постоянном объёме или постоянном давлении)[7][8], и от способа нагревания/охлаждения (квазистатического или нестатического)[7][9]. Неоднозначность в определении теплоёмкости[10] на практике устранят тем, что выбирают и фиксируют путь квазистатического процесса (обычно оговаривается, что процесс происходит при постоянном давлении, равным атмосферному). При однозначном выборе процесса теплоёмкость становится параметром состояния[11][12] и теплофизическим свойством вещества, образующего термодинамическую систему[13].
Удельная, молярная и объёмная теплоёмкости[править | править код]
Очевидно, что чем больше масса тела, тем больше требуется теплоты для его нагревания, и теплоёмкость тела пропорциональна количеству вещества, содержащегося в нём. Количество вещества может характеризоваться массой или количеством молей. Поэтому удобно пользоваться понятиями удельной теплоёмкости (теплоёмкости единицы массы тела):
- c=Cm{\displaystyle c={C \over m}}
и молярной теплоёмкости (теплоёмкости одного моля вещества):
- Cμ=Cν,{\displaystyle C_{\mu }={C \over \nu },}
где ν=mμ{\displaystyle \nu ={m \over \mu }} — количество вещества в теле; m{\displaystyle m} — масса тела; μ{\displaystyle \mu } — молярная масса. Молярная и удельная теплоёмкости связаны соотношением Cμ=cμ{\displaystyle C_{\mu }=c\mu }[14][15].
Объёмная теплоёмкость (теплоёмкость единицы объёма тела):
- C′=CV.{\displaystyle C’={C \over V}.}
Теплоёмкость для различных процессов и состояний вещества[править | править код]
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа).
Теплоёмкость идеального газа[править | править код]
Теплоёмкость системы невзаимодействующих частиц (например, идеального газа) определяется числом степеней свободы частиц.
Молярная теплоёмкость при постоянном объёме:
- CV=dUdT=i2R,{\displaystyle C_{V}={dU \over dT}={\frac {i}{2}}R,}
где R{\displaystyle R} ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная, i{\displaystyle i} — число степеней свободы молекулы[14][15].
Молярная теплоёмкость при постоянном давлении связана с CV{\displaystyle C_{V}} соотношением Майера:
- CP=CV+R=i+22R.{\displaystyle C_{P}=C_{V}+R={{i+2} \over 2}R.}
Теплоёмкость кристаллов[править | править код]
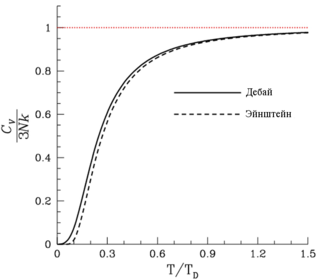 Сравнение моделей Дебая и Эйнштейна для теплоёмкости твёрдого тела
Сравнение моделей Дебая и Эйнштейна для теплоёмкости твёрдого телаСуществует несколько теорий теплоёмкости твердого тела:
- ↑ Теплоёмкость. БРЭ, 2016.
- ↑ Булидорова Г. В. и др., Физическая химия, кн. 1, 2016, с. 41.
- ↑ Артемов А. В., Физическая химия, 2013, с. 14.
- ↑ Ипполитов Е. Г. и др., Физическая химия, 2005, с. 20.
- ↑ Сивухин Д. В., Термодинамика и молекулярная физика, 2006, с. 65.
- ↑ Сивухин Д. В., Термодинамика и молекулярная физика, 2006, с. 66.
- ↑ 1 2 Лифшиц Е. М., Теплоёмкость, 1992.
- ↑ Белов Г. В., Термодинамика, ч. 1, 2017, с. 94.
- ↑ Лифшиц Е. М., Теплоёмкость, 1976.
- ↑ Базаров И. П., Термодинамика, 2010, с. 39.
- ↑ Борщевский А. Я., Физическая химия, т. 1, 2017, с. 115.
- ↑ Кубо Р., Термодинамика, 1970, с. 22.
- ↑ Беляев Н. М., Термодинамика, 1987, с. 5.
- ↑ 1 2 Никеров. В. А. Физика: учебник и практикум для академического бакалавриата. — Юрайт, 2015. — С. 127—129. — 415 с. — ISBN 978-5-9916-4820-2.
- ↑ 1 2 Ильин В. А. Физика: учебник и практикум для прикладного бакалавриата. — Юрайт, 2016. — С. 142—143. — 399 с. — ISBN 978-5-9916-6343-4.
- Артемов А. В. Физическая химия. — М.: Академия, 2013. — 288 с. — (Бакалавриат). — ISBN 978-5-7695-9550-9.
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.—Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3. (недоступная ссылка)
- Белов Г. В. Термодинамика. Часть 1. — 2-е изд., испр. и доп. — М.: Юрайт, 2017. — 265 с. — (Бакалавр. Академический курс). — ISBN 978-5-534-02731-0. (недоступная ссылка)
- Беляев Н. М. Термодинамика. — Киев: Вища школа, 1987. — 344 с.
- Борщевский А. Я. Физическая химия. Том 1 online. Общая и химическая термодинамика. — М.: Инфра-М, 2017. — 868 с. — (Высшее образование: Бакалавриат). — ISBN 978-5-16-104227-4. (недоступная ссылка)
- Булидорова Г. В., Галяметдинов Ю. Г., Ярошевская Х. М., Барабанов В. П. Физическая химия. Книга 1. Основы химической термодинамики. Фазовые равновесия. — М.: КДУ; Университетская книга, 2016. — 516 с. — ISBN 978-5-91304-600-0.
- Ипполитов Е. Г., Артемов А. В., Батраков В.В. Физическая химия / Под ред. Е. Г. Ипполитова. — М.: Академия, 2005. — 448 с. — (Высшее профессиональное образование). — ISBN 978-5-7695-1456-6.
- Кубо Р. Термодинамика. — М.: Мир, 1970. — 304 с. (недоступная ссылка)
- Лифшиц Е. М. Теплоёмкость // Физическая энциклопедия / Ред. А. М. Прохоров. — М.: Большая Советская Энциклопедия, 1992. — Т. 5. — С. 77–78.
- Лифшиц Е. М. Теплоёмкость // Большая советская энциклопедия / Ред. А. М. Прохоров. — 3-е издание. — М.: Большая Советская Энциклопедия, 1976. — Т. 25. — С. 451.
- Сивухин Д. В. Общий курс физики. — Издание 5-е, исправленное. — М.: Физматлит, 2006. — Т. II. Термодинамика и молекулярная физика. — 544 с. — ISBN 5-9221-0601-5.
- Теплоемкость // Большая российская энциклопедия. — М.: Большая российская энциклопедия, 2016. — Т. 32. — С. 54.
| | Адрес этой страницы (вложенность) в справочнике dpva.ru: главная страница / / Техническая информация / / Рабочие среды / / Воздух (Атмосфера) / / Температура, плотность, удельная теплоемкость, объемный коэффициент теплового расширения, кинематическая вязкость,и число (критерий) Прандтля для сухого воздуха при атмосферном давлении в в диапазоне -150 /+400 oC. Поделиться:
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Изохорная и изобарная теплоемкости воздуха. Пример задачи :: SYL.ru
Термодинамика газов является специальным разделом физики, который изучает и исследует поведение газовых систем при различных внешних условиях. В данной статье рассмотрим вопрос теплоемкости воздуха с использованием модели идеального газа.
Воздух – идеальный газ
Прежде чем раскрывать вопрос теплоемкости воздуха, рассмотрим модель идеального газа. В соответствии с ней полагают, что система состоит из невзаимодействующих друг с другом частиц, которые хаотично движутся в ограниченном объеме пространства. Скорости частиц подчиняются классическому распределению Максвелла-Больцмана. Модель также предполагает, что частицы являются безразмерными.
Насколько точно в приведенную модель вписывается воздушная смесь? Известно, что воздух состоит в основном из молекул азота и кислорода. Эти молекулы являются химически нейтральными. Существующие между ними ван-дер-ваальсовые взаимодействия являются очень слабыми, поэтому их при выполнении термодинамических расчетов можно не учитывать. Что касается размеров молекул, то ими также можно пренебречь, так как расстояния между ними на несколько порядков больше. Таким образом, воздух очень хорошо описывается моделью идеального газа.
Теплоемкость и ее виды
Согласно физическому определению, теплоемкость – это величина, показывающая, сколько нужно на систему затратить теплоты, чтобы ее нагреть на 1 градус Цельсия или на 1 кельвин. Поскольку процессы нагревания и охлаждения являются обратимыми, то при охлаждении системы на 1 градус выделяется количество теплоты, равное ее теплоемкости.
Как физическая величина теплоемкость может быть абсолютной, молярной или массовой. Определение абсолютной теплоемкости для произвольной системы было дано выше. Молярной называется теплоемкость на 1 моль газа, массовой – на 1 кг газа. Молярная величина чаще используется для рассматриваемого агрегатного состояния материи.
В зависимости от изопроцесса, при котором измеряют теплоемкость, она бывает изохорной и изобарной. В первом случае в системе с газом не изменяется объем, во втором случае сохраняется давление.
Формулы изохорной и изобарной теплоемкостей воздуха
Сначала рассмотрим изохорную величину. Обозначим ее CV. Первое начало термодинамики, которое следует из закона сохранения энергии, для изохорного процесса выглядит следующим образом:
H = dU
То есть все тепло H, подводимое к системе, идет на увеличение ее внутренней энергии. Изменение величины U можно записать так:
dU = CV*dT
С другой стороны, если воспользоваться универсальным уравнением состояния идеальной газовой системы, то формула для dU запишется в виде:
dU = z/2*n*R*dT
Здесь z – количество степеней свободы молекул, n – количество вещества, R – постоянная, dT – изменение температуры. Выражение выше следует из того факта, что внутренняя энергия идеального газа в точности равна кинетической энергии его молекул.
Из сравнения двух равенств получаем формулу для изохорной теплоемкости:
CV = z/2*n*R
В случае воздуха z=5, поскольку он на 99 % состоит из двухатомных молекул азота и кислорода (двухатомные молекулы имеют 3 поступательные и 2 вращательные степени свободы). Полагая n=1 моль, приходим к формуле изохорной молярной теплоемкости воздуха:
CV = 5/2*R = 2,5*R
Напомним, что постоянная R равна 8,314, тогда CV = 20,785 Дж/(моль*К).
Теперь определим молярную изобарную теплоемкость воздуха. Поскольку в результате изобарного нагрева газ расширяется, то он выполняет некоторую работу. Первое начало термодинамики в этом случае принимает вид:
H = dU + P*dV
Энтальпия H через изобарную теплоемкость CP для 1 моль вещества запишется так:
H = CP*dT
Работу газа с использованием уравнения Клапейрона-Менделеева можно записать так:
P*dV = R*dT
Эти выражения позволяют записать следующее соотношение изобарной и изохорной теплоемкостей:
CP = CV + R
Подставляя величину CV для воздуха, получаем изобарную молярную теплоемкость для него:
CP = 2,5*R + R = 3,5*R = 29,099 Дж/(моль*К)
Таким образом, величина CP оказывается больше, чем CV.
Пример решения задачи
В цилиндре под поршнем находятся 3 моль воздуха при атмосферном давлении. В процессе нагрева цилиндра поршень стал подниматься, сохраняя постоянное давление в системе. Чему равна работа газа при расширении, если известно, что его конечная температура стала больше начальной на 10 oC?
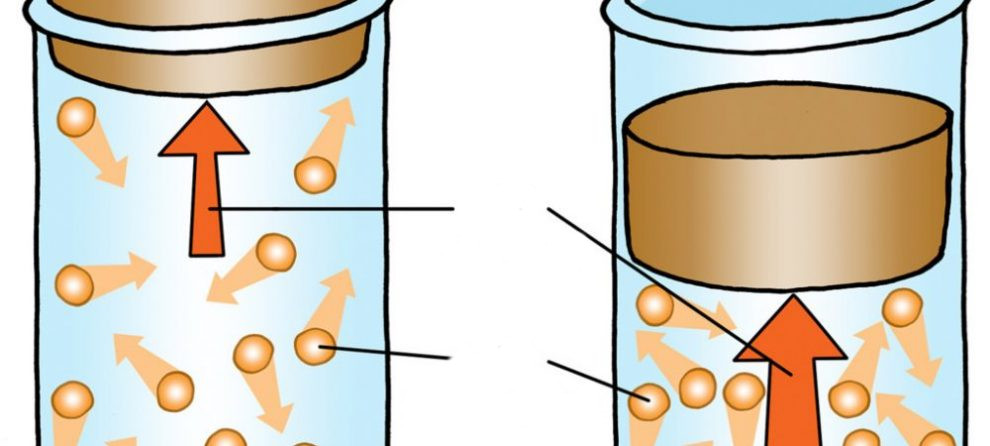
Воспользуемся первым законом термодинамики для изобарного нагрева:
n*CP*dT = n*CV*dT + P*dV
Отсюда работа газа (третье слагаемое) выразится так:
P*dV = n*(CP – CV)*dT
Подставляя данные из условия задачи, а также значения молярных теплоемкостей воздуха, получаем ответ: воздух в цилиндре, расширяясь, совершит работу 249,42 Дж.
| АБС пластик | 1300…2300 |
| Аглопоритобетон и бетон на топливных (котельных) шлаках | 840 |
| Алмаз | 502 |
| Аргиллит | 700…1000 |
| Асбест волокнистый | 1050 |
| Асбестоцемент | 1500 |
| Асботекстолит | 1670 |
| Асбошифер | 837 |
| Асфальт | 920…2100 |
| Асфальтобетон | 1680 |
| Аэрогель (Aspen aerogels) | 700 |
| Базальт | 850…920 |
| Барит | 461 |
| Береза | 1250 |
| Бетон | 710…1130 |
| Битумоперлит | 1130 |
| Битумы нефтяные строительные и кровельные | 1680 |
| Бумага | 1090…1500 |
| Вата минеральная | 920 |
| Вата стеклянная | 800 |
| Вата хлопчатобумажная | 1675 |
| Вата шлаковая | 750 |
| Вермикулит | 840 |
| Вермикулитобетон | 840 |
| Винипласт | 1000 |
| Войлок шерстяной | 1700 |
| Воск | 2930 |
| Газо- и пенобетон, газо- и пеносиликат, газо- и пенозолобетон | 840 |
| Гетинакс | 1400 |
| Гипс формованный сухой | 1050 |
| Гипсокартон | 950 |
| Глина | 750 |
| Глина огнеупорная | 800 |
| Глинозем | 700…840 |
| Гнейс (облицовка) | 880 |
| Гравий (наполнитель) | 850 |
| Гравий керамзитовый | 840 |
| Гравий шунгизитовый | 840 |
| Гранит (облицовка) | 880…920 |
| Графит | 708 |
| Грунт влажный (почва) | 2010 |
| Грунт лунный | 740 |
| Грунт песчаный | 900 |
| Грунт сухой | 850 |
| Гудрон | 1675 |
| Диабаз | 800…900 |
| Динас | 737 |
| Доломит | 600…1500 |
| Дуб | 2300 |
| Железобетон | 840 |
| Железобетон набивной | 840 |
| Зола древесная | 750 |
| Известняк (облицовка) | 850…920 |
| Изделия из вспученного перлита на битумном связующем | 1680 |
| Ил песчаный | 1000…2100 |
| Камень строительный | 920 |
| Капрон | 2300 |
| Карболит черный | 1900 |
| Картон гофрированный | 1150 |
| Картон облицовочный | 2300 |
| Картон плотный | 1200 |
| Картон строительный многослойный | 2390 |
| Каучук натуральный | 1400 |
| Кварц кристаллический | 836 |
| Кварцит | 700…1300 |
| Керамзит | 750 |
| Керамзитобетон и керамзитопенобетон | 840 |
| Кирпич динасовый | 905 |
| Кирпич карборундовый | 700 |
| Кирпич красный плотный | 840…880 |
| Кирпич магнезитовый | 1055 |
| Кирпич облицовочный | 880 |
| Кирпич огнеупорный полукислый | 885 |
| Кирпич силикатный | 750…840 |
| Кирпич строительный | 800 |
| Кирпич трепельный | 710 |
| Кирпич шамотный | 930 |
| Кладка «Поротон» | 900 |
| Кладка бутовая из камней средней плотности | 880 |
| Кладка газосиликатная | 880 |
| Кладка из глиняного обыкновенного кирпича | 880 |
| Кладка из керамического пустотного кирпича | 880 |
| Кладка из силикатного кирпича | 880 |
| Кладка из трепельного кирпича | 880 |
| Кладка из шлакового кирпича | 880 |
| Кокс порошкообразный | 1210 |
| Корунд | 711 |
| Краска масляная (эмаль) | 650…2000 |
| Кремний | 714 |
| Лава вулканическая | 840 |
| Латунь | 400 |
| Лед из тяжелой воды | 2220 |
| Лед при температуре 0°С | 2150 |
| Лед при температуре -100°С | 1170 |
| Лед при температуре -20°С | 1950 |
| Лед при температуре -60°С | 1700 |
| Линолеум | 1470 |
| Листы асбестоцементные плоские | 840 |
| Листы гипсовые обшивочные (сухая штукатурка) | 840 |
| Лузга подсолнечная | 1500 |
| Магнетит | 586 |
| Малахит | 740 |
| Маты и полосы из стекловолокна прошивные | 840 |
| Маты минераловатные прошивные и на синтетическом связующем | 840 |
| Мел | 800…880 |
| Миканит | 250 |
| Мипора | 1420 |
| Мрамор (облицовка) | 880 |
| Настил палубный | 1100 |
| Нафталин | 1300 |
| Нейлон | 1600 |
| Неопрен | 1700 |
| Пакля | 2300 |
| Парафин | 2890 |
| Паркет дубовый | 1100 |
| Паркет штучный | 880 |
| Паркет щитовой | 880 |
| Пемзобетон | 840 |
| Пенобетон | 840 |
| Пенопласт ПХВ-1 и ПВ-1 | 1260 |
| Пенополистирол | 1340 |
| Пенополистирол «Пеноплекс» | 1600 |
| Пенополиуретан | 1470 |
| Пеностекло или газостекло | 840 |
| Пергамин | 1680 |
| Перекрытие армокерамическое с бетонным заполнением без штукатурки | 850 |
| Перекрытие из железобетонных элементов со штукатуркой | 860 |
| Перекрытие монолитное плоское железобетонное | 840 |
| Перлитобетон | 840 |
| Перлитопласт-бетон | 1050 |
| Перлитофосфогелевые изделия | 1050 |
| Песок для строительных работ | 840 |
| Песок речной мелкий | 700…840 |
| Песок речной мелкий (влажный) | 2090 |
| Песок сахарный | 1260 |
| Песок сухой | 800 |
| Пихта | 2700 |
| Пластмасса полиэфирная | 1000…2300 |
| Плита пробковая | 1850 |
| Плиты алебастровые | 750 |
| Плиты древесно-волокнистые и древесно-стружечные (ДСП, ДВП) | 2300 |
| Плиты из гипса | 840 |
| Плиты из резольноформальдегидного пенопласта | 1680 |
| Плиты из стеклянного штапельного волокна на синтетическом связующем | 840 |
| Плиты камышитовые | 2300 |
| Плиты льнокостричные изоляционные | 2300 |
| Плиты минераловатные повышенной жесткости | 840 |
| Плиты минераловатные полужесткие на крахмальном связующем | 840 |
| Плиты торфяные теплоизоляционные | 2300 |
| Плиты фибролитовые и арболит на портландцементе | 2300 |
| Покрытие ковровое | 1100 |
| Пол гипсовый бесшовный | 800 |
| Поливинилхлорид (ПВХ) | 920…1200 |
| Поликарбонат (дифлон) | 1100…1120 |
| Полиметилметакрилат | 1200…1650 |
| Полипропилен | 1930 |
| Полистирол УПП1, ППС | 900 |
| Полистиролбетон | 1060 |
| Полихлорвинил | 1130…1200 |
| Полихлортрифторэтилен | 920 |
| Полиэтилен высокой плотности | 1900…2300 |
| Полиэтилен низкой плотности | 1700 |
| Портландцемент | 1130 |
| Пробка | 2050 |
| Пробка гранулированная | 1800 |
| Раствор гипсовый затирочный | 900 |
| Раствор гипсоперлитовый | 840 |
| Раствор гипсоперлитовый поризованный | 840 |
| Раствор известково-песчаный | 840 |
| Раствор известковый | 920 |
| Раствор сложный (песок, известь, цемент) | 840 |
| Раствор цементно-перлитовый | 840 |
| Раствор цементно-песчаный | 840 |
| Раствор цементно-шлаковый | 840 |
| Резина мягкая | 1380 |
| Резина пористая | 2050 |
| Резина твердая обыкновенная | 1350…1400 |
| Рубероид | 1500…1680 |
| Сера | 715 |
| Сланец | 700…1600 |
| Слюда | 880 |
| Смола эпоксидная | 800…1100 |
| Снег лежалый при 0°С | 2100 |
| Снег свежевыпавший | 2090 |
| Сосна и ель | 2300 |
| Сосна смолистая 15% влажности | 2700 |
| Стекло зеркальное (зеркало) | 780 |
| Стекло кварцевое | 890 |
| Стекло лабораторное | 840 |
| Стекло обыкновенное, оконное | 670 |
| Стекло флинт | 490 |
| Стекловата | 800 |
| Стекловолокно | 840 |
| Стеклопластик | 800 |
| Стружка деревянная прессованая | 1080 |
| Текстолит | 1470…1510 |
| Толь | 1680 |
| Торф | 1880 |
| Торфоплиты | 2100 |
| Туф (облицовка) | 750…880 |
| Туфобетон | 840 |
| Уголь древесный | 960 |
| Уголь каменный | 1310 |
| Фанера клееная | 2300…2500 |
| Фарфор | 750…1090 |
| Фибролит (серый) | 1670 |
| Циркон | 670 |
| Шамот | 825 |
| Шифер | 750 |
| Шлак гранулированный | 750 |
| Шлак котельный | 700…750 |
| Шлакобетон | 800 |
| Шлакопемзобетон (термозитобетон) | 840 |
| Шлакопемзопено- и шлакопемзогазобетон | 840 |
| Штукатурка гипсовая | 840 |
| Штукатурка из полистирольного раствора | 1200 |
| Штукатурка известковая | 950 |
| Штукатурка известковая с каменной пылью | 920 |
| Штукатурка перлитовая | 1130 |
| Штукатурка фасадная с полимерными добавками | 880 |
| Шунгизитобетон | 840 |
| Щебень и песок из перлита вспученного | 840 |
| Щебень из доменного шлака, шлаковой пемзы и аглопорита | 840 |
| Эбонит | 1430 |
| Эковата | 2300 |
| Этрол | 1500…1800 |