Углекислотное равновесие – Энциклопедия по машиностроению XXL
СО2, то определяемому этим содержанием парциальному давлению должно было бы отвечать содержание СО2 в воде 0,5—1 мг/л. Вместе с тем подавляющее большинство поверхностных и подземных вод содержит значительно большее количество СО2 вследствие его участия в так называемом углекислотном равновесии . [c.6]Подставив найденные значения равновесных концентраций отдельных компонентов углекислотного равновесия (выраженных Через их исходные концентрации) в уравнение (1-24), получим [c.26]
Подставив эти величины в уравнение углекислотного равновесия (1-24), получим [c.28]
Концентрация Н+ в воде уменьшается, а величина pH возрастает, что вызывает смещение углекислотного равновесия в сторону образования карбонат-ионов. При этом происходят следующие процессы
[c.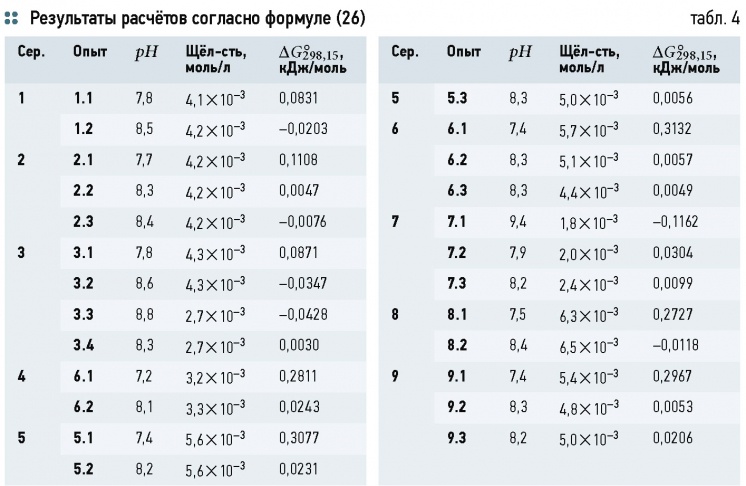
Различные формы угольной кислоты в водных растворах связаны так называемым динамическим углекислотным равновесием [c.21]
При наличии ионов Са2+ углекислотное равновесие выражается уравнением [c.21]
Увеличение степени минерализации воды приводит к уменьшению в ней количества свободной угольной кислоты, необходимой для поддержания углекислотного равновесия. Это обусловливает большую агрессивность воды, содержащей много солей, при равном содержании свободной угольной кислоты. [c.22]
Термический метод умягчения воды целесообразно применять при использовании карбонатных вод, идущих на питание котлов низкого давления а также в сочетании с реагентными методами умягчения воды. Он основан на смещении углекислотного равновесия при ее нагревании в сторону образования карбоната кальция, что описывается реакцией [c.474]
Концентрация растворенных газов в воде зависит от множества факторов природы газа, температуры воды, степени минерализации воды, парциального давления газа над водой, pH воды и др. Это во многих случаях существенно затрудняет ее аналитическое определение в технологических процессах и требует специальных методов анализа. Концентрация СО2 в природной воде существенно зависит от степени минерализации воды, углекислотного равновесия и составля-
[c.40]
Это во многих случаях существенно затрудняет ее аналитическое определение в технологических процессах и требует специальных методов анализа. Концентрация СО2 в природной воде существенно зависит от степени минерализации воды, углекислотного равновесия и составля-
[c.40]
В чем сущности углекислотного равновесия и связанных с ним понятий стабильности и нестабильности воды [c.47]
Углекислотное равновесие 26 Удельная электрическая проводимость 38 Ультрафильтрация 160 Умягчение воды 102 Устойчивость коллоидных систем 49 Утилизация стоков 151 [c.306]
Выпадение карбонатов в осадок связано с нарушением углекислотного равновесия при подщелачивании катодного пространства, так как при этом равновесие НСО 7СО я смещается в сто-
НАРУШЕНИЕ УГЛЕКИСЛОТНОГО РАВНОВЕСИЯ — ОСНОВНОЙ ФАКТОР ВЫДЕЛЕНИЯ КАРБОНАТА КАЛЬЦИЯ ИЗ ВОДНЫХ РАСТВОРОВ [c.22]
Для выражения способности вод с разной карбонатной жесткостью к выделению твердой фазы карбоната кальция нами предложен коэффициент углекислотного равновесия
[c. 26]
26]
Гусев Б. Т., Кандидатская диссертация, Роль углекислотного равновесия при магнитной обработке природной воды, МЭИ, 1967. [c.142]
Концентрация растворенных газов в воде зависит от множества факторов природы газа, температуры воды, степени минерализации воды, парциального давления газа над водой, pH воды и т. п. Это во многих случаях существенно затрудняет их аналитическое определение в технологических процессах и требует специальных методов анализа. Концентрация СО2 в природной воде существенно зависит от степени углекислотного равновесия и составляет примерно 0,5 мг/кг (10 моль/кг) при 293 К. Концентрация О2 в значительной степени зависит от содержания в воде органических веществ и температуры. При увеличении температуры от 273 до 308 К концентрация кислорода в чистой воде уменьшается от 14,6 до 6,5 мг/кг. [c.31]
Таким образом, pH возрастает, что вызывает смещение углекислотного равновесия в сторону образования ионов СО , в которые переходят все формы угольной кислоты.
 Увеличение концентрации СО 3 вызывает реакцию образования труднорастворимого карбоната кальция
[c.54]
Увеличение концентрации СО 3 вызывает реакцию образования труднорастворимого карбоната кальция
[c.54]Условия углекислотного равновесия согласно реакциям [c.292]
С помощью уравнений материального баланса и констант диссоциации ионные концентрации компонентов углекислотного равновесия запишутся в виде
Тогда условия углекислотного равновесия (12.9) приводятся к виду [c.295]
Углекислотное равновесие 24—28 Удельные приведенные затраты на производство дистиллята 220, 252 Уменьшение сбросов 255 Умягчение воды, методы 164 Установки комбинированные 192 [c.325]
Следует отметить важность правильного отбора пробы для анализа. Доказано экспериментально, что содержание углекислоты в исследуемой воде при контакте с воздухом быстро изменяется, стремясь к равновесию с окружающей атмосферой. Обычное содержание СОг в воздухе лабораторий таково, что в воде, находящейся в углекислотном равновесии с этим воздухом, концентрация СОг составляет 1—3 мг/кг. Следовательно, все воды, в которых концентрация углекислоты выше 1—3 мг/кг, будут при отборе пробы и ее титровании терять углекислоту и анализ их
[c.269]
Следовательно, все воды, в которых концентрация углекислоты выше 1—3 мг/кг, будут при отборе пробы и ее титровании терять углекислоту и анализ их
[c.269]
В присутствии ионов Са + углекислотное равновесие схематически вь -ражается уравнениями [c.24]
Нормальной работе систем оборотного водоснабжения препятствуют различного рода отложения и обрастания, образующиеся в теплообменных аппаратах, трубопроводах и градирнях в процессе эксплуатации. К наиболее часто встречающимся отложениям относятся солевые, и в частности” отложения карбоната кальция, образующиеся наиболее интенсивно на поверхностях теплообмена вследствие нарушения углекислотного равновесия в системах обо- [c.13]
УГЛЕКИСЛОТНОЕ РАВНОВЕСИЕ В ПРИРОДНЫХ ВОДАХ И В оборотной воде [c.14]
Изменение температуры раствора приводит к перераспределению различных форм углекислоты в соответствии с изменением констант приведенных выше уравнений.
Если />0, вода считается стабильной. Такая вода способна создавать на стали карбонатную защитную пленку СаСОз. Если /способна растворять СаСОз. Авторы работы [5] показали, что для воды с температурой 60 °С индекс насыщения примерно на единицу выше, чем для воды того же со-става при температуре 10 °С. В умягченной воде углекислотное равновесие теряет смысл. [c.14]
При подкислении воды серной кислотой происходит нейтрализация бикарбонатов кальция и магния с образованием сульфатов, обладающих высокой растворимостью и не выпадающих в осадок. В процессе подкис-ления понижается щелочность воды и увеличивается концентрация свободной углекислоты, которая предотвращает нарушение углекислотного равновесия и образование малорастворимого карбоната СаСОз.
Установление углекислотного равновесия, сопровождающееся или выделением каобоната кальция в осадок, или переходом его в раствор из донных отложений. [c.17]
Уравнение (1-23) характеризует условия так называемого углекислотного равновесия, т. е. равновесия системы, содержащей одновременно ионы Са -Ь и НСОз”. Из уравнения (1-23) следует, что равновесие может наблюдаться тодько в том случае, когда одновременно с ионами Са2+ и НСОГ в растворе присутствует в определенной концентрации и угольная кислота НгСОз, называемая равновесной угольной кислотой. [c.24]
Уравнение (1-26) показывает равновесие между концентрациями молекул НгСОз и СО2. Так как СО2 — газообразный продукт, то растворимость его в воде зависит от парциального давления СО2 в воздухе и температуры. При определенных условиях (повышенная температура, малое парциальное давление СО2) может оказаться, что величина растворимости СО2 в воде будет меньше величины ее равновесной концентрации (определяемой только концентрациями Са + и НС01 ),в которой СО2 была в растворе в системе, находившейся в равновесном состоянии.
Последнее уравнение позволяет рассчитать величину х и по найденной величине его найти значения равновесных концентраций отдельных компонентов углекислотного равновесия. Величина х указывает одновременно число молей СаСОз, которые выделятся из 1 л воды до момента установления равновесия. [c.26]
Расчет концентрации агрессивной СОз может быть произведен методом, аналогичным тому, который был применен при выводе уравнения (1-27), характеризующего состояние равновесия при Сщсо,[c.27]
Возможность образования осадка карбоната кальция определяется рассмотренным выше углекислотным равновесием. Образующиеся возле металлической поверхности продукты анодной (Ре +) и катодной (ОН ) реакции могут оказывать влияние на углекислотное равновесие, сдвигая его в ту или иную сторону. При этом условия осаждения СаСОз отличаются от тех условий, которые создаются в объеме воды вдали от корродирующей поверхности металла.
[c.46]
При этом условия осаждения СаСОз отличаются от тех условий, которые создаются в объеме воды вдали от корродирующей поверхности металла.
[c.46]
Стабилизация воды предусматривает обработку ее для снижения коррозионной активности путем поддержания углекислотного равновесия. Обычно в первый период эксплуатации водопроводов в воду добавляют реагенты, способствующие образованию на внутренних стенках труб защитной пленки из карбоната кальция (при этом вода должна иметь положительный индекс насыщения, /=рН—рН5>0). После того как на поверхности сформируется защитная пленка, для ее сохранения индекс насыщения стабилизированной (обработанной) воды должен быть близким к нулю, так как под воздействием СО2 защитная пленка может раствориться. Поэтому стабилизационную обработку воды следует проводить непрерывно для поддержания необходимого количественного соотнощения НСОз и СО2.
Л1етод стабилизационной обработки воды фильтрованием через дробленый мрамор можно применять при карбонатной жесткости воды менее 3 мэкв/л. При большой жесткости воды затрудняется наступление состояния углекислотного равновесия. Нельзя фильтровать через дробленый мрамор воду, содержащую марганец и железо, без предварительной очистки ее,, чтобы не допустить загрязнения фильтра. Применение подобных фильтров особенно выгодно для малых установок их отличает простота конструкций и обслуживания [43].
[c.98]
При большой жесткости воды затрудняется наступление состояния углекислотного равновесия. Нельзя фильтровать через дробленый мрамор воду, содержащую марганец и железо, без предварительной очистки ее,, чтобы не допустить загрязнения фильтра. Применение подобных фильтров особенно выгодно для малых установок их отличает простота конструкций и обслуживания [43].
[c.98]
Как показывает многолетний опыт эксплуатации, при применении необработанной водопроводной воды в ряде случаев работа подогревателей осложняется интенсивным выделением в трубках карбонатной или карбонатно-железистой накипи. Появление отложений обусловливается качеством исходной водопроводной воды. Если характеризовать химический состав воды индексом стабильности Яс, показывающим состояние углекислотного равновесия в воде, и возможность выделения карбоната кальция при смещении равновесия, а также карбонатной жесткостью Жк, дающей представление о концентрации основного накипеобразователя в воде, то образование крабонатной накипи возможно при условии Яс>0 и Жк>4,5 мг-экв/кг. [c.140]
[c.140]
Задача представленной в этой главе программы ПРЕДОЧ -расчет равновесных концентраций ионов в воде, подвергнутой совместной коагуляции и известкованию. Исходными параметрами для расчета являются ионный состав исходной воды, термодинамические константы, характеризующие углекислотное равновесие воды, концентрация углекислого газа в исходной воде, дозы коагулянта, значение pH известкованной воды. [c.41]
В программе ПРЕДОЧ, так же как и в программе ТИТР, реализуется метод последовательных приближений до достижения требуемой точности расчета по ионной силе раствора, используются термодинамические соотношения по ионному произведению воды, ее углекислотному равновесию и закономерности поведения слабых растворов сильных электролитов, описанные в гл. 3. [c.44]
Приведенное выше подтверждает, что выделение твердой фазы карбоната кальция из водных растворов под влиянием магнитного поля можетпроисходитьтолько из Пересы-щенного раствора в отношении этой соли, определяемое углекислотным равновесием. [c.30]
[c.30]
В процессе нагрева и испарения воды углекислотное равновесие смещается. Это смещение можно определить по известному составу примесей. При установлении нового состояния равновесия если концентрация НСО3 согласно (12.2) снизится на 2х моль/л, то концентрации СОз и СО 2 увеличатся на х моль/л каждая. Из (12.3) видно, что при снижении концентрации НСО на у моль/л соответственно повысятся концентрации ОН и СО2 на у моль/л. Тогда можно записать, что концентрация растворенной в воде СО2 составит [c.292]
В системах водяного охлаждения тсплонагруженных деталей (чистых циклах) образуются преимущественно отложения карбоната кальция. Причиной их возникновения является сдвиг углекислотного равновесия, который интенсифицируется с повышением температуры. Максимальная интенсивность отложений наблюдается в зонах местного кипения воды [c.172]
Находящиеся в воде ионы НСОз, СОз и углекислый газ связаны углекислотным равновесием
[c. 24]
24]
Определение значения рН воды без использования рН метра
Тихонов И.А.
Аннотация
В статье рассмотрена методика расчета значения рН воды, основанная на углекислотном равновесии воды. Представлен пример из практики автора.
Значение рН природной воды как правило определяется соотношением различных форм углекислоты входящих в ее состав. Различные формы углекислоты в воде образуются в результате адсорбции и последующего гидролиза диоксида углерода в воде. В результате гидролиза образуются следующие формы углекислоты:
CO2 – свободная углекислота,
НСО3 – полусвязанная углекислота,
СО3 – связанная углекислота.
Значение рН воды можно определить по уравнению Хендерсона – Хассельбальха.
(1)
(2)
Уравнение (1) описывает диссоциацию углекислоты в воде по первой стадии, уравнение (2) по второй.
В данной статье мы будем работать с уравнением (1). Расчет рН по уравнению (2) описан в статье Тихонова И.А. «Влияние различных форм углекислоты в воде на ее значение рН» — https://tiwater.info/the-influence-of-various-forms-of-carbon-dioxide-in-water-on-its-ph-value/.
Очевидно, что для определения значения рН по уравнению (1) необходимо знать значения свободной и полусвязанной углекислоты в воде.
Определить количество полусвязанной углекислоты (бикарбонат иона) можно при помощи анализа воды на щелочность по ГОСТ 31957-2012. «Вода. Методы определения щелочности и массовой концентрации карбонатов и гидрокарбонатов». Определение основано на титровании пробы воды соляной кислотой (0,1Н). В результате в диапазоне рН пробы от 8,37 до 4,5 в воде находятся только бикарбонат ионы. Соответственно, по количеству кислоты ушедшей на титровании пробы от рН 8,37 до 4,5 определяют количество бикарбонат иона.
Для определения свободной углекислоты в воде можно воспользоваться следующей методикой. В пробу воды (100 мл) необходимо добавить индикатор – фенолфталеин. Затем пробу надо титровать раствором едкого натра (0,1Н) до появления устойчивой слабо-розовой окраски. Едкий натр связывает свободную углекислоту в бикарбонат по реакции (3). В результате повышается значение рН пробы и при значении рН= 8,37 проба окрашивается в слабо розовый цвет.
В пробу воды (100 мл) необходимо добавить индикатор – фенолфталеин. Затем пробу надо титровать раствором едкого натра (0,1Н) до появления устойчивой слабо-розовой окраски. Едкий натр связывает свободную углекислоту в бикарбонат по реакции (3). В результате повышается значение рН пробы и при значении рН= 8,37 проба окрашивается в слабо розовый цвет.
NaOH+CO2 NaHCO3 (3)
Если продолжать титрование такой пробы едким натром, то значение рН вырастит более 8,37 и в воде начнут появляться карбонаты по уравнению (4).
NaHCO3+NaOH Na2CO3+H2O (4)
Это говорит о том, как важно титровать пробу едким натром до значения рН именно 8,37. Использование фенолфталеина для индикации вместо рН метра допустимо, но может увеличить погрешность определения количества свободной углекислоты.
Количество едкого натра (0,1Н) ушедшего на титрование пробы равно количеству свободной углекислоты (СО2) в ммоль/л. Т.е. 1 мл раствора едкого натра эквивалентен 1 ммоль/л СО2 (при объеме пробы 100 мл).
Т.е. 1 мл раствора едкого натра эквивалентен 1 ммоль/л СО2 (при объеме пробы 100 мл).
В результате зная концентрации НСО3 и СО2 по уравнению (1) можно определить рН пробы воды. В уравнение (1) можно подставлять концентрации, а не активности, предполагая равенство коэффициентов активностей одновалентных ионов.
Необходимо уточнить еще один момент. Представленная методика для определения концентрации СО2 в воде известна достаточно давно и рекомендуется для определения СО2 в водах типа конденсат. Т.к. конденсат, как правило, насыщен углекислотой и практически не содержит солей жесткости (Са, Mg). При наличии солей жесткости будет происходить выпадение кальция в осадок, т.к. происходит изменение состояния насыщения воды по карбонату кальция в сторону выделения твердого карбоната кальция. Значение рН будет увеличиваться.
В результате часть едкого натра может тратиться на вывод карбоната кальция и, соответственно, количество углекислоты для такой воды может быть определено большее чем реально существующее.
Для воды с небольшой жесткостью погрешности фактически не будет, но для воды с жесткостью более 2 ммоль/л я рекомендую проводить предварительное умягчение пробы.
Рассмотрим пример из моей практики.
Необходимо определить значение рН воды тепловой сети. Контур тепловой сети закрытый. Температурный график 95-70 0C. Подпиточная вода проходит одноступенчатое умягчение. Дозирование реагента для увеличения рН подпиточной воды отсутствует.
Т.к. контур закрытый, то происходит постепенное удаление свободной углекислоты из контура через воздушники за счет нагрева циркуляционной воды (уменьшается растворимость СО2) и, соответственно, значение рН циркуляционной воды увеличивается до значений примерно 8,2-8,3.
В реальности в контуре постоянно происходили утечки и контур подпитывался умягченной водой с рН порядка 7,0-7,1 (концентрация СО2 подпиточной воды около 10 — 15 мг/л). Соответственно, значение рН циркуляционной воды уменьшалось.
Неравномерность подпиток и постоянное колебание значения рН циркуляционной воды заставляло сомневаться в точности измерений рН при помощи рН метра. В результате я произвел химические анализы по представленным выше методикам. Данные по результатам анализов представлены в таблице 1. Значение рН измерялось при помощи рН метра.
Таблица 1
| Показатели | Ед. изм | Подпиточная вода | Циркуляционная вода |
| Жесткость | мг-экв/л | 0,11 | 0,18 |
| Щелочность (НСО3) | мг-экв/л | 2,0 | 2,7 |
| рН | ед. рН | 7,1 | 7,8 |
| СО2 | мг-экв/л | 0,35 (15 мг/л) | 0,07 (3,0 мг/л) |
| Электропроводность | µS/см | 421 | 459 |
Как видно из таблицы в циркуляционной воде содержится значительно меньше СО2 чем в подпиточной. В результате значение рН циркуляционной воды растет.
В результате значение рН циркуляционной воды растет.
Рассчитаем значение рН по уравнению (1).
Значения рН измеренные и расчетные практически совпадают.
Фактически при отсутствии подпитки значения рН циркуляционной воды вырастает до 8,3-8,4, и углекислотная коррозия трубопроводов прекращается.
Необходимо отметить еще один момент. Щелочность циркуляционной воды в данном примере больше, чем щелочность подпиточной воды. Хотя в контур поступает только подпиточная вода. Вероятно, это происходит из-за того, что когда контур долго не подпитывается, то происходит полная отгонка СО2 и рН вырастает до 8,3-8,4. В результате в циркуляционной воде появляется гидрат из-за гидролиза образующихся при таких значениях рН карбонатов. В случае подпитки контура подпиточной водой, которая имеет свободную углекислоту, происходит процесс связывания свободной углекислоты в бикарбонат гидратом циркуляционной воды. Соответственно, увеличивается бикарбонатная щелочность циркуляционного контура. Так же поступление СО2 в циркуляционный контур возможно от процессов окисления органики, содержащейся в циркуляционной воде. Это необходимо учитывать при определении щелочности для расчета рН циркуляционной воды. Т.е. необходимо провести анализ на щелочность именно циркуляционной воды, а не предполагать, что щелочность циркуляционного контура равна щелочности воды источника водоснабжения.
Так же поступление СО2 в циркуляционный контур возможно от процессов окисления органики, содержащейся в циркуляционной воде. Это необходимо учитывать при определении щелочности для расчета рН циркуляционной воды. Т.е. необходимо провести анализ на щелочность именно циркуляционной воды, а не предполагать, что щелочность циркуляционного контура равна щелочности воды источника водоснабжения.
Так же надо учитывать, что, если в воде также содержаться значительные количества сероводорода или аммиака это так же будет влиять на рН. Вода с такой спецификой будет требовать комплексного подхода для выявления причин загрязнения и разработки технологии очистки. Тем не менее при высоком содержании бикарбоната в воде по отношению к сероводороду и аммиаку именно углекислотное равновесие будет определять рН воды.
Надеюсь, данная информация может быть полезной.
Водоснабжение и санитарная техника Журнал
bbk 000000
УДК 628. 162.53:66.081
162.53:66.081
Скрябин А. Ю., Педашенко Д. Д., Божко Л. Н., Поповьян Г. В.
Аннотация
Приводятся результаты определения показателей стабильности (индекс насыщения, эмиссия диоксида углерода в атмосферу) донской воды с использованием результатов полных химических анализов, выполняемых лабораториями на водопроводных станциях. На примере Ростовского водопровода показано преимущество использования коагулянтов полиДАДМАХ как самостоятельно, так и совместно с полиоксихлоридом алюминия «АКВА-АУРАТТМ10», которые не повышают (по сравнению с традиционной обработкой сульфатом алюминия) коррозионную активность обработанной воды и не способствуют эмиссии диоксида углерода в атмосферу.
Ключевые слова
питьевая вода , коагуляция , стабильность , углекислотное равновесие , индекс насыщения , коррозионность , эмиссия диоксида углерода
Скачать статью в журнальной верстке (PDF)
При очистке поверхностных вод одной из основных задач является достижение стабильности обработанной воды в отношении форм угольной кислоты. Соотношение форм угольной кислоты в воде зависит от водородного показателя рН и изменяется по известной закономерности. При рН 3,7–4 вся угольная кислота, находящаяся в воде, представлена только диоксидом углерода (СО2). По мере увеличения рН доля СО2 уменьшается, но одновременно увеличивается доля бикарбонатов НСО3–. При рН 8,3–8,4 практически вся присутствующая в воде угольная кислота находится в форме бикарбонатных ионов.
Соотношение форм угольной кислоты в воде зависит от водородного показателя рН и изменяется по известной закономерности. При рН 3,7–4 вся угольная кислота, находящаяся в воде, представлена только диоксидом углерода (СО2). По мере увеличения рН доля СО2 уменьшается, но одновременно увеличивается доля бикарбонатов НСО3–. При рН 8,3–8,4 практически вся присутствующая в воде угольная кислота находится в форме бикарбонатных ионов.
Донская вода, используемая для хозяйственно-питьевого водоснабжения многих населенных пунктов и городов, практически во все периоды года имеет рН 8–8,3. Следовательно, основная масса углекислоты в ней находится в форме бикарбонатных ионов НСО3–, концентрация которых, по многолетним наблюдениям, находится в пределах 171–256 мг/л, а на долю СО2 приходится незначительная часть – в среднем 6,7 мг/л. Таким образом, с учетом повышенной величины рН донской воды без значительной ошибки можно принять, что ее щелочность определяется только наличием бикарбонатов (подтверждено лабораторными исследованиями). В переводе на мг-экв/л величина щелочности составляет 2,8–4,2.
В природной воде существует динамическое равновесие между различными формами угольной кислоты. Если количество находящейся в воде свободной окиси углерода превышает равновесную концентрацию, то избыток ее способен вступать в реакцию с СаСО3, вызывая его растворение. Разницу между свободной и равновесной углекислотой называют агрессивной. Она разрушающе действует на бетонные конструкции [1], вызывает электрохимическую коррозию металла.
В традиционной технологии водоочистки углекислотное равновесие нарушает обработку воды неорганическим коагулянтом и хлором. При введении в воду 1 мг сульфата алюминия выделяется 0,77 мг/л СО2, что стехиометрически определяется из уравнения реакции:
Аl2(SO4)3 + 3Са(НСО3)2 = 2Аl(ОН)3 + 3СаSО4 + 6СО2.
Концентрация СО2 в воде повышается за счет разложения бикарбонатов. Хлорирование жидким хлором (не гипохлоритом натрия) снижает рН воды за счет гидролиза хлора, что вызывает дополнительное разложение бикарбонатов с выделением СО2:
Н+ + НСО3– = Н2О + СО2.
В табл. 1 представлена количественная оценка нарушения углекислотного равновесия воды при следующих вариантах коагуляционной обработки, применяемых на Ростовских водоочистных сооружениях:
Вариант 1. Обработка воды сульфатом алюминия (проектный вариант), среднегодовая доза 26 мг/л по товарному продукту. Технология использовалась до конца 1995 г.
Вариант 2. Обработка воды только органическим коагулянтом полиДАДМАХ (до 2006 г.), доза реагента 0,18 мг/л по активному веществу. Дозирование осуществлялось на водозаборах.
Вариант 3. Обработка воды полиоксихлоридом алюминия «АКВА-АУРАТТМ10» дозой 0,5 мг/л по Аl2О3 совместно с полиДАДМАХ дозой 0,2 мг/л. Дозирование коагулянтов осуществлялось на водозаборах.
Во всех случаях хлорирование проводилось жидким хлором (доза ~ 4,2 мг/л).
Отклонение углекислотной системы донской воды от равновесного состояния оценено путем сравнения фактической величины рН питьевой воды с водородным показателем равновесного насыщения воды карбонатом кальция (рНs), т. е. по методике Ланжелье [2]. Вычисления выполнены на основе результатов химического анализа воды по показателям: рН, температура, концентрация кальция, щелочность, солесодержание с использованием методик и графиков для определения рНs [2; 3].
Условия стабильности воды характеризуются индексом насыщения:
J = рН – рНs.
При J > 0 вода не коррозионная, при J < 0 – коррозионная, при J = 0 – стабильная.
Результаты вычислений, приведенные в табл. 1, свидетельствуют о следующем:
донская вода без обработки не коррозионная, однако имеет положительный индекс насыщения, т. е. склонна к выделению СаСО3;
при коагуляционной обработке сульфатом алюминия индекс насыщения во всех случаях отрицательный. При его величине менее 0,3, в соответствии с нормами [3], почти всегда требовалась стабилизационная обработка воды. Однако такая обработка никогда не проводилась, что могло служить причиной не только снижения прочности бетонных конструкций за счет растворения карбоната кальция, но и преждевременного выхода из строя водопроводных стальных трубопроводов, преобладающих в системе водоснабжения города;
при переходе на самостоятельную обработку флокулянтом полиДАДМАХ (в качестве примера приведены данные за 1998 г.) индекс насыщения незначительно колебался около нулевого значения, т. е. вода практически была стабильной, и стабилизационной обработки не требовалось;
то же самое наблюдается и при переходе на технологию очистки совместной обработкой полиоксихлоридом алюминия и полиДАДМАХ. При этом преобладают небольшие, но отрицательные значения индекса насыщения, т. е. после дополнительной обработки полиоксихлоридом алюминия индекс насыщения изменился незначительно. Это объясняется тем, что неорганический коагулянт вводится небольшой дозой – 0,4–0,5 мг/л по Аl2О3, что в несколько раз меньше, чем при введении сульфата алюминия при базовой технологии (в среднем за год 26 мг/л по товарному продукту, или 4 мг/л по Аl2О3). К тому же полиоксихлорид алюминия имеет высокий показатель основности, т. е. достаточно высокий щелочной резерв в составе самого коагулянта.
При использовании Аl2(SО4)3·18Н2О в качестве коагулянта также имеет место негативное воздействие на окружающую среду – происходит частичная эмиссия СО2 в атмосферу. Из ранее приведенного уравнения, описывающего образование при коагуляции гидроокиси алюминия и диоксида углерода, следует, что последний выделяется за счет разложения части бикарбонатов. Образуется разница между содержанием диоксида углерода, растворенного в донской воде и входящего в состав бикарбонатов, и соответствующим содержанием этих же компонентов углекислоты в очищенной воде. Эта разница и представляет собой эмиссию СО2 в атмосферу. Таким образом, величина эмиссии СО2, мг/л, может быть вычислена по формуле:
ЭСО2 = СО2р – СО2в + 0,72∆НСО3–,
где СО2р, СО2в – содержание СО2 соответственно в речной воде и на выходе очистных сооружений, мг/л; 0,72 – доля содержания диоксида углерода в НСО3–; ∆НСО3– – разница концентраций бикарбонатов исходной и очищенной воды, мг/л.
Диоксид углерода – парниковый газ, способствующий повышению температуры поверхности Земли. Согласно Киотскому протоколу, правительство РФ приняло обязательства по ограничению выбросов парниковых газов в атмосферу.
Оценка эмиссии диоксида углерода в атмосферу при обработке донской воды сульфатом алюминия приведена в табл. 2 (Ростовский водопровод, данные 1994 г.). До конца 1995 г. для Ростовских водоочистных сооружений производительностью 450 тыс. м3/сут эмиссия СО2 составляла около 960 т/год. Cтабилизационная обработка известкованием не производилась, однако и она в конечном счете не снизила бы выделение в атмосферу парникового газа СО2.
Известь СаО получают обжигом природного известняка по реакции:
СаСО3 + тепло = СаО + СО2.
Из этого уравнения можно определить, что при производстве извести на каждые 56 мг (по СаО) полученного продукта в атмосферу выделяется 44 мг СО2. Кроме того, за счет сжигания теплоносителя (например, угля) выделяется дополнительное количество СО2.
Обработка воды реагентом полиДАДМАХ самостоятельно или совместно с полиоксихлоридом алюминия позволяет добиться многократного уменьшения эмиссии СО2. Она соизмерима с погрешностью определения компонентов углекислотного равновесия и не поддается точному измерению.
Выводы
При очистке донской воды сульфатом алюминия значительно нарушается углекислотное равновесие в питьевой воде. Индекс насыщения воды почти всегда становится отрицательным (вода коррозионная), что требует постоянной стабилизационной обработки. При этом эмиссия СО2 в атмосферу составляет в среднем 5,85 г/м3 обработанной воды. При использовании органического коагулянта полиДАДМАХ самостоятельно или совместно с полиоксихлоридом алюминия «АКВА-АУРАТТМ10» питьевая вода остается практически не коррозионной и стабилизационной обработки не требует. Эмиссия СО2 в атмосферу многократно ниже.
Список цитируемой литературы
- Degrmont. Технический справочник по обработке воды. – СПб, 2007.
- Клячко В. А., Апельцин И. Э. Очистка природных вод. – М.: Стройиздат, 1971.
- СНиП 2.04.02-84. Водоснабжение. Наружные сети и сооружения. – М., 1985.
22. Кислотно-основное равновесие в природных водах.РН атм. Осадков.
Кислотно-осн. равновесие в природных водах определяется присутствием ионов карбонатна НСО3 и СО3.
При рН =7: [H+]=[ НСО3–]+2[CO32-]+[OH–]
Карбонатную систему образуют неорг. соединения углерода присутствующие в природных водах в виде производных уголной к-ты.
СО2газ→СО2(р-р)+Н2О→ Н2 СО3
Диссоциация Н2 СО3:
1 стадия: Н2 СО3→ НСО3–+Н+ k1=аН+*а НСО3-/а Н2 СО3
2 стадия: Н2 СО3→ Н+ + СО32- k2=а СО32-* аН+/а НСО3-
k2< k1, примерно на 4 порядка, поэтому вклад во 2 ступени диссоциации величину рН можно не учитывать.
Выпадение кислотных дождей.
Кислотными дождями наз-ся осадки с рН<5,5. г Питлокри (Шотландия) рН=2,4.
Основной вклад в кислотность носит соединение S (до 80%) и азота (до 15%)
В 1872 году Роберт Смит ввел термин в своей книге «Воздух и дождь, начало химической климатологии ».
Последствия выпадения кислотных дождей:
1)закисление почвенных водоемов;
2)в почве уменьшается продуктивность, сокращается поступление питательных веществ, падает урожайность с/х культур.
3) страдают леса (высыхают,особенно хвойные)
4) разрушаются памятники архитектуры.
5) ухудшается состояние техногенных объектов следствии коррозии.
6)люди вынуждены употреблять загрязненную воду и т. Д. в климатической среде увеличивается подвижность тяжелых металлов. Для уменьшения кислотности осадков необходимо снижать выбросы в атм-ру осадков серы и азота.
23. Растворимость карбонатов и рН природных вод.
Среди карбонатов самыми распространенными яв-ся СаСО3
Кальцит преобладает в умеренной климатической зоне, а арагонит в теплых тропических морях.
Арагонит не стабильная форма постепенно переходит в кальцит. Растворение карбонатов в природных водоемах чаще протекает в присутствии СО2
СаСО3+ Н2О + СО2→Са2++2НСО3–
НСО3– – включается в общую систему карбонатных равновесий и влияет на рН природных вод.
[H+]= (pCO22 k2k1k г(СО2)γНСО3/k нсо3 γСО32+)1/3
k нсо3=аса2+*асо3-
для большинства поверхностных вод при наличии контакта с карбонатными породами рН =8,3-8,4. в литосфере помимо СаСО3 встречается еще Са Mg(СО3)2
растворение в природных водах:
Са Mg(СО3)2→Ca2+Mg 2+ +СO32-
в природных водах возможны взаимные преобразования кальцита и доломита:
Са Mg(СО3)2+ Ca2→Ca СO3+Mg 2+
K= а Mg 2+/а Ca2
Карбонатное равновесие в океане .
В морской воде помимо СО2 ,СО3 , НСО2 присутствуют другие ионы, кот нужно учитывать при расчетах.
В океанах по глубине выделяют 4 зоны с разной степенью насыщения воды карбонатами.
1 зона – до глубины 800м (пересыщен карбонатами)
2 зона – до 2000 м (недосыщена карбонатами)
3 зона – до 4000 м (равновесное состояние)
4 зона – до дна (недонасыщенное состояние связана с ростом гидростатического давления).
24.Жесткость природных вод.Классификация природных вод по величине жесткости. Способы уменьшения жесткости воды.
Жесткостью называют свойство воды, обусловленное наличием в ней растворимых солей кальция и магния. Различают следующие виды жесткости.
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Реагентное умягчение. Метод основан на добавлении в воду соды или гашенной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний). Взамен, в зависимости от ионной формы, отдавая ионы натрия иливодорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. Как правило, жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л.Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4: 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓+ 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4 Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому достигается лучшее умягчение воды. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду. Определенное умягчение воды происходит и в бытовых фильтрах для питьевой воды. Отфильтрованная вода дает меньше накипи. Полностью очистить воду можно методом перегонки(дистилляцией)
Характеристика химических показателей качества воды
Химический анализ природной воды имеет решающее значение в практике водоснабжения. Результаты анализа позволяют установить пригодность источника для питьевого и технического водоснабжения, наличие в воде вредных для организма загрязнений или соединений, способствующих ее коррозийной активности, вспениванию, образованию накипи и т. д.
На основании сопоставления результатов анализа природной воды с требованиями, предъявляемыми к ней потребителем, можно судить о том, каким процессам очистки следует подвергнуть эту воду для улучшения тех или иных показателей ее качества.
Активная реакция воды, т. е. степень ее кислотности или щелочности, определяется концентрацией водородных ионов, точнее, их активностью 1. Как известно, вода в незначительной степени диссоциирует на ионы водорода и гидроксила. В упрощенном виде, без учета воды, гидратирующей протон и гидроксил, процесс диссоциации можно представить в виде
H2O ↔ H+ + OH–
Для этой обратимой реакции константа равновесия определяется уравнением
где aH+, aOH- – активности соответствующих ионов.
В связи с тем что степень диссоциации молекул воды незначительна, воду можно рассматривать как чистое вещество, для которого при стандартных температуре и давлении активность равна единице (aH2O=1). Тогда ан + аон- = Кw, где Кw — так называемое ионное произведение воды, зависящее только от температуры:
Поскольку содержание ионов Н+ и ОН~ в воде очень мало, активности ионов можно заменить их концентрациями:
[H+] [OH–] = Kw.
При комнатной температуре можно принять Кw = 1 • 10-14. В нейтральном растворе концентрация водородных ионов равна концентрации гидроксильных ионов:
[H+] = [OH–] = 10-7 г-ион/л.
При [H+] > 10-7 растворы имеют кислую реакцию, при [H+] < 10-7 – щелочную.
Активную реакцию воды принято выражать водородным показателем pH, представляющим собой отрицательный десятичный логарифм концентрации водородных ионов: pH = – lg [Н+]. Величина pH нейтральных растворов равна 7, кислых растворов – меньше 7 и щелочных растворов – больше 7.
В отличие от чистой воды или нейтральных растворов солей, в которых концентрации [Н+] и [ОН–] настолько малы, что ими можно пользоваться вместо активностей, в кислых и щелочных растворах концентрации этих ионов могут отличаться на несколько порядков по величине. В таком случае вместо концентрации необходимо пользоваться активностью.
В кислых или щелочных растворах ионное произведение воды выражается зависимостью aH + aОH- = Кw. Связь между величинами Кw и Кw описывается следующим уравнением:
KwF2 = K`w,
Где F – коэффициент активности, зависящий от ионной силы раствора.
Обычно для большинства природных вод величина pH изменяется в пределах 6,5—8,5. На величину pH воды влияют повышенная концентрация гумусовых кислот, загрязнение водоема сточными водами промышленных предприятий и т. п.
Постоянство величины pH, которое имеет большое значение для нормального протекания в воде различных биологических и физико-химических процессов, обеспечивается в природных водах буферной системой, состоящей из растворенной в воде угольной кислоты и ионов НСО3– Угольная кислота диссоциирует на ионы
H2CO3 ↔ HCO3– + H+.
Константа равновесия при этом определяется из уравнения
откуда
Таким образом, концентрация ионов водорода прямо пропорциональна количеству Н2СО3 и обратно пропорциональна содержанию НСО3-.
Концентрация водородных ионов такой буферной системы незначительно изменяется с разбавлением, так как pH системы определяется не концентрацией кислоты и ее соли, а отношением этих концентраций.
Прибавление некоторых количеств кислоты или щелочи мало влияет на pH воды, так как при прибавлении к воде щелочи часть ионов Н+, которые образовались при диссоциации угольной кислоты, связывается в малодиссоциированную воду.
Это приводит к диссоциации новых количеств кислоты и восстановлению первоначальной концентрации Н+.
В случае прибавления к воде кислоты избыточные ионы водорода связываются с НСО3–
в малодиссоциированную угольную кислоту, в результате чего концентрация Н+ в системе также изменяется незначительно.
Хотя емкость гидрокарбонатной буферной смеси в природной воде не очень велика, все же в процессах обработки воды, связанных с подкислением или подщелачиванием, pH последней, как правило, меняется мало. Согласно ГОСТ 2874-82 «Вода питьевая», pH хозяйственно-питьевой воды должно находиться в пределах 6-9.
Окисляемость воды. Наличие в природных водах органических и некоторых легкоокисляющихся неорганических примесей (сероводорода, сульфитов, железа (II) и др.) обусловливает определенную величину окисляемости воды. В связи с тем, что окисляемость поверхностных вод объясняется главным образом наличием органических веществ, установление окисляемости, т. е. количества кислорода, необходимого для окисления примесей в данном объеме воды, является одним из косвенных методов определения органических веществ в воде.
Наименьшей величиной окисляемости (~ 2 мг/л 02) характеризуются артезианские воды. Окисляемость грунтовых вод зависит от глубины их залегания. Грунтовые незагрязненные воды имеют окисляемость, близкую к окисляемости артезианских вод. Окисляемость чистых озерных вод в среднем составляет 5-8 мг/л кислорода; в речной воде она колеблется в широких пределах, доходя до 60 мг/л и более. Высокой окисляемостью воды отличаются реки, бассейны которых расположены в болотистых местностях. В болотных водах в некоторых случаях она достигает 400 мг/л.
Окисляемость природных, особенно поверхностных, вод не является постоянной величиной. Изменение химической характеристики поступающих в воду веществ меняет величину ее окисляемости. Повышенная окисляемость воды свидетельствует о загрязнении источника и требует применения соответствующих мероприятий по его охране при использовании для водоснабжения. Внезапное повышение окисляемости воды служит признаком загрязнения ее бытовыми сточными водами, поэтому величина окисляемости – важная гигиеническая характеристика воды.
Окисляемость определяют обработкой исследуемой воды марганцевокислым калием (перманганатная окисляемость). Однако такое определение имеет недостатки: степень окисления органических веществ перманганатом различна, некоторые органические вещества им вообще не окисляются.
Кроме того, сам перманганат в условиях анализа разлагается.
Установлено, что этим методом определяется примерно 50 % органических веществ, находящихся в воде. Поэтому подобное определение дает лишь условное представление о количестве находящихся в воде примесей и загрязнений и служит в основном для сравнения качества воды одного источника в разных местах в различное время.
Наиболее полное окисление (90-95 %) содержащихся в природных водах органических веществ достигается при замене перманганата дихроматом (дихроматная окисляемость). Высокая степень окисления, достигаемая при этом методе, позволяет применять его для количественного определения органических веществ в воде.
Дополнительные сведения о характере содержащихся в воде органических соединений можно получить, сравнивая отношение цветности и окисляемости. Повышенное значение этого отношения свидетельствует о преобладании в воде устойчивых гумусовых веществ болотного происхождения, пониженное – о гумусовых веществах планктонного происхождения. Средние значения характерны для почвенных гумусовых веществ.
Интересно отметить, что окисляемость воды после обработки ее коагулянтами и фильтрования снижается значительно меньше, чем цветность.
Таким образом, определение окисляемости является не только способом установления концентрации органических веществ, но в сочетании с другими показателями, например с цветностью, может служить и методом определения их происхождения.
Азотсодержащие вещества (ионы аммония, нитритные и нитратные ионы) образуются в воде в результате разложения белковых соединений, попадающих в нее почти всегда со сточными бытовыми водами, сточными водами коксобензольных, азотнотуковых и других заводов. Белковые вещества под действием микроорганизмов подвергаются распаду, конечный продукт которого –аммиак. Наличие последнего свидетельствует о загрязнении воды сточными водами.
Иногда в воде присутствуют ионы аммония неорганического происхождения, образующиеся в результате восстановления нитратов и нитритов гумусовыми веществами, железом (II) и т. д. Наличие в воде ионов Nh5+-, образующихся таким путем, не представляет опасности в санитарном отношении.
Если появление в воде азотсодержащих соединений происходит в результате гниения белковых веществ, то такие воды непригодны для питья. В природной воде ионы NH4+ неустойчивы и при окислении кислородом воздуха под действием бактерий Nitrosomonas и Nitrobacter постепенно превращаются в нитритные и нитратные ионы:
2NH+ + 20Н~ + 302 = 2NO;f + 2Н++4НгО, 2NO7+ 02 = 2NOJ-.
Первая стадия окисления протекает значительно быстрее, чем вторая. Весь процесс окисления замедляется при понижении температуры, а при 0 °С почти прекращается.
При недостатке кислорода и наличии безазотистых веществ (крахмала, клетчатки) ионы NO-Г под действием группы денитрифицирующих бактерий разлагаются до азота:
Образование нитратов и нитритов в воде может быть не только следствием описанных выше процессов. Нитраты, например, образуются при электрических грозовых разрядах в результате окисления азота кислородом воздуха или при растворении нитратных солей почвенными водами. Восстанавливаясь, нитраты служат источником обогащения воды нитритами.
В поверхностных водах содержатся главным образом нитраты (количество их невелико, 0,001-0,003 мг/л). В артезианских водах содержание нитритов может достигать десятых долей миллиграмма в литре.
По наличию тех или иных азотсодержащих соединений судят о времени загрязнения воды сточными водами. Так, наличие в воде NH4+ и отсутствие нитритов указывает на недавнее загрязнение воды. Одновременное присутствие их свидетельствует о том, что с момента первичного загрязнения прошел уже какой-то промежуток времени. Отсутствие NH4+ при наличии нитритов и особенно нитратов говорит о том, что загрязнение произошло уже давно и вода за это время самоочистилась.
Повышенное содержание нитратов (более 50 мг/л) в воде, постоянно используемой для питья, приводит к нарушению окислительной функции крови — метгемоглобинемии. Случай метгемоглобине- мии наблюдались при употреблении питьевой воды, в которой концентрация нитратов составляла 60—800 мг/л.
Сухой остаток и потеря при прокаливании. О количестве солей, содержащихся в природных водах, можно судить по величине сухого остатка и потере массы при прокаливании. Сухой остаток, образующийся при выпаривании определенного объема воды, предварительно профильтрованной через бумажный фильтр, состоит из минеральных солей и нелетучих органических соединений. Органическая часть сухого остатка воды определяется потерей его при прокаливании.
Определение потери при прокаливании используется для контроля содержания органических веществ, хотя достоверные результаты получаются лишь для вод с малым содержанием солей. Для вод с повышенным количеством солей полученные данные обычно превышают истинное содержание органических веществ в результате частичного распада и улетучивания при прокаливании минеральных солей некоторых азотсодержащих соединений, карбонатов, а также кристаллизационной воды.
Хлориды и сульфаты. Благодаря большой растворимости хлористых солей ионы хлора содержатся почти во всех водах. Так, растворимость NaCl составляет 360, MgCl – 545 г/л. Большие количества хлоридов могут попадать в воду в результате вымывания поваренной соли или других хлористых соединений из соприкасающихся с водой пластов пород, а также при попадании в воду промышленных и хозяйственно-бытовых сточных вод. В последнем случае наряду с повышенным содержанием ионов хлора в воде наблюдаются наличие аммиака, нитритов, повышенная окисляемость и другие показатели, свидетельствующие о загрязненности воды.
Кроме ионов Сl– в природных водах часто встречаются ионы SO42–. В реках и пресных озерах содержание сульфат-ионов обычно колеблется в пределах 60-100 мг/л. Сульфат-ионы попадают в воду в основном при растворении осадочных пород, в состав которых входит гипс. Иногда ионы SO42– образуются в воде в результате окисления сульфидов и самородной серы, а также вследствие загрязнения воды промышленными и бытовыми сточными водами. При отсутствии кислорода ионы SOP под действием сульфатредуцирующих бактерий восстанавливаются до H2S.
Наличие в воде большого количества сульфатов нежелательно, так как сульфат натрия, например, нарушает деятельность желудочно-кишечного тракта, а сульфаты кальция и магния повышают некарбонатную жесткость воды.
Сульфаты и хлориды в определенных концентрациях являются причиной коррозийной активности (агрессивности) воды. Сульфатная агрессивность возникает при наличии в воде ионов сульфата в количестве 300 мг/л и более. Согласно данным, воды, содержащие 250-800 мг/л SO42–, слабоагрессивны и только при концентрации SO42– более 800— 900 мг/л становятся агрессивными.
Воды, содержащие большое количество сульфатов, оказывают разрушающее действие на бетонные конструкции. Причиной служит образование гипса (в результате реакции между известью цемента и сульфатами), которое сопровождается увеличением объема и возникновением в бетоне трещин. Хлориды, содержащиеся в воде в больших количествах, при соприкосновении с бетоном разрушают его в результате выщелачивания образующихся при взаимодействии с известью растворимых хлоридов; кальция и магния.
Щелочность воды. Под общей щелочностью воды подразумевается сумма содержащихся в воде гидроксильных ионов (ОН–) и анионов слабых кислот, например угольной (ионов НСО3-, СО32–). Поскольку в большинстве природных вод преобладают углекислые соединения, различают обычно лишь гидрокарбонатную и карбонатную щелочность. При некоторых приемах обработки воды и при pH ее выше 8,5 возникает гидратная щелочность.
Щелочные металлы. Из ионов щелочных металлов в воде наиболее распространены Na+ и К+, попадающие в воду в результате растворения коренных пород. Основным источником натрия в природных водах являются залежи поваренной соли. В природных водах натрия содержится больше, чем калия. Это объясняется лучшим поглощением последнего почвами, а также большим извлечением его из воды растениями.
Жесткость воды. Жесткость природных вод обусловливается наличием в них солей кальция и магния. Ионы Са2+ поступают в воду при растворении известняков под действием содержащейся в воде углекислоты и при непосредственном выщелачивании водой гипса.
СаСO3 + Н2O + СO2 Са2+ + 2НСО3–
Таблица 2.2. Сравнение различных единиц измерения жесткости воды
|
Единицы измерения жесткости воды |
мг-экв/л |
Градус жесткости |
|||
|
немецкий |
французкий |
английский |
американский |
||
|
мг-экв/л |
1 |
2,8040 |
5,0050 |
3,5110 |
50,045 |
|
Градус |
|
|
|
|
|
|
немецкий |
0,3566 |
1 |
1,7848 |
1,2521 |
17,847 |
|
французский |
0,1998 |
0,5603 |
1 |
0,7015 |
10,000 |
|
англиискии |
0,2848 |
0,7987 |
1,4235 |
1 |
14,253 |
|
американским |
0,0199 |
0,0560 |
0,1000 |
0,0702 |
1 |
и при непосредственном выщелачивании водой гипса.
Основным источником ионов магния служат доломиты, также растворяющиеся водой в присутствии углекислоты:
СаСO3 • MgCO3 + 2CO2 + 2Н2O ↔ Са2++ Mg2++ 4HCO3–.
Хотя указанные соли и не являются особо вредными для организма, наличие их в воде в больших количествах нежелательно, так как вода становится непригодной для хозяйственно-питьевых нужд и промышленного водоснабжения. В жесткой воде плохо развариваются овощи, перерасходуется мыло при стирке белья. Жесткая вода непригодна для питания паровых котлов; ее нельзя использовать во многих отраслях промышленности.
Общая жесткость воды представляет собой суммы карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жеcткость, связанная с присутствием в воде в основном гидрскзрбонатов кальция или магния, почти полностью удаляется при кипячении воды. Гидрокарбонаты при этом распадаются с образованием углекислоты, в осадок выпадают карбонаты кальция и гидроксид магния.
Некарбонатная жесткость обусловливается присутствием кальциевых и магниевых солей серной, соляной и азотной кислот и кипячением не устраняется.
Жесткость воды представляет сумму эквивалентных концентраций ионов Са2+ и Mg2+ и выражается в миллиграмм-эквивалентах на 1л; 1 мг-экв/л жесткости отвечает 20,04 мг/л ионов Са2+или 12,6 мг/л ионов Mg2+. В зарубежных странах жесткость измеряется различными единицами. Так, немецкий градус составляет 10мг СаО в 1 л воды, английский — 10 мг СаСО3 в 0,7 л воды, французский — 10 мг СаСО3 в 1 л воды, американский — 1 мг СаСО8 в 1 л воды. Соотношение различных единиц жесткости воды приведено в табл. 2.2.
Железо и марганец. Железо в природных водах может находиться в виде ионов Fe2+ и Fe3+, неорганических (Fe(OH)3, Fe(OH)2, FeS) и органических коллоидов, комплексных соединений (главным образом органических комплексных соединений железа) и тонкодисперсной взвеси (Fe(OH)3, Fe(OH)2, FeS). В поверхностных водах железо содержится в виде органических комплексных соединений, коллоидов или тонкодисперсных взвесей. В подземных водах при отсутствии растворенного кислорода железо обычно находится в виде солей железа (II). Форма, в которой присутствуют в природных водах железо и марганец, зависит от величины pH и содержания кислорода.
Окисление железа (II) в воде с максимальной скоростью происходит при pH > 7, а марганца (II) – при pH > 9. Образующийся в результате гидролиза и окисления железа (II) гидроксид железа (III) малорастворим и благодаря защитному действию гумусовых веществ 1 может присутствовать в природных водах в коллоидном состоянии.
Обычно содержание железа и марганца не превышает нескольких десятков миллиграммов в 1 л воды. Хотя вода, содержащая и более высокие количества этих ионов, совершенно безвредна для здоровья, все же для питьевых, промышленных и хозяйственных целей она непригодна, так как имеет неприятный чернильный или железистый привкус.
Наличие в воде железа и марганца может приводить к развитию в трубопроводах железистых и марганцевых бактерий, использующих в процессе своей жизнедеятельности энергию, выделяемую при окислении соединений с низшей в соединения с высшей валентностью. Продукты жизнедеятельности бактерий накапливаются в таких количествах, что могут значительно уменьшить сечение водопроводных труб, а иногда и полностью их закупорить.
Соединения кремния. Кремний присутствует в природных водах в виде минеральных и органических соединений. Выщелачивание силикатных пород обогащает природные воды кремниевой кислотой и ее солями. Кремниевая кислота очень слабая и диссоциирует на ионы в незначительной степени:
H2Si03 ↔ Н+ + HSiO3-.
При pH < 7 в воде находится только недиссоциированная кремниевая кислота. Часть кремния может присутствовать в воде в коллоидном состоянии в виде SiО2 • Н2О или в виде поликремниевой кислоты хSiО2 • yНО2. Наибольшее количество кремния находится в подземных водах. В воде поверхностных источников удержание его меньше и колеблется от десятых долей до нескольких миллиграммов в 1 л. Объясняется это тем, что соли кремния являются питательными веществами для многих организмов, населяющих открытые водоемы.
Наличие соединений кремния в питьевой воде не вредно для здоровья. Если же вода используется для питания паровых котлов высокого давления, содержание самого незначительного количества кремниевой кислоты недоступно из-за образования плотной силикатной накипи.
Соединения фосфора. Фосфор встречается в воде в виде ионов ортофосфорной кислоты или органического комплекса, а также в виде взвешенных частиц органического и минерального происхождения. Соединения фосфора содержатся в природных водах в ничтожных количествах, однако имеют огромное значение для развития растительной жизни в водоемах.
Растворенные в воде газы. Из растворенных в воде газов наиболее важными для оценки ее качества являются углекислота, кислород, сероводород, азот и метан. Углекислота, кислород и сероводород при определенных условиях придают воде коррозийные свойства по отношению к бетону и металлам.
Углекислота встречается в больших или меньших количествах во всех природных водах. Подземные воды обогащаются углекислотой за счет разложения органических соединений в воде и почвах, а также вследствие протекающих в глубине геохимических процессов.
Уменьшение содержания СО2 в природных водах может происходить благодаря выделению углекислоты в атмосферу, растворению карбонатных пород с образованием гидрокарбонатов или в результате фотосинтеза.
Содержание углекислоты в природных водах колеблется от нескольких долей до нескольких сотен миллиграммов в 1 л. Наибольшее количество ее находится в подземных водах. В воде поверхностных источников содержание СО2 не превышает 20-30 мг/л.
В зависимости от величины pH воды углекислота встречается в ней в свободном (в виде углекислого газа СО2) или связанном состоянии (в виде гидрокарбонат-ионов НСО3– и карбонат-ионов СОз2–). При pH < 4,0 гидрокарбонат-ионы в воде отсутствуют и вся углекислота находится в виде углекислого газа. При pH 8,4 в воде содержатся преимущественно ионы НСО3-, а при pH > > 10,5 — только ионы СОз2-.
Ионы гидрокарбоната наиболее распространены в природных водах. В некоторых случаях содержание их достигает 1200 мг/л. Для поддержания высоких концентраций ионов гидрокарбоната необходимо большое количество СО2.
Однако это не реально в поверхностных водах, поэтому в реках и пресных озерах содержание НСО3– не превышает 300 мг/л. Наиболее устойчивы в речной воде ионы НСО3– в концентрации 50— 70 мг/л. Содержание ионов СОз2 в воде, за исключением содовых вод, невелико и определяется растворимостью карбоната кальция.
Находящиеся в воде ионы НСО3-, СОз2 и углекислый газ связаны так называемым углекислотным равновесием:
При наличии ионов Са2+ углекислотное равновесие выражается уравнением
По закону действующих масс константа равновесия этой реакции
Если учесть, что концентрации [Н2O] и [СаСO3] — постоянные величины и могут быть введены в константу, а [Са2+] эквивалентен 2 [НСО3-], то
Из этого выражения видно, что гидрокарбонат-ионы существуют в растворе только при наличии свободной углекислоты. Часть свободной углекислоты, находящейся в равновесии с гидрокарбонатами, называется равновесной. Она как бы связана с гидрокарбонатами и поэтому не вступает в химические реакции.
Избыточная свободная углекислота в отличие от равновесной очень активна и называется агрессивной. Однако не вся она агрессивна: одна часть избыточной свободной углекислоты, действуя на карбонат кальция, превращает его в гидрокарбонат, а другая идет на увеличение количества равновесной углекислоты для удержания в растворе вновь образовавшихся количеств гидрокарбоната.
В водах открытых водоемов из-за низкого содержания углекислоты в воздухе присутствие агрессивной углекислоты маловероятно. В подземных водах содержание агрессивной углекислоты иногда бывает весьма значительным.
Для определения агрессивной углекислоты в воде можно пользоваться кривыми равновесия связанная углекислота — свободная углекислота (рис. 2.4) Е Точки, лежащие на кривой MB, характеризуют количество свободной углекислоты, находящейся в равновесии с гидрокарбонатной углекислотой. Точки выше равновесной кривой соответствуют аг- грессивным водам, точки ниже кривой — водам, пересыщенным карбонатом кальция.
На основании рис. 2.4 количество агрессивной углекислоты определяют следующим образом. Допустим, что в растворе имеется 180 мг/л углекислоты, из них 80 мг/л составляет связанная углекислота, 100 мг/л — свободная (рис. 2.4, точка А). 80 мг/л связанной углекислоты удерживается в воде при наличии 11,5 мг/л равновесной (FD).Так как содержание свободной углекислоты равно 100 мг/л, в системе имеется избыток свободной углекислоты, часть которой пойдет на растворение углекислого кальция, приводя к установлению равновесия. Этому равновесию на кривой отвечает точка, в которой количество связанной и равновесной углекислоты должно, очевидно, равняться 180 мг/л. Такую точку легко найти графическим путем, проведя из точки А прямую под углом 45° к оси абсцисс до пересечения с кривой. В равенстве AD -Т DO= BE -j- ЕО легко убедиться. При установившемся равновесии количество равновесной углекислоты соответствует отрезку BE. Количество агрессивной углекислоты находим, проводя из точки В прямую, параллельную оси абсцисс, до пересечения с AD. Таким образом, отрезок CD соответствует равновесной углекислоте, а АС — агрессивной.
При увеличении в воде концентрации гидрокарбонатов количество необходимой оавновесной углекислоты значительно повышается. Следовательно, вероятность наличия агрессивной углекислоты больше для мягких, чем для жестких, вод.
При оценке агрессивности воды наряду с концентрацией агрессивной углекислоты следует учитывать солевой состав воды в связи с тем, что углекислотное равновесие зависит, как уже отмечалось, и ст общего содержания солей. При увеличении содержания солей в воде количество свободной углекислоты, необходимое для поддержания углекислотного равновесия, уменьшается. Поэтому при одном и том же содержании свободной углекислоты вода при наличии большего количества солей будет более агрессивной.
Смешение двух или нескольких неагрессивных вод в результате смещения углекислотного равновесия может привести к появлению агрессивности. Воды состава М и N (см. рис. 2.4) не агрессивны, их смеси, состав которых определяется прямой MN, агрессивны.
Значительное нарушение углекислот- н:г: сззновесия воды происходит при счистке природных вод коагулировани- е::. так как введение каждого милли- грамма безводного сульфата алюминия или хлорида железа сопровождается выделением 0,8 мг свободной углекислоты.
Агрессивные свойства углекислоты основаны на ее способности взаимодействовать с карбонатными породами и переводить их в растворимые в воде гидрокарбонаты, а также на некотором снижении pH среды, в результате чего усиливается электрохимическая коррозия некоторых металлов, например железа.
Действие углекислоты на бетон сводится к растворению извести цемента, что значительно ослабляет прочность бетона. Удаление извести нарушает равновесие и приводит к разложению других составных частей цемента, в частности силикатов и алюминатов кальция. На этом же процессе основано и коррозионное действие воды, содержащей углекислоту, на металлические трубы.
Углекислота не является коррозионным агентом, непосредственно воздействующим на металл. Действие ее заключается в растворении карбонатов составных частей ржавокарбонатных отложений, которые образуются в водопроводной сети. В результате этого процесса происходят дальнейшая коррозия материала труб и образование новых отложений; вода приобретает желтую или красноватую окраску, неприятный вкус и содержит мелкие комья рыхлых железистых веществ.
Коррозионные отложения в водопроводных трубах, обладающие значительной адсорбционной способностью, поглощают остаточный хлор, снижая этим эффект обеззараживания. Наличие в трубопроводах соединений железа (II), которые образуются в результате разрушения материала труб, способствует развитию железобактерий, жизнедеятельность которых связана с процессом окисления железа. Присутствие в воде агрессивной углекислоты значительно ухудшает работу очистных сооружений за счет усиленного зарастания отстойников синезелеными водорослями и засорения фильтров пузырьками газа.
Кислород может находиться в природных водах в различных концентрациях (0—14,6 мг/л), что определяется интенсивностью противоположно направленных процессов, влияющих на содержание кислорода в воде. Обогащение воды кислородом происходит за счет растворения его из воздуха (в соответствии с парциальным давлением кислорода и температурой воды) и выделения водной растительностью в процессе фотосинтеза.
Окисление некоторых примесей воды, гниение органических остатков, брожение, дыхание организмов понижают содержание кислорода в воде. Резкое уменьшение содержания кислорода в воде по сравнению с нормальным свидетельствует о ее загрязнении.
Определение концентрации кислорода имеет большое значение при изучении физико-химического режима водоема, его самоочищения и биологической жизни.
Кислород интенсифицирует процессы коррозии металлов, поэтому в водах, которые используются для теплоэнергетических систем, количество растворенного кислорода лимитируется.вслёдствие пассивации поверхности за счет образования оксидных пленок.
Ионы Fe2+, реагируя с гидроксильными ионами воды, дают гидроксид железа (II)
Fe2++-20Н– =. Fe(ОН)2,
который под действием кислорода в присутствии влаги переходит в гидроксид железа (III)
4Fe(ОН)2 + 2Н2О + О2 = 4Fe(ОН)3.
В дальнейшем гидроксид железа (III) превращается в ржавчину
m FeO(Н20)р + п Fe30 (Н2О)3.
Сероводород попадает в природные воды в результате их соприкосновения с гниющими органическими остатками (сероводород органического происхождения) либо с некоторыми минеральными солями (гипсом, серным колчеданом и др.). Последние, восстанавливаясь и разлагаясь, выделяют сероводород (сероводород неорганического происхождения).
Наличие в воде сероводорода органического происхождения свидетельствует о загрязненности водоисточника. Обычно содержание сероводорода в природных водах не превышает нескольких десятков миллиграммов в 1 л. В поверхностных источниках присутствие сероводорода маловероятно, так как он легко окисляется. Иногда сероводород встречается в придонных слоях поверхностных источников.
В связи с ухудшением органолептических показателей качества воды, развитием серобактерий и интенсификацией процессов коррозии сероводород необходимо удалять из воды, используемой для хозяйственно-питьевого или промышленного водоснабжения.
Азот попадает в природные воды при поглощении его из воздуха, восстановлении соединений азота денитрифицирующими бактериями, а также в результате разложения органических остатков. Несмотря на меньшую по сравнению с кислородом растворимость азота содержание последнего в природных водах больше из-за более высокого парциального давления его в воздухе.
Метан образуется в воде иногда в очень значительных количествах при разложении микробами клетчатки растительных остатков. Количество метана в природной воде может достигать 30 мг/л.
Микроэлементы. Наряду с органическими и минеральными примесями и загрязнениями, которые находятся в природных водах в относительно больших количествах, в последних содержится ряд химических элементов в самых ничтожных дозах (иод, бром, фтор, селен, теллур и др.). В отличие от других примесей природных вод эти элементы почти не контролируются, хотя в настоящее время установлено, что они оказывают большое влияние на здоровье человека.
Для нормальной жизнедеятельности человеческого организма содержание перечисленных элементов в воде должно находиться в строго определенных пределах. При нарушении этих пределов могут возникать массовые заболевания, называемые геохимическими эндемиями. Например, установлена суточная потребность организма в иоде и фторе. Человек ежесуточно должен потреблять 0,06—• 0,10 мг иода. Отсутствие или недостаток его в питьевой воде и пище нарушает нормальную деятельность щитовидной железы и приводит к тяжелому заболеванию — эндемическому зобу.
Содержание фтора в питьевой воде должно находиться в пределах 0,7—- 11,5 мг/л. Недостаточное или избыточное содержание его в воде одинаково вредно и вызывает разрушение зубов и изменения в костях скелета.
Радиоактивные элементы. К примесям природных вод относятся и радиоактивные элементы. Радиоактивность в той или иной мере свойственна всем водам [80—83]. Допустимым пределом радиоактивности в обычной питьевой воде считается 10—8—10-9 мкКи/л. Радиоактивность некоторых минеральных вод достигает 2,8 • 10-3 мкКи/л.
Большое содержание урана и общая радиоактивность обнаруживаются в воде рек, русла которых дренируют карнатиты. За последние годы усилилась опасность внешнего загрязнения природных вод радиоактивными элементами [84, 85]. Так, радиоактивность, являющаяся следствием испытаний атомного оружия, была отмечена в период дождей в Индии, Японии, Франции, США и других странах. Атомные реакторы, построенные во многих странах мира выделяют, особеннов период аварии, сточные воды с высокой радиоактивностью.
Ядовитые вещества попадают в воду с промышленными отбросами и канализационными сточными водами населенных пунктов, а также при умышленном отравлении водоема. Токсическая концентрация таких веществ обычно достигается уже при содержании их в количестве нескольких миллиграммов (редко одного- двух десятков миллиграммов) в 1 л воды. К этой группе веществ относятся свинец, цинк, медь, мышьяк, ртуть и др., а также органические вещества, называемые отравляющими (ОВ).
Свинец, медь и цинк попадают в воду главным образом с промышленными сточными водами. Наиболее ядовитым из этих металлов является свинец, который накапливается в организме и может вызвать опасное отравление.
Вода, подаваемая населению, не должна содержать более 0,03 мг/л свинца, 1 мг/л меди и 5 мг/л цинка. Определение содержания этих металлов требуется лишь в тех случаях, когда предполагается наличие их в источнике водоснабжения.
Мышьяк в очень небольших концентрациях может поступать в воду из почв, содержащих его соли. В значительных количествах он был обнаружен в некоторых минеральных водах. В открытые водоемы мышьяк попадает со сточными водами населенных пунктов и промышленных предприятий (от дубильных цехов кожевенных заводов, красильных, ситцепечатных фабрик, металлообрабатывающих заводов и т. д.). Его содержание в питьевой воде не должно превышать 0,05 мг/л.
Известны ОВ самого различного действия, однако, попадая в воду, они ведут себя в основном как общеядовитые. На зараженность воды ОВ могут указывать некоторые внешние признаки и данные обычных методов контроля, так как наличие ОВ вызывает изменение многих показателей качества воды, например pH, окисляемости, хлоропоглощаемости, содержания хлоридов и растворенного кислорода, а также данные биологических и бактериологических исследований. Поэтому все перечисленные показатели в условиях отравления воды ОВ должны определяться и фиксироваться систематически.
При pH < 7 в воде находится только недиссоциированная кремниевая кислота. Часть кремния может присутствовать в воде в коллоидном состоянии в виде SiО2• Н2О или в виде поликремниевой кислоты хSiО2• yНО2. Наибольшее количество кремния находится в подземных водах. В воде поверхностных источников удержание его меньше и колеблется от десятых долей до нескольких миллиграммов в 1 л. Объясняется это тем, что соли кремния являются питательными веществами для многих организмов, населяющих открытые водоемы.
Наличие соединений кремния в питьевой воде невредно для здоровья. Если же вода используется для питания паровых котлов высокого давления, содержание самого незначительного количества кремниевой кислоты недоступно из-за образования плотной силикатной накипи.
Соединения фосфора.Фосфор встречается в воде в виде ионов ортофосфорной кислоты или органического комплекса, а также в виде взвешенных частиц органического и минерального происхождения. Соединения фосфора содержатся в природных водах в ничтожных количествах, однако имеют огромное значение для развития растительной жизни в водоемах.
Растворенные в воде газы.Из растворенных в воде газов наиболее важными для оценки ее качества являются углекислота, кислород, сероводород, азот и метан. Углекислота, кислород и сероводород при определенных условиях придают воде коррозийные свойства по отношению к бетону и металлам.
Углекислота встречается в больших или меньших количествах во всех природных водах. Подземные воды обогащаются углекислотой за счет разложения органических соединений в воде и почвах, а также вследствие протекающих в глубине геохимических процессов.
Уменьшение содержания СО2 в природных водах может происходить благодаря выделению углекислоты в атмосферу, растворению карбонатных пород с образованием гидрокарбонатов или в результате фотосинтеза.
Содержание углекислоты в природных водах колеблется от нескольких долей до нескольких сотен миллиграммов в 1 л. Наибольшее количество ее находится в подземных водах. В воде поверхностных источников содержание СО2 не превышает 20-30 мг/л.
Строительство плавательных водоёмов, декоративных водоёмов, бассейнов, фонтанов. Проекты водоёмов. 8 (800) 333-65-78
Добавлено: 05.02.2015
Углерод
Диоксид углерода
Важную роль в процессах, протекающих в воде искусственного водоёма, играет оксид углерода (IV) или, как его чаще называют, углекислый газ. Он представляет собой соединение углерода с кислородом; в молекуле вещества один атом углерода связан с двумя атомами кислорода — CO2. Углекислый газ влияет на гидрохимические параметры воды (жесткость, pH, содержание различных веществ), он действует на рыб и других водных животных и играет важнейшую роль в развитии аквариумных растений.
Диоксид углерода содержится в воде в основном в виде растворенных молекул CO2 и лишь малая часть его (около 1%) при взаимодействии с водой образует угольную кислоту:
CO2 + H2O <=> H2CO3
Диоксид углерода, гидрокарбонатные и карбонатные ионы являются основными компонентами карбонатной системы. В растворе между ними существует подвижное равновесие:
H2CO3 <=> Н+ + HCO3– <=> 2Н+ + CO32-
Соотношение между компонентами в значительной мере определяется величиной рН.
- При рН 4.5 и ниже из всех компонентов карбонатного равновесия в воде присутствует только свободная углекислота.
- В интервале рН=6-10 (pH водs в искусственном водоёме в нормальных условиях должен быть от 7.8 до 9) гидрокарбонатные ионы являются основной формой производных угольной кислоты (максимальное их содержание при рН=8.3-8.4).
- При рН более 10.5 главной формой существования угольной кислоты являются карбонатные ионы.
Главным источником поступления оксида углерода в воды искусственного водоёма являются процессы биохимического распада органических остатков, окисления органических веществ, дыхания водных организмов.
Одновременно с процессами поступления значительная часть диоксида углерода потребляется при фотосинтезе, а также расходуется на растворение карбонатов и химическое выветривание алюмосиликатов:
CaCO3 + CO2 + H2O <=> Ca(HCO3)2
HSiO3– + CO2 + H2O <=> H2SiO3 + HCO3–
Уменьшение диоксида углерода в воде происходит также в результате его выделения в атмосферу.
Концентрация диоксида углерода в природных водах колеблется от нескольких десятых долей до 3-4 мг/дм3, изредка достигая 10-20 мг/дм3.
Обычно весной и летом содержание диоксида углерода в водоеме понижается, а в конце зимы достигает максимума. Диоксид углерода имеет исключительно важное значение для растительных организмов населяющих искусственный водоём (как источник углерода).
Как известно, водные растения состоят из органических соединений, т. е. соединений, основу (скелет) которых составляет углерод. Нарастание биомассы растений связано с необходимостью подпитки их извне соединениями углерода. Основным веществом, служащим для питания растений является углекислый газ. Растения ассимилируют (поглощают) CO2, превращая его в органические соединения — глюкозу, крахмал и другие.
Поглощение CO2 связано с изменением pH воды искусственного водоёма: сдвигом его значения в щелочную сторону. Содержание углекислого газа в воде искусственного водоёма снижается при уменьшении жесткости и уменьшении кислотности воды. Поэтому очень мягкая и особенно щелочная вода неблагоприятны для водных растений. Многие растения прекращают рост даже в слабощелочной среде (при pH около 8).
Забирая углекислый газ из воды, водные растения сами ухудшают условия своего существования; для их улучшения необходим новый источник углерода. Некоторые водные растения могут использовать в процессе фотосинтеза только свободный CO2, растворенный в воде искусственного водоёма. Если весь углекислый газ израсходован, то процесс фотосинтеза прекращается, и рост растения останавливается.
В то же время повышенные концентрации CO2 угнетающе действуют на животные организмы обитающие в пруду. Углекислый газ в больших концентрациях токсичен для водных животных. При большом содержании CO2 в воде он попадает в кровь рыб, вызывая удушье. Для нормального функционирования аквасистемы концентрация CO2 в воде искусственного водоёма не должна превышать 4 мл/л.
При высоких концентрациях CO2 воды также становятся агрессивными по отношению к металлам и бетону в результате образования растворимых гидрокарбонатов, нарушающих структуру этих материалов.
Карбонаты
Важная роль углекислого газа в гидрохимии искусственного водоёма состоит в установлении так называемого углекислотно-известкового равновесия. Это равновесие определяется главным образом тремя параметрами; концентрацией CO2 в воде, значениями pH и карбонатной жесткости dKH.Карбонат кальция CaCO3 обладает очень плохой растворимостью в воде (7 мг в 1 л), что соответствует 2° жесткости. При растворении CO2 в воде карбонаты, которые практически всегда содержатся в грунте, начинают взаимодействовать с углекислым газом, с образованием гидрокарбонатов, которые хорошо растворимы в воде:
Основным источником гидрокарбонатных и карбонатных ионов в поверхностных водах являются процессы химического выветривания и растворения карбонатных пород типа известняков, мергелей, доломитов:
CaCO3 + CO2 + H2O <=> Сa2+ + 2HCO3–
MgCO3 + CO2 + H2O <=> Mg2+ + 2HCO3–
Некоторая часть гидрокарбонатных ионов поступает с атмосферными осадками и грунтовыми водами. Гидрокарбонатные и карбонатные ионы выносятся в водоемы со сточными водами предприятий химической, силикатной, содовой промышленности и т.д.
По мере накопления гидрокарбонатных и особенно карбонатных ионов последние могут выпадать в осадок:
Ca(HCO3)2 => CaCO3 + H2O + CO2
Сa2+ + CO32- => CaCO3
В речных водах содержание гидрокарбонатных и карбонатных ионов колеблется от 30 до 400 мг HCO3– /дм3, в озерах – от 1 до 500 мг HCO3–/дм3, в морской воде – от 100 до 200 мг/дм3, в атмосферных осадках – от 30 до 100 мг/дм3, в грунтовых – от 150 до 300 мг/дм3, в подземных водах – от 150 до 900 мг/дм3.
Однако кислотность и карбонатная жесткость не являются единственными факторами, определяющими углекислотно-известковое равновесие воды в искусственном водоёме. Это равновесие зависит от целого ряда факторов:
1.Объем искусственного водоёма. Как правило, в искусственных водоёмах большого объема равновесные процессы более устойчивы.
2.Геометрические размеры искусственного водоёма. В искусственном водоёме с большой площадью поверхности лучше осуществляется газообмен, с воздухом.
3.Количество рыб и других водных животных, выделяющих углекислый газ при дыхании.
4.Количество водных растений в искусственном водоёме, которые, в зависимости от освещенности, выделяют или поглощают углекислый газ.
5.Интенсивность освещения, влияющая на жизнедеятельность водных растений.
6.Химический состав воды, наливаемой в искусственный водоём. Наиболее важный фактор — карбонатная жесткость (dKH).
7.Режим кормления рыб. Разлагающийся избыточный корм становится источником углекислого газа.
8.Температура воды. Влияет на растворимость карбонатов, углекислого газа, на скорость всех химических реакций.
9.Грунт. От содержания карбонатов в грунте зависит гидрохимический состав воды.
10.Движение воды за счет фильтров, ручьев, каскадов, насосов и т. п. Влияет на насыщение воды углекислым газом из воздуха и растворимость карбонатов.
Все указанные факторы говорят о сложной зависимости равновесия от условий содержания искусственного водоёма: из-за такого большого комплекса факторов часто бывает невозможно предугадать направление смещения углекислотно-известкового равновесия и соответствующее ему изменение гидрохимического состава воды искусственного водоёма.
По материалам:
- сайта maxnimere.my1. ru
- Справочник по гидрохимии. Электронная версия.
Регулирование рН воды, очищаемой в горизонтальных отстойниках, с помощью диоксида углерода Текст научной статьи по специальности «Химические технологии»
ЭКОЛОГИЯ И ПРИРОДОПОЛЬЗОВАНИЕ
УДК 502.65
РЕГУЛИРОВАНИЕ рН ВОДЫ, ОЧИЩАЕМОЙ В ГОРИЗОНТАЛЬНЫХ ОТСТОЙНИКАХ, С ПОМОЩЬЮ ДИОКСИДА УГЛЕРОДА
ОН. ДЁМИНА
ФГОУ ВПО «Брянская государственная сельскохозяйственная академия»
В статье представлены результаты исследования, нацеленного на повышение производительности горизонтальных отстойников, используемых при очистке воды. Это достигается на основе взаимосвязи между концентрацией растворенного СО2, концентрацией гидрокарбонатного иона и величиной рН, наиболее оптимального для осаждения определенного состава взвешенных веществ.
В воде естественных водоемов всегда растворено большее или меньшее количество углекислого газа, содержание которого в природных водах весьма разнообразно – от нескольких десятых долей миллиграмма в 1л до 3-4 тыс. Наименьшая концентрация двуокиси углерода наблюдается в поверхностных источниках, наибольшая – в подземных и загрязненных сточных водах [1]. Обычно она встречается в виде недиссоциированной формы, гидрокарбонат- и карбонат-ионов. Растворенная газообразная двуокись углерода СО2 в воде частично гидратируется, образуя очень мало диссоциированную угольную кислоту Н2СО3. Эта форма называется свободной двуокисью углерода. Суммарное содержание всех трех форм СО2 называется «общей двуокисью углерода».
Диоксид углерода поступает в воду следующими способами:
1. В результате его поглощения водой из атмосферы, при условии, если парциальное давление СО2, растворенного в воде, ниже, чем парциальное давление СО2 в атмосфере, так как между СО2 атмосферы и СО2 в воде существует состояние подвижного равновесия.
Воздух содержит до 0,0314 %СО2. По закону Генри-Дальтона, если над раствором присутствуют другие газы, то растворимость каждой составной части смеси газов в жидкости пропорциональна парциальному давлению этого газа в данной смеси. Таким образом, умножив растворимость СО2 при определенной температуре на его парциальное давление получим значение максимально возможного количества СО2 в миллиграммах, которое может перейти из воздуха в 1 литр воды при давлении 760 мм рт. СаSО4 +СО2 + Н2О.
5. Мощным источником углекислого газа являются биологические процессы в почве. [2]. Всё бионаселение почвы непрерывно потребляет кислород и продуцирует углекилоту. Кроме того, выделение углекислоты является результатом конечной стадии разрушения органического вещества почвы. В работах В.И.Вернадского и Б.Б. Полынова показано, что химический состав поверхностных и грунтовых вод регионов с влажным и умеренно влажным климатом формирует в первую очередь именно почва.
Наряду со свободным воздухом в порах почвы, значительное количество газов и прежде всего О2 и СО2 растворено в почвенной воде. М.Рассел отмечает важное явление, заключающееся в том, что наряду со свободным воздухом в почве обычно ещё содержится воздух, растворенный в воде и адсорбированный на поверхности почвенных коллоидов. В нем, однако, очень мало кислорода, а больше углекислоты и азота. Поэтому при повышенном со-
держании влаги в почве и её уплотнении содержание СО2 в почвенном воздухе достигает 20% и более. При наличии растительного покрова в почвенном воздухе больше углекислоты, т.к. её продуцируют корни растений.
Повторив расчет, описанный в первом пункте данной работы, получаем значение максимально возможного количества СО2 в миллиграммах, которое может перейти в 1 литр воды из почвенного воздуха при температуре 20°С и давлении 760 мм рт.ст. при содержании СО2 в последнем 1, 10, 20 %: 17,5; 170,5; 341 мг\л соответственно.
6. Река в нашей зоне часто является дреной для грунтовых вод и насыщение воды СО2 происходит на водосборе. В грунтовые воды попадают с поверхности почвы с просачивающейся водой растительные и животные остатки, происходит их разложение.
В грунтовых водах встречается разнообразная микрофлора, питательной средой для которой служит органическое вещество, растворенное в воде. Как отмечает В.М. Швец, общее число бактерий колеблется в пределах десятков тысяч на 2 мл воды, причем число жизнеспособных клеток достигает 100% [1]. Наиболее интенсивно на глюкозо-пенной среде с образованием СО2 в этих водах развиваются сапрофиты.
7. В качестве источника поступления СО2 в водные объекты необходимо рассматривать и поверхностный дождевой и талый сток, который в условиях городского ландшафта, образуясь на водосборных территориях промышленных площадок, временных снегосвалок, дорожных покрытий и обочин дорог, содержит большое число загрязняющих веществ, включая токсичные и органические соединения, ухудшая качество воды. Например, в реку Сура, протекающую по территории г. Пензы, попадает ливневый сток с БПК5 до 316 мг\л, а талый – до 170мг\л соответственно при допустимом значении 6 мг\л [2].
Изучение содержания растворенного углекислого газа имеет важное значение, так как он играет особую роль для протекающих в воде процессов. Лишь за счет одного природного компонента – СО2 – степень кислотности вод и актуальная кислотность почв (кислотность, обусловленная растворенной в почвенном растворе угольной кислотой, действующей непосредственно на корневую систему растений и почвенные процессы) могут варьироваться в широком диапазоне. Диоксид углерода увеличивает растворяющую способность воды и сам по себе является источником образования ионов НСОз и СОз 2 Недостаток СО2 отрицательно сказывается на жизни водных растений, которые во время фотосинтеза с помощью хлорофилла извлекают из углекислого газа необходимый для построения живого вещества углерод. Однако и большие концентрации СО2 вредны для растительных (угнетение фотосинтеза из-за блокировки ферментных процессов) и животных организмов (снижение эффективности потребления кислорода, растворенного в воде). Избыток углекислого газа в мягкой воде может заметно подкислить такую воду, сделав её неблагоприятной для жизни биоцено-
за водоёмов, нарушив биодоступность элементов питания. К числу других последствий снижения рН для абиотических и биотических компонентов водных систем следует отнести повышение степени миграции большинства металлов, возрастание содержания токсичных форм А1, Cd, РЬ, снижение содержания фосфора и общих показателей биомассы, нарушение процесса самоочищения вод (понижение скорости разложения некоторых органических веществ, осложнение процессов сорбции и седиментации), изменение видового состава (выпадение сине-зеленых водорослей), сокращение числа видов, изменение их численности и скорости роста [3].
Высокое содержание свободной двуокиси углерода делает воду агрессивной по отношению к строительным материалам (особенно к бетону) и к металлам. Разрушающее действие такой воды заключается в образовании растворимых гидрокарбонатов, вследствие чего структура материала разрушается. Агрессивное действие воды зависит от общего углеки-слотного равновесия – равновесного состояния системы из гидрокарбонатных, карбонатных ионов и свободной углекислоты [4]:
К1 К2
СО2 + Н2О ~ Н ++ НСОз ” ~ 2 Н+ + СОз 2″ (1)
Значения констант К1 иК2 обратно пропорциональны ионной силе раствора и прямо пропорциональны температуре. При увеличении температуры кривые смещаются вправо, так как растворимость СО2 снижается в более теплой воде. Если концентрация СО2 будет меньше, чем это необходимо для поддержания равновесия, то гидрокарбонатные ионы будут разлагаться по уравнению:
2 НСОз СОз 2″+ СО2 + Н2О до тех пор, пока не установится новое равновесие.
Если концентрация СО2 будет больше, чем это требуется для установления равновесия, то будет происходить растворение СаСОз по уравнению:
СаСОз +СО2 + Н2О ~ Са (НСОз) и образовываться карбонатная пленка на известковых и бетонных сооружениях.
Следовательно, та концентрация свободной углекислоты, в которой последняя должна присутствовать в растворе, чтобы обусловить устойчивость гидрокарбонат-иона, называется равновесной углекислотой.
Именно соотношение форм углекислотного (карбонатного) равновесия определяет в большинстве случаев в природных водах значение рН [1].(Таблица 2).
Таким образом, имеем, что карбонат-ионы определяют щелочные свойства воды, а свободная углекислота – кислотные. И, как следует из таблицы, для поддержания, к примеру, нейтральной среды при рН=7 (на очистных сооружениях, в частности на горизонтальных
Таблица 2 – Зависимость содержания отдельных форм СО2 от рН (при температуре 25°С)
Форма Содержание отдельных форм СО2 , %
Свободная 99,5 95,4 67,7 17,з 2,0 1,0 0,2 – –
Гидрокарбонатная 0,5 4,6 з2,з 82,7 97,4 97,8 94,1 62,5 14,з
карбонатная – – – – 0,6 1,2 5,7 з7,5 85,7
рН 4 5 6 7 8 8,з 9 10 11
отстойниках, для наилучшего осаждения взвесей), необходимо наличие гидрокарбонатных форм в количестве 82,7 % от общего суммарного содержания всех трех форм СО2. • (2)
„ 1 \н +\-\нсо-\ ,
рК—- 1ёЧСОг+18Г
где у – поправочный коэффициент, учитывающий активность ионов. рК= 6,317 – 0,08 ц, а ц-ионная сила.
В уравнении (2) трудно определять концентрацию гидрокарбонат-ионов (НСОз ). С достаточной для применения уравнения (2) точностью суммарную концентрацию ионов НСОз можно считать равной концентрации внесенного в раствор бикарбоната натрия №НСОз, если последняя превышает концентрацию водородных ионов хотя бы в 10 раз. Обычно в раствор вносят бикарбонат натрия (№НСОз) в определенном количестве, который диссоциирует с образованием ионов НСОз .
При выводе уравнения (2) не учитывалась вторая ступень диссоциации:
НСОз Н+ + СОз 2″ то есть бикарбонатные ионы переходят в карбонатные.
[СОз ] — о рН – рк
Зависимость |нСО ] _ К показывает, что чем выше рН раствора, тем большее ко-
личество бикарбонатных ионов переходит в карбонатные (см. таблицу 2).
В целом можно считать, что при рН=6-8 практически весь внесенный в раствор бикарбонат натрия будет находиться в виде ионов НСОз , если концентрация №НСОз в растворе не ниже 1 • 10-4 – Ы0″5М.
Таким образом, в интервале рН=6-8 при условии, что концентрация бикарбоната на-
где [№НСОз ] – концентрация бикарбоната натрия, моль\л, А- коэффициент растворимости СО2 моль\л, р СО2 – содержание СО2 в газовой фазе,%. Уравнение (3) позволяет определить содержание СО2 в газовой фазе, необходимое для обеспечения требуемых значений рН и наоборот, можно рассчитать концентрация бикарбоната натрия, необходимую для обеспечения требуемого рН при заданном составе газовой фазы:
нужно, чтобы содержание СО2 в газовой фазе при t=37°С и атмосферном давлении 740 мм рт. нужно содержание СО2 в газовой фазе сделать постоянным.
Значение рН снижается с увеличением численности клеток. Размножаясь, клетки выделяют продукты метаболизма, часть из которых относятся к слабым кислотам. №НСОз вступает в реакцию с ними, образуя натриевую соль, а также воду и диоксид углерода. Таким образом, уменьшение концентрации бикарбоната натрия прямо связано с выделением кислых продуктов метаболизма, поэтому процесс нейтрализации №НСОз можно формально отождествить с его потреблением.
При лизисе погибших клеток выделяются, в том числе, и вещества щелочной природы. Можно предположить, что выделение щелочных веществ при лизисе клеток эквивалентно количеству бикарбоната натрия, которое нейтрализуется при образовании одной клетки, тогда уравнение ассимиляции принимает вид:
Со,С – начальная и текущая концентрация исследуемого вещества, моль\л.
Скорость выделения СО2 в процессе размножения клеток описывается уравнением ассимиляции:
трия в раствор не нижеЫО”4 – 1-10″5 М, уравнение (2) можно использовать в виде:
(3),
С= Со – \&\ (х-х0),
где & — коэффициент метаболизма,
У2 = \ асо 2 \ Р1(Мо – х)х , где асо 2 – коэффициент метаболизма, характеризующий суммарное количество СО2, выделяемое при образовании одной клетки как за счет процессов метаболизма, так и в результате сопутствующей росту популяции NaHСOз с кислыми продуктами обмена.
Скорость десорбции СО2 описывается общим уравнением газового массообмена:
VI = К’ (С*со2 – Сс02), 1
где К’ – объемный коэффициент массопередачи СО2, час ,
С*сО2 и ССО2 – равновесная и текущая концентрация углекислого газа. \ oco 2 \ Рт , ч-
Cco 2 = C * co 2 +-2, 11 (М 0 – х) х
Это уравнение описывает изменение концентрации растворенного СО2 при С*со2= const, К’ = const. Увеличиваясь с ростом Х, СО2 достигает максимума при Х= Мо\2.Однако, концентрацию растворенного СО2 непосредственно измерить сложно, но её можно рассчитать по уравнению (2), если известна концентрация бикарбоната натрия и рН:
рН-рК
Ссо2 = CNa+ • 10 .
Если С*со2= const, К’ = const, то постоянство рН можно обеспечить дополнительным вводом в среду бикарбоната натрия по мере его нейтрализации кислыми продуктами обмена.
Однако концентрация NaHCO3 при культивировании убывает линейно с ростом численности популяции. Поэтому обеспечить постоянство CNa+ \ Ссо2 можно лишь уменьшением также по линейному закону концентрации растворенного СО2. 1 + K j 10 рН – рК
К max / k 4
C 0 Na + – Na + \ ‘( M 0 1 + R ~ x 0
если М0 = 3 •Ю9 кл\л;Х0 = 0,3 • 109 кл\л;СоNa+ = 2,6 • 10-2 моль\л; \ d Na+\= 0,8740пмоль\кл,
, 22 моль • л К _ 0 8
\ d со2\ Р1= 13,6 • 10- ; 1 + к ~ ‘ , то для поддержания рН=7 требуется изменение
1 1
коэффициента массопередачиСО2 от 0,2 до 0,9 .
час час
Величина объемного коэффициента массопередачи при одних и тех же характеристиках питательной среды микробов в условиях поверхностного способа аэрации зависит от объема и конструкции отстойника, а так же от интенсивности перемешивания.-рК-2,44–(М ~х)х
К
Чтобы избежать снижения рН, нужно уменьшить рСО2, а чтобы добиться этого, нужно увеличить коэффициент массопередачи (8) посредством интенсификации перемешивания.
Таким образом, используя взаимосвязь между концентрацией растворенного СО2, концентрацией гидрокарбонатного иона и величиной рН, и зная наиболее оптимальное его значение для осаждения определенного состава взвешенных веществ, можно влиять на производительность горизонтальных отстойников.
СПИСОК ЛИТЕРАТУРЫ
1. Никаноров, А.М. Гидрохимия. – Л.: Гидрометеоиздат,1989. – 347 с.
2. Фомичева, Г.И. Разработка и исследование системы совместного отведения ливневых и дренажных сточных вод с урбанизированных территорий (на примере г. Пензы). Автореферат. – Пенза, 2003 г.
3. Латыпова, В.З. Факторы формирования кислотно-основных свойств природной среды. Соровский образовательный журнал, том 6. – 2000. – №7.
4. Ввозная, Н.Ф. Химия воды и микробиология. – М.: «Высшая школа», 1979. – 341 с.
REGULATION OF WATER рН, CLEANING AT HORIZONTAL SETTLES WITH
HELP OF CARBON DIOXIDE
O.N. DYOMINA The Bryansk state agricultural academy
SUMMARY
In given article results of research aimed on increasing productivity of horizontal settles ising for water cleaning. Such result are achieved on the basis of interaction between concentration of dissolved carbon dioxide, concentration of hydrocarbon ion and value of рН maximally optimal for precipitation of definite composition of fluidized substances.
Баланс кислорода и углекислого газа в атмосфере Земли
Глава
- 6 Цитаты
- 122 Загрузки
Abstract
Нехватка благородных газов на Земле по сравнению с их космическим изобилием является убедительным доказательством того, что Земля образовалась без атмосферы и что атмосфера образовалась в результате выделения газов из недр Земли.Эти газы состояли в основном из углекислого газа и водяного пара и не содержали свободного кислорода. Водяной пар в основном образовал океаны, а углекислый газ в основном перешел в карбонатные породы, а второстепенный компонент, азот, остается основным компонентом атмосферы. Кислород выделяется в основном в результате фотосинтеза, который включает потребление углекислого газа. В большинстве случаев фотосинтез не вносит постоянного вклада в атмосферный кислород, потому что продукты фотосинтеза подвергаются распаду и окислению, потребляя столько кислорода, сколько было произведено при их производстве.Небольшая часть (около 10 -4 ) продуктов фотосинтеза ускользает от распада и обеспечивает длительный вклад в кислород воздуха. Это естественное преобразование углекислого газа из недр земли в кислород сегодня полностью подавляется, примерно в 10 3 раз, сжиганием ископаемого топлива, и поэтому содержание углекислого газа в атмосфере увеличивается относительно быстрыми темпами. Хотя подробные исследования отсутствуют, существует вероятность того, что это может повлиять на мировой климат.Риск серьезного возмущения кажется небольшим, но проблема плохо изучена, и уровень достоверности такого прогноза низок.
Ключевые слова
Двуокись углерода Атмосферный кислород Углекислый газ в атмосфере Оксид железа Содержание двуокиси углеродаЭти ключевые слова были добавлены машиной, а не авторами. Это экспериментальный процесс, и ключевые слова могут обновляться по мере улучшения алгоритма обучения.
Это исследование было поддержано Национальным управлением по аэронавтике и исследованию космического пространства в рамках гранта NGL 44-004-001.
Это предварительный просмотр содержимого подписки,
войдите в, чтобы проверить доступ.
Предварительный просмотр
Невозможно отобразить предварительный просмотр. Скачать превью PDF.
Ссылки
Беркнер, Л.В. и Маршалл, LC: 1964, История концентрации кислорода в атмосфере Земли », Обсуждения Общества Фарадея, № 37.
Google ScholarCloud, PE: 1968, «Атмосферная и гидросферная эволюция на примитивной Земле», Science 160, 729–736.
CrossRefGoogle ScholarDietrich, G .: 1963, General Oceanography, Interscience-Wiley, New York.
Google ScholarДонахью, Т. М .: 1966, Проблема атомарного водорода », Ann. Geophys. 22, 175–188.
Google ScholarДональд К. М .: 1960, «Влияние дешевого азота», J. Aust. Inst. Agric. Sci. 26, 319–338.
Google ScholarХатчинсон, Г. Э .: 1954, Биогеохимия земной атмосферы », в книге« Земля как планета »(изд.Дж. П. Койпер), University of Chicago Press, Чикаго, стр. 371–433.
Google ScholarЛейт, Х .: 1963, Роль растительности в содержании двуокиси углерода в атмосфере, J. Geophys. Res. 68, 3887–3898.
Google ScholarМанабе С. и Стриклер Р. Ф .: 1964, «Тепловое равновесие атмосферы с конвективной регулировкой», J. Atmos. Sci. 21, 361–385.
CrossRefGoogle ScholarНациональная академия наук, Отчет об энергетических ресурсах 1000-D, 1962.
Google ScholarПалес, Дж. К. и Килинг, К. Д.: 1965, «Концентрация атмосферного углекислого газа на Гавайях», J. Geophys. Res. 70, 6053–6076.
CrossRefGoogle ScholarПолдерваарт, А .: 1955, «Химия земной коры», Кора Земли, Специальная статья GSA № 62, 119–144.
Google ScholarРизбро, Р. У., Хаггетт, Р. Дж., Гриффин, Дж. Дж. И Голдберг, Э. Д .: 1968, «Пестициды: трансатлантические движения в северо-восточной торговле», Science 159 (3820), 1233–1235.
CrossRefGoogle ScholarRubey, W.W .: 1951, «Геологическая история морской воды», Bull. Геол. Soc. Являюсь. 62, 1111–1148.
CrossRefGoogle ScholarRyther, J. H .: 1963, «Биологическая океанография, географические вариации продуктивности», in The Sea, Vol. 2 (под ред. М. Н. Хилла), Interscience, Нью-Йорк, стр. 347–380.
Google ScholarСингер С.Ф .: 1968, «Происхождение Луны и геофизические последствия», Geophys. Дж. Рой. Astron. Soc. 15, 205–226.
CrossRefGoogle ScholarStrickland, JDH: 1965, «Производство органического вещества на первичных стадиях морской пищевой цепи», в химической океанографии (под редакцией JP Riley и G. Skirrow), Academic Press, стр. 477– 712.
Google ScholarВикман, Ф. Э .: 1954, «Общее» количество отложений и состав «средней магматической породы», Geochim. Космохим. Acta 5, 97–110.
CrossRefGoogle ScholarWurster, C.F. и Wingate, D.Б .: 1968, «Остатки ДДТ и снижение воспроизводства у бермудских буревестников», Science 159 (3818), 979–981.
CrossRefGoogle Scholar
Для дальнейшего чтения
1.
О геохимических процессах, включая количественные оценки количества элементов в различных геологических режимах: Брайан Мейсон, Принципы геохимии, 2-е изд., John Wiley and Sons, New York, 1964.
Google Scholar2.
По множеству различных проблем в области атмосферной эволюции: P.Дж. Бранкацио и AGW Cameron (ред.), Происхождение и эволюция атмосферы и океанов, John Wiley and Sons, New York, 1964.
Google Scholar3.
О химических и жизненных процессах в океанах и особенно статьи Э. Стимана Нильсона и Дж. Х. Ритера о мировых темпах фотосинтеза: MN Hill (ed.), The Sea, Vol. II, Interscience, New York, 1963.
Google Scholar4.
Обзорная статья об эволюции планетных атмосфер: Фрэнсис С.Джонсон, «Происхождение планетных атмосфер», Space Science Reviews 9 (1969), 303–324.
Google Scholar
Информация об авторских правах
© D. Reidel Publishing Company, Дордрехт, Голландия 1970
Авторы и аффилированные лица
- 1. Юго-западный центр перспективных исследований, Даллас, США
Углеродный цикл и климат Земли
Углеродный цикл и Климат ЗемлиУглеродный цикл и климат Земли
Углекислый газ – компонент атмосферы, играющий несколько жизненно важные роли в окружающей среде.Это парниковый газ, который задерживает инфракрасное излучение тепла в атмосфере. Он играет решающую роль в выветривание горных пород. Это источник углерода для растений. это хранится в биомассе, органическом веществе в отложениях и в карбонате камни, похожие на известняк.
Углеродный цикл
Первичный источник углерода / CO2 выделение газов из недр Земли в срединно-океанических хребтах, горячих точках вулканы и вулканические дуги, связанные с субдукцией. Большая часть Выбросы CO2 в зонах субдукции рассчитываются от метаморфизма карбонатных пород, субдуцирующих с океаном корочка.Большая часть общего количества выделяемого CO2, особенно как срединно-океанические хребты и вулканы хот-пот, хранились в мантии, когда Земля сформировалась. Некоторая часть выделенного углерода остается в виде CO2 в атмосфере, некоторая часть растворяется в океаны, некоторое количество углерода содержится в биомассе в живых или мертвых и разлагающиеся организмы, а некоторые связаны в карбонатных породах. Углерод вывезен на длительное хранение путем захоронения осадочных толщ, особенно уголь и черные сланцы, которые накапливают органический углерод из неразложившаяся биомасса и карбонатные породы, такие как известняк (кальций карбонат).
Фотосинтез
Растения, фотосинтезирующие водоросли и бактерии используют энергию из солнечный свет для объединения углекислого газа (C02) из атмосфера с водой (h3O), чтобы сформировать углеводы. Эти углеводы хранят энергию. Кислород (O2) – это побочный продукт, который попадает в Атмосфера. Этот процесс известен как фотосинтез.
углекислый газ + вода + солнечный свет -> углеводы + кислородCO 2 + H 2 O + солнечный свет -> CH 2 O + О 2
Дыхание
Растения (а также фотосинтезирующие водоросли и бактерии) затем используют некоторые из накопленные углеводы как источник энергии для поддержания своей жизни функции.Часть углеводов остается в виде биомассы (основная часть завод и т. д.). Потребители, такие как животные, грибы и бактерии, получают свою энергию из этой избыточной биомассы в живых или мертвых и разлагающийся. Кислород из атмосферы сочетается с углеводами высвободить накопленную энергию. Вода и углекислый газ побочные продукты.
кислород + углевод -> энергия + вода + углеводO 2 + CH 2 O -> энергия + H 2 O + CO 2
Обратите внимание на то, что фотосинтез и дыхание противоположны друг другу.Фотосинтез удаляет CO2 из атмосферы и заменяет его на O2. Дыхание занимает O2 из атмосферы и заменяет его на СО2. Однако этих процессов нет в остаток средств. Не все органические вещества окисляются. Некоторые похоронены в осадочные породы. В результате за геологическое время произошло было введено больше кислорода в атмосферу и удален углекислый газ фотосинтезом, чем наоборот.
Выветривание
Углекислый газ и другие атмосферные газы растворяются на поверхности воды.Растворенные газы находятся в равновесии с газом в Атмосфера. Двуокись углерода реагирует с водой в растворе с образованием слабая кислота, угольная кислота. Угольная кислота диссоциирует на водород ионы и ионы бикарбоната. Ионы водорода и вода реагируют с наиболее распространенные минералы (силикаты и карбонаты), изменяющие минералы. Продуктами выветривания являются преимущественно глины (группа силикатных минералов) и растворимых ионов, таких как кальций, железо, натрий, и калий. Бикарбонат-ионы также остаются в растворе; остаток угольная кислота, которая использовалась для выветривания скал.
Карбонатные породы
1. Углекислый газ удаляется из атмосферы путем растворения в вода и образование угольной кислоты
CO 2 + H 2 O -> H 2 CO 3 (угольная кислота)2. Угольная кислота используется для выветривания горных пород с образованием бикарбоната. ионы, другие ионы и глины
H 2 CO 3 + H 2 O + силикат минералы -> HCO 3 – + катионы (Ca ++ , Fe ++ , Na + и др.) + глины3. Карбонат кальция осаждается из кальция и бикарбоната. ионы в морской воде морскими организмами, такими как кораллы
Ca ++ + 2HCO 3 – -> CaCO 3 + CO 2 + H 2 O- углерод теперь хранится на морском дне слоями известняк
Метаморфизм карбонатов
Часть этого углерода возвращается в атмосферу в результате метаморфизма. известняка на глубине в зонах субдукции или в орогенных поясах
CaCO 3 + SiO 2 -> CO 2 + CaSiO 3с последующим выделением газа вулканической дугой.
Парниковый эффект
Большая часть солнечной энергии, попадающей на поверхность Земли, находится в часть видимого света электромагнитного спектра. Это в во многом потому, что атмосфера Земли прозрачна для этих длины волн (все мы знаем, что при действующем озоновом слое более высокие частоты, такие как ультрафиолет, в основном не пропускаются). Часть солнечный свет отражается обратно в космос, в зависимости от альбедо или отражательная способность поверхности.Часть солнечного света превращается в инфракрасный (более низкая частота, чем видимый свет). В то время как доминирующий газы атмосферы (азот и кислород) прозрачны для инфракрасный, так называемые парниковые газы, в первую очередь водяной пар (h3O), диоксид углерода и метан (Ch5) поглощают инфракрасное излучение. Они собирать эту тепловую энергию и удерживать ее в атмосфере. В то время как мы беспокоиться о возможном глобальном потеплении из-за дополнительных CO2 мы выбрасываем в атмосферу путем сжигания ископаемое топливо, если в атмосфера глобальный климат будет значительно прохладнее.
Климатический буфер
Из-за роли CO2 в климате, обратная связь в углеродном цикле способствует поддержанию глобальной температуры в определенных пределах, чтобы климат никогда не становился слишком жарким или слишком жарким. холод, чтобы поддерживать жизнь на Земле. Процесс является масштабным примером принципа Лешателье. Этот химический принцип гласит, что если реакция в равновесии нарушается добавлением или удалением продукта или реагента, реакция будет регулироваться так, чтобы попытаться вернуть этот химический вид к его первоначальной концентрации.Для например, как угольная кислота удаляется из раствора выветриванием горных пород, реакция будет регулироваться за счет производства большего количества углекислоты. А также поскольку растворенный CO2 находится в равновесии с атмосферный CO2, более CO2 удаляется из атмосферы для замены который удален из раствора выветриванием.
некоторые примеры:
Если концентрация CO2 увеличивается в атмосферы из-за повышенной скорости дегазации, глобальный температура повысится. Повышение температуры и растворение CO2 приведет к усилению выветривания земной коры в результате более высоких скоростей реакции (температура эффект) и большей кислотности.Усиленное выветривание израсходует избыток CO2, тем самым охлаждая климат.
Если глобальная температура снизится в результате каких-либо астрономических форсирование или эффект тектонической / океанской циркуляции, более низкие температуры приведет к снижению скорости химического выветривания. Уменьшено выветривание означает, что из атмосферой в результате реакций выветривания, оставляя больше CO2 в атмосфере увеличится температуры.
Если больше горных пород станет доступным для быстрого выветривания в результате горное поднятие усиленное выветривание приведет к понижению атмосферного CO2 и снижение глобальной температуры.Но пониженные температуры замедляют скорость реакции, тем самым используя меньше CO2, что позволяет снизить температуру.
Двуокись углерода в океане и атмосфере
Двуокись углерода (CO 2 ) считается следовым газом в атмосфере, потому что он намного меньше больше, чем кислород или азот. Однако этот следовой газ играет жизненно важную роль. роль в поддержании жизни на Земле и в управлении земными климат, удерживая тепло в атмосфере.
Океаны играют важную роль в регулировании количества CO. 2 в атмосфере, потому что CO 2 может быстро перемещаться в океан и выходить из него. Попав в океаны, CO 2 больше не задерживает тепло. CO 2 также быстро перемещается между атмосферой и наземной биосферой (материал, который находится или жил на суше).
Из трех мест, где хранится углерод – атмосферы, океанов и наземная биосфера – примерно 93% CO 2 водится в океанах. Атмосфера, содержащая около 750 петаграмм углерода (петаграмма [Pg] – 10 15 граммов), имеет наименьшее количество углерода.
Баланс уровней углекислого газа
Приблизительно от 90 до 100 пг углерода перемещается вперед и назад между атмосфера и океаны, а также между атмосферой и сушей биосфера.Хотя эти обменные курсы велики по сравнению с общим количество углерода, хранящегося в атмосфере, концентрация CO 2 был постоянным
Морские растения и животные играют роль в поглощении и высвобождении углекислый газ в океане. Растения, в первую очередь фитопланктон, но также макрофиты, такие как эти водоросли, поглощают углекислый газ и выделяют кислород, необходимый кислородзависимым животным для выживания.
при 280 частях на миллион (ppm) по объему не менее 1000 лет назад в индустриальную эпоху. Атмосферные концентрации CO 2 были постоянными, потому что углерод, удаляемый из атмосферы в в некоторых местах точно соответствует CO 2 добавляется к атмосфере в других местах.Сегодня CO 2 концентрации в атмосфере увеличиваются как прямой результат деятельность человека, такая как вырубка лесов и сжигание ископаемого топлива (е.г., уголь и нефть). За последние 150 лет CO 2 концентрация в атмосфере увеличилась на целых 30 процентов (от 280 до 370 промилле).
Все деревья, почти все растения из холодного климата и большинство сельскохозяйственных посевы реагируют на увеличение атмосферного CO 2 уровни за счет увеличения количества CO 2 они принимают участие в фотосинтезе.Считается, что повышенная поглощение наземными растениями из-за повышения содержания CO в атмосфере 2 уровни примерно уравновешивают CO 2 освобождены от вырубки влажных тропических лесов и других сельскохозяйственных практики в десятилетие 1980-х гг. В 1990-е гг. Биосфера суши по оценкам, поглощает примерно на 1 пг больше CO 2 чем он выпускается каждый год.
Большая часть СО 2 освобожден от сжигания ископаемого топлива и другой деятельности человека (например, производство цемента) хранится либо в атмосфере, либо в океаны. Сотрудничество 2 остающийся в атмосфере действует как парниковый газ, поглощая длинноволновое излучение (тепло) в атмосфере. CO 2 поглощение океанов не влияет на тепловой баланс Земли, Итак, понимание обмена CO между воздухом и морем 2 является неотъемлемой частью понимание климатической системы Земли и потенциала влияние будущего CO 2 выбросы.
Регулирование выбросов углекислого газа.
Потенциал антропогенного (антропогенного) CO 2 отрицательно повлиять на климат Земли привело к попыткам на международном уровне для регулирования глобального CO 2 выбросы. Киотский протокол, например, был разработан для сокращения глобальный CO 2 выбросы на 5 процентов ниже уровня 1990 года.По состоянию на конец 2002 г. не были ратифицированы, и глобальные выбросы продолжали расти. Глобальные выбросы в 2001 году были примерно на 11 процентов выше, чем в 1990 году. уровни.
Природный углеродный цикл океана
Океаны содержат примерно в 50 раз больше CO. 2 чем атмосфера и в 19 раз больше, чем биосфера суши. CO 2 перемещается между атмосферой и океаном путем молекулярной диффузии, когда есть разница между CO 2 давление газа (pCO 2 ) между атмосферой и океанами.Например, когда атмосферный pCO 2 выше поверхности океана, CO 2 распространяется через границу между воздухом и морем в морскую воду.
Океаны способны удерживать гораздо больше углерода, чем атмосфера, потому что большая часть СО 2 который диффундирует в океаны, вступает в реакцию с водой с образованием углекислого газа. кислота и продукты ее диссоциации, бикарбонат- и карбонат-ионы.В конверсия CO 2 газ в негазообразные формы, такие как угольная кислота и бикарбонат, и карбонат-ионы эффективно снижают CO 2 давление газа в воде, тем самым обеспечивая большую диффузию из Атмосфера.
Океаны перемешиваются намного медленнее, чем атмосфера, поэтому есть большие горизонтальные и вертикальные изменения CO 2 концентрация.Как правило, тропические воды выделяют CO 2 в атмосферу, тогда как океаны высоких широт поглощают CO 2 из атмосферы. CO 2 также примерно на 10 процентов выше в глубоком океане, чем на поверхности. Два основных механизма, контролирующих распределение углерода в океаны называют насосом растворимости и биологическим насосом.
Насос растворимости.
Насос растворимости зависит от двух основных факторов. Во-первых, более чем вдвое больше CO 2 может растворяться в холодных полярных водах, чем в теплых экваториальных водах. Поскольку основные океанские течения (например, Гольфстрим) перемещают воду из тропиков к полюсам, они охлаждаются и могут поглощать больше CO 2 из атмосферы.Во-вторых, высокоширотные зоны тоже являются местами. где образуются глубокие воды. По мере охлаждения воды они становятся плотнее и погружаются в глубины океана, унося с собой CO 2 накапливается на поверхности.
Биологический насос.
Другой процесс, который перемещает CO 2 вдали от поверхности океана называется биологическим насосом.Рост морские растения (например, фитопланктон) поглощают CO 2 и другие химические вещества из морской воды для изготовления тканей растений. Микроскопический морские животные, называемые зоопланктоном, питаются фитопланктоном и обеспечивают основа пищевой сети для всего животного мира в море. Так как для фотосинтеза нужен свет, фитопланктон растет только в вблизи поверхности океана, куда может проникать достаточное количество света.
Хотя большая часть CO 2 поглощенный фитопланктоном, повторно используется у поверхности, что является значительным фракция, возможно, 30 процентов, опускается в более глубокие воды, прежде чем быть конвертируется обратно в CO 2 морскими бактериями.Только около 0,1 процента достигает дна, чтобы быть похоронен в отложениях.
Ученые исследуют обмен углекислого газа между атмосфера и океан. Эта фотография показывает Рональд Х. Браун, исследовательское судно Национального управления океанических и атмосферных исследований. Администрация в Экваториальной части Тихого океана во время GASEX II экспедиция 2001 г. Плавучий инструмент на переднем плане. измеряет ряд параметров, связанных с переносом СО 2 через границу раздела воздух – море.
Сотрудничество 2 который повторно используется на глубине, медленно переносится течениями на большие расстояния в районы возврата воды на поверхность (районы апвеллинга). Когда вода восстанавливает контакт с атмосферой, CO 2 Первоначально поглощенный фитопланктоном, возвращается в атмосферу. Этот процесс обмена помогает контролировать атмосферный CO. 2 концентрации в десятилетних и более длительных временных масштабах.
Антропогенный CO
2 ПоглощениеПостоянный атмосферный CO 2 концентрации в веках до промышленной революции предполагают, что океаны выпустили небольшое количество CO 2 в атмосферу, чтобы сбалансировать выброс углерода из рек. Сегодня это тенденция обратная, и океаны должны удалить CO 2 добавлен в атмосферу в результате деятельности человека, известный как антропогенный (человеческий) CO 2 .
В 1980-х годах океаны удалили примерно 2,0 ± 0,6 пг антропогенный CO 2 каждый год. Поскольку люди производят CO 2 со все возрастающей скоростью средняя скорость удаления океана увеличилась до 2,4 ± 0,5 пг углерода каждый год в 1990-е годы.
Поглощение антропогенного CO 2 океанов обусловлено разницей в давлении газа в в атмосфере и в океанах и по воздуху и морю скорость.Поскольку pCO 2 увеличивается в атмосфере, CO 2 движется в океан, пытаясь уравновесить океаническое и атмосферное давление газа.
Механизмы, регулирующие скорость, с которой СО 2 газ может перемещаться из атмосферы в океаны (перенос воздух-море скорость) сегодня не очень хорошо изучены.Последние технологические достижения помогают ученым лучше понять эти механизмы.
Скорость передачи связана с шероховатостью поверхности океана. и скорость ветра. Разница в pCO 2 относится к количеству углерода, который превращается из CO 2 газа к другим негазообразным формам углерода в морской воде, например бикарбонат- и карбонат-ионы.Этот так называемый «буфер» «емкость» – это то, что позволяет океанам удерживать столько углерода.
Относительные концентрации CO 2 (1%), бикарбонат-ион (91%) и карбонат-ион (8%) регулируют кислотность (pH) океанов. Поскольку CO 2 кислый газ, поглощение антропогенного CO 2 использует ионы карбоната и снижает pH океана.Карбонат-ион концентрация поверхностных морских вод снизится примерно на 30 процентов с удвоением атмосферного CO 2 от доиндустриальных уровней (от 280 до 560 промилле). Как карбонат-ион концентрация уменьшается, буферная емкость океана и его способность принимать CO 2 из атмосферы снижается.
В долгосрочной перспективе (в тысячелетних масштабах) у океана есть потенциал поглощать примерно 85 процентов антропогенного CO 2 что выбрасывается в атмосферу.Пока атмосферный CO 2 концентрация продолжает расти, океаны будут продолжать поглощать CO 2 . Однако эта реакция обратима. Если атмосферный CO 2 будут уменьшаться в будущем, океаны начнут выпускать накопленный антропогенный CO 2 обратно в атмосферу.
Лучшее место хранения антропогенного CO 2 должны быть реакции, которые связывают CO 2 способом, который нелегко изменить. Растворение кальция карбонат в океанах, например, является местом длительного хранения CO 2 . Поскольку океаны продолжают поглощать антропогенный CO 2 , он будет глубже проникать в толщу воды, понижая pH и делает воду более агрессивной по отношению к карбонату кальция.Проблема в что растворение карбонатов обычно происходит в глубоком океане, ну удален из антропогенного СО 2 попадает в поверхностные воды. В частях Северной Атлантики и Однако в северной части Тихого океана антропогенный CO 2 возможно, уже проникли достаточно глубоко, чтобы повлиять на растворение карбонат кальция в толще воды.
Захоронение отложений.
Захоронение растительных и животных материалов в отложениях также может обеспечить длительное хранение антропогенного CO 2 . Интересно, что почти нет фитопланктона, который растет быстрее в более высоких CO 2 окружающей среды, в отличие от многих наземных растений. Это потому, что фитопланктон рост в океанах обычно ограничивается доступностью света и химикаты кроме CO 2 , в основном азот и фосфор, но также в меньших количествах железо, цинк и другие микроэлементы.
Один из предлагаемых подходов к увеличению удаления углерода из атмосферы заключается в увеличении роста фитопланктона путем удобрения определенных регионов океан с относительно недорогим биологически ограничивающим химическим веществом как железо. Гипотеза заключается в том, что в результате цветения океанических растений удалит CO 2 из атмосферы переносят этот углерод в глубокий океан или отложения, эффективно удалив его из краткосрочного бюджета.В эффективность «железной гипотезы» проверяется с несколькими исследовательскими усилиями, пытающимися увеличить удобрение железом эксперименты.
Другой углерод секвестрация подходы, в том числе прямой впрыск сжиженного CO 2 в глубокий океан, также исследуются. Дальнейшие исследования необходимо определить, будет ли какой-либо из этих методов эффективен или экономически целесообразно.Реализация этих подходов может зависеть от: в значительной степени, по политическим решениям, принятым на национальном и международном уровни.
Библиография
Брокер, Уоллес С. и Цунг-Хунг Пэн. Трассеры в море. Палисадес, Нью-Йорк: Eldigio Press, 1982.
Фальковски, Пол Г., Ричард Т. Барбер и Виктор Сметачек. “Биогеохимический контроль и обратная связь по первичному Производство.” Наука 281 (1998): 200–206.
Прентис, И. Колин и др. «Углеродный цикл и атмосферный Двуокись углерода. “В Изменение климата: научная основа – вклад работы Группа I Третьего оценочного доклада Межправительственной группы экспертов по изменению климата , ред. Джон Т. Хоутон и др. др., Кембридж, Великобритания: Кембриджский университет Press, (2001): 183–237.
КИОТСКИЙ ПРОТОКОЛВ 1997 году в Киото, Япония, состоялась встреча Организации Объединенных Наций, на которой юридически обязывающие обязательства по сокращению будущих выбросов CO 2 и другие парниковые газы. Цель заключалась в том, чтобы каждая страна-член обязуются сократить выбросы до 5 процентов ниже уровня 1990 г. период 2008–2012 гг. Сроки 2008–2012 гг. Были установлены на соблюдение требований, чтобы страны-члены могли перейти на эффективные низкоэмиссионные углеродные технологии.Киотских протоколов не будет. имеют обязательную силу в течение 3 месяцев после их ратификации не менее 55 страны-участницы, в том числе достаточное количество развитых стран таким образом, чтобы составлять 55 процентов глобальных выбросов 1990 года.
Набор данных по обмену CO2 между океаном и атмосферой | Наука в сфере
Описание
Когда углекислый газ CO 2 выбрасывается в атмосферу в результате сжигания ископаемого топлива, примерно 50% остается в атмосфере, в то время как 25% поглощается наземными растениями и деревьями, а остальные 25% поглощаются определенными участками океан.В других частях океана, где концентрация CO 2 выше в воде, чем в атмосфере выше, CO 2 выбрасывается в атмосферу.
Этот перенос CO 2 из океана в атмосферу называется положительным «потоком», в то время как отрицательный поток означает, что океан поглощает CO 2 . Океан имеет сложную структуру как положительных, так и отрицательных потоков. До промышленной революции и сжигания ископаемого топлива чистый глобальный поток океана был слегка положительным, чтобы компенсировать поглощение CO 2 наземными растениями.Сегодня люди изменили эту тенденцию, поэтому океаны поглощают больше CO 2 , чем выделяют, хотя сложная структура положительных и отрицательных потоков все еще существует.
Районы апвеллинга (экваториальная часть Тихого океана и западное побережье Южной Америки) являются естественными источниками CO 2 , где старая вода с высокими концентрациями CO 2 выносится на поверхность, а избыток CO 2 составляет дегазирован в атмосферу. Более холодные регионы способны поглощать больше CO 2 , чем теплые регионы, поэтому полярные регионы, как правило, являются стоками CO 2 (см. Северная Атлантика и Арктика).По мере того, как CO 2 в атмосфере увеличивается в результате сжигания ископаемого топлива, все больше регионов океана поглощают CO 2 из атмосферы, а регионы источников и поглотителей в глобальном океане больше не находятся в равновесии. К 2100 году большая часть мирового океана, как ожидается, станет стоком CO 2 из атмосферы. Когда этот CO 2 растворяется в океане, он изменяет химический состав океана и снижает pH воды.
Моделирование модели основано на выбросах в атмосферу, основанных на записях уровней углекислого газа в атмосфере за прошлые даты и CMIP5 IPCC RCP 8.5 для будущих дат (приблизительно 950 ppm атмосферного CO 2 к 2100 году). Этот набор данных начинается с 1861 года и продолжается до 2100 года.
Примечательные особенности
- Когда углекислый газ CO 2 выбрасывается в атмосферу в результате сжигания ископаемого топлива, примерно 50% остается в атмосфере, 25% поглощается наземными растениями и деревьями, а остальные 25% поглощаются определенными территориями. океана.
- Более холодные регионы способны поглощать больше CO 2 , чем теплые регионы, поэтому полярные регионы, как правило, являются стоками CO 2 (см. Северная Атлантика и Арктика)
- Ожидается, что к 2100 году большая часть мирового океана будет поглощать CO 2 из атмосферы.
Связанные наборы данных
Ваш браузер не поддерживает элемент HTML5У вас есть 0 наборов данных в вашем.
парниковых газов | Отчет EPA об окружающей среде (ROE)
Каковы тенденции выбросов и концентраций парниковых газов и их влияние на здоровье человека и окружающую среду?
Важность парниковых газов
Парниковые газы, такие как углекислый газ, метан, закись азота и некоторые синтетические химические вещества, улавливают часть исходящей энергии Земли, таким образом удерживая тепло в атмосфере.Это удержание тепла вызывает изменения в радиационном балансе Земли – балансе между энергией, полученной от Солнца и излучаемой Землей, – которые изменяют климат и погодные условия в глобальном и региональном масштабах.
Многочисленные доказательства подтверждают, что деятельность человека является основной причиной глобального потепления последних 50 лет. 1 Природные факторы, такие как колебания солнечной энергии, вулканическая активность, орбита Земли, углеродный цикл и другие, также влияют на радиационный баланс Земли.Однако, начиная с конца 1700-х годов, чистым глобальным эффектом деятельности человека было постоянное увеличение концентрации парниковых газов.
Это изменение концентраций вызывает потепление и влияет на различные аспекты климата, включая температуру приземного воздуха и океана, осадки и уровень моря. Здоровье человека, сельское хозяйство, водные ресурсы, леса, дикая природа и прибрежные районы уязвимы для изменения климата.
Многие парниковые газы чрезвычайно долгоживущи в атмосфере, а некоторые остаются в воздухе от десятков до сотен лет после выброса.Эти долгоживущие парниковые газы глобально смешиваются с атмосферой, и их концентрации отражают прошлый и недавний вклад источников выбросов во всем мире. Другие, такие как тропосферный озон, имеют относительно короткое время жизни в атмосфере.
Начало страницы
Другие факторы, влияющие на изменение климата
Помимо парниковых газов, другие связанные факторы, включая другие радиационно важные вещества и альбедо, могут изменить климат Земли.
- Другие радиационно важные вещества: Некоторые вещества технически не являются парниковыми газами из-за своего физического состояния, но они, тем не менее, влияют на энергетический баланс Земли. Некоторые из них, например сульфатные аэрозоли, обладают отрицательным радиационным воздействием, которое может привести к охлаждающим эффектам. Другие, такие как сажа или сажа, способствуют потеплению.
- Альбедо: Альбедо – это количество солнечной радиации, отраженной от объекта или поверхности, в данном случае от поверхности Земли.Природные и человеческие факторы могут влиять на альбедо в глобальном масштабе (через изменения в крупномасштабных объектах, таких как полярные ледяные щиты) или в локальном или региональном масштабе (например, из-за увеличения количества темных мощеных поверхностей, поглощающих энергию, по сравнению со световыми мощеными поверхностями, отражают энергию).
Хотя этот вопрос ROE не касается радиационно важных веществ или альбедо, оба фактора важны для понимания энергетического баланса планеты и того, каким образом деятельность человека может повлиять на этот баланс. 2
Начало страницы
Парниковые газы и их источники
Некоторые парниковые газы выбрасываются исключительно в результате деятельности человека (например, синтетические галоидоуглероды). Другие возникают естественным путем, но их уровень повышен из-за воздействия человека (например, углекислый газ). Антропогенные источники являются результатом деятельности, связанной с энергетикой (например, сжигание ископаемого топлива в электроэнергетическом и транспортном секторах), сельского хозяйства, изменений в землепользовании, деятельности по управлению отходами и их очистке, а также различных промышленных процессов.Основные парниковые газы включают двуокись углерода, метан, закись азота и различные синтетические химические вещества.
- Двуокись углерода широко считается наиболее важным антропогенным парниковым газом, поскольку в настоящее время на нее приходится наибольшая часть потепления, связанного с деятельностью человека. Двуокись углерода возникает естественным образом как часть глобального углеродного цикла, но деятельность человека увеличила атмосферную нагрузку из-за сжигания ископаемого топлива и других источников выбросов.Естественные поглотители, удаляющие углекислый газ из атмосферы (например, океаны, растения), помогают регулировать концентрации углекислого газа, но деятельность человека может нарушать эти процессы (например, вырубка лесов) или усиливать их.
- Метан поступает из многих источников, включая деятельность человека, такую как добыча угля, производство и распределение природного газа, разложение отходов на свалках и процессы пищеварения в животноводстве и сельском хозяйстве. Природные источники метана включают водно-болотные угодья и термитники.
- Закись азота выделяется в результате сельскохозяйственной и промышленной деятельности, а также при сжигании твердых отходов и ископаемого топлива.
- Различные синтетические химические вещества , такие как гидрофторуглероды, перфторуглероды, гексафторид серы и другие синтетические газы, выделяются в результате коммерческого, промышленного или бытового использования.
- Известно, что многие другие газы улавливают тепло в атмосфере. Примеры включают водяной пар, который возникает естественным образом как часть глобального круговорота воды, и озон, который естественным образом встречается в стратосфере и находится в тропосфере в основном благодаря деятельности человека.
Каждый парниковый газ имеет разную способность поглощать тепло в атмосфере из-за различий в количестве и типе энергии, которую он поглощает, а также разном «времени жизни» или времени, в течение которого он остается в атмосфере.
Например, потребуются тысячи молекул углекислого газа, чтобы сравняться с согревающим эффектом одной молекулы гексафторида серы – самого мощного парникового газа – с точки зрения способности поглощать тепло, по оценке Межправительственной группы экспертов по изменению климата ( МГЭИК). 3 Чтобы облегчить сравнение газов, которые имеют существенно разные свойства, МГЭИК разработала набор показателей, называемых «потенциалами глобального потепления».
Начало страницы
Воздействие изменения климата
Изменение климата по-разному влияет на общество и экосистемы. Например:
- Ожидается, что более теплый климат повысит риск заболеваний и смертей, связанных с жарой, и увеличит некоторые виды загрязнения воздуха.
- В более теплом климате ожидаются более суровые периоды жары, наводнения и засухи. Это может снизить урожайность.
- Повышение уровня моря может привести к эрозии и затоплению прибрежных экосистем и уничтожению водно-болотных угодий.
- Изменение климата может изменить место обитания видов и способы их взаимодействия, что может коренным образом изменить существующие экосистемы.
Эти и другие аспекты изменения климата разрушают жизнь людей и наносят ущерб некоторым секторам экономики США. 4 Это побудило многие правительства штатов и местные органы власти подготовиться к этим воздействиям посредством «адаптации» (т. Е. Планирования изменений, которые, как ожидается, произойдут).
Начало страницы
Показатели ROE
ROE представляет шесть индикаторов, показывающих тенденции выбросов парниковых газов и связанных с ними воздействий на окружающую среду: выбросы парниковых газов, концентрации парниковых газов, использование энергии, температура и осадки, уровень моря и температура поверхности моря.
- Выбросы. Для нескольких парниковых газов оценочные совокупные выбросы в стране, которые напрямую связаны с деятельностью человека, увеличились на 7 процентов в период с 1990 по 2014 год. Сжигание ископаемого топлива является основным источником антропогенных выбросов парниковых газов в стране.
- Концентрации. Данные об атмосферных концентрациях парниковых газов имеют исключительно длительные исторические записи, причем данные по некоторым газам охватывают несколько сотен тысяч лет.Для углекислого газа, метана и закиси азота исторический контекст, представленный ледяными кернами, показывает, что нынешние концентрации в атмосфере беспрецедентны за последние 800 000 лет и демонстрируют, что недавнее повышение уровней отражает влияние деятельности человека.
- Удары. Показатели представляют собой убедительное свидетельство того, что многие фундаментальные показатели климата в Соединенных Штатах меняются. Средние температуры в 48 смежных штатах повысились с 1901 года, при этом темпы потепления увеличились с конца 1970-х годов.Общее годовое количество осадков увеличилось в Соединенных Штатах и на суше по всему миру. С 1901 года общее количество осадков в 48 смежных штатах увеличивалось в среднем на 0,17 дюйма за десятилетие. Температура поверхности океана повысилась во всем мире в течение 20 – веков, а средние температуры поверхности в течение последних трех десятилетий были выше, чем в любое другое время, с тех пор, как в конце 1800-х годов начались повсеместные измерения.
Наконец, при усреднении по всем океанам мира уровень моря повышался примерно на шесть десятых дюйма за десятилетие с 1880 года, а скорость повышения в последние годы ускорилась до более чем одного дюйма за десятилетие.Информацию и убедительные доказательства о гораздо более широком спектре воздействий изменения климата можно найти в Индикаторах изменения климата Агентства по охране окружающей среды в США и в научной литературе.
Есть несколько ограничений, связанных с показателями ROE парниковых газов.
- Выбросы. Тенденции выбросов основаны в основном на оценках, которые имеют неопределенности, присущие основным инженерным расчетам и методологиям оценки.Неопределенность в оценках выбросов варьируется для разных газов и источников, хотя оценочные выбросы из некоторых из крупнейших источников (например, выбросы углекислого газа от сжигания ископаемого топлива) считаются очень точными. 5
Один пробел в индикаторе выбросов заключается в том, что инвентаризация парниковых газов EPA не отслеживает каждый парниковый газ или каждый источник выбросов. Примерами парниковых газов, не включенных в кадастр, являются озон и отдельные хлорфторуглероды. Наиболее заметными источниками, не отслеживаемыми в кадастре, являются природные источники, такие как метан из водно-болотных угодий, углекислый газ и метан от таяния вечной мерзлоты, а также множественные выбросы вулканов.
- Концентрации. В то время как данные о концентрациях полностью характеризуют тенденции для углекислого газа (наиболее важного антропогенного парникового газа) и других широко изученных газов, всеобъемлющие глобальные данные недоступны для других радиационно важных веществ, таких как сажа и аэрозоли. Хотя эти вещества технически не являются парниковыми газами, отслеживание тенденций в концентрациях этих веществ важно из-за их способности изменять энергетический баланс Земли.
- Удары. Изменение климата может повлиять на общество и экосистемы разными способами. Например, изменение климата может изменить вероятность экстремальных погодных явлений, повлиять на урожайность сельскохозяйственных культур, повлиять на здоровье человека, вызвать изменения в лесах и других экосистемах и даже повлиять на энергоснабжение. Показатели ROE были разработаны для нескольких климатических мер, которые наиболее напрямую связаны с выбросами и концентрацией парниковых газов и имеют особенно длительные и многочисленные записи.Информацию о гораздо более широком спектре воздействий изменения климата можно найти в «Индикаторах изменения климата» Агентства по охране окружающей среды США и в научной литературе.
Начало страницы
Список литературы
[1] Melillo, J.M., T.C. Ричмонд и Г. Йохе (ред.). 2014. Воздействие изменения климата в Соединенных Штатах: Третья национальная оценка климата. Программа исследования глобальных изменений США.
[2] Подробную информацию об этих связанных факторах можно найти в различных научных публикациях, например, подготовленных Межправительственной группой экспертов по изменению климата, группой, сформированной Всемирной метеорологической организацией для компиляции и обобщения растущего объема научной литературы. по изменению климата.
[3] Межправительственная группа экспертов по изменению климата. 2013. Изменение климата 2013: Основы физических наук Выход. Вклад Рабочей группы I в Пятый оценочный доклад МГЭИК. Кембридж, Соединенное Королевство: Издательство Кембриджского университета.
[4] Melillo, J.M., T.C. Ричмонд и Г. Йохе (ред.). 2014. Воздействие изменения климата в Соединенных Штатах: Третья национальная оценка климата. Программа исследования глобальных изменений США.
[5] U.S. Агентство по охране окружающей среды. 2016. Инвентаризация выбросов и поглотителей парниковых газов в США: 1990-2014 гг. EPA 430-R-16-002.
Начало страницы
CO2: баланс – практичное рыбоводство
Введение диоксида углерода (CO2) в аквариумы с растениями стало очень популярным, и все больше производителей поставляют удобные наборы.
Углерод – самый важный элемент для роста растений, а закачка газа – самый эффективный способ обеспечить это питательным веществом.Однако это не простой случай добавить как можно больше.
Этот газ очень токсичен при передозировке и, вероятно, является самой большой причиной гибели домашнего скота в аквариумах с растениями. Поэтому жизненно важно проверять или контролировать уровни газа в долгосрочной перспективе.
Порог изменения
Содержание CO2 в 30 частей на миллион (ppm) или миллиграммов на литр (мг / л) безопасно для большинства рыб и беспозвоночных. Однако порог токсичности может значительно варьироваться в зависимости от уровней растворенного кислорода (O2).
В аквариумах с относительно низким уровнем O2 домашний скот будет более чувствителен к газу, но в аквариумах с высоким уровнем O2 безопасный пороговый предел CO2 увеличивается.
Тем не менее, я бы никогда не стал превышать 30 ppm CO2, и аквариумы с более низким освещением будут обеспечивать меньше. Соотношение pH / KH / CO2
Когда газ CO2 растворяется в воде, образуется угольная кислота. Это подкисит воду и снизит pH. Это базовое соотношение позволяет нам приблизительно определить, сколько CO2 содержится в воде.
Еще одним важным аспектом химического состава воды является карбонатная жесткость (KH). Также известный как щелочность, KH представляет собой буферную способность воды по pH. Более жесткая вода будет иметь более высокую буферную способность и наоборот.
Внутренняя взаимосвязь между CO2, pH и KH известна и может быть найдена в таблице выше. Используйте его, чтобы проверить свой pH.
Допустим, pH 6,6. Проверьте свой KH. Он измеряет 4 ° (4 KH). Посмотрите в таблицу на pH и KH и посмотрите, где они пересекаются.Это уровень CO2 – в данном случае 30 ppm.
Однако мы можем неправильно интерпретировать наши наборы для тестирования или они могут быть неточными. Тестовые наборы для определения pH основаны на интерпретации цветовой диаграммы, а тестовые наборы KH полагаются на подсчет количества капель жидкости тестового набора, необходимого для изменения цвета аквариумной воды в пробирке.
Если какой-либо параметр считывается неверно или неточен всего на 0,2 pH или 0,5 KH, это может означать заниженные или завышенные показания.
Можно подумать, что вы читаете 30 частей на миллион CO2, но это может быть до 45 частей на миллион или выше и смертельно опасно для рыбы.
Другой фактор может сказаться на точности измерения CO2. Соотношение pH / KH / CO2 предполагает, что угольная кислота из CO2 является единственным подкисляющим соединением, но для большинства из нас это не так.
Азотные кислоты, гуминовые кислоты и другие органические вещества будут способствовать подкислению аквариумной воды. Обычно это приводит к тому, что показания pH ниже, чем предполагается в таблице, что приводит к ложному расчету CO2.
Падение шашки
Долгосрочный мониторинг газа существует уже много лет и, возможно, является гораздо более точным и удобным методом проверки уровней.Самый распространенный метод – использование каплеуловителей, которые работают, сидя в аквариумной воде.
Они заполнены раствором воды и pH-реагента, известного как бромтимоловый синий. Это реагент из набора для тестирования pH, который поставляется с наборами для тестирования низких значений pH (от 6,0 до 7,6). Наборы для тестирования pH с широким диапазоном значений не подходят.
Когда газ в воде вступает в реакцию с раствором бромсинего / вода, он меняет цвет раствора от темно-синего, что означает высокий pH / низкий уровень CO2, до желтого, который означает низкий pH / высокий уровень CO2.
Лучший способ использовать каплеуловитель – наполнить его водой с известным химическим составом. В нашем случае идеально подходит вода с KH 4 ° (4KH). Это эталонное решение 4 KH позволяет нам более точно контролировать уровни CO2.
Используя набор для тестирования низкого уровня pH, обратите внимание на салатовый цвет pH 6,6 на диаграмме. Используя таблицу pH / KH / CO2, мы знаем, что pH 6,6 с 4 KH дает нам 30 ppm CO2.
Таким образом, стремясь к тому специфическому зеленоватому цвету лайма в нашем каплеуловителе, мы стремимся к 30 ppm CO2.
Голубого больше, чем в этом лаймово-зеленом, и в нем меньше 30 частей на миллион CO2.
Более желтый цвет означает более 30 частей на миллион CO2.
Поскольку эталонный раствор 4 KH в нашем капле-чекере отделяется от аквариумной воды воздушным зазором, единственное влияние на его pH – через CO2. Этот принцип делает его более точным и потенциально более безопасным, чем использование таблицы pH / KH / CO2 и тестовых наборов.
У этого метода есть недостатки. Для изменения цвета раствора внутри каплеуловителя может потребоваться несколько часов, что может ввести нас в заблуждение и заставить думать, что требуется больше газа.Чем больше воздушный зазор между аквариумной водой и раствором для проверки капель и чем больше объем раствора, тем больше времени потребуется.
Также требуется сравнение с таблицей цветов, что может привести к неправильной интерпретации. Будьте осторожны и получайте более темный зеленый цвет, а не желто-зеленый цвет. В очень больших аквариумах нередко можно использовать несколько каплеуловителей, чтобы убедиться, что СО2 эффективно распределяется по аквариуму.
Перемещайте каплеуловитель, чтобы определить уровень газа во всех частях аквариума, особенно в высокоэнергетических системах, требующих точного определения уровня CO2.
Тестирование нижнего уровня CO2
Если у вас аквариум с растениями с низким энергопотреблением, например, с низким уровнем освещения и уровня питательных веществ, то 30 ppm CO2 не требуется. Растения будут довольны содержанием 15 частей на миллион, и это представляет меньший риск для рыб.
Чтобы легко измерить это с помощью устройства для проверки капель, просто разбавьте раствор 4 KH 50% -ной водой обратного осмоса. Это делает его 2 KH, и при 15 ppm каплеуловитель приобретет желаемый цвет лайма. Перекрестная ссылка на pH 6,6 на цветовой таблице набора для тестирования низкого уровня pH.
Газовое отравление
Один из лучших индикаторов передозировки – внимательно следить за рыбой. Ранние симптомы включают вялое поведение и потерю аппетита. Более серьезные симптомы включают в себя поверхностное дыхание и потерю сознания.
В таких обстоятельствах наиболее эффективный способ снизить уровень CO2 – как можно скорее произвести большую подмену воды. Убедитесь, что новая вода имеет примерно такую же температуру и не хлорирована, чтобы уменьшить дальнейшее напряжение.
Поможет встряхнуть поверхность путем перемещения выпускного отверстия фильтра или добавления воздушного камня, но они не так эффективны, как быстрая подмена воды. Скорее всего, рыба подвергнется отравлению газом в темный период, когда растения дышат, производят CO2 и используют кислород.
По этой причине отключите впрыск CO2 непосредственно перед тем, как погаснет свет. Многие любители предпочитают включать газ примерно за час до зажигания. Это позволяет уровням накапливаться, чтобы растения могли начать фотосинтез раньше в фотопериод.
Некоторые комплекты для подачи CO2 под давлением сбрасывают большое количество газа в аквариум непосредственно перед тем, как баллон опустеет. Замените цилиндр до того, как он достигнет такого низкого уровня.
Типы дропшипперов
Существуют стеклянные или пластиковые типы всех форм и размеров, но все они используют один и тот же принцип: удерживание небольшого объема раствора реагента pH / воды, который меняет цвет в зависимости от уровня CO2.
Некоторые инструкции для проверки капель советуют использовать аквариумную воду, но из-за огромного разброса потенциальных показаний, если у вас есть аквариумная вода с KH, равным 10, потребуется намного больше, чем 30 ppm CO2, чтобы сместить цвет в зеленый диапазон.
Dennerle и Cal Aqua поставляют эталонный раствор pH / KH, идеально подходящий для добавления прямо в ваш каплеуловитель, но довольно просто приготовить свои собственные эталонные растворы pH / KH.
Купите набор для тестирования низкого уровня pH, и Nutrafin и API – две известные марки, или вы можете купить бромтимоловый синий. Я рекомендую купить набор, чтобы у вас была таблица цветов, необходимая для сравнения вашего цвета каплеуловителя с указанным зеленым pH 6,6.
Вы можете купить готовое эталонное решение 4KH или сделать свое собственное.Для этого добавьте 0,12 грамма пищевой соды и 1 л дистиллированной воды.
Регуляторы pH
Они работают по принципу, согласно которому уровни газа связаны с pH воды в аквариуме. Соленоид, связанный с датчиком pH, будет включать и выключать CO2 в зависимости от предварительно установленного значения pH, определенного KH аквариумной воды и с помощью таблицы.
Как упоминалось ранее, CO2 – не единственный фактор, изменяющий уровень pH. Из-за природы большинства регуляторов pH газ включается и выключается много раз в течение 24-часового светового периода с помощью соленоида.Вы также можете подключить соленоид к фарам, чтобы CO2 не терялся в темноте.
Самая большая потенциальная проблема с регуляторами pH заключается в том, что они производят нестабильные уровни CO2, обычно связанные с проблемами водорослей. Они также относительно дороги, и датчик pH требует регулярной калибровки. Если датчик выйдет из строя, CO2 может оставаться постоянно, что приведет к передозировке.
Знаете ли вы?
В высокоэнергетическом аквариуме с растениями с хорошим освещением и регулярным дозированием питательных веществ основной причиной появления водорослей является плохой или колеблющийся уровень CO2.
Быстрорастущие растения зависят от стабильного источника обогащения углеродом и приспосабливаются к предоставленным условиям. Если этот источник колеблется или исчезает во время процесса фотосинтеза, растение пострадает и вызовет рост водорослей.
Дозирование жидких углеродных удобрений в сочетании с впрыском газа может помочь устранить любую нехватку углерода, но в долгосрочной перспективе лучше обеспечить соответствующий уровень впрыска CO2.
В энергосберегающих системах, например при слабом освещении, впрыск можно заменить дозированием жидкого углерода.
Как использовать каплеуловитель CO2 4 KH
1. Приобретите прибор для проверки капель, набор для тестирования низкого уровня pH или реагент pH бромтимолового синего, эталонный раствор 4 KH, пробирку и пипетку или шприц.
2. С помощью пипетки или шприца добавьте раствор 4 KH в пробирку. Не заполняйте до линии, так как для проверки капель требуется совсем немного.
3. Добавьте две капли pH-реагента бромсинего в раствор 4 KH в пробирке.Обратите внимание, что он синий, так как CO2 отсутствует.
4. Затем с помощью пипетки или шприца еще раз наберите раствор из пробирки.
5. Добавьте раствор в каплеуловитель с помощью пипетки или шприца.
6. Устройство защиты от падения готово к установке. Эта модель висит на боковой стороне стакана открытым концом внутрь воды.
Углеродный цикл и атмосферный CO2
Глобальный углеродный цикл
Биогеохимический цикл, в котором происходит обмен углерода между земной биосферой , гидросферой , геосферой и атмосферой , называется углеродным циклом .Глобальный углеродный баланс – это баланс потоков углерода между этими четырьмя резервуарами . Термины источник или сток определяют, идет ли чистый поток углерода из коллектора или в него, соответственно.
Схематическое изображение глобального углеродного цикла, показывающее запасы углерода и потоки (обмены) углерода между ними. Примечание: GtC = гигатонны углерода.
Двуокись углерода в атмосфере
Углеродный цикл представляет интерес для понимания климата, потому что он включает два наиболее важных парниковых газа: углекислый газ (CO 2 ) и метан (CH 4 ).Большая часть атмосферного углерода находится в форме CO 2 , тогда как CH 4 присутствует только в следовых концентрациях. Поскольку CO 2 химически инертен, он относительно хорошо перемешивается в атмосфере вдали от лесных пологов, тогда как CH 4 химически активен и быстро удаляется из атмосферы путем окисления до CO 2 и воды. Общая концентрация этих парниковых газов в атмосфере увеличилась за последнее столетие и способствовала глобальному потеплению.
Углерод удален из атмосферы посредством:
- фотосинтетическое преобразование углекислого газа в углеводы растениями с выделением кислорода в процессе;
- образование углекислоты по мере охлаждения циркулирующих поверхностных вод океана около полюсов, тем самым поглощая больше атмосферного CO 2 ;
- преобразование восстановленного углерода в органические ткани или карбонатов в твердые части тела, такие как раковины, морской биотой в поверхностных водах океана; и
- реакция между угольной кислотой и силикатной породой, которая приводит к образованию ионов бикарбоната, которые переносятся в океан и в конечном итоге осаждаются в морских карбонатных отложениях.
Углерод может быть введен в атмосферу с помощью различных процессов, в том числе:
- дыхание растений и животных, экзотермическая реакция, которая включает расщепление органических молекул на CO 2 и воду;
- разложение грибами и бактериями, которые расщепляют углеродные соединения в мертвых животных и растениях и преобразуют углерод в CO 2 , если присутствует кислород, или в метан, если нет;
- сжигание органических веществ (включая вырубку лесов и сжигание ископаемого топлива), которое окисляет углерод, производящий CO 2 ;
- производство цемента, когда известняк (карбонат кальция) нагревается для получения извести (оксида кальция), компонента цемента, и выделяется CO 2 ;
- выброс растворенного CO 2 обратно в атмосферу за счет нагревания поверхностных вод океана; и
- выброс водяного пара, диоксида углерода и диоксида серы в результате извержений вулканов и метаморфизма.
Океанический углерод
Неорганический углерод легко обменивается между атмосферой и океаном, оказывая важное влияние на pH океанской воды. Углерод выбрасывается в атмосферу в местах океанического апвеллинга, тогда как районы нисходящего потока переносят углерод из атмосферы в океан. Когда углерод (CO 2 ) попадает в океан, угольная кислота образуется в результате реакции: CO 2 + H 2 O = H 2 CO 3. Угольная кислота диссоциирует с образованием бикарбонат-ионов (HCO 3 – ), форма, в которой существует большая часть углерода в океанах; меньшее количество углерода присутствует в виде угольной кислоты (H 2 CO 3 или растворенный CO 2 ) и карбонат-ионов (CO 3 2- ) в сочетании с кальцием, магнием и другими катионами.Морские организмы строят свои скелеты и раковины из минералов кальцита и арагонита (CaCO 3 ) за счет включения ионов бикарбоната. Эти минералы растворяются после смерти организма, но часть материала оседает на морском дне, где его можно похоронить и хранить в виде известняка.
Углерод в биосфере
Углерод – неотъемлемая часть жизни на Земле. Он играет важную роль в структуре, биохимии и питании всех живых клеток.Автотрофы – это организмы, которые производят свои собственные органические соединения, используя углекислый газ из воздуха или воды, в которых они живут. Этот образ жизни требует внешнего источника энергии, например, поглощения солнечного излучения в процессе, называемом фотосинтезом, или использованием химической энергии. источники в процессе, называемом хемосинтезом. Наиболее важными автотрофами для углеродного цикла являются деревья в лесах и фитопланктон в океане.
Большое количество углерода проходит между атмосферой и биосферой за короткие промежутки времени: удаление атмосферного углерода происходит во время фотосинтеза по реакции CO 2 + H 2 O = CH 2 O + O 2 , в то время как большая часть углерода покидает биосферу посредством дыхания, обратная реакция предыдущей реакции, в которой количество энергии, эквивалентное поглощенному во время фотосинтеза, выделяется в виде тепла.Когда присутствует кислород, происходит аэробное дыхание, которое выделяет углекислый газ в окружающий воздух или воду. В противном случае происходит анаэробное дыхание и выброс метана в окружающую среду, который в конечном итоге попадает в атмосферу или гидросферу.
Биосфера способна хранить ~ 10% атмосферного углерода в любой момент времени. Однако на хранение углерода в биосфере влияет ряд процессов в разных временных масштабах: в то время как чистая первичная продуктивность следует сезонным и годовым циклам, углерод может накапливаться до нескольких сотен лет в деревьях и до тысяч лет в почвах. .Таким образом, изменения в этих долгосрочных углеродных пулах могут повлиять на глобальное изменение климата (просмотрите этот пример изменений в почве).
Углерод в геосфере
Резервуары органического и неорганического углерода в земной коре имеют большие размеры и длительное время пребывания. Углерод проникает в геосферу через биосферу, когда мертвое органическое вещество (например, торф или морские водоросли) включается в ископаемое топливо, такое как уголь и богатые органическими веществами нефте- и газовые породы, и когда раковины карбоната кальция становятся известняком в процессе седиментация кратко описана выше.Эти резервуары углерода могут оставаться нетронутыми, то есть углерод может оставаться в них в течение многих миллионов лет. В конце концов, большинство горных пород поднимается и подвергается воздействию атмосферы, где они выветриваются и размываются, или они подвергаются субдукции, метаморфизму и извержению вулканов, возвращая накопленный углерод обратно в атмосферу, океан и биосферу. Зависимость нашего общества от ископаемого топлива обходит этот естественный процесс, перемещая из геосферы в атмосферу столько углерода за один год, сколько в противном случае потребовалось бы за сотни тысяч или миллионы лет.В Пенсильвании, когда мы вскрываем шахту и сжигаем уголь, мы фактически высвобождаем атмосферный углекислый газ и запасенную энергию солнца, которая была похоронена более 300000000 лет!
Смотри!
Во время поездки в Bear Meadows, недалеко от кампуса University Park в Пенсильвании, я описываю хранение углерода в атмосфере и органического углерода в Критической зоне.
Видео: Поездка на Медвежьи луга (5:40)
Щелкните здесь, чтобы просмотреть стенограмму видео «Поездка на Медвежьи луга».
ТИМ УАЙТ: Я побывал в Медвежьих лугах, национальной природной достопримечательности, примерно в восьми милях к юго-востоку от главного кампуса штата Пенсильвания в центральной Пенсильвании. Я привел вас сюда сегодня, чтобы описать взаимосвязь между содержанием углекислого газа в атмосфере и хранением органического углерода на поверхности Земли в пределах критической зоны. Пойдем посмотрим на болото.
Медвежьи луга – это торфяное болото, которое начало формироваться почти 10 000 лет назад, вскоре после того, как северо-запад и северо-восток Пенсильвании были покрыты обширными ледяными щитами, которые простирались далеко на север в регион Гудзонова залива и Канаду.Эти ледяные щиты были ближе всего к Государственному колледжу и кампусу Пенсильванского университета к северо-востоку от Уильямспорта, примерно в 30 милях от них. Одна из задач, которую я хотел бы выполнить, пока мы здесь, – это исследовать торф в болоте и посмотреть, из чего он сделан, и для этого я собираюсь пройтись по краю болота. – на заднем плане вы можете видеть, куда я собираюсь пойти – и я собираюсь достать свой почвенный шнек, чтобы у меня был способ зондировать и пробовать торф.
Напомним, что растения используют воду, атмосферный углекислый газ и энергию солнца для создания своего органического каркаса посредством фотосинтеза.Таким образом, растения поглощают атмосферный углекислый газ как часть своей жизненной привычки. Когда растения умирают, органическое вещество окисляется, и углекислый газ возвращается в атмосферу.
Это влажное заболоченное место идеально подходит для сохранения органических веществ и органического углерода. Если вы посмотрите под поверхность воды, вы можете ясно увидеть различные органические компоненты, связанные с растениями, которые обитают в болоте. Я вижу кленовые листья и обильные корни, связанные с этими травами.Если растения умирают и их различные органические компоненты сохраняются, как в случае здесь, в болоте, исходный углерод в атмосферном углекислом газе, который был фотосинтезирован живым растением, также сохраняется или сохраняется, а не возвращается в атмосферу через разложение. . Мы называем место таких процессов стоком углерода.
Я исследую торф шнеком, чтобы посмотреть, насколько глубоко я могу добраться до основания болота, чтобы посмотреть, смогу ли я взять здесь образец торфа из основания болота.Вы видите, что я прошел более метра торфа и взял образец из основания болота. И вы можете видеть, что торф там состоит из тонкой органической грязи, а также нескольких корней и нескольких листьев травы, подобных тем, которые вы можете найти прямо здесь, на поверхности.
Дальше в болоте есть места, где за последние 8000 лет скопилось 15 футов торфа. Это означает, что 8000 лет назад углерод был удален из древней атмосферы, хранился здесь в торфе и остается сегодня.Еще одна последняя мысль, прежде чем мы уйдем, касается временной шкалы хранения органического углерода в критической зоне. Я сказал вам, что органическое вещество накапливалось здесь за последние 8000 лет, но эта среда существует в Аппалачских горах, и судьба гор в конечном итоге должна быть разрушена, что происходит с этими горами сегодня. Таким образом, хотя этот органический углерод остается здесь и сейчас, в течение длительного геологического времени – от сотен тысяч до миллионов лет – этот торф будет окислен, и этот древний органический углерод будет возвращен в нашу современную атмосферу.
Затем посетите угольный пласт в Пенсильвании и близлежащую электростанцию, чтобы узнать о связи между Медвежьими лугами и сжиганием угля.
Видео: посещение угольного пласта Пенсильвании (02:52)
Щелкните здесь, чтобы просмотреть стенограмму видео о посещении угольного пласта в Пенсильвании.
Угольные пласты и производство электроэнергии около Шавилля, Пенсильвания
[Тим стоит рядом с угольным пластом.]
Геологическая, экономическая и культурная история Пенсильвании пронизана естественным изобилием угля в этом штате. Чтобы дать студентам возможность увидеть уголь в его естественной обстановке, мне нравится приезжать сюда, на плотину Карвенсвилл, примерно в 45 милях к северо-западу от Государственного колледжа.
[Здесь вы видите два угольных пласта, один прямо передо мной, а другой немного дальше на склоне. Уголь – это торф, глубоко зарытый в землю и подвергающийся воздействию высоких давлений и температур.Помните, в Bear Meadows мы изучили торф и смогли увидеть различные компоненты растений, из которых он сделан.
Мы также обсуждали, что этим компонентам растений на дне болота было 8000 лет, и они содержали 8000-летний атмосферный углекислый газ. Этим угольным пластам более 300 миллионов лет. Они образовались из обширных торфяных болот, существовавших на окраинах большого внутреннего морского пути, затопившего в то время большую часть Северной Америки. Поэтому, когда мы выкапываем и добываем эти угли и используем их для зажигания наших электростанций и компьютеров, которые вы используете сегодня для просмотра этого видео, мы выбрасываем углекислый газ возрастом 300 миллионов лет в нашу сегодняшнюю атмосферу. .
[смотрит в окно машины на электростанцию Shawville]
Мы приближаемся к генерирующей станции Шавилля. На этой электростанции, которая находится примерно в 15 милях от обнаженного угля в Карвенсвилле, который мы только что посетили, уголь сжигается для производства электроэнергии для местного и регионального потребления.
[Др. Белый стоит перед электростанцией]
На многочисленных угольных электростанциях по всему штату уголь сжигается для производства электроэнергии.И именно благодаря этому процессу Пенсильвания производит 1% от общих мировых выбросов углекислого газа в любой конкретный год.
В последующих уроках мы рассмотрим и обсудим влияние антропогенных выбросов углекислого газа и изменения климата на процессы в критических зонах.