ИЗМЕНЕНИЕ рН ВОДЫ, БУФЕРНАЯ СИСТЕМА
- Подробности
Просмотров: 2910
Процесс жизнедеятельности гидробионтов сопровождается закислением среды, подробнее
этот вопрос будет рассмотрен ниже. В некоторых рыбоводных установках снижение рН прини-
мает опасные для культивируемых видов формы. Так, например, нормой работы замкнутых по
воде установок является снижение рН до 6 – 6,5 при значение рН подпиточной воды 7 – 8. При
непринятие мер рН снижается до опасных значений.
Природные воды располагают собственной буферной системой, определенным образом га-
сящей рост концентрации ионов водорода. Буферные свойства воды определяются растворен-
ной в ней двуокисью углерода СО2 с образованием угольной кислоты Н2СО3. Эта слабая кисло-
35
та взаимодействует с карбонатосодержащими породами СаСО3 с образованием бикарбоната
Бикарбонат диссоциирует с образованием водородных и карбонатных ионов. Весь процесс
растворения углерода в воде описывается серией уравнений
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3
– ↔ Н+ + СО3
2-. /15/
Эти химические реакции во многом зависят от концентрации ионов водорода. С повышени-
ем концентрации ионов водорода (снижение рН) реакция сдвигается влево. Однако, эта хими-
ческая система обладает буферностью, она сопротивляется любым изменениям концентрации
ионов водорода. При добавление ионов водорода частная реакция
Н+ + НСО3
– ↔ Н+ + СО3
2- /16/
остается относительно стабильной, поскольку в обеих частях содержатся ионы Н+. Сдвиг ре-
акции влево компенсирует добавление ионов водорода. Поскольку концентрация угольной ки-
слоты в частной реакции (уравнение 16) увеличилось, то это приводит к частичной диссоциа-
ции угольной кислоты с образованием воды и углекислого газа
СО2 + Н2О ↔ Н2СО3. /17/
Происходит сдвиг реакции влево, при этом наблюдается уменьшение концентрации бикар-
боната в воде (НСО3
-). В результате реакций большая часть ионов водорода будет связана в Н2О
и НСО3
-.
Если вода контактирует с карбонатными отложениями СаСО3, то пополнение утраченного
бикарбоната (НСО3
-) произойдет за счет диссоциации карбонатных отложений
CaCO3 ↔ Ca2+ + CO3
2-, /18/
CO3
2- + H+ ↔ HCO3
-.
С целью стабилизации рН водных систем, например, аквариумов, в воду вносят материалы,
содержащие СаСО3: раковины моллюсков, мраморную крошку и т.п.
В воде океанов рН поверхностных вод обычно находится в пределах 7,8 – 8,3, то есть имеет
щелочную реакцию. Этим объясняется наличие прочных раковин у морских моллюсков. В кис-
лых водах пресных водоемов раковины растворяются.
В природных водах озер рН изменяется от 6 до 9. Под влиянием вулканических кислот рН
может снизиться до 1,7, что часто случается в зонах активной вулканической деятельности
может достигнуть значения 9. Чаще всего это бывает в артезианских источниках.
Буферные свойства воды оцениваются по ЩЕЛОЧНОСТИ ВОДЫ, тесно связанной с карбо-
натной жесткостью воды. Щелочность (ее обозначают символом А1к) выражает концентрацию
анионов слабых кислот (угольной, борной, фосфорной и др.), связанных с сильным основанием.
Щелочность вычисляется по формуле:
HCO3
– в мг/л СО3
2- в мг/л
А1к = –––––––––––– + ––––––––––––, (мг-экв/л). /19/
61 24
Связь между рН воды и формами углерода, входящими в буферную систему пресной воды,
приведена на рис.18.
Рис.18. Графическая связь pH и форм углерода в пресной воде.
Если в замкнутых по воде рыбоводных установках буферные свойства подпиточной воды
невысоки, то для стабилизации рН воды используется известковое молоко, получаемое при га-
шении извести СаО. При гашении СаО образуется сильное основание – гидроксид кальция
Са(ОН)2.
CaO + Н2O = Са(ОН)2 + 16 ккал /20/
На 1 кг аммиака, выделяемого гидробионтами (Nh5
+ – N), потребуется примерно 4 кг СаО.
biblio.arktikfish.com
БУФЕРНЫЕ СВОЙСТВА (буферное действие и растворы)
БУФЕРНЫЕ СВОЙСТВА, способность многих веществ ослаблять изменение активной реакции раствора, которое без них произошло бы при прибавлении к раствору кислот или щелочей. Это стабилизирующее влияние на реакцию раствора называется буферным действием.
Буферное действие
Если к десяти кубических см децинормального раствора уксусной кислоты постепенно добавлять раствор едкого натра такой же концентрации, то кислотность раствора, определяемая концентрацией содержащихся в нем свободных водородных ионов, будет уменьшаться. При прибавлении 10 кубических
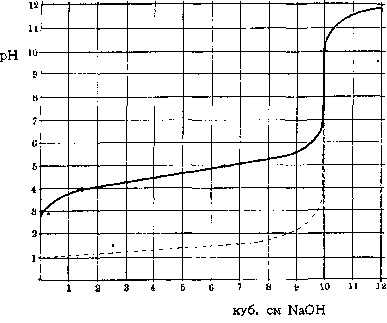
Рисунок 1. Изменение реакции (буферные свойства в действии)
Прерывистая линия на том же рисунке изображает соответствующее изменение реакции (рН) при прибавлении NaOH к децинормальной соляной кислоте. Если сравнить обе кривые и посмотреть, сколько потребовалось щелочи для одинакового изменения реакции, напр., для изменения рН от 4 до 5, то результаты окажутся весьма различными: в первом случае – около 5 кубических см NaOH, во втором – едва уловимые следы последнего. Количество щелочи (или соответственно кислоты), которое требуется для определенного изменения реакции, и является мерилом устойчивости реакции раствора, величины его буферного действия. В первом случае оно весьма значительно, во втором – совершенно ничтожно. Если количество грамм-эквивалентов щелочи (или, соответственно, кислоты), прибавленной к литру испытуемого раствора, обозначить знаком ДВ, а вызванное этим изменение реакции через ДрН, то, по Ван-Слайку (Van-Slyke), буферное действие будет равно отношению этих величин: Буферное действие = отношение ДВ к ДрН. Различие в хорде кривых для обоих рассмотренных выше растворов обусловлено свойствами обеих кислот. Соляная кислота принадлежит к сильным кислотам, полностью диссоциированным на свои ионы. Напротив, уксусная кислота сравнительно слабо диссоциирована: только небольшая часть ее молекул (в децинормальном растворе около 1,3%) распадается и дает водородные ионы, определяющие кислую реакцию раствора. Поэтому, уксусная кислота имеет значительно менее кислую реакцию (больший рН), чем соляная в одинаковой молекулярной концентрации. При прибавлении NaOH гидроксильные ионы щелочи связывают водородные ионы. Но в силу общих условий химическом равновесия удаление продуктов диссоциации вызывает распад новых, прежде недиссоциированных молекул, освобождая все новые количества Н-ионов на место связываемых щелочью. Таким образом, уксусная кислота (в отличие от полностью диссоциированной соляной), кроме свободных, активных Н-ионов, обусловливающих активную реакцию раствора, обладает еще в своих недиссоциированных молекулах запасными, резервными водородными ионами, резервной кислотностью, способной быстро пополнять убыль свободных ионов. Эти кислотные резервы (или щелочные, если раствор может освобождать запасные ОН-ионы и связывать прибавляемые кислоты) и обусловливают его буферное действие; оно тем значительнее, чем больше резервных ионов мобилизуется при данном изменении реакции. Самое название (буферное действие) было дано по аналогии с железнодорожными буферами, смягчающими резкость механических толчков. Более правильным было бы сравнение с сосудами различной емкости, в которых прибавление одинакового количества жидкости вызывает различное изменение уровня. Чем значительнее емкость сосуда, тем больше требуется жидкости для определенного повышения уровня; подобным же образом от количества резервных Н – или О Н-ионов («буферной емкости») зависит количество щелочи (или кислоты), необходимое для данного изменения «уровня» реакции.
Буферные растворы
Электролитическая диссоциация слабых кислот и щелочей резко понижается в присутствии солей, имеющих общий с ними ион. Напр., уксусная кислота значительно слабее диссоциирована в присутствии своей натриевой соли (уксуснокислого натрия, дающего, подобно уксусной кислоте, ацетат-ион) и дает значительно меньше водородных ионов, чем в чистом растворе. Концентрация водородных ионов прямо пропорциональна концентрации молекул уксусной кислоты и обратно пропорциональна концентрации ацетат-ионов. Так как нейтральные соли принадлежат к сильным электролитам, почти полностью диссоциированным на свои ионы, можно с достаточным приближением, вместо концентрации ацетат-ионов, взять просто концентрацию соответствующей соли. Концентрация водородных ионов в таком растворе, содержащем слабую кислоту и ее соль, выразится тогда простой формулой (в которой прямоугольные скобки обозначают концентрацию стоящих в них веществ): [Н’]=К [кислота] / [соль] (1).
Подобным же образом в смеси слабой щелочи и ее соли концентрация гидроксильных ионов (по которой точно так же легко вычислить тесно связанную с ней концентрацию Н-ионов и реакцию раствора) определяется аналогичным выражением: [Н’]=К [щелочь] / [соль] (2).
Для более точного расчета необходимо было бы в обеих формулах несколько уменьшить знаменатель, умножив его на степень диссоциации соли (величину меньшую единицы). Такие смеси имеют особенно большие количества резервных, легко мобилизуемых Н- и ОН-ионов и соответственно особенно большое буферное действие. При этом они делают реакцию раствора устойчивой одновременно по отношению и к щелочам и к кислотам. Так, напрример, смесь уксусной кислоты с уксуснокислым натрием (получающаяся при частичной нейтрализации уксусной кислоты едким натром, смотрите рисунок), как мы видели, сравнительно мало изменяет свою реакцию при подщелачивании. Точно так же при прибавлении сильной кислоты, напр., соляной, действие ее ослабляется благодаря тому, что она соединяется с натрием, вытесняя эквивалентное количество слабой уксусной кислоты из ее соли. Растворы подобных смесей слабой кислоты или щелочи с соответствующей солью, так называемые буферные растворы, приобрели особенное значение благодаря той легкости, с которой по приведенным формулам (1) и (2) может быть вычислена их реакция. Постоянная К в этих формулах представляет характерную для каждой кислоты или щелочи константу – т. н. константу диссоциации. Если кислота и ее соль присутствуют в равной (эквивалентной) концентрации, то, очевидно, концентрация водородных ионов делается численно равной константе диссоциации ([Н’]=К). Таким образом, константа диссоциации кислоты (или, соответственно, щелочи) непосредственно указывает среднюю реакцию, в районе которой проявляется буферное действие данной смеси. В этой точке буферное действие более чем особенно велико. В следующей таблице приведен водородный показатель нескольких буферных растворов: смеси уксусной кислоты и уксуснокислого натрия (ацетатная смесь), однометаллического (первичного) и двуметаллического (вторичного) фосфата натрия (NaH
Таблица рН буферных смесей.
Уксусная кислота
Молярное соотношение
Уксусно- кисл. Na
32:1 3,2 16:1 3,5 8:1 3,8 4:1 4,1 2:1 4,4 1:1 4,7 1:2 5,0 1:4 5,3 1:8 5,6 1:16 5,9 1:32 6,2 Первичный фосфат
Вторичный фосфат
Хлор. аммоний
Аммиан
1 4 7 0 3 7 3,3 8,0 8,3 8,6 8,9 9,2 9,5 9,8 10,1 10,4 10,7 11,0
Из формул (1) и (2) можно непосредственно вывести одно очень важное свойство буферных растворов: реакция, даваемая буферной смесью, зависит (в первом приближении) исключительно от соотношения и её компонентов, а не от их абсолютной концентрации. Поэтому и в приведенной таблице можно было, не приводя концентрации кислоты (или щелочи) и соли, ограничиться указанием их соотношения. Разбавление буферного раствора не влияет на его реакцию. Конечно, того же нельзя сказать о буферном действии. При данной реакции оно тем значительнее, чем выше концентрация буферов. Рассмотренные свойства буферных растворов определяют их важнейшие практические применения:
- Очень многие биохимические и биологические процессы в высокой степени чувствительны даже к незначительным изменениям реакции (смотрите Активная реакция и Водородные ионы). В самом ходе этих процессов часто вырабатываются большие количества кислых или щелочных продуктов, которые могли бы изменить или даже совершенно остановить их дальнейшее течение. Для точного изучения подобных процессов необходимо их проводить в условиях, исключающих возможность сколько-нибудь значительных колебаний реакции. Для этого служат буферные растворы, применяемые здесь как регуляторы реакции. Этот метод был применен Серенсеном (Sorensen, 1909 г.) для изучения влияния активной реакции на деятельность ферментов. В зависимости от количества вырабатываемых кислых или щелочных продуктов, с одной стороны, от желательной степени постоянства реакции – с другой, приходится применять растворы с более или менее значительным буферным действием.
- В других случаях величина буферного действия не имеет особенно существенного значения, а применение буферных растворов основано на даваемой ими возможности готовить стойкие растворы любой желательной реакции (смотрите таблицу). При помощи индикаторов – веществ, меняющих свою окраску в зависимости от активной реакции раствора, можно сравнивать исследуемый раствор с серией буферных растворов известной реакции. Устанавливая, в каком из этих растворов данный индикатор принимает такую же окраску, как и в испытуемом, можно определить реакцию последнего. Таким образом, буферы применяются здесь как стандартные растворы, путем сравнения с которыми измеряется реакция. Применение таких стандартных буферных растворов лежит в основе индикаторного, или колориметрического метода измерения реакции. Другие буферные системы. Другие хим. системы также могут оказывать более или менее значительное буферное действие. Оно может зависеть, например, от выпадения в осадок прибавляемой щелочи или кислоты. Так, если к морской воде прибавлять едкий натр, раствор будет подщелачиваться до тех пор, пока его рН не сделается равным, приблизительно 8,6. При этой реакции начнет осаждаться Mg(OH)2, образующийся из магниевых солей и прибавляемого NaOH; дальнейшее увеличение щелочности приостановится, пока весь магний не выпадет из раствора. Далее, даже нерастворимые вещества (например, животный уголь) могут захватывать прибавляемые кислоты или щелочи путем адсорпции. Наконец, очень сильным буферное действием отличаются белки и другие амфотерные вещества (смотрите Амфолиты). Благодаря своей двойственной («амфотерной») природе, они могут связывать как кислоты, так и щелочи. Амфотерный характер клеточных коллоидов имеет большое значение для постоянства внутриклеточной реакции.
Буферы морской воды
Изменения реакции оказывают огромное влияние на жизненные явления; жизнь возможна лишь в определенном, для большинства организмов сравнительно узком, интервале концентраций Н- и ОН-ионов. Поэтому в природе буферы играют большую роль в поддержании необходимого для жизни постоянства реакции. Морская вода, представляющая естественную внешнюю среду большинства водных организмов, обладает весьма значительным буферное действием, которое зависит от содержащейся в ней бикарбонатной смеси – сочетания углекислоты и двууглекислого натрия (бикарбоната натрия). Благодаря наличию этого буфера, сохраняется обычная слабощелочная реакция морской воды и умеряются колебания реакции, которые производят водные организмы, поглощающие при фотосинтезе CO2 или выделяющие кислые продукты обмена веществ.
Буферные свойства крови
Особенный интерес представляют буферные свойства внутренней среды организма, в частности, крови. Кровь имеет слабощелочную реакцию, отличающуюся большим постоянством. Даже in vitro кровь стойко удерживает свою реакцию и обладает весьма большим буферным действием. К ней приходится прибавлять в несколько десятков раз больше едкого натра, чем к дистиллированной воде, чтобы вызвать одинаковое подщелачивание раствора, и в несколько сот раз больше НС1 для одинакового подкисления. Так же, как и в морской воде, главным буфером кровяной сыворотки является бикарбонатная смесь – сочетание CO2 и NaHCO3. Даваемая ею концентрация Н-ионов приближенно определяется так: [Н’]=К [СO2] / [NaHCO3] (3), где К равняется, приблизительно, 3 * 10-7. В сыворотке содержатся также фосфаты, однако, по сравнению с бикарбонатами, их количество и их роль невелики. В отношении буферного действия бикарбонатный раствор вполне сходен с кровяной сывороткой.
Так, например, обе жидкости растворяют одинаковое количество CO2, пропорциональное ее парциальному давлению в окружающем воздухе. При изменении этого давления, как показывает формула (3), во столько же раз изменяется в них концентрация водородных ионов. Цельная кровь со своими форменными элементами обнаруживает при тех же условиях заметно большее постоянство реакции. Это добавочное, по сравнению с сывороткой, Буферное действие зависит от амфотерных белковых веществ крови, в частности – от находящегося в эритроцитах НЬ. Последний представляет очень слабую кислоту, настолько слабую, что его кислый характер не может проявиться при избытке CO2. Но, когда давление последней понижено, например, в артериальной крови, оксигемоглобин, как кислота, разлагает некоторое количество бикарбоната, вытесняя из него CO2. В результате уменьшается знаменатель в формуле (3) и отчасти компенсируется влияние пониженного содержания CO2.
Таким образом, НЬ оказывает существенное влияние на кривую связывания углекислоты, а тем самым и на реакцию крови. В частности, он умеряет различия, связанные с различным давлением CO2 в артериальной и в венозной крови. Во всяком случае, в конечном итоге реакция крови вполне определяется соотношением углекислоты и бикарбоната, т. е. отношением свободной (растворенной) CO2 и CO2 химически связанной. Первая легко выделяется из крови, вторая может быть вытеснена путем разложения бикарбонатов кислотами. Обе эти величины – количество свободной и связанной CO2 – совместно характеризуют буферные свойства и реакцию крови. Их измерение получило в последнее время большое распространение и значение.
В отношении своей реакции кровь обладает теми же свойствами, что и другие буферные растворы. Мы видели, что реакция буферной смеси определяется соотношением кислоты и ее соли, а не их абсолютной концентрацией. Соответственно этому и реакция крови остается практически неизменной даже при многократном разбавлении ее изотоническим раствором NaCl (или любым другим безбуферным раствором). Этим свойством крови нередко пользуются при измерении ее реакции, применяя с этой целью небольшое количество крови, разбавленной раствором NaCl. Оно же делает безвредным внутривенное вливание различных так наз. «физиологических растворов», нередко имеющих ненормальную реакцию, которая оказалась бы гибельной для организма, если бы уже небольшая примесь крови не приближала ее к физиологической норме. При прибавлении к крови in vitro щелочи эта последняя нейтрализуется углекислотой; напротив, всякая кислота реагирует с бикарбонатом и, образуя нейтральную соль, заменяется эквивалентным количеством вытесненной ею из бикарбоната CO2. Этим объясняется замечательный факт, не раз уже обращавший на себя внимание исследователей: путем введения в кровь (in vivo) различных кислот – от наиболее слабых до самых сильных – оказывается совершенно невозможным добиться различного (соответственно силе применяемой кислоты) изменения реакции крови.
Пока в крови остается некоторое количество бикарбонатного буфера, изменения реакции оказываются во всех случаях одинаково ничтожными. Затем, одновременно с резким нарушением реакции, наступает смерть. Эти грубые экспериментальные воздействия дают наглядное представление о том, что происходит в организме в естественных условиях. Огромное большинство продуктов обмена веществ имеет кислый характер (фосфорная, угольная, молочная, масляная и другие кислоты). От этих непрерывно поступающих из тканей кислот и должны буферы крови предохранить ее нормальную реакцию. Последняя является слабощелочной, то есть характеризуется небольшим избытком активных гидроксил-ионов. Водородный показатель (рН) крови равняется, в среднем, 7,4, концентрация Н-ионов – 0,44 * 10-7, концентрация ОН-ионов – около 7 * 10-7 (при 37°). По сравнению с этой незначительной концентрацией свободных ОН-ионов количество резервных ионов, которое может быть освобождено для связывания прибавляемых кислот, весьма велико (около 2 * 10-2). Их количество, однако, далеко не отличается таким постоянством, как активная реакция крови, и может подвергаться сильным изменениям, особенно в патологических условиях.
Щелочные растворы представляют лишь первый барьер против вводимых извне или вырабатываемых в организме кислых продуктов. Производимое последними нарушение реакции во много раз ослабляется буферами крови, но не может быть ими совершенно устранено: связывание части молекул бикарбоната и освобождение CO2 смещает первоначальное соотношение этой основной буферные смеси. Более тонкая регуляция реакции совершается легкими. Всякое увеличение концентрации водородных ионов служит возбудителем дыхательного центра и немедленно усиливает вентиляцию легких (смотрите Дыхание). Благодаря высокой чувствительности дыхательного центра к Н-ионам, аппарат легочной регуляции работает необычайно точно: удаляя из крови, в зависимости от существующей в ней активной реакции, большие или меньшие количества CO2, он автоматически восстанавливает нормальное соотношение между нею и бикарбонатом.
Буферы крови защищают организм от резких колебаний реакции, которые были бы для него гибельны; дыхательный аппарат обеспечивает постоянное соотношение компонентов буферной смеси (даже при резких изменениях их абсолютной концентрации) и тем самым – точное постоянство активной реакции. Особенно значительное патологическое накопление нелетучих кислот и соответствующее уменьшение резервной щелочности наблюдаются при ацидозах. Однако, и оно обычно не ведет к изменению активной реакции крови: путем усиленной вентиляции легких достигается уменьшение содержания CO2, компенсирующее в большинстве случаев понижение концентрации бикарбоната («компенсированный ацидоз»). Противоположное явление представляет компенсированный алкалоз, при котором увеличение щелочных резервов компенсируется пропорциональным повышением давления CO2. Изменения содержания СО 2 в альвеолярном воздухе легких может служить в обоих случаях прямым показателем изменений концентрации бикарбонатов в крови. Общее количество буферов в крови в первом случае уменьшается, во втором увеличивается, но активная реакция остается практически постоянной.
Литература: Мiсhаеlis L., Die Wassers offionen-konzentration, Т. 1, Aufl. 2, B„ 1922; Кора-cuwsly W., Les ions d’hydrogene, P., 1926; Kolthoff J. M., Der Gebraueh von Farbenindi-katoren, 3 Aufl., В., 1926; Van Slyke D., The carbon dioxide carriers of the blood, Physical Review, v. I, p. 141, 1921. Д. Рубинштейн. В.
Изучайте:
- САЛЬПИНГИТ
САЛЬПИНГИТ (от греч. salpinx—труба), воспаление Фаллопиевой трубы; заболевание чаще всего бактерийного происхождения; п… - НУКЛЕОПРОТЕИДЫ
НУКЛЕОПРОТЕИДЫ (нуклеопротеины), сложные белки, в к-рые в качестве небелковой части (простетической группы) входят нукл… - БУРОВОЙ КОЛОДЕЦ
БУРОВОЙ КОЛОДЕЦ, название буровой скважины (см.), имеющей назначение добывать из глубоких подземных пластов (горизонтов… - ЛИТРЕ ГРЫЖА
ЛИТРЕ ГРЫЖА, см. Меккелев дивертикул. \ ЛИТРЕ ЖЕЛЕЗЫ (Littre) расположены в слизистой уретры, хорошо развиты у \ мужчин… - ГИДРОТЕРАПИЯ
ГИДРОТЕРАПИЯ, или водолечение (от греч. hydor — вода и therapeia — лечение), воздействие на здоровый и больной организм…
medencped.ru
Буферность или буферизация | Акваловер
Буферность или буферизация — это способность воды реагировать на изменения ее химического состава (в основном под воздействием внешних факторов) без скачков pH. Еще эту особенность воды называют способностью «противостоять» внешним воздействиям.
Между общей жесткостью воды и буферизацией существует связь.
Общая жесткость — это преимущественно продукт ионов кальция и магния, а буферизация обеспечивается ионами бикарбоната (гидрокарбоната) и карбоната (ионами углекислой соли).
Буфер воды можно представить как большую губку, и чем больше способность воды буферизовать кислоту, тем больше эта губка.
Какая буферизация необходима аквариуму?
Чем выше карбонатная жёсткость воды КН (то есть, чем больше нарисованная нами губка-буфер), тем более устойчива вода к любым колебаниям уровня рН. Поэтому, уровень КН воды аквариума должен быть достаточно высоким, чтобы предотвратить скачки рН, случающиеся время от времени по независящим от аквариумиста причинам. При КН менее 4.5°, необходимо уделять значительное внимания уровню рН (то есть, периодически измерять его и реагировать на скачки) до тех пор, пока не будет полной уверенности в его стабильности.
Буферизация имеет как положительные, так и отрицательные стороны. Плюсом является то, что во время азотного круга буфер заботится о постоянстве рН. Минус буферизации состоит в том, что жесткая вода почти всегда — превосходный буфер, и, если рыбкам противопоказана повышенная жёсткость, то снижать её бывает довольно трудно при устоявшемся буфере. Стоит отметить, что несмотря на плюсы воды с хорошим буфером, многим рыбам и растениям она противопоказана: жить в такой воде рыбы еще смогут, а вот размножаться — нет.
Если не учитывать буферную емкость воды, то попытки изменить показатель pH в аквариуме обречены на неудачу. Таким образом, при снижении рН, обязательно следует отслеживать и менять и карбонатную жесткость.
Буферизация часто ассоциируется со щёлочностью, но следует различать такие понятия как щелочность воды и щелочная среда. Щелочность способствует лучшей буферизации, а щелочная среда — это среда, в которой щелочь несколько преобладает над кислотой. При щелочной среде уровень рН чуть больше нейтрального, то есть, выше 7. Но не больше 8. В то время как щёлочность — это состояние воды, где рН более 8 и существуют прекрасные условия для хорошей буферизации (стабилизации) рН.
Буферная емкость — это способность воды сохранить уровень pH устойчивым при добавлении, как кислоты, так и щелочи в воду. Буферная емкость и pH взаимосвязаны друг с другом; хотя можно было бы предположить, что добавление равных частей кислоты и нейтральной воды приведет к изменению pH в сторону кислой воды, но это случается на практике достаточно редко. Если вода имеет хороший уровень буферизации, то буферная емкость воды поглощает и нейтрализовывает добавленную кислоту, без значительного изменения уровня pH.
Буфер действует подобно большой пористой губке: при добавлении кислоты губка поглощает ее и не дает измениться уровню pH. Емкость губки не безгранична, и как только буферная емкость исчерпывается, pH начинает сильно изменяться при дальнейшем добавлении кислоты.

www.aqualover.ru
Буферные свойства — Подскажите, пожалуйста, БУФЕРНЫЕ СВОЙСТВА ВОДЫ, а то ничего толкового не нашла… — 22 ответа
В разделе Домашние задания на вопрос Подскажите, пожалуйста, БУФЕРНЫЕ СВОЙСТВА ВОДЫ, а то ничего толкового не нашла… заданный автором Инна лучший ответ это буферизация – временное накопление и хранение информации.. .
поищите про то как вода накапливает информацию )
Привет! Вот подборка тем с ответами на Ваш вопрос: Подскажите, пожалуйста, БУФЕРНЫЕ СВОЙСТВА ВОДЫ, а то ничего толкового не нашла…
Ответ от черносотенный[гуру]
На первый взгляд кажется, что при добавлении в воду кислоты или щелочи величина рН будет изменяться пропорционально количеству подлитых растворов с иным значением рН. Но это не так для природной воды. Если вы начнете по каплям добавлять в воду с рН7 раствор фосфорной кислоты, то, вопреки ожидаемому уменьшению величины водородного показателя, значение рН долгое время будет оставаться постоянным или почти постоянным. Затем, после добавления довольно большого количества кислоты, величина водородного показателя начнет резко падать и каждая новая капля будет снижать это значение. То же самое можно увидеть и при добавлении в воду щелочи. Такая инерция к изменению величины водородного показателя при добавлении кислот или щелочей называется буферностью. Если раствор ведет себя подобным образом, то говорят, что он обладает буферными свойствами.
Дистиллированная вода буферными свойствами не обладает. Подливая в нее кислоту, вы увидите, что значение рН уменьшается. А вот вода из реки или аквариума ведет себя как хороший буферный раствор. Таким “поведением” вода обязана солям жесткости. 6 общем случае буферными свойствами обладают растворы слабой кислоты и ее же соли. В речной или аквариумной воде такую пару составляют угольная кислота и гидрокарбонаты, или, иными словами, соли временной жесткости.
Величину буферности не измеряют, говорят лишь о более или менее выраженной буферности. Об этом свойстве природной воды аквариумисты заговорили совсем недавно, хотя с проблемами, связанными с нарушением этого свойства, в аквариумной практике сталкиваются довольно часто. Понимание того, что такое буферность и как это свойство влияет на другие параметры в водоеме, необходимо, если вы хотите добиться успехов в создании декоративных аквариумов с растениями. Одна из наиболее частых неприятностей, поджидающих растениеводов, связана как раз с разрушением буферной системы в аквариумной воде. Происходит это следующим образом: растения на свету поглощают углекислый газ в процессе фотосинтеза. Когда свободная углекислота, растворенная в воде, заканчивается, большинство растений знает, как найти себе углерод другим способом: они поглощают углекислый газ, полученный при расщеплении ионов НСО3+, которые водят в состав солей временной жесткости: Са (НСО3)2 -> СаСО3 + СО2 + Н2О.
Ответ от 2 ответа[гуру]
Привет! Вот еще темы с нужными ответами:
Буферные системы крови на Википедии
Посмотрите статью на википедии про Буферные системы крови
Ответить на вопрос:
22oa.ru
ИЗМЕНЕНИЕ рН ВОДЫ, БУФЕРНАЯ СИСТЕМА
- Подробности
Просмотров: 2910
Процесс жизнедеятельности гидробионтов сопровождается закислением среды, подробнее
этот вопрос будет рассмотрен ниже. В некоторых рыбоводных установках снижение рН прини-
мает опасные для культивируемых видов формы. Так, например, нормой работы замкнутых по
воде установок является снижение рН до 6 – 6,5 при значение рН подпиточной воды 7 – 8. При
непринятие мер рН снижается до опасных значений.
Природные воды располагают собственной буферной системой, определенным образом га-
сящей рост концентрации ионов водорода. Буферные свойства воды определяются растворен-
ной в ней двуокисью углерода СО2 с образованием угольной кислоты Н2СО3. Эта слабая кисло-
35
та взаимодействует с карбонатосодержащими породами СаСО3 с образованием бикарбоната
Са(НСО3)2.
Бикарбонат диссоциирует с образованием водородных и карбонатных ионов. Весь процесс
растворения углерода в воде описывается серией уравнений
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3
– ↔ Н+ + СО3
2-. /15/
Эти химические реакции во многом зависят от концентрации ионов водорода. С повышени-
ем концентрации ионов водорода (снижение рН) реакция сдвигается влево. Однако, эта хими-
ческая система обладает буферностью, она сопротивляется любым изменениям концентрации
ионов водорода. При добавление ионов водорода частная реакция
Н+ + НСО3
– ↔ Н+ + СО3
2- /16/
остается относительно стабильной, поскольку в обеих частях содержатся ионы Н+. Сдвиг ре-
акции влево компенсирует добавление ионов водорода. Поскольку концентрация угольной ки-
слоты в частной реакции (уравнение 16) увеличилось, то это приводит к частичной диссоциа-
ции угольной кислоты с образованием воды и углекислого газа
СО2 + Н2О ↔ Н2СО3. /17/
Происходит сдвиг реакции влево, при этом наблюдается уменьшение концентрации бикар-
боната в воде (НСО3
-). В результате реакций большая часть ионов водорода будет связана в Н2О
и НСО3
-.
Если вода контактирует с карбонатными отложениями СаСО3, то пополнение утраченного
бикарбоната (НСО3
-) произойдет за счет диссоциации карбонатных отложений
CaCO3 ↔ Ca2+ + CO3
2-, /18/
CO3
2- + H+ ↔ HCO3
-.
С целью стабилизации рН водных систем, например, аквариумов, в воду вносят материалы,
содержащие СаСО3: раковины моллюсков, мраморную крошку и т.п.
В воде океанов рН поверхностных вод обычно находится в пределах 7,8 – 8,3, то есть имеет
щелочную реакцию. Этим объясняется наличие прочных раковин у морских моллюсков. В кис-
лых водах пресных водоемов раковины растворяются.
В природных водах озер рН изменяется от 6 до 9. Под влиянием вулканических кислот рН
может снизиться до 1,7, что часто случается в зонах активной вулканической деятельности
(Камчатка, Курилы). Если питающие хозяйство воды текут по известковым отложениям, то рН
может достигнуть значения 9. Чаще всего это бывает в артезианских источниках.
Буферные свойства воды оцениваются по ЩЕЛОЧНОСТИ ВОДЫ, тесно связанной с карбо-
натной жесткостью воды. Щелочность (ее обозначают символом А1к) выражает концентрацию
анионов слабых кислот (угольной, борной, фосфорной и др.), связанных с сильным основанием.
Щелочность вычисляется по формуле:
HCO3
– в мг/л СО3
2- в мг/л
А1к = –––––––––––– + ––––––––––––, (мг-экв/л). /19/
61 24
Связь между рН воды и формами углерода, входящими в буферную систему пресной воды,
приведена на рис.18.
Рис.18. Графическая связь pH и форм углерода в пресной воде.
Если в замкнутых по воде рыбоводных установках буферные свойства подпиточной воды
невысоки, то для стабилизации рН воды используется известковое молоко, получаемое при га-
шении извести СаО. При гашении СаО образуется сильное основание – гидроксид кальция
Са(ОН)2.
CaO + Н2O = Са(ОН)2 + 16 ккал /20/
На 1 кг аммиака, выделяемого гидробионтами (Nh5
+ – N), потребуется примерно 4 кг СаО.
biblio.arktikfish.com
3. Редокс-буферность природных вод
висит от рН раствора. В связи с этим для характеристики природных вод строятся диаграммы в координатах ре– — рН.
Окислительно-восстановительныесвойства природных вод зависят также от парциального давления кислородаPO и водорода атмосферыPH. При достаточно большом давленииPO вода способна окисляться по уравнению
2Н2О = О2 + 4Н+ +4е–.
Окислительная граница устойчивости воды определяется уравнением pе– = 20,8 + 0,25lgPO – pH.
Вода может восстанавливаться по уравнению
2Н2О + 2е– = Н2 +2ОН–.
Восстановительная граница устойчивости воды определяется уравнением
ре– = lgK + 0,5lgPH – pH.
Следует отметить, что разложение воды по вышеприведенным уравнениям, несмотря на то, что она термодинамически разрешена, в природных водах практически не происходит. Причиной этого являются высокая энергия активация реакций и, соответственно, низкая скорость процесса. Скорость процесса может быть увеличена, но требуется катализатор, которого в природе нет.
Наряду с редокс-уровнемре– природные воды характеризуются понятиемредокс-буферности (редокс-емкости).Это аналог понятиякислотно-основнойбуферности. Система является забуференной относительноредокс-процессов,если в ней присутствуют соединения, способные окисляться или восстанавливаться, что является препятствием для существенных измененийре– при добавлении окислительных или восстановительных реагентов (небольших количеств). На основе научных исследований было установлено, что если в системе «водный раствор — газ» есть свободный кислород, величинаре– остается достаточно высокой, причемредокс-уровеньсистемы слабо зависит от концентрации кислорода. Поэтому в природных водах, контактирующих с атмосферой или почвенным воздухом, значениере– остается высоким.
Таким образом, природные воды обладают буферной редокс-емкостью,обусловленной присутствием кислорода в равновесном с ним воздухе. Однако если контакт природных вод с воздухом будет нарушен, торедокс-состояниеводы резко изменяется — снижается, и в системе могут инициироваться окис-лительно-восстановительныереакции без участия кислорода воздуха, а с участием кислородсодержащих соединений и бактерий.
Выводы
• Окислительно-восстановительныереакции играют исключительно важную роль в природных водоемах, поскольку качество природных вод в значительной степени зависит от видаокислительно-восстановительныхреакций,
62
studfiles.net
ИЗМЕНЕНИЕ рН ВОДЫ, БУФЕРНАЯ СИСТЕМА
- Подробности
Просмотров: 2911
Процесс жизнедеятельности гидробионтов сопровождается закислением среды, подробнее
этот вопрос будет рассмотрен ниже. В некоторых рыбоводных установках снижение рН прини-
мает опасные для культивируемых видов формы. Так, например, нормой работы замкнутых по
воде установок является снижение рН до 6 – 6,5 при значение рН подпиточной воды 7 – 8. При
непринятие мер рН снижается до опасных значений.
Природные воды располагают собственной буферной системой, определенным образом га-
сящей рост концентрации ионов водорода. Буферные свойства воды определяются растворен-
ной в ней двуокисью углерода СО2 с образованием угольной кислоты Н2СО3. Эта слабая кисло-
35
та взаимодействует с карбонатосодержащими породами СаСО3 с образованием бикарбоната
Са(НСО3)2.
Бикарбонат диссоциирует с образованием водородных и карбонатных ионов. Весь процесс
растворения углерода в воде описывается серией уравнений
СО2 + Н2О ↔ Н2СО3 ↔ Н+ + НСО3
– ↔ Н+ + СО3
2-. /15/
Эти химические реакции во многом зависят от концентрации ионов водорода. С повышени-
ем концентрации ионов водорода (снижение рН) реакция сдвигается влево. Однако, эта хими-
ческая система обладает буферностью, она сопротивляется любым изменениям концентрации
ионов водорода. При добавление ионов водорода частная реакция
Н+ + НСО3
– ↔ Н+ + СО3
2- /16/
остается относительно стабильной, поскольку в обеих частях содержатся ионы Н+. Сдвиг ре-
акции влево компенсирует добавление ионов водорода. Поскольку концентрация угольной ки-
слоты в частной реакции (уравнение 16) увеличилось, то это приводит к частичной диссоциа-
ции угольной кислоты с образованием воды и углекислого газа
СО2 + Н2О ↔ Н2СО3. /17/
Происходит сдвиг реакции влево, при этом наблюдается уменьшение концентрации бикар-
боната в воде (НСО3
-). В результате реакций большая часть ионов водорода будет связана в Н2О
и НСО3
-.
Если вода контактирует с карбонатными отложениями СаСО3, то пополнение утраченного
бикарбоната (НСО3
-) произойдет за счет диссоциации карбонатных отложений
CaCO3 ↔ Ca2+ + CO3
2-, /18/
CO3
2- + H+ ↔ HCO3
-.
С целью стабилизации рН водных систем, например, аквариумов, в воду вносят материалы,
содержащие СаСО3: раковины моллюсков, мраморную крошку и т.п.
В воде океанов рН поверхностных вод обычно находится в пределах 7,8 – 8,3, то есть имеет
щелочную реакцию. Этим объясняется наличие прочных раковин у морских моллюсков. В кис-
лых водах пресных водоемов раковины растворяются.
В природных водах озер рН изменяется от 6 до 9. Под влиянием вулканических кислот рН
может снизиться до 1,7, что часто случается в зонах активной вулканической деятельности
(Камчатка, Курилы). Если питающие хозяйство воды текут по известковым отложениям, то рН
может достигнуть значения 9. Чаще всего это бывает в артезианских источниках.
Буферные свойства воды оцениваются по ЩЕЛОЧНОСТИ ВОДЫ, тесно связанной с карбо-
натной жесткостью воды. Щелочность (ее обозначают символом А1к) выражает концентрацию
анионов слабых кислот (угольной, борной, фосфорной и др.), связанных с сильным основанием.
Щелочность вычисляется по формуле:
HCO3
– в мг/л СО3
2- в мг/л
А1к = –––––––––––– + ––––––––––––, (мг-экв/л). /19/
61 24
Связь между рН воды и формами углерода, входящими в буферную систему пресной воды,
приведена на рис.18.
Рис.18. Графическая связь pH и форм углерода в пресной воде.
Если в замкнутых по воде рыбоводных установках буферные свойства подпиточной воды
невысоки, то для стабилизации рН воды используется известковое молоко, получаемое при га-
шении извести СаО. При гашении СаО образуется сильное основание – гидроксид кальция
Са(ОН)2.
CaO + Н2O = Са(ОН)2 + 16 ккал /20/
На 1 кг аммиака, выделяемого гидробионтами (Nh5
+ – N), потребуется примерно 4 кг СаО.
biblio.arktikfish.com