формула, применение. Действие диоксида хлора на организм
Диоксид хлора, или ClO2, — это неорганическое соединение химического элемента Cl (хлор) с химическим элементом O (кислород). В данной статье мы очень подробно рассмотрим данное вещество, а также выясним, где его применяют, как его получают в лабораториях и промышленности, как он действует на организм.
Что такое диоксид? Отличие диоксида от оксида
Многие ученики теряются при виде слова “диоксид”, потому что в такой науке, как химия, это понятие уже немного устарело. Слово “диоксид” до сих пор можно встретить в учебниках, книгах и на просторах Интернета, но в некоторых школах уже перестали объяснять, что это такое.
Итак, все мы знаем, что такое оксид. Оксид — это соединение кислорода (O) с любым другим менее электроотрицательным химическим элементом. Оксидом является и ClO2. Диоксидом же принято называть соединение, в котором присутствует два атома O. Приставка “ди” в слове “диоксид” означает “два”.
Если вы слышите слово “диоксид”, значит в этом соединении два атома кислорода. Это поможет вам правильно записать химическую формулу соединения.
Физические свойства вещества
Диоксид хлора — это газообразное вещество, которое имеет характерный запах, а также окрас красно-желтого цвета. Но при температуре ниже 10 градусов по Цельсию вещество меняет свое агрегатное состояние и превращается в жидкость красно-коричневого цвета. При нагревании взрывается. Очень хорошо и быстро растворяется в воде. Очень хорошо смешивается и растворяется в некоторых органических растворителях, таких как уксусная и серная кислоты. Температура плавления вещества составляет -59 градусов по Цельсию, а его температура кипения — всего 9,7 градусов по Цельсию.
Получение лабораторным способом
На сегодняшний день пользуются лишь одним способом получения диоксида хлора в лаборатории — путем реакции хлората калия (KClO3) с щавелевой кислотой, которая имеет формулу H2C2O4. В результате данной реакции выделяется ClO2, а также вода и оксалат натрия.
Однако получить ClO2 можно и другим способом. Для этого существует специальная установка. Установка диоксида хлора — это полезная научная модель. Такая установка содержит в себе блок управления, реактор, насосы для передачи различных реагентов в реактор, а также различные вентили и клапаны. Для получения ClO2 используется серная кислота, растворы хлорида натрия и хлората натрия. В результате этого получается раствор диоксида хлора.

Получение промышленным способом
ClO2 ученые научились получать и промышленным способом. Для этого производят реакцию восстановления, в которой хлорат натрия восстанавливают диоксидом серы. В результате реакции выделяется диоксид хлора, получение которого мы добились, а также гидросульфат натрия.
Химические свойства вещества
У диоксида хлора есть несколько важных химических свойств. ClO2 является кислотным оксидом (он проявляет кислотные свойства, а также образует кислосодержащие кислоты). При растворении диоксида хлора в воде происходит реакция диспропорционирования, то есть образуются такие кислоты, как хлорноватая и хлористая. Если сам оксид хлора взрывается на свету, то его растворы вполне устойчивы в темноте, а на свету не взрываются, а очень медленно разлагаются.
ClO2 во многих реакциях ведет себя как оксилитель средней силы, реагирует с очень многими соединениями органической химии.
Применение
Диоксид хлора, применение которого довольно распространено по всему миру, сейчас наиболее популярен. Чаще всего данное вещество выступает отбеливателем. Оксид хлора используют, в частности, для отбеливания таких материалов, как бумага, мука и др.
Помимо этого, вещество ClO2 считается химиками одним из самых сильных антимикробных агентов во всем мире. Именно поэтому его очень часто используют для стерилизации, а также дезинфекции различных материалов. Он убивает болезнетворные микробы путем окисления, благодаря тому, что является средним окислителем. Диоксид хлора, применение которого благодаря кислотному свойству увеличилось, сейчас является незаменимым веществом.
Это вещество незаменимо в промышленности именно потому, что существует достаточно мало веществ, которые дезинфицируют материалы экономично и экологически безопасно. Дезинфекция с использование ClO2 абсолютно безопасна для окружающей нас среды. По сей день используют газообразный, а также жидкий Cl для стерилизации и обеззараживания воды. Но в последнее время, в связи с экологическими проблемами, используют самый безопасный дезинфектор — диоксид хлора. В отличие от чистого вещества хлора, известный нам ClO2 не вступает в реакции хлорирования с другими веществами и химическими элементами.
Воду, дезинфицированную хлором, нельзя не только пить, но и использовать для промывания участков кожи. Зато диоксид хлора помог решить эту проблему: он вполне безопасен, поскольку не учавствует в реакции хлорирования.

Действие диоксида хлора на организм
Диоксид хлора, его действие на организм изучается учеными несколько десятков лет. Сейчас это химическое вещество активно используется в пищевой промышленности, в качестве добавки E926. К сожалению, многие добавки E являются очень вредными, а обычным людям, потребителям продукции, мало что про них известно. Некоторые добавки, правда, безвредны, но есть особенно опасные. Диоксид хлора можно поставить посерединке: он вреден для организма человека, нежелателен, но при этом данное химическое вещество не оказывает сильных побочных действий на организм человека, в отличие от популярного сегодня глутамата натрия.
При употреблении пищи с содержанием этой добавки может появиться кашель, иногда довольно сильный и продолжительный, раздражение слизистых оболочек, астматические приступы. При попадании данного вещества в дыхательные пути может произойти раздражение легких.

Диоксид хлора — это довольно интересное вещество, которое ученые изучают уже на протяжении многих столетий. Оно незаменимо в промышленности, особенно в пищевой, является экологически безвредным и безопасным (конечно же, только при правильном использовании).
fb.ru
Мифы и заблуждения о диоксиде хлора
Что же такое диоксид хлора и в чем его отличие от хлора? В этой статье у Вас будет возможность узнать всю правду о свойствах и поведении диоксида хлора, а также о тех мифах, что его окружают.
 Является ли диоксид хлора тем же веществом, что и обычный хлор? Опаснее ли он чем распространенная перекись водорода? Является ли взрывоопасным и канцерогенным? Давайте разбираться.
Является ли диоксид хлора тем же веществом, что и обычный хлор? Опаснее ли он чем распространенная перекись водорода? Является ли взрывоопасным и канцерогенным? Давайте разбираться.
Не секрет, что в мире существует очень много заблуждений, в которые мы порой верим и даже не догадываемся, что они могут быть ложными. Такое происходит повсеместно. Например, известный во всем мире диоксид хлора часто путают с обычным хлором, считая его тем же веществом, хотя единственное, что их роднит, это само слово “хлор” в названии.
Миф: хлор и диоксид хлора – одно и то же вещество
Этот миф исходит из ложной связи между хлором и диоксидом хлора. Принцип действия диоксида хлора абсолютно отличен от обычного хлора (газообразный хлор, гипохлорит натрия и др.) и хотя они имеют схожий запах, это абсолютно разные вещества. Здесь можно провести аналогию с углеродом и углекислым газом, хотя в химической формуле и того, и другого есть молекула углерода, это абсолютно два разных вещества – твердое и газ.
При взаимодействие с водой «обычный хлор» гидролизуется с образованием хлорноватистой кислоты или так называемого «остаточного хлора», и в случае хлора именно он является дезинфектантом. Минус его заключается в том, что остаточный хлор – достаточно агрессивное вещество, которое в воде окисляет всё без разбора, образуя при этом вредные побочные продукты реакции. В случае диоксида хлора он сам по себе является дезинфектантом, при этом особенность его строения такова, что в воде он взаимодействует избирательно, благодаря чему, не образует вредных продуктов. Интересным моментом является, например, то, что диоксид хлора не разрушает озоновый слой, а газ хлора его разрушает.
Миф: диоксид хлора является коррозионным для нержавеющей стали (в высоких концентрациях)
Этот миф возник из-за некоторых способов получения диоксида хлора. В этом случае диоксид хлора получается путем смешивания основания и активатора, в результате образуются побочные продукты реакции, такие как хлористая кислота и подкисленный хлорит натрия. Именно эти побочные продукты могут вызвать коррозию нержавеющих сталей. Доказано, что сам диоксид хлора совместим с нержавеющей сталью и не коррозирует. Проведенные исследования дезинфицирующего средства Dutrion – раствора диоксида хлора, полученного из сухой формы (таблеток или порошков), показали, что в ходе реакции не образуется хлористая кислота и подкисленный хлорит, вследствие чего он безопасен и не вызывает коррозию.
Миф: диоксид хлора взрывоопасен
Диоксид хлора действительно может быть взрывоопасным, но только в очень высоких концентрациях. Концентрация, при которой применяется раствор диоксид хлора в птицеводстве, животноводстве, растениеводстве, пищевой промышленности и очистке питьевой воды, как минимум в 250 раз меньше порога взрывоопасности вещества.
Миф: диоксид хлора остается на обрабатываемых поверхностях
Это миф возник вследствие того, что обычный хлор оставляет на поверхности следы, которые требуют дальнейшего очищения, и это связано с его строением. Газообразный диоксид хлора не оставляет остатков на поверхности. Одно из первых коммерческих применений чистого диоксида хлора предназначалось для стерилизации имплантируемых контактных линз. Для того чтобы этот процесс был одобрен FDA, нужно было показать, что чистый диоксид хлора не оставляет следов.
Миф: диоксид хлора является канцерогеном
Происхождение этого мифа неизвестно, поскольку нет доказательств того, что диоксид хлора является канцерогеном. Диоксид хлора можно найти в зубных пастах и средствах для полоскания рта. Он используется для очистки питьевой воды и промывки различных фруктов, овощей и мяса, что делает претензии на статус канцерогена необоснованными.
Миф: диоксид хлора опаснее перекиси водорода
Рассмотрим мировой опыт использования диоксида хлора для обеззараживания жилых комнат, больничных палат и других помещений. Миф о том, что он более опасен, чем пар перекиси водорода исходит из обывательского заблуждения. В связи с распространением потребительского использования перекиси водорода её восприятие кажется более безопасным, чем диоксида хлора. Правда же заключается в том, что ни диоксид хлора, ни перекись водорода не являются по своей сути безопасными, так как все дезактивирующие агенты опасны и смертельны, именно поэтому они и используются для обеззараживания.
Однако газообразный диоксид хлора обладает свойствами, которые помогают снизить риск опасности для человека. Он имеет запах подобный хлору и может быть обнаружен при концентрациях даже ниже 0,1 ppm. Это помогает в случае утечки, так как персонал учреждения будет знать об утечке даже на очень низких уровнях, действуя дальше по своему усмотрению (либо прерывая процесс, либо устраняя утечку). Перекись водорода не пахнет, и любая утечка не может быть оперативно идентифицирована, из-за чего пары перекиси накапливаются в помещении, незаметно ухудшая состояние здоровья.
Другое свойство, которое также помогает в обеспечении безопасности при использовании диоксида хлора, является его статус истинного газа, благодаря чему он не конденсируется на поверхностях, и в случае чрезвычайной ситуации достаточно снизить концентрацию до безопасных уровней за 12-15 воздухообменов в комнате, приблизительно за 30 минут. При комнатной температуре перекись водорода представляет собой жидкость и поэтому конденсируется на поверхностях. Снижение концентрации в комнате занимает длительное время, так как нужно, чтобы высохли поверхности, и на это требуется минимум несколько часов. Это означает, что в случае утечки газ диоксида хлора легче удалить, сделав зону безопасной в течение 30 минут или менее, тогда как снижение концентрации перекиси водорода может занять от нескольких часов до целого дня.
Миф: газообразный хлор невозможно удержать в одном помещении
Этот миф основан на высокой проникающей способности диоксида хлора. Преимущество диоксида хлора заключается в том, что он является истинным газом при комнатной температуре. Как истинный газ, высвобождаясь, он расширяется и равномерно заполняет собою пространство. Это дает ему естественную способность контактировать со всеми поверхностями в равных концентрациях, гарантируя равный уровень дезинфекции во всем пространстве. Малый размер молекулы диоксида хлора в сочетании с этой распределительной способностью позволяет диоксиду хлора проникать в небольшие трещины и щели. Эта проникающая способность является основой мифа о том, что газообразный диоксид хлора сложно удержать. По правде говоря, диоксид хлора удерживается в помещении таким же образом, как и пары формальдегида, перекиси водорода, а также других широко используемых фумигантов. Чтобы их удержать, двери и другие отверстия герметизируются с использованием ленты или других средств.
Этот миф также связан с тем, что диоксид хлора имеет запах, а перекись водорода – нет. Из-за отсутствия запаха перекиси водорода пользователи могут не знать об утечках, как это было бы с газообразным диоксидом хлора. Этот контраст в понимании утечек может дать пользователям ложное представление о том, что диоксид хлора не удерживается так же легко, как перекись водорода, а на самом деле он просто иллюстрирует опасность перекиси водорода.
Вывод: Итак, рассмотрев самые распространённые мифы и заблуждения, связанные с диоксидом хлора, можно сделать вывод, что в большинстве своем они не соответствуют действительности. Согласно мировой практике диоксида хлора является одним из самых эффективных дезинфицирующих средств нашего времени, которое применяется повсеместно – как в Европе, так и в Америке. При этом его уникальные свойства делают его не только высоко эффективным, но и безопасным и удобным в применении.
Наша компания является официальным поставщиком всей продуктовой линейки DUTRION на территории России, Казахстана и Беларуси.
Если Вас заинтересовала данная информация, и Вы хотели бы получить экспресс-консультацию, закажите звонок прямо с сайта или отправьте нам мгновенное сообщение.
dutrion.ru
Что такое диоксид хлора?
Диоксид хлора это уникальное вещество с молекулой состоящей из одного атома хлора и двух атомов кислорода. В разбавленных растворах ClO2 существует в виде молекул стабильного радикала. Диоксид хлора в 10 раз более растворим в воде и в 2,5 раза более эффективен чем хлор. Диоксид хлора эффективен в широком диапазоне рН от 4 до 10.
Диоксид хлора обладает мощным бактерицидным, вируцидным, фунгицидным и альгицидным действием. Его мощная окислительная способность все больше используется во многих развитых странах в качестве дезинфицирующего средства для обработки воды. Стремительно развивающийся прогресс в технологии получения диоксида хлора делает его применение безопасным и более выгодным по сравнению с другими дезифектантами. Он отлично окисляет трехвалентное железо, марганец, фенолы, цианиды, нитраты, микотоксины и мн. др. но не реагирует с аммиаком. Это имеет большее значение в том, что диоксид хлора не реагирует со многими органическими соединениями и, как следствие, ClO2 не производит экологически опасных хлорорганических соединений (тригалометанов, концерогенов и т.д.). Кроме того, использование диоксида хлора способствует резкому падению хлорированных органических веществ в воде. Диоксид хлора обеззараживает бактерии, проникая в клеточную структуру.
Органические вещества в клетках и на поверхности клеточной мембраны реагируют с диоксидом хлора, в результате чего происходит нарушение клеточного метаболизма. Диоксид хлора также реагирует непосредственно с аминокислотами и РНК в клетке. Уникальность в том, что эта реакция не зависит от времени реакции или концентрации. В отличие от других дезинфицирующих средств, диоксида хлора убивает микроорганизмы, даже если они неактивны. Микроорганизмы не могут оказать сопротивление диоксиду хлора и тем самым приспособиться к его действию. Диоксид хлора убивает вирусы, предотвращая образование белка. ClO2 реагирует с пептоном, растворимое в воде вещество, которое образуется в результате гидролиза белков до аминокислот. Диоксид хлора является одним из ряда дезинфицирующих средств, эффективных против цист Giardia и Cryptosporidium Lambia, которые вызывают криптоспоридиоз в водопроводной питьевой воде, а так же опаснейшей бактерии Legionella.
Сравнительная характеристика некоторых дезинфицирующих средств
| Озон | О3 | 2,07 | 2 электрона |
| Уксусная кислота | CH3CO3H | 1,88 | 2 электрона |
| Перекись водорода | H2O2 | 1,76 | 2 электрона |
| Хлорноватистая кислота | HOCl | 1,49 | 2 электрона |
| Хлор | Cl2 | 1,36 | 2 электрона |
| Бром | Br2 | 1,07 | 2 электрона |
| Диоксид хлора | ClO2 | 0,95 | 5 электронов |
| Йод | l2 | 0,54 | 2 электрона |
| Кислород | O2 | 0,4 | 2 электрона |
Диоксид хлора и некоторые другие дезсредства являются окислителями (приемниками электронов). Однако, среди всего многообразия дезинфицирующих веществ, только диоксид хлора имеет возможность принять 5 электронов, в то время как остальные только 2. См. таблицу. Это означает, что ClO2 в 2,5 раза более эффективн.
Диоксид хлора не является дезифицирующим веществом хлорного типа. Хотя в своем названии Диоксид хлора (ClO2) имеет слово “хлор”, его химия радикально отличается от хлора (Cl). Как мы знаем, в химии средней школы, можно смешать два соединения и создать третий состав, который мало похож на своих родителей. Например, путем смешивания двух частей водорода с одной частью кислорода мы получаем жидкую форму воды. Мы не должны вводиться в заблуждение тем фактом, что у хлора и диоксида хлора есть общее слово. Эти два вещества, совершенно различны. Диоксид хлора, как правило, более мощный, проще в использовании, и более экологически чистый, чем хлорсодержащие продукты дезинфекции (Гипохлорид, Жавель, хлорамин и др.). Диоксид хлора дезинфецирующее вещество не хлорного типа, не образует свободный хлор. Благодаря уникальному строению молекулы диоксида хлора, основным действующим веществом является кислород. Диоксид хлора признан зеленой химией.
Еще одной особенностью является механизмом реакции окисления диоксидом хлора. В результате реакции происходит процесс, называемый электрофильной (электронное притягивание) абстракцией свободного радикала, а не окислительной замены или дополнения, как в процессе дезинфекции хлором или гипохлоритом. Диоксид хлора имеет эту способность благодаря своему уникальному одноэлектронному механизму обмена. Термин «окислительная сила» используется, чтобы описать, как сильно реагирует с окислителем окисляемое вещество. Озон, как правило, рассматриваются как имеющие высшую силу окисления и реагирует с каждым веществом, которое может окисляться. В практическом плане это часто нежелательно, так как количество побочных реакций может образовать опасные побочные продукты дезинфекции.
dutrion.com.ua
Диоксид хлора (CLO2) – безопасное дезинфицирующее вещество окислитель, не выделяющее активный хлор
Основным активным компонентом, входящим в состав средства Dutrion, является диоксид хлора – ClO2.
Диоксид хлора впервые был открыт в 1814 году сэром Гемфри Дэви, профессором Лондонского Королевского общества, в ходе реакции серной кислоты и хлората калия. Это соединение в водном растворе обладает желто-зеленой окраской, хорошо растворяется, является сильным окислителем и абсолютно безопасно для здоровья человека.
Диоксид хлора отличается высокими дезинфицирующими свойствами. При внедрении в клеточную оболочку бактерий и микроорганизмов ClO2 вступает в реакцию с органическими веществами клеточной мембраны, что приводит к нарушению обменных процессов. Диоксид хлора отличается специфичным механизмом воздействия, против которого клетки микроорганизмов не способны выработать защитных механизмов.
Основные физико-химические характеристики
| Агрегатное состояние | Газ |
| Цвет, запах | Зеленовато-желтый, запах резкий, схожий с хлором |
| Молекулярный вес | 67,45 г/моль |
| Температура tпл tкип |
-59°С 9,9°С |
| Растворимость в воде при нормальных условиях | 2,5 г/л |
| Восстановительно-окислительный потенциал E(ClO2/ClO2−) | 0,94 В |
| Особые свойства | Разлагается под действием высокой температуры, УФ-излучения, сильной щелочной среды (рН > 12) При концентрации в воздухе более 10% взрывоопасен |
Дезинфицирующие препараты, в основе которых лежит диоксид хлора, принадлежат к группе веществ-окислителей, не выделяющих активный хлор. По сравнению с аналогичными антисептиками, двуокись хлора оказывает более эффективное воздействие на бактерии, микроорганизмы, микробы, вирусы, водоросли и грибки в связи с высоким окислительно-восстановительным потенциалом. Оно обладает большим окислительным потенциалом по сравнению с обычным хлором, поэтому используемая концентрация данного вещества может быть значительно ниже. Одновременно с этим диоксид хлора не выделяет активного хлора в атмосферу и не коррозирует поверхности. Отличительной особенностью диоксида хлора является его полная инертность по отношению к соединениям с азотом аммиака и бромидами, в то время как озон и хлор вступают с ними в реакцию, продуктом которой является бромистоводородная кислота.
Диоксид хлора и хлор: химическая разница
Химический состав диоксида хлора, тип взаимодействия с органическими веществами и побочные продукты реакций значительно отличаются от тех же характеристик обычного хлора.
Как хлор (Cl2), так и диоксид хлора (ClO2) являются сильными окислителями, которые содержат в себе атомы – приемники электронов. В окислительно-восстановительных реакциях хлор способен принимать два электрона, в то время как диоксид хлора – пять. В диоксиде хлора электроны принимают атомы кислорода. У обыкновенного хлора, соответственно, только атомы хлора. Два вещества отличаются друг от друга в силу именно этих особенностей.
В результате реакции между молекулой хлора и органическими веществами к последним присоединяется атом хлора, что приводит к образованию токсичных хлорорганических соединений. Диоксид хлора при его использовании в качестве дезинфицирующего средства отдает органическим загрязнениям в ходе реакции атомы кислорода. В результате продуктами реакции становятся безвредные карбоновые кислоты, преобразованные из токсичных фенолов.
Вместо того чтобы соединяться с ароматическими кольцами, двуокись хлора разрушает их, поскольку действующим веществом в данном соединении выступает активный кислород.
Хлор и аналогичные ему вещества на его основе в результате дезинфекции выделяют «свободный хлор», который является биоцидным компонентом. В ходе реакции дезинфекции вещества на основе чистого хлора образуют побочные продукты, в состав которых входят эстрогенные и канцерогенные соединения, несущие опасность для здоровья человека в больших количествах.
Диоксид хлора ClO2 является наиболее безопасным соединением, аналогичным обычному хлору и веществам на его основе.
На сегодняшний день практически весь объем производимого двуокись хлора (более 95%) используется в качестве дезинфицирующего средства в системах очистки питьевой воды, отбеливающего средства для изготовления бумаги, целлюлозы, муки.
После разработки безопасного метода производства clo2 многие специалисты и ученые начали пророчить ему судьбу такого же важного дезинфицирующего средства и окислителя в мире, каким был хлор после его открытия более ста лет назад.
Согласно статистическим данным на 2014 год, диоксид используется в качестве дезинфицирующего средства во многих странах мира и применяется для очистки и дезинфекции различных материалов в разных сферах деятельности.
dutrion.ru
Диоксид хлора – это… Что такое Диоксид хлора?
У этого термина существуют и другие значения, см. Оксид хлора.
Диоксид хлора — неорганическое химическое соединение хлора и кислорода, формула: ClO2.
Физические свойства диоксида хлора
В нормальных условиях ClO2 — газ красновато-жёлтого цвета, с характерным запахом. При температурах ниже 10 °C ClO2 представляет собой жидкость красно-коричневого цвета. Малоустойчив, взрывается на свету, при контактах с окислителями и при нагревании. Хорошо растворим в воде. Теплота испарения диоксида хлора 6,3 ± 0,1 ккал/моль, критическая температура 192 °C, критическое давление 85 атм. Плотность ClO2 уменьшается от 1,973 г/см³ при −60 °C до 1,653 г/см³ при 5 °C. Диоксид хлора растворим в воде, уксусной и серной кислотах, в четырёххлористом углероде, ацетонитриле, а также в ряде других органических растворителей. Растворимость диоксида хлора возрастает с ростом полярности растворителя. Потенциал ионизации диоксида хлора равен 10,33 ± 0,02 эВ, сродство к электрону 2,378 ± 0,006 эВ. Потенциал окисления-восстановления в водном растворе — E(ClO2/ClO2−) = 0,94 В.
Оксид хлора(IV) имеет нечётное количество электронов (33) и является стабильным радикалом, не проявляющим при нормальных условиях тенденции к димеризации. В газовой фазе ЭПР спектр ClO2 не наблюдается, что объясняется большим числом вращательных уровней его молекулы. ЭПР-спектр раствора оксида хлора(IV) представляет собой широкий синглет, но при некоторых условиях (например, низких температурах) спектральная линия усложняется, превращаясь в широкий квартет вследствие сверхтонкого расщепления на ядрах хлора 35Cl и 37Cl, для которых константы сверхтонкой структуры равны 1,70 ± 0,03 и 1,37 ± 0,03 мT соответственно.
Получение
В лаборатории диоксид хлора получают по реакции хлората калия с щавелевой кислотой:
Из-за взрывоопасности диоксид хлора невозможно хранить в виде жидкости. Однако адсорбирование на поверхности силикагеля позволяет хранить диоксид хлора при пониженной температуре достаточно долго, а также избавиться от примесей хлора, силикагелем не поглощающегося.
Промышленный метод получения ClO2 основан на реакции восстановления хлората натрия диоксидом серы:
Свойства
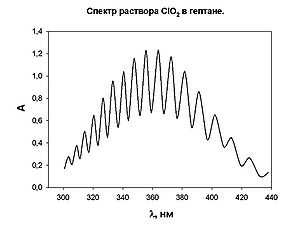 Спектр диоксида хлора в видимой и ультрафиолетовой области
Спектр диоксида хлора в видимой и ультрафиолетовой областиКислотный оксид. При растворении в воде образуются хлористая и хлорноватая кислоты (реакция диспропорционирования). Разбавленные растворы устойчивы в темноте, на свету медленно разлагаются:
Образующаяся хлористая кислота очень неустойчива и разлагается:
ClO2 реагирует со многими с органическими соединенями и выступает окислителем средней силы. Большинство реакций с участием ClO2 протекают по механизму одноэлектронного окисления с образованием органических катион-радикалов и хлорит-иона на первой стадии реакции, но возможно протекание и других реакций, в частности, реакции отрыва атома водорода.
Применение
Используется в основном для отбеливания например, целлюлозы, бумаги, муки и т. п., дезинфекции и стерилизации различных материалов.
Физиологическое действие
Диоксид хлора вызывает раздражение слизистых оболочек, вызывает кашель. ПДК в воздухе рабочей зоны 0,1 мг/м3, ЛД50 = 140 мг/кг (крысы, перорально).
Литература
- Зефиров Н.С. и др. т.5 Три-Ятр // Химическая энциклопедия. — М.: Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9
dic.academic.ru
ДИОКСИД ХЛОРА (CLO2) / DUTRION
Основным активным компонентом, входящим в состав средства Dutrion, является диоксид хлора – ClO2.
Диоксид хлора впервые был открыт в 1814 году сэром Гемфри Дэви, профессором Лондонского Королевского общества, в ходе реакции серной кислоты и хлората калия. Это соединение в водном растворе обладает желто-зеленой окраской, хорошо растворяется, является сильным окислителем и абсолютно безопасно для здоровья человека.
Диоксид хлора отличается высокими дезинфицирующими свойствами. При внедрении в клеточную оболочку бактерий и микроорганизмов ClO2 вступает в реакцию с органическими веществами клеточной мембраны, что приводит к нарушению обменных процессов. Диоксид хлора отличается специфичным механизмом воздействия, против которого клетки микроорганизмов не способны выработать защитных механизмов.
Основные физико-химические характеристики
| Агрегатное состояние | Газ |
| Цвет, запах | Зеленовато-желтый, запах резкий, схожий с хлором |
| Молекулярный вес | 67,45 г/моль |
| Температура tпл tкип | -59 ◦С 9,9 ◦С |
| Растворимость в воде при нормальных условиях | 2,5 г/л |
| Восстановительно-окислительный потенциал E(ClO2/ClO2−) | 0,94 В |
| Особые свойства | Разлагается под действием высокой температуры, УФ-излучения, сильной щелочной среды (рН > 12) При концентрации в воздухе более 10% взрывоопасен |
Дезинфицирующие препараты, в основе которых лежит диоксид хлора, принадлежат к группе веществ-окислителей, не выделяющих активный хлор. По сравнению с аналогичными антисептиками, двуокись хлора оказывает более эффективное воздействие на бактерии, микроорганизмы, микробы, вирусы, водоросли и грибки в связи с высоким окислительно-восстановительным потенциалом. Оно обладает большим окислительным потенциалом по сравнению с обычным хлором, поэтому используемая концентрация данного вещества может быть значительно ниже. Одновременно с этим диоксид хлора не выделяет активного хлора в атмосферу и не коррозирует поверхности. Отличительной особенностью диоксида хлора является его полная инертность по отношению к соединениям с азотом аммиака и бромидами, в то время как озон и хлор вступают с ними в реакцию, продуктом которой является бромистоводородная кислота.
Диоксид хлора и хлор: химическая разница
Химический состав диоксида хлора, тип взаимодействия с органическими веществами и побочные продукты реакций значительно отличаются от тех же характеристик обычного хлора.
Как хлор (Cl2), так и диоксид хлора (ClO2) являются сильными окислителями, которые содержат в себе атомы – приемники электронов. В окислительно-восстановительных реакциях хлор способен принимать два электрона, в то время как диоксид хлора – пять. В диоксиде хлора электроны принимают атомы кислорода, у хлора, соответственно, только атомы хлора. Диоксид хлора и хлор отличаются друг от друга в силу именно этих особенностей.
В результате реакции между молекулой хлора и органическими веществами к последним присоединяется атом хлора, что приводит к образованию токсичных хлорорганических соединений. Диоксид хлора при его использовании в качестве дезинфицирующего средства отдает органическим загрязнениям в ходе реакции атомы кислорода. В результате продуктами реакции становятся безвредные карбоновые кислоты, преобразованные из токсичных фенолов.
Вместо того чтобы соединяться с ароматическими кольцами, двуокись хлора разрушает их, поскольку действующим веществом в данном соединении выступает активный кислород.
Хлор и аналогичные ему вещества на его основе в результате дезинфекции выделяют «свободный хлор», который является биоцидным компонентом. В ходе реакции дезинфекции вещества на основе чистого хлора образуют побочные продукты, в состав которых входят эстрогенные и канцерогенные соединения, несущие опасность для здоровья человека в больших количествах.
Диоксид хлора (ClO2) является наиболее безопасным соединением, аналогичным обычному хлору и веществам на его основе.
На сегодняшний день практически весь объем производимого двуокись хлора (более 95%) используется в качестве дезинфицирующего средства в системах очистки питьевой воды, отбеливающего средства для изготовления бумаги, целлюлозы, муки.
После разработки безопасного метода производства ClO2 многие специалисты и ученые начали пророчить ему судьбу такого же важного дезинфицирующего средства и окислителя в мире, каким был хлор после его открытия более ста лет назад.
Согласно статистическим данным на 2014 год, диоксид хлора используется в качестве дезинфицирующего средства во многих странах мира и применяется для очистки и дезинфекции различных материалов в разных сферах деятельности.
ДИЗИНФЕКЦИЯ И ОБЕЗЗАРАЖИВАНИЕ
Под дезинфекцией подразумевают комплекс мероприятий, основной целью которых является уничтожение либо удаление возбудителей заболеваний (вирусов, грибков, плесени, бактерий) из окружающей среды и разрушение выделяемых ими токсинов. Задачей дезинфекции является уничтожение путей распространения инфекционных заболеваний.
Препарат Dutrion обладает высокими обеззараживающими и дезинфицирующими свойствами. Обуславливается это химическими особенностями основного компонента – диоксида хлора. Вещество воздействует на возбудителей заболеваний на клеточном уровне. Молекулы диоксида хлора вступают в реакцию с органическими веществами бактерий, проникая внутрь них через клеточную мембрану. В результате такого взаимодействия с РНК и аминокислотами бактерий нарушаются обменные процессы в клетках, что приводит к их гибели. Преимуществом такого типа реакций является их полная независимость как от времени воздействия, так и от количества и концентрации диоксида хлора. Основным достоинством препарата Dutrion по сравнению с аналогичными дезинфицирующими препаратами является то, что диоксид хлора разрушает клетки не только активных микроорганизмов, но и тех, которые находятся в неактивной форме. Обуславливается это особенностями протекания реакции с участием диоксида хлора: механизм взаимодействия таков, что клетки патогенных микроорганизмов не способы выработать защитные реакции против химического вещества. Препарат Dutrion эффективен при использовании против бактерий, грибков, водорослей, вирусов и аналогичных микроорганизмов, разрушая их на молекулярном и генетическом уровне.
Препарат Dutrion наиболее эффективен и в борьбе против наиболее известных и вредоносных микроорганизмов – Giardia и Cryptosporidium. Данные паразиты являются возбудителями сильных расстройств желудочно-кишечного тракта – к примеру, диареи, заболевания, которое носит как острый, так и хронический характер. Заражение происходит при употреблении некачественных консервированных продуктов питания или неочищенной питьевой воды.
В настоящее время широкое распространение получили методы использования диоксида хлора совместно с аналогичными дезинфицирующими средствами: хлором, озоном, ультрафиолетовыми лучами. Проведенные исследования показали, что комбинированное использование веществ оказывает наибольшую эффективность, чем использование таких веществ по отдельности.
Ниже приведены результаты лабораторных испытаний препаратов Dutrion с течением времени:
| БАКТЕРИИ | ||
| Pseudomonas Aeroginosa Pseudomona Specie Enterobarcer Cloaceae Enterobarcter Hafnia Proteus Vulgaris Klebsiella Pneumoniae Salmonella Typhi Salmonella Enteritidis Salmonella Gallinarum Salmonella Typhimorium Salmonella Choleraesuis Salmonella Typhosa Corynebacterium Nucleatum Sarcinae Lutae Streptococcus Pyrogenes Strep 1, 2, 3 Mycobacterium Smegmatis | Campylobacter Jejuni Flavobacterium Species Yersinia Enterolitica Clostridium Sporogenus Clostridium Dificile Clostridium Perfingens Fusobacterium Nucleatum Bacilus Subtilis Bacilus Circulans Bacilus Megatarium Bacilus Cereus Bifedibacter Liberium Staphylococcus Aureus Staphylococcus epidermia Streptococcus Faecalis Mycobacteroi Bovis Mycobacterium kansaaii | |
| ГРИБКИ | ||
| Candida Albicans Scopulariosis Species Trichophyton Mentagrophytes Mucor Species Saahromyces Cerevisiae | Trichophyton Rubrum Aspergillus Niger Aspergillus Flavus Fusarium Specie Fonsecaea Pedrosoi | |
| ВИРУСЫ | ||
| Herpes Virus I f Herpes Virus II Adenovirus Echovirus Coxsakievirus Vesicular Influenza Para Feline Parvovirus Mouse Flu Mouse Minute Virus of Mice (MVM) New Castle Disease Virus Iridovirus | Poliovirus Encephalomyocerditis (EMS) Vaccina Virus Stomatitis Virus (VSV) Influenza Bluetongue Virus Hepatitis Virus (MHV) Mouse Encephalomyelitis V Mouse Polio Virus (MEV) Pertiviries – Togaviridae | |
| Тестируемый организм | Время контакта | Результат (убивает) |
|---|---|---|
| Aspergillus fumigatus spores | 60 сек | 99,9999% убивает |
| Bacillus cereus Spores | 5 мин | 99,999% убивает |
| Candida albicans | 60 сек | 99,99999% убивает |
| Canine Parvovirus Canine Parvovirus | 10 мин | 100% вирулицидно |
| Erwinia carotovora carotovara | 60 сек | 99,999% убивает |
| Escherica coli | 60 сек | 99,9999% убивает |
| Lactobacillus sp. | 60 сек | 99,999% убивает |
| Legionella pneumophila | 60 сек | 99,999% убивает |
| Listeria monocytogenes | 60 сек | 99,9999% убивает |
| Mycobacterium bovis | 10 мин | > 6 log убивает |
| Newcastle Disease virus | 10 мин | 100% вирулицидно |
| Pediococcus spores | 60 сек | 99,999% убивает |
| Proteus mirabilis | 60 сек | > 6 log убивает |
| Pseudomonas aeruginosa | 60 сек | > 6 log убивает |
| Pseudomonas aeruginosa | 10 мин | 100% убивает |
| Pseudo rabies virus | 10 мин | 100% вирулицидно |
| Saccharomyces cerevisiae | 60 сек | 99,999% убивает |
| Salmonella choleraesuis | 10 мин | 100% убивает |
| Salmonella typhimurium | 60 сек | 99,999% убивает |
| Staphylococcus aureus | 10 мин | 100% убивает |
| Staphylococcus aureus | 60 мин | 100% убивает |
| Staphylococcus aureus | 60 сек | 99,9999% убивает |
| Staphylococcus faecalis | 60 сек | 99,9999% убивает |
| Staphylococcus faecalis | 60 сек | 99,99999% убивает |
| Staphylococcus faecium | 60 сек | 99,9999% убивает |
| Trichophyton mentagro phytes | 5 мин | 100% убивает |
ОКИСЛЕНИЕ
Окислительные реакции марганца и железа:
Диоксид хлора вступает в эффективные окислительно-восстановительные реакции с марганцем (II), окисляя его до марганца (IV). Продуктом реакции является выпадающий осадок оксида марганца. Так как хлорид-анион может вступать в реакцию с Mn (II), то всю реакцию окисления можно представить следующим образом:
2ClO2 + 5Mn2+ + 6H2O -> 5MnO2 + 12H+ + 2Cl-
Представленная реакция отличается высокой скоростью протекания и интенсивностью. Спустя пять минут после начала взаимодействия веществ более 99% оксида марганца можно удалить при помощи фильтрования раствора. Прохождению реакции способствует больше слабощелочная, чем кислая среда.
Для того чтобы окислить 1 мг марганца, понадобится 2,5 мл диоксида хлора при уровне кислотности pH >7.
Диоксид хлора вступает в эффективные окислительно-восстановительные реакции с двухвалентным железом, окисляя его до трехвалентного железа. Продуктом реакции является выпадающий осадок гидроксида железа (III). Так как хлорид-анион может вступать в реакцию с двухвалентным железом, то всю реакцию окисления можно представить следующим образом:
ClO2 + 5Fe2+ + 13H2O -> 5Fe(ОH)3 + Cl- + 11H+
Образующийся в результате реакции осадок устраняется при помощи фильтрования раствора. Способствует течению реакции либо нейтральная, либо слабощелочная среда.
Для того чтобы окислить 1 мг железа, понадобится 1,3 мг диоксида хлора при уровне кислотности pH >5.
Окисление сульфидов (сероводорода) диоксидом хлора:
Диоксид хлора с большой эффективностью применяется для очистки воды от сульфидов, в том числе сероводорода. Данные вещества встречаются практически в любой водной системе. Сульфиды отрицательно влияют на органолептические характеристики воды – вкус и запах. Выделяются сульфиды (сероводород) в процессе восстановительных реакций, протекающих при разложении бактерий и микроорганизмов и биохимическом окислении органических веществ.
Наличие сульфидов в сточных водах может стать причиной износа и коррозии трубопровода. Поражается в большинстве случаев оборудование предприятий металлургической, пищевой, химической промышленности, производства сульфатной целлюлозы.
Реакция протекает при небольшом количестве взаимодействующих веществ при уровне кислотности pH = 6,8 – 8,5. В результате реакции образуется взвесь коллоидной серы.
Представить реакцию можно следующим образом:
2ClO2 + S2- -> SO42- + 2Cl-
Для того чтобы мгновенно окислить 1 мг сероводорода, необходимо 5,2 мг диоксида хлора.
С целью удаления из воды серы, получающейся в результате течения химической реакции, необходимо провести коагуляцию и фильтрование. Чтобы устранить неприятный запах после хлорирования, воду можно пропустить через фильтры с активированным углем.
Диоксид хлора нередко используется для селективного окисления органических сульфидов до сульфоксидов. Последние широко используются в роли флотореагентов, селективных растворителей и физиологически активных веществ.
Окисление азотосодержащих соединений:
Диоксид хлора не вступает в реакции с аммиаком, однако может окислить нитрит до нитрата.
Окисление фенольных соединений:
Диоксид хлора способен вступать в окислительные реакции с органическими веществами, что широко используется в водопроводных системах с целью устранения неприятного запаха, причиной которого являются различные органические соединения и продукты их распада.
Фенольные соединения с легкостью реагируют с диоксидом хлора в случае, если они выступают в качестве феноксид-анионов (в роли депротонированного соединения). Поскольку такие соединения реагируют легче, то скорость протекания реакции во многом зависит от уровня кислотности среды, т. е. чем выше уровень pH, тем быстрее будет протекать реакция. Данная особенность диоксида хлора позволяет использовать его для улучшения органолептических свойств воды.
ПРЕИМУЩЕСТВА
 Эффективность:
Эффективность:
- Диоксид хлора отличается высоким уровнем эффективности при его использовании против бактерий, грибков, спор, водорослей.
- Оказывает длительное дезинфицирующее воздействие до 72 часов.
- Эффективно окисляет соединения железа и марганца.
- Улучшает органолептические свойства воды (вкус и запах).
- Диоксид хлора действует при уровне кислотности, варьирующемся от 4 до 11 pH, в условиях нормальной температуры. Эффективность препарата не зависит от добавления специальных реагентов с целью корректировки уровня pH.
- Экологически безопасен и наиболее эффективен при использовании с целью очистки сточных вод.
Безопасность:
- При производстве диоксида хлора не образуется побочных токсичных продуктов, оказывающих отрицательное воздействие на окружающую среду.
- В ходе использования не образует хлорфенолов и тригалометанов.
- Не вступает в реакции с соединениями азота и аминами.
- Вода, дезинфицированная диоксидом хлора, не оказывает коррозирующего воздействию на полимерные и металлические материалы.
- Не огнеопасен, безопасен в применении.
Чистота труб:
- Полностью устраняет биопленку и предотвращает ее последующий рост и развитие.
- Диоксид хлора способствует полному удалению слизи, восстанавливая работоспособность и тепловую эффективность градирен и аналогичного теплообменного оборудования. При распылении обработанной при помощи диоксида хлора воды устраняются бактерии и вирусы, распространяющиеся воздушно-капельным путем.
Простота:
- Максимальный уровень эффективности при небольших дозах вещества по сравнению с аналогичными препаратами (для дезинфекции одинакового объема воды необходима доза диоксида хлора в 10-12 раз меньшая, чем при использовании обычного хлора).
- Возможность использовать совместно с другими средствами.
- Легкость транспортировки.
Экономичность:
- Не требует больших вложений на начальном этапе использования.
- Быстро окупается благодаря высокой эффективности.
Сравнение методов дезинфекции аналогичными препаратами
Природная вода отличается как по своему физическому, так и по химическому состоянию. На состояние и состав природных вод большое влияние оказывают различные факторы, в том числе грунт, породы земли, близость стоков промышленных предприятий. На сегодняшний день используются различные методы дезинфекции и очистки воды, которые можно разделить на две категории: технические (очищающие установки и фильтры) и химические (окислители и дезинфектанты).
За последние сто лет наиболее эффективным и широко используемым средством для дезинфекции воды был обычный хлор, что обуславливалось, в первую очередь, его низкой стоимостью. Хлор в газообразном состоянии является очень токсичным веществом, а хлорамин, являющийся одним из его продуктов, даже при небольших концентрациях и количествах становится причиной серьезных проблем с легочно-дыхательной системой и слизистой оболочек.
В процессе дезинфекции воды с применением хлора в виде побочных продуктов образуются такие вещества, как гетероцикличные ароматические амины, хлороформ и трилагометаны, которые относятся к категории канцерогенных и мутагенных. Помимо этого, эффективность использования хлора как дезинфицирующего средства очень сильно зависит от уровня кислотности среды: при pH более 7,5 его действие практически сводится к нулю. После того, как были обнаружены образующиеся в результате реакций хлора токсичные органические вещества, ученые многих стран начали искать альтернативные препараты для очистки загрязненной воды. Ниже приведена таблица, в которой перечислены основные современные способы очистки воды, обладающие как своими плюсами, так и минусами.
| Dutrion (диоксид хлора) | УФ-облучение | Обычное хлорирование (гипохлорит натрия, жидкий хлор и т.д) | Озонирование |
|---|---|---|---|
| Дезинфицирующее и обеззараживающее действие | |||
| Сильный дезинфектант (эффективен против бактерий, вирусов, грибков, спор) | Дезинфицирующая активность зависит от мутности воды, ее жесткости (образования отложений на поверхности лампы), осаждения органических загрязнений на поверхности лампы, а также колебаний в электрической сети, влияющих на изменение длины волны | Дезинфектант | Очень сильный дезинфектант |
| Эффективен против вирусов | Отсутствует возможность оперативного контроля эффективности обеззараживания воды | Малоэффективен против вирусов | Эффективен против вирусов |
| Высокоэффективен против Giardia, Cryptosporidium, а также любой другой патогенной микрофлоры | Эффективен против цист (Giardia, Cryptosporidium) | Малоэффективен против Giardia и не эффективен против Cryptosporidium | Наиболее эффективен против Giardia, Cryptosporidium, а также любой другой патогенной микрофлоры |
| Обладает длительным дезинфицирующим последействием (до 72 часов) | Не обеспечивает дезинфицирующего последействия | Обладает дезинфицирующим последействием (24 часа) | Не обеспечивает дезинфицирующего последействия |
| Проникает в глубь биопленки, разрушает ее, удаляет из трубопровода и предотвращает дальнейшее ее развитие | Образование биопленки усиливается при отключении ультрофиолетовых ламп или при малой дозе облучения | Неэффективен в удалении биопленки | Неэффективен в удалении биопленки |
| Требуется меньшая доза реагента по сравнению с другими дезинфектантами (0,05-0,5 мг/л) | Высокая доза дезинфекции 1-2 мг/л | Дозы озона, в зависимости от состава обрабатываемой воды, составляют от 0,5 до5 мг/л | |
| Окислительные свойства | |||
| Сильный окислитель | Окислитель | Очень сильный окислитель | |
| Быстро окисляет железо и марганец | Медленное окисление марганца и железа | ||
| Разрушает органические соединения (фенолы) | Разрушает органические соединения (фенолы) | ||
| Хорошо окисляет серододород, фенол, меркаптаны, цианиды пестициды и другие | Не окисляет или плохо окисляет серододород, фенол, меркаптаны, цианиды пестициды и другие | ||
| Побочные (опасные) продукты реакции | |||
| Не образует хлорсодержащих тригалометанов | Не образует хлорсодержащих тригалометанов | Образование побочных продуктов дезинфекции – тригалометанов (ТГМ) | Не образует хлорсодержащих тригалометанов |
| Бромид не окисляется диоксидом хлора, так что при его использовании не будет образовываться бромноватистая кислота, ион гипобромида или бромата | Не образует побочных продуктов | Образуетброматы и броморганические побочные продукты дезинфекции в присутствии бромидов | Образует побочные продукты, включающие: альдегиды, кетоны, органические кислоты, бромсодержащиетригалометаны (включая бромоформ), броматы (в присутствии бромидов), пероксиды, бромуксусную кислоту |
| Не взаимодействует с аммиаком | Взаимодействует с аммиаком с образованием хлораминов | Озон, реагируя со сложными органическими соединениями, расщепляет их на фрагменты, являющиеся питательной средой для микроорганизмов в системах распределения воды | |
| Образует хлораты и хлориты | Образует хлораты и хлориты | ||
| Органолептические свойства воды | |||
| Эффективен для удаления неприятного вкуса и запахов, не влияет на органолептические свойства воды | Не влияет на посторонние привкусы и запахи | Удаляет посторонние привкусы и запахи, но при передозировке может сам придавать воде резкий неприятный запах и вкус | Удаляет посторонние привкусы и запахи |
| Влияние различных факторов | |||
| Высокоэффективен при низких температурах и температурах выше 45°С | Малоэффективен при низких температурах и температурах выше 30 °С | ||
| Не зависит от действия рН, эффективен при рН = 4-10 | Реакционная способность сильно зависит от рН, резко уменьшается при рН более 7,5 | ||
| Хлор по своей природе имеет высокие коррозионные свойства (Коррозионная агрессивность напрямую зависит от рН.Понижение рН ведет к увеличению эффективности, но при этом к усилению коррозионного эффекта) | |||
| Простота использования, рентабельность | |||
| Начальные затраты сведены к минимуму (требуется только насос-дозаторов) | Требует больших затрат на оборудование и техническое облуживание | Средние начальные затраты на оборудование (требуются генераторы) | Требует высоких начальных затрат на оборудование |
| Требует высоких операционных (энергетических) затрат | Необходимость использования дополнительных фильтров для удаления образующихся побочных продуктов | ||
| Не требует повышенных требований к перевозке и хранению (поставляется в виде невзрывоопасных таблеток) | Не требует хранения и транспортировки химикатов | Повышенные требования к перевозке и хранению | Высокие меры предосторожности |
| Потенциальный риск здоровью в случае утечки | Значительные затраты на обучение операторов и обслуживание установок | ||
Согласно приведенным в таблице данным, наиболее эффективным дезинфицирующим средством являются препараты, созданные на основе диоксида хлора, такие как DUTRION. Многие специалисты и ученые склоняются к мнению, что за последующие двадцать лет диоксид хлора займет место хлора и станет столь же важным дезинфектантом и окислителем, каким был хлор в последние сто лет.
Препараты Dutrion представляют собой дезинфицирующее средство высокой эффективности, применяемое для очищения загрязненных вод после проведения их фильтрации. Хлор и озон после попадания в воду начинают сразу же вступать в окислительные реакции со всеми неорганическими и органическими веществами, находящимися в ней, и только после этого приступают к непосредственной процедуре дезинфекции. Механизм действия Dutrion немного отличается: препарат является селективным окислителем, который сначала уничтожает все патогенные микроорганизмы и, соответственно, реагирует и дезинфицирует воду гораздо быстрее, чем аналогичные препараты. Благодаря избирательному механизму работы для эффективной и качественной дезинфекции воды необходима значительно меньшая концентрация препаратов на основе диоксида хлора, чем при озонировании или хлорировании. Использование препарата Dutrion обеспечивает длительный остаточный эффект (до 72 часов), что позволяет продезинфицировать всю линию от начала до конца. Аналогичные препараты, к примеру, хлор не обеспечивают столь длительного остаточного воздействия, позволяя очистить линию только на 20-30%. Использование же озона и ультрафиолетовых лучей не обеспечивает никакого остаточного воздействия. Помимо этого, препараты Dutrion не вступают в реакции гидролиза, побочными продуктами которых являются токсичные вещества, к примеру, альдегиды, кетоны и ТГМ.
Преимуществом Dutrion можно назвать и то, что использование таких препаратов не требует огромных капиталовложений на начальных стадиях применения и специального оборудования – достаточно обычного насоса с дозатором. Для озонирования или ультрафиолетового облучения требуется сложное оборудование, высокие как энергетические, так и финансовые затраты, постоянное техническое обслуживание.
dutri.by
Двуокись хлора – это… Что такое Двуокись хлора?
Окси́д хло́ра(IV) (диоксид хлора) ClO2 — газ красновато-жёлтого цвета, с характерным запахом. При температурах ниже 10 °C ClO2 представляет из себя жидкость красно-коричневого цвета. Малоустойчив, взрывается на свету, при контактах с окислителями и при нагревании. Хорошо растворим в воде. Теплота испарения диоксида хлора 6.3 ± 0.1 ккал/моль, критическая температура 192°C, критическое давление 85 атм. Плотность ClO2 уменьшается от 1.973 г/см3 при –60°C до 1.653 г/см3 при 5°C. Диоксид хлора растворим в воде, уксусной и серной кислотах, в четыреххлористом углероде, ацетонитриле, а также в ряде других органических растворителей. Растворимость диоксида хлора возрастает с ростом полярности растворителя. Потенциал ионизации диоксида хлора равен 10.33 ± 0.02 эВ, сродство к электрону 2.378 ± 0.006 эВ. Потенциал окисления-восстановления в водном растворе – E(ClO2/ClO2–) = 0.94 В
Оксид хлора (IV) имеет нечетное количество электронов (33) и является стабильным радикалом, не проявляющим при нормальных условиях тенденции к димеризации. В газовой фазе ЭПР спектр ClO2 не наблюдается, что объясняется большим числом вращательных уровней его молекулы. ЭПР-спектр раствора оксида хлора (IV) представляет собой широкий синглет, но при некоторых условиях (например, низких температурах) спектральная линия усложняется, превращаясь в широкий квартет вследствие сверхтонкого расщепления на ядрах хлора 35Cl и 37Cl, для которых константы сверхтонкой структуры равны 1.70 ± 0.03 и 1.37 ± 0.03 мT соответственно
Получение
В лаборатории получают по реакции:
2KClO3 + H2C2O4 → K2CO3 + 2ClO2↑ + CO2↑ + H2O.
Из-за взрывоопасности диоксид хлора невозможно хранить в виде жидкости. Однако адсрбирование на поверхности силикагеля позволяет хранить диоксид хлора при пониженной температуре достаточно долго, а также избавиться от примесей хлора, силикагелем не поглощающегося.
Промышленный метод получения ClO2 основан на реакции:
2NaClO3 + SO2 + H2SO4 → 2NaHSO4 + 2ClO2↑.
Свойства
Кислотный оксид. При растворении в воде образуются хлористая и хлорноватая кислоты (реакция диспропорционирования). Разбавленные растворы устойчивы в темноте, на свету медленно разлагаются:
- 2ClO2 + H2O → HClO2 + HClO3.
Образующаяся хлористая кислота очень неустойчива и разлагается:
- 5HClO2 → 3HClO3 + Cl2↑ + H2O.
ClO2 реагирует со многими с органическими соединенями и выступает окислителем средней силы. Большинство реакций с участием ClO2 протекают по механизму одноэлектронного окисления с образованием органических катион-радикалов и хлорит-иона на первой стадии реакции, но возможно протекание и других реакций, в частности, отрыва атома водорода.
Применение
Используется в основном для отбеливания и стерилизации различных материалов, например, целлюлозы, бумаги, муки и т. п.
Физиологическое действие
Высоко токсичен и опасен для окружающей среды.
Wikimedia Foundation. 2010.
dic.academic.ru