Дейтерий и тритий: водород, да не тот
Прошло более 85 лет с момента открытия тяжёлых изотопов водорода, тем не менее интерес к ним с каждым годом возрастает. Они дают надежду на выход из энергетического кризиса, но вместе с тем могут поставить под угрозу существование всего живого на нашей планете. Эту опасность человечество ощутило ещё полвека назад.Натурные макеты атомной и водородной (на переднем плане) бомб в Музее ядерного оружия (г. Саров). Фото Александра Семёнова.
Соотношение тяжёлой и лёгкой воды в природной смеси. Фото Александра Семёнова.
Студент РХТУ Борис Иванов (слева) проходит практику в тритиевом отделе АО «ВНИИНМ». Справа — автор статьи. Фото: АО «ВНИИНМ».
Стеклянный баллон вакуумной установки, потемневший от многолетнего воздействия бета-излучения трития. Фото: АО «ВНИИНМ».
Радиолюминограмма образца нержавеющей стали, экспонированного в тритии. Разным цветом показаны участки, содержащие различное количество этого изотопа. Фото: АО «ВНИИНМ».
‹
›
В 1931—1932 годах американский физикохимик Гарольд Юри и его коллеги сумели выделить из обыкновенного, всем известного водорода необычную фракцию. Водород из этой фракции имел большие атомный вес и плотность, давал в эмиссионном спектре ранее незнакомые линии, напоминающие классические линии спектра водорода, но в то же время немного смещённые. Это означало, что в природном водороде присутствуют атомы нескольких сортов, отличные по своим свойствам. Так был открыт первый из тяжёлых изотопов водорода — дейтерий. Вскоре в чистом виде была получена «тяжёлая вода» — оксид дейтерия. Она имела на 10% бóльшую плотность, более высокие температуры плавления и кипения, чем вода обычная, сложнее разлагалась электрическим током, что вскоре легло в основу одного из первых способов её получения. Длительный, многоступенчатый электролиз воды позволял сконцентрировать дейтерий и очистить его от лёгкого изотопа водорода.
Другой тяжёлый изотоп, тритий, открыли двумя годами позже в Кембриджском университете физики Эрнест Резерфорд, Марк Олифант и физикохимик Пауль Хартек при бомбардировке ядрами дейтерия мишеней из дейтерийсодержащих соединений. При этом исследователи впервые столкнулись с ядерным синтезом — искусственным превращением одних ядер в другие. Как оказалось, третий изотоп водорода сильно радиоактивен (период полураспада 12,32 года) и поэтому не может накапливаться в природе в сколько-нибудь значимых количествах.
За открытие дейтерия Г. Юри в 1934 году был награждён Нобелевской премией по химии.
Поначалу дейтерий производили электролитическим методом, что требовало больших затрат электроэнергии и обходилось недёшево. А реакторная наработка весовых количеств трития даже по самым скромным подсчётам должна была стоить баснословных денег. Кто бы мог тогда подумать, что через два десятка лет после их открытия в нескольких государствах мира будут работать крупномасштабные производства и дейтерия и трития! Причина такой популярности тяжёлых изотопов водорода заключалась в том, что они стали основой самого мощного из всех существовавших когда-либо видов оружия. Это оружие получило название термоядерного или водородного.
Вспоминая эпоху «холодной войны», в которую довелось родиться автору этой статьи, стоит заметить, что зловещее и практически забытое сейчас выражение «водородная бомба» долгое время было у всех на слуху и вызывало неприятный холодок в душе жителя Советского Союза. Все жили под дамокловым мечом ядерной войны, которая, как казалось, могла начаться в любой момент. В политических карикатурах журнала «Крокодил» недобрый «дядя Сэм», как правило, доставал из-за пазухи или держал в руке выразительную чёрную бомбу с эмблемой «Н», что означало «водородная», или с эмблемой «N», что означало бомбу нейтронную, представляющую более современный тип бомбы водородной. Не все понимали, что идёт речь не о самом водороде, а только о его тяжёлых изотопах, составляющих термоядерный заряд. Изобилие карикатур на эту тему привело к тому, что атомные и водородные бомбы часто попадали в детские рисунки и были причиной многих детских страхов.
В чём же секрет небывалой мощи, скрытой в тяжёлых изотопах водорода? Он заключён в высоком энергетическом эффекте реакции слияния ядер дейтерия и трития и в рекордно малой величине энергетического барьера, который необходимо преодолеть, чтобы их ядра слились. Если обычный урановый или плутониевый ядерный заряд использовать для поджигания термоядерной реакции, то его энергию можно усилить в 600 раз и более. Большое достоинство такого заряда состоит в том, что дейтерий и тритий при слиянии не только не дают долгоживущих радиоактивных продуктов, но и способствуют более полному сгоранию самого ядерного запала. И значит, термоядерное оружие при его использовании наносит значительно меньший экологический урон, оставляя меньшее радиоактивное заражение местности, чем ядерное оружие той же мощности. Это открывало не только военные, но и мирные перспективы его использования — при сооружении подземных ёмкостей-хранилищ газа, при тушении пожаров на нефтяных скважинах, а также для быстрого и относительно безопасного создания искусственных котлованов и каналов серией небольших термоядерных взрывов.
Абсолютным рекордсменом среди всех видов взрывных устройств, когда-либо созданных человеком, следует назвать советскую водородную бомбу АН602, которая была испытана 30 октября 1961 года на ядерном полигоне «Сухой Нос» архипелага Новая Земля. С лёгкой руки Генерального секретаря Компартии СССР Н. С. Хрущёва эта бомба вошла во Всемирную историю под названием «Кузькина мать». Кроме того, по аналогии с Царь-пушкой и Царь-колоколом этот заряд часто называют «Царь-бомбой». Разработана она была под руководством академика АН СССР И. В. Курчатова. Её измеренная мощность в тротиловом эквиваленте составила 58,6 мегатонны.
Сколько же тяжёлых изотопов водорода в природе? Дейтерия в природе не так уж и мало. Его концентрация относительно протия составляет около 0,016% ат., но, учитывая широкую распространённость самого водорода, запасы дейтерия можно считать неисчерпаемыми. Наибольшие его количества находятся в Мировом океане; концентрация дейтерия в океанической воде также заметно выше, чем в водах рек, вследствие фракционирования изотопов воды в атмосферном водяном цикле (см. «Наука и жизнь» № 5, 2011 г., статья «Изотопная «дактилоскопия» для Шерлока Холмса»). Дейтерия в водах Мирового океана содержится даже больше, чем таких химических элементов, как фтор и йод. Природные вариации соотношения изотопов дейтерия и протия изменяются в диапазоне от 5500 до 11 000 атомов лёгкого водорода на один атом тяжёлого — это своеобразный рекорд среди природных вариаций всех стабильных изотопов. Наименьшие концентрации дейтерия наблюдаются в ледниках Антарктики, а наибольшие — в закрытых водоёмах пустыни Сахара.
Трития в природе в десятки и сотни триллионов раз меньше, чем дейтерия. Из-за радиоактивного распада тритий практически отсутствует в объектах, изолированных от атмосферы, например в углеводородах нефти и природного газа. Естественная наработка трития на Земле постоянно происходит при воздействии космических лучей на ядра азота и кислорода в верхних слоях атмосферы, поэтому наиболее богаты природным тритием осадки: дождь и снег. Такая естественная наработка трития находится в равновесии с его распадом и составляет не более 7 кг на весь земной шар.
Во второй половине ХХ века количество трития в природе многократно возрастало в период интенсивных испытаний термоядерного оружия. Так, при взрыве водородной бомбы мощностью одна мегатонна образуется и попадает в окружающую среду до 2 кг трития. За всё время наземных и воздушных испытаний термоядерного оружия в атмосфере накапливались сотни килограммов трития. После их запрета количество трития в земной атмосфере заметно снизилось за счёт его радиоактивного распада и сейчас не превышает десятков килограммов. Важный источник поступления трития в окружающую среду — атомные электростанции, которые ежегодно вырабатывают килограммы трития (сопоставимо с его природной наработкой). Из этого количества в окружающую среду попадает не более одной седьмой части.
Как разделить изотопы водорода? Известный учёный и публицист академик И. В. Петрянов-Соколов в конце 1960-х годов, проведя несложные математические выкладки, показал, насколько утопичен миф о «накоплении тяжёлой воды» в чайнике при длительном кипячении. Чтобы получить хотя бы литр воды с обогащением по дейтерию всего в 10 раз больше природного, пришлось бы испарить такое её количество, масса которого во много раз превышает массу всей Солнечной системы. Причина — близость физико-химических свойств обычной и дейтериевой воды, малая величина коэффициента разделения этих изотопов при дистилляции. Эффективность разделения может быть значительно повышена, если использовать многоступенчатые противоточные процессы. Наиболее освоены и промышленно реализованы такие методы получения дейтерия, как ректификация жидкого водорода, двухтемпературный сероводородный метод, и метод, основанный на химическом обмене в системе «вода—водород». При получении концентрированного трития приходится считаться с его радиоактивностью. В этом случае могут быть применены лишь те методы, в которых водород присутствует в молекулярном виде, так как и вода и сероводород, содержащие тритий, сильно разлагаются вследствие авторадиолиза. При получении дейтерия в качестве исходного сырья используют природную воду. Тритий может быть получен только в реакторах, при облучении нейтронами одного из изотопов лития.
Приятно отметить, что наше предприятие, АО «ВНИИНМ» им. академика А. А. Бочвара, которое ранее называлось НИИ-9, стоит у истоков создания всех отечественных тритиевых технологий. И реакторная наработка трития, и его очистка от сопутствующих примесей, и проблемы безопасности обращения с ним — все эти вопросы были в своё время успешно решены.
С самого начала Атомного проекта СССР проблема получения трития была по значимости на втором месте после изготовления ядерного заряда. Тритий предстояло нарабатывать реакторным путём из лёгкого изотопа лития — 6Li. Решение этой задачи было поручено коллективу НИИ-9, состоявшему из специалистов разных направлений. С их помощью в Советском Союзе создали тритиевое производство и ныне действующее на ФГУП «ПО «Маяк» (г. Озёрск).
Процессы разделения изотопов водорода в нашей стране большей частью разработаны в МХТИ (ныне — РХТУ им. Д. И. Менделеева). Там же в 1934 году А. И. Бродский получил первую советскую тяжёлую воду на специально разработанной лабораторной установке. Ежегодно кафедра технологии изотопов РХТУ даёт образование десяткам специалистов в этой области.
Наибольшее количество дейтерия в нашей стране, по-видимому, наработано методом низкотемпературной ректификации*, хотя на первом этапе для этого активно использовали очень энергозатратный способ получения тяжёлой воды электролизом. Производства дейтерия были распределены по всей стране, при этом ориентировались на наличие свободной электроэнергии и на возможность использования отходящего водорода, в частности на азотно-туковых заводах**. Одно из наиболее крупных производств дейтерия существовало в городе Чирчик; тяжёлую воду производили также в Днепродзержинске, Сталиногорске, Ленинграде, Норильске, Каменке, Березниках, Горловке и во многих других городах СССР. Меньшее распространение у нас получил двухтемпературный сероводородный метод производства тяжёлой воды, реализованный в городе Алексине, в то время как в мировом масштабе это один из основных методов её получения.
Исторически первой страной, производившей тяжёлую воду в крупнотоннажных масштабах, была Норвегия. Это связано с наличием в ней большого количества избыточной электроэнергии, необходимой для электролитического производства D2O. Принято считать, что если бы гитлеровская Германия получила в своё распоряжение запасы норвежской тяжёлой воды, то вполне могла бы успеть создать до своего разгрома собственное ядерное оружие. К счастью, этого не произошло благодаря проведённой спецоперации: парóм с норвежской тяжёлой водой, предназначенной для переправки в Германию, был уничтожен. На сегодня крупнейшие производители тяжёлой воды в мире — это Индия, Китай и Иран, активно развивающие тяжеловодное направление своей атомной энергетики. Огромными запасами тяжёлой воды владеют Канада и США, которым пришлось даже остановить ряд своих предприятий из-за перепроизводства и экологических проблем. При эксплуатации тяжеловодных АЭС Канаде приходится периодически очищать теплоноситель как от протия (он мешает ядерной реакции), так и от нарабатываемого трития (повышает радиационную нагрузку на персонал). При этом Канада попутно получает до 2 кг трития в год как ценный побочный продукт эксплуатации своих тяжеловодных АЭС. Собственное тяжеловодное производство имеет Румыния.
В нашей стране тяжёлую воду и дейтерий в настоящее время производит единственное предприятие — ПИЯФ им. Б. П. Константинова в Гатчине. В качестве исходного сырья используют запасы, накопленные в СССР. Из природного сырья дейтерий у нас в стране сейчас не выделяют.
Говоря об отечественных тритиевых технологиях, нельзя не упомянуть РФЯЦ-ВНИИЭФ (г. Саров), специалисты которого многие годы занимаются этим вопросом как в рамках оборонных задач, так и для нужд фундаментальной науки. В частности, они разработали тритиевую криомишень для получения сверхтяжёлых изотопов лёгких элементов, используемую в ОИЯИ (г. Дубна) на установке АКУЛИНА***, позволившую получить пятый изотоп водорода и до сих пор востребованную в фундаментальных исследованиях.
Где же применяют тритий и дейтерий? Так уж получилось, что открытые человеком колоссальные источники энергии деления и слияния ядер изначально предполагалось использовать для разрушения, и лишь потом было освоено их мирное использование. Кроме того, есть немало сфер применения этих изотопов, вообще не связанных с реакцией термоядерного синтеза.
Один из основных отечественных потребителей трития и производителей тритиевой продукции — ФГУП «ВНИИА им. Н. Л. Духова». На этом предприятии разрабатывают и производят нейтронные генераторы — ускорительные устройства, в которых ядра дейтерия, ударяясь в мишень, вступают в ядерную реакцию с содержащимся в ней тритием. При этом выделяющиеся нейтроны имеют постоянную энергию 14,1 МэВ, а само устройство очень удобно в эксплуатации. При отсутствии ускоряющего напряжения нейтроны не излучаются (в отличие от радиоизотопных нейтронных источников), а радиоактивный тритий находится внутри нейтронной трубки и в таком виде практически безопасен (его мягкое бета-излучение не способно пробить даже лист бумаги).
Нейтронные генераторы используются везде, где требуются компактные автономные источники нейтронов. Очень востребованы они у геологов, которые используют их при гео-физическом исследовании скважин методом нейтронного каротажа. (Слово «каротаж» происходит от французского слова «carotte» — морковь, что объясняется сходством формы керна, извлекаемого из земли, с морковью.) Метод нейтронной активации при этом позволяет оперативно получить полную информацию о химическом составе всех горных пород по глубине скважины, просто опустив в неё нейтронный зонд с детектором. Нейтронный генератор, изготовленный во ВНИИА, есть даже на марсоходе «Curiosity» («Кьюриосити»; в переводе с английского означает «любопытство»), в составе прибора ДАН (Детектора альбедных нейтронов), созданного в ИКИ РАН. Главная задача этого прибора — поиск воды на Марсе под толщей грунта, и уже имеются первые положительные результаты. ВНИИНМ внёс свой вклад в этот международный проект, поставив для ВНИИА мишени, насыщенные тритием.
То, что тритий является мягким бета-излучателем с высокой радиоактивностью, обусловливает его использование в радиоизотопных источниках света и электроэнергии. Во многих часах и приборах со светящимися стрелками применяют люминофоры, активированные тритием. Тритиевая подсветка на оружейных прицелах существенно повышает точность стрельбы в ночное время.
Сейчас АО «ВНИИНМ» по заказу Роскосмоса и под руководством ООО «Солар-Си» принимает участие в разработке отечественного бета-вольтаического источника питания на основе трития — «тритиевой батарейки». Этот источник питания нужен в тех ответственных узлах, где требуется стабильное бесперебойное электроснабжение в течение многих лет. Его создание решит актуальный вопрос импортозамещения, поскольку аналогичных источников электропитания Россия в настоящее время не производит.
Наибольшие количества дейтерия потребляются атомной энергетикой. Содержащая его тяжёлая вода — один из наилучших замедлителей нейтронов, настолько эффективный, что позволяет «зажечь» реакцию деления ядер даже в уране с природным обогащением по изотопу U-235, тогда как все остальные типы ядерных реакторов требуют обогащённого урана. Использование тяжёлой воды в качестве замедлителя позволяет повысить и степень выгорания ядерного топлива. По этому пути пошла атомная энергетика Канады, которая производит для себя и строит по всему миру на заказ тяжеловодные реакторы CANDU.
И дейтерий и тритий активно применяют при производстве меченых соединений. В этой продукции заинтересованы в первую очередь биологи и медики, которые с помощью изотопной метки определяют механизмы биохимических реакций. У нас меченные тритием соединения традиционно производят в Институте молекулярной генетики РАН.
Самая заманчивая перспектива использования дейтерия и трития — создание управляемой термоядерной реакции. Если это удастся, человечество будет иметь в своём распоряжении неисчерпаемый источник энергии. К сожалению, эта задача оказалась чрезвычайно сложной. Более полувека в мире ведутся разработки в этой области, но всё равно мы очень далеки от создания такого термоядерного реактора, который производил бы энергии больше, чем потреблял. В настоящее время весь мир с надеждой смотрит на международный термоядерный реактор ИТЭР, создаваемый в городе Кадараш на юге Франции. С его помощью физики надеются приблизиться к созданию энергетики, использующей энергию слияния ядер трития и дейтерия, а в перспективе перейти к использованию одного дейтерия, чьи ядра могут взаимодействовать между собой.
В своё время на нашем предприятии пересказывали забавную историю, как один из вновь назначенных чиновников, проходя по территории ВНИИНМ, потребовал, чтобы ему «показали тритий», и был очень возмущён тем, что этого не сделали. Ему объясняли, что тритий — это газ, который прозрачен и потому невидим, тем не менее новый босс сурово резюмировал: «Что-то у вас здесь нечисто!». Давайте попытаемся понять, можно ли изотопы водорода «увидеть»?
Что касается трития, то, несомненно, да — можно, и без всяких дополнительных устройств. В концентрированном виде этот изотоп водорода даёт голубое свечение вследствие самоионизации. Поток бета-излучения трития способен при длительном контакте изменить цвет стекла, он вызывает потемнение эмульсии фотопластинок, на чём основан классический метод авторадиографического анализа, в котором по интенсивности потемнения фотоэмульсии определяют концентрацию радиоактивного изотопа. В последнее время приобретает популярность новый метод анализа трития, позволяющий визуализировать его распределение по поверхности образцов, — радиолюминография. Метод основан на образовании скрытого изображения в некоторых люминофорах под воздействием радиации. Это изображение считывается специальным лазерным сканером, причём интенсивность люминесценции пропорциональна активности образца. Концентрация трития с помощью радиолюминографии может быть представлена довольно наглядно и красочно. Радиоактивность трития даёт возможность определять даже ничтожные его количества методом жидкостной сцинтилляции, в котором определяют интенсивность свечения некоторых жидкостей, пропорциональную содержанию в них радиоактивного изотопа, и газовыми ионизационными методами, использующими свойство газовых смесей менять свои вольт-амперные характеристики при воздействии на них ионизирующего излучения. Кроме того, и дейтерий и тритий, так же как самый лёгкий из изотопов водорода протий, можно без труда «увидеть», используя современные методы атомно-эмиссионной, ИК- и масс-спектрометрии.
Не стоит забывать и об опасности, которую несут тяжёлые изотопы водорода. Самая грозная и зловещая из них скрыта в термоядерном оружии, произведённом за десятилетия «холодной войны». В своё время в прессе звучали сообщения, что мощности накопленного вооружения достаточно, чтобы неоднократно уничтожить всё живое на нашей планете. Даже малая его часть в случае использования способна вызвать глобальную экологическую катастрофу, известную под названием «ядерная зима». Несомненно, важнейшая задача всего человечества — не допустить развития такого сценария в мировой истории.
Но даже тот тритий, который не используется в вооружении, представляет для человека существенную опасность, так как является высокотоксичным радиоактивным изотопом. Риск облучения персонала, контактирующего с тритием, очень высок в связи с тем, что этот изотоп не удерживается современными фильтрующими системами защиты органов дыхания и способен проникать через кожу. При этом в форме тритированной воды тритий в 10 000 раз токсичнее, чем в виде молекулярного водорода, так как пары тритированной воды уже при комнатной температуре практически мгновенно обменивают изотопы водорода, моментально попадая за счёт этого в организм человека. Значительная часть трития при переработке радиоактивных отходов сбрасывается в атмосферу или попадает в Мировой океан. И обращение с отходами, содержащими тритий (особенно с низкоактивными, которых очень много), до сих пор представляет собой серьёзную проблему, ожидающую своего решения.
***
Кто бы мог предугадать 100 лет назад, что самый первый и самый простой из химических элементов — водород преподнесёт нам столько сюрпризов, столько радости и страхов, надежд и разочарований? Сегодня хочется верить, что все знания, полученные человечеством, будут направлены только на созидание, а не на разрушение, а изотопы водорода со своими удивительными свой-ствами помогут нам ещё не раз заглянуть в сокровенные тайники Природы и сделать немало интересных и полезных открытий.
Автор выражает благодарность Г. М. Тер-Акопьяну (ОИЯИ), А. А. Юхимчуку (РФЯЦ-ВНИИЭФ), Л. А. Ривкису, М. И. Белякову, А. Н. Букину, А. С. Аникину, Н. Е. Забировой, А. В. Лизунову и всему тритиевому отделу АО «ВНИИНМ» им. академика А. А. Бочвара, а также специалистам кафедры технологии изотопов РХТУ им. Д. И. Менделеева, особенно М. Б. Розенкевичу и Ю. С. Паку, которые оказали помощь при подготовке материала.
***
Не только тяжёлые изотопы водорода имеют собственные красивые имена. Привычный нам самый лёгкий и распространённый изотоп водорода тоже имеет специальное обозначение — протий. Все три названия этих изотопов появились ещё до открытия трития, когда Г. Юри, Д. Мерфи и Ф. Брикведде 5 июня 1933 года предложили их в письме редактору научного журнала «The Journal of Chemical Physics». Названия изотопов водорода происходят от греческих слов «protos» (первый), «deuteros» (второй) и «tritos» (третий). Интересно отметить, что название «протий» менее известно широкой общественности, чем имена тяжёлых и намного более редких его «собратьев». В последнее время в интернете появились такие названия, как «квадий», «пентий», «гексий» и «септий», отнесённые к чрезвычайно короткоживущим изотопам водорода массой от 4 до 7 и с периодами полураспада 10–22 — 10–23 с. Однако, по-видимому, эти названия не имеют под собой основы и являются одним из «фейков» интернета. В частности, профессор Г. М. Тер-Акопьян, который с коллективом ОИЯИ (г. Дубна) впервые получил в 2001 году ядра пятого изотопа водорода, названия «пентий» ему не давал и никогда не слышал упоминания такого термина в научных публикациях и на конференциях.
Комментарии к статье
* Ректификация — разделение жидких смесей на практически чистые компоненты, отличающиеся температурами кипения, путём многократных испарений жидкости и конденсации паров. Разделение сжиженных газовых смесей ректификацией проводят при очень низких температурах под избыточным давлением.
** На азотно-туковых заводах из природного газа получают дешёвые азотные удобрения.
*** Название АКУЛИНА происходит от английского «accurate line» — аккуратная (прецизионная) линия.
www.nkj.ru
Нейтронная бомба | Журнал Популярная Механика
«Популярная механика» уже писала о современном ядерном оружии («ПМ» № 1’2009) на основе зарядов деления. В этом номере — рассказ о еще более мощных боеприпасах синтеза.
За время, прошедшее после первого испытания в Аламогордо, прогремели тысячи взрывов зарядов деления, в каждом из которых добывались драгоценные знания об особенностях их функционирования. Знания эти подобны элементам мозаичного полотна, причем оказалось, что «полотно» это ограничено законами физики: снижению габаритов боеприпаса и его мощности кладет предел кинетика замедления нейтронов в сборке, а достижение энерговыделения, существенно превышающего сотню килотонн, невозможно из-за ядерно-физических и гидродинамических ограничений допустимых размеров докритической сферы. Но сделать боеприпасы более мощными все же возможно, если вместе с делением заставить «работать» ядерный синтез.
Деление плюс синтез
Топливом для синтеза служат тяжелые изотопы водорода. При слиянии ядер дейтерия и трития образуется гелий-4 и нейтрон, энергетический выход при этом — 17,6 МэВ, что в несколько раз больше, чем при реакции деления (в пересчете на единицу массы реагентов). В таком топливе при нормальных условиях не может возникнуть цепная реакция, так что количество его не ограничено, а значит, у энерговыделения термоядерного заряда нет верхнего предела.

Однако для того, чтобы началась реакция синтеза, нужно сблизить ядра дейтерия и трития, а этому мешают силы кулоновского отталкивания. Для их преодоления нужно разогнать ядра навстречу друг другу и столкнуть. В нейтронной трубке при реакции срыва на ускорение ионов высоким напряжением тратится большая энергия. А вот если разогреть топливо до очень высоких температур в миллионы градусов и сохранить его плотность на протяжении необходимого для реакции времени, оно выделит энергию куда большую, чем та, которая затрачена на нагрев. Именно благодаря этому способу реакции и оружие стали называться термоядерными (по составу топлива такие бомбы также называют водородными).
Для нагрева топлива в термоядерной бомбе — в качестве «запала» — и нужен ядерный заряд. Корпус «запала» прозрачен для мягкого рентгеновского излучения, которое при взрыве опережает разлетающееся вещество заряда и превращает в плазму ампулу, содержащую термоядерное топливо. Вещество оболочки ампулы подобрано так, что его плазма существенно расширяется, сжимая топливо к оси ампулы (такой процесс называют радиационной имплозией).
Дейтерий и тритий
Дейтерий «примешан» к природному водороду в еще примерно впятеро меньших количествах, чем «оружейный» уран — к обычному. Но разность масс у протия и дейтерия — двойная, поэтому процессы их разделения в противоточных колоннах более эффективны. Тритий же, подобно плутонию-239, не существует в природе в ощутимых количествах, его добывают, воздействуя мощными нейтронными потоками в ядерном реакторе на изотоп лития-6, получая литий-7, который распадается на тритий и гелий-4.
Как радиоактивный тритий, так и стабильный дейтерий оказались опасными веществами: подопытные животные, которым вводились соединения дейтерия, умирали с симптомами, характерными для старости (охрупчивание костей, потеря интеллекта, памяти). Этот факт послужил основой теории, в соответствии с которой смерть от старости и в естественных условиях наступает при накоплении дейтерия: через организм в процессе жизнедеятельности проходят многие тонны воды и других соединений водорода, и более тяжелые дейтериевые компоненты постепенно накапливаются в клетках. Теория объясняла и долгожительство горцев: в поле земного притяжения концентрация дейтерия действительно незначительно убывает с высотой. Однако многие соматические эффекты оказались противоречащими «дейтериевой» теории, и в итоге она была отвергнута.
Изотопы водорода — дейтерий (D) и тритий (T) — при нормальных условиях представляют собой газы, достаточные количества которых сложно «собрать» в устройстве разумных размеров. Поэтому в зарядах используют их соединения — твердые гидриды лития-6. По мере того как синтез самых «легкозажигаемых» изотопов разогревает топливо, в нем начинают протекать и другие реакции — с участием как содержавшихся в смеси, так и образовавшихся ядер: слияние двух ядер дейтерия с образованием трития и протона, гелия-3 и нейтрона, слияние двух ядер трития с образованием гелия-4 и двух нейтронов, слияние гелия-3 и дейтерия с образованием гелия-4 и протона, а также слияние лития-6 и нейтрона с образованием гелия-4 и трития, так что и литий оказывается не совсем уж «балластом».
…Плюс деление
Хотя энерговыделение двухфазного (деление + синтез) взрыва может быть сколь угодно велико, значительная его часть (для первой из упомянутых реакций — более 80%) уносится из огненного шара быстрыми нейтронами; их пробег в воздухе составляет многие километры, и поэтому они не вносят вклад во взрывные эффекты.

Если же необходим именно взрывной эффект, в термоядерном боеприпасе реализуется еще и третья фаза, для чего ампула окружается тяжелой оболочкой из урана-238. Нейтроны, испускаемые при распаде этого изотопа, имеют слишком малую энергию для поддержания цепной реакции, но зато уран-238 делится под действием «внешних» высокоэнергетичных термоядерных нейтронов. Нецепное деление в урановой оболочке дает прибавку энергии огненного шара, иногда превышающую даже вклад термоядерных реакций! На каждый килограмм веса трехфазных изделий приходится несколько килотонн тротилового эквивалента — они существенно превосходят по удельным характеристикам другие классы ядерного оружия.
Однако у трехфазных боеприпасов есть очень неприятная особенность — повышенный выход осколков деления. Конечно, двухфазные боеприпасы тоже загрязняют местность нейтронами, вызывающими практически во всех элементах ядерные реакции, не прекращающиеся и спустя многие годы после взрыва (так называемая наведенная радиоактивность), осколками деления и остатками «запалов» (в процессе взрыва «расходуется» всего 10−30% плутония, остальное разлетается по окрестностям), но трехфазные превосходят их в этом отношении. Превосходят настолько, что некоторые боеприпасы даже выпускались в двух вариантах: «грязных» (трехфазных) и менее мощных «чистых» (двухфазных) для применения на территории, где предполагались действия своих войск. Например, американская авиабомба В53 выпускалась в двух идентичных по внешнему виду вариантах: «грязном» В53Y1 (9 Мт) и «чистом» варианте В53Y2 (4,5 Мт).
 Виды ядерных взрывов: 1. Космический. Применяется на высоте более 65 км для поражения космических целей. 2. Наземный. Производится на поверхности земли или на такой высоте, когда светящаяся область касается грунта. Применяется для разрушения наземных целей. 3. Подземный. Производится ниже уровня земли. Характерен сильным заражением местности. 4. Высотный. Применяется на высоте от 10 до 65 км для поражения воздушных целей. Для наземных объектов опасен только воздействием на электро- и радиоприборы. 5. Воздушный. Производится на высотах от нескольких сотен метров до нескольких километров. Радиоактивное заражение местности практически отсутствует. 6. Надводный. Производится на поверхности воды или на такой высоте, когда световая область касается воды. Характерен ослаблением действия светового излучения и проникающей радиации. 7. Подводный. Производится под водой. Световое излучение и проникающая радиация практически отсутствует. Вызывает сильное радиоактивное заражение воды.
Виды ядерных взрывов: 1. Космический. Применяется на высоте более 65 км для поражения космических целей. 2. Наземный. Производится на поверхности земли или на такой высоте, когда светящаяся область касается грунта. Применяется для разрушения наземных целей. 3. Подземный. Производится ниже уровня земли. Характерен сильным заражением местности. 4. Высотный. Применяется на высоте от 10 до 65 км для поражения воздушных целей. Для наземных объектов опасен только воздействием на электро- и радиоприборы. 5. Воздушный. Производится на высотах от нескольких сотен метров до нескольких километров. Радиоактивное заражение местности практически отсутствует. 6. Надводный. Производится на поверхности воды или на такой высоте, когда световая область касается воды. Характерен ослаблением действия светового излучения и проникающей радиации. 7. Подводный. Производится под водой. Световое излучение и проникающая радиация практически отсутствует. Вызывает сильное радиоактивное заражение воды.
Факторы взрыва
Из энергии 202 МэВ, которую поставляет каждый акт деления, мгновенно выделяются: кинетическая энергия продуктов деления (168 МэВ), кинетическая энергия нейтронов (5 МэВ), энергия гамма-излучения (4,6 МэВ). Благодаря этим факторам ядерное оружие и господствует на поле боя. Если взрыв происходит в сравнительно плотном воздухе, две трети его энергии переходит в ударную волну. Почти весь остаток забирает световое излучение, оставляя лишь десятую часть проникающей радиации, а из этого мизера лишь 6% достается сотворившим взрыв нейтронам. Существенную энергию (11 МэВ) уносят с собой нейтрино, но они настолько неуловимы, что найти им и их энергии практическое применение не удается до сих пор.
Со значительным запаздыванием после взрыва выделяются энергия бета-излучения продуктов деления (7 МэВ) и энергия гамма-излучения продуктов деления (6 МэВ). Эти факторы отвечают за радиоактивное заражение местности — явление, весьма опасное для обеих сторон.
Действие ударной волны понятно, поэтому и мощность ядерного взрыва стали оценивать, сравнивая со взрывом обычной взрывчатки. Не были необычными и эффекты, вызываемые мощной вспышкой света: горели деревянные постройки, получали ожоги солдаты. А вот эффекты, не превращающие цель в головешки или тривиальную, не вызывающую возмущения груду развалин — быстрые нейтроны и жесткое гамма-излучение — конечно же, считались «варварством».

Прямое действие гамма-излучения уступает по боевому эффекту и ударной волне, и свету. Лишь огромные дозы гамма-излучения (десятки миллионов рад) могут причинить неприятности электронике. При таких дозах плавятся металлы, а ударная волна с куда меньшей плотностью энергии уничтожит цель без подобных излишеств. Если плотность энергии гамма-излучения меньше, оно становится безвредным для стальной техники, а ударная волна и тут может сказать свое слово.
С «живой силой» тоже не все очевидно: во‑первых, гамма-излучение существенно ослабляется, например, броней, а во-вторых — особенности радиационных поражений таковы, что даже получившие абсолютно смертельную дозу в тысячи бэр (биологический эквивалент рентгена, доза любого вида излучения, производящая такое же действие в биологическом объекте, как 1 рентген) экипажи танков оставались бы боеспособными в течение нескольких часов. За это время подвижные и сравнительно малоуязвимые машины успели бы сделать многое.
Смерть электронике
Хотя прямое гамма-облучение существенного боевого эффекта не обеспечивает, он возможен за счет вторичных реакций. В результате рассеяния гамма-квантов на электронах атомов воздуха (Комптон-эффект) возникают электроны отдачи. От точки взрыва расходится ток электронов: их скорость существенно выше, чем скорость ионов. Траектории заряженных частиц в магнитном поле Земли закручиваются (а значит, двигаются с ускорением), формируя при этом электромагнитный импульс ядерного взрыва (ЭМИ ЯВ).
 В постоянной готовности Любое соединение, содержащее тритий, нестабильно, потому что половина ядер этого изотопа сама по себе распадается на гелий-3 и электрон за 12 лет, и чтобы поддерживать готовность многочисленных термоядерных зарядов к применению, необходимо непрерывно нарабатывать тритий в реакторах. В нейтронной трубке трития немного, и гелий-3 поглощается там специальными пористыми материалами, а вот из ампулы этот продукт распада надо откачивать насосом, иначе ее просто разорвет давлением газа. Подобные трудности привели, например, к тому, что английские специалисты, получив в 1970-х годах из США ракеты Polaris, предпочли отказаться от американского термоядерного боевого оснащения в пользу разработанных в своей стране по программе Chevaline менее мощных однофазных зарядов деления.
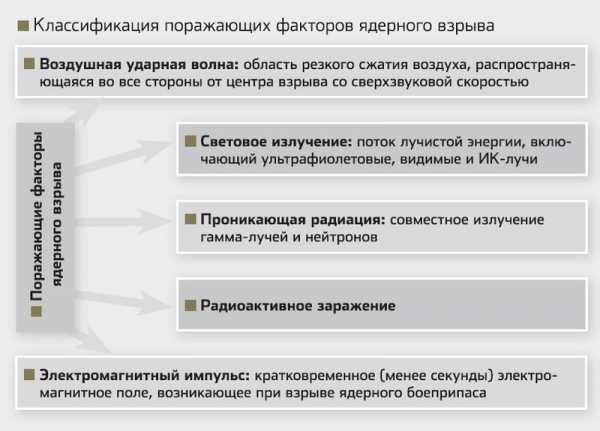
В предназначенных для борьбы с танками нейтронных боеприпасах была предусмотрена замена ампул с существенно уменьшившимся количеством трития на «свежие», производимая в арсеналах в процессе хранения. Могли такие боеприпасы применяться и с «холостыми» ампулами — как однофазные ядерные снаряды килотонной мощности. Можно использовать термоядерное топливо и без трития, только на основе дейтерия, но тогда, при прочих равных условиях, энерговыделение существенно снизится. Схема работы трехфазного термоядерного боеприпаса. Взрыв заряда деления (1) превращает ампулу (2) в плазму, сжимающую термоядерное топливо (3). Для усиления взрывного эффекта за счет потока нейтронов используется оболочка (4) из урана-238.
В постоянной готовности Любое соединение, содержащее тритий, нестабильно, потому что половина ядер этого изотопа сама по себе распадается на гелий-3 и электрон за 12 лет, и чтобы поддерживать готовность многочисленных термоядерных зарядов к применению, необходимо непрерывно нарабатывать тритий в реакторах. В нейтронной трубке трития немного, и гелий-3 поглощается там специальными пористыми материалами, а вот из ампулы этот продукт распада надо откачивать насосом, иначе ее просто разорвет давлением газа. Подобные трудности привели, например, к тому, что английские специалисты, получив в 1970-х годах из США ракеты Polaris, предпочли отказаться от американского термоядерного боевого оснащения в пользу разработанных в своей стране по программе Chevaline менее мощных однофазных зарядов деления.
В предназначенных для борьбы с танками нейтронных боеприпасах была предусмотрена замена ампул с существенно уменьшившимся количеством трития на «свежие», производимая в арсеналах в процессе хранения. Могли такие боеприпасы применяться и с «холостыми» ампулами — как однофазные ядерные снаряды килотонной мощности. Можно использовать термоядерное топливо и без трития, только на основе дейтерия, но тогда, при прочих равных условиях, энерговыделение существенно снизится. Схема работы трехфазного термоядерного боеприпаса. Взрыв заряда деления (1) превращает ампулу (2) в плазму, сжимающую термоядерное топливо (3). Для усиления взрывного эффекта за счет потока нейтронов используется оболочка (4) из урана-238.
В энергию ЭМИ ЯВ переходит лишь 0,6% энергии гамма-квантов, а ведь их доля в балансе энергии взрыва сама по себе мала. Вклад вносит и дипольное излучение, возникающее за счет изменения плотности воздуха с высотой, и возмущение магнитного поля Земли проводящим плазмоидом. В результате образуется непрерывный частотный спектр ЭМИ ЯВ — совокупность колебаний огромного числа частот. Существенен энергетический вклад излучения с частотами от десятков килогерц до сотен мегагерц. Эти волны ведут себя по‑разному: мегагерцевые и более высокочастотные затухают в атмосфере, а низкочастотные — «ныряют» в естественный волновод, образованный поверхностью Земли и ионосферой, и могут не раз обогнуть земной шар. Правда, «долгожители» эти напоминают о своем существовании лишь хрипением в приемниках, похожим на «голоса» грозовых разрядов, а вот их более высокочастотные родственники заявляют о себе мощными и опасными для аппаратуры «щелчками».
Казалось бы, такие излучения вообще должны быть безразличны военной электронике — ведь любое устройство с наибольшей эффективностью принимает волны того диапазона, в каком их излучает. А принимает и излучает военная электроника в гораздо более высокочастотных, чем ЭМИ ЯВ, диапазонах. Но ЭМИ ЯВ действует на электронику не через антенну. Если ракету длиной в 10 м «накрывала» длинная волна с не поражающей воображение напряженностью электрического поля в 100 В/см, то на металлическом ракетном корпусе наводилась разность потенциалов в 100 000 В! Мощные импульсные токи через заземляющие связи «затекают» в схемы, да и сами точки заземления на корпусе оказывались под существенно отличающимися потенциалами. Токовые перегрузки опасны для полупроводниковых элементов: для того чтобы «сжечь» высокочастотный диод, достаточно импульса мизерной (в десятимиллионную долю джоуля) энергии. ЭМИ занял почетное место могущественного поражающего фактора: иногда им выводилась из строя аппаратура за тысячи километров от ядерного взрыва — такое было не по силам ни ударной волне, ни световому импульсу.
Понятно, параметры вызывающих ЭМИ взрывов были оптимизированы (в основном высота подрыва заряда данной мощности). Разрабатывались и меры защиты: аппаратура снабжалась дополнительными экранами, охранными разрядниками. Ни один образец боевой техники не принимался на вооружение, пока не была доказана испытаниями — натурными или на специально созданных имитаторах — его стойкость к ЭМИ ЯВ, по крайней мере такой интенсивности, которая характерна для не слишком уж больших дистанций от взрыва.

Бесчеловечное оружие
Однако вернемся к двухфазным боеприпасам. Их основной поражающий фактор — потоки быстрых нейтронов. Это породило многочисленные легенды о «варварском оружии» — нейтронных бомбах, которые, как писали в начале 1980-х советские газеты, при взрыве уничтожают все живое, а материальные ценности (здания, технику) оставляют практически неповрежденными. Настоящее мародерское оружие — взорвал, а потом приходи и грабь! На самом деле любые предметы, подвергшиеся воздействию значительных нейтронных потоков, опасны для жизни, потому что нейтроны после взаимодействия с ядрами инициируют в них разнообразные реакции, становящиеся причиной вторичного (наведенного) излучения, которое испускается в течение длительного времени после того, как распадется последний из облучавших вещество нейтронов.
Для чего же было предназначено это «варварское оружие»? Двухфазными термоядерными зарядами оснащались боевые части ракет Lance и 203-мм гаубичные снаряды. Выбор носителей и их досягаемость (десятки километров) указывают на то, что создавалось это оружие для решения оперативно-тактических задач. Нейтронные боеприпасы (по американской терминологии — «с повышенным выходом радиации») предназначались для поражения бронетехники, по численности которой Варшавский пакт превосходил НATO в несколько раз. Танк достаточно стоек к воздействию ударной волны, поэтому после расчетов применения ядерного оружия различных классов против бронетехники, с учетом последствий заражения местности продуктами деления и разрушений от мощных ударных волн, основным поражающим фактором решили сделать нейтроны.
Абсолютно чистый заряд
В стремлении получить такой термоядерный заряд попытались отказаться от ядерного «запала», заменив деление сверхскоростной кумуляцией: головной элемент струи, состоявшей из термоядерного топлива, разогнали до сотни километров в секунду (в момент столкновения температура и плотность значительно возрастают). Но на фоне взрыва килограммового кумулятивного заряда «термоядерная» прибавка оказалась ничтожной, и эффект зарегистрировали лишь косвенно — по выходу нейтронов. Отчет об этих проведенных в США экспериментах был опубликован в 1961 году в сборнике «Атом и оружие», что при тогдашней параноидальной секретности само по себе свидетельствовало о неудаче.
В семидесятых, в «неядерной» Польше, Сильвестр Калиский теоретически рассмотрел сжатие термоядерного топлива сферической имплозией и получил весьма благоприятные оценки. Но экспериментальная проверка показала, что, хотя выход нейтронов, по сравнению со «струйным вариантом», возрос на много порядков, нестабильности фронта не позволяют достичь нужной температуры в точке схождения волны и реагируют только те частицы топлива, скорость которых, из-за статистического разброса, значительно превышает среднее значение. Так что совсем «чистый» заряд создать не удалось.
Рассчитывая остановить навал «брони», в штабах НАТО разработали концепцию «борьбы со вторыми эшелонами», стараясь отнести подальше рубеж применения нейтронного оружия по противнику. Основная задача бронетанковых войск — развитие успеха на оперативную глубину, после того как их бросят в брешь в обороне, пробитую, например, ядерным ударом большой мощности. В этот момент применять радиационные боеприпасы уже поздно: хотя 14-МэВ нейтроны незначительно поглощаются броней, поражения экипажей излучением сказываются на боеспособности не сразу. Поэтому такие удары планировались по выжидательным районам, где изготавливались к введению в прорыв основные массы бронетехники: за время марша к линии фронта на экипажах должны были проявиться последствия облучения.

Нейтронные перехватчики
Еще одним применением нейтронных боеприпасов стал перехват ядерных боеголовок. Перехватить боевой блок противника надо на большой высоте, чтобы даже в случае его подрыва не пострадали объекты, на которые он нацелен. Но отсутствие вокруг воздуха лишает противоракету возможности поразить цель ударной волной. Правда, при ядерном взрыве в безвоздушном пространстве возрастает преобразование его энергии в световой импульс, но помогает это мало, поскольку боевой блок рассчитан на преодоление теплового барьера при входе в атмосферу и снабжен эффективным обгорающим (абляционным) теплозащитным покрытием. Нейтроны же свободно «проскакивают» через такие покрытия, а проскочив, бьют в «сердце» боевого блока — сборку, содержащую делящееся вещество. Ядерный взрыв при этом невозможен — сборка докритична, но нейтроны порождают в плутонии много затухающих цепей деления. Плутоний, который и при нормальных условиях из-за самопроизвольно протекающих ядерных реакций имеет ощутимую при касании повышенную температуру, при мощном внутреннем подогреве плавится, деформируется, а значит, уже не сможет превратиться в нужный момент в сверхкритическую сборку.
Такими двухфазными термоядерными зарядами оснащены американские противоракеты Sprint, охраняющие шахты межконтинентальных баллистических ракет. Конусная форма ракет позволяет выдерживать огромные перегрузки, возникающие во время старта и при последующем маневрировании.
Автор статьи с 1984 по 1997 год возглавлял лабораторию специальных боеприпасов ЦНИИ химии и механики. В этом году в издательстве «Моркнига» вышла его книга «Огонь!», посвященная таким боеприпасам
Статья опубликована в журнале «Популярная механика» (№6, Июнь 2009).www.popmech.ru
ТРИТИЙ | Энциклопедия Кругосвет
Содержание статьиТРИТИЙ – (сверхтяжелый водород), один из изотопов водорода, в ядре которого содержатся один протон и два нейтрона. Радиоактивен, период полураспада – 12,26 года; при бета-распаде превращается в гелий-3. Температура плавления – 252,2° С, температура кипения – 248,1° С.
В погоне за тритием.
Почти сразу же после открытия дейтерия (см. ДЕЙТЕРИЙ И ТЯЖЕЛАЯ ВОДА) начались поиски в природе трития – третьего сверхтяжелого изотопа водорода, в ядре которого помимо одного протона есть два нейтрона. Физикам было очевидно, что если тритий есть в обычном водороде, он будет концентрироваться вместе с дейтерием. Поэтому сразу несколько групп исследователей, которые наладили получение тяжелой воды или имели доступ к ней, включились в погоню за новым изотопом, используя для поисков разные методы. Впоследствии обнаружилось, что почти все методы принципиально не могли дать положительных результатов, так как не обладали нужной чувствительностью.
Уже в первой работе Г.Юри, в которой был открыт дейтерий, была сделана попытка обнаружить и тритий – точно таким же образом, по заранее предсказанному теорией положению спектральных линий. Однако на спектрограммах не было даже намека на эти линии, что, в общем, не удивило исследователей. Если дейтерия в обычном водороде всего сотые доли процента, то вполне вероятно, что трития намного меньше. Вывод был ясен: надо увеличивать как чувствительность анализа, так и степень обогащения водорода его тяжелыми изотопами.
В начале 1933 известный американский физикохимик, автор теории электронных пар Гилберт Льюис совместно с химиком Франком Спеддингом повторил опыт Юри. На этот раз в распоряжении исследователей был сильно обогащенный образец, содержащий 67% дейтерия. Такой образец уже при 2-минутной экспозиции в спектрографе давал на фотопластинке четкие линии дейтерия. Но и за 40 часов экспозиции то место на пластинке, где по теории должны были проявиться линии трития, оставалось совершенно чистым. Это означало, что содержание в обычном водороде трития по крайней мере меньше, чем 1:6·106, т.е. менее одного атома 3H на 6 миллионов атомов 1H. Отсюда был сделан такой вывод: надо брать еще более концентрированные образцы, то есть подвергать электролизу уже не обычную воду для накопления D2O, а тяжелую воду для накопления Т2О (или, по крайней мере, DТО). На практике это означало, что исходной тяжелой воды надо было взять столько, сколько раньше брали обычной воды для получения тяжелой!
После неудач спектроскопистов в поиски включились специалисты по масс-спектрометрии. Этот чрезвычайно чувствительный метод позволяет анализировать ничтожные количества вещества в виде ионов. Для опытов воду сконцентрировали в 225 тысяч раз. Исследователи надеялись найти в образце ионы (DT)+ с массой 5. Ионы с такой массой были обнаружены, но оказалось, что они принадлежат трехатомным частицам (НDD)+, без какого-либо участия трития. Стало очевидным, что трития, если он и присутствует в природе, намного меньше, чем думали раньше: не больше, чем 1:5·108, то есть уже 1 атом Т на 500 миллионов атомов Н!
Синтез трития.
Пока спектроскописты и масс-спектрометристы публиковали один за другим сообщения о тритии, которые все оказались ложными, тритий был получен искусственно. Это произошло в лаборатории патриарха ядерной физики Эрнста Резерфорда. В марте 1934 в выходящем в Англии журнале «Nature» («Природа») была опубликована небольшая заметка, подписанная М.Л.Олифантом, П.Хартеком и Резерфордом (фамилия лорда Резерфорда не требовала при публикации инициалов!). Несмотря на скромное название заметки: Эффект трансмутации, полученный с тяжелым водородом, она сообщала миру о важном достижении – получении третьего изотопа водорода. Соавторами работы были молодой австралиец Марк Лоуренс Олифант и австриец Пауль Хартек. И если Олифант стал впоследствии академиком и директором Физического института университета Канберры, то судьба Хартека сложилась иначе. Своеобразно понимая свой долг перед немецкой наукой, он в 1934 решил возвратиться в Германию и работать для нацистского режима. В 1939 он написал письмо в высшие военные инстанции Германии о возможности создания атомного оружия, а затем попытался построить урановый котел – к счастью, безуспешно.
В 1933 лабораторию в Кембридже посетил Г.Льюис из Беркли, который подарил Резерфорду три крошечные стеклянные ампулки почти чистой тяжелой воды. Их общий объем был всего 0,5 мл. Олифант получил из этой воды немного чистого дейтерия, который служил для получения пучков ионов D+, разгонявшихся в разрядной трубке до высоких энергий. А Хартек синтезировал соединения, в которых атомы водорода были частично заменены атомами дейтерия. Так были получены ничтожные количества «утяжеленного» хлорида аммония путем обменных реакций NH4Cl + D2O NH3DCl + HDO, NH3DCl + D2O NH2D2Cl + HDO и т.д. При бомбардировке дейтерированного хлорида аммония разогнанными ионами D+ наблюдался очень интенсивный поток новых частиц. Как оказалось, это были ядра нового изотопа водорода – трития (их назвали тритонами). Стало очевидным также, что впервые в истории удалось наблюдать ядерный синтез: два атома дейтерия, сливаясь вместе, образовывали неустойчивое ядро гелия-4, которое затем распадалось с образованием трития и протона: 4He ® 3H + 1H.
В том же году Резерфорд уже демонстрировал новые ядерные превращения на своих лекциях: счетчик частиц был соединен через усилитель с громкоговорителем, так что в аудитории раздавались громкие щелчки, которые по мере повышения напряжения на разрядной трубке становились все чаще. При этом на каждый миллион дейтериевых «снарядов», попадающих в мишень, получался один атом трития – это очень много для ядерных реакций такого типа.
Итак, первый тритий был получен искусственно, в результате ядерных реакций. Вопрос о существовании его в природе оставался открытым. Искусственный синтез трития в Кембридже только подхлестнул исследователей, проводивших концентрирование тяжелой воды во все больших и больших масштабах в надежде найти тритий в природном источнике. Так, физики и химики из Принстонского университета, объединив усилия, в 1935 подвергли электролизу уже 75 тонн воды – почти две железнодорожные цистерны! В результате титанических усилий была получена крохотная ампула с остатком обогащенной воды объемом всего 0,5 мл. Это было рекордное концентрирование – в 150 миллионов раз! Масс-спектральный анализ этого остатка не дал ничего нового – в спектре по-прежнему присутствовал пик, отвечающий массе 5, который был приписан ионам (DT)+, а оценка содержания трития в природе с учетом огромного концентрирования дала отношение Т:Н ~ 7:1010, то есть не больше одного атома Т на 70 миллиардов атомов Н.
Таким образом, для обнаружения трития надо было еще больше увеличить степень концентрирования воды. Но это требовало уже гигантских затрат. К решению проблемы подключили самого Резерфорда. Используя свой огромный авторитет, он обратился с личной просьбой к норвежцам, чтобы они провели невиданный доселе по масштабам эксперимент: получили бы тяжелую воду, сконцентрировав обычную в миллиард раз! Сначала было подвергнуто электролизу 13 000 тонн обычной воды, из которых получили 43,4 кг тяжелой воды с содержанием D2O 99,2%. Далее это количество путем почти 10-месячного электролиза уменьшили до 11 мл. Условия электролиза были выбраны так, чтобы способствовать концентрированию предполагаемого трития. Таким образом, из 13 тысяч тонн воды (а это 5 железнодорожных составов по 50 цистерн в каждом!) была получена всего одна пробирка обогащенной воды. Мир не знал еще столь грандиозных опытов!
Возникла проблема, как лучше всего поступить с этим драгоценным образцом. Вероятно, единственным человеком в мире, способным непосредственно различить в масс-спектрометре очень близкие по массе ионы (DT)+ и «маскирующиеся» под них ионы (DDH)+, был нобелевский лауреат Ф.У.Астон – выдающийся специалист в области масс-спектрометрического анализа. Именно ему было решено передать образец для анализа. Результат был обескураживающим: не было никаких следов присутствия ионов DT+! Соответственно оценка отношения T:H было снижено до 1:1012. Стало очевидным, что если тритий и присутствует в природных источниках, то в таких ничтожных количествах, что его выделение из них сопряжено с неимоверными, если вообще преодолимыми трудностями.
Обнаружение природного трития.
Может ли тритий быть радиоактивным? Уже Резерфорд после неудачи со своим грандиозным опытом не исключал такой возможности. Расчеты также говорили о том, что ядро трития должно быть нестабильным и, следовательно, он должен быть радиоактивным. Именно радиоактивностью трития со сравнительно небольшим временем жизни можно было объяснить ничтожные его количества в природе. Действительно, вскоре радиоактивности у трития была обнаружена экспериментально. Конечно, это был искусственно полученный тритий. В течение 5 месяцев не было заметно спада радиоактивности. Из этого следовало, с учетом точности экспериментов, что период полураспада трития не меньше 10 лет. Современные измерения дают для периода полураспада трития 12,262 года.
При распаде тритий испускает бета-частицы, превращаясь в гелий-3. Энергия излучения трития настолько мало, что оно не может пройти даже через тоненькую стенку счетчика Гейгера. Поэтому анализируемый на присутствие трития газ необходимо запускать внутрь счетчика. С другой стороны, малая энергия излучения имеет свои преимущества – с соединениями трития (если они нелетучи) работать не опасно: испускаемые им бета-лучи проходят в воздухе всего несколько миллиметров.
Для отработки методов анализа трития потребовались значительные его количества. Поэтому стали появляться новые способы его синтеза, например, 9Be + 2H ® 8Be + 3H, 6Li + 1n ® 4He + 3H и другие. А точность анализа чрезвычайно повысилась. Стало возможным, например, анализировать образцы, в которых происходил всего один распад атома трития в секунду – в таком образце трития содержится меньше, чем 10–15 моль! Теперь в руках физиков был исключительно чувствительный метод анализа – в довоенные годы он был примерно в миллион раз чувствительнее, чем масс-спектрометрический. Настало время вернуться к поискам трития в природных источниках.
Тритий в природе.
В 1946 известный авторитет в области ядерной физики, лауреат Нобелевской премии У.Ф.Либби предположил, что тритий непрерывно образуется в результате идущих в атмосфере ядерных реакций. Первые измерения радиоактивности природного водорода, хотя и были неудачными, показали, что отношение Н:Т на 5 порядков меньше, чем думали раньше и составляет не более 1:1017. Стала очевидной невозможность обнаружения трития масс-спектрометрически даже при самых больших обогащениях: к началу 50-х годов масс-спектрометры позволяли определять концентрации примесей при их содержании не менее 10–4%.
В 1951 группа американских физиков из Чикагского университета с участием У.Либби достала хранившуюся «резерфордовскую» ампулу с 11 мл сверхобогащенной тяжелой воды, в которой Астон когда-то пытался обнаружить тритий масс-спектрометрически. И хотя с момента выделения этого образца из природной воды прошло полтора десятка лет и от содержащегося в нем трития осталось меньше половины, результат не заставил себя ждать: тяжелая вода была радиоактивна! Измеренная активность с учетом обогащения при получении образца соответствовала природному содержанию трития 1:1018.
Чтобы застраховаться от возможной ошибки, решили повторить все с самого начала, тщательно следя за каждым шагом этого решающего эксперимента. Авторы попросили норвежскую компанию приготовить еще несколько образцов обогащенной воды. Воду взяли из горного озера на севере Норвегии в январе 1948. Из нее путем электролитического концентрирования получили 15 мл тяжелой воды. Ее перегнали и ввели в реакцию с оксидом кальция: СаО + D2O ® Ca(OD)2. Восстановлением цинком при температуре красного каления из дейтероксида кальция получили дейтерий: Ca(OD)2 + Zn ® CaZnO2 + D2. Масс-спектрометрический анализ показал, что получен чистейший дейтерий, который и запустили в счетчик Гейгера для измерения его радиоактивности. Газ оказался радиоактивным, а это означало, что вода, из которой был выделен дейтерий, содержала тритий. Аналогично было приготовлено и проанализировано еще несколько образцов, чтобы уточнить, сколько же трития содержится на самом деле в природном водороде.
Исключительная тщательность работы не оставляла никаких сомнений в полученных результатах. Но еще за год до окончания этой работы вышла статья Ф.Фалтингса и того же П.Хартека из Физико-химического института при Гамбургском университете, в которой сообщалось об обнаружении трития в атмосферном водороде. Таким образом, Хартек дважды участвовал в открытии трития: сначала – искусственного, а через 16 лет – природного.
Воздух – не самый богатый источник водорода – его в нем всего 0,00005% (на уровне моря). Поэтому по заказу немецких физиков фирма «Линде» переработала сто тысяч кубометров воздуха, из которого путем сжижения и ректификации был выделен водород, а из него окислением на оксиде меди получено 80 г воды. С помощью электролиза эта вода была сконцентрирована в несколько десятков раз, затем ею был «погашен» карбид кальция: CaC2 + 2H2O ® Ca(OH)2 + С2H2, а ацетилен прогидрирован оставшимся водородом до этана: С2Н2 + 2Н2 ® С2Н6. Полученный этан, в который переходил весь исходный тритий, затем анализировали на радиоактивность. Расчет показал, что в воздухе трития (в виде молекул НТ) исключительно мало: в 20 куб. см воздуха содержится одна молекула трития, т.е. во всей атмосфере его должно быть всего… 1 моль или 3 г. Однако если учесть, что водорода в воздухе исключительно мало, то получается, что атмосферный молекулярный водород обогащен тритием в 10 000 раз больше, чем водород в составе дождевой воды. Отсюда следовало, что свободный и связанный водород в атмосфере имеют разное происхождение. Подсчет показал также, что во всех водоемах Земли трития содержится всего лишь 100 кг.
Значение, полученное в Чикаго для содержания трития в воде (Н:Т = 1:1018), стало общепринятым. Такое содержание атомов трития получило даже специальное название – «тритиевая единица» (ТЕ). В 1 л воды в среднем содержится 3,2·10–10 г трития, в 1 л воздуха – 1,6·10–14 г (при абсолютной влажности 10 мг/л). Образуется тритий в верхних слоях атмосферы с участием космического излучения со скоростью 1200 атомов в секунду в расчете на 1 м2 земной поверхности. Таким образом, в течение тысячелетий содержание трития в природе было почти постоянным – непрерывное его образование в атмосфере компенсировалось естественным распадом. Однако с 1954 (начало испытаний термоядерных бомб) положение резко изменилось и в дождевой воде содержание трития увеличилось в тысячи раз. И это не удивительно: взрыв водородной бомбы мощностью 1 мегатонна (Мт) приводит к выделению от 0,7 до 2 кг трития. Общая мощность воздушных взрывов составила за 1945–1962. 406 Мт, а наземных – 104 Мт. При этом общее количество трития, поступившее в биосферу в результате испытаний, составило сотни килограммов! После прекращения наземных испытаний уровень трития пошел на убыль. В последние годы основным источником техногенного трития в окружающей среде стали атомные электростанции, которые ежегодно выделяют несколько десятков килограммов трития.
Современные радиохимические методы позволяют с большой точностью определять содержание трития в сравнительно небольшом количестве воды, взятой из того или иного источника. Для чего это нужно? Оказывается, радиоактивный тритий с весьма удобным временем жизни – чуть больше 10 лет – может дать много ценной информации. У.Либби назвал тритий «радиоводородом», по аналогии с радиоуглеродом. Тритий может служить прекрасной меткой для изучения различных природных процессов. С его помощью можно определять возраст растительных продуктов, например, вин (если им не больше 30 лет), поскольку виноград поглощает тритий из почвенных вод, а после снятия урожая содержание трития в виноградном соке начинает снижаться с известной скоростью. Сам Либби провел множество подобных анализов, переработав сотни литров различных вин, поставленных ему виноделами из разных местностей. Анализ атмосферного трития дает ценную информацию о космических лучах. А тритий в осадочных породах может свидетельствовать о перемещениях воздуха и влаги на Земле.
Наиболее богатые природные источники трития – дождь и снег, поскольку почти весь тритий, образующийся под действием космических лучей в атмосфере, переходит в воду. Интенсивность космической радиации изменяется с широтой, поэтому осадки, например, в средней полосе России несут в несколько раз больше трития, чем тропические ливни. И совсем мало трития в дождях, которые идут над океаном, поскольку их источник – в основном та же океаническая вода, а ней трития немного. Понятно, что глубинный лед Гренландии или Антарктиды совсем не содержит трития – он там давно успел полностью распасться. Зная скорость образования трития в атмосфере, можно рассчитать, как долго влага находится в воздухе – с момента ее испарения с поверхности до выпадения в виде дождя или снега. Оказалось, что, например, в воздухе над океаном этот срок составляет в среднем 9 дней.
Запасы природного трития ничтожны. Поэтому весь тритий, используемый для различных целей, получают искусственно, путем облучения лития нейтронами. В результате стало возможным получить значительные количества чистого трития и изучить его свойства, а также свойство его соединений. Так, сверхтяжелая вода Т2О имеет плотность 1,21459 г/см3. Синтезированный тритий сравнительно дешев и находит применение в научных исследованиях и в промышленности. Широкое применение нашли тритиевые светящиеся краски, которые наносят на шкалы приборов. Эти светосоставы с точки зрения радиации менее опасны, чем традиционные радиевые. Например, сульфид цинка, содержащий небольшое количество соединений трития (примерно 0,03 мг на 1 г светосостава), непрерывно излучает зеленый свет. Такие светосоставы постоянного действия используют для изготовления указателей, шкал приборов и т.п. На их производство ежегодно расходуют сотни граммов трития.
Тритий присутствует и в человеческом организме. Он поступает в него с пищей, с вдыхаемым воздухом и через кожу (12%). Интересно, что газообразный Т2 в 500 раз менее токсичен, чем сверхтяжелая вода Т2О. Это объясняется тем, что молекулярный тритий, попадая с воздухом в легкие, затем быстро (примерно за 3 мин) выделяется из организма, тогда как тритий в составе воды задерживается в нем на 10 суток и успевает за это время передать ему значительную дозу радиации. В среднем организм человека содержит 5·10–12 г трития, что дает вклад 0,13 мбэр в общую дозу годового облучения (это в сотни раз меньше облучения от других источников радиации). Интересно, что у людей, носящих часы, в которых стрелки и цифры покрыты тритиевым люминофором, содержание трития в теле в 5 раз выше среднего.
А еще тритий является одним из основных компонентов взрывчатого вещества термоядерных (водородных) бомб, а также весьма перспективен для проведения управляемой термоядерной реакции по схеме D + T > 4He + n.
Илья Леенсон
www.krugosvet.ru
что это такое? Масса трития
Еще совсем недавно люди считали, что атом – это цельная неделимая частица. Позднее стало ясно, что он состоит из ядра и вращающихся вокруг него электронов. При этом центральная часть снова считалась неделимой и цельной. Сегодня мы знаем, что она состоит из протонов и нейтронов. Причем, в зависимости от числа последних, у одного и того же вещества может быть несколько изотопов. Итак, тритий – что это такое? Что это за вещество, как его получить и использовать?
Тритий – что это такое?
Водород – самое простое вещество в природе. Если говорить про его самую распространенную форму, о которой подробнее будет сказано чуть ниже, то его атом состоит лишь из одного протона и одного электрона. Однако он может принимать и “лишние” частицы, которые несколько меняют его свойства. Так, ядро трития состоит из протона и двух нейтронов. И если протий, то есть самая простая форма водорода – это самый распространенный во вселенной элемент, то про его “улучшенную” версию этого не скажешь – в природе он встречается в незначительных количествах.
Изотоп водорода тритий (название происходит от греческого слова “третий”) был открыт в 1934 году Резерфордом, Олифантом и Хартеком. И на самом деле, найти его пытались очень долго и упорно. Сразу после открытия дейтерия и тяжелой воды в 1932 году ученые стали искать этот изотоп с помощью повышения чувствительности спектрального анализа при изучении обычного водорода. Однако, несмотря ни на что, их попытки были тщетны – даже в самых концентрированных образцах не удавалось получить даже намек на присутствие вещества, которое было просто обязано существовать. Но в итоге поиски все-таки увенчались успехом – Олифант синтезировал элемент с помощью тяжелой воды в лаборатории Резерфорда.
Если коротко, то определение трития звучит следующим образом: радиоактивный изотоп водорода, ядро которого состоит из протона и двух нейтронов. Итак, что о нем известно?

Об изотопах водорода
Первый элемент периодической таблицы является одновременно наиболее распространенным во Вселенной. При этом в природе он встречается в виде одного из трех своих изотопов: протия, дейтерия или трития. Ядро первого состоит из одного протона, что и дало ему название. Кстати, это единственный стабильный элемент, у которого отсутствуют нейтроны. Следующим в ряду изотопов водорода является дейтерий. Ядро его атома состоит из протона и нейтрона, а название восходит к греческому слову “второй”.
В лаборатории были получены также еще более тяжелые изотопы водорода с массовыми числами от 4 до 7. Период их полураспада ограничивается долями секунд.
Свойства
Атомная масса трития составляет примерно 3,02 а. е. м. По своим физическим свойствам это вещество почти не отличается от обычного водорода, то есть в нормальных условиях является легким газом без цвета, вкуса и запаха, обладает высокой теплопроводностью. При температуре около -250 градусов по Цельсию становится легкой и текучей бесцветной жидкостью. Диапазон, в пределах которых он находится в данном агрегатном состоянии довольно узок. Температура плавления составляет около 259 градусов по Цельсию, ниже которой водород становится снегоподобной массой. Кроме того, этот элемент довольно хорошо растворяется в некоторых металлах.

Однако есть и некоторые отличия в свойствах. Во-первых, третий изотоп обладает меньшей реакционной способностью, а во-вторых, тритий радиоактивен и в связи с этим нестоек. Период полураспада составляет чуть более 12 лет. В процессе радиолиза он превращается в третий изотоп гелия с испусканием электрона и антинейтрино.
Получение
В природе тритий содержится в незначительных количествах и образуется чаще всего в верхних слоях атмосферы при соударении космических частиц и, например, атомов азота. Однако существует и промышленный метод получения этого элемента с помощью облучения лития-6 нейтронами в ядерных реакторах.
Синтез трития в объеме, масса которого составляет около 1 килограмма, обходится примерно в 30 миллионов долларов.

Использование
Итак, мы немного больше узнали про тритий – что это такое и его свойства. Но зачем он нужен? Разберемся чуть ниже. По некоторым данным мировая коммерческая потребность в тритии составляет порядка 500 граммов в год, еще около 7 килограмм уходит на военные нужды.
По данным американского института исследований энергетики и окружающей среды, с 1955 по 1996 год в США было произведено 2,2 центнера сверхтяжелого водорода. А на 2003 год общие запасы этого элемента составляли около 18 килограмм. Для чего же они используются?
Во-первых, тритий необходим для поддержания боеспособности ядерного оружия, которым, как известно, пока еще обладают некоторые страны. Во-вторых, без него не обходится термоядерная энергетика. Еще тритий используется в некоторых научных исследованиях, например, в геологии с его помощью датируют природные воды. Еще одно назначение – источник питания подсветки в часах. Кроме того, в настоящее время проводятся эксперименты по созданию радиоизотопных генераторов сверхмалой мощности, например, для питания автономных датчиков. Ожидается, что в этом случае срок их службы составит около 20 лет. Стоимость такого генератора составит порядка одной тысячи долларов.

В качестве оригинальных сувениров также существуют брелки с небольшим количеством трития внутри. Они издают свечение и выглядят довольно экзотично, особенно если знать о внутреннем содержании.
Опасность
Тритий радиоактивен, именно этим объясняется часть его свойств и видов использования. Его период полураспада составляет около 12 лет, при этом образуется гелий-3 с испусканием антинейтрино и электрона. В процессе этой реакции выделяется 18,59 кВт энергии и бета-частицы распространяются в воздухе. Обывателю может показаться странным, что радиоактивный изотоп используется, скажем, для подсветки в часах, ведь это может быть опасным, разве нет? На самом деле тритий едва ли чем-то угрожает человеческому здоровью, поскольку бета-частицы в процессе его распада распространяются максимум на 6 миллиметров и не могут преодолеть простейшие преграды. Впрочем, это не значит, что работа с ним абсолютно безопасна – любое попадание внутрь с пищей, воздухом или впитывание через кожу может привести к проблемам. Хотя в большинстве случаев он легко и быстро выводится, так бывает не всегда. Итак, тритий – что это такое с точки зрения радиационной опасности?

Меры защиты
Несмотря на то что малая энергия распада трития не позволяет радиации серьезно распространяться, так что бета-частицы не могут преодолеть даже кожу, не стоит пренебрегать своим здоровьем. При работе с этим изотопом можно, конечно, не использовать костюм радиационной защиты, но элементарные правила, такие как закрытая одежда и хирургические перчатки, соблюдать необходимо. Поскольку основную опасность тритий представляет при попадании внутрь, важно пресечь деятельность, при которой это станет возможным. В остальном беспокоиться не о чем.
Если все же он в большом количестве поступил в ткани организма, может развиться, острая или хроническая лучевая болезнь в зависимости от длительности, дозы и регулярности воздействия. В некоторых случаях этот недуг успешно излечивается, но при обширных поражениях возможен летальный исход.

В любом нормальном организме есть следы трития, хоть они и абсолютно незначительны и едва ли влияют на радиационный фон. Ну а у любителей часов со светящимися стрелками его уровень выше в несколько раз, хотя и все равно считается безопасным.
Сверхтяжелая вода
Тритий, как и обычный водород, может образовывать новые вещества. В частности, он входит в молекулу так называемой сверхтяжелой (супертяжелой) воды. Свойства этого вещества не слишком отличаются от привычной каждому человеку H2O. При том, что тритиевая вода также может участвовать в метаболизме, она отличается довольно высокой токсичностью и выводится в течение десятидневного срока, за который ткани могут получить довольно высокую степень облучения. И хотя данное вещество менее опасно само по себе, оно является более опасным в связи с периодом, на протяжении которого находится в организме.
fb.ru
Водородный обмен на дейтерий и тритий
О.В. Мосин
ВОДОРОДНЫЙ ОБМЕН НА ДЕЙТЕРИЙ И ТРИТИЙ В МАКРОМОЛЕКУЛАХ БЕЛКОВ И ДНК.
При растворении многих веществ в дейтериевой (D2O) или тритиевой (3Н2О) воде происходит обмен атомов водорода на дейтерий D или тритий 3Н.
Изотопный обмен характеризуется как самопроизвольное перераспределение изотопов химического элемента между различными фазами системы (в частности, между различными агрегатными состояниями одного и того же вещества), частицами (молекулами, ионами) или внутри молекул (сложных ионов).
При изотопном обмене сохраняется неизменным элементный состав каждого участвующего в обмене вещества, изменяется лишь его изотопный состав.
Распределение изотопов между веществами в состоянии равновесия характеризуется коэффициентом распределения, определяющим соотношение равновесных концентраций изотопов в реагирующих веществах. При равномерном распределении изотопов коэффициент распределения равен 1.
Однако, на практике равномерное распределение изотопов в реагирующих веществах происходит только для изотопов лёгких элементов.
Для лёгких изотопов углерода, азота и кислорода с небольшими разницами атомных масс при достижении химического равновесия изотопного обмена каждый изотоп распределяется между реагирующими веществами равномерно.
Для изотопов тяжёлых элементов дейтерия и трития эта неравномерность в распределении между некоторыми веществами может достигатьсотен процентов.
Отклонение от равномерного распределения зависит не только от массы изотопов, но и от химического состава веществ, между которыми происходит изотопный обмен. Кроме того, коэффициент распределения зависит от температуры и во всех случаях по мере её повышения приближается к 1.
Скорость протекания изотопного обмена определяется механизмом реакций. В некоторых случаях изотопный обмен протекает практически мгновенно (например, при ионных реакциях в растворе), в других случаях — крайне медленно или же не происходит вовсе. Для ускорения изотопного обмена так же, как и для других химических реакций, часто используют различные катализаторы.
Так, при помещении молекулы в тяжёлую/тритиевую воду происходит довольно быстрый изотопный (Н-D-T)-обмен протонов на дейтерий/тритий в гидроксильных -ОН, карбоксильных -СООН, сульфгидрильных –SH, аминогруппах –Nh3 и амидных –NH всех органических соединений, включая нуклеиновые кислоты, липиды, белки и сахара. Известно, что в этих условиях только С-Н связь не подвергается изотопному обмену и вследствие этого только соединения со связями типа С-D (С-T) могут синтезироваться de novo.
При помещении молекулы в тяжёлую/тритиевую воду происходит быстрый изотопный (1Н-2H-3Н)-обмен в гидроксильных -ОН, карбоксильных -СООН, сульфгидрильных –SH, аминогруппах –Nh3 и амидных –NH всех органических соединений, включая нуклеиновые кислоты, липиды, белки и сахара. Известно, что в этих условиях только С-Н связь не подвергается изотопному обмену и вследствие этого только соединения со связями типа С-2H (С-3H) могут синтезироваться de novo.
Кроме вышеобозначенных эффектов, возможное изменение энергетики самой дейтериевой/тритиевой связи, что может сказаться на стабильность макромолекул. Изотопные эффекты дейтерия и трития связаны с образованием в тяжёлой/тритиевой воде конформаций молекул с иными структурно-динамическими свойствами, чем конформаций, образованных с участием водорода, и поэтому имеющих другую активность и биологические свойства. Так, в случае с дейтерием разрыв С1H-связей может происходить быстрее, чем С2H-связей, подвижность дейтерия меньше, чем подвижность протия, константа ионизации тяжёлой воды несколько меньше константы ионизации обычной воды. Изотопные эффекты дейтерия и трития связаны с их увеличенной массой по сравнению с протием и вследствие этого с кинетикой реакций, подвижностью, энергетикой и т.д.
Аминокислоты, нуклеозиды, короткие полипептиды, белки в конформации беспорядочного клубка и одноцепочечные нуклеиновые кислоты быстро обменивают атомы водорода, связанные с атомами азота, кислорода и серы; атомы водорода, связанные с атомами углерода, обмениваются гораздо медленнее.
В белках, в силу их химических свойств, способные к обмену протоны боковых групп некоторых аминокислот (например гидрокси-группа ОН серина и амино-группа NH2 глутамина и аспарагина) обмениваются намного быстрее, чем протоны пептидной связи или амидных групп глутамина и аспарагина. Эти два класса протонов – при гидроксиаминной и амидной группах различают по рН-зависимости скоростей водородного обмена — первый класс имеет минимум при рН 7, второй — при рН 3. Каждый класс протонов можно подразделить по принципу степени участия протонов в образовании водородных связей.
Поскольку скорость водородного обмена обычно гораздо меньше, чем скорость образования и разрыва водородных связей (которая контролирует доступ растворителя к группам, участвующим в образовании водородных связей), наблюдаемая скорость водородного обмена для любой группы есть произведение скорости водородного обмена на долю времени, в течение которого группа доступна растворителю. Таким образом, если протоны группы участвует в образовании водородной связи, то это должно приводить к понижению скорости водородного обмена.
Это происходит потому, что протоны в данных группах подвергается действию растворителя только тогда, когда имеет место локальный разрыв водородных связей. Следовательно, измеряя скорости водородного обмена для протонов открытых групп (например, в мономерах) и скорости обмена для аналогичных групп макромолекулы, можно определить в каждый данный момент времени долю протонов этих групп, не участвующих в образовании водородных связей.
В двухцепочечных нуклеиновых кислотах обмен протонов, участвующих в образовании водородных связей, значительно облегчается при действии агента, который разрывает водородные связи. Протон, потенциально способный к быстрому обмену, обменивается плохо, если он образует водородную связь.
Этот факт можно использовать для определения числа водородных связей, эффективности различных денатурирующих агентов или динамического состояния макромолекулы. При первом применении этой методики рассматривали только дейтериевый обмен, потому что 3Н2О была недоступна. Обнаружение дейтерия было очень трудной задачей, которую решали либо масс-спектрометрией, либо путем инфракрасной спектрофотометрии. Как только стала доступной 3Н2О, вместо дейтериевого обмена стали использовать тритиевый, поскольку тритий легко обнаруживать по радиоактивности.
Тритиевый обмен служит методом исследования структуры белка или ДНК. При этом требуется отделение макромолекул от 3Н2О. Такого специфического разделения можно достигнуть с использованием заряженного геля, поскольку 3Н2О сильно удерживается всеми гелями. Если поры геля имеют минимальный размер, макромолекулы выходят из геля без особого труда.
Рис. 1. Эксперимент по тритиевому обмену в белках.
Полипролин (А) и РНазу (Б) инкубировали в течение нескольких часов в 3Н2О до достижения максимального обмена. Затем образцы растворяли водой и через различные промежутки времени наносили на колонку с сефадексом G-25 для разделения белка от 3Н2О. На графике А отсутствует тритий, ассоциированный с полипролином, из чего следует, что либо водородный обмен не происходит, либо он происходит очень быстро. На графике Б показано, что в случае с РНКазой тритий связывается с белком. (из работы Englander W., Biochemistry, 2, 798-807 (1965).
Методика тритиевого обмена, в которой используется гель-проникающая хроматография на различных молекулярных ситах типа сефадекс (рис. 1), состоит в следующем. К белку или нуклеиновой кислоте в растворе Н2О добавляют тритиевую воду. Через различные промежутки времени отбирают пробы и помещают их на колонку. 3Н2О сильно задерживается колонкой, в то время как белки и нуклеиновые кислоты быстро проходят через нее. Используя колонку такой длины, что белок или нуклеиновая кислота проходят через нее за 10 секунд, концентрацию несвязанного трития понижают приблизительно в 108 раз.
Затем с колонки отбирают фракции и радиоактивность каждой определяют методом сцинтилляционного счетчика; концентрацию белка или нуклеиновой кислоты определяют спектрофотометрически или с помощью цветных реакций на белок. Так можно измерить число обменявшихся атомов водорода, приходящееся на единицу массы или на молекулу (если известна молекулярная масса) как функцию времени.
Методом тритиевого обмена получено несколько важных результатов. Например, установлено, что протоны, участвующие в образовании водородных связей двухцепочечной ДНК, могут обмениваться. Из данных по кинетике изотопного обмена и равновесному распределению изотопов и влиянию на них рН выяснено, что водородные связи в двухцепочечной ДНК постоянно разрушаются и образуются вновь; этот процесс назвали «дыханием» и предположили, что он лежит в основе возможного механизма таких процессов, как инициация синтеза ДНК и спаривание ДНК — ДНК при генетической рекомбинации.
Другой пример — определение числа водородных связей в тРНК путем измерения доли быстро обмениваемых протонов; эти данные были использованы учёными для подтверждения одной из предложенных структур тРНК.
В изотопных исследованиях с тяжёлой и тритиевой водой часто используют метод изотопного разбавления. Пусть надо проанализировать содержание соединения А в смеси, которую невозможно количественно разделить на отдельные компоненты.
Эту задачу можно выполнить следующим образом. К смеси добавляют небольшое количество А, содержащего известную примесь радиоактивного изотопа. Единственное условие дальнейшего анализа состоит в том, чтобы можно было хотя бы частично отделить из смеси компонент А в чистом виде. Введем коэффициент разбавления, равный отношению удельной активности изотопа А до разбавления к удельной активности того же изотопа после разбавления. Для стабильных изотопов отношение концентраций конкретного изотопа до и после разбавления во многих случаях можно определить с помощью масс-спектрометра. Исходя из коэффициента разбавления и количества добавленного компонента А, можно рассчитать концентрацию А в исходной смеси.
Метод изотопного разбавления можно использовать, например, для определения общего количества воды в организме. Для этого вводят известное количество воды, содержащей определенную примесь радиоактивного трития. Через некоторое время, требуемое для полного смешивания введенной воды с остальной ее частью, отбирают образец сыворотки крови и измеряют в нем удельную активность трития. Если при этом оказалось, что коэффициент разбавления равен, например, 800, то полное количество воды в организме в 800 раз превышает объем воды, введенной в эксперименте.
Метод изотопного обмена применим для многих биохимических, диагностических и структурно-функциональных исследований макромолекул, в том числе белков и ДНК.
Литература:
Д. Фрайфельдер, Физическая биохимия, М., Мир, 1982).
О.В. Мосин, Д.А. Складнев, В.И. Швец. Биотехнология. 2001, с. 16-32
www.o8ode.ru
ТЕРМОЯД: СКВОЗЬ ТЕРНИИ К ЗВЕЗДАМ
ПРЕОДОЛЕВАЯ НЕМАЛЫЕ ТРУДНОСТИ, ЧЕЛОВЕЧЕСТВО ВСЕ ЖЕ ПРОДВИГАЕТСЯ К САМЫМ ЭКОЛОГИЧЕСКИ ЧИСТЫМ И БЕЗОПАСНЫМ ЭНЕРГЕТИЧЕСКИМ УСТАНОВКАМ, ДЛЯ КОТОРЫХ К ТОМУ ЖЕ ЗЕМНЫЕ ЗАПАСЫ ТОПЛИВА БЕЗГРАНИЧНЫВ начале июня в Москве проходили’ Дни ИТЭР’ – представительная конференция, посвященная вопросам строительства первого в мире международного экспериментального термоядерного реактора.
Потребление энергии в мире стремительно растет – на 2,3 процента ежегодно, то есть удваиваясь каждые 30 лет, и сегодня составляет около 8 тераватт в год (1 ТВт = 10<SUP>12</SUP> Вт, тысяча миллиардов ватт).
Тепловые электростанции с кпд около 30% не только сжигают ценнейшее органическое сырье – нефть, природный газ и уголь , но и выбрасывают в атмосферу тысячи тонн копоти, углекислого газа и соединений серы.
Экспериментальная солнечная электростанция, построенная в Германии, вырабатывает 11 тысяч киловатт-часов электроэнергии в год.
Перспективным источником энергии сегодня во многих странах считаются ветроэлектростанции (ВЭС).
Реакторы будущего могут использовать энергию синтеза ядер, протекающую по четырем основным схемам с участием дейтерия (D), трития (T), нейтронов (n) и протонов (p).
‹
›
Собравшись в Москве в июне этого года, физики, инженеры, руководители промышленности и политические деятели Европейского союза, Японии, России, Канады, Казахстана, США и ряда других стран отметили знаменательное событие, которое наверняка войдет в историю не только научного, но и общечеловеческого прогресса. После более чем девяти лет совместной работы многих крупных исследовательских и промышленных центров создан технический проект первого в мире экспериментального термоядерного реактора. Проектирование осуществляется в рамках международной программы “Технический проект ИТЭР”. ITER (International Termonuclear Experimental Reactor – Международный Экспериментальный Термоядерный Реактор, а само слово iter в переводе с латыни означает шаг, шаг на пути к звездной энергии). Эта аббревиатура уже стала именем как самого проекта, так и будущего реактора. Собравшись на “Дни ИТЭР” в Москве, участники встречи обсудили не только завершенный ими проект и результаты испытаний изготовленных промышленностью основных экспериментальных узлов будущего реактора. В кулуарах встречи обсуждались и конкретные планы его постройки, в частности, возможные места для сооружения первенца будущей термоядерной энергетики и организация работ на этом завершающем этапе.
СТРАТЕГИЯ СТРЕКОЗЫ
Жить, всякий знает, можно по-разному. Можно проводить свои дни беспечно, беззаботно, не думая о завтрашнем: что есть, то съел, не хватит – займем, день прошел и прекрасно. Эта стратегия не раз была представлена в художественной литературе, например, в известной басне “Стрекоза и муравей”.
Можно жить и по-другому: полностью пожертвовать быстроубегающим нынешним деньком, все отдать подготовке к дню грядущему. И эту стратегию обрисовало нам писательское перо – вспомните припрятанные на черный день плюшкинские сухари.
В малых масштабах, в жизни отдельного человека, семьи, подобные крайности встретишь редко – люди в основном живут сегодняшним днем, но какую-то часть времени, сил, средств вкладывают в свое завтра. Тратят годы на образование, варят на зиму варенье, зарабатывают пенсию, заводят сберкнижку. Но вот что удивительно – большие общественные структуры, целые страны и даже, бывает, все человечество целиком уходят в текущие свои дела, к будущему относятся беспечно, в стиле стрекозы из басни Крылова. Посмотрите, с какой легкостью мы кромсаем природу, не задумываясь о том, что дело вот-вот дойдет до непоправимого. С удивительной беспечностью мы наполняем мир многообразием новых химических соединений, не думая о том, как они состыкуются с тонкими химическими машинами живой природы и во что могут превратить род человеческий. Обратите внимание, наконец, на то, с каким азартом мы черпаем из недр нефть, каждый раз подбадривая себя порцией оптимизма: “Ученые уверены, что нефти еще много, вполне хватит на 30 лет… Какое там на тридцать, по новейшим прогнозам, на сорок… Даже на пятьдесят – ура!..”
Но забываем, что период становления новой энергетики не менее 50 лет, так что мы уже опоздали…
Нельзя, конечно, сказать, что человечество совсем уже беспечно относится к вопросам энергетики в целом. Нет, нет – кое-что все же делается, чтобы иметь энергетическую подмену к моменту, когда на индикаторе мирового бензобака стрелка упадет до нуля. Но делается, как считают специалисты, намного меньше, чем можно было бы. И уж наверняка меньше, чем нужно.
Во всяком случае сегодня мировое сообщество тратит на подготовку к неотвратимо надвигающейся энергетической зиме в тысячи раз меньше средств, чем на совершенно пустое, бессмысленное дело – на вооружение. На то, чтобы народы, жители единого дома могли пугать друг друга, напоминая детей, которые играют в войну и еще ничего не знают о проблемах взрослой жизни.
ЭКСКУРСИЯ В ЗАКРОМА
Сейчас основную часть всей потребляемой энергии дает нам органическое топливо – нефть, уголь, газ. И в основном живем мы только за счет того, что природа в свое время создала молекулы этих углеводородов, что она, образно говоря, сжала бессчетные молекулярные пружины и они, распрямляясь, возвращают запасенную энергию. Происходит это так – в процессе горения, то есть соединяясь с отобранным из воздуха кислородом, органическая молекула выделяет микропорцию тепла. А поскольку таких молекул много (в одном грамме нефти, например, миллиарды миллиардов), то при сжигании органического топлива можно получить немалую энергию. Именно эта нехитрая химия обеспечивает сегодня почти все наше энергетическое пропитание – тепло и свет в домах, сталеплавильные печи и хлебозаводы, миллионы тракторов на полях и сотни миллионов автомобилей на дорогах. Еще раз напомним – все это начинается с химической реакции окисления углеводородов, с процессов в электронных оболочках атомов.
Есть у нас, у землян, и иные источники энергии. Самый, казалось бы, бесплатный – Солнце, в виде тепла и света отдающее Земле чуть ли ни в миллион раз больше киловатт, чем сегодня потребляет наше индустриальное общество. Но попробуй собери эти бесплатные киловатты – никаких денег не хватит. По мелочам выходит неплохо – микрокалькуляторы и иная маломощная электроника уже давно питаются электричеством, полученным с помощью света. Хорошие полупроводниковые панели превращают в электричество примерно 20 процентов попадающей на них солнечной энергии, и энтузиасты в своих гаражах уже строят автомобили и яхты на солнечной тяге (см. “Наука и жизнь” № 6, 2001 г.). Но накормить таким способом города и страны – совсем другое дело. Огромные панели занимают много места, и на их работу сильно влияют капризы погоды. Поэтому предлагается когда-нибудь запустить на высокую околоземную орбиту спутники с огромными, километровых размеров панелями солнечных батарей и оттуда, с орбиты, гнать энергию на Землю с помощью мощнейшего луча радиоволн. Но как это будет влиять на экологию планеты – большой вопрос!
Пока же хорошо использовать солнечную энергию умеют только растения. Не случайно нынешних изобретателей так привлекает “старый способ” – сжигание древесины. Но так, чтобы получать в основном не тепло, а горючий газ, который можно будет вывозить с лесных энергетических плантаций в баллонах или транспортировать по трубопроводам.
Кое-где в ощутимых масштабах энергию добывают, используя вторичные эффекты солнечной активности – ветер и круговорот воды, питающий реки. Есть в резерве еще и неостывшие недра планеты – уже на глубине 100-200 километров ее температура измеряется сотнями градусов. Энергию подбрасывает нам заведенное миллиарды лет назад небесное перпетуум-мобиле – Луна. Вращаясь вокруг Земли, она создает на ней приливные волны, от которых только на побережье морей и океанов в принципе можно было бы собрать энергетический урожай, составляющий 10 процентов наших нынешних потребностей. Новую область крупномасштабной химической энергетики мог бы открыть водород, если дешево и безопасно добывать, хранить и сжигать его.
А еще есть в наших закромах огромные запасы энергии, припрятанные природой в атомных ядрах, о чем мы вскоре поговорим особо.
Одним словом, в целом источников энергии немало, проблема лишь в том, как эту энергию извлечь, как ее пустить в дело, затратив не слишком много сил. И не испортив при этом Природу – среду нашего обитания.
МАШИНА, РАБОТАЮЩАЯ В ДВУХ СОВЕРШЕННО РАЗНЫХ РЕЖИМАХ
Как было только что отмечено, энергией нас снабжают в основном атомы и молекулы. Горят дрова, взрываются в цилиндрах автомобильного двигателя пары бензина, сгорает газ в паровых котлах городской электростанции – во всех этих случаях определенные атомы в молекулах топлива соединяются с кислородом. При этом объединяются и перестраиваются некоторые их электронные орбиты, и в результате такой перестройки новая молекулярная система выбрасывает во внешний мир то, что для нее оказалось лишним – порцию энергии. Для разных химических реакций это разная порция, но всегда не очень большая – несколько электрон-вольт. Напомним, что электрон-вольт (эВ) – это одна из единиц измерения энергии, так же как метр или дюйм – одна из единиц измерения длины. Энергия 1 эВ появится у электрона, если его ускорить в электрическим поле с разностью потенциалов в 1 вольт. Более крупная единица – мегаэлектронвольт, 1 МэВ = 1 000 000 эВ. Лампочка небольшого карманного фонарика за минуту потребляет примерно сто миллиардов МэВ.
Не зная всех этих подробностей, человек тысячи лет использовал энергию горения. Глубокие исследования мира атомов и молекул позволили постепенно понять суть дела и в итоге открыли для энергетики принципиально новые возможности. В частности, в начале прошлого века стало выясняться, что энергетическая машина “Атом” может выдавать во внешний мир энергию, работая, так сказать, в двух совершенно разных режимах и используя при этом две разные силы – электромагнитную и ядерную.
В настоящее время известны всего четыре разновидности сил или взаимодействий: ядерные, электромагнитные, гравитационные и слабые. Другие науке не известны! Почему их именно четыре? Почему они такие, какие есть, а не другие? Почему действуют так, как они действуют, а не как-нибудь иначе? На подобные вопросы сегодня есть один ответ – так устроен мир, в котором мы живем (см. “Наука и жизнь” № 11, 2000 г.). Первые две силы из великолепной четверки нам хорошо известны – мы неоднократно видели их в работе. Это гравитация (бутерброд падает на пол) и электромагнитные силы (клочки бумаги тянутся к натертой расческе, железные опилки – к магниту). Две другие силы нельзя обнаружить столь же просто, они действуют лишь в атомном ядре, причем на очень малых расстояниях – меньше триллионной доли миллиметра. Это третья по счету ядерная, или иначе – сильная, сила и четвертая по счету – слабая сила (название не самое удачное: она на много порядков сильнее гравитации).
Ядерные силы стягивают, или, как часто говорят, склеивают, тяжелые частицы атомного ядра – протоны и нейтроны. И для такого склеивания, стягивания протонов и нейтронов в единое ядро силы нужны немалые. Достаточно вспомнить, что у протонов есть положительный заряд, а одноименные заряды, как известно, взаимно отталкиваются. Причем на малых внутриядерных расстояниях протоны расталкиваются особенно энергично, ядерные силы должны быть действительно очень сильными, чтобы ядра не разваливались и мир был стабильным, устойчивым.
Вместе с тем в каких-то случаях и в атомных ядрах могут происходить изменения, в том числе и такие, после которых от ядерных сил требуется меньше усилий и их избыток уходит из ядра в виде порции энергии. В принципе происходит то же самое, что и при химических реакциях, при изменениях в электронной структуре атомов – атом меняет свое состояние, и это сопровождается выделением уже не нужной ему энергии. Но только изменения в атомных ядрах, изменения с участием могучих ядерных сил сопровождаются несравнимо большим выделением энергии, чем дают химические процессы, то есть процессы в электронных оболочках, где в основном действуют не очень мощные (в сравнении с ядерными) электромагнитные силы.
В этом одно из главных достоинств атомной, или, лучше сказать, ядерной, энергетики – каждый участвующий в деле атом выдает в миллионы раз больше энергии, чем при химических реакциях. Второе достоинстово – запасы ядерного топлива достаточно велики, а для ядерного синтеза, где энергию получают в основном из ядер водорода и топливом может служить обычная вода, – практически безграничны.
СТАКАН ВОДЫ ВМЕСТО БОЧКИ БЕНЗИНА
Существуют два поставщика ядерной энергии – деление, распад атомных ядер и создание, синтез нового ядра из двух слившихся более простых ядер. Реакции деления, в частности деление атомных ядер урана, используется в современных, так сказать, традиционных атомных электростанциях. Их в мире уже работает больше четырехсот общей мощностью почти 350 гигаватт (1 ГВт = 109 Вт), что составляет более 4 процентов мировой энергетики. А в некоторых странах они производят весьма заметную часть электроэнергии – во Франции, например, 75 процентов, в Бельгии – 58, в Японии – 35, в США – 20, в России – 14.
Что же касается синтеза, то здесь реально речь идет об одном виде таких ядерных реакций – о слиянии двух ядер водорода, точнее его изотопов, в одно ядро, в ядро гелия. Каждое такое слияние двух водородных ядер в расчете на единицу массы дает во много раз больше энергии, чем деление уранового ядра, и при этом не сопровождается появлением радиоактивных отходов. Наконец, еще одно достоинство – водорода чрезвычайно много и на Земле, и во Вселенной. Не случайно при сотворении мира Природа выбрала именно водородный синтез для своих энергетических агрегатов – для звезд. Так, в частности, вся гигантская энергия, которую выдает наше Солнце, в том числе тепло и свет, попадающий на Землю (0,0000001 процента общей солнечной мощности), рождается из ряда ядерных реакций синтеза. Поняв это, вполне естественно было подумать о том, чтобы воспроизвести водородный синтез в земных условиях – заставить маленькое прирученное Солнце щедро кормить нас энергией. Тогда уже не нужно будет опасаться энергетического голода – водород можно брать из воды, а ее у нас немерено. К тому же ядерные реакции – это вам не слабосильное горение, водородный синтез позволит из стакана обычной воды, в которой есть и молекулы D2О, получить столько энергии, сколько дает сжигание целой бочки бензина.
НЕВИДИМЫЕ МИРУ СЛЕЗЫ
Крылатое выражение “невидимые миру слезы” вполне можно отнести к многолетним попыткам использовать водородный синтез в большой энергетике. Широкая публика часто слышала о том, что в этой области проводятся интересные исследования, строятся экспериментальные установки, что наука весело и успешно приближается к намеченной цели. Но мало кто знает, с какими сложными, порой, казалось, неразрешимыми проблемами сталкивались физики и инженеры, как много появлялось на их пути совершенно неожиданных препятствий, как дорого приходилось платить чуть ли ни за каждое продвижение вперед. Достигнутый сегодня рубеж – технический проект термоядерного реактора – не только итог многолетних усилий многих тысяч профессионалов высочайшего уровня. Это на самом деле еще и напоминание о мужестве ученых и инженеров, умеющих держать удар и разумно рисковать, преодолевать, казалось бы, непреодолимое и, сделав ставку на математический прогноз, начинать работы стоимостью в миллионы долларов, взяв на себя ответственность за результат.
Невозможно рассказать обо всех задачах, которые решались и еще только решаются на пути к энергетическому реактору ядерного синтеза. Но о некоторых из них полезно знать даже человеку, не имеющему возможности вникать в детали, – это поможет почувствовать масштабы проблемы.
Получать энергию от ядерного синтеза научились почти полвека назад, но лишь в виде неуправляемой лавины – в водородной бомбе. А энергетике нужен не взрыв, а ровное “горение”, непрерывное выделение энергии. Иначе говоря, энергетике нужен управляемый термоядерный синтез, сокращенно УТС.
Настал, видимо, момент пояснить значение приставки “термо” в слове “термояд”, которая появилась вместе с названием самого проекта ИТЭР. Чтобы получить ядро гелия из двух ядер водорода, нужно с огромной силой столкнуть эти ядра. Тогда они смогут преодолеть взаимное электрическое отталкивание (не забудьте: ядро водорода – это протон, частица с положительным электрическим зарядом) и сблизиться до чрезвычайно малого расстояния 10-13 см, когда уже начинают действовать ядерные силы.
Процесс синтеза обычно осуществляют в газообразном водороде, нагретом до очень высокой температуры: чем выше температура, тем больше средняя энергия хаотически движущихся частиц газа. Правильнее, пожалуй, сказать иначе: температура – это мера интенсивности движения частиц, мера их скорости и, следовательно, их кинетической энергии. Чем выше температура, тем больше ядер имеют энергию, позволяющую преодолеть электрическое расталкивание и сблизиться для последующего слияния в ядро гелия.
Для эффективного ядерного синтеза нужно нагреть водородный газ до температуры в сотни миллионов градусов. Для получения большой энергии при синтезе ядер гелия используют изотопы водорода – тяжелый водород дейтерий и сверхтяжелый – тритий. Однако для упрощения мы будем там, где это возможно, называть эти изотопы просто водородом. И еще одно терминологическое замечание – при высокой температуре атомы сбрасывают свои электронные оболочки и вместо водородного газа, состоящего из нейтральных атомов, образуется плазма – в целом квазинейтральная смесь свободных атомных ядер и свободных электронов.
Итак, для ядерного синтеза водородный газ нужно очень сильно нагреть, попутно превратив его в водородную, а точнее дейтерий-тритиевую , плазму. С ростом температуры возрастает вероятность слияния водородных ядер, а значит, и эффективность процесса – выход высвободившейся энергии. Здесь, правда, есть немало тонкостей. Температуру, в частности, можно снизить, не потеряв эффективности, если увеличить давление водородного газа, но при этом возникает ряд новых проблем. В лабораторных установках для термоядерного синтеза плазма имеет температуру 50-100 миллионов градусов, а в ИТЕРе она будет поддерживаться на уровне 150-200 миллионов. В недрах Солнца ядерный синтез идет при температуре 20 миллионов градусов, но там водород очень сильно сжат гравитационными силами – огромной солнечной массой.
(Окончание следует.)
Подробности для любознательных
СКОЛЬКО ТОПЛИВА НА ЗЕМЛЕ
Энергию, столь необходимую человечеству, сегодня получают в основном за счет сжигания углеродного топлива (1). Часть энергии (в ряде стран – немалую) дают атомные электростанции, работающие за счет деления радиоактивного изотопа урана 235U, количество которого составляет только 0,71% от общей массы природного урана. Практически все остальное – его “негорючий” изотоп 238U. Однако делящиеся изотопы урана и плутония (238Pu) нетрудно получить искусственно, облучая потоком нейтронов уран 238U и торий 232Th (2):
238U + n → 239Pu + 2e– +γ + 2;
232Th + n → 233U + e– + γ + .
В качестве своего рода “побочных продуктов” реакции при каждом взаимодействии возникает гамма-излучение (γ) и вылетают электроны(e –) и электронные антинейтрино ().
Наилучшим образом эти реакции проходят в ныне действующих реакторах-размножителях на быстрых нейтронах (бридерах), а в будущем, если потребуется, их можно будет проводить в бланкетах термоядерных реакторов (3).
Из таблицы видно, что запасы сырья для ядерной энергии синтеза (лития, из которого получают тритий) примерно в 30 раз превышают запасы урана и тория, пригодных для получения энергии деления. К тому же на тритии будут работать термоядерные реакторы только первого поколения. Уже сейчас идет работа по созданию реактора на безнейтронных реакциях синтеза, например на 3He (3He + 3He → 4He + 2p+ +12,8 Мэв) и других легких ядрах. А все органическое топливо Земли – нефть, газ и уголь – может дать только одну стомиллионную часть этой энергии. При современной мощности мировой энергетики запасов органического топлива, в первую очередь угля, хватит лет на двести, а сырья для ядерной энергетики – на тысячелетия.
ОТКУДА БЕРУТСЯ ТРИТИЙ И ДЕЙТЕРИЙ
Изотоп водорода, содержащий два “лишних” нейтрона – тритий 3H, или T, имеет период полураспада 12,26 года. Количество природного трития на Земле не превышает четырех килограммов. Но поскольку на его реакции с дейтерием основано действие термоядерного оружия, современные запасы трития исчисляются десятками килограммов. Откуда же он берется?
В природе тритий образуется при бомбардировке нейтронами космического излучения атомов азота воздуха:
147 N + n = 31T + 342 He.
А в реакторах деления тритий получают за счет взаимодействия с нейтронами ядер лития:
63 Li + n = 31 T + 42 He.
Эта реакция проходит гораздо интенсивнее, чем природная, поэтому и количество трития удается поддерживать на должном уровне.
Дейтерий 2H, или D, стабилен, в природе имеется, хотя и в очень малых количествах – 0,015% общего количества водорода. Обыкновенная вода рек, озер, морей и океанов хранит его в молекулах D2O – “тяжелой воды”. Масса дейтерия в два раза больше массы водорода, поэтому скорости химических реакций между веществами, их содержащими, могут отличаться раз в 5 – 10. Эту особенность и используют для выделения дейтерия, применяя многоступенчатый электролиз воды, “выпаривание” жидкого водорода и другие методы.
www.nkj.ru
Реакции с дейтерием и тритием
Тритий можно получить бомбардировкой дейтерия дейтронами. Написать уравнение этой реакции. [c.37]Водород широко используется в химической промышленности для синтеза аммиака, метанола, хлорида водорода, для гидрогенизации твердого и жидкого тяжелого топлива, жиров и т. д. В смеси с СО (в виде водяного газа) применяется как топливо. При горении водорода в кислороде возникает высокая температура (до 2600°С), используемая для сварки и резки тугоплавких металлов, кварца и др. Жидкий водород используют как одно из наиболее эффективных реактивных топлив. В атомной энергетике для осуществления ядерных реакций большое значение имеют изотопы водорода — тритий и дейтерий. [c.275]
В реакции ядерного деления способны вступать изотопы элементов с > 84 ядерный синтез возможен для наиболее легких изотопов — дейтерия, трития. [c.467]
Нейтроны действуют практически на все химические элементы с образованием радиоактивных изотопов, большинство которых имеет малые периоды полураспада и не накапливается в земной коре. Однако некоторые радиоактивные изотопы находятся в земной коре именно благодаря ядерным реакциям химических элементов с нейтронами. Например при действии нейтронов на все водородсодержащие вещества происходит образование из дейтерия трития 2Н(п, у) Н. [c.259]
Пути превращений органических соединений успешно исследуются методом меченых атомов. В молекулу органического соединения вводят изотопы водорода (дейтерия, трития) или радиоактивные изотопы других элементов (кислорода, азота, серы, углерода), что дает возможность установить механизм реакции. В некоторых случаях этот метод, оказавший неоценимые услуги в биологии, является единственным, дающим однозначное суждение о течении химического процесса. Квантовомеханические методы, например метод молекулярных орбиталей (МО ЛКАО — молекулярные орбитали — линейная комбинация атомных орбиталей), позволяют рассчитывать молекулярные диаграммы органических соединений, включающие такие параметры, как порядок связей, индексы свободных валентностей, эффективные заряды на атомах, и оценивать способность молекул к химическим реакциям. [c.8]
Применение. В. широко используется в химич. пром-сти, преим. для произ-ва аммиака крупным потребителем В. является также произ-во метанола, синтезируемого из В. и СО. На основе синтеза из В. и СО получают и другие спирты, а также альдегиды, кетоны и др. продукты. В. применяют для гидрогенизации твердого и тяжелого жидкого топлива, а также жиров и различных органич. соединений, для синтеза НС1, для гидроочистки продуктов переработки нефти, в сварке и резке металлов горячим кислородо-водородным пламенем (темп-ра до 2800°), а также в атомарно-водородной сварке (темп-ра до 4000°). В прошлом В. использовался для наполнения аэростатов и дирижаблей. Очень важное применение в ато.мной энергетике нашли изотопы В. (см. Дейтерий, Тритий, Термоядерные реакции). [c.312]
Широко используются также изотопы водорода — дейтерий и тритий. Тяжелая вода ОгО используется в атомной энергетике как замедлитель нештронов в атомных реакторах. Дейтерий и тритий используются в ка-честпе термоядерного горючего в водородных бомбах, поскольку при реакции [c.288]
Для решения теоретических и практических задач весьма важно определить лимитирующую стадию реакции. Использование с этой целью ароматических углеводородов, содержащих вместо атомов водорода дейтерий или тритий, позволяет в несколько раз снизить скорость 2 второй стадии реакции, т. е. отрыва Н+. Подобный кинетический изотопный эффект объясняется большей энергией связи С—D и С—Т по – сравнению со [c.44]
Обратимся вначале к симметричным реакциям Х-перехода. Предположение о том, что активированный комплекс таких реакций локализован в центральной области района, является, по-видимому, достаточно обоснованным. Так, замещение атома водорода на дейтерий или тритий приводит к сильному первичному кинетическому изотопному эффекту в реакции На Н- Н – – Н . Этот результат [2321 [c.149]
При исследовании механизма реакции электрофильного замещения применялся изотопный метод [159]. Оказалось, что соединения, меченные дейтерием и тритием, замещаются с такой же скоростью, как и водородсодержащие аналоги, т. е. заметного изотопного кинетического эффекта для большинства реакций не наблюдается. Учитывая, что энергия разрыва связей углерод — дейтерий и углерод — третий выше, чем энергия связи С—Н, можно заключить, что последняя стадия реакций электрофильного замещения — отрыв протона — не должна быть лимитирующей. Поскольку образование л-комплексов — быстрый процесс, то в качестве лимитирующей стадии остается изомеризация я-комплекса в а-комплекс. [c.238]
Практически существенные изотопные эффекты наблюдаются лишь в случае замены атома водорода на дейтерий или тритий. В этом случае скорости реакций для реагентов, содержащих разные изотопы, могут отличаться в несколько раз. Для остальных элементов изотопные эффекты невелики и не превышают обычно нескольких процентов. Поэтому в дальнейшем рассматривается только изотопный эффект водорода. [c.132]
В настоящее время исследуется практическое осуществление термоядерного синтеза по так называемой дейтериево-тритиевой реакции, в ходе которой дейтерий и тритий превращаются в ядра гелия гНе с выделением в ходе слияния двух ядер огромной энергии (17,6 МэВ) и одного нейтрона. [c.17]
Практически существенные изотопные эффекты наблюдаются лишь в случае замены атома водорода на дейтерий или тритий. В этом случае скорости реакций для реагентов, содержаш их разные изотопы, могут [c.121]
Однако кинетический метод с использованием ароматических соединений, меченных дейтерием и тритием, позволил однозначно установить, что большинство реакций электрофильного замещения в ароматическом ядре протекает по двухстадийному механизму. Если бы реакции протекали по первому механизму в одну стадию или если бы вторая стадия второго механизма лимитировала весь процесс, то при замене в реагирующем ароматическом соединении водорода на дейтерий или тритий наблюдался бы изотопный эффект, т. е. произошло бы значительное уменьшение скорости реакции. (Известно, что вследствие различия масс водорода, дейтерия и трития разрыв связи С—Н происходит в 5—8 раз быстрее, чем связи С—О, и в 20—30 раз быстрее, чем связи С—Т). [c.315]
Реакция ядерного синтеза также может служить источником энергии. Так, при образовании ядра атома гелия из ядер дейтерия и трития
www.chem21.info