Изотопы водорода: свойства, характеристика и применение
Любой химический элемент имеет разновидности природного или искусственного происхождения, называемые изотопами. Различие между ними заключается в неодинаковом количестве нейтронов в ядрах и, следовательно, в атомном весе, а также в степени стабильности. Что касается количества протонов, то оно одинаково, благодаря чему элемент, собственно, и остается самим собой. В этой статье мы обратимся к изотопам водорода – самого легкого и распространенного элемента во Вселенной. Нам предстоит рассмотреть их свойства, роль в природе и область практического применения.
Сколько разновидностей имеет водород
Ответ на этот вопрос зависит от того, какие изотопы водорода имеются в виду.
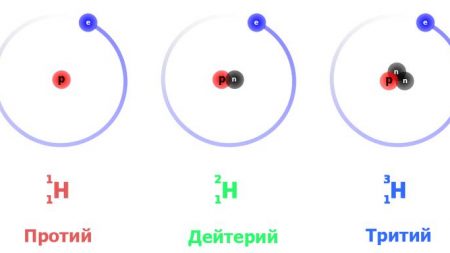
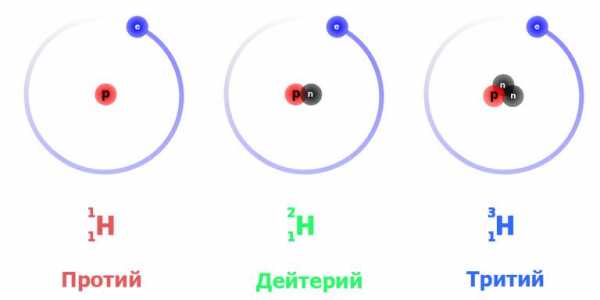
Для этого элемента установлено три природных изотопных формы: протий – легкий водород, тяжелый дейтерий и сверхтяжелый тритий. Все они обнаружены в естественном виде.
Помимо них, существуют четыре искусственно синтезированных изотопа: квадий, пентий, гексий и септий. Характеризуются данные разновидности чрезвычайной нестабильностью, время жизни их ядер выражается величинами порядка 10-22 – 10-23 секунд.
Таким образом, всего на сегодняшний день у водорода известно семь изотопных разновидностей. На трех из них, имеющих практическое значение, мы и сосредоточим свое внимание.
Легкий водород
Это наиболее просто устроенный атом. Изотоп водорода протий с атомной массой 1,0078 а. е. м. обладает ядром, в состав которого входит только одна частица – протон. Поскольку он стабилен (теоретически время жизни протона оценивается не менее чем в 2,9×1029 лет), то стабилен и атом протия. При записи ядерных реакций он обозначается как 1h2 (нижний индекс – это атомный номер, то есть число протонов, верхний – общее число нуклонов в ядре), иногда просто p – «протон».
Легкий изотоп – это почти 99,99 % всего водорода; лишь чуть более одной сотой процента приходится на остальные формы. Именно протий вносит решающий вклад в распространенность водорода в природе: во Вселенной в целом – около 75 % массы барионного вещества и приблизительно 90 % атомов; на Земле – 1 % массы и целых 17 % атомов всех элементов, входящих в состав нашей планеты. Вообще, протий (точнее сказать, протон как один из главных компонентов Вселенной) смело можно назвать важнейшим элементом. Он обеспечивает возможность термоядерного синтеза в недрах звезд, в том числе и Солнца, и за счет него образуются прочие элементы. Кроме того, легкий водород играет важную роль в построении и функционировании живого вещества.

В молекулярной форме водород вступает в химические взаимодействия при высоких температурах, поскольку для расщепления его достаточно прочной молекулы нужно много энергии. Атомарный водород характеризуется очень высокой химической активностью.
Дейтерий
Тяжелый изотоп водорода имеет более сложно устроенное ядро, состоящее из протона и нейтрона. Соответственно атомная масса дейтерия вдвое больше – 2,0141. Принятое обозначение – 2h2 или D. Эта изотопная форма также стабильна, так как в процессах сильного взаимодействия в ядре протон и нейтрон постоянно превращаются друг в друга, и последний не успевает претерпеть распад.
На Земле водород содержит от 0,011% до 0,016% дейтерия. Концентрация его различна в зависимости от среды: в морской воде этого изотопа больше, а в составе, например, природного газа – существенно меньше. На других телах Солнечной системы отношение дейтерия к легкому водороду может быть иным: так, лед некоторых комет содержит большее количество тяжелого изотопа.
Дейтерий плавится при 18,6 К (легкий водород – при 14 К), а кипит при 23,6 К (соответствующая точка протия – 20,3 К). Тяжелый водород проявляет, в общем, те же химические свойства, что и протий, образуя все характерные для этого элемента типы соединений, однако ему присущи и некоторые особенности, связанные с серьезной разницей в атомной массе – ведь дейтерий тяжелее в 2 раза. Следует заметить, что по этой причине изотопным формам водорода свойственны наибольшие химические различия из всех элементов. В целом для дейтерия характерны более низкие (в 5 – 10 раз) скорости протекания реакций.
Роль дейтерия в природе
Ядра тяжелого водорода принимают участие в промежуточных стадиях термоядерного цикла. Солнце светит благодаря этому процессу, на одном из этапов которого образующийся изотоп водорода дейтерий, сливаясь с протоном, рождает гелий-3.

Вода, в состав которой входит, кроме протия, один атом дейтерия, называется полутяжелой и имеет формулу HDO. В молекуле тяжелой воды D2O дейтерий полностью заменяет легкий водород.
Тяжелая вода характеризуется замедленным течением химических реакций, вследствие чего в больших концентрациях она вредна для живых организмов, особенно высших, таких как млекопитающие и в том числе человек. Если в составе воды четверть водорода замещена дейтерием, длительное употребление ее чревато развитием бесплодия, анемии и других заболеваний. При замещении 50% водорода млекопитающие погибают через неделю употребления такой воды. Что касается кратковременных повышений концентрации тяжелого водорода в воде, она практически безвредна.

Как получают тяжелый водород
Удобнее всего получать этот изотоп в составе воды. Есть несколько способов обогащения воды дейтерием:
- Ректификация – процесс разделения смесей на компоненты, кипящие при разной температуре. Разделение достигается через многократное испарение и конденсацию смеси изотопов в жидком водороде или воде на специальном оборудовании – ректификационных колоннах, в которых потоки газообразной и жидкой фаз идут во встречных направлениях.
- Электролитическое разделение. Метод основан на том, что при электролизе воды от ее молекул более активно отщепляется легкий изотоп. Электролиз проводят в несколько этапов.
- Ионный изотопный обмен, при котором происходит взаимное замещение ионов разных изотопов в составе реагентов. В настоящее время этот способ с использованием воды и сероводорода в качестве реагирующих компонентов является наиболее эффективным и экономичным.

Тритий
Сверхтяжелый изотоп водорода, в ядре которого наличествуют протон и два нейтрона, имеет атомную массу 3,016 – примерно втрое больше, чем у протия. Тритий обозначается символом Т либо 3h2. Он плавится и кипит при еще более высоких температурах: 20,6 К и 25 К соответственно.
Это радиоактивный нестабильный изотоп с периодом полураспада 12,32 года. Образуется он при бомбардировке ядер атмосферных газов, например, азота, частицами космических лучей. Распад изотопа происходит с испусканием электрона (так называемый бета-распад), при этом один нейтрон в ядре претерпевает превращение в протон, а химический элемент повышает атомный номер на единицу, становясь гелием-3. В природе тритий присутствует в следовых количествах – его очень мало.
Сверхтяжелый водород образуется в тяжеловодных ядерных реакторах при захвате дейтерием медленных (тепловых) нейтронов. Часть его доступна для извлечения и служит источником трития. Кроме того, его получают как продукт распада лития при облучении последнего тепловыми нейтронами.
Тритий характеризуется малой энергией распада и представляет некоторую радиационную опасность только в случаях, когда попадает внутрь организма с воздухом или пищей. Для защиты кожных покровов от бета-излучения достаточно резиновых перчаток.
Применение изотопов водорода
Легкий водород используется во множестве отраслей: в химической промышленности, где с его помощью ведется производство аммиака, метанола, соляной кислоты и других веществ, в нефтепереработке и металлургии, где он необходим для восстановления тугоплавких металлов из оксидов. Также он применяется на некоторых стадиях производственного цикла (в производстве твердых жиров) в пищевой и косметической промышленности. Водород служит одним из видов ракетного топлива и используется в лабораторной практике в науке и на производстве.
Дейтерий незаменим в ядерной энергетике как прекрасный замедлитель нейтронов. Он применяется в этом качестве, а также как теплоноситель в тяжеловодных реакторах, позволяющих использовать природный уран, что снижает затраты на обогащение. Он также, наряду с тритием, является компонентом рабочей смеси в термоядерном оружии.

Химические свойства тяжелого водорода позволяют использовать его в производстве медицинских препаратов в целях замедления выведения их из организма. И, наконец, дейтерий (как и тритий) имеет перспективы в качестве топлива в термоядерной энергетике.
Итак, мы видим, что все изотопы водорода так или иначе «находятся при деле» как в традиционных, так и в высокотехнологичных, имеющих прицел на будущее отраслях техники, технологии и научных исследований.
www.nastroy.netВодород — ТеплоВики – энциклопедия отопления
Материал из ТеплоВики – энциклопедия отоплении
Водоро́д (лат. Hydrogenium; обозначается символом H) — первый элемент периодической системы элементов. Широко распространён в природе. Катион (и ядро) самого распространённого изотопа водорода H — протон. Свойства ядра H позволяют широко использовать ЯМР-спектроскопию в анализе органических веществ.
Три изотопа водорода имеют собственные названия: H — протий (Н), H — дейтерий (D) и H — тритий (радиоактивен) (T).
Простое вещество водород — H2 — лёгкий бесцветный газ. В смеси с воздухом или кислородом горюч и взрывоопасен. Нетоксичен. Растворим в этаноле и ряде металлов: железе, никеле, палладии, платине.
История
Еще средневековый ученый Парацельс заметил, что при действии кислот на железо выделяются пузырьки какого-то «воздуха». Но что это такое, он объяснить не мог. Теперь известно, что это был водород. «Водород представляет пример газа, – писал Д.И.Менделеев, – на первый взгляд не отличающегося от воздуха… Парацельс, открывший, что при действии некоторых металлов на серную кислоту получается воздухообразное вещество, не определил его отличия от воздуха. Действительно, водород бесцветен и не имеет запаха, так же, как и воздух; но, при ближайшем знакомстве с его свойствами, этот газ оказывается совершенно отличным от воздуха».
Английские химики 18 в., Генри Кавендиш и Джозеф Пристли, заново открывшие водород, первыми изучили его свойства. Они обнаружили, что это необычайно легкий газ – он в 14 раз легче воздуха. Если надуть им резиновый шарик, он взлетит ввысь. Это свойство водорода использовали раньше для наполнения воздушных шаров и дирижаблей. Правда, первый воздушный шар, построенный братьями Монгольфье, был наполнен не водородом, а дымом от горения шерсти и соломы. Такой странный способ получения горячего воздуха связан с тем, что братья, видимо, не были знакомы с законами физики; они наивно полагали, что эта смесь образует «электрический дым», способный поднять их легкий шар. Физик Шарль, знавший закон Архимеда, решил наполнить шар водородом; в отличие от монгольфьеров, наполненных горячим воздухом, шары с водородом французы называли шарльерами. Первый такой шар (он не нес никакого груза) поднялся с Марсова поля в Париже 27 августа 1783 и за 45 минут пролетел 20 км.
В декабре 1783 Шарль в сопровождении физика Франсуа Робера в присутствии 400 тысяч зрителей предприняли первый полёт на воздушном шаре, заполненном водородом. Гей-Люссак (также совместно с физиком Жаном Батистом Био) поставил в 1804 рекорд высоты, поднявшись на 7000 метров.
Но водород горюч. Более того, его смеси с воздухом взрываются, а смесь водорода с кислородом называют даже «гремучим газом». В мае 1937 пожар за несколько минут уничтожил гигантский немецкий дирижабль «Гинденбург» – в нем было 190 000 кубометров водорода. Тогда погибло 35 человек. После многих несчастных случаев водород в воздухоплавании больше не используют, его заменяют гелием или горячим воздухом.
При горении водорода образуется вода – соединение водорода и кислорода. Это доказал в конце 18 французский химик Лавуазье. Отсюда и название газа – «рождающий воду». Лавуазье также сумел получить водород из воды. Он пропускал водяные пары через раскаленную докрасна железную трубку с железными опилками. Кислород из воды прочно соединялся с железом, а водород выделялся в свободном виде. Сейчас водород тоже получают из воды, но другим способом – с помощью электролиза (см. ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ. ЭЛЕКТРОЛИТЫ)
Свойства водорода
Водород – самый распространенный химический элемент во Вселенной. Он составляет примерно половину массы Солнца и большинства звезд, является основным элементом в межзвездном пространстве и в газовых туманностях. Распространен водород и на Земле. Здесь он находится в связанном состоянии – в виде соединений. Так, вода содержит 11% водорода по массе, глина – 1,5%. В виде соединений с углеродом водород входит в состав нефти, природных газов, всех живых организмов. Немного свободного водорода содержится в воздухе, но его там совсем мало – всего 0,00005%. Он попадает в атмосферу из вулканов.
Водороду принадлежит много других «рекордов».
Жидкий водород – самая легкая жидкость (плотность 0,067 г/см3 при температуре –250°С),
Твердый водород – самое легкое твердое вещество (плотность 0,076 г/см3).
Атомы водорода – самые маленькие из всех атомов. Однако при поглощении энергии электромагнитного излучения внешний электрон атома может удаляться от ядра все дальше и дальше. Поэтому возбужденный атом водорода теоретически может иметь любые размеры. А практически? В книге Мировые рекорды в химии сказано, что в межзвездных облаках якобы обнаружены по их спектрам атомы водорода диаметром 0,4 мм (они зафиксированы по спектральному переходу с 253-й на 252-ю орбиталь). Атомы таких размеров вполне можно увидеть невооруженным глазом! При этом дается ссылка на статью, опубликованную в 1991 в самом известном в мире журнале, посвященном химическому образованию – Journal of Chemical Education (он издается в США). Однако автор статьи ошибся – он завысил все размеры ровно в 100 раз (об этом сообщил тот же журнал год спустя). Значит, обнаруженные атомы водорода имеют диаметр «всего лишь» 0,004 мм, и такие атомы, даже если бы они был «твердыми», невооруженным глазом увидеть нельзя – только в микроскоп. Конечно, по атомным меркам и 0,004 мм – величина огромная, в десятки тысяч раз больше диаметра невозбужденного атома водорода.
Молекулы водорода тоже очень маленькие. Поэтому этот газ легко проходит через самые тонкие щели. Резиновый шарик, надутый водородом, «худеет» намного быстрее шарика, надутого воздухом: молекулы водорода понемногу просачиваются через мельчайшие поры в резине.
Если вдохнуть водород и начать разговаривать, то частота издаваемых звуков будет втрое выше обычной. Этого достаточно, чтобы звук даже низкого мужского голоса оказался неестественно высоким, напоминающим голос Буратино. Происходит это потому, что высота звука, издаваемая свистком, органной трубой или голосовым аппаратом человека, зависит не только от их размеров и материала стенок, но и от газа, которым они наполнены. Чем больше скорость звука в газе, тем выше его тон. Скорость звука зависит от массы молекул газа. Молекулы водорода значительно легче молекул азота и кислорода, из которых состоит воздух, и звук в водороде распространяется почти вчетверо быстрее, чем в воздухе. Однако вдыхать водород рискованно: в легких он неминуемо смешается с остатками воздуха и образует гремучую смесь. И если при выдохе поблизости окажется огонь… Вот какая история произошла с французским химиком, директором Парижского музея науки Пилатром де Розье (1756–1785). Как-то он решил проверить, что будет, если вдохнуть водород; до него никто такого эксперимента не проводил. Не заметив никакого эффекта, ученый решил убедиться, проник ли водород в легкие. Он еще раз хорошо вдохнул этот газ, а затем выдохнул его на огонь свечи, ожидая увидеть вспышку пламени. Однако водород в легких смелого экспериментатора был смешан с воздухом и произошел сильный взрыв. «Я думал, что у меня вылетели все зубы вместе с корнями», – писал он впоследствии, очень довольный опытом, который чуть не стоил ему жизни.
История получения дейтерия и трития
Дейтерий
Помимо «обычного» водорода (протия, от греческого protos – первый), в природе присутствует также его тяжелый изотоп – дейтерий (от латинского deuteros – второй) и в ничтожных количествах сверхтяжелый водород – тритий. Долгие и драматические поиски этих изотопов вначале не давали результата из-за недостаточной чувствительности приборов. В конце 1931 группа американских физиков – Г.Юри со своими учениками, Ф.Брикведде и Дж.Мэрфи, взяли 4 л жидкого водорода и подвергли его фракционной перегонке, получив в остатке всего 1 мл, т.е. уменьшив объем в 4 тысячи раз. Этот последний миллилитр жидкости после ее испарения и был исследован спектроскопическим методом. Опытный спектроскопист Юри заметил на спектрограмме обогащенного водорода новые очень слабые линии, отсутствующие у обычного водорода. При этом положение линий в спектре точно соответствовало проведенному им квантово-механическому расчету нуклида 2H (см. ЭЛЕМЕНТЫ ХИМИЧЕСКИЕ).
После спектроскопического обнаружения дейтерия было предложено разделять изотопы водорода электролизом. Эксперименты показали, что при электролизе воды легкий водород действительно выделяется быстрее, чем тяжелый. Именно это открытие стало ключевым для получения тяжелого водорода. Статья, в которой сообщалось об открытии дейтерия, была напечатана весной 1932, а уже в июле были опубликованы результаты по электролитическому разделению изотопов. В 1934 за открытие тяжелого водорода Гарольд Клейтон Юри получил Нобелевскую премию по химии.
Тритий
17 марта 1934 в выходящем в Англии журнале «Nature» («Природа») была опубликована небольшая заметка, подписанная М.Л.Олифантом, П.Хартеком и Резерфордом (фамилия лорда Резерфорда не требовала при публикации инициалов!). Несмотря на скромное название заметки: Эффект трансмутации, полученный с тяжелым водородом, она сообщала миру о выдающемся результате – искусственном получении третьего изотопа водорода – трития. В 1946 известный авторитет в области ядерной физики, лауреат Нобелевской премии У.Ф.Либби предположил, что тритий непрерывно образуется в результате идущих в атмосфере ядерных реакций. Однако в природе трития так мало (1 атом 1Н на 1018 атомов 3Н), что обнаружить его удалось только по слабой радиоактивности (период полураспада 12,3 года).
Гидриды
Водород образует соединения – гидриды со многими элементами. В зависимости от второго элемента, гидриды очень сильно различаются по свойствам. Наиболее электроположительные элементы (щелочные и тяжелые щелочноземельные металлы) образуют так называемые солеобразные гидриды ионного характера. Они получаются в результате непосредственной реакции металла с водородом под давлением и при повышенной температуре (300–700°С), когда металл находится в расплавленном состоянии. Их кристаллическая решетка содержит катионы металлов и гидрид-анионы H– и построена аналогично решетке NaCl. При нагревании до температуры плавления солеобразные гидриды начинают проводить электрический ток, при этом, в отличие от электролиза водных растворов солей, водород выделяется не на катоде, а на положительно заряженном аноде. Солеобразные гидриды реагируют с водой с выделением водорода и образованием раствора щелочи, легко окисляются и кислородом и используются как сильные восстановители.
Ряд элементов образуют ковалентные гидриды, среди которых наиболее известны гидриды элементов IV–VI групп, например, метан CH4, аммиак NH3, сероводород H2S и т.п. Ковалентные гидриды обладают высокой реакционной способностью и являются восстановителями. Некоторые из этих гидридов малостабильны и разлагаются при нагревании или гидролизуются водой. Примером могут служить SiH4, GeH4, SnH4. С точки зрения строения интересны гидриды бора, например, В2Н6, В6Н10, В10Н14 и др., в которых пара электронов связывает не два, как обычно, а три атома В–Н–В. К ковалентным относят и некоторые смешанные гидриды, например, литийалюминийгидрид LiAlH4, который нашел широкое применение в органической химии в качестве восстановителя. Гидриды германия, кремния, мышьяка используют для получения высокочистых полупроводниковых материалов.
Гидриды переходных металлов весьма разнообразны по свойствам и строению. Часто это соединения нестехиометрического состава, например, металлоподобные TiH1,7, LaH2,87 и т.п. При образовании подобных гидридов водород сначала адсорбируется на поверхности металла, затем происходит его диссоциация на атомы, которые диффундируют вглубь кристаллической решетки металла, образуя соединения внедрения. Наибольший интерес представляют гидриды интерметаллических соединений, например, содержащие титан, никель, редкоземельные элементы. Число атомов водорода в единице объема такого гидрида может быть в пять раз больше, чем даже в чистом жидком водороде! Уже при комнатной температуре сплавы упомянутых металлов способны быстро поглощать значительные количества водорода, а при нагревании – выделять его. Таким образом получают обратимые «химические аккумуляторы» водорода, которые, в принципе, могут использоваться для создания двигателей, работающих на водородном топливе. Из других гидридов переходных металлов интересен гидрид урана постоянного состава UH3, который служит источником других соединений урана высокой чистоты.
Применение
Водород используют в основном для получения аммиака, который нужен для производства удобрений и многих других веществ. Из жидких растительных масел с помощью водорода получают твердые жиры, похожие на сливочное масло и другие животные жиры. Их используют в пищевой промышленности. При производстве изделий из кварцевого стекла требуется очень высокая температура. И здесь водород находит применение: горелка с водородно-кислородным пламенем дает температуру выше 2000 градусов, при которой кварц легко плавится.
В лабораториях и в промышленности широко используется реакция присоединения водорода к различным соединениям – гидрирование. Наиболее распространены реакции гидрирования кратных углерод-углеродных связей. Так, из ацетилена можно получить этилен или (при полном гидрировании) этан, из бензола – циклогексан, из жидкой непредельной олеиновой кислоты – твердую предельную стеариновую кислоту и т.д. Гидрированию подвергаются и другие классы органических соединений, при этом происходит их восстановление. Так, при гидрировании карбонильных соединений (альдегидов, кетонов, сложных эфиров) образуются соответствующие спирты; например, из ацетона получается изопропиловый спирт. При гидрировании нитросоединений образуются соответствующие амины.
Гидрирование молекулярным водородом часто проводят в присутствии катализаторов. В промышленности, как правило, используют гетерогенные катализаторы, к которым относятся металлы VIII группы периодической системы элементов – никель, платина, родий, палладий. Самый активный из этих катализаторов – платина; с ее помощью можно гидрировать при комнатной температуре без давления даже ароматические соединения. Активность более дешевых катализаторов можно повысить, проводя реакцию гидрирования под давлением при повышенных температурах в специальных приборах – автоклавах. Так, для гидрирования ароматических соединений на никеле требуются давления до 200 атм и температура выше 150°С.
В лабораторной практике широко используют также различные способы некаталитического гидрирования. Один из них – действие водорода в момент выделения. Такой «активный водород» можно получить в реакции металлического натрия со спиртом или амальгамированного цинка с соляной кислотой. Значительное распространение в органическом синтезе получило гидрирование комплексными гидридами – борогидридом натрия NaBH4 и алюмогидридом лития LiAlH4. Реакцию проводит в безводных средах, так как комплексные гидриды мгновенно гидролизуются.
Водород используют во многих химических лабораториях. Его хранят под давлением в стальных баллонах, которые для безопасности с помощью специальных хомутов прикрепляют к стене или даже выносят во двор, а газ поступает в лабораторию по тонкой трубке.
ru.teplowiki.org
Водород тритий – Справочник химика 21
Водород широко используется в химической промышленности для синтеза аммиака, метанола, хлорида водорода, для гидрогенизации твердого и жидкого тяжелого топлива, жиров и т. д. В смеси с СО (в виде водяного газа) применяется как топливо. При горении водорода в кислороде возникает высокая температура (до 2600°С), используемая для сварки и резки тугоплавких металлов, кварца и др. Жидкий водород используют как одно из наиболее эффективных реактивных топлив. В атомной энергетике для осуществления ядерных реакций большое значение имеют изотопы водорода — тритий и дейтерий. [c.275]Применение в качестве индикатора радиоактивного водорода. Была сделана попытка определить стадии, через которые протекает изомеризация -бутана в изобутан при помощи радиоактивного изотопа водорода, трития [65]. Катализатор представлял собой хлористый алюминий, нанесенный на древесный уголь или на окись алюминия. Он применялся в присутствии или в отсутствии хлористого водорода. Обмен атомами водорода между бутаном и молекулярным водородом мало дает для объяснения механизма изомеризации, за исключением случаев, когда молекула бутана атакуется водородом. Степень обмена с хлористым водородом указывает на более эффективное участие его в реакции. Поскольку с тщательно очищенными реагентами опыты не проводились, любые заключения о механизме реакции, основанные на обмене трития и водорода, остаются открытыми для критики. [c.21]
Метод меченых атомов нашел дальнейшее развитие, когда научились искусственно получать новые радиоактивные изотопы и тех элементов (натрия, хлора, брома, серы, фосфора и других), природные изотопы которых нерадиоактивны. Это в несколько раз увеличило число элементов, используемых при методе меченых атомов, и вместе с тем во многих случаях позволило значительно повысить чувствительность метода, так как присутствие радиоактивного изотопа может быть обнаружено, даже если концентрация его очень мала, и часто довольно доступными способами. Преимущества эти настолько существенны, что наряду с дейтерием нашел применение и искусственно получаемый радиоактивный изотоп водорода—тритий. [c.542]
Исключение составляют изотопы водорода Н и fH. Вследствие огромной относительной разницы в их атомных массах (масса атома одного изотопа вдвое больше массы атома другого изотопа) свойства этих изотопов заметно различаются. Изотоп водорода с массовым числом 2 называют дейтерием и обозначают символом D. Дейтерий содержится в обычном водороде в количестве около 0 017%. Известен также радиоактивный изотоп водорода — тритий (период полураспада около 12 лет), получаемый только искусственным путем его обозначают символом Т. [c.91]
Сверхтяжелый водород (тритий) [c.23]
При замещении водорода тритием величина изотопных эффектов превышает соответствующие эффекты дейтерия [38]. Изотопные эффекты других элементов намного меньше, порядка 1,02—1,10. Например, к>-.с1к[c.296]
Жидкий водород используется как эффективное ракетное топливо. Изотопы водорода (тритий и дейтерий) находят применение в атомной энергетике для осуществления ядерных реакций. [c.413]
До недавнего времени основное применение литий в виде металла имел для рафинирования и дегазации меди, никеля, при получении сплавов алюминия типа склерон при производстве антифрикционных сплавов на свинцовой основе, наряду с натрием и кальцием. Большое значение в последнее время получил литий в производстве синтетического каучука, а также для получения гидрида Ak Hi, как одного из самых эффективных восстановителей в процессах органической химии и др. Особое значение и большую будущность имеет литий в качестве исходного сырья в производстве термоядерного горючего. Для этого используют изотоп находящийся в соотношении с как 7,4 к 92,6, получая из него тяжелый изотоп водорода — тритий [2]. Изотоп используется как обычный литий. Мировое производство лития оценивается в 500—600 т/год (без СССР). [c.319]
Р-Радиоактивный изотоп водорода — тритий — получают в промышленных масштабах путем бомбардировки бериллия ядрами дейтерия по реакции [c.47]
Существует два устойчивых изотопа водорода 1Н и Н. Более тяжелый изотоп называют дейтерием. В природном водороде его содержится 0,01 %. Изотоп 1Н называют тритием-, он радиоактивен и в природе не встречается. Относительная разница в массах водорода и дейтерия больше, чем для любой другой пары изотопов (исключая пару водород — тритий). По этой причине разница в свойствах водорода и дейтерия больше, чем у изотопов других элементов. [c.379]
Литий и его соединения находят применение в различный областях техники для получения изотопа водорода — трития, в металлургии в качестве раскислителя и модификатора для черных и цветных металлов, в качестве компонента легких сплавов, в промышленности органического синтеза, при производстве аккумуляторов и химич еских источников тока. [c.499]
В атомной энергетике для осуществления ядерных реакций синтеза гелия имеют большое значение изотопы водорода — тритий и дейтерий. [c.309]
Методы определения содержания жидкости в организме основаны на изучении концентрации веществ, введенных в кровяное русло. Так, при определении общей жидкости тела вводят вещества, которые свободно проникают через эндотелий капилляров, клеточные мембраны, гематоэнцефалический барьер и равномерно распределяются во всех водных пространствах. Для этого применяют тяжелые изотопы водорода (тритий, дейтерий), антипирин, сульфаниламиды, мочевину. [c.182]
Важными в практическом отношении реакциями являются реакции ( , Т), ведущие к образованию сверхтяжелого радиоактивного изотопа водорода трития ( , Т) Ы , T)Ag o Т) 8п1 , [c.83]
Последняя задача была решена при использовании для экспериментов в качестве метчика гемицеллюлоз радиоактивного тяжелого водорода трития [30], который, находясь в газовой фазе, обладает способностью обмениваться с водородом органических соединений. Для исследований использовали ксилоуронид, полученный из древесины белой березы и имевший средний молекулярный вес около 22 000. Меченый тритием ксилоуронид растворяли в 6,4%-ном водном растворе едкого натра, который использовали затем для варки березовой древесины при разных температурах и продолжительности. Получали при этом образцы целлюлозы с раз- [c.370]
Реакция изотопного о
www.chem21.info
Тритий излучение – Справочник химика 21
Протий и дейтерий стабильны, тритий радиоактивен (мягкое р-излучение с переходом в Не, период полураспада 12,262 года). Подавляющую массу атомов нормального водорода ( 99,984%) составляет протий, остальная незначительная часть 0,016%) практически состоит из дейтерия. В зависимости от происхождения водорода содержание дейтерия в нем колеблется от 0,013 до 0,016% [6]. Выделение дейтерия из природной смеси изотопов осуществляется различными методами, один из наиболее экономичных — низкотемпературная ректификация жидкого водорода [6]. [c.10]Детектор по электронному захвату. Процессы, происходящие в детекторе по электронному захвату, схематично показаны на рис. VI.7. Под действием радиоактивного излучения трития в камере детектора происходит ионизация молекул азота и образуются медленные электроны [c.188]
Мягкое излучение — слабо проникающее. Например, Р-лучи трития полностью поглощаются слоем воздуха толщиной всего лишь в 5 мм. [c.387]
Тритий намного дешевле и поставляется в существенно больших удельных активностях. Так как тритий распадается быстрее, 1 мг-атом чистого трития представляет собой в 445 раз более высокую активность, чем 1 мг-атом О. Поскольку энергия бета-излучения трития на порядок ниже, чем радиоуглерода, доза для любого критического органа также приблизительно на порядок меньше. [c.663]
Источник света с газообразным тритием представляет собой стеклянный баллон, на внутренней поверхности которого закреплен слой порошка люминофора. Баллон заполнен газообразным тритием, р-излучение которого возбуждает [c.163]
В настоящее время во многих странах разрабатываются новые, более эффективные самосветящиеся тритированные краски. Основные проблемы, которые приходится при эР)у( решать, связаны, во-первых, с наиболее целесообразным совмещением тритированного соединения с порошком люминофора и со связующим, что обусловлено малой длиной пробега Р-излучения трития (доли микрона), и, во-вторых, с необходимостью использования наиболее радиационно-и химически стойких веществ [И]. [c.164]
Естественные (природные) радионуклиды либо содержатся как химические элементы в земной коре (уран, торий) или в атмосфере (радон), либо образуются там в результате природных ядерных реакций (уран-233, плутоний-239, нептуний-237) и ядерных реакций, инициированных космическим излучением (тритий, углерод-14, аргон-41). Осаждаясь атмосферными осадками и вымываясь поверхностными и грунтовыми водами, естественные радионуклиды попадают в гидросферу. [c.307]
Взаимодействие ядер азота с нейтронами, порожденными космическим излучением, приводит к образованию радиоактивного изотопа водорода — трития [c.309]
Этот метод широко применяется для локализации радиоактивного материала в клетке, срезе ткани или на пластине геля после электрофореза смеси макромолекул. Для регистрации радиоактивных зон на исследуемый образец накладывают рентгеновскую пленку, в которой под действием радиоактивного излучения из бромида серебра образуется металлическое серебро. Засвеченные участки, соответствующие радиоактивным зонам, наблюдаются визуально после проявления пленки. Одним из вариантов радиоавтографии является флюорография. В этом случае в исследуемый образец импрегнируют сцинтиллятор и вновь накладывают рентгеновскую пленку. Метод основан на том, что низкоэнергетические Р-частицы, образующиеся при распаде изотопа (например, трития), взаимодействуют с молекулами сцинтиллятора, при [c.65]
Чрезвычайно широко при исследовании компонентов живой материи, в том числе биополимеров, применяются радиохимические методы. В ходе фракционирования биологического материала они могут быть применены, если живые организмы выращивались на среде, содержащей радиоактивные предшественники биополимеров, получали их в составе продуктов питания или при инъекциях. Используют главным образом изотоп водорода (тритий), изотоп углерода изотопы фосфора Щ и изотоп серы Два важнейших биогенных элемента— азот и кислород — имеют изотопы и isq распадающиеся с испусканием позитронов. Так же распадается и изотоп углерода . Они являются перспективными для использования в позитронной томографии, основанной на введении изотопов в живые организмы и обнаружении и локализации их в организме по -у-излучению, возникающему при аннигиляции позитронов и электронов. Поскольку время полураспада всех этих изотопов измеряется минутами, работа с ними [c.250]
Жидкостной сцинтилляционный счетчик позволяет быстро и эффективно анализировать различные меченные радиоактивными изотопами органические и неорганические соединения, а также биологические препараты. Высокая общая эффективность счета и легкость подготовки образцов для анализа делают этот метод особенно привлекательным при работе с веществами, меченными H С ” и 8 . В большинстве случаев можно использовать систему, обладающую способностью растворять исследуемое органическое соединение если же такую систему подобрать не удается, то очень хорошие результаты дает суспендирование анализируемого вещества в жидком [69] или тиксотропно-геле-образном [71] сцинтилляторе. В последнем случае анализ веществ, меченных тритием, осуществить не удается, так как само-поглощение очень мягких р-лучей частицами суспензии слишком велико. Поправку на отклонения, например вследствие тушения, можно определить после подсчета активности пробы, добавляя внутренний стандарт. Метод можно использовать для одновременного анализа двух или трех радиоактивных изотопов при условии, если энергетические спектры их излучения достаточно сильно различаются. Опубликованы обзорные статьи, посвященные жидкостным сцинтилляционным счетчикам [99—101]. [c.28]
При использовании подходящего радиоактивного элемента метод радиоактивных индикаторов очень пригоден для изучения адсорбции ПАВ с малой поверхностной активностью. Для этого используется радиоактивный тритий, энергия р-излучения которого мала. Этот вариант метода впервые применил Нильсон [33], который выбрал додецилсульфат натрия, меченный тритием, для своего исследования главным образом по следующим соображениям 1) это соединение уже достаточно подробно исследовано [c.213]
Тритиевый Бета-излучение трития — (0.5- 1,2) 10- [c.276]
Тритий непрерывно образуется в верхних слоях атмосферы в результате взаимодействия нейтронов вторичного космического излучения с ядрами атомов азота по реакции [c.263]
Нахождение в природе Водород (Нус1годеп1ит — воду рождающий) имеет три изотопа протий ( Н), дейтерий или О и тритий Н или Т, последний из которых образуется в атмосфере в результате ядерных реакций, вызванных действием космического излучен
www.chem21.info
что это такое, особенности, свойства и производство
Энергия реакций распада и синтеза в ядре атома давно нашла применение в науке и технике. Она используется в промышленности, оружии, геологии, на атомных электростанциях. Процессы ядерных реакций могут приносить как пользу, так и огромный вред. В статье речь пойдет о том, что это такое – тритий, как он добывается, о его использовании в атомной энергетике и какие опасности связаны с его применением.
Изотопы водорода
Прежде чем объяснить, что это такое тритий, необходимо познакомиться с понятием изотопа.
Атом любого вещества состоит из ядра и электронов (отрицательно заряженных частиц), движущихся по орбитам вокруг него. Ядро атома содержит положительно заряженные частицы – протоны, и частицы с нейтральным зарядом – нейтроны.
В обычном атоме число электронов и протонов совпадает, а вот количество нейтронов может отличаться. В этом случае элементы, имеющие разное число нейтронов в ядре, называются изотопами элемента.
Водород имеет заряд 1, то есть в нем содержится один электрон и один протон. Его изотопы – протий, дейтерий и тритий. Слово “протий” образовано от греческого слова “первый”. Этот элемент имеет лишь один протон в ядре. По сути, он представляет собой привычный нам водород.
Дейтерий означает “второй”. В его ядре имеется один протон и один нейтрон. А тритий переводится как “третий” и содержит в ядре опять же один протон, но два нейтрона.
Краткий ответ на вопрос “Тритий – что это такое?” выглядит так: это третий изотоп химического элемента водорода.

История открытия
Названия для изотопов 1Н и 2Н – протия и дейтерия – были предложены американским физиком Гарольдом Юри. Обнаружив существование дейтерия, ученые сразу предположили наличие третьего изотопа водорода, имеющего два нейтрона в ядре. Юри для исследований использовал метод спектрального анализа. Однако результатов он не дал. Оказалось, что концентрация трития слишком мала, чтобы его можно было обнаружить традиционными способами. В природе это вещество практически невозможно найти. Поэтому для исследований стали использоваться другие методы, например, масс-спектрометрия.

В 1934 году Эрнест Резерфорд сумел искусственно получить третий изотоп при помощи ядерных реакций. Само собой, название было выбрано заранее, и, по аналогии с протием и дейтерием, он стал называться тритием.
Свойства
В нормальных условиях физические свойства трития примерно такие же, как у обычного водорода. Он имеет газообразное состояние; вкус, запах и цвет отсутствуют. При понижении температуры до -250 °C он становится легкой бесцветной жидкостью. А при нагревании он напоминает снег.
Атомная масса трития равняется примерно 3 а.е.м.
Тритий является радиоактивным веществом. Период полураспада составляет 12 лет, что является очень удобным в исследованиях. Канал распада элемента – бета. Тритий превращается в изотоп гелий-3. При этом происходит испускание электронов и антинейтрино.
Дефект масс и энергия связи трития
Одним из ключевых в физике элементарных частиц является понятие энергии связи атомных ядер. Под энергией связи ядра трития понимают то количество энергии, которое необходимо, чтобы произошло расщепление его ядра на отдельные нуклоны. Поскольку ядра удерживаются так называемым сильным взаимодействием, требуется большое количество энергии, чтобы их расщепить.
Чтобы высчитать энергию связи ядра, необходимо знать массу субатомных частиц. Известно, что масса покоя ядра меньше суммарной массы нуклонов в его составе. Разницу между массами ядра и суммами его нуклонов называют дефектом масс.
Дефект массы трития, как и других ядер, рассчитывается по формуле:
Δm = (Z*mp + N*mn) – Мя, где
Z – число протонов;
N – число нейтронов;
mp – масса протона;
mn – масса нейтрона;
Мя – масса ядра.
Удельная энергия связи для элемента трития составляет 2 827,2 кэВ на нуклон.
Тритий в природе
Количество этого изотопа в природе является ничтожным. Связано это с его радиоактивностью, то есть нестабильностью ядра.
В природе он вырабатывается в основном в верхних слоях атмосферы. Его формирование осуществляется при сталкивании частиц космических лучей с ядрами атомов, например, азота. Поскольку тритий образуется в атмосфере, его источники на Земле – осадки (дождь и снег).
По подсчетам ученых, в чистом виде трития на Земле содержится едва ли более 1 кг. Поэтому его вырабатывают искусственно, в лабораторных условиях.

Производство трития
В настоящее время получение данного изотопа не представляет трудностей, но является чрезвычайно дорогостоящим процессом. Для изготовления одного килограмма вещества требуются затраты в размере 30 млн долларов.
В качестве сырья используют чаще всего литий. Реже – бериллий или бор. Литий подвергают нейтронному облучению на циклотроне. Затем его растворяют в воде, получая водород, в составе которого имеется тритий. Половина лития приходит в негодность в результате этого процесса и отравляется в утиль.
Для получения водорода с тритием из бериллия и бора их обрабатывают серной кислотой.
Еще одним способом получения изотопа является облучение тяжелой воды дейтронами. Тяжелая вода – вещество, образующееся из дейтерия (другое название – оксид дейтерия). После облучения такую воду подвергают электролизу и затем извлекают тритий.
В настоящее время элемент производится в основном на территории США, Канады и России.

Радиоактивность
Тритий является радиоактивным. При его распаде выделяется бета-излучение, представляющее собой поток электронов.
При внешнем облучении организма тритий не наносит серьезного вреда. Однако при попадании внутрь с водой, пищей или воздухом он может нанести существенный ущерб здоровью. Дело в том, что являясь изотопом водорода, тритий способен замещать его в химических соединениях. Таким образом, он попадает внутрь живых клеток и встраивается в их структуру. Это сказывается на генетической информации клетки.

Как было сказано, в природе тритий практически не встречается, поэтому едва ли может нанести вред живым организмам. Однако предприятия атомной промышленности становятся источником искусственной выработки этого изотопа. Атомные электростанции выбрасывают тритий в жидком и газообразном состоянии. Причина этого в том, что изотоп практически не фильтруется. В год на АЭС образуется до 4 кг трития. Результатом выбросов становится радиоактивное загрязнение почвы, воздуха и воды. Таким образом, он является потенциальным источником заражения живых организмов. Именно поэтому тритий был занесен в список контролируемых параметров при оценке качества питьевой воды.
Применение
Основное направление использования трития – атомная промышленность. Дело в том, что реакция слияния дейтерия и трития приводит к управляемому термоядерному синтезу. Энергия связи трития настолько велика, что в ходе термоядерных реакций вырабатывается в огромном количестве, в разы больше, чем при реакциях распада атомных ядер, поэтому управляемые термоядерные реакции могут стать главным источником энергии на Земле на многие годы. В связи с этим ученые в настоящее время работают над строительством термоядерного реактора, в котором процессы синтеза ядер происходили бы в крупных масштабах. Наиболее известный проект такого реактора – строящийся в настоящее время ITER (ИТЭР) во Франции.

Производство трития может успешно применяться для военных целей, например, при создании термоядерного оружия.
С использованием трития изготавливаются специальные светящиеся краски. Это обусловлено радиолюминесценцией – явлением свечения элемента при радиоактивном распаде. Светящиеся краски наносят на шкалы приборов, а также используются для изготовления брелоков и часов. Количество трития в них не настолько велико, чтобы нести угрозу для здоровья.
Тритий применяется в качестве индикатора химических реакций.
Наконец, этот изотоп используется для определения возраста объектов, которым не более 100 лет, например, вин.

Итак, что это такое – тритий? Выводы:
- Тритий – изотоп водорода, имеющий в ядре один протон и два нейтрона.
- Изотоп практически не встречается в природе, но успешно производится в лабораториях.
- Тритий радиоактивен, и его использование может принести человечеству и пользу, и вред.
www.nastroy.net
Тритий, получение – Справочник химика 21
Получение трития Получение некоторых трансурановых элементов [c.67]Важнейшей областью применения лития является атомная энергетика. Его используют как источник получения трития [c.486]
Процесс насыщения мишени включает обезгаживание при нагревании до 600—700° С в вакууме с последующим охлаждением в атмосфере дейтерия или трития. Полученные таким образом мишени практически не выделяют эти газы даже в вакууме, если температура мишени не превышает 200° С для титана и 300° С для циркония. Это обстоятельство очень существенно, так как при падении ионного пучка на мишень выделяется большое количество тепла, что приводит к значительному нагреванию мишени. Эти термостойкие мишени позволяют использовать более высокий [c.45]
При алкилировании изобутана бутеном-2 с использованием серной кислоты, содержавшей вместо водорода радиоактивный изотоп его — тритий, полученный продукт содержал тритий. [c.276]
В современной ядерной технике используются изотопы лития, натрия и цезия. Изотоп является исходным продуктом для получения трития ( Н) — сверхтяжелого радиоактивного изотопа водорода — по следующей ядерной реакции [c.34]
Для водорода известны, три изотопа специальные названия и обозначения Н — протий Н, терий В, Н тритий Т. Первые два встречаются в природе, третий получен искусственно. Обычно различия в химических свойствах изотопов ничтожно малы, но так как отношение масс у изотопов водорода больше, чем у изотопов других элементов, изотопы водорода химически заметно отличаются. [c.464]
Хи.мический символ Н. Порядковый номер 1. Атомная масса 1,00797. Число известных изотопов 4, из которых Н -протий, Н – дейтерий (символ О) и [Н – тритий (символ Т) обнаружены в природе, а четвертый – [Н — получен искусственно. Ядро атома водорода содержит один протон. Электронная конфигурация 15 . Основное отличие водорода от остальных элементов заключается в том, что его единственный электрон находится непосредственно в сфере действия атомного ядра — у него нет промежуточного электронного слоя. При потере электрона образуется положительный ион Н , представляющий собой элементарную частицу — протон. [c.156]
Нейтронные пучки не должны обладать такой высокой энергией, так как нейтроны не испытывают электростатического отталкивания от ядер мишени. Например, нейтронные пучки из атомных реакторов используются для получения трития, fH, применяемого в медицине или в химических исследованиях методом меченых атомов получение трития происходит в реакциях [c.421]
Неисчерпаемые возможности таит ядерная энергетика. Расчеты показали, что при правильном использовании урана можно не бояться его истощения в ближайшие тысячелетия. В перспективе получение энергии управляемым термоядерным синтезом ядер дейтерия и трития. [c.172]
Применение щелочных металлов. Металлы 1А-подгруппы широко используются в новой технике. Изотоп лития используют как исходный продукт для получения трития Н в ядерной реакции [c.289]
В больших количествах водород применяется в процессах получения аммиака, метанола, жидкого горючего на основе минеральных углей и в ряде других промышленных процессов. Изотопы водорода— дейтерий и тритий используются в ядерной энергетике. [c.47]
Применяют водород для получения высоких температур кислородно-водородным пламенем режут и сваривают металлы. Он используется для получения металлов (молибдена, вольфрама и др.) из их оксидов, в химической промышленности — для получения аммиака из азота воздуха н искусственного жидкого топлива из угля в пищевой промышленности—для гидрогенизации жиров (см. 17.14). Изотопы водорода — дейтерий и тритий — нашли важное применение в атомной энергетике (термоядерное горючее). [c.164]
В природе встречаются два стабильных изотопа водорода — Н (протий) и Н, или В (дейтерий), а также один радиоактивный — Н, или Т (тритий). Искусственно может быть получен неустойчивый изотоп Н. [c.97]
Разновидности атомов одного и тога же элемента, отличающиеся массой, называются изотопами. По нескольку естественных изотопов имеют олово, свинец, хлор, водород и многие другие элементы периодической системы элементов Д. И. Менделеева. Известны, например, два природных изотопа хлора ,С1 (17р+18п) и ,”С1 (17р+20п) три изотопа водорода (третий получен искусственно) 1Н(1р) — протий (Н), 5Н(1р+1п)-дейтерий (О), Н(1р+2п) тритий (Т). [c.11]
Открыты три изотопа водорода — протий, обозггачается символом Н,, Н — дейтерий — символом D, IH — тритий — символом Т. Протий и дейтерий встречаются в природе, тритий синтезирован. В природном водороде содержание дейтерия достигает 0,02%. Дейтерий впервые был получен при электролизе природной воды в виде тяжелой воды D2O. В процессе электролитического разложения большого количества природной воды D2O концентрируется в остатке, так как при электролизе воды разряжение ионов происходит значительно быстрее, чем ионов D+. [c.246]
Все ЩЭ имеют нечетный атомный номер. В связи с этим число стабильных изотопов в природной плеяде относительно мало. (Как видно из табл. 1.1, натрий и цезий являются элементами-одиночками.) Природный литий представляет собой смесь двух стабильных изотопов— Li и Li. Литий (после водорода) был первым элементом, изотопы которого стали разделять в промышленном масштабе (для получения трития, используемого при термоядерном синтезе). В плеяду изотопов природного калия входят три изотопа. Наиболее распространен К с типом ядра по массе 4 -f3, что характерно для нечетных элементов первой половины периодической системы. Распространенность изотопа К (тип ядра по массе 4п-Ы) на порядок ниже, а изотоп К (тип ядра по массе 4п) неустойчив, имеет слабую -радиоак-тивность. Его доля в смеси изотопов мала (0,01%), но активирующее действие постоянно присутствующего в организме человека и животных радиоизотопа калия, по всей видимости, имеет большое биологическое значение. Впрочем, период полураспада К очень велик 10 лет, т. е. соизмерим с возрастом Земли. [c.9]
Тяжелая вода как химическое соединение представляет интерес не только в научном отношении. За последние 20 лет она приобрела большое значение в ядерной технике как замедлитель нейтронов в ядерных реакторах и сырье для получения дейтерия, используемого в ядерных и термоядерных реакциях. В настоящее время производство тяжелой воды составляет тысячи тонн в год. Возможны другие разновидности тяжелой воды, в состав которой входят смешанные изотопы водорода НОО, НТО и ОТО, где Т — тритий — изотоп водорода с массовым числом 3. Т О получают и используют для тех же целей, что и О О. Вследствие того, что тритий радиоактивен, тритиевая вода обладает высокой радиоактивностью. [c.629]
&ensp
www.chem21.info
Изотопы водорода. Дейтерий, протий и тритий.
Всякое разное Изотопы водорода. Дейтерий, протий и тритий.
Количество просмотров публикации Изотопы водорода. Дейтерий, протий и тритий. – 26
| Наименование параметра | Значение |
| Тема статьи: | Изотопы водорода. Дейтерий, протий и тритий. |
| Рубрика (тематическая категория) | Всякое разное |
Водород имеет три изотопа с массовыми числами 1, 2 и 3.
Самый распространенный изотоп водорода – ϶то обычный, привычный нам водород ʼʼ1Hʼʼ с ядром, состоящим из одного единственного протона. Нейтронов в данном ядре нет вовсе. По умолчанию, когда говорится ʼʼводородʼʼ, имеют в виду именно такой изотоп, но когда мы говорим о разных изотопах водорода, то термин ʼʼводородʼʼ будет непонятен – то ли мы имеем в виду именно ϶тот изотоп без нейтронов, то ли любой изотоп водорода. По϶тому для такого изотопа есть свое собственное название: ʼʼпротийʼʼ.
Еще один изотоп, который встречается в природе, ϶то ʼʼдейтерийʼʼ – ʼʼ2Hʼʼ. Ядро дейтерия состоит из одного протона и одного нейтрона. Содержание дейтерия в природе очень мало – около 0.01% от всех атомов водорода. Дейтерий ещё обозначают для краткости буквой ʼʼDʼʼ
Третий изотоп – ʼʼтритийʼʼ – ʼʼ3Hʼʼ. Его для краткости обозначают ещё как ʼʼTʼʼ
В природе водород встречается в виде молекул h3 и HD в соотношении 3200:1.
Если взять разные химические элементы и посмотреть – насколько сильно отличаются физические свойства их изотопов, то мы увидим, что изотопы водорода отличаются друг от друга сильнее всего. Это можно легко объяснить, ведь в ядре водорода лишь один протон, и прибавление нейтрона к одному протону увеличивает массу ядра аж на 100%! Таким образом масса ядра меняется очень сильно, соответственно и физические свойства тоже сильно меняются.
Изотопы водорода. Дейтерий, протий и тритий. – понятие и виды. Классификация и особенности категории “Изотопы водорода. Дейтерий, протий и тритий.”2017-2018.
referatwork.ru