Производство дейтерия и трития – Энциклопедия по машиностроению XXL
Тритий представляет собой рода с массой 3 в результате 12 лет этот изотоп превращается в Не . Тритий можно накапливать, получать его органические производные, в которых он замещает водород, и, наконец, конденсировать при низких температурах. Его наиболее экономичное производство, которое все же В миллион раз более сложно, чем производство дейтерия, заключается в бомбардировке дейтерия, лития, бора или азота нейтронами реактора. Каждый нейтрон из реактора, использованный с этой целью, очевидно, уже потерян для производства плутония (фиг. 105). [c.155]ПРОИЗВОДСТВО ДЕЙТЕРИЯ И ТРИТИЯ [c.112]
Центр США по производству водородного ядерного горючего расположен в штате Южная Каролина, в Саванна-Ривер. Здесь получают дейтерий, тритий и другие компоненты, служащ,ие для снаряжения термоядерного оружия. [c.175]
Ядерный синтез. Реакция синтеза заключается в слиянии легких ядер и образовании тяжелых ядер при чрезвычайно высоких температурах. Многие склонны считать ядерный синтез панацеей от всех проблем, связанных с энергоснабжением, после того как будет разработана соответствующая технология. Потенциальные преимущества здесь действительно кажутся значительными. Исходное топливо — дейтерий встречается практически в неограниченных количествах и доступен при незначительных затратах. Продуктом ядерной реакции является гелий — нетоксичное и нерадиоактивное вещество. Отсутствует опасность выхода из-под контроля цепной реакции. Уровень радиоактивности относительно низок. Некоторые специалисты считают, что отсутствует возможность похищения материалов для производства ядерного оружия, хотя другие отмечают, что тритий, тяжелый изотоп водорода, масса которого в три раза превышает массу обычного водорода, ведет себя в процессе подобно дейтерию (масса которого вдвое превышает массу обычного водорода), тритий же используется в водородных бомбах. [c.230]
Если внутри реактора, где поток нейтронов примерно в 100 ООО раз интенсивнее, циркулирует дейтерий, то производство трития можно значительно увеличить. [c.156]
Для термоядерного оружия нужны были новые, не применявшиеся ранее материалы тяжелые изотопы водорода — тритий и дейтерий, для получения которых необходимо бьшо создание специальных производств. Для получения трития в реакции Li + п Т + Не” необходимо бьшо иметь ядерные реакторы с высокими потоками нейтронов. Для наработки трития в декабре 1951 года на комбинате № 817 был пущен реактор АИ мощностью около 100 МВт. [c.300]
При создании термоядерного оружия необходимо было создавать дополнительные сложные производства. В стране была создана промышленность получения лития-6, трития и дейтерия. [c.306]
Энергетический баланс. Этот критерий является основным, т. к. если нет положительного энергетического выхода, то нет и предмета обсуждения. Исследуемой величиной является коэффициент усиления энергии , где верхние индексы относятся, соответственно, к делению F и синтезу 5, который должен быть больше единицы. Здесь Е[ — энергия, которую необходимо затратить на единицу массы топлива, чтобы создать условия для протекания реакции, а E f — энергия, выделившаяся в реакции. Чтобы энергетическая установка была оправдана экономически, требуется С 100. Несмотря на то, что удельная калорийность DT-топлива выше, чем у актиноидов (в 4 раза), G синтеза значительно уступает делению. Это связано с тем, что энергетические затраты при производстве энергии на АЭС в основном связаны с добычей и переработкой исходного сырья, а непосредственно затраты на осуществление реакции деления отсутствуют (не считая расходов на собственные нужды станции, составляющие в среднем 5% от выработанной энергии). Для реакций синтеза ситуация противоположная добыча дейтерия относительно недорогая, тритий производится сам собой в бланкете реактора, но создание условий эффективного протекания реакции синтеза чрезвычайно энергоемки,
Устройство для производства трития — блан-кет — является составной частью термоядерного реактора. Для облучения лития используются нейтроны, образующиеся в процессе термоядерной реакции (XV.3). Одновременно бланкет используется для отвода теплоты от оболочки камеры реактора. Образующийся тритий должен быть отделен от других компонентов протекающего через бланкет теплоносителя и направлен в специальную камеру приготовления форплазмы, где он смешивается в нужной пропорции с дейтерием. Полученная плазма специальным инжектором вводится в рабочую камеру реактора, где производится разогрев плазмы до температуры зажигания реакции. Критическое значение критерия Лоусона для поддержания реакции (XV.3) составляет (рт)к= (частиц/см ) с. Отсюда следует, что для возникновения реакции требуется достаточно большое время X удержания плазмы в реакторе. Эта задача является наиболее трудной во всей проблеме управляемого термоядерного синтеза.
Возможность использования в перспективе не только DT-топлива, но и чисто дейтериевого топлива (или дейтериевого топлива с малой добавкой трития), что может заметно облегчить решение тритиевой проблемы. Хотя энергетическая система инерциального термоядерного синтеза на дейтериевом топливе к настоящему времени не разработана, с точки зрения основных физических процессов, создание такой системы представляется возможным. При этом предполагается использование в мишени небольшого количества трития (порядка одного процента от массы дейтерия) и регенерация трития в самой мишени. По сравнению с DT-топливом, основные параметры установки увеличиваются примерно на порядок и составляют до 100 МДж в энерговложении и 10 ГДж в полном энерговыделении. Основные преимущества такой системы огромные запасы топлива и отсутствие бланкета для производства трития. [c.125]
mash-xxl.info
Дейтерий. Тяжелая вода. Тритий – Справочник химика 21
Тяжёлую воду и тяжёлый изотоп водорода выделяют из природных соединений, главным образом из воды. Содержание дейтерия (В) в природных соединениях составляет примерно 0,015% ат., при этом отклонение в величине концентрации обычно составляет не более 0,001% ат. [1], а трития (Т) на Земле всего несколько килограммов. Для концентрирования дейтерия и трития используют различия в физико-химических свойствах изотопов и их соединений, обусловленные разными массами атомных ядер. Наибольшее применение получили следующие методы [19] [c.278]После облучения происходит отбор обогащённых дейтерием (или тритием) продуктов фотодиссоциации, а обеднённый дейтерием (или тритием) исходный газ-носитель поступает в специальный обменник, содержащий исходное сырьё, например воду (или тяжёлую воду), где происходит реакция изотопного обмена. В результате изотопного обмена относительная концентрация дей-
Отметим, что объём используемой для единовременной загрузки этих реакторов тяжёлой воды достаточно велик. Например, в эксплуатируемом во Франции (Институт им. М. Лауэ — П. Ланжевена в Гренобле) исследовательском ядерном реакторе, где тяжёлая вода служит теплоносителем и отражателем нейтронов, её загрузка в контуре составляет 40 тонн, а в баке-отражателе — 15 тонн. Кроме единовременной загрузки, эксплуатация исследовательских реакторов, так же как и энергетических, предполагает периодическую их подпитку тяжёлой водой. Такая подпитка связана с испарением и утечкой воды из контура, с её разбавлением протиевой водой, а также с накоплением в тяжёлой воде контура трития. В оборонных целях дейтерий используется в составе дейтерида лития при производстве термоядерного оружия. В последние годы потребность в тяжёлой воде и дейтерии возросла в связи с интенсификацией исследовательских работ по управляемому термоядерному синтезу.
www.chem21.info
СТАРШИЙ «БРАТ» ДЕЙТЕРИЯ
ТЯЖЕЛАЯ ВОДА
Ри делении тяжелых ядер в реакторе выделяется энергия. Где же источник этой энергии? Почему она освобождается в тот момент, когда ядро раскалывается на две части?
Ядро урана-235 состоит из 92 протонов и 143 нейтронов. Это не простая механическая смесь элементарных частиц, подобно, скажем, смеси железных опилок и порошка серы. Частицы, составляющие ядро атома, очень прочно связаны друг с другом так называемыми ядерными силами. Эта связь частиц в ядре во много миллионов раз крепче, чем связь, существующая между атомами в молекуле любого химического соединения. Прокалите те же железные опилки, смешанные с серой, получится химическое соединение — сернистое железо. Чтобы разрушить все молекулы сернистого железа до атомов железа и серы, содержащиеся в одном грамме, необходима энергия в количестве примерно одной большой калории. А чтобы разрушить до элементарных частиц все ядра, находящиеся в кусочке урана весом один грамм, понадобилась бы энергия порядка 170 миллионов больших калорий. Такое количество энергии выделяется при сжигании почти 20 тонн бензина.
Нейтроны и протоны в ядрах различных химических элементов связаны друг с другом по-разному: в одних прочнее, в других — слабее. При делении ядра урана, как уже говорилось, образуются два «осколка», представляющие собой ядра атомов середины периодической таблицы элементов Менделеева, например ядра атомов бария и криптона. Протоны и нейтроны в этих ядрах связаны между собой более прочно, чем они были связаны в ядрах урана или других тяжелых элементах конца таблицы Менделеева. Для разрушения одного ядра бария и одного ядра криптона до элементарных частиц (на протоны и нейтроны) потребовалось бы энергии на десять процентов больше, чем для разрушения одного ядра урана.
Если для расщепления ядра на отдельные элементарные частицы необходима некоторая определенная энергия, то при образовании ядер из этих частиц, согласно закону сохранения энергии, должна выделяться такая же энергия.
Расчленим мысленно процесс деления ядра урана на две стадии. Первая стадия — разрушение ядра урана на протоны и нейтроны; при этом затрачивается энергия в количестве 170 миллионов больших калорий на один грамм чистого урана. Вторая стадия — образование ядер бария и криптона из элементарных частиц, образовавшихся при разрушении ядер урана. Этот процесс сопровождается выделением энергии в количестве уже около 190 миллионов больших калорий. В результате проведения обеих стадий реакции получается выигрыш энергии в 20 миллионов больших калорий. Для получения такого количества энергии надо сжечь примерно две тонны бензина. Таким образом, «теплотворная способность» у урана при его делении оказывается в два миллиона раз выше, чем при горении бензина.
Поясним наши рассуждения следующим примером. Допустим, вы стоите на склоне горы и из колодца глубиной два метра черпаете воду. На поднятие каждого килограмма воды вы затрачиваете работу в два килограмм-метра. Затем вы эту воду льете по желобу на колесо турбины, расположенной на пять метров ниже. Если пренебречь всевозможного рода потерями энергии, то турбина совершит работу, равную уже пяти килограмм-метрам. В результате мы получаем работы на три килограмм-метра больше, чем затрачиваем.
При делении ядер тяжелых элементов они не распадаются до отдельных элементарных частиц, они только раскалываются на две части — осколки. Внутри полученных осколков мгновенно происходит перегруппировка элементарных частиц; они более плотно «упаковываются», и этот процесс сопровождается выделением энергии, причем выделяется энергии больше, чем ее расходуется на разрушение тяжелого ядра.
Расчеты показывают, что при делении тяжелых ядер выделяется только часть энергии, запасенной в ядре. Значительно больше энергии получается, если те же самые ядра бария и криптона синтезировать (составлять) непосредственно из протонов и нейтронов. Тогда не придется затрачивать энергию в 170 миллионов больших калорий на разрушение тяжелых ядер. В примере с водой это соответствовало бы тому, что не надо вытягивать ее из колодца наверх, а пользоваться бассейном, вода в котором находится на уровне верхнего края желоба.
Но для синтеза атомных ядер из нейтронов и протонов необходимо прежде всего иметь в своем распоряжении эти элементарные частицы. В готовом виде в природе их нет. Их можно получить только искусственным путем. Однако выделенные в свободном состоянии нейтроны и протоны нельзя запасать впрок. Протоны — это атомы протия, лишенные единственного электрона, в обычных условиях они долго существовать не могут. Протоны найдут для себя потерянные электроны и вновь превратятся в электрически нейтральные атомы протия.
Нейтроны легко проникают внутрь ядер атомов и захватываются ими. Кроме того, нейтроны радиоактивны. Продолжительность жизни нейтронов в свободном состоянии — считанные минуты. Если нейтрону удалось избежать захвата ядром, то он самопроизвольно превращается в протон и электрон. Откуда при радиоактивном превращении нейтрона появился электрон? Дело в том, что и нейтрон и протон по сути одна и та же элементарная частица, только находится она в разных энергетических состояниях. Чтобы подчеркнуть общность этих частиц, когда они составляют в совокупности какое-нибудь ядро атома, их даже называют одним именем — нуклоны. Так и говорят, например, ядро изотопа хлор-35 состоит из 35 нуклонов, не подразделяя их на протоны и нейтроны. Процесс перехода нейтрона в протон, это — самопроизвольный переход с более высокого энергетического уровня на более низкий; при этом и «рождается» электрон. Самопроизвольный же переход протона в нейтрон невозможен, это соответствовало бы переходу с низкого уровня энергии на более высокий, что противоречит закону сохранения энергии. Камень, лежащий на земле, никогда сам собою, без вмешательства внешней силы, не поднимется вверх. Если же протону сообщить извне необходимое количество энергии, он может превратиться в нейтрон, причем этот акт сопровожается появлением частички, подобной электрону, но положительно заряженной. Ее называют, как мы уже знаем, позитрон. Вот так и получается, что хотя в нейтронах и нет электронов, а в протонах — позитронов, но при взаимном их превращении частицы эти выделяются.
Итак, если удается получить в свободном виде нейтроны и протоны, то их необходимо тотчас же пустить для синтеза атомных ядер.
Разрушение тяжелых ядер типа урана на элементарные частицы (нуклоны) сопряжено с затратой большого количества энергии. А нет ли в природе таких ядер, в которых протоны и нейтроны связаны не так прочно между собой, как в ядре урана? Если такие ядра имеются, то первая мысленная стадия реакции — разрушение ядра — потребовала бы меньшей затраты энергии. Возвращаясь к примеру с колодцем и желобом,— надо искать по возможности мелкий колодец.
Здесь-то и выходит на сцену водород со своими тяжелыми изотопами и теперь уже не одним, а двумя.
Какую роль играл дейтерий в работе ядерного реактора? Его роль была вспомогательная — замедлять быстрые нейтроны до тепловых скоростей. Прямого участия в высвобождении ядерной энергии он не принимал. Во многих реакторах, как вы уже знаете, в качестве замедлителей нейтронов успешно используются углерод в виде графитовых блоков, или обыкновенная вода. Имеются реакторы и вовсе без замедлителя — это реакторы, работающие на быстрых нейтронах. В процессах же, с которыми мы теперь познакомимся, изотопы водорода имеют решающее значение в освобождении ядерной энергии.
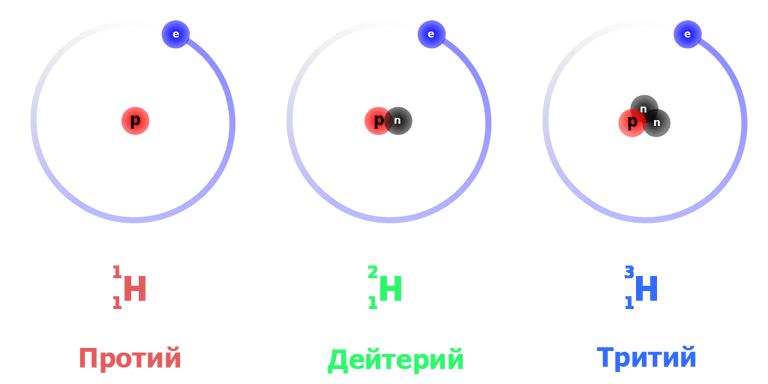
Кроме тяжелого изотопа водорода — дейтерия, имеется еще сверхтяжелый изотоп — тритий; его обозначают буквой Т. В ядро трития кроме протона входит не один нейтрон, как у дейтерия, а два (рис. 13). В отличие от дейтерия
Ядро трития радиоактивно; оно самопроизвольно распадается на ядро легкого изотопа гелия-3 и электрон: |
(белыми кружками обозначены протоны, черными — нейтроны, составляющие ядра).
Ф С* Ь) Рис. 13. Ядро дейтерия состоит из одного протона и одного нейтрона (а). Ядро трития — из одного протона и двух нейтронов (б). |
Половина всех имеющихся в наличии атомов трития распадается за 12,2 года. Этот срок не велйк, но вполне достаточный, чтобы всегда иметь тритий в запасе в нужном количестве.
Тритий является более сложно устроенным изотопом водорода. По своим свойствам он отличается от протия сильнее, чем дейтерий.
Как и первые два изотопа, тритий может быть сконденсирован в жидкость. Температура кипения жидкого трития уже на 4,65 градуса выше температуры кипения протия. Теплота испарения у него еще выше, чем у дейтерия. При соединении трития с кислородом образуется вода, которую называют тритиевой или сверхтяжелой водой. Подобно дейтерию тритий в сочетании с протаем, дейтерием и изотопами кислорода дает воду различного изотопного состава. К тем девяти разновидностям воды, которые дал дейтерий, теперь добавляется столько же новых, в состав молекул которых входят атомы трития. Формулы этих молекул можно записать так:
Т2о1в, т2о17, Т2018, тно1в, тно17, тно18,
ТБО16, ТОО17 и ТОО18.
Тритий имеется в природной воде, но только в
И очень малых количествах ( зо ооо ооо ооо ооо ооо ооо от числа атомов протия). Ничтожное количество трития имеется и в атмосфере.
Тритий не выделяют из природной воды, как дейтерий, а получают искусственным путем. Если поместить внутрь ядерного реактора, где имеется мощный поток нейтронов,
Вещества, содержащие атомы дейтерия, лития, бора или азота, то в результате ядерной реакции образуется тритий. Например:
| |
| |
Ядра трития образуются также при бомбардировке быстролетящими ядрами дейтерия какого-нибудь соединения, имеющего большое количество атомов дейтерия, например тяжелую воду или парафин, в молекулах которого все атомы водорода замещены на атомы дейтерия:
|
Теперь, когда получен сверхтяжелый изотоп водорода — тритий, можно осуществить реакцию синтеза атомов гелия, по следующему уравнению:
|
Рассуждая таким же образом, как и в случае деления ядер урана (см. стр. 50), мысленно расчленим процесс на две стадии: первая—разрушение ядер дейтерия и трития до отдельных нуклонов, вторая — синтез из них ядер гелия. Нейтроны и протоны связаны между собой в ядрах дейтерия и трития значительно менее прочно, чем в ядрах гелия. Поэтому на разрушение ядер двух изотопов водорода суммарно затрачивается меньше энергии, чем ее выделяется при синтезе одного ядра гелия из полученных элементарных частиц. Расчет показывает, что при образовании всего лишь одного грамма атомов изотопа гелия-4 из ядер дейтерия и трития высвобождается энергии около ста миллионов больших калорий. Это в пять раз больше энергии, выделяемой при делении одного грамма урана под действием нейтронов.
Чтобы осуществить реакцию синтеза ядер гелия, надо привести к столкновению ядра дейтерия и трития друг с другом. В этом состоит основная трудность в проведении реакции синтеза ядер гелия. Ведь оба сталкивающихся ядра положительно заряжены, а электрически, одноименно заряженные тела отталкиваются друг от друга. Для преодоления электрических сил отталкивания надо к ядрам при
ложить большие силы. Как же это сделать? Видимо, надо сообщить ядрам такую энергию движения, которой хватило бы на преодоление сил отталкивания, действующих между ними.
Средняя скорость беспорядочного движения частиц, а следовательно, и их энергия определяются температурой. Чем выше температура тела, тем больше средняя энергия частиц, тем быстрее они движутся. Значит, надо наши изотопы нагреть и нагреть до очень высокой температуры, порядка миллиона градусов и даже выше. Только при таких температурах энергия частиц будет достаточной для преодоления электрических сил отталкивания между ядрами. Если вспомнить, что даже на поверхности Солнца температура составляет всего лишь 6000 градусов, то трудность нагревания тел до миллиона градусов становится очевидной. Единственный известный в наше время источник, с помощью которого можно достигнуть таких температур, это взрыв атомной бомбы, то есть цепной процесс деления ядер урана или плутония. В зоне такого взрыва дейтерий и тритий будут существовать в форме плазмы — среды, состоящей из «голых» атомных ядер, лишенных электронных оболочек. В таких условиях ядра изотопов водорода получают возможность при встрече соединяться в ядра гелия, осуществляется так называемая термоядерная реакция. Такой или подобный ему процесс и происходит при взрыве водородной бомбы.
Чтобы использовать энергию, выделяющуюся при термоядерных реакциях, для мирных целей, необходимо научиться управлять такими реакциями. Разрешением этой очень трудной задачи заняты теперь ученые многих стран мира. Большие исследования в этом направлении проводятся у нас, в Советском Союзе. Удачное решение этой задачи снимет с человечества заботу о поисках новых источников энергии и приведет к невиданному расцвету науки и техники.
❖ *
*
Всего два с половиной десятилетия отделяют нас от момента открытия тяжелой воды и того времени, когда она получалась в количествах, умещающихся на дне маленькой пробирки. За это короткое время тяжелая вода завоевала себе прочное место в ядерной энергетике. Она оказалась лучшим замедлителем для атомных реакторов, работа
Ющих на тепловых нейтронах. Однако это еще не самое главное. Основное значение тяжелая вода приобретает при осуществлении термоядерных реакций. Для этих реакций прежде всего необходимо иметь в достаточном количестве сырье, то есть дейтерий и тритий. Атомы дейтерия являются составной частью молекул тяжелой воды. Атомы трития могут быть получены, как мы видели, из атомов дейтерия. Следовательно, тяжелая вода — вот тот источник, который поставляет необходимые элементы для осуществления реакции синтеза ядер гелия. Поэтому теперь получение тяжелой воды во многих странах мира ведется в крупных заводских масштабах.
Освобождение энергии, заключенной в ядрах атомов хи – ” мических элементов, является величайшим достижением современной науки. Освобождение ядерной энергии в про – Мышленных масштабах производится в специальных установках — ядерных …
С Разу же после открытия дейтерия и его кислородного соединения — тяжелой воды — стали искать сырье, из которого можно было бы получать эти вещества в достаточных количествах. Прежде всего …
msd.com.ua
чем отличается тритий от дейтерия?
В атоме трития 3 нейтрона, а в атоме дейтерия 2.
тритий образуется в результате захвата нейтронов ядрами дейтерия
Ценой за грам!!
В дейтерии 1 нейтрон, в тритии 2 нейтрона. Тритий, – радиоактивный изотоп водорода, дейтерий – нет. Еще дейтерий называют тяжелый водород.
Изотопы водорода отличаются периодом полураспада.
В ядре протия (обычного водорода) один протон <br>В ядре Дейтерия один протон и один нейтрон<br>в ядре трития два нейтрона и один протон<br>(в водороде содержится где то 99.985% протия и 0.015% дейтерия)<br>Тритий образуется только в результате ядерных реакций<br>ТРитий радиоактивный<br>он распадается с периодом полураспада 12.3 года на изотоп гелия 3 (два протона и один нейтрон) с испусканием антинейтрино и электрона (бета распад)
тритий образован в результате ядерных испытаний в атоме 3 электрона .В атоме изотопа водорода дейтерия 2 электрона.
touch.otvet.mail.ru
Водород дейтерий – Справочник химика 21
Позднее, благодаря тому, что научились разделять изотопы некоторых элементов, стали получать различные соединения, содержащие данный элемент в виде одного изотопа (или хотя бы обогащенные им), и применять их для исследования хода процесса. В особенности широкое применение получил тяжелый водород (дейтерий) благодаря относительно большому различию значений массы легкого и тяжелого изотопов водорода. Для [c.541]Определите молекулярную массу воды, молекулы которой содержат тяжелый изотоп водорода — дейтерий. [c.63]
Широко используются также изотопы водорода — дейтерий и тритий. Тяжелая вода ОгО используется в атомной энергетике как замедлитель нештронов в атомных реакторах. Дейтерий и тритий используются в ка-честпе термоядерного горючего в водородных бомбах, поскольку при реакции [c.288]
Каталитические превращения о- и водородов и изотопный обмен водород-дейтерий. [c.416]
Водород существует в виде трех изотопов Ш — водород, — дейтерий и радиоактивный Н — тритий. Тритий встречается в природе в ничтожных количествах. [c.224]
Для решения теоретических и практических задач весьма важно определить лимитирующую стадию реакции. Использование с этой целью ароматических углеводородов, содержащих вместо атомов водорода дейтерий или тритий, позволяет в несколько раз снизить скорость 2 второй стадии реакции, т. е. отрыва Н+. Подобный кинетический изотопный эффект объясняется большей энергией связи С—D и С—Т по – сравнению со [c.44]
Гелий Водород. Дейтерий Неол [c.332]
В таблице приведены основные чувствительные линии элементов, используемые для аналитических определений. Элементы расположены в алфавитном порядке их русских названий. Изотопы водорода (дейтерий и тритий), в связи с большей величиной изотопического смещения аналитических линий, выделены как отдельные элементы и включены в общий алфавит. Рядом с названием и символом элемента указана (в скобках) величина первого ионизационного потенциала. [c.637]
Особое значение приобрели изотопы водорода дейтерий и тритий как компоненты заряда водородного оружия и перспективное термоядерное топливо (управляемый термоядерный синтез). [c.205]
Открытие Уреем в 1932 г. тяжелого изотопа водорода, дейтерия (О) , быстро привело в органической химии к важным последствиям. Теоретически возможно заменить дейтерием каждый отде.иьный атом водорода в любом известном органическом соединении таким образом, делается доступным исследованию неизмеримое число новых органических веществ, многие из которых получены в последние годы в чистом виде. [c.1143]
Степень замещения водорода дейтерием. [c.683]
В пересчете на 100%-ное замещение водорода дейтерием. [c.683]
Применяют водород для получения высоких температур кислородно-водородным пламенем режут и сваривают металлы. Он используется для получения металлов (молибдена, вольфрама и др.) из их оксидов, в химической промышленности — для получения аммиака из азота воздуха н искусственного жидкого топлива из угля в пищевой промышленности—для гидрогенизации жиров (см. 17.14). Изотопы водорода — дейтерий и тритий — нашли важное применение в атомной энергетике (термоядерное горючее). [c.164]
Однако кинетический метод с использованием ароматических соединений, меченных дейтерием и тритием, позволил однозначно установить, что большинство реакций электрофильного замещения в ароматическом ядре протекает по двухстадийному механизму. Если бы реакции протекали по первому механизму в одну стадию или если бы вторая стадия второго механизма лимитировала весь процесс, то при замене в реагирующем ароматическом соединении водорода на дейтерий или тритий наблюдался бы изотопный эффект, т. е. произошло бы значительное уменьшение скорости реакции. (Известно, что вследствие различия масс водорода, дейтерия и трития разрыв связи С—Н происходит в 5—8 раз быстрее, чем связи С—О, и в 20—30 раз быстрее, чем связи С—Т). [c.315]
С изотопным эффектом дейтерия приходится считаться в том случае, если скоростьопределяющей стадией реакции является разрыв связи водорода (дейтерия) с другим элементом (М.—0- [c.198]
Таким образом, есть основание считать, что изотопные разности энергии водородной связи при замещении водорода дейтерием вызваны преимущественно изменениями энергии колебаний атомов, принимающих участие в образовании водородной связи. Эти примеры указывают на важность исследований изотопических эффектов для теории межмолекулярных взаимодействий. Учет изменений энергии характеристических колебаний атомов при образовании Н-связи полезен для выяснения вопроса, куда расходуется энергия, требующаяся для разрыва водородной связи. [c.68]
В больших количествах водород применяется в процессах получения аммиака, метанола, жидкого горючего на основе минеральных углей и в ряде других промышленных процессов. Изотопы водорода— дейтерий и тритий используются в ядерной энергетике. [c.47]
Замена водорода в молекуле реагента атомом дейтерия часто приводит к изменению скорости реакции. Такие изменения известны как изотопные эффекты дейтерия [32], которые выражаются отношением /гн/ о. В основном состоянии колебательная энергия связи (называемая энергией нулевых колебаний) зависит от массы атомов и при увеличении приведенной массы понижается [33]. Поэтому связи О—С, О—О, Ь—N и др. в основном состоянии имеют более низкую энергию, чем соответствующие связи Н—С, Н—О, Н—N и др. Следовательно, полная диссоциация связи в дейтерированном соединении требует больше энергии, чем в соответствующем изотопно незамещенном соединении (рис. 6.4). Если связи Н—С, Н—О или И—N вообще не разрываются в ходе реакции или разрываются не в лимитирующей стадии, замещение водорода дейтерием практически не оказывает никакого влияния на скорость (об исключениях будет сказано ниже), но если эти связи разрываются в лимитирующей стадии, то скорость при замещении дейтерием понижается. [c.294]
СВЯЗЬ участвует. Благодаря гиперконъюгации разность колебательной энергии между связями С—Н и С—О в переходном состоянии меньше, чем в основном состоянии, поэтому при замещении водорода дейтерием реакция замедляется. [c.297]
Другого типа вторичные изотопные эффекты возникают в результате замещения водорода дейтерием у атома углерода, соединенного с уходящей группой. Эти вторичные изотопные эффекты а-дейтерия имеют величину от 0,87 до 1,26 [50]. Они также коррелируют с карбокатионным характером переходного состояния. В
www.chem21.info
Тритий распад – Справочник химика 21
Концентрация атомов трития в воздухе приблизительно 5-10 моль/л Период полураспада трития около 12 лет Через сколько лет распадается 90 % трития, содержащегося в воздухе Пополнение содержания трития в воздухе за счет реакций синтеза не учитывать [c.360]ТРИТИЙ — радиоактивный изотоп водорода с массовым числом 3, ядро которого состоит из одного протона и двух нейтронов (символ Т или Н). Период полураспада = 12,26 лет при распаде испускает мягкие -частицы. Незначительные количества Т. образуются в результате ядерных процессов. В промышленности Т. получают облучением лития медленными нейтронами в ядерном реакторе. Т.— газ. Соединение Т. с кислородом Т О — сверхтяжелая вода — образуется при окислении Т. над горячим оксидом меди (И) или при электрическом разряде. Известно большое количество соединений (главным образом органических), включающих в себя, наряду с обычным водородом, и Т. Т. применяют как горючее в термоядерных бомбах и в ядерной технике, как радиоактивный индикатор в различных исследованиях, для определения возраста метеоритов и др. [c.254]
Тритий намного дешевле и поставляется в существенно больших удельных активностях. Так как тритий распадается быстрее, 1 мг-атом чистого трития представляет собой в 445 раз более высокую активность, чем 1 мг-атом О. Поскольку энергия бета-излучения трития на порядок ниже, чем радиоуглерода, доза для любого критического органа также приблизительно на порядок меньше. [c.663]
Хотя тритий распадается до 2Не с испусканием р-ча-стицы (период полураспада 12,5 лет), последний под действием тепловых нейтронов снова. быстро превращается в тритий по реакции [c.160]
Не + Н Тритий радиоактивен подвергается р-распаду [c.465]
Существует несколько типов радиоактивного распада. Для легких радиоактивных элементов типичен -распад, сопровождающийся испусканием из ядра одного электрона ф -распад) или позитрона (р -распад). Первый путь распада типичен для элементов с некоторым избытком нейтронов против оптимального. Так, Р -распаду подвергаются ядра углерода 0 (более тяжелые, чем стабильные изотопы С и 1 С), Н (трития), и (более тяжелые, чем стабильный изотоп фосфора), N3 (более тяжелый, чем стабильный изотоп Ма). Наоборот, р+-распаду подвергаются ядра, у которых имеется дефицит нейтронов против оптимального, например 11С или Ыа. Возникновение позитрона можно представить себе как происходящее в ядре превращение одного протона в нейтрон и позитрон. Вне ядра такой процесс требует значительной затраты энергии, так как сопровождается увеличением массы на 0,0014 а. е. м. [c.23]
Тритий находится в нормальном водороде в таких ничтожных количествах, что выделение его из природной смеси изотопов нереально [6, 17]. Искусственный радиоактивный изотоп тритий образуется в результате некоторых ядерных реакций, главным образом при бомбардировке атомов легких элементов дейтронами или нейтронами. Распад атмосферного трития компенсируется [c.10]
Существует несколько типов радиоактивного распада. Для легких радиоактивных элементов типичен р-распаядра углерода С (более тяжелые, чем стабильные изотопы С и С), Н (трития), з2р и ззр (более тяжелые, чем стабильный изотоп фосфора), (более тяжелый, чем ста- [c.26]
Все атомы одного и того же элемента имеют одинаковое число протонов и, следовательно, одинаковый заряд ядра, но могут содержать различное количество нейтронов, а значит, и различное массовое число. Такие атомы называют изотопами. Следовательно, изотопы —это атомы одного и того же химического элемента, отличающиеся друг от друга содержанием нейтронов в ядре. Например, водород имеет такие изотопы Н — протий (2 = 1, Л = 1), О —дейтерий (2=1, А = 2) и Т —тритий (2=1, Л=3). Почти все химические элементы состоят из нескольких изотопов. Изотопы делятся на две группы стабильные и радиоактивные. Ядра стабильных изотопов вполне устойчивы, ядра радиоактивных изотопов самопроизвольно распадаются, превращаясь в ядра других элементов. [c.17]
Написать полное уравнение а-распада трития. [c.39]
JU + Jn—jHe + jH Тритий радиоактивен, подвергается -распаду
www.chem21.info