Адсорбция движущая сила – Справочник химика 21
Массопередача при адсорбции. Движущей силой процесса адсорбции является разность между концентрацией адсорбируемого вещества в паровоздушной смеси и концентрацией адсорбируемого вещества в паро-воздушной смеси, соответствующей равновесной [c.530]III. Массообменные процессы связаны с переходом вещества из одной фазы в другую в результате диффузии. Поэтому их называют также диффузионными. К этому классу относятся перегонка, ректификация, абсорбция и десорбция, адсорбция, экстракция, сушка, кристаллизация и др. Движущей силой массообменных процессов является разность концентраций. Скорость процесса определяется законами массопередачи. [c.13]
В. Регулирование температуры процесса как средство повышения движущей силы применяется главным образом в сорбционных и десорбционных процессах. Движущая сила процессов абсорбции, адсорбции, конденсации выражается как ЛС=С—С. Понижая температуру жидкой фазы, уменьшают парциальное давление паров газового (парового) компонента над ней, т. е. С, и соответственно увеличивают движущую силу ЛС и общую скорость процесса и. Снижение температуры в проточных аппаратах чаще всего достигается подачей жидкости, предварительно охлажденной в холодильниках. Применяют также холодильные элементы (трубы, змеевики), помещенные непосредственно в аппарате, или охлаждение стенок аппарата. Движущая сила процессов десорбции и испарения выражается как ЛС = С —С. Сдвиг равновесия и увеличение скорости этих процессов достигается повышением температуры жидкости перед подачей ее в аппарат (в теплообменниках, трубчатых печах и других типах нагревателей) или непосредственно в аппаратах горячими газами, острым или глухим паром. Одновременная регулировка температуры и давления позволяет увеличить движущую силу процесса за счет обоих составляющих.
В случае прямолинейной изотермы адсорбции средняя движущая сила процесса для данного момента времени определяется из выражения [c.208]
Движущей силой агломерации является стремление дисперсной системы уменьшить свою поверхностную энергию Гиббса и перейти к более устойчивому состоянию. Но если при адсорбции молекул извне поверхностная энергия системы уменьшается вследствие понижения удельной энергии Гиббса, то в рассматриваемом случае основной причиной понижения поверхностной энергии системы является уменьшение свободной поверхности зерен за счет возникновения контактов между ними. Поэтому агломерация возникает самопроизвольно, обусловливая слипание частиц друг с другом при хранении материалов и налипание их на мелющие тела. Очевидно, что с увеличением значения а (зависимости от природы вещества, строения его кристаллической решетки) и увеличением свободной поверхности 5 твердой фазы дисперсной системы сильнее выражена тенденция порошка к агломерации. [c.298]
В этом случае глубина осушки газа при работе слоя до проскока влаги будет соответствовать точке росы газа по воде ниже —40° С. В тех случаях, когда необходимо осушать газ до точки росы заметно ниже —40° С (например па заводах сжижения), рекомендуется влагоемкость адсорбентов принимать несколько меньшей приведенной. Это связано с тем, что массообмен между газом и адсорбентом в концевой части слоя ухудшается из-за уменьшения движущей силы процесса адсорбции.
Если динамика адсорбции контролируется внутридиффузионным массопереносом, то применяют приближенное уравнение, предложенное Глюкауфом, в котором движущая сила процесса записывается через разность концентраций в адсорбированном состоянии [c.132]
Ас = с—с (где с — текущая концентрация адсорбтива в потоке, равновесная текущей величине адсорбции а). Для уравнения кинетики в форме (10.6) движущая сила в тех же условиях составляет Да = а —а (где а — величина адсорбции, равновесная текущей концентрации адсорбтива). [c.225]
Нанося на диаграмму в координатах х—у равновесные кривые, которые вычисляются методом, применявшимся выше, получим характерную для абсорбции кривую / и характерную для адсорбции кривую 2. Движущая сила сорбции будет несравненно большей при протекании процесса по [c.544]
Диффузия поверхностно-активного вещества от периферии пленки повышает значение адсорбции в центре, которая при этом остается неизбежно ниже, чем адсорбция в тот же момент на периферии [Р (О, ) движущей силой процесса стабилизации межфазной пленки, удалось провести для [c.151]
Применение мембранных процессов в разделении газовых смесей — новое перспективное направление, позволяющее в ряде случаев получить значительный экономический эффект, особенно для маломасштабных задач. Однако использование известных в настоящее время полимерных мембран для глубокой очистки газов еще не получило широкого распространения. Поскольку в области малых содержаний резко уменьшается движущая сила диффузии (разность парциальных давлений) молекул примеси, то преимущественно через мембрану проникает основной компонент. Поэтому материал мембраны должен обладать большей проницаемостью по отношению к основному компоненту. Удаление накапливающегося в кислороде метана (несколько долей на миллион) может быть осуществлено путем его выжигания в печах на катализаторах (оксиды меди или алюминия). Оно должно предшествовать очистке кислорода от влаги и диоксида углерода. Примеси криптона и ксенона могут быть удалены из смеси с кислородом методом адсорбции на силикагеле.
В 1955 г. Глюкауф [23] предложил уравнение, в котором движущая сила внутридиффузионного процесса адсорбции записывалась через разность концентраций адсорбата в твердой фазе. Автор отмечает, что такое выражение движущей силы является достаточно хорошей аппроксимацией уравнения нестационарной диффузии при линейной изотерме сорбции. Уравнение Глюкауфа записывается следующим образом [c.212]
Величина п может быть определена графически построением ступенчатой линии между изотермой адсорбции и рабочей линией (рис. 4.17). Ввиду незначительного отличия изотермы от прямой линии на малом участке Сг+1 — можно принять Ас как среднюю арифметическую разность движущих сил на входе и на выходе из ступени [c.202]
Скорость и
www.chem21.info
3. Поверхностные явления. Адсорбция
3.1. Движущие силы адсорбции
До сих пор мы рассматривали межфазные равновесия и распределения компонентов между фазами. А что происходит на межфазных границах?
Адсорбция – самопроизвольное концентрирование вещества на межфазной границе. Движущая сила процесса адсорбции – нескомпенсированность межмолекулярных взаимодействий на границе фаз по сравнению с таковыми внутри объема фаз. Если химические (ковалентные) связи на границе фаз не образуются, то межмолекулярными взаимодействиями, ответственными за адсорбцию, могут быть водородные связи, ион-дипольные, диполь-дипольные, индукционные, дисперсионные (вспомните общую химию и воспользуйтесь дополнительной литературой [2, 3]).
В результате нескомпенсированности межмолекулярных взаимодействий обязательно возникает избыточная поверхностная энергия Гиббса:
GS = , (3.1)
где , – площадь поверхности раздела фаз (м2), – избыточная удельная поверхностная энергия (Дж/м2).
Самопроизвольно в многофазной системе могут идти только процессы с уменьшением этой энергии (Δ GS < 0). Поэтому возможны две группы явлений на межфазных границах:
1) При = const условие ΔGS = Δ < 0 выполнимо при уменьшении площади межфазной границы: Δ < 0. Образование, устойчивость и особые свойства систем с большой общей поверхностью раздела фаз (дисперсных систем) рассмотрим в курсе коллоидной химии)
2) При = const условие ΔGS = Δ < 0 выполняется, если понижается избыточная удельная межфазная энергия: Δ < 0.
Величина , как и силы межмолекулярного взаимодействия, зависит от природы молекул, находящихся в поверхностном слое. Поэтому самопроизвольно на поверхность будут стремиться “попасть” молекулы, характеризующиеся наиболее слабыми межмолекулярными взаимодействиями. Это означает, что концентрация таких молекул в объеме окажется меньше, чем на поверхности, т.е. будет протекать адсорбция молекул в поверхностном слое.
Значительную роль при адсорбции играет также геометрия поверхности раздела фаз. В курсе физической химии рассмотрим случай открытой плоской поверхности. Случай искривленной поверхности (например, адсорбция в порах твердого тела или на мельчайших частицах твердой фазы) приводит к зависимости термодинамических характеристик системы от радиуса кривизны поверхности раздела фаз (от размера пор; от размера частиц твердой фазы или размера капель жидкой фазы, распределенных в другой фазе). Такие системы, а также явления на границе раздела трех соприкасающихся фаз (твердой, жидкой и газообразной) будут рассматриваться в курсе коллоидной химии.
3.2. Адсорбция на границе раздела жидкой и газообразной фаз. Поверхностно-активные вещества (пав)
Избыточную удельную поверхностную энергию на границе жидкость (раствор) – газ (воздух) принято называть поверхностным натяжением жидкости (ее размерность в системе СИ Дж/м 2=Н/м).
Рассмотрим зависимости раствора от концентрации растворенного вещества (с). С увеличением концентрации водного раствора может либо убывать (растворенные вещества в этом случае называются поверхностно-активными, ПАВ), либо возрастать (такие вещества являются поверхностно-инактивными, ПИАВ).
Количественно обе зависимости описываются адсорбционной формулой Гиббса:
, (3.2)
где Г – избыток вещества на межфазной границе, т.е. на поверхности жидкости (т.н. Гиббсовская адсорбция, моль/м2) по сравнению с объемом раствора, с – концентрация растворенного вещества (моль/л), (dσ / dc) – поверхностная активность.
Для водных растворов ПАВ (dσ / dc)<0 и Г>0 (положительная адсорбция), для водных растворов ПИАВ (
Разница в поведении ПАВ и ПИАВ обусловлена их строением. Для водных растворов поверхностно-активными являются дифильные молекулы, содержащие полярную головку и неполярный «хвост» (алифатический радикал). Схема строения молекулы ПАВ показана на рис. 3.1.
Рис. 3.1. Схема строения молекулы ПАВ
Поверхностно-инактивными веществами являются сильные электролиты, диссоциирующие в водном растворе на ионы.
На границе полярной (вода) и неполярной (воздух) фаз молекулы ПАВ и ПИАВ ведут себя по-разному. ПАВ – концентрируется, ориентируясь полярной головкой в полярную фазу (воду), а «хвостом» – в неполярную (воздух), поскольку именно в этом случае σ и Gs понижаются. ПИАВ, более полярные, чем вода, вообще «не хотят» выходить на поверхность.
На рис. 3.2 приведена зависимость удельной поверхностной энергии (поверхностного натяжения) водного раствора ПАВ от его концентрации и показано состояние поверхностного слоя раствора при разных концентрациях ПАВ.
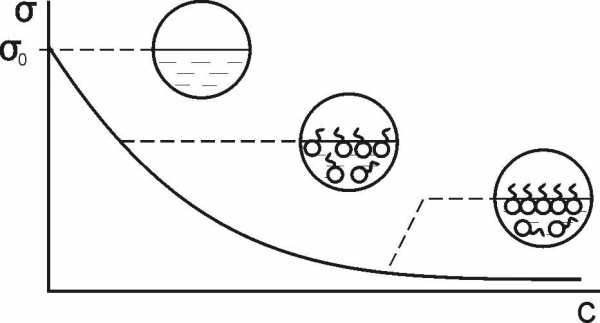
Рис. 3.2. Зависимость удельной поверхностной энергии водного раствора ПАВ от его концентрации и изменение состояния поверхностного слоя (при постоянной температуре)
По мере увеличения концентрации ПАВ в растворе растет его концентрация в поверхностном слое и уменьшается поверхностная энергия. При полном заполнении поверхностного слоя молекулами ПАВ (образовании мономолекулярного слоя из таких молекул) зависимость σ от концентрации ПАВ исчезает.
studfiles.net
Движущая сила – процесс – адсорбция
Движущая сила – процесс – адсорбция
Cтраница 1
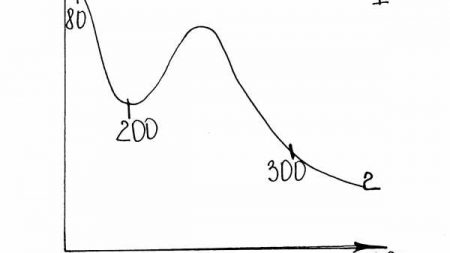
Движущая сила процесса адсорбции определяется при данной величине адсорбции а. Поскольку движущая сила в процессе адсорбции изменяется по высоте аппарата, вводится понятие о средней движущей силе процесса Асср. [2]
Что является движущей силой процесса адсорбции на любой тарелке адсорбера. [3]
Что является движущей силой процессов адсорбции. [4]
Что является движущей силой процесса адсорбции на любой тарелке адсорбера. [5]
После построения рабочих линий движущую силу процесса адсорбции находят обычным путем – или определением числа ступеней изменения концентраций, или подсчетом общего числа единиц переноса. [6]
По уравнению (24.7) рассчитывают движущую силу процесса адсорбции на выходе из адсорбера. [7]
Кроме принятого в этой работе выражения для движущей силы процесса адсорбции, разностью каких двух других величин она может быть выражена. [8]
Кроме принятого в этой работе выражения для движущей силы процесса адсорбции разностью каких двух других величин она также может быть выражена. [9]
Новые порции потока газа-носителя или раствора при поступлении в слой встречаются с зернами адсорбента, в порах которых уже есть ранее поглощенное вещество. В результате того, что движущая сила процесса адсорбции ( ао – а () уменьшается с ростом щ, скорость адсорбции падает и процесс снижения концентрации вещества в потоке от Со до О заканчивается на большем расстоянии от начала слоя. [11]
Новые порции потока газа-носителя или раствора при поступлении в слой встречаются с зернами адсорбента, в порах которых уже есть ранее поглощенное вещество. В результате того, что движущая сила процесса адсорбции ( а0 – а /) уменьшается с ростом а, скорость адсорбции падает и процесс снижения концентрации вещества в потоке от С0 до О заканчивается на большем расстоянии от начала слоя. [13]
Для заданных значений F, W и Р и их составов при неизменной скорости адсорбента движущая сила процесса адсорбции постоянна. [14]
В тех случаях, когда необходимо осушать газ до точки росы заметно ниже – 40 С ( например на заводах сжижения), рекомендуется влагоемкость адсорбентов принимать несколько меньшей приведенной. Это связано с тем, что массообмен между газом и адсорбентом в концевой части слоя ухудшается из-за уменьшения движущей силы процесса адсорбции. [15]
Страницы: 1
www.ngpedia.ru
12.5. Адсорбция. Поверхностно-активные и поверхностно-инактивные вещества. Уравнение адсорбции Гиббса.
Процессы поглощения газов или растворенных веществ твердыми материалами или жидкостями носят общее название сорбции.
Различают три основных вида сорбционных процессов: адсорбцию, абсорбцию, капиллярную конденсацию.
Абсорбцией называют поглощение газа или пара всем объемом твердого вещества или жидкости.
Капиллярная конденсация представляет собой процесс сжижения пара в порах твердого сорбента.
Если образующаяся жидкость хорошо смачивает стенки капилляров, т. е. поверхность твердого вещества, то в капиллярах образуется вогнутые мениски в результате слияния жидких адсорбционных слоев, возникающих на стенках капилляров. Над вогнутым мениском давление насыщенного пара понижено по сравнению с давлением насыщенного пара над плоской поверхностью при одной и той же температуре. Это явление приводит к тому, что в капиллярах пар начинает конденсироваться при более низком давлении, в то время как над плоской поверхностью конденсация еще не происходит.
Адсорбция – это самопроизвольное концентрирование вещества на твердой или жидкой поверхности раздела фаз.
Адсорбируемое вещество называется адсорбатом, а адсорбирующее – адсорбентом.
Наиболее применяемые адсорбенты – капиллярно-пористые тела, такие как цеолиты, активированные угли, силикагели, глины, торф.
Движущей силой адсорбции является избыточная поверхностная энергия на границе раздела фаз.
В зависимости от природы сил между адсорбентом и адсорбатом различают химическую и физическую адсорбцию. При химической адсорбции или хемосорбции образуются химические связи, а физическая адсорбция вызвана лишь ван-дер-ваальсовым взаимодействием. При повышении температуры физическая адсорбция понижается, так как при этом усиливается движение молекул в адсорбционном слое, нарушается ориентация адсорбированных молекул и усиливается десорбция. Нагревание повышает энергию адсорбирующихся молекул и соответственно усиливает химическую адсорбцию.
Рассмотрим системы жидкость-газ; жидкость-жидкость.
Для характеристики адсорбции используют полную (абсолютную) адсорбцию А, которую выражают через количество вещества, адсорбированного единицей поверхности или массы адсорбента (моль/см2, г/см2, моль/г, г/г), и удельную (избыточную) или гиббсовскую адсорбцию Г, которая характеризует избыток адсорбированного компонента в поверхностном слое по сравнению с его количеством в объеме фазы, приходящийся на единицу площади раздела фаз .
Изотермой адсорбции называется зависимость величины адсорбции от равновесного давления или концентрации адсорбата при постоянной температуре
или
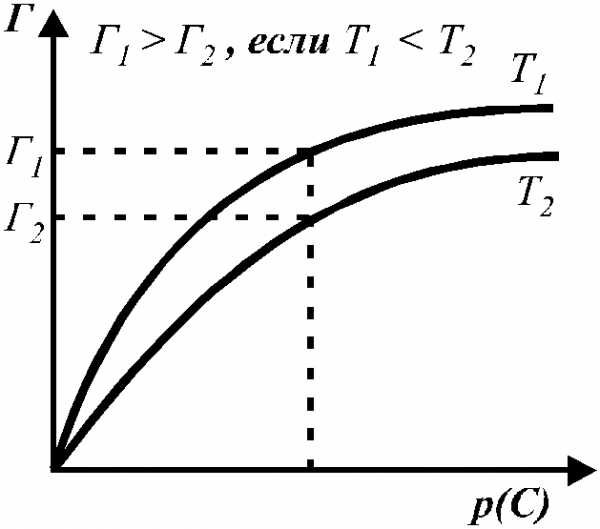
Рис. 3. Зависимость адсорбции Г от равновесного
давления (концентрации) и при различных температурах.
Следует отметить, что гиббсовская адсорбция Г бывает положительной и отрицательной.
В случае, если концентрация адсорбата в поверхностном слое больше его концентрации в объеме, то адсорбция положительна, а при концентрации адсорбата в поверхностном слое меньшей, чем концентрация в объеме, адсорбция отрицательна.
Прямых методов определения избытка растворенного вещества в адсорбционном слое пока не существует однако здесь можно точно измерить поверхностное натяжение. Поэтому очень важным в теории адсорбции является уравнение Гиббса, связывающее адсорбцию Г растворенного вещества с изменением поверхностного натяжения раствора:
d = Г d;
d – бесконечно малое изменение хим. потенциала адсорбируемого вещества.
= о + RT lna
d = RT dlna = RT 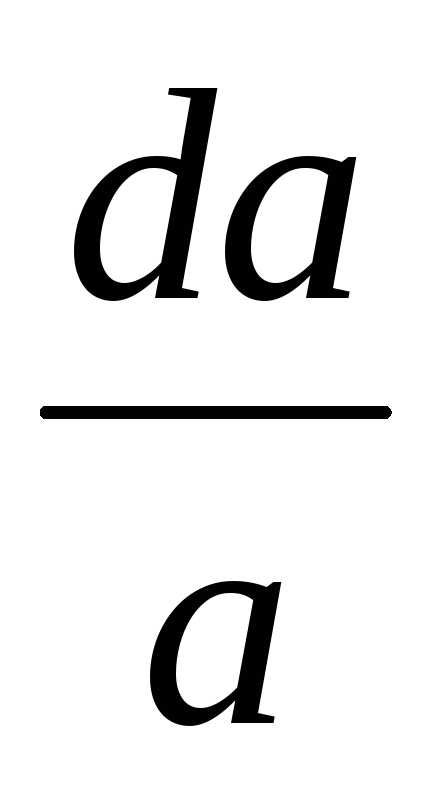
При небольших значениях концентрации а с
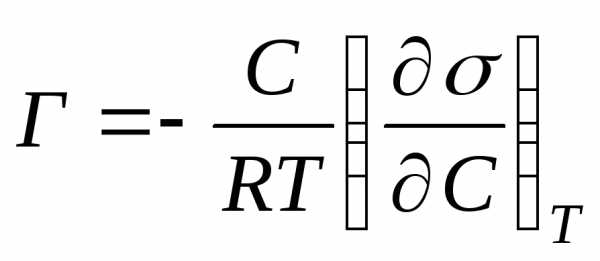 , (8)
, (8)
где С – равновесная концентрация вещества в растворе.
Область практического использования уравнения для определения величины адсорбции ограничена системами, для которых доступно экспериментальное измерение поверхностного натяжения, т. е. системами жидкость – газ и жидкость – жидкость.
Из уравнения Гиббса следует, что адсорбцию растворенного вещества можно определить по понижению поверхностного натяжения жидкости с ростом концентрации этого вещества в растворе.
Вещества,
понижающие поверхностное натяжение на
границе раздела фаз, называются
поверхностно – активными (ПАВ), для них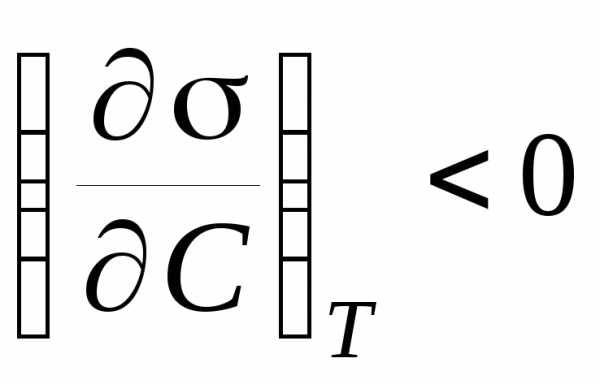 ,т. е. поверхностное
натяжение раствора по мере прибавления
ПАВ уменьшается и, следовательно,
адсорбция будет больше нуля. Это означает,
что концентрация ПАВ в поверхностном
слое больше, чем в объемной фазе. К ПАВ
относятся органические соединения с
несимметричным строением молекул,
состоящих из полярных и неполярных
групп. Полярная группа, имеет сродство
к полярной фазе. Полярными свойствами
обладают такие атомные группировки,
как –СООН, -ОН, -NН2,
-СНО, -SO2OH
и др. Все эти группы способны к гидратации
и являются гидрофильными. Неполярная
часть молекул ПАВ представляет собой
гидрофобную углеводородную цепь или
радикал.
,т. е. поверхностное
натяжение раствора по мере прибавления
ПАВ уменьшается и, следовательно,
адсорбция будет больше нуля. Это означает,
что концентрация ПАВ в поверхностном
слое больше, чем в объемной фазе. К ПАВ
относятся органические соединения с
несимметричным строением молекул,
состоящих из полярных и неполярных
групп. Полярная группа, имеет сродство
к полярной фазе. Полярными свойствами
обладают такие атомные группировки,
как –СООН, -ОН, -NН2,
-СНО, -SO2OH
и др. Все эти группы способны к гидратации
и являются гидрофильными. Неполярная
часть молекул ПАВ представляет собой
гидрофобную углеводородную цепь или
радикал.
Молекулы, в которых имеются гидрофильная и гидрофобная группировки называют дифильными.
Вещества, увеличивающие поверхностное натяжение на границе раздела фаз, называются поверхностно-инактивными (ПИВ).
Для них
 ,
,
т. е. поверхностное натяжение раствора по мере прибавления ПИВ увеличивается и, следовательно, адсорбция будет меньше нуля. Это означает, что такие вещества стремятся накапливаться в объемной фазе, а не на поверхности.
Если  ,
то адсорбция будет равна нулю, т. е.
концентрации растворенного вещества
на поверхности и в объеме равны.
,
то адсорбция будет равна нулю, т. е.
концентрации растворенного вещества
на поверхности и в объеме равны.
Величина называетсяповерхностной активностью вещества.
Она обозначается через G (в честь Гиббса).

Поверхностная активность – это мера способности вещества понижать поверхностное натяжение.
Для органических предельных спиртов и кислот в гомологических рядах соблюдается правило Дюкло – Траубе: увеличение цепи на одну СН2-группу увеличивает поверхностную активность гомолога в 3 – 3,5 раза в водном растворе.
Таким образом, для двух соседних гомологов можно записать
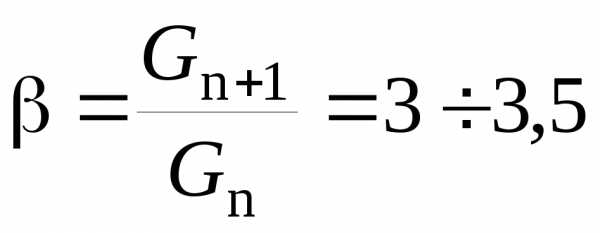 . (9)
. (9)
Величину  называюткоэффициентом
Траубе.
называюткоэффициентом
Траубе.
Зависимость поверхностного натяжения от концентрации водных растворов ПАВ хорошо описывается эмпирическим уравнением Шишковского
, (10)
где σ0 – поверхностное натяжение чистой воды, С – концентрация ПАВ, b и а – эмпирические постоянные, σ поверхностное натяжение раствора.
Для газов, растворов неэлектролитов и слабых электролитов адсорбция часто выражается эмпирическим уравнением Фрейндлиха:
, (11)
где С – равновесная концентрация, k и n – эмпирические константы.
17
studfiles.net
Вопрос 3. Физическая сущность процесса адсорбции. Основные меры пожарной безопасности.
На практике по механизму адсорбции осуществляют процесс поглощения одного или нескольких компонентов из газовой смеси или раствора как правило на поверхности твердого вещества – адсорбентом. Смесь паров или газов, направляемую на адсорбцию , называют адсорбтивом вещество, которое используют как поглотитель, называют адсорбентом. Адсорбируемое вещество называют адсорбатом. Адсорбенты обладают селективностью (избирательностью) и обратимостью. Благодаря этому имеется возможность улавливать и затем выделять адсорбируемые вещества из растворов или смесей газов и возвращать их в производство. В этом состоит сущность рекуперации. Рекуперация используется, в частности, для возврата в производственный цикл пожаровзрывоопасных и токсичных растворителей.
В качестве адсорбентов используются твердые пористые вещества и материалы как природные, так и искусственные, обладающие высокой пористостью. Количество вещества, поглощаемое (сорбируемое) единицей массы (или единицей объема) адсорбента называют активностью. Различают статическую и динамическую активность. Адсорбционную активность нельзя отождествлять с активностью поверхности по отношению к кислороду, т.е. с реакционной способностью. Это различные активности. Часто высокоактивный сорбент может обладать пониженной склонностью к самовозгоранию.
В промышленности в качестве адсорбентов применяют активные угли, силикагель, цеолиты и иониты.
Активные угли – высокопористые углеродные материалы, получаемые путем температурной карбонизации дерева, бурого угля, косточек плодов и других углеродосодержащих материалов и последующего их активирования, т.е. придания им повышенной пористости. Пористость активных углей 600…1700 м2/г. Основной недостаток активных углей – повышенная склонность к самовозгоранию. Самовозгорание в адсорберах может приводить к взрывам паровоздушных смесей. Поэтому в адсорбционных установках активный уголь стремятся заменить негорючим силикагелем.
Силикагель представляет собой микропористое тело, получаемое прокаливанием геля поликремниевой кислоты. Состоит из SiO2. Удельная адсорбционная поверхность 400… 770 м2/г. Негорюч, механически прочен.
Основные недостатки силикагеля по сравнению с активным углем – его меньшая поглотительная активность и высокая гигроскопичность. По мере увлажнения силикагель свои сорбционные свойства к улавливанию растворителей теряет. Поэтому нередки случаи, когда в системах рекуперации адсорберы с силикагелем своего назначения не выполняют.
Цеолиты – (молекулярные сита) – природные минералы или искусственные соединения (алюмосиликаты). Имеют высокую избирательную способность. Применяются для осушки и очистки газов и жидкостей.
Иониты:неорганические –природные и синтетические алюмосиликаты, гидроокиси и соли поливалентных металлов; органические – ионообменные соли. Применяются для умягчения воды, извлечения из растворов следов металлов, очистки сахарных сиропов, лекарств и т.д.
Движущей силой процесса адсорбции является разность между рабочей концентрацией поглощаемого вещества в растворе или парогазовой смеси и концентрацией этого вещества (компонента) в условиях равновесия.
При более глубоком рассмотрении этого процесса просматривается связь адсорбционных свойств со свободной энергией поверхности сорбента. При адсорбции молекулы газа или пара удерживаются адсорбционными силами. Эти силы могут быть ионными, дисперсионными и другими ещё недостаточно изученными силами Адсорбция молекул на поверхности твердых материалов сопровождается выделением теплоты. Поэтому о прочности связи сорбированных молекул с поверхностью можно судить по теплотам адсорбции.
Адсорбционные силы по сравнению с химическими являются достаточно слабыми, но их действие распространяется на несколько сорбированных молекулярных слоёв. С повышением температуры кинетическая энергия адсорбированных молекул возрастает, и адсорбционные силы оказываются не в состоянии удерживать сорбированные молекулы на поверхности адсорбента. Поэтому при повышенных температурах происходит десорбция, поверхность адсорбента освобождается от сорбированного вещества.
На протекание процесса адсорбции оказывают влияние следующие факторы:
1.Свойства адсорбента, его статическая и динамическая активность. При этом под статической активностью понимают количество вещества, поглощаемое единицей массы или единицей объёма адсорбента из неподвижной газовой смеси до установления состояния равновесия. Под динамической активностью понимают количество вещества, поглощаемое единицей массы (или объёма) адсорбента при движении через него газовой смеси до момента “проскока”. Динамическая активность всегда меньше статической, так как в условиях движения газа не достигается равновесное состояние в системе газ – твёрдое тело.
2.Температура газовой смеси. С повышением температуры адсорбция ухудшается. Поэтому адсорбцию следует проводить при сравнительно низких температурах. При повышенных температурах извлекают поглощённое вещество из адсорбента, т.е. ведут процесс десорбции.
3.Давление газовой смеси. С повышением давления процесс адсорбции улучшается. Поэтому адсорбцию следует проводить при повышенном давлении, а десорбцию – при пониженном.
4.Свойства поглощаемых веществ. Из смеси газов и паров в первую очередь и в большем количестве поглощается компонент с более высокой температурой кипения (низком давлении насыщенного пара). Поэтому из паровоздушных смесей поглощаются пары растворителей, а не кислород и азот воздуха.
Адсорберы
Адсорбция осуществляется в специальных аппаратах, называемых адсорберами. Адсорберы бывают непрерывного и периодического действия. В аппаратах непрерывного действия адсорбент находится в виде движущегося или «кипящего» слоя. В аппаратах периодического действия слой сорбента обычно находится в неподвижном состоянии.
Принцип работы однокамерного адсорбера непрерывного действия с «кипящим» слоем заключается в следующем. Адсорбент поступает внутрь аппарата на решетку сверху, а газ на очистку снизу. Скорость подачи газа такова, что сорбент как бы кипит, что обеспечивает хороший контакт газа с поверхностью сорбента. Отработавший сорбент с уловленным его поверхностью газом или паром выводится из рабочей камеры по трубе вниз, а газ через циклонное устройство, где очищается от сорбента, через верхний штуцер выводится из аппарата. Десорбция газов или паров, уловленных сорбентом, осуществляется в отдельном аппарате. После очистки и охлаждения регенерированный сорбент возвращается снова в адсорбер.
Адсорберы периодического действия могут быть горизонтального, вертикального или кольцевого исполнения. Вертикальный адсорбер периодического действия. В корпусе на специальной решетке размещается слой адсорбента. Загрузка свежего адсорбента осуществляется через загрузочный люк в крышке адсорбера. Паровоздушная смесь подаётся в аппарат также сверху через штуцер. Отвод очищенного воздуха осуществляется через патрубок
Активный уголь выдерживает около 1000 циклов, после чего подлежит замене. Выгрузка отработавшего угля из аппарата осуществляется через люк.
Паровоздушная смесь по специальной линии подаётся в адсорбер, где проходит через слой адсорбента. Через определенное время уголь насыщается парами растворителя, и поглощение практически прекращается. Этот момент, называемый «проскоком», определяется по концентрации паров растворителя в отходящих из адсорбера газах. Процесс адсорбции прекращают. Отработавший уголь, насыщенный парами растворителя, подвергают десорбции в этом же адсорбере.
Продолжительность работы адсорбера до проскока зависит от свойств сорбента и высоты слоя угля в адсорбере. Согласно эмпирической формуле Н.А.Шилова длительность процесса поглощения определяется формулой
, (1)
k – коэффициент защитного действия слоя; H – высота слоя адсорбента в адсорбере; – потеря времени защитного действия слоя в начале работы адсорбента.
Как видно из формулы, с увеличением высоты слоя адсорбента в адсорбере длительность работы адсорбера по улавливанию паров увеличивается. Но это сопровождается возрастанием гидравлического сопротивления слоя и, если адсорбентом является активный уголь, с увеличением H возрастает опасность самовозгорания угля в адсорбере.
Десорбция (отдув) уловленных паров с поверхности адсорбента осуществляется водяным паром. Отдув можно осуществлять и нагретым воздухом, что более экономично, но такой способ отдува обладает повышенной пожаровзрывоопасностью, поэтому в нашей стране его в настоящее время не применяют. Отдув, практически везде осуществляют паром. Такой способ экономически не выгоден, но он менее пожаровзрывоопасен, поэтому он практически повсеместно вытеснил более экономичный способ отдува нагретым воздухом.
Пар для отдува адсорбированного вещества с адсорбента, в рассматриваемом случае для десорбции растворителя с поверхности активного угля, подаётся по кольцевому перфорированному трубопроводу. При прохождении водяного пара через уголь пары растворителя с поверхности угля переходят в водяной пар, и через патрубок паровоздушная смесь отводится в специальные аппараты, где пары воды и растворителя конденсируются, а затем производится их разделение
При отдуве адсорбированного вещества с адсорбента, некоторая часть пара конденсируется, уголь увлажняется и разогревается, в результате чего становится непригодным для следующего цикла адсорбции. Его следует высушить и охладить.
Сушку угля осуществляют подогретой паровоздушной смесью. Этот период работы адсорбера является наиболее пожаровзрывоопасным, так как повышается температура угля в адсорбере и одновременно не улавливаются пары растворителя, создавая опасность образования взрывоопасной смеси.
Из вышеизложенного следует, при десорбции растворителя водяным паром полный цикл работы адсорбера периодического действия включает следующие четыре операции (фазы): адсорбцию (концентрирование паров растворителя на поверхности адсорбента), десорбцию (отдув паров растворителя с поверхности адсорбента водяным паром), сушку сорбента (угля) и его охлаждение. Следует отметить, что большинство промышленных установок работает не по четырехфазному, а двухфазному циклу: когда фазы сушки и охлаждения совмещены с фазой охлаждения. Естественно, что влажный и разогретый уголь не адсорбирует пары растворителя, поэтому в этот момент они не улавливаются в адсорбере, а выбрасываются в атмосферу. Этот период таит в себе повышенную опасность самовозгорания угля и последующего взрыва паровоздушной смеси в адсорбционной установке.
Похожие статьи:
poznayka.org
Пример адсорбции – адсорбирующие свойства
Физическая и химическая адсорбция
Адсорбция – поглощение веществ из растворов или газов поверхностным слоем твёрдого тела или жидкости. Движущей силой процесса является наличие на поверхности некомпенсированных сил межатомного взаимодействия, за счёт чего и притягиваются молекулы адсорбированного вещества – адсорбата. Происходит не только снижение поверхностной энергии, но и образование на поверхности различной по составу пленки.
Термодинамическое состояние атомно-чистой поверхности способствует активному протеканию процесса адсорбции. Известно, что на чистой металлической поверхности содержится около 105 адсорбционных позиций, приходящихся на 1 см2.
Различают физическую и химическую адсорбцию веществ на поверхности. Возможны и промежуточные виды взаимодействий на границе раздела фаз.
Физическая адсорбция.Адсорбированный слой связан с поверхностью слабыми межатомными связями, например силами Ван-дер-Ваальса. Теплота физической адсорбции, как правило, невелика и редко превосходит несколько десятков кДж/моль (примерно 40 кДж/моль). Процесс физической адсорбции обратим, относится к неактивируемым, протекает очень быстро, как только молекулы адсорбата окажутся на поверхности твёрдого или жидкого тела. Наиболее часто физическую адсорбцию связывают с взаимодействием поверхности с газовой фазой. Количество адсорбированного газа снижается при уменьшении давления и возрастании температуры.
Простейшие уравнения мономолекулярной адсорбции предложены Генри и Ленгмюром. Уравнение Генри (так называемая изотерма Генри)
| , | (2.4) |
где Θ — степенях заполнения молекулами адсорбата однородной поверхности адсорбента, к— коэффициент пропорциональности, зависящий главным образом от температуры и характера взаимодействия адсорбента с адсорбентом, Р — давление, справедливо при очень низких Θ степенях заполнения молекулами адсорбата однородной поверхности адсорбента.
Изотерма Генри представляет собой прямую линию 1 (рисунок 2.1, а). С увеличением давления Р рост адсорбированного мономолекулярного слоя замедляется. Молекула адсорбата испытывает трудности в закреплении на еще не занятом пространстве поверхности адсорбента.

Рисунок 2.1 — Зависимость изменения количества адсорбированного вещества от давления (а) и температуры (б) (пояснения в тексте)
Изотерма приобретает выпуклый характер 2, а значение в стремится к единице (см. рисунок 2.1, а). Выпуклые изотермы описываются уравнением Ленгмюра
| , | (2.5) |
где а – адсорбционный коэффициент, аналогичный по физическому смыслу константе к в уравнении (2.5).
Следует отметить, что уравнение Ленгмюра справедливо только для мономолекулярной адсорбции на однородной поверхности, возможностью притяжения молекул адсорбата между собой и их подвижностью вдоль поверхности адсорбента пренебрегают. При дальнейшем увеличении давления адсорбата происходит заполнение второго, третьего и других слоев. Процесс переходит в полимолекулярную адгезию.
Поверхность твёрдых адсорбентов в основном неоднородна. Одни участки благоприятны для адсорбции, другие – наоборот. С ростом давления адсорбата полимолекулярная адсорбция происходит одновременно по всей поверхности с различной степенью интенсивности.
Процесс адсорбции почти всегда сопровождается выделением теплоты, которое называют теплотой адсорбции. Прочность адсорбционного слоя пропорциональна теплоте адсорбции. При переходе к полимолекулярной адсорбции теплота адсорбции приближается к теплоте конденсации адсорбата.
Температурные условия оказывают большое влияние на протекание процесса физической адсорбции. Высокая подвижность молекул на поверхности при повышении температуры приводит к десорбции образующегося слоя. Дальнейшее повышение температуры может переводить физическую адсорбцию в химическую – хемосорбцию, имеющую более прочные связи.
На рисунке 2.1, б приведена качественная зависимость адсорбции газовой среды от температуры при постоянном давлении. При низких температурах изобара 1 описывает физическую адсорбцию. При достижении определенной температуры возможен процесс перехода физической адсорбции к хемосорбции. Происходит рост адсорбируемого вещества (кривая 2). При заполнении всей поверхности адсорбатом снова начинает снижаться количество адсорбированного вещества (кривая 3). Адсорбция в области 1 обратима, а в области 2 необратима. В случае охлаждения системы процесс переходит из области 3 в область 4.
Слабые междуатомные связи на поверхности при физической адсорбции, по-видимому, в малой степени способны уравновесить некомпенсированные связи поверхностных атомов. Соответственно этому не следует ожидать значительного снижения уровня свободной поверхностной энергии. При подготовке поверхности изделий для нанесения покрытий следует учитывать слабые связи физически адсорбированных веществ (твердых, жидких и газообразных).
Химическая адсорбция.Хемосорбция представляет собой процесс поглощения поверхностью жидкого или твердого тела веществ из окружающей среды, сопровождающийся образованием химических соединений. При хемосорбции выделяется значительное количество теплоты. Обычно теплоты хемосорбции лежат в пределах 80–125 кДж/моль. Взаимодействие кислорода с металлами (окисление) даёт значительно более высокие значения теплоты, достигающие 400 кДж/моль.
Подобно химическим реакциям хемосорбция требует для своего протекания значительной энергии активации. Следовательно, при увеличении температуры процесс хемосорбции ускоряется. Происходит так называемая активируемая адсорбция. Хемосорбция относится к избирательным процессам и зависит от химического сродства абсорбента и адсорбата, которое наряду с температурой определяет скорость протекания реакции. Например, при взаимодействии газов с чистыми металлами или металлоподобными поверхностями наблюдается исключительно быстрая хемосорбция, что связано со слабой насыщенностью связями поверхностных атомов. Хемосорбция протекает при минимальных значениях энергии активации. Хемосорбция на твёрдых поверхностях зависит от кристаллографической ориентации зёрен, наличия различных дефектов и др. Хемосорбция начинается на наиболее активных участках поверхности. Принято считать, что хемосорбция происходит до тех пор, пока вся поверхность не покроется мономолекулярным слоем адсорбата. По сравнению с физической адсорбцией хемосорбция чувствительна к давлению окружающей среды.
Наличие на поверхности хемосорбированных пленок в значительной мере уравновешивает некомпенсированные оборванные связи поверхностных атомов. Поверхностная энергия при этом достигает минимальных значений, что следует учитывать при подготовке поверхностей для нанесения покрытий. Для удаления хемосорбированных поверхностных соединений (загрязнений) требуются значительные энергетические воздействия.
Дата добавления: 2017-12-05; просмотров: 805;
ПОСМОТРЕТЬ ЕЩЕ:
Адсорбция в химии
Введение
Адсорбцией называют процесс поглощения вещества из смеси газов, паров или растворов поверхностью или объемом пор твердого тела — адсорбента.
Явление адсорбции известно очень давно. Такие природные материалы, как песок и почва, использовали для очистки воды еще на заре человеческого общества. В конце XVIII века К. Шееле и одновременно Фонтана обнаружили способность свежепрокаленного древесного угля поглощать различные газы в объемах, в несколько раз превышающих его собственный объем. Вскоре выяснилось, что величина поглощенного объема зависит от типа угля и природы газа. Т.Е. Ловиц в 1785 году открыл явление адсорбции углем в жидкой среде, подробно исследовал его и предложил использовать уголь для очистки фармацевтических препаратов, спирта, вина, органических соединений. Ловиц показал, что древесный уголь способен быстро очищать испорченную воду и делать ее пригодной для питья. И сейчас основным действующим началом фильтров для воды служат углеродные материалы, конечно более современные, чем природные угли. Адсорбция отравляющих веществ из воздуха была использована Н.Д. Зелинским при создании противогаза во время первой мировой войны.
Адсорбция газов на твердых поверхностях используется в некоторых отраслях пищевой промышленности, а именно масложировой (например, в производстве маргарина) и в бродильной (например, в производстве дрожжей) для очистки технологических газовых потоков с целью предотвращения выбросов вредных веществ в атмосферу. Поглощение паров воды происходит на пористых веществах, которые выполняют роль твердого адсорбента. Подобные процессы наблюдаются в отношении сахара, соли и сухарей.
Адсорбция, ее виды
Адсорбционный способ регулирования газового состава хранилищ скоропортящихся продуктов позволяет в несколько раз сократить потери и увеличить сроки хранения. Адсорбция различных пищевых кислот, лимонной в частности, снижает по сравнению с водой поверхностное натяжение большинства прохладительных напитков. Адсорбция веществ на поверхности раздела жидкость — газ способствует устойчивости пен. Подобный процесс имеет место в бродильной промышленности при производстве дрожжей и некоторых других полупродуктов. Усиление смачивания водой различных поверхностей широко используется в промышленности в качестве сопутствующего процесса при мойке оборудования, подготовке сырья, обработке полуфабрикатов и т.д. Адсорбция на границе твердое тело — жидкость широко применяется при очистке жидкостей (например, диффузионного сока при производстве сахара, растительных масел и соков) от примесей.
Развитие теории адсорбционных сил еще не достигло такой стадии, когда по известным физико-химическим свойствам газа и твердого тела можно было бы рассчитать изотерму адсорбции, не проводя экспериментальных исследований. Поэтому попыткам описать экспериментальные изотермы с помощью различных теоретических уравнений, которым соответствуют определенные модели адсорбции, посвящено огромное количество работ. Если теоретическое уравнение изотермы адсорбции хорошо воспроизводит экспериментальные данные, то можно рассчитать неизвестные величины адсорбции при разных условиях (р и Т ) и определить различные геометрические параметры твердых тел. Рассмотрим лишь немногие, наиболее распространенные теоретические уравнения изотерм адсорбции.
Делись добром 😉
содержание .. 10 11 12 13 14 15 16 17 18 19 20 ..
АДСОРБЦИЯ В ПИЩЕВЫХ ПРОИЗВОДСТВАХ
Процесс поглощения одного или нескольких компонентов из смеси газов, паров или жидких растворов поверхностью твердого вещества — адсорбента называется адсорбцией. Процесс адсорбции подобно процессу абсорбции избирателен, т. е. из смеси поглощаются только определенные компоненты. Как и при абсорбции поглощенное вещество может быть выделено из адсорбента, например, при нагревании. Этот процесс регенерации — обновления абсорбента называется десорбцией.
Процессы абсорбции и адсорбции внешне похожи. Разница между ними заключается в том, что в одном случае вещество поглощается всем объемом жидкости, а в другом — только поверхностью твердого поглотителя — адсорбента.
В пищевой промышленности адсорбция применяется при очистке водно-спиртовых смесей в ликеро-водочном производстве, при очистке и стабилизации вин, соков и других напитков. В свеклосахарном производстве адсорбцией обеспечивается основная очистка диффузионного сока в процессе его сатурации, а также обесцвечивание сахарных сиропов перед кристаллизацией.
Равновесие при адсорбции
Количество вещества, поглощенного адсорбентом, зависит от концентрации поглощаемого вещества в парогазовой смеси или растворе, а также от температуры, при которой осуществляется процесс. Условия равновесия для адсорбции
Линии равновесия, соответствующие уравнениям (7.75) и (7.76), получили название изотерм сорбции. Изотермы сорбции (рис. 26) строят по опытным данным. Характер кривой изотермы сорбции зависит от многих факторов, в том числе от удельной поверхности адсорбента, объема пор, структуры и распределения пор, свойств поглощаемого вещества и, конечно, от температуры.
Движущая сила процесса адсорбции определяется как разность между рабочей и равновесной концентрациями поглощаемого вещества в парогазовой или жидкой фазах.
Рабочая линия для непрерывных процессов адсорбции соответствует уравнению (7.6).
В процессе адсорбции происходит выделение теплоты, что ведет к повышению температуры в системе и снижению активности адсорбента. Поэтому для поддержания скорости процесса в промышленных адсорберах предусматривают охлаждение адсорбента.
Адсорбенты
Количество поглощаемого вещества зависит от площади поверхности поглотителя. Поэтому адсорбенты обладают чрезвычайно развитой поверхностью, что достигается за счет образования большого количества пор в твердом теле.
Активированный уголь. Это самый распространенный адсорбент. Его получают сухой перегонкой дерева с последующей активацией — прокаливанием при температуре около 900 °С. Суммарная поверхность 1 г активированного угля 600… 1700 м2. Активированный уголь получают также из костей животных и других углеродсодержащих материалов. Размеры кусков активированного угля в зависимости от марки лежат в пределах от 1 до 5 мм. Активированный уголь лучше поглощает пары органических веществ, чем пары воды. Недостатками активированных углей являются их небольшая механическая прочность и горючесть.
Силикагели. Этот адсорбент получают обезвоживанием геля кремниевой кислоты, обрабатывая силикат натрия (жидкое стекло) минеральными кислотами или кислыми растворами их солей. Размер гранул силикагеля лежит в пределах от 0,2 до 7 мм.
Физическая и химическая адсорбция
Суммарная поверхность 1 г силикагеля 400…770 м2. Силикагели эффективно поглощают пары органических веществ, а также влагу из воздуха и газов. Поэтому гранулы силикагеля иногда используют при упаковке на хранение приборов и материалов, боящихся влаги. В отличие от активированного угля силикагель негорюч и обладает большой механической прочностью.
Цеолиты. Это пористые водные алюмосиликаты катионов элементов первой и второй групп Периодической системы Д. И. Менделеева. Встречаются в природе и добываются карьерным способом. В промышленности чаще применяют синтетические цеолиты, обладающие весьма однородной структурой, с размерами пор, которые можно сравнить с размерами крупных молекул. Поэтому цеолиты обладают свойствами микрофильтра-ционных мембран.
Цеолиты отличаются высокой поглотительной способностью по отношению к воде и поэтому используются для глубокой осушки газов и воздуха с незначительным содержанием влаги. Гранулы промышленных цеолитов обычно имеют размеры от 2 до 5 мм.
Иониты. Это природные и искусственные адсорбенты, действие которых основано на химическом взаимодействии с очищаемыми растворами. Процессы с применением ионитов следует отнести к хемосорбции — адсорбции, сопровождаемой химическими реакциями. Иониты, содержащие кислые активные группы и обменивающиеся с раствором электролита подвижными анионами, называются анионитами. Иониты, содержащие основные активные группы и обменивающиеся подвижными катионами, называются катионитами. Существует группа аморфных ионитов, способных к анионному и катионному обменам одновременно. Наибольшее распространение в промышленности получили ионообменные смолы. Так, в сахарорафинадном производстве с помощью ионообменных смол осуществляют обесцвечивание сиропов. Смолы применяют также в некоторых случаях при обработке воды. Последние успехи в области синтеза ионитов позволяют надеяться на их успешное использование в нетрадиционных технологиях, например в производстве спирта-ректификата из спирта-сырца.
В качестве естественных адсорбентов в пищевой промышленности, например для осветления вин, используют мелкодисперсные глины: бентонит, диатомит, каолин. С этой же целью применяют рыбий клей (желатин) и другие вещества.
Расчет адсорберов
Порядок расчета адсорберов аналогичен порядку расчета абсорберов. И только фиксированная поверхность массообмена, которую несложно определить, позволяет воспользоваться неко-торыми кинетическими уравнениями и более точно рассчитать требуемые размеры аппарата, не прибегая к определению числа ступеней изменения концентрации.
Материальный баланс. Уравнение материального баланса процесса адсорбции соответствует уравнению (7.3):
Кинетика процесса адсорбции. Процесс поглощения вещества при адсорбции в общем случае описывается критериальным уравнением для систем с твердой фазой:
Количество теплоты, выделяемое при адсорбции. Удельную теплоту адсорбции г (Дж/моль) обычно определяют опытным путем и для разных веществ приводят в справочниках. При отсутствии опытных данных можно воспользоваться следующим уравнением:
содержание .. 10 11 12 13 14 15 16 17 18 19 20 ..
Физическая и химическая адсорбция
Адсорбция – поглощение веществ из растворов или газов поверхностным слоем твёрдого тела или жидкости. Движущей силой процесса является наличие на поверхности некомпенсированных сил межатомного взаимодействия, за счёт чего и притягиваются молекулы адсорбированного вещества – адсорбата. Происходит не только снижение поверхностной энергии, но и образование на поверхности различной по составу пленки.
Термодинамическое состояние атомно-чистой поверхности способствует активному протеканию процесса адсорбции. Известно, что на чистой металлической поверхности содержится около 105 адсорбционных позиций, приходящихся на 1 см2.
Различают физическую и химическую адсорбцию веществ на поверхности. Возможны и промежуточные виды взаимодействий на границе раздела фаз.
Физическая адсорбция.Адсорбированный слой связан с поверхностью слабыми межатомными связями, например силами Ван-дер-Ваальса. Теплота физической адсорбции, как правило, невелика и редко превосходит несколько десятков кДж/моль (примерно 40 кДж/моль).
Процесс физической адсорбции обратим, относится к неактивируемым, протекает очень быстро, как только молекулы адсорбата окажутся на поверхности твёрдого или жидкого тела. Наиболее часто физическую адсорбцию связывают с взаимодействием поверхности с газовой фазой. Количество адсорбированного газа снижается при уменьшении давления и возрастании температуры.
Простейшие уравнения мономолекулярной адсорбции предложены Генри и Ленгмюром. Уравнение Генри (так называемая изотерма Генри)
| , | (2.4) |
где Θ — степенях заполнения молекулами адсорбата однородной поверхности адсорбента, к— коэффициент пропорциональности, зависящий главным образом от температуры и характера взаимодействия адсорбента с адсорбентом, Р — давление, справедливо при очень низких Θ степенях заполнения молекулами адсорбата однородной поверхности адсорбента.
Изотерма Генри представляет собой прямую линию 1 (рисунок 2.1, а). С увеличением давления Р рост адсорбированного мономолекулярного слоя замедляется. Молекула адсорбата испытывает трудности в закреплении на еще не занятом пространстве поверхности адсорбента.

Рисунок 2.1 — Зависимость изменения количества адсорбированного вещества от давления (а) и температуры (б) (пояснения в тексте)
Изотерма приобретает выпуклый характер 2, а значение в стремится к единице (см. рисунок 2.1, а). Выпуклые изотермы описываются уравнением Ленгмюра
| , | (2.5) |
где а – адсорбционный коэффициент, аналогичный по физическому смыслу константе к в уравнении (2.5).
Следует отметить, что уравнение Ленгмюра справедливо только для мономолекулярной адсорбции на однородной поверхности, возможностью притяжения молекул адсорбата между собой и их подвижностью вдоль поверхности адсорбента пренебрегают. При дальнейшем увеличении давления адсорбата происходит заполнение второго, третьего и других слоев. Процесс переходит в полимолекулярную адгезию.
Поверхность твёрдых адсорбентов в основном неоднородна. Одни участки благоприятны для адсорбции, другие – наоборот. С ростом давления адсорбата полимолекулярная адсорбция происходит одновременно по всей поверхности с различной степенью интенсивности.
Процесс адсорбции почти всегда сопровождается выделением теплоты, которое называют теплотой адсорбции.
Прочность адсорбционного слоя пропорциональна теплоте адсорбции. При переходе к полимолекулярной адсорбции теплота адсорбции приближается к теплоте конденсации адсорбата.
Температурные условия оказывают большое влияние на протекание процесса физической адсорбции. Высокая подвижность молекул на поверхности при повышении температуры приводит к десорбции образующегося слоя. Дальнейшее повышение температуры может переводить физическую адсорбцию в химическую – хемосорбцию, имеющую более прочные связи.
На рисунке 2.1, б приведена качественная зависимость адсорбции газовой среды от температуры при постоянном давлении. При низких температурах изобара 1 описывает физическую адсорбцию. При достижении определенной температуры возможен процесс перехода физической адсорбции к хемосорбции. Происходит рост адсорбируемого вещества (кривая 2). При заполнении всей поверхности адсорбатом снова начинает снижаться количество адсорбированного вещества (кривая 3). Адсорбция в области 1 обратима, а в области 2 необратима. В случае охлаждения системы процесс переходит из области 3 в область 4.
Слабые междуатомные связи на поверхности при физической адсорбции, по-видимому, в малой степени способны уравновесить некомпенсированные связи поверхностных атомов. Соответственно этому не следует ожидать значительного снижения уровня свободной поверхностной энергии. При подготовке поверхности изделий для нанесения покрытий следует учитывать слабые связи физически адсорбированных веществ (твердых, жидких и газообразных).
Химическая адсорбция.Хемосорбция представляет собой процесс поглощения поверхностью жидкого или твердого тела веществ из окружающей среды, сопровождающийся образованием химических соединений. При хемосорбции выделяется значительное количество теплоты. Обычно теплоты хемосорбции лежат в пределах 80–125 кДж/моль.
Физическая и химическая адсорбция
Взаимодействие кислорода с металлами (окисление) даёт значительно более высокие значения теплоты, достигающие 400 кДж/моль.
Подобно химическим реакциям хемосорбция требует для своего протекания значительной энергии активации. Следовательно, при увеличении температуры процесс хемосорбции ускоряется. Происходит так называемая активируемая адсорбция. Хемосорбция относится к избирательным процессам и зависит от химического сродства абсорбента и адсорбата, которое наряду с температурой определяет скорость протекания реакции. Например, при взаимодействии газов с чистыми металлами или металлоподобными поверхностями наблюдается исключительно быстрая хемосорбция, что связано со слабой насыщенностью связями поверхностных атомов. Хемосорбция протекает при минимальных значениях энергии активации. Хемосорбция на твёрдых поверхностях зависит от кристаллографической ориентации зёрен, наличия различных дефектов и др. Хемосорбция начинается на наиболее активных участках поверхности. Принято считать, что хемосорбция происходит до тех пор, пока вся поверхность не покроется мономолекулярным слоем адсорбата. По сравнению с физической адсорбцией хемосорбция чувствительна к давлению окружающей среды.
Наличие на поверхности хемосорбированных пленок в значительной мере уравновешивает некомпенсированные оборванные связи поверхностных атомов. Поверхностная энергия при этом достигает минимальных значений, что следует учитывать при подготовке поверхностей для нанесения покрытий. Для удаления хемосорбированных поверхностных соединений (загрязнений) требуются значительные энергетические воздействия.
Дата добавления: 2017-12-05; просмотров: 804;
ПОСМОТРЕТЬ ЕЩЕ:
ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ АДСОРБЕНТОВ
Любые препараты необходимо принимать по рекомендации врача и следуя инструкции! Основным противопоказанием к приему адсорбентов для кишечника является их индивидуальная непереносимость. Препараты активированного угля не рекомендуется использовать при желудочном кровотечении, язвенных поражениях ЖКТ и др.; препараты лигнина – при нарушении углеводного обмена, анацидном гастрите, склонности к запорам. Необходимо учитывать, что при приеме адсорбирующих средств внутрь может уменьшаться эффективность других лекарственных средств, принимаемых с ними одновременно. Поэтому важно делать интервал между приемом адсорбентов и других препаратов.
Сорбционная очистка
НЕОСМЕКТИН® – АДСОРБЕНТ НОВОГО ПОКОЛЕНИЯ
Современный препарат Неосмектин® способствует устранению диареи различного происхождения, метеоризма, изжоги, вздутия и тяжести в животе. Неосмектин® действует в двух направлениях.
СПОСОБСТВУЕТ УСТРАНЕНИЮ ФАКТОРОВ, ПРОВОЦИРУЮЩИХ РАССТРОЙСТВА ПИЩЕВАРЕНИЯ
Патогенная микрофлора, кишечные газы, токсины иногда являются причиной расстройства пищеварения. Неосмектин® адсорбирует их, способствуя их выведению из организма. Таким образом, препарат способствует устранению не симптомов, а самих факторов, которые могут провоцировать проблемы с пищеварением.
защищает слизистую желудочно-кишечного тракта
Неосмектин® стабилизирует слизистый барьер желудочно-кишечного тракта, создавая на его поверхности защитную пленку, которая предохраняет слизистую от повреждения болезнетворными микроорганизмами и дает ей возможность быстрее восстановиться.

magictemple.ru
Движущая сила процесса абсорбции – Справочник химика 21
Для осуществления процесса абсорбции необходимо, чтобы парциальное давление извлекаемого компонента в газовой фазе Рг было больше, чем в абсорбенте р. Разность этих давлений Ар = Рг — Рж определяет движущую силу процесса абсорбции. При ДР > О происходит процесс абсорбции, при ДР процесс десорбции. Процесс абсорбции (десорбции) прекращается, когда система достигает состояния равновесия, т. е. Рг Рг = Рж- [c.295]Движущая сила процесса абсорбции на верху абсорбера [c.175]
Движущая сила процесса абсорбции в низу абсорбера [c.175]
Абсорбция (десорбция) — диффузионный процесс, в котором участвуют две фазы газовая и жидкая. Движущей силой процесса абсорбции (десорбции) является разность парциальных давлений поглощаемого компонента в газовой и жидкой фазах, который стремится перейти в ту фазу, где его концентрация меньше, чем это требуется по условию равновесия. [c.193]
Поскольку парциальное давление компонента пропорционально его концентрации, то движущая сила процесса абсорбции или десорбции может быть выражена также через разность концентраций компонента в газовой Ду = у — Ур или жидкой фазе Ах = Хр — х. [c.193]
Единица измерения величины К зависит от единиц измерения составляющих, входящих в уравнение (VI. 1). Так, например, если измерять массу поглощенного компонента в кг/ч, поверхность контакта фаз в м , а движущую силу процесса абсорбции в МПа, то из уравнения (VI. 1) получим единицу измерения К в кг/(м – МПа ч). [c.193]
Ар — движущая сила процесса абсорбции. [c.171]
Движущая сила процесса абсорбции внизу абсорбера [c.352]Выбираем коэффициент массопередачи К. Поскольку в литературе отсутствуют формулы для расчета К при абсорбции Nh4 рассолами, коэффициент массопередачи можно найти из основного уравнения массопередачи подстановкой данных, характеризующих работу станции абсорбции содового завода. Ориентировочно значение К составит l,0-i-l,7 кг/(м -ч-мм рт. ст.). Принимаем = 1,4 кг/(м2-ч-мм рт. ст.). Рассчитываем движущую силу процесса абсорбции. Определяем объем подаваемого газа на 1 т соды. [c.358]
В. Регулирование температуры процесса как средство повышения движущей силы применяется главным образом в сорбционных и десорбционных процессах. Движущая сила процессов абсорбции, адсорбции, конденсации выражается как ЛС=С—С. Понижая температуру жидкой фазы, уменьшают парциальное давление паров газового (парового) компонента над ней, т. е. С, и соответственно увеличивают движущую силу ЛС и общую скорость процесса и. Снижение температуры в проточных аппаратах чаще всего достигается подачей жидкости, предварительно охлажденной в холодильниках. Применяют также холодильные элементы (трубы, змеевики), помещенные непосредственно в аппарате, или охлаждение стенок аппарата. Движущая сила процессов десорбции и испарения выражается как ЛС = С —С. Сдвиг равновесия и увеличение скорости этих процессов достигается повышением температуры жидкости перед подачей ее в аппарат (в теплообменниках, трубчатых печах и других типах нагревателей) или непосредственно в аппаратах горячими газами, острым или глухим паром. Одновременная регулировка температуры и давления позволяет увеличить движущую силу процесса за счет обоих составляющих. [c.68]
Движущая сила процесса абсорбции для любого значения X и выбранной величины I будет выражаться разностью ординат У— У, изображенных вертикальными отрезками, соединяющими соответствующие точки рабочей линии и линии равновесия. Для всего абсорбера можно принять среднее значение АУВеличина движущей силы будет тем больше, чем круче наклон рабочей линии и, следовательно, чем больше удельный расход абсорбента. При совпадении рабочей линии с вертикалью АУ р будет иметь максимальное значение, и, следовательно, размеры аппарата при этом минимальны [так как число единиц переноса = (АУе — АУ )/АУ р, то при постоянстве АУ значения АУб и АУ р максимальны]. Удельный расход абсорбента при этом будет бесконечно большим, поскольку Х = Х и знаменатель в уравнении (16.11) будет равен 0. [c.48]
www.chem21.info