Формула воды в химии
Химическая и структурная формула воды
Химическая формула: Н2O
Структурная формула:
Молярная масса: 18,01528 г/моль.
Альтернативные названия: оксид водорода, гидроксид водорода, гидроксильная кислота, монооксид дигидрогена, оксидан, дигидромонооксид.
В молекуле воды атом кислорода находится в состоянии sp3–гибридизации, поскольку в образовании гибридных орбиталей участвуют не только валентные электроны, но и неподеленные электронные пары. Гибридные орбитали направлены к вершинам тетраэдра:
Вследствие большой разницы электроотрицательностей кислорода и водорода связи в молекуле сильно поляризованы, и происходит смещение электрон ной плотности в сторону кислорода. Молекула воды обладает большим дипольным моментом, поскольку полярные связи расположены несимметрично.
С сильной поляризацией связи О – Н связано образование водородных связей между молекулами воды. Каждая молекула воды может образовывать до четырёх водородных связей – две из них образует атом кислорода, а еще две – атомы водорода:
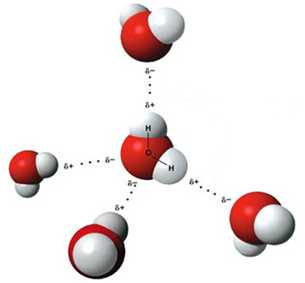
Образование водородных связей определяет более высокую температуру кипения, вязкость и поверхностное натяжение воды по сравнению с гидридами аналогов (серы селена и теллура).
Изотопные модификации воды
В зависимости от типа изотопов водорода, входящих в состав молекулы, выделяют следующие изотопные модификации воды:
| Название | Формула |
|---|---|
|
Легкая вода (основной компонент природной воды) |
H2O |
|
Тяжёлая вода (дейтериевая) |
D2O |
|
Сверхтяжёлая вода (тритиевая) |
T2O |
|
Тритий-дейтериевая вода |
TDO |
|
Тритий-протиевая вода |
THO |
|
Дейтерий-протиевая вода |
DHO |
С учетом того, что у кислорода три стабильных изотопа (16O, 17O и 18O), можно составить 18 формул молекул воды, различающихся изотопным составом. Как правило, природная вода содержит все эти разновидности молекул.
Примеры решения задач по теме «формула воды»
ru.solverbook.com
Вода
Физические и химические свойства
Физические и химические свойства воды определяются химическим, электронным и пространственным строением молекул Н
Атомы Н и О в молекуле Н20 находятся в своих устойчивых степенях окисления, соответственно +1 и -2; поэтому вода не проявляет ярко выраженных окислительных или восстановительных свойств. Обратите внимание: в гидридах металлов водород находится в степени окисления -1.
Молекула Н2O имеет угловое строение. Связи Н-O очень полярны. На атоме О существует избыточный отрицательный заряд, на атомах Н – избыточные положительные заряды. 8 целом молекула Н2O является полярной, т.е. диполем. Этим объясняется тот факт, что вода является хорошим растворителем для ионных и полярных веществ.
Наличие избыточных зарядов на атомах Н и О, а также неподеленных электронных пар у атомов О обусловливает образование между молекулами воды водородных связей, вследствие чего они объединяются в ассоциаты. Существованием этих ассоциатов объясняются аномально высокие значения т. пл. и т. кип. воды.
Наряду с образованием водородных связей, результатом взаимного влияния молекул Н2O друг на друга является их самоионизация:в одной молекуле происходит гетеролитический разрыв полярной связи О-Н, и освободившийся протон присоединяется к атому кислорода другой молекулы. Образующийся ион гидроксония Н3О+ по существу является гидратированным ионом водорода Н+ • Н2O, поэтому упрощенно уравнение самоионизации воды записывается так:
Н2O ↔ H+ + OH–
Константа диссоциации воды чрезвычайно мала:
Это свидетельствует о том, что вода очень незначительно диссоциирует на ионы, и поэтому концентрация недиссоциированных молекул Н2O практически постоянна:
В чистой воде [Н+] = [ОН–] = 10-7 моль/л. Это означает, что вода представляет собой очень слабый амфотерный электролит, не проявляющий в заметной степени ни кислотных, ни основных свойств.
HCl + Н2O – Н3O+ + Сl–
(сильный электролит)
(или без учета гидратации: HCl → Н+ + Сl–)
CH3COOH + H2O ↔ CH3COO– + H+ (слабый электролит)
(или CH3COOH ↔ CH3COO– + H+)
Согласно теории кислот и оснований Брёнстеда-Лоури, в этих процессах вода проявляет свойства основания (акцептор протонов). По той же теории в роли кислоты (донора протонов) вода выступает в реакциях, например, с аммиаком и аминами:
NH3 + H2O ↔ NH4+
+ OH–CH3NH2 + H2O ↔ CH3NH3+ + OH–
Окислительно-восстановительные реакции с участием воды
Эти реакции возможны только с сильными восстановителями, которые способны восстановить ионы водорода, входящие в состав молекул воды, до свободного водорода.
1) Взаимодействие с металлами
а) При обычных условиях Н2О взаимодействует только со щел. и щел.-зем. металлами:
2Na + 2Н+2О = 2NaOH + H02↑
Ca + 2Н+2О = Ca(OH)2 + H02↑
б) При высокой температуре Н2О вступает в реакции и с некоторыми другими металлами, например:
Mg + 2Н+2О = Mg(OH)2 + H02↑
3Fe + 4Н+2О = Fe2O4 + 4H02↑
в) Al и Zn вытесняют Н2 из воды в присутствии щелочей:
2Al + 6Н+2О + 2NaOH = 2Na[Al(OH)4] + 3H02↑
2) Взаимодействие с неметаллами, имеющими низкую ЭО (реакции происходят в жестких условиях)
C + Н+2О = CO + H02↑ («водяной газ»)
2P + 6Н+2О = 2HPO3 + 5H02↑
В присутствии щелочей кремний вытесняет водород из воды:
Si + Н+2О + 2NaOH = Na2SiO3 + 2H02↑
3) Взаимодействие с гидридами металлов
NaH + Н+2 O = NaOH + H02↑
CaH2 + 2Н+2О = Ca(OH)2 + 2H02↑
4) Взаимодействие с угарным газом и метаном
CO + Н+2O = CO2 + H02
2CH4 + O2 + 2Н+2 O = 2CO 2 + 6H02
Реакции используются в промышленности для получения водорода.
ти реакции возможны только с очень сильными окислителями, которые способны окислить кислород СО С. О. -2, входящий в состав воды, до свободного кислорода O2 или до пероксид-анионов [O2]2-. В исключительном случае (в реакции с F2) образуется кислород со c o. +2.
1) Взаимодействие с фтором
2F2 + 2Н2O-2 = O02 + 4HF
или:
2F2 + Н2O-2 = O+2F2 + 2HF
2) Взаимодействие с атомарным кислородом
Н2O-2 + O• = Н2O–2
3) Взаимодействие с хлором
При высокой Т происходит обратимая реакция
2Cl2 + 2Н2O-2 = O02 + 4HCl
Под действием электрического тока или высокой температуры может происходить разложение воды на водород и кислород:
2Н+2O-2 = 2H02↑ + O02↑
Термическое разложение – процесс обратимый; степень термического разложения воды невелика.
I. Гидратация ионов. Ионы, образующиеся при диссоциации электролитов в водных растворах, присоединяют определенное число молекул воды и существуют в виде гидратированных ионов. Некоторые ионы образуют столь прочные связи с молекулами воды, что их гидраты могут существовать не только в растворе, но и в твердом состоянии. Этим объясняется образование кристаллогидратов типа CuSO4 • 5H2O, FeSO4• 7Н2O и др., а также аквакомплексов: [Cr(H2O)6]CI3, [Pt(H2O)4]Br4 и др.
I. Гидролиз солей
Обратимый гидролиз:
а) по катиону соли
Fe3+ + Н2O = FeOH2+
+ Н+; (кислая среда. рНб) по аниону соли
СО32- + Н2O = НСО3– + ОН–; (щелочная среда. рН > 7)
в) по катиону и по аниону соли
NH4+ + СН3СОО– + Н2O = NH4OH + СН3СООН (среда, близкая к нейтральной)
Необратимый гидролиз:
Al2S3 + 6Н2O = 2Аl(ОН)3↓ + 3H2S↑
II. Гидролиз карбидов металлов
Al4C3 + 12Н2O = 4Аl(ОН)3↓ + 3CH4↑ нетан
СаС2 + 2Н2O = Са(ОН)2 + С2Н2↑ ацетилен
III. Гидролиз силицидов, нитридов, фосфидов
Mg2Si + 4Н2O = 2Mg(OH)2↓ + SiH4↑ силан
Ca3N2 + 6Н2O = ЗСа(ОН)2 + 2NH3↑ аммиак
Cu3P2 + 6Н2O = ЗСu(ОН)2 + 2РН3↑ фосфин
IV. Гидролиз галогенов
Cl2 + Н2O = HCl + HClO
Вr2 + Н2O = НВr + НВrО
V. Гидролиз органических соединений
Классы органических веществ | Продукты гидролиза (органические) |
Галогеналканы (алкилгалогениды) | Спирты |
Арилгалогениды | Фенолы |
Дигалогеналканы | Альдегиды или кетоны |
Алкоголяты металлов | Спирты |
Галогенангидриды карбоновых кислот | Карбоновые кислоты |
Ангидриды карбоновых кислот | Карбоновые кислоты |
Сложные зфиры карбоновых кислот | Карбоновые кислоты и спирты |
Жиры | Глицерин и высшие карбоновые кислоты |
Ди- и полисахариды | Моносахариды |
Пептиды и белки | α-Аминокислоты |
Нуклеиновые кислоты | Азотсодержащие гетероциклы, пентозы (рибоза или дезоксирибоза) |
examchemistry.com
Формула Воды структурная химическая
Структурная формула
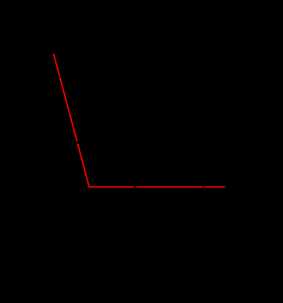 |
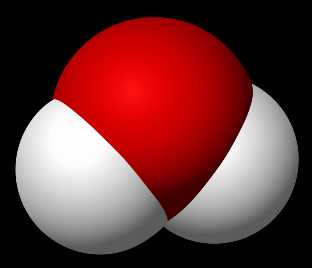 |
Истинная, эмпирическая, или брутто-формула: H2O
Химический состав Воды
| Символ | Элемент | Атомный вес | Число атомов | Процент массы |
|---|---|---|---|---|
| H | Водород | 1,008 | 2 | 11,2% |
| O | Кислород | 15,999 | 1 | 88,8% |
Молекулярная масса: 18,015
Вода́ (оксид водорода) — бинарное неорганическое соединение с химической формулой H2O. Молекула воды состоит из двух атомов водорода и одного — кислорода, которые соединены между собой ковалентной связью. При нормальных условиях представляет собой прозрачную жидкость, не имеет цвета (в малом объёме), запаха и вкуса. В твёрдом состоянии называется льдом (кристаллы льда могут образовывать снег или иней), а в газообразном — водяным паром. Вода также может существовать в виде жидких кристаллов (на гидрофильных поверхностях). Составляет приблизительно около 0,05 % массы Земли.
Является хорошим сильнополярным растворителем. В природных условиях всегда содержит растворённые вещества (соли, газы).
Вода при нормальных условиях находится в жидком состоянии, тогда как аналогичные водородные соединения других элементов являются газами (H2S, CH4, HF). Атомы водорода присоединены к атому кислорода, образуя угол 104,45° (104°27′). Из-за большой разности электроотрицательностей атомов водорода и кислорода электронные облака сильно смещены в сторону кислорода. По этой причине молекула воды обладает большим дипольным моментом (p = 1,84 Д, уступает только синильной кислоте). Каждая молекула воды образует до четырёх водородных связей — две из них образует атом кислорода и две — атомы водорода. Количество водородных связей и их разветвлённая структура определяют высокую температуру кипения воды и её удельную теплоту парообразования. Если бы не было водородных связей, вода, на основании места кислорода в таблице Менделеева и температур кипения гидридов аналогичных кислороду элементов (серы, селена, теллура), кипела бы при −80 °С, а замерзала при −100 °С.
При переходе в твёрдое состояние молекулы воды упорядочиваются, при этом объёмы пустот между молекулами увеличиваются, и общая плотность воды падает, что и объясняет меньшую плотность (больший объём) воды в фазе льда. При испарении, напротив, все водородные связи рвутся. Разрыв связей требует много энергии, отчего у воды самая большая удельная теплоёмкость среди прочих жидкостей и твёрдых веществ. Для того чтобы нагреть один литр воды на один градус, требуется затратить 4,1868 кДж энергии. Благодаря этому свойству вода нередко используется как теплоноситель. Помимо большой удельной теплоёмкости, вода также имеет большие значения удельной теплоты плавления (333,55 кДж/кг при 0 °C) и парообразования (2250 кДж/кг).
formula-info.ru
Формула – вода – Большая Энциклопедия Нефти и Газа, статья, страница 1
Формула – вода
Cтраница 1
Формула воды Н2О ( читается: аш два о) показывает, что молекула воды состоит из 2 атомов водорода и 1 атома кислорода и весит поэтому 18 условных единиц. [2]
Формула воды М20 означает, что в состав молекулы воды входят два атома водорода и один атом кислорода. [3]
Формула воды – Н20 – была предложена в 1805 г. А. В связи с тем, что водород имеет 3 изотопа, а кислород 5 – может существовать 36 видов изотопной воды. Так как в молекуле воды имеется асси-метричное распределение электронных зарядов, она является диполем с высоким дипольным моментом, равным 1 87 дебая. Благодаря этому свойству она является универсальным растворителем. [4]
Формулу воды для удобства записываем так: НОН. [5]
Знакомая всем формула воды – Н20 – стала известна только в 1805 г. благодаря открытию А. И до 30 – х годов нашего столетия такое представление прочно утвердилось в химии и физике. Осборном было обнаружено химическое соединение, характеризовавшееся той же формулой, что и вода, но имевшее больший на 2 единицы молекулярный вес. [6]
Коэффициент перед формулой воды находят методом подбора, подсчитав число атомов водорода в правой и левой частях. [7]
Коэффициент перед формулой воды находим методом подбора. [8]
Но коэффициент перед формулой воды относится не только к кислороду, но и к водороду. Значит, теперь в левой части выражения два атома водорода, а в правой – четыре. [9]
Но коэффициент перед формулой воды относится не только к кислороду, но и к водороду. Значит, теперь в левой части выражения два атома водорода, а в правой – четыре. [10]
Выявление коэффициента перед формулой воды в правой части уравнения производится сопоставлением чисел атомов водорода и кислорода в левой и правой частях схемы. [11]
Чтобы уравнять число атомов водорода и кислорода, поставим перед формулой воды двойку. [12]
Формула III содержит группу О – Н, как это имеет место в формуле воды ( Н – О – Н), тогда как формула IV в этом отношении на формулу воды не похожа. [13]
Формула III содержит группу О – Н, как это имеет место в формуле воды ( Н – О – Н), тогда как формула IV в этом отношении на формулу воды не похожа. [14]
Еще в 1846 г. Лоран заметил, что формулы спирта и эфира можно вывести из формулы воды [ 130, стр. [15]
Страницы: 1 2 3
www.ngpedia.ru
ВОДА, h3O – это… Что такое ВОДА, h3O?
h3O: Просто добавь воды — h3O: Just Add Water … Википедия
Вода — ВОДА, h3O, жидкость без запаха, вкуса и цвета; плотность 1,000 г/см3 (3,98°C), tпл 0°C, tкип 100°C; при замерзании образует лед. Одно из наиболее распространенных соединений в природе (количество воды на поверхности Земли 1,39´1018 т, в атмосфере … Иллюстрированный энциклопедический словарь
вода — вода, h3O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плотность 1000 г/см3 (3,98ºC), tпл 0ºС, tкип 100ºC. Самое распространённое вещество … Сельское хозяйство. Большой энциклопедический словарь
h3O: Просто добавь воды. Список серий телесериала — Содержание 1 Эпизоды 2 Обзор сезонов 3 Список серий 3.1 … Википедия
Вода — хим. соединение водорода и кислорода. Весовой состав ее: 11,19% Н и 88,81% О. Молекулярная масса 18,0153. В молекуле В. имеется 10 электронов (5 пар): одна пара внутренних электронов расположена вблизи ядра кислорода, две пары внешних электронов… … Геологическая энциклопедия
ВОДА — вода, окись водорода, h3O, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Молекулярная масса 18,0160, t замерзания 0°C (при 1 ат), t кипения 100ºC (при 1 ат), плотность при… … Ветеринарный энциклопедический словарь
вода (вещество) — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN water (substance) Common liquid (h3O) which forms rain, rivers, the sea, etc., and which makes up a large part of the bodies of organisms. (Source: PHC)… … Справочник технического переводчика
вода адсорбційна — вода адсорбционная adsorbtion water Adsorptionswasser молекули h3O, які притягаються мінералами під впливом поверхневої енергії … Гірничий енциклопедичний словник
ВОДА — h3O, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая). Простейшее устойчивое соединение водорода с кислородом (11,19% Н и 88,81% О по массе). Плота. 1000 г/см3 (3,98 °С), tпл 0 °С, tкип 100 °С. Самое распространённое в во в природе … Сельско-хозяйственный энциклопедический словарь
Вода — окись водорода, h30, простейшее устойчивое в обычных условиях химическое соединение водорода с кислородом (11,19% водорода и 88,81% кислорода по массе), молекулярная масса 18,0160; бесцветная жидкость без запаха и вкуса (в толстых слоях… … Большая советская энциклопедия
dic.academic.ru
ТАЙНА ДВУХ ОКЕАНОВ или ФОРМУЛА ВОДЫ: hajoh
По материалам книги Позднякова Э.А. http://predmet.ru/zagadki-nauki.pdf
ПОДСКАЗКИ ПРИРОДЫ
О чем хотят нам сказать эти растительные узоры? И эта геометрия?

Какова же химическая формула воды, если не h3O?
Лавуазье установил, что воздух состоит из смеси двух газов: азота и кислорода.
Источником кислорода и азота в огромном воздушном океане не могут быть растения и бактерии, но может быть только такой же огромный водный океан и состоять он должен из тех же компонентов, т.е. из кислорода и азота. С кислородом проблем нет, а вот с азотом… Водород в воде есть, а азот?
Но азот – это Ch3. В итоге:
ФОРМУЛА ВОДЫ: Ch3O
Формула Ch3O устраняет аномалии воды:
– МОЛЕКУЛЯРНЫЙ ВЕС, рассчитанный по формуле Ch3O (12+2+16=30), приходит в соответствие с молекулярным весом, установленным опытным путем;
– ТЕМПЕРАТУРА кипения воды (+100 град. по Цельсию при норм. атмосферном давлении), исходя из формулы Ch3O, близка температурам кипения органических веществ, наиболее близких по своему химическому составу:
– муравьиная кислота (СН2O2) +100,8;
– уксусная кислота (С2Н4O2) +118,5;
– метиловый спирт (СНЗOН) +64,7;
– этиловый спирт (С2Н5OН) +78,3;
– азотная кислота (HNO3) +86,0;
– АКТИВНОСТЬ: быстро проникает в живые клетки, как и другие вещества, в состав которых входит углеводородная группа.
– ЭЛЕКТРОЛИЗ: то, что в процессе электролиза, помимо выделения кислорода и водорода, появляется азотная кислота у анода и аммиак у катода, объясняется наличием в формуле воды азота (органического вещества Ch3, названного азотом). Второй закон термодинамики не нарушается.
Вывод, к которому пришел Поздняков Э.А.: вода, как и азот, является веществом органическим и формула Ch3O в гораздо большей мере отвечает действительности, нежели существующая.
Из формул воды и азота следует, что:
– химический состав воды и химический состав воздуха ТОЖДЕСТВЕННЫ тот и другой состоят из углеводородной группы СН2 и кислорода, но только в разных СТРУКТУРНЫХ модификациях;
– единство жизни, единство всех трех сфер – гидросферы, атмосферы и биосферы – связываются в систему взаимозависимости явлений органического мира, опирающуюся, как на фундамент, на общее для всех трех сфер вещество – СН2.
ФОРМУЛА Ch3O ВОДЫ И ВОЗДУХА :
– находит источник кислорода и азота воздуха;
– находит источник углерода растений;
– находит недостающее первое звено в пищевой цепи;
– объясняет параллельное развитие животного и растительного мира в едином русле эволюции;
– объясняет единство жизненных процессов водных и земных животных и растений, обитающих как в воде, так и на суше;
– объясняет самозарождение жизни.
МЕХАНИЗМ ПЕРЕХОДА ВОДЫ В ДРУГОЕ ФАЗОВОЕ СОСТОЯНИЕ
Солнечная энергия преобразует воду в газообразное состояние (в воздух) путем ее испарения. Испарение – процесс эндотермический, идущий при поглощении водой энергии извне. В результате притока солнечной энергии, структура молекулы жидкой воды преобразуется в структуру молекулы воды-газа и затем – воздуха. Наоборот, отток энергии превращает структуру молекулы жидкой воды в структуру твердой воды – в лед. Таким образом, энергетические изменения в структурном состоянии одного и того же вещества – воды, дают в итоге три различные модификации одного и того же вещества СН2O – жидкость, газ (в виде пара и воздуха) и лед. При одинаковом химическом составе они имеют разные физические свойства.
Вследствие этого постоянно идущего процесса, время от времени происходит то, что можно назвать перенасыщенностью атмосферы. При определенных условиях среды избытки испаряющейся воды конденсируют и возвращаются на землю в виде осадков. Этот процесс носит уже экзотермический характер (с отдачей тепла): конденсируясь, воздух (или пар) высвобождает полученную им ранее энергию и одновременно благодаря этому преобразуется в иное агрегатное состояние, то есть в воду или в лед (снег).
КРУГОВОРОТ ВОДЫ В ПРИРОДЕ
Солнце нагревает воду, вода испаряется, превращаясь в газ-воздух, и заполняет им пространство атмосферы до тех пределов, которые определяются силой земного притяжения, а также силой сцепления молекул воздуха, все более растягивающегося вверх, подобно пружине, по мере ослабления земного притяжения. В результате, создается насыщенная газом-воздухом среда. Избыточное количество испарившейся воды, конденсируется вновь в воду и виде дождя или снега возвращается на землю.
ВОДА – ЭТО ЖИЗНЬ (не метафора)
Всемирный океан, включающий все водные резервуары и источники на земле есть та единственная кладовая, которая постоянно снабжает атмосферу в неизменном отношении и объеме двумя ее составными частями – азотом (или что то же самое – углеводородной группой СН2) и кислородом. Водный океан, таким образом, дает жизнь океану воздушному. Вода есть единственный источник существования атмосферы и его необходимое условие. Именно этим важнейшим обстоятельством определяется постоянство состава атмосферы в любой точке земного шара, независимо от климатических условий, времени года, богатства или бедности растительного мира и прочих эмпирических причин.
Но тот же океан питает и третью рассматриваемую сферу – биосферу. Только благодаря тому обстоятельству, что вода является веществом органическим, что она есть источник атмосферы, возможна жизнь на Земле вообще, возможно существование органического мира.
Жизнь не может зависеть от случайных и непостоянных величин и обстоятельств. В ее основе должны лежать устойчивые и неизменные элементы и условия. На Земле таким элементом является вода, дающая воздух, представляющая ту субстанцию, без которой немыслима жизнь, которая создает, творит жизнь, создает и творит ее не только как среда, но и как вещество, из которого строятся в конечном счете все элементы живого организма, начиная от простейшей клетки и кончая высокоорганизованными существами.
Но коли это так, то тем самым окончательно решается вопрос об углеродном питании растений. Углерод поступает в растения в виде уже готового органического соединения, каковым является вода. При участии различных минеральных солей она синтезируется в корневой системе растений в сложные органические соединения и затем вместе с пасокой поступает во все их части. То же относится и к азоту (или группе СН2), имеющей также своим главным источником воду.
В науке существует так называемый принцип простоты. Теория или гипотеза, при всех прочих равных условиях, считается тем достовернее, чем меньшее количество независимых допущений она использует для объяснения одного и того же круга явлений по сравнению с другими теориями. Если применить этот принцип к предлагаемой гипотезе, то она вполне ему соответствует, ибо прибегает только к одному независимому постулату – химическому составу воды, который связывает все рассматриваемые элементы в единую органическую систему, из которого выводится все остальное. При существующих же ныне взглядах, каждый элемент системы, напротив, требует отдельного и особого объяснения его существования и функционирования вне органической связи с другими. (Поздняков Э.А.)
http://hajoh.livejournal.com/890.html – аномалии воды
http://hajoh.livejournal.com/1723.html – азот не простое вещество
http://hajoh.livejournal.com/1195.html – фотосинтез?
http://hajoh.livejournal.com/2983.html – (гидро, атмо и био) сферы
http://hajoh.livejournal.com/4226.html – воздух и вакуум
http://hajoh.livejournal.com/25140.html – самозарождение
http://hajoh.livejournal.com/27139.html – электролиз воды (часть1)
http://hajoh.livejournal.com/27487.html – электролиз воды (часть 2)
hajoh.livejournal.com
Формула воды – Справочник химика 21
Графическую формулу воды можно записать в следующих видах [c.89]Химические формулы, указывающие истинное число атомов в молекуле, называют молекулярными формулами. Если химическая формула указывает только относительное соотношение атомов в молекуле, то ее называют эмпирической или простейшей. Она отображает вид атомов, входящих в состав молекулы, и числовые соотношения между ними, например СН. При написании формул часто указывают последовательность взаимного расположения атомов в молекуле. Такие формулы называют графическими. Например, формулы. воды, пероксида водорода, метана и т. д. можно изображать так [c.11]
Графическую формулу воды можно представить, например, таким образом Н—О—Н. [c.381]
На рис. 1 изображены формулы воды (модели молекулы). Расположите формулы (модели) в порядке повышения их информативной емкости. [c.20]
Второй вариант структурной формулы воды учитывает тот факт, что молекула воды не линейна две связи Н—О образуют угол 105° друг с другом. [c.21]
Формула воды в электронном виде с указанием места локализации зарядов в молекуле. [c.54]
Написать структурную формулу воды и объяснить, почему молекула воды обладает дипольным моментом. [c.163]
Из формулы воды видно, что [c.97]
Получается, что /=2=01 2. Однако неизвестны реакции, в которых х>2 и у>2. Следовательно, х=у=2, и формула воды запишется так НаО. Прямое доказательство числа атомов в молекуле можно получить из данных по теплоемкости газов (гл. 2). [c.13]
Цифры, написанные ниже строки, указывают в каком соотношении связаны атомы различных элементов в данном соединении. Например, в химической формуле воды, Н2О, цифра 2 показывает, что в этой молекуле имеются два атома водорода. Заметим, что, хотя в молекуле воды присутствует один атом кислорода, цифра 1 не пишется. [c.42]
Учитывая, что для водорода известны изотопы Н(О) и Н(Т), а для кислорода О, Ю и выписать все возможные формулы воды (18 формул). Указать среди них самую легкую и самую тяжелую воду, подсчитать их молекулярные веса. [c.30]
Формулу воды для удобства записываем так НОН. [c.118]
При составлении уравнений реакций пользуйтесь следующими правилами следует уравнять числа атомов, определяющих название иона (хром, цинк, бор, фосфор и т.д.), в правой части уравнения написать формулу воды, подсчитать число атомов кислорода в обеих частях уравнения и, если слева имеется избыток атомов кислорода, перед знаком равенства прибавить ионы водорода, а если недостаток — прибавить гидроксид-ионы и уравнять числа атомов кислорода и водорода по обе стороны знака равенства. Какие уравнения не составляются при помощи этого алгоритма [c.225]
Подбираем коэффициент перед формулой воды [c.95]
Рассчитываем количество вещества атомного кислорода П1(0), который соединится с водородом, образуя воду, и количество вещества атомного кислорода Пг(0), который соединится с углеродом при образовании СОг- Из формулы воды следует [c.194]
Сильные акцепторные свойства ионов Н+ приводят к тому, что в водных растворах протоны в свободном состоянии практически не существуют. Поэтому в уравнении диссоциации кислоты записывают формулу воды, которая присоединяет ионы Н+, например НС1 + Н20 = Нз0++ l- [c.155]
Истинная структурная формула воды следующая li M. 5, гл. Ш) [c.381]
В большинстве неорганических соединений сущест вует ионная (или условно принимаемая за ионную) связь между элементами, основанная на притяжении разноименных электрических зарядов. Одноименно заряженные элементарные ионы не могут быть связаны между собой. Все валентности должны быть полностью взаимо насы-ш,еиы. Каждая единица валентной связи обозначается черточкой между символами связанных между собой ионов. Структурные формулы являются в некоторых отношениях условными и, как правило, не отражают реальной геометрии молекул. Например, структурная формула воды обычно пин1ется Н —О—Н, но современная наука нашла угол между направлениями валентных связей между ионами кислорода и водорода (ок. 105 ), обусловленный полярностью молекул воды. Поэтому графическое начертание структурных формул может быть различным, но должно удовлетворять требованиям симметрии и удобства, а также основному требованию—чередованию положительных и отрицательных Зарядов. Приводим примеры составления структурных формул окислов, оснований, кислот и солей. [c.41]
В последнюю очередь подставляем коэффициент перед формулой воды [c.92]
На основании формулы воды записываем [c.262]
Расчеты по химическим формулам. Формула химического вещества показывает его стехиометрический состав. Например, формула воды НаО показывает, что 1 моль этого вещества образован из 2. моль атомного водорода и 1 моль атомного кислорода, или и(Н) 2 п (Н,0) 1 п (Н,0) 1 п(0) 1 й(Н) 2 п(0) I [c.9]
Теперь остается только записать, сколько атомов каждого вида в молекуле данного соединения, и получится его формула. Например, молекула воды содержит два атома водорода (Н) и один атом кислорода (О). Поэтому формулу воды можно написать так Н2О1. Обычно, когда в молекуле есть только один атом того или иного вида, цифру 1 не пишут. Поэтому формулу воды записывают так Н2 О. Заметьте, что цифры пишут маленькие и ставят их немного ниже строки. Такие цифры называются индексами. [c.14]
Выявление коэффициента перед формулой поды в правой части уравнения производится солоставлеикем чисел атомов водорода и кислорода в левой и правой частях схемы. Очевидно, что перед формулой воды требуется поставить коэф(1лн1иент 6. В окончательном виде получим следующее уравиение [c.59]
Подставляем полученные коэффициенты в схему реакции зс + 4HNOз —> ЗС02 + N0 + НгО Подбираем коэффициент перед формулой воды [c.88]
www.chem21.info

