Известкование воды
Известкование реализуется при обработке исходной воды в осветлителях суспезией гашеной извести Са(ОН)2, называемой известковым молоком. Основное назначение известкования – снижение щелочности обрабатываемой воды; при этом происходит частичное снижение общей жесткости обрабатываемой воды, солесодержания, кремнийсодержания, концентрации соединений железа и одновременно из воды удаляются ГДП.
Сущность процесса
известкования состоит в том, что при
вводе извести достигается повышение рН обрабатываемой воды до значения 9,5 –
10,3, при котором бикарбонаты 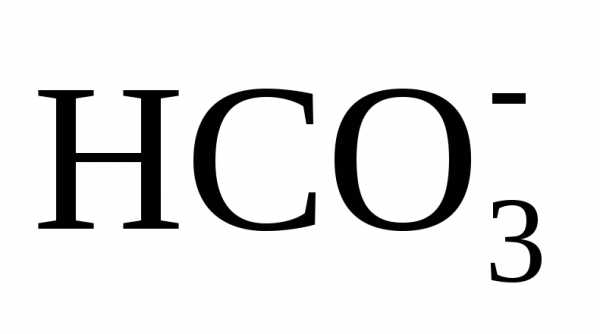 и равновесная углекислота СО2 переходят в карбонат-ионы
.
С учетом присутствия в обрабатываемой
воде ионов кальция и образовавшихся
карбонат-ионов произведение их
концентраций становится больше
произведения растворимости СаСО
и равновесная углекислота СО2 переходят в карбонат-ионы
.
С учетом присутствия в обрабатываемой
воде ионов кальция и образовавшихся
карбонат-ионов произведение их
концентраций становится больше
произведения растворимости СаСО
В упрощенном виде при известкования протекают следующие реакции:
1) при вводе извести происходит её диссоциация, приводящая к повышению рН
(1)
2) в воде появляются ионы ОН–, которые связывают свободную углекислоту переводя ее в карбонат-ионы
(2)
3) происходит диссоциация гидрокарбонатных ионов (бикарбонатов) с переводом их в карбонаты
(3)
причем по реакции
(3) из одного одновалентного иона 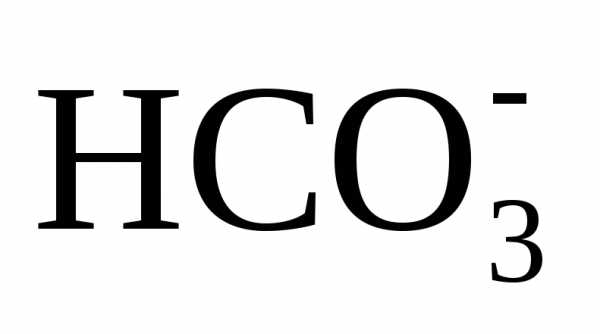 образуется один двухвалентный ион
образуется один двухвалентный ион 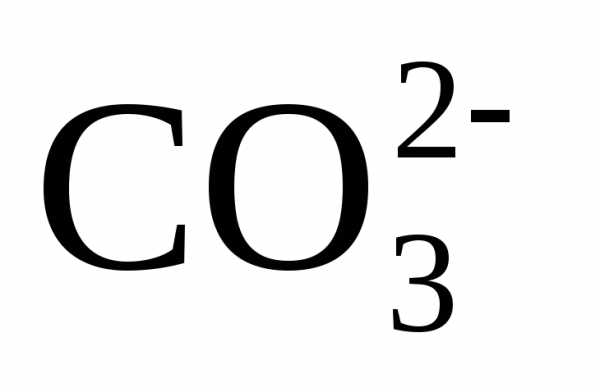
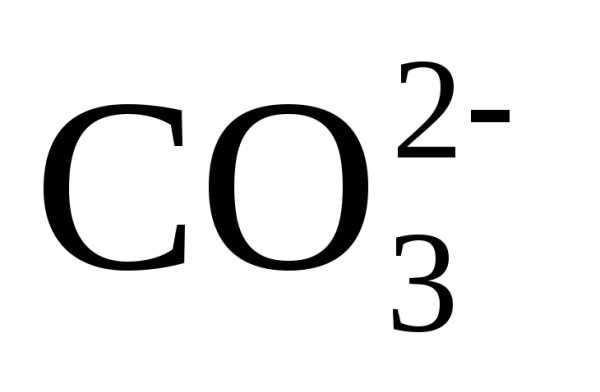 будет в два раза больше концентрации
разрушаемых ионов
будет в два раза больше концентрации
разрушаемых ионов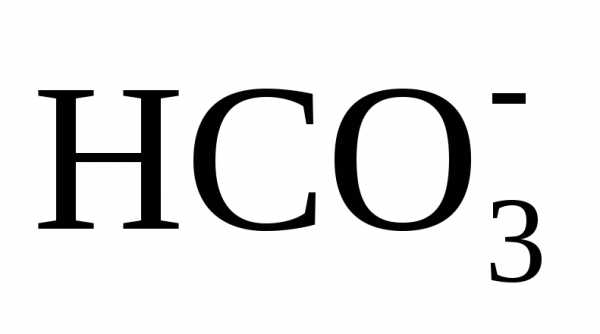 ;
;4) выделение в осадок почти нерастворимого СаСО3 происходит при достижении произведения растворимости по карбонату кальция, так как в воде есть кальций, как содержащийся в исходной воде, так и введенный с известью, и вновь образованные карбонаты
; (4)
5) при превышении
дозы извести над её количеством,
необходимым для образования карбонатов
в воде, появляется избыток ионов ОН– и может быть превышено произведение
растворимости 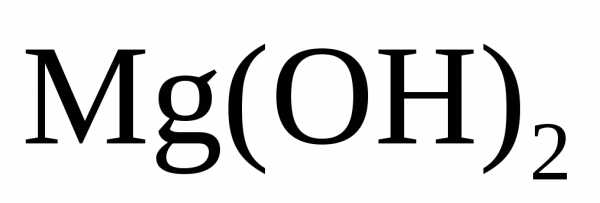
(5)
При совмещении процессов известкования и коагуляции в качестве коагулянта используют обычно сульфат двухвалентного железа в дозировке Дк. На образование гидроксида железа при известковании требуется дополнительный расход извести как источника гидроксид-ионов, что должно учитываться при расчете дозы извести:
(6)
Приведенные реакции
(1-6) позволяют определить требуемую дозу
извести в процессе известкования при
выделении, главным образом, СаСО3 (карбонатный режим с рН = 9,5), а также
увеличенную дозу извести с дополнительным
осаждением магния в виде Mg(OH)2 (гидратный режим с рН = 10,0 – 10,3). В
промышленных условиях вести строгий
режим дозирования извести, обеспечивающий
отсутствие гидратной щелочности,
практически невозможно. Обычно процесс
известкования проводят в гидратном
режиме с остаточной гидратной щелочностью,
равной 0,1 – 0,3 мг-экв/дм 3.
В гидратном режиме образуется шлам,
имеющий однородную творожную структуру
с крупными хорошо осаждающимися хлопьями.
В карбонатном режиме шлам имеет структуру
песка, быстро оседает, но столб жидкости
над границей раздела осветляется плохо.
К преимуществам гидратного режима
известкования относится также то, что
присутствие гидроксида магния в осадке
способствует снижению кремнийсодержания
на 25 – 30 % за счет адсорбции ионов  на свежеосажденном гидроксиде магния.
на свежеосажденном гидроксиде магния.
При определении дозы извести надо иметь в виду, что кроме теоретически необходимого количества ионов ОН– по реакциям (2), (3), (5) для смещения обратимых реакций в нужном направлении приходится вводить избыток извести в пределах 0,1 – 0,2 мг-экв/дм3, что определяет наличие в известкованной воде титруемой гидратной щелочности, повышение рН до 10,1 – 10,3 единиц и практическое отсутствие титруемой бикарбонатной щелочности.
При расчете дозы
извести необходимо учитывать ионный
состав обрабатываемой воды. Для
практического использования расчетная
доза извести Ди,
мг-экв/дм3,
определяется для большинства типов
вод, для которых  Жо + Дк ≥ Щисх – Щобр,
Жо + Дк ≥ Щисх – Щобр,
. (7)
Передозировка извести по отношению к доле выделенного магния Mg2+ при гидратном режиме не сопровождается снижением жесткости и щелочности, а вызывает замену некарбонатной магниевой жесткости на кальциевую по реакции
.
К моменту прохождения
всех стадий известкования остаточная
карбонатная щелочность (т.е. сумма 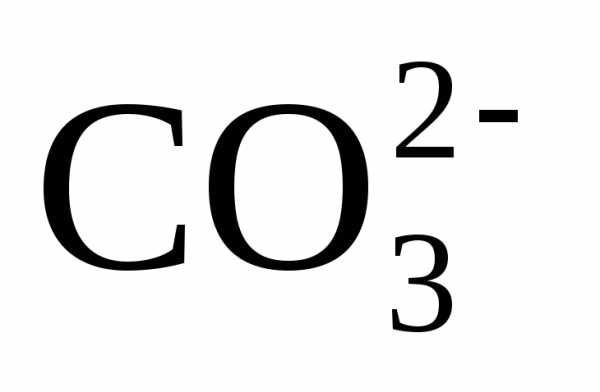
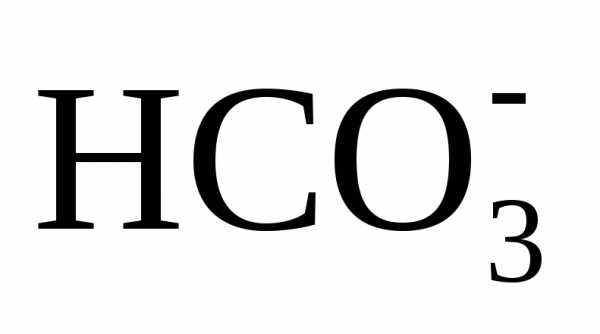 )
обычно составляет 0,5 – 0,8 мг-экв/дм3 в зависимости от кальциевой жесткости
известкованной воды.
)
обычно составляет 0,5 – 0,8 мг-экв/дм3 в зависимости от кальциевой жесткости
известкованной воды.Ухудшение реальных результатов по щелочности, концентрациям ионов Са2+ (на 0,15 – 0,3 мг-экв/дм3) и Mg2+ (на 0,1 – 0,15 мг-экв/дм3) в процессе известкования по сравнению с равновесными их значениями связывают с влиянием кинетических факторов: достаточно медленной кристаллизацией образующейся твердой фазы СаСО3 и Mg(OH)2 при приближении системы к состоянию равновесия и «тормозящей» роли органических примесей (защитных коллоидов) исходной воды, а также с выносом из осветлителя микрокристаллов твердой фазы.
Известкование и коагуляция – что это такое? Для чего нужна. Формулы реакций |
При подготовке добавочной воды для парогенераторов и тепловых сетей в качестве исходного сырья используются природные воды поверхностных водоемов. В этих водах, как правило, в значительных концентрациях присутствуют органические и минеральные примеси, находящиеся в грубодисперсном и коллоидном состояниях.
Предварительная очистка чаще всего осуществляется путем известкования с коагуляцией. При этом наряду с удалением коллоидных веществ происходит снижение содержания соединений железа и кремнекислоты, карбонатной жесткости и сухого остатка.
Для возможности эксплуатации схемы с уменьшенным количеством стоков на Минской ТЭЦ-3 на ряду с обычным известкованием с коагуляцией предусматривается и подача в осветлитель едкого натра или же его смеси с содой. При этом протекают следующие процессы:
— декарбонизация воды за счет связывания известью свободной углекислоты с образованием труднорастворимого, выпадающего в осадок, соединения карбоната кальция – CaCO3.
— снижение щелочности и, соответственно, временной жесткости воды при введении извести в большем количестве, чем это необходимо для связывания свободной углекислоты.
Ca(HCO3)2+Ca(OH)2→2CaCO3↓+2h3O
Mg(HCO3)2+2Ca(OH)2→Mg(OH)2↓+2CaCO3↓+2h3O
Как видно из приведенных уравнений из воды удаляются ионы магния и кальция, введенные с известью, а также эквивалентное содержанию бикарбонат-иона количество кальция, содержащиеся в исходной воде. Образующиеся в процессе известкования воды карбонат кальция (CaCO3) и гидроксид магния Mg(OH)2 выпадают в виде осадка(шлама).
При введении щелочи происходит необходимое для обессоливания снижение постоянной жесткости и дополнительное снижение временной за счет протекания реакции:
CaSO4+2NaOH→Ca(OH)2+Na2SO4
CaCl2+2NaOH→Ca(OH)2+2NaCl
MgSO4+2NaOH→Mg(OH)2↓+Na2SO4
MgCl2+2NaOH→Mg(OH)2↓+2NaCl
CaCO3+2NaOH→Ca(OH)2+Na2CO3
В свою очередь образующийся карбонат натрия вступает в реакцию с солями жесткости.
CaSO4+Na2CO3→CaCO3↓+Na2SO4
CaCl2+ Na2CO3→CaCO3↓+2NaCl
MgSO4+ Na2CO3→MgCO3+Na2SO4
MgCl2+ Na2CO3→MgCO3+2NaCl
Карбонат магния вступает в реакцию с гидроокисью кальция
Ca(OH)2+ MgCO3→ CaCO3↓+ Mg(OH)2↓
При использовании вместо NaOH кальцинированной соды необходимо увеличить дозировку извести для перевода магния в осадок; в случае же использования щелочи или смеси щелочи с содой дополнительная известь не требуется.

Введение в обрабатываемую воду коагулянта-раствора железного купороса приводит к взаимодействию его с известью с последующим его гидролизом, с окислением, растворенным в воде кислородом и образованием гидроокиси железа Fe(OH)3.
Реакции могут быть выражены следующими уравнениями:
FeSO4 = Fe2++SO42-
Fe2++2OH- = Fe(OH)2
4Fe(OH)2+O2+2h3O→4Fe(OH)3↓
Суммарно:
4FeSO4+8OH+2h3O+O2→4Fe(OH)3↓+4SO4
или в молекулярной форме
4FeSO4+4Ca(OH)2+2h3O+O2→4Fe(OH)3↓+4CaSO4.
Процесс образования идет при pH 10,0÷10,3.
Гидроокись железа образует положительно заряженную коллоидную систему, а коллоидные примеси исходной воды — отрицательно заряженную. Благодаря электростатическому взаимодействию разноименно заряженных частиц происходит процесс коагуляции — слипания коллоидных частиц и образования грубодисперсных хлопьев. Образовавшиеся хлопья механически захватывают взвесь из воды и мелкие частицы осадка, образовавшегося при известковании воды. Таким образом, в воде снижается содержание коллоидных веществ, в том числе кремнекислоты и органических веществ.
Совместное известкование и коагуляция обеспечивает наилучший эффект протекания обоих процессов, т.к. Ca(OH)2 является поставщиком гидроксил-ионов при гидролизе FeSO4. В свою очередь, при удалении коллоидных веществ в процессе коагуляции создаются благоприятные условия для роста кристаллов CaCO3.
belenergetics.ru
ОСНОВНЫЕ СХЕМЫ ОБРАБОТКИ ВОДЫ Коагуляция — известкование — осветление
Ремонт паровых котлов
Для обработки природных вод применяется схема: коагуляция — известкование с последующей фильтрацией на осветлительных (механических) фильтрах. Коагуляция и известкование исходной воды проводятся в специальных аппаратах-осветлителях.
Исходная вода, предварительно подогретая до температуры 40 °С, поступает в воздухоотделитель осветлителя, где освобождается от пузырьков воздуха, затем в
131
Нижнюю часть осветлителя, куда подается раствор коагулянта и извести. Вода и реагенты перемешиваются благодаря вращательному движению, создаваемому соплами.
При известковании и коагуляции в качестве коагулянта применяется сернокислое закисное железо (рН воды 4—10), при одной коагуляции можно применять сернокислый алюминий (рН воды 6,5—7,5). В результате обработки воды растворами коагулянта и извести образуется осадок в виде шлама, который поступает в шламоуплотнитель, где уплотняется и выводится из него через трубопроводы непрерывной продувки.
Более плотный шлам скапливается в нижней части осветлителя-грязевика, откуда выводится при периодической продувке.
Осветленная вода собирается в верхней части осветлителя и отводится в баки осветленной воды.
Приготовление раствора коагулянта осуществляется по следующей схеме: склад мокрого хранения коагулянта— перекачивающие насосы — механический фильтр (для очистки раствора коагулянта от механических примесей)— расходный бак коагулянта — насосы-дозаторы.
Раствор коагулянта применяется 5—10%-ной концентрации.
Приготовление раствора извести осуществляется по схеме: гашение извести в известегасителе—перекачивающие насосы — циркуляционный смеситель — циркуляционные насосы — насосы-дозаторы. Известковое молоко для известкования применяется 3 — 5%-ной концентрации. Коагуляция применяется для снижения окисляемости, содержания взвешенных веществ, соединений железа и может выполняться периодически (весной, осенью). Известкование снижает щелочность (карбонатная жесткость), солесодержание, содержание свободной углекислоты и частично содержание железа. Известкование воды является одним из способов умягчения воды методом осаждения.
Вода из осветлителя поступает на механические фильтры для удаления взвешенных веществ. При нормальной работе осветлителя концентрация взвешенных веществ в осветленной воде должна составлять 10— 12 мг/кг, после механических фильтров — не более 5 мг/кг. Вода поступает в фильтр через верхнее распределительное устройство. В качестве фильтрующего ма
териала применяется дробленый антрацит, кварцевый песок.
Эксплуатация механических фильтров состоит из фильтрации (работа фильтра), промывки (взрыхление). При фильтрации вода проходит через слой загрузки сверху вниз, при промывке — в обратном направлёнии.
Включение фильтра в работу производится открытием задвижек на входе и выходе воды. В процессе фильтрования через фильтрующий материал вода освобождается от взвешенных частиц. Продолжительность рабочего цикла фильтра будет тем длиннее, чем больше фильтр способен задержать взвешенных веществ. Во время работы ведется контроль за прозрачностью осветленной воды и перепадом давлений на входе и выходе воды из фильтра. Если фильтр начнет выдавать воду с прозрачностью ниже нормы, фильтр отключают на про – мывку. Задвижки на входе воды из фильтра закрывают и открывают на трубопроводе подачи взрыхляющей воды и на верхнем дренаже, вода поступает в фильтр снизу.
В течение 3—5 мин вода из фильтра сбрасывается, затем закрывают задвижку на трубопроводе подачи сжатого воздуха при открытой задвижке на верхнем дренаже. Взрыхление воздухом производится в течение 5—7 мин, затем задвижку на трубопроводе подачи воздуха закрывают и открывают на трубопроводе подачи взрыхляющей воды. Взрыхление водой производится насосом из бака для взрыхления.
Взрыхление продолжается до тех пор, пока из верхнего дренажа фильтра не появится прозрачная вода (15—30 мин). Затем задвижки закрывают, открывают задвижки на подаче воды в фильтр и на нижнем дренаже; отмывка производится в течение 5—10 мин до прозрачной воды, после чего фильтр готов к работе.
Котлы Е-1/9-1М, работающие на жидком топливе, оборудуются горелочными устройствами АР-90. Для защиты котла подача топлива автоматически прекращается при понижении уровня воды в котле ниже допустимого, при повышении давления пара в …
При изготовлении, монтаже и ремонте элементов котлов, пароперегревателей и экономайзеров должны применяться только стыковые соединения при сварке обечаек, труб (патрубков) и приварке выпуклых днищ, а также тавровые и угловые или …
А. Баранов
msd.com.ua
1.2 Умягчение
_________________________________________________________________
*
Действующие санитарные нормы жесткости воды (Общая жесткость не более 7мгэкв/л) были приняты несколько десятилетий назад и являются по нынешним временам и для нынешней техники слишком мягкими. Известковые отложения выводят из строя то, на чем им суждено скапливаться.
Обратный осмос.
Метод основан на прохождении воды через полупроницаемые мембраны. Одновременно с солями жёсткости удаляется и большинство других солей. Эффективность очистки может достигать 99,9%. Метод обратного осмоса нашёл наибольшее применение в бытовых системах подготовки питьевой воды. В качестве недостатка данного метода следует отметить необходимость тщательной предварительной подготовки воды, подаваемой на обратноосмотическую мембрану. Электродиализ. Удаление из воды солей под действием электрического поля. Удаление ионов растворенных веществ происходит за счёт специальных мембран. Так же как и при использовании технологии обратного осмоса, происходит удаление и других солей, помимо ионов жёсткости.
Термический способ умягчения воды.
Основан на нагреве воды, устраняет только временную (карбонатную) жёсткость. Находит применение в промышленности в частности, на ТЭЦ.
Реагентное умягчение. Метод основан на добавлении в воду соды или гашеной извести. При этом соли кальция и магния переходят в нерастворимые соединения и выпадают в осадок. Такой метод оправдан при довольно больших расходах воды, так как связан с решением ряда сложных проблем: а именно фильтрации осадка и точной дозировки добавляемых веществ.
Метод ионного обмена.
Метод основан на использовании ионообменной смолы. Такая загрузка при контакте с водой поглощает отрицательно заряженные ионы солей жёсткости (кальций и магний). Взамен, в зависимости от ионной формы, отдавая ионы натрия или водорода. Такие методы называются натрий-катионирование и Н-катионирование. В этом случае жёсткость воды снижается при однократном натрий-катионировании до 0,05-0,1мг-экв/л, при двухкратном — до 0,01мг-экв/л.
www.e-ope.ee
4.2. Осаждение методами известкования и содоизвесткования
Известкование
воды, т. е. обработка воды Са(ОН)2,
применяется для снижения щелочности
(декарбонизации) исходной воды, при этом
одновременно уменьшаются жесткость и
сухой остаток, удаляются грубодисперсные
примеси, соединения железа. В подогретую
до температуры около 30 °С обрабатываемую
воду дозируют в виде суспензии (молока)
гашеную известь Са(ОН)2.
Растворяясь, ее компоненты обогащают
воду ионами Ca2+ и одновременно ионами ОН–,
сдвигая углекислотное равновесие в
сторону образования ионов 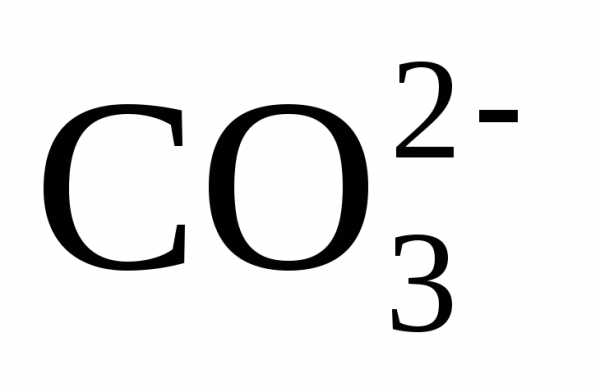 .
В результате повышения их концентрации
достигается произведение растворимости
СаСО3.
В составе этого соединения в осадок
выпадает ион Ca2+,
как содержащийся в исходной воде, так
и введенный с известью.
.
В результате повышения их концентрации
достигается произведение растворимости
СаСО3.
В составе этого соединения в осадок
выпадает ион Ca2+,
как содержащийся в исходной воде, так
и введенный с известью.
Качество известкованной воды оценивают по следующим показателям: остаточной щелочности, содержанию взвешенных веществ или прозрачности, жесткости с составляющими ее видами, сухому остатку и стабильности. Как отмечалось, значение фактической остаточной щелочности известкованной воды всегда получают значительно большим расчетного (равновесного) вследствие неполноты кристаллизации образующихся соединений. Вместе с тем в этом случае сохраняются действия теоретических предпосылок – чем больше остаточная концентрация Са2+ в известкованной воде (определяется, по существу, некарбонатной кальциевой жесткостью исходной воды), тем меньше остаточная карбонатная и общая щелочность. Исходя из опыта эксплуатации ВПУ, высказанное положение представлено следующими данными:
Остаточное содержание Са2+, ммоль/дм3 более 3 1,0–3,0 0,5–1,0
Щелочность, ммоль/дм3 0,5–0,6 0,6–0,7 0,7–0,8
Состав компонентов общей щелочности будет зависеть от избытка извести, т. е. рН известкованной воды. Виды щелочности по заданному значению рН можно оценить расчетным путем. При титровании известкованной воды кислотой со стандартными индикаторами обнаруживаются обычно только гидратная и карбонатная щелочности, что вносит определенные противоречия в понимание получаемых результатов.
Содержание взвешенных веществ в известкованной воде при налаженном режиме обработки не превышает обычно 10 мг/дм3. Предельно допустимое содержание их не должно быть более 20 мг/дм3. В эксплуатационной практике из-за трудоемкости и длительности определения концентрации взвешенных веществ используют косвенный показатель – прозрачность воды.
Малая нестабильность (менее 0,1 ммоль/дм3) – обязательное и важное требование к воде обработанной методами осаждения, так как при последующей транспортировке и обработке нестабильной воды происходит образование карбонатных отложений в трубопроводах, на зернах фильтрующей загрузки осветлительных, а иногда и ионообменных фильтров. В таких случаях необходимо использование кислотных промывок и более частая смена фильтрующих материалов.
Эффективность процесса известкования воды зависит от целого ряда факторов, к основным из которых относится правильное дозирование извести удовлетворительного качества, использование в необходимых случаях коагуляции, подогрев воды до строго заданной температуры, использование образовавшегося шлама для углубления процесса обработки, выбор оптимальных режимов движения обрабатываемой воды в осветлителях.
Характеристики эксплуатационных условий проведения процессов известкования и коагуляции, а также обычно наблюдаемые результаты представлены в табл. 4.1.
Таблица 4.1
Характеристика и результаты эксплуатационной обработки воды методами осаждения
Характеристика и результаты процесса | Известкование – коагуляция | Коагуляция в осветлителе |
Реагенты | FeSО4, CaO, ПАА | А12(SO4)3 |
Температура, °С | 30–40 | 25–30 |
Состав шлама | CaCО3+Mg(OH)2+ +Fe(OH)3+MgO·SiО2 | А1(ОН)3 |
Снижение перманганатной окисляемости, % | 40–60 | 50–75 |
Остаточная концентрация ГДП, мг/дм3 рН | менее 10 9,5–10,2 | менее 10 5,5–7,5 |
Углекислота свободная, мг/дм3 | удаляется полностью | возрастает на Дк·44 |
Ион | титрованием не обнаруживается | уменьшается на Дк |
Ион | 0,4–0,7 | – |
Ион ОН–, ммоль/дм3 | 0,05–0,3 | – |
Щелочность общая, ммоль/дм3 | 0,7–1,0 | снижается на Дк |
Жесткость некарбонатная, ммоль/дм3 | увеличивается на Дк | увеличивается на Дк |
Жесткость общая, ммоль/дм3 | Жнк + Дк + (0,8+1,2) | не изменяется |
Кремниевая кислота, мг/дм3 | снижается на 50 % | снижается на 20 – 50 % |
Сульфаты, ммоль/дм3 | увеличивается на Дк | увеличивается на Дк |
Технологический процесс известкования воды широко применяется на ТЭС для вод со щелочностью, превышающей 1,5 ммоль/дм3. Наряду с благоприятным изменением основных показателей качества обработанной воды (см. табл. 4.1), приводящим к экономии кислоты и щелочи при последующем химическом обессоливании известкованной воды, следует отметить, что при известковании примеси переходят в сбросные воды в виде твердой фазы, что упрощает их переработку при создании бессточных схем, а содержащиеся в продувочных водах щелочные компоненты – карбонат кальция и гидроксид магния – могут быть использованы для нейтрализации кислых стоков.
Процесс
содоизвесткования как метод умягчения
применим к водам практически любого
состава в отличие от известкования, при
котором жесткость воды, как указывалось
ранее, снижается лишь на значение ее
карбонатной составляющей. Для более
глубокого умягчения воды необходимо
ввести извне ионы 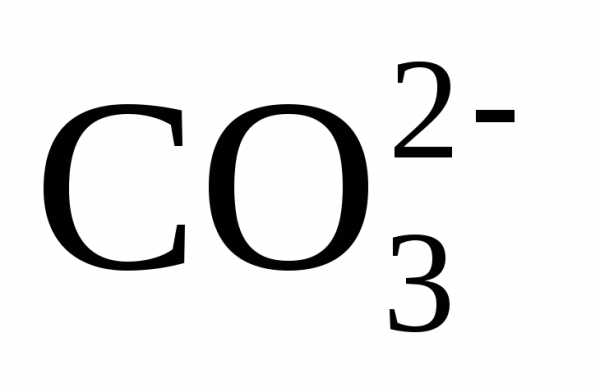 ,
а для выделенияMg(OH)2 требуется увеличить дозу извести. Это
достигается известково-содовой обработкой
воды, при которой наряду с известью
дозируют также кальцинированную соду
Nа2СО3,
которая за счет диссоциации создает в
воде избыток ионов
,
а для выделенияMg(OH)2 требуется увеличить дозу извести. Это
достигается известково-содовой обработкой
воды, при которой наряду с известью
дозируют также кальцинированную соду
Nа2СО3,
которая за счет диссоциации создает в
воде избыток ионов 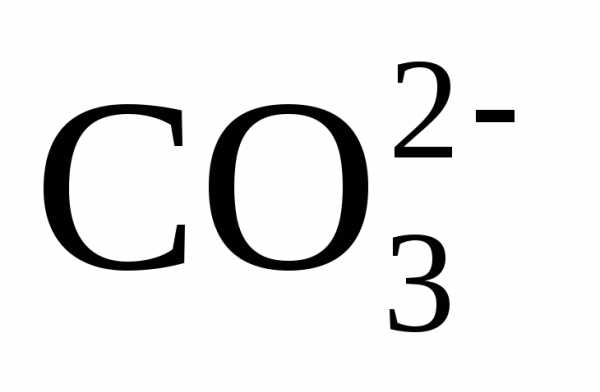 ,
способствующих переводу в твердую фазу
ионов Са2+.
Дозировку соответствующих реагентов
при содоизвестковании выбирают так:
извести – по уравнению, принимая
повышенный избыток извести в пределах 0,2–0,35 ммоль/дм3,
соды – с учётом остаточной концентрации
ионов Са2+ при известковании по формуле
,
способствующих переводу в твердую фазу
ионов Са2+.
Дозировку соответствующих реагентов
при содоизвестковании выбирают так:
извести – по уравнению, принимая
повышенный избыток извести в пределах 0,2–0,35 ммоль/дм3,
соды – с учётом остаточной концентрации
ионов Са2+ при известковании по формуле
, |
где Ис – избыток соды.
В отсутствие необходимости удаления коллоидных примесей (например, при обработке регенерационных стоков) потребная доза соды и извести не включает расход этих реагентов на химические реакции с участием коагулянта FeSО4.
Исходя из допустимой остаточной щелочности и экономических соображений избыток соды принимают до 1 ммоль/дм3 (ИИ = 0,2–0,35 ммоль/дм3), что обеспечивает снижение общей жесткости в содоизвесткованной воде до 0,3–0,4 ммоль/дм3. Такая глубина умягчения способствовала широкому применению этого метода до начала 30-х годов для получения добавочной воды для котлов электростанций, работающих на низком давлении. Позже этот метод был вытеснен катионообменной технологией умягчения воды. В настоящее время содоизвесткование нашло широкое применение в проектах ВПУ с запрещенным сбросом сточных вод для умягчения регенерационных стоков и их повторного использования.
Контрольные вопросы
1. Какие коагулянты применяются в процессах осаждения?
2. В чем сущность коагуляции?
3. Почему известкованная вода должна характеризоваться малой нестабильностью?
4. По каким параметрам должен оптимизироваться процесс известкования?
5. Каковы реальные значения остаточных концентраций примесей, удаляемых при известковании и содоизвестковании?
6. Напишите основные химические реакции процесса коагуляции.
studfiles.net
Известково-содовый метод умягчения воды — КиберПедия
Сущность известково-содового метода умягчения воды сводится к следующим основным процессам:
Ca(ОH)2 + CO2 → CaCO3↓ + H2O
Ca(ОH)2 + Ca(HCO3)2 → 2CaCO3↓ + 2H2O
Ca(ОH)2 + Mg(HCO3)2 → CaCO3↓ + MgCO3 + H2O
Ca(ОH)2 + MgCO3 → CaCO3 + Mg(OH)2↓
Na2CO3 + CaCl2 → CaCO3↓ + 2NaCl
Na2CO3 + CaSO4 → CaCO3↓ + Na2 SO4
Этим методом остаточная жесткость может быть доведена до 0,5-1,0; щелочность – до 0,8-1,2 мг-экв/л.
Дозу извести Ди при известково-содовом методе определяют по формуле:
Ди = 28([CО2] + Жк + [Mg2+] + Дк+ 0,5),
22 12 lк
где Жк – жесткость карбонатная.
Дозу соды Дс при известково-содовом методе определяют по формуле:
Дс = 53(Жнк + Дк+ 1),
lк
где Дс – доза соды в пересчете на Na2CO3, мг/л;
Жнк – жесткость некарбонатная.
При известково-содовом методе умягчения воды образующиеся CaCO3 и Mg(OH)2 могут перенасыщать растворы и долго оставаться в коллоидном состоянии. Переход в грубодисперсный шлам длителен.
Ди = ([CО2] + (Жк + Жм + Дк+ 0,5))
22 lк
При умягчении воды содово-натровым методом воду обрабатывают содой и гидроксидом натрия:
Ca(HCO3)2 + 2NaOH → CaCO3 + Na2CO3 + 2H2O
Mg(HCO3)2 + 2NaOH → Mg(OH)2↓ + Na2CO3 + CO2 + H2O
CaSO4 + Na2CO3 → CaCO3↓ + Na2SO4
При высокой концентрации гидрокарбонатов в воде и низкой некарбонатной жесткости избыток Na2CO3 может оставаться в умягченной воде. Поэтому данный метод применяется лишь с учетом соотношений между карбонатной и некарбонатной жесткостью. Если карбонатная жесткость равна некарбонатной, то соду можно не добавлять, поскольку необходимое количество ее для умягчения воды образуется в результате взаимодействия гидрокарбонатов с NaOH. Доза кальцинированной соды увеличивается по мере повышения некарбонатной жесткости воды.
Термохимический метод умягчения воды
Этим методом умягчение воды производят при температуре воды выше
100°С. Более интенсивному умягчению воды при ее подогреве способствует:
● образование тяжелых и крупных хлопьев осадка;
● быстрейшее его осаждение вследствие снижения вязкости воды при нагревании;
● сокращается также расход извести, так как CO2 удаляется при нагревании.
Термохимический метод может применяться с добавлением и без добавления коагулянта, поскольку большая плотность осадка исключает необходимость его утяжеления.
Термохимический метод применяют при использовании воды в паровых котлах.
В качестве реагентов при этом методе применяют известь и соду, реже – гидроксид натрия и соду.
Содержание в воде магния может быть снижено до 0,05-0,1 мг-экв/л.
Фосфатный метод умягчения воды самостоятельно не применяют из-за высокой стоимости реагента. Фосфаты применяют для доумягчения воды после ее обработки другими реагентами, например, известью и содой.
В качестве реагентов применяют ди- и тринатрий фосфат.
При добавлении этих реагентов к воде образуются малорастворимые фосфаты кальция и магния:
3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓ + 6Na HCO3
3Mg(HCO3)2 + 2Na3PO4 → Mg3(PO4)2 + 6NaHCO3
3CaCl2 + 2Na3PO4 → Ca3(PO4)2 + 6NaCl
3Mg SO4 + 2Na3PO4 → Mg3 (PO4)2 + 3Na2SO4
Процесс фосфатного доумягчения воды проводят обычно при температуре выше 100°С.
Остаточная жесткость при этом получается 0,04-0,05 мг-экв/л. Схема установки приведена на рисунке 18.9 (слайд 60).
Магнитная обработка воды
В последнее время в отечественной и зарубежной литературе появляются сообщения об успешном применении магнитной обработки с целью интенсификации процессов очистки воды, для борьбы с накипеобразованием и инкрустацией.
Механизм действия магнитного поля на воду окончательно не выяснен. Все существующие гипотезы Тебенихин и Гусев классифицировали в три группы:
● первая, объединяющая большинство гипотез, связывает действие магнитного поля на ионы солей. Под влиянием магнитного поля происходит поляризация и деформация ионов, сопровождающиеся уменьшением их гидратации, что повышает вероятность их сближения и образования центров кристаллизации;
● вторая предполагает действие магнитного поля на примеси воды, находящиеся в коллоидном состоянии;
● третья – возможность влияния магнитного поля на структуру воды. Это влияние вызывает изменение в агрегации воды и нарушает ориентацию ядерных атомов водорода в молекуле.
Наиболее широко магнитная обработка воды распространена в борьбе с накипеобразованием. Принцип метода заключается в том, что при пересечении водой магнитных силовых линий накипеобразователи выделяются не на поверхности нагрева, а в массе воды.
Метод эффективен для кальциево-карбонатных вод, которые составляют 80% вод всех водоемов.
cyberpedia.su
| На главную | База 1 | База 2 | База 3 |
| Поиск по реквизитамПоиск по номеру документаПоиск по названию документаПоиск по тексту документа |
| Искать все виды документовДокументы неопределённого видаISOАвиационные правилаАльбомАпелляционное определениеАТКАТК-РЭАТПЭАТРВИВМРВМУВНВНиРВНКРВНМДВНПВНПБВНТМ/МЧМ СССРВНТПВНТП/МПСВНЭВОМВПНРМВППБВРДВРДСВременное положениеВременное руководствоВременные методические рекомендацииВременные нормативыВременные рекомендацииВременные указанияВременный порядокВрТЕРВрТЕРрВрТЭСНВрТЭСНрВСНВСН АСВСН ВКВСН-АПКВСПВСТПВТУВТУ МММПВТУ НКММПВУП СНЭВУППВУТПВыпускГКИНПГКИНП (ОНТА)ГНГОСТГОСТ CEN/TRГОСТ CISPRГОСТ ENГОСТ EN ISOГОСТ EN/TSГОСТ IECГОСТ IEC/PASГОСТ IEC/TRГОСТ IEC/TSГОСТ ISOГОСТ ISO GuideГОСТ ISO/DISГОСТ ISO/HL7ГОСТ ISO/IECГОСТ ISO/IEC GuideГОСТ ISO/TRГОСТ ISO/TSГОСТ OIML RГОСТ ЕНГОСТ ИСОГОСТ ИСО/МЭКГОСТ ИСО/ТОГОСТ ИСО/ТСГОСТ МЭКГОСТ РГОСТ Р ЕНГОСТ Р ЕН ИСОГОСТ Р ИСОГОСТ Р ИСО/HL7ГОСТ Р ИСО/АСТМГОСТ Р ИСО/МЭКГОСТ Р ИСО/МЭК МФСГОСТ Р ИСО/МЭК ТОГОСТ Р ИСО/ТОГОСТ Р ИСО/ТСГОСТ Р ИСО/ТУГОСТ Р МЭКГОСТ Р МЭК/ТОГОСТ Р МЭК/ТСГОСТ ЭД1ГСНГСНрГСССДГЭСНГЭСНмГЭСНмрГЭСНмтГЭСНпГЭСНПиТЕРГЭСНПиТЕРрГЭСНрГЭСНсДИДиОРДирективное письмоДоговорДополнение к ВСНДополнение к РНиПДСЕКЕНВиРЕНВиР-ПЕНиРЕСДЗемЕТКСЖНМЗаключениеЗаконЗаконопроектЗональный типовой проектИИБТВИДИКИМИНИнструктивное письмоИнструкцияИнструкция НСАМИнформационно-методическое письмоИнформационно-технический сборникИнформационное письмоИнформацияИОТИРИСОИСО/TRИТНИТОсИТПИТСИЭСНИЭСНиЕР Республика КарелияККарта трудового процессаКарта-нарядКаталогКаталог-справочникККТКОКодексКОТКПОКСИКТКТПММ-МВИМВИМВНМВРМГСНМДМДКМДСМеждународные стандартыМетодикаМетодика НСАММетодические рекомендацииМетодические рекомендации к СПМетодические указанияМетодический документМетодическое пособиеМетодическое руководствоМИМИ БГЕИМИ УЯВИМИГКМММНМОДНМонтажные чертежиМос МУМосМРМосСанПинМППБМРМРДСМРОМРРМРТУМСанПиНМСНМСПМТМУМУ ОТ РММУКМЭКННАС ГАНБ ЖТНВННГЭАНДНДПНиТУНКНормыНормы времениНПНПБНПРМНРНРБНСПНТПНТП АПКНТП ЭППНТПДНТПСНТСНЦКРНЦСОДМОДНОЕРЖОЕРЖкрОЕРЖмОЕРЖмрОЕРЖпОЕРЖрОКОМТРМОНОНДОНКОНТПОПВОПКП АЭСОПНРМСОРДОСГиСППиНОСНОСН-АПКОСПОССПЖОССЦЖОСТОСТ 1ОСТ 2ОСТ 34ОСТ 4ОСТ 5ОСТ ВКСОСТ КЗ СНКОСТ НКЗагОСТ НКЛесОСТ НКМОСТ НКММПОСТ НКППОСТ НКПП и НКВТОСТ НКСМОСТ НКТПОСТ5ОСТНОСЭМЖОТРОТТПП ССФЖТПБПБПРВПБЭ НППБЯПВ НППВКМПВСРПГВУПереченьПиН АЭПисьмоПМГПНАЭПНД ФПНД Ф СБПНД Ф ТПНСТПОПоложениеПорядокПособиеПособие в развитие СНиППособие к ВНТППособие к ВСНПособие к МГСНПособие к МРПособие к РДПособие к РТМПособие к СНПособие к СНиППособие к СППособие к СТОПособие по применению СППостановлениеПОТ РПОЭСНрППБППБ-АСППБ-СППБВППБОППРПРПР РСКПР СМНПравилаПрактическое пособие к СППРБ АСПрейскурантПриказПротоколПСРр Калининградской областиПТБПТЭПУГПУЭПЦСНПЭУРР ГазпромР НОПРИЗР НОСТРОЙР НОСТРОЙ/НОПР РСКР СМНР-НП СРО ССКРазъяснениеРаспоряжениеРАФРБРГРДРД БГЕИРД БТРД ГМРД НИИКраностроенияРД РОСЭКРД РСКРД РТМРД СМАРД СМНРД ЭОРД-АПКРДИРДМРДМУРДПРДСРДТПРегламентРекомендацииРекомендацияРешениеРешение коллегииРКРМРМГРМДРМКРНДРНиПРПРРТОП ТЭРС ГАРСНРСТ РСФСРРСТ РСФСР ЭД1РТРТМРТПРУРуководствоРУЭСТОП ГАРЭГА РФРЭСНрСАСанитарные нормыСанитарные правилаСанПиНСборникСборник НТД к СНиПСборники ПВРСборники РСН МОСборники РСН ПНРСборники РСН ССРСборники ценСБЦПСДАСДАЭСДОССерияСЗКСНСН-РФСНиПСНиРСНККСНОРСНПСОСоглашениеСПСП АССП АЭССправочникСправочное пособие к ВСНСправочное пособие к СНиПСправочное пособие к СПСправочное пособие к ТЕРСправочное пособие к ТЕРрСРПССНССЦСТ ССФЖТСТ СЭВСТ ЦКБАСТ-НП СРОСТАСТКСТМСТНСТН ЦЭСТОСТО 030 НОСТРОЙСТО АСЧМСТО БДПСТО ВНИИСТСТО ГазпромСТО Газпром РДСТО ГГИСТО ГУ ГГИСТО ДД ХМАОСТО ДОКТОР БЕТОНСТО МАДИСТО МВИСТО МИСТО НААГСТО НАКССТО НКССТО НОПСТО НОСТРОЙСТО НОСТРОЙ/НОПСТО РЖДСТО РосГеоСТО РОСТЕХЭКСПЕРТИЗАСТО САСТО СМКСТО ФЦССТО ЦКТИСТО-ГК “Трансстрой”СТО-НСОПБСТПСТП ВНИИГСТП НИИЭССтП РМПСУПСССУРСУСНСЦНПРТВТЕТелеграммаТелетайпограммаТематическая подборкаТЕРТЕР Алтайский крайТЕР Белгородская областьТЕР Калининградской областиТЕР Карачаево-Черкесская РеспубликаТЕР Краснодарского краяТЕР Мурманская областьТЕР Новосибирской областиТЕР Орловской областиТЕР Республика ДагестанТЕР Республика КарелияТЕР Ростовской областиТЕР Самарской областиТЕР Смоленской обл.ТЕР Ямало-Ненецкий автономный округТЕР Ярославской областиТЕРмТЕРм Алтайский крайТЕРм Белгородская областьТЕРм Воронежской областиТЕРм Калининградской областиТЕРм Карачаево-Черкесская РеспубликаТЕРм Мурманская областьТЕРм Республика ДагестанТЕРм Республика КарелияТЕРм Ямало-Ненецкий автономный округТЕРмрТЕРмр Алтайский крайТЕРмр Белгородская областьТЕРмр Карачаево-Черкесская РеспубликаТЕРмр Краснодарского краяТЕРмр Республика ДагестанТЕРмр Республика КарелияТЕРмр Ямало-Ненецкий автономный округТЕРпТЕРп Алтайский крайТЕРп Белгородская областьТЕРп Калининградской областиТЕРп Карачаево-Черкесская РеспубликаТЕРп Краснодарского краяТЕРп Республика КарелияТЕРп Ямало-Ненецкий автономный округТЕРп Ярославской областиТЕРрТЕРр Алтайский крайТЕРр Белгородская областьТЕРр Калининградской областиТЕРр Карачаево-Черкесская РеспубликаТЕРр Краснодарского краяТЕРр Новосибирской областиТЕРр Омской областиТЕРр Орловской областиТЕРр Республика ДагестанТЕРр Республика КарелияТЕРр Ростовской областиТЕРр Рязанской областиТЕРр Самарской областиТЕРр Смоленской областиТЕРр Удмуртской РеспубликиТЕРр Ульяновской областиТЕРр Ямало-Ненецкий автономный округТЕРррТЕРрр Ямало-Ненецкий автономный округТЕРс Ямало-Ненецкий автономный округТЕРтр Ямало-Ненецкий автономный округТехнический каталогТехнический регламентТехнический регламент Таможенного союзаТехнический циркулярТехнологическая инструкцияТехнологическая картаТехнологические картыТехнологический регламентТИТИ РТИ РОТиповая инструкцияТиповая технологическая инструкцияТиповое положениеТиповой проектТиповые конструкцииТиповые материалы для проектированияТиповые проектные решенияТКТКБЯТМД Санкт-ПетербургТНПБТОИТОИ-РДТПТПРТРТР АВОКТР ЕАЭСТР ТСТРДТСНТСН МУТСН ПМСТСН РКТСН ЭКТСН ЭОТСНэ и ТЕРэТССЦТССЦ Алтайский крайТССЦ Белгородская областьТССЦ Воронежской областиТССЦ Карачаево-Черкесская РеспубликаТССЦ Ямало-Ненецкий автономный округТССЦпгТССЦпг Белгородская областьТСЦТСЦ Белгородская областьТСЦ Краснодарского краяТСЦ Орловской областиТСЦ Республика ДагестанТСЦ Республика КарелияТСЦ Ростовской областиТСЦ Ульяновской областиТСЦмТСЦО Ямало-Ненецкий автономный округТСЦп Калининградской областиТСЦПГ Ямало-Ненецкий автономный округТСЦэ Калининградской областиТСЭМТСЭМ Алтайский крайТСЭМ Белгородская областьТСЭМ Карачаево-Черкесская РеспубликаТСЭМ Ямало-Ненецкий автономный округТТТТКТТПТУТУ-газТУКТЭСНиЕР Воронежской областиТЭСНиЕРм Воронежской областиТЭСНиЕРрТЭСНиТЕРэУУ-СТУказУказаниеУказанияУКНУНУОУРврУРкрУРррУРСНУСНУТП БГЕИФАПФедеральный законФедеральный стандарт оценкиФЕРФЕРмФЕРмрФЕРпФЕРрФормаФорма ИГАСНФРФСНФССЦФССЦпгФСЭМФТС ЖТЦВЦенникЦИРВЦиркулярЦПИШифрЭксплуатационный циркулярЭРД |
| Показать все найденныеПоказать действующиеПоказать частично действующиеПоказать не действующиеПоказать проектыПоказать документы с неизвестным статусом |
| Упорядочить по номеру документаУпорядочить по дате введения |
files.stroyinf.ru
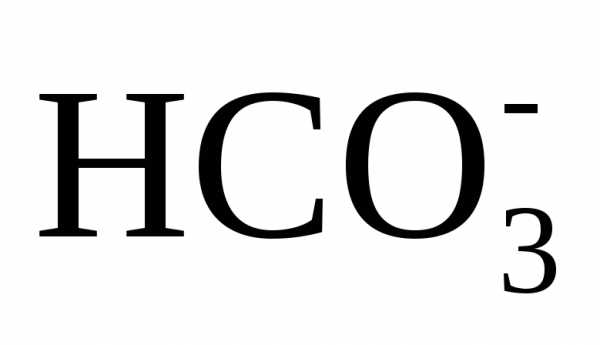 ,
ммоль/дм3
,
ммоль/дм3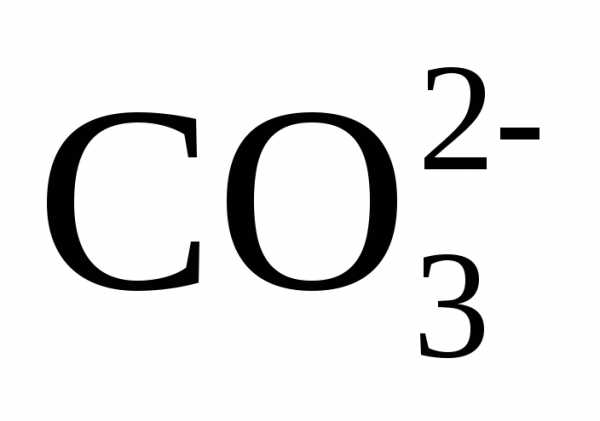 ,
ммоль/дм3
,
ммоль/дм3