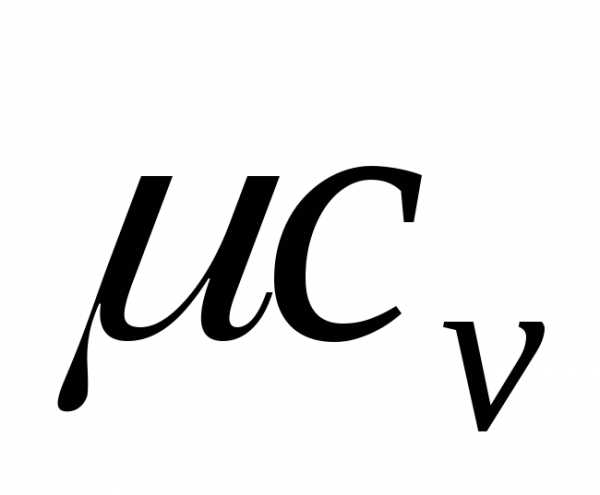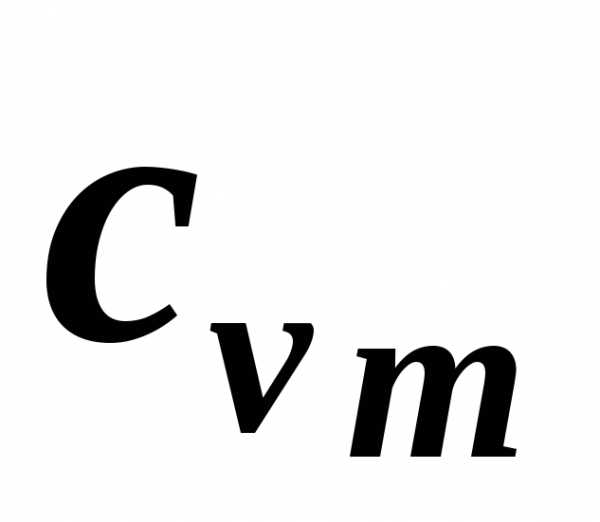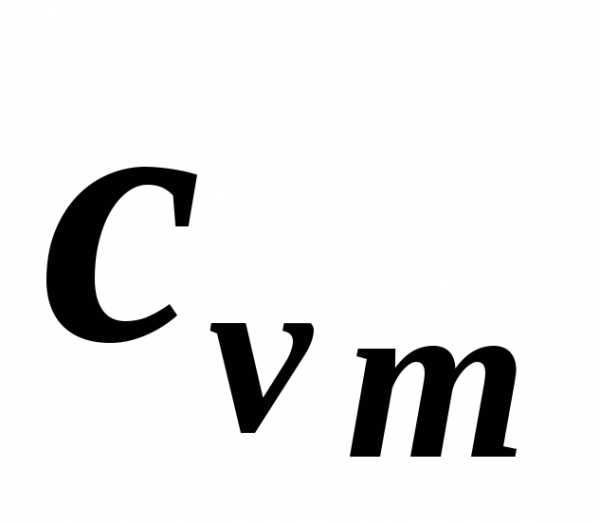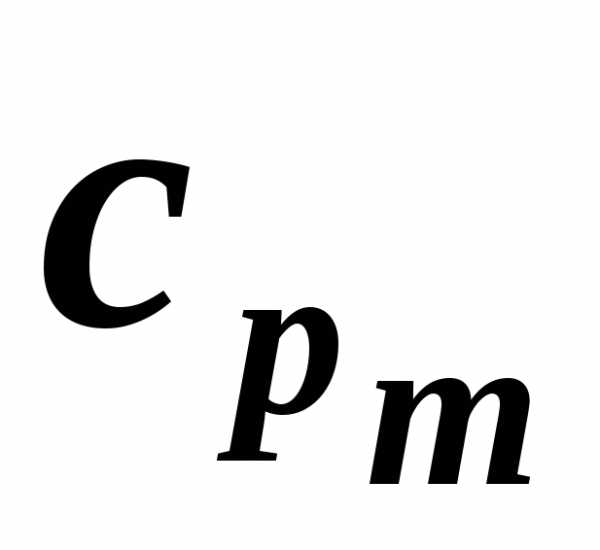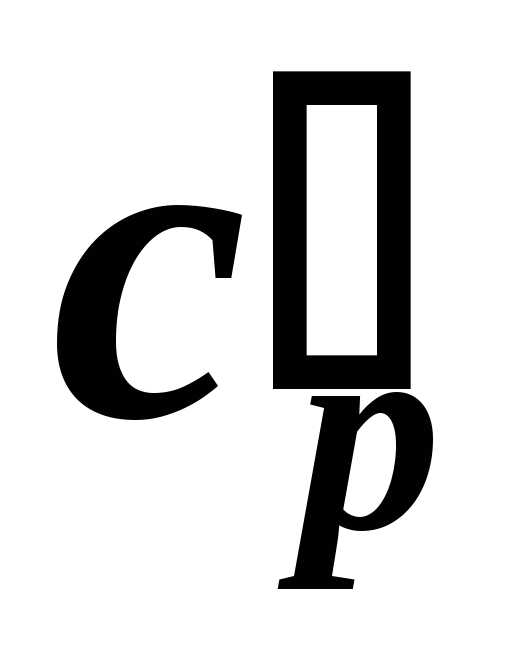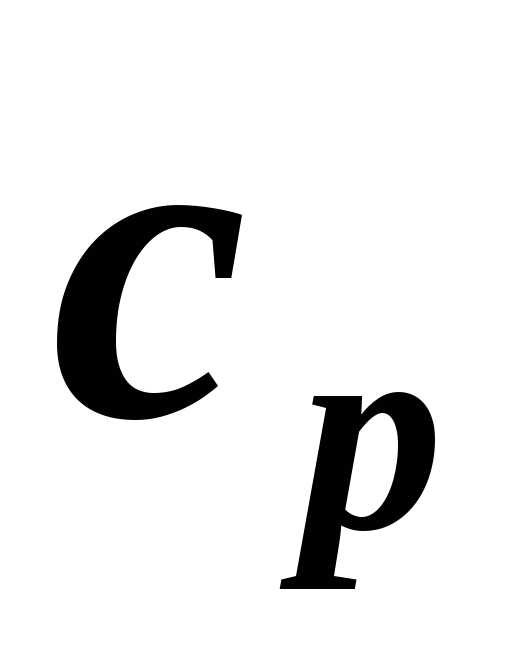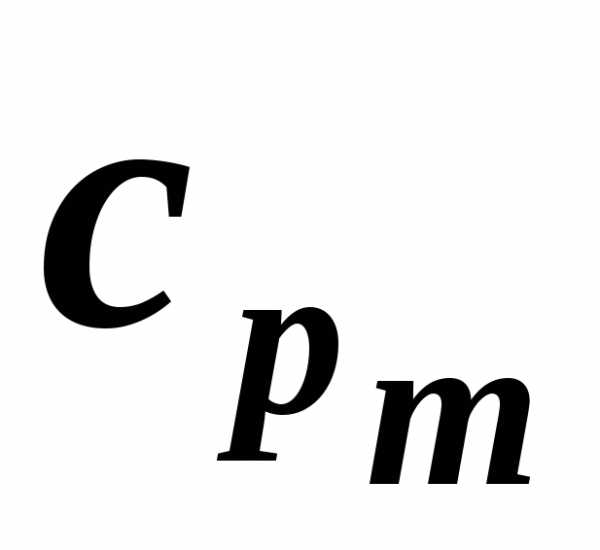| АБС пластик | 1300…2300 |
| Аглопоритобетон и бетон на топливных (котельных) шлаках | 840 |
| Алмаз | 502 |
| Аргиллит | 700…1000 |
| Асбест волокнистый | 1050 |
| Асбестоцемент | 1500 |
| Асботекстолит | 1670 |
| Асбошифер | 837 |
| Асфальт | 920…2100 |
| Асфальтобетон | 1680 |
| Аэрогель (Aspen aerogels) | 700 |
| Базальт | 850…920 |
| Барит | 461 |
| Береза | 1250 |
| Бетон | 710…1130 |
| Битумоперлит | 1130 |
| Битумы нефтяные строительные и кровельные | 1680 |
| Бумага | 1090…1500 |
| Вата минеральная | 920 |
| Вата стеклянная | 800 |
| Вата хлопчатобумажная | 1675 |
| Вата шлаковая | 750 |
| Вермикулит | 840 |
| Вермикулитобетон | 840 |
| Винипласт | 1000 |
| Войлок шерстяной | 1700 |
| Воск | 2930 |
| Газо- и пенобетон, газо- и пеносиликат, газо- и пенозолобетон | 840 |
| Гетинакс | 1400 |
| Гипс формованный сухой | 1050 |
| Гипсокартон | 950 |
| Глина | 750 |
| Глина огнеупорная | 800 |
| Глинозем | 700…840 |
| Гнейс (облицовка) | 880 |
| Гравий (наполнитель) | 850 |
| Гравий керамзитовый | 840 |
| Гравий шунгизитовый | 840 |
| Гранит (облицовка) | 880…920 |
| Графит | 708 |
| Грунт влажный (почва) | 2010 |
| Грунт лунный | 740 |
| Грунт песчаный | 900 |
| Грунт сухой | 850 |
| Гудрон | 1675 |
| Диабаз | 800…900 |
| Динас | 737 |
| Доломит | 600…1500 |
| Дуб | 2300 |
| Железобетон | 840 |
| Железобетон набивной | 840 |
| Зола древесная | 750 |
| Известняк (облицовка) | 850…920 |
| Изделия из вспученного перлита на битумном связующем | 1680 |
| Ил песчаный | 1000…2100 |
| Камень строительный | 920 |
| Капрон | 2300 |
| Карболит черный | 1900 |
| Картон гофрированный | 1150 |
| Картон облицовочный | 2300 |
| Картон плотный | 1200 |
| Картон строительный многослойный | 2390 |
| Каучук натуральный | 1400 |
| Кварц кристаллический | 836 |
| Кварцит | 700…1300 |
| Керамзит | 750 |
| Керамзитобетон и керамзитопенобетон | 840 |
| Кирпич динасовый | 905 |
| Кирпич карборундовый | 700 |
| Кирпич красный плотный | 840…880 |
| Кирпич магнезитовый | 1055 |
| Кирпич облицовочный | 880 |
| Кирпич огнеупорный полукислый | 885 |
| Кирпич силикатный | 750…840 |
| Кирпич строительный | 800 |
| Кирпич трепельный | 710 |
| Кирпич шамотный | 930 |
| Кладка «Поротон» | 900 |
| Кладка бутовая из камней средней плотности | 880 |
| Кладка газосиликатная | 880 |
| Кладка из глиняного обыкновенного кирпича | 880 |
| Кладка из керамического пустотного кирпича | 880 |
| Кладка из силикатного кирпича | 880 |
| Кладка из трепельного кирпича | 880 |
| Кладка из шлакового кирпича | 880 |
| Кокс порошкообразный | 1210 |
| Корунд | 711 |
| Краска масляная (эмаль) | 650…2000 |
| Кремний | 714 |
| Лава вулканическая | 840 |
| Латунь | 400 |
| Лед из тяжелой воды | 2220 |
| Лед при температуре 0°С | 2150 |
| Лед при температуре -100°С | 1170 |
| Лед при температуре -20°С | 1950 |
| Лед при температуре -60°С | 1700 |
| Линолеум | 1470 |
| Листы асбестоцементные плоские | 840 |
| Листы гипсовые обшивочные (сухая штукатурка) | 840 |
| Лузга подсолнечная | 1500 |
| Магнетит | 586 |
| Малахит | 740 |
| Маты и полосы из стекловолокна прошивные | 840 |
| Маты минераловатные прошивные и на синтетическом связующем | 840 |
| Мел | 800…880 |
| Миканит | 250 |
| Мипора | 1420 |
| Мрамор (облицовка) | 880 |
| Настил палубный | 1100 |
| Нафталин | 1300 |
| Нейлон | 1600 |
| Неопрен | 1700 |
| Пакля | 2300 |
| Парафин | 2890 |
| Паркет дубовый | 1100 |
| Паркет штучный | 880 |
| Паркет щитовой | 880 |
| Пемзобетон | 840 |
| Пенобетон | 840 |
| Пенопласт ПХВ-1 и ПВ-1 | 1260 |
| Пенополистирол | 1340 |
| Пенополистирол «Пеноплекс» | 1600 |
| Пенополиуретан | 1470 |
| Пеностекло или газостекло | 840 |
| Пергамин | 1680 |
| Перекрытие армокерамическое с бетонным заполнением без штукатурки | 850 |
| Перекрытие из железобетонных элементов со штукатуркой | 860 |
| Перекрытие монолитное плоское железобетонное | 840 |
| Перлитобетон | 840 |
| Перлитопласт-бетон | 1050 |
| Перлитофосфогелевые изделия | 1050 |
| Песок для строительных работ | 840 |
| Песок речной мелкий | 700…840 |
| Песок речной мелкий (влажный) | 2090 |
| Песок сахарный | 1260 |
| Песок сухой | 800 |
| Пихта | 2700 |
| Пластмасса полиэфирная | 1000…2300 |
| Плита пробковая | 1850 |
| Плиты алебастровые | 750 |
| Плиты древесно-волокнистые и древесно-стружечные (ДСП, ДВП) | 2300 |
| Плиты из гипса | 840 |
| Плиты из резольноформальдегидного пенопласта | 1680 |
| Плиты из стеклянного штапельного волокна на синтетическом связующем | 840 |
| Плиты камышитовые | 2300 |
| Плиты льнокостричные изоляционные | 2300 |
| Плиты минераловатные повышенной жесткости | 840 |
| Плиты минераловатные полужесткие на крахмальном связующем | 840 |
| Плиты торфяные теплоизоляционные | 2300 |
| Плиты фибролитовые и арболит на портландцементе | 2300 |
| Покрытие ковровое | 1100 |
| Пол гипсовый бесшовный | 800 |
| Поливинилхлорид (ПВХ) | 920…1200 |
| Поликарбонат (дифлон) | 1100…1120 |
| Полиметилметакрилат | 1200…1650 |
| Полипропилен | 1930 |
| Полистирол УПП1, ППС | 900 |
| Полистиролбетон | 1060 |
| Полихлорвинил | 1130…1200 |
| Полихлортрифторэтилен | 920 |
| Полиэтилен высокой плотности | 1900…2300 |
| Полиэтилен низкой плотности | 1700 |
| Портландцемент | 1130 |
| Пробка | 2050 |
| Пробка гранулированная | 1800 |
| Раствор гипсовый затирочный | 900 |
| Раствор гипсоперлитовый | 840 |
| Раствор гипсоперлитовый поризованный | 840 |
| Раствор известково-песчаный | 840 |
| Раствор известковый | 920 |
| Раствор сложный (песок, известь, цемент) | 840 |
| Раствор цементно-перлитовый | 840 |
| Раствор цементно-песчаный | 840 |
| Раствор цементно-шлаковый | 840 |
| Резина мягкая | 1380 |
| Резина пористая | 2050 |
| Резина твердая обыкновенная | 1350…1400 |
| Рубероид | 1500…1680 |
| Сера | 715 |
| Сланец | 700…1600 |
| Слюда | 880 |
| Смола эпоксидная | 800…1100 |
| Снег лежалый при 0°С | 2100 |
| Снег свежевыпавший | 2090 |
| Сосна и ель | 2300 |
| Сосна смолистая 15% влажности | 2700 |
| Стекло зеркальное (зеркало) | 780 |
| Стекло кварцевое | 890 |
| Стекло лабораторное | 840 |
| Стекло обыкновенное, оконное | 670 |
| Стекло флинт | 490 |
| Стекловата | 800 |
| Стекловолокно | 840 |
| Стеклопластик | 800 |
| Стружка деревянная прессованая | 1080 |
| Текстолит | 1470…1510 |
| Толь | 1680 |
| Торф | 1880 |
| Торфоплиты | 2100 |
| Туф (облицовка) | 750…880 |
| Туфобетон | 840 |
| Уголь древесный | 960 |
| Уголь каменный | 1310 |
| Фанера клееная | 2300…2500 |
| Фарфор | 750…1090 |
| Фибролит (серый) | 1670 |
| Циркон | 670 |
| Шамот | 825 |
| Шифер | 750 |
| Шлак гранулированный | 750 |
| Шлак котельный | 700…750 |
| Шлакобетон | 800 |
| Шлакопемзобетон (термозитобетон) | 840 |
| Шлакопемзопено- и шлакопемзогазобетон | 840 |
| Штукатурка гипсовая | 840 |
| Штукатурка из полистирольного раствора | 1200 |
| Штукатурка известковая | 950 |
| Штукатурка известковая с каменной пылью | 920 |
| Штукатурка перлитовая | 1130 |
| Штукатурка фасадная с полимерными добавками | 880 |
| Шунгизитобетон | 840 |
| Щебень и песок из перлита вспученного | 840 |
| Щебень из доменного шлака, шлаковой пемзы и аглопорита | 840 |
| Эбонит | 1430 |
| Эковата | 2300 |
| Этрол | 1500…1800 |
thermalinfo.ru
Теплоемкость – это… Чему равна теплоемкость? Таблица теплоемкости
Теплоемкость – это способность поглощать некоторые объемы тепла во время нагревания или отдавать при охлаждении. Теплоемкость тела – это отношение бесконечно малого числа теплоты, что получает тело, к соответствующему приросту его температурных показателей. Величина измеряется в Дж/К. На практике применяют немного другую величину – удельную теплоемкость.
Определение

Что означает удельная теплоемкость? Это величина, относящаяся к единичному количеству вещества. Соответственно, численность вещества можно измерить в кубометрах, килограммах или даже в молях. От чего это зависит? В физике теплоемкость зависит напрямую от того, к какой количественной единице она относиться, а значит, различают молярную, массовую и объемную теплоемкость. В строительной сфере вы не будете встречаться с молярными измерениями, но с другими – сплошь и рядом.
Что влияет на удельную теплоемкость?

Что такое теплоемкость, вы знаете, но вот какие значения влияют на показатель, еще не ясно. На значение удельной теплоемкости напрямую воздействуют несколько компонентов: температура вещества, давление и иные термодинамические характеристики.
Во время роста температуры продукции его удельная теплоемкость растет, однако определенные вещества отличаются совершенно нелинейной кривой в этой зависимости. Например, с возрастанием температурных показателей с нуля до тридцати семи градусов удельная теплоемкость воды начинает понижаться, а если предел будет находиться между тридцатью семью и ста градусами, то показатель, наоборот, возрастет.
Стоит отметить, что параметр зависит еще и от того, каким образом разрешается изменяться термодинамическим характеристикам продукции (давлению, объему и так далее). Например, удельная теплоемкость при стабильном давлении и при стабильном объеме будут отличаться.
Как рассчитать параметр?
Вас интересует, чему равна теплоемкость? Формула расчета следующая: С=Q/(m·ΔT). Что это за значения такие? Q – это количество теплоты, что получает продукция при нагреве (или же выделяемое продукцией во время охлаждения). m – масса продукции, а ΔT – разность окончательной и начальной температур продукции. Ниже приведена таблица теплоемкости некоторых материалов.
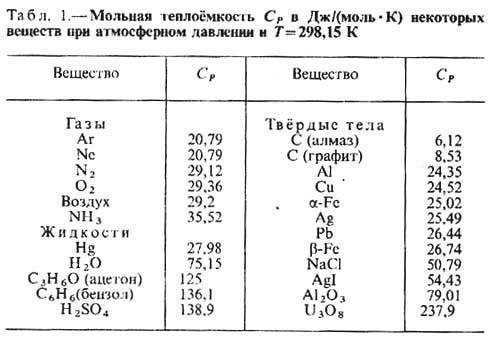
Что можно сказать о вычислении теплоемкости?
Вычислить теплоемкость – это задача не из самых простых, особенно если применять исключительно термодинамические методы, точнее это невозможно сделать. Потому физики используют методы статистической физики или же знания микроструктуры продукции. Как произвести вычисления для газа? Теплоемкость газа рассчитывается из вычисления средней энергии теплового движения отдельно взятых молекул в веществе. Движения молекул могут быть поступательного и вращательного типа, а внутри молекулы может быть целый атом или колебание атомов. Классическая статистика говорит, что на каждую степень свободы вращательных и поступательных движений приходится в мольной теплоемкости газа величина, что равняется R/2, а на каждую колебательную степень свободы значение равняется R. Это правило еще именуют законом равнораспределения.
При этом частичка одноатомного газа отличается всего тремя поступательными степенями свободы, а потому его теплоемкость должна приравниваться к 3R/2, что отлично согласуется с опытом. Каждая молекула двухатомного газа отличается тремя поступательными, двумя вращательными и одной колебательной степенями свободы, а значит, закон равнораспределения будет равняться 7R/2, а опыт показал, что теплоемкость моля двухатомного газа при обычной температуре составляет 5R/2. Почему оказалось такое расхождение теории? Все связано с тем, что при установлении теплоемкости потребуется учитывать разные квантовые эффекты, другими словами, пользоваться квантовой статистикой. Как видите, теплоемкость – это довольно-таки сложное понятие.
Квантовая механика говорит, что любая система частичек, что совершают колебания или же вращения, в том числе и молекула газа, может иметь определенные дискретные значения энергии. Если же энергия теплового движения в установленной системе недостаточна для возбуждения колебаний необходимой частоты, то данные колебания не вносят вклада в теплоемкость системы.
В твердых телах тепловое движение атомов являет собой слабые колебания поблизости определенных положений равновесия, это касается узлов кристаллической решетки. Атом обладает тремя колебательными степенями свободы и по закону мольная теплоемкость твердого тела приравнивается к 3nR, где n– количество имеющихся атомов в молекуле. На практике это значение является пределом, к которому стремится теплоемкость тела при высоких температурных показателях. Значение достигается при обычных температурных изменениях у многих элементов, это касается металлов, а также простых соединений. Также определяется теплоемкость свинца и других веществ.
Что можно сказать о низких температурах?

Мы уже знаем, что такое теплоемкость, но если говорить о низких температурах, то как значение будет рассчитываться тогда? Если речь идет о низких температурных показателях, то теплоемкость твердого тела тогда оказывается пропорциональной T 3 или же так называемый закон теплоемкости Дебая. Главный критерий, позволяющий отличить высокие показатели температуры от низких, является обычное сравнение их с характерным для определенного вещества параметром – это может быть характеристическая или температура Дебая qD. Представленная величина устанавливается спектром колебания атомов в продукции и существенно зависит от кристаллической структуры.
У металлов определенный вклад в теплоемкость дают электроны проводимости. Данная часть теплоемкости высчитывается с помощью статистики Ферми-Дирака, в которой учитываются электроны. Электронная теплоемкость металла пропорциональная обычной теплоемкости, представляет собой сравнительно небольшую величину, а вклад в теплоемкость металла она вносит только при температурных показателях, близких к абсолютному нулю. Тогда решеточная теплоемкость становится очень маленькой, и ею можно пренебречь.
Массовая теплоемкость
Массовая удельная теплоемкость – это количество теплоты, что требуется поднести к единице массы вещества, дабы нагреть продукт на единицу температуры. Обозначается данная величина буквой С и измеряется она в джоулях, поделенных на килограмм на кельвин – Дж/(кг·К). Это все, что касается теплоемкости массовой.
Что такое объемная теплоемкость?
Объемная теплоемкость – это определенное количество теплоты, что требуется подвести к единице объема продукции, дабы нагреть ее на единицу температуры. Измеряется данный показатель в джоулях, поделенных на кубический метр на кельвин или Дж/(м³·К). Во многих строительных справочниках рассматривают именно массовую удельную теплоемкость в работе.
Применение на практике теплоемкости в строительной сфере
Многие теплоемкие материалы применяют активно при строительстве теплоустойчивых стен. Это крайне важно для домов, отличающихся периодическим отоплением. Например, печным. Теплоемкие изделия и стены, возведенные из них, отлично аккумулируют тепло, запасают его в отопительные периоды времени и поэтапно отдают тепло после выключения системы, позволяя таким образом поддерживать приемлемую температуру на протяжении суток.
Итак, чем больше будет запасено тепла в конструкции, тем комфортней и стабильней будет температура в комнатах.
Стоит отметить, что обычный кирпич и бетон, применяемые в домостроении, обладают значительно меньшей теплоемкостью, чем пенополистирол. Если брать эковату, то она в три раза более теплоемкая, нежели бетон. Следует отметить, что в формуле расчета теплоемкости совершенно не зря присутствует масса. Благодаря большой огромная массе бетона или кирпича в сравнении с эковатой позволяет в каменных стенах конструкций аккумулировать огромные объемы тепла и сглаживать все суточные температурные колебания. Только малая масса утеплителя во всех каркасных домах, несмотря на хорошую теплоемкость, является самой слабой зоной у всех каркасных технологий. Чтобы решить данную проблему, во всех домах монтируют внушительные теплоаккумуляторы. Что это такое? Это конструктивные детали, отличающиеся большой массой при достаточно хорошем показателе теплоемкости.
Примеры теплоаккумуляторов в жизни

Что это может быть? К примеру, какие-то внутренние кирпичные стены, большая печь или камин, стяжки из бетона.
Мебель в любом доме или квартире является отличным теплоаккумулятором, ведь фанера, ДСП и дерево фактически в три раза больше могут запасаться теплом лишь на килограмм веса, нежели пресловутый кирпич.
Есть ли недостатки в теплоаккумуляторах? Конечно, главный минус данного подхода состоит в том, что теплоаккумулятор требуется проектировать еще на стадии создания макета каркасного дома. Все из-за того, что он отличается большим весом, и это потребуется учесть при создании фундамента, а после еще представить, как данный объект будет интегрирован в интерьер. Стоит сказать, что учитывать придется не только массу, потребуется оценивать в работе обе характеристики: массу и теплоемкость. К примеру, если применять золото с невероятным весом в двадцать тонн на кубометр в качестве теплоаккумулятора, то продукция будет функционировать как нужно лишь на двадцать три процента лучше, нежели бетонный куб, вес которого составляет две с половиной тонны.
Какое вещество больше всего подходит для теплоаккумулятора?

Наилучшим продуктом для теплоаккумулятора является совсем не бетон и кирпич! Неплохо с этой задачей справляется медь, бронза и железо, но они очень тяжелые. Как ни странно, но лучший теплоаккумулятор – вода! Жидкость имеет внушительную теплоемкость, самую большую среди доступных нам веществ. Больше теплоемкость только у газов гелия (5190 Дж/(кг·К) и водорода (14300 Дж/(кг·К), но их проблематично применять на практике. При желании и необходимости смотрите таблицу теплоемкости нужных вам веществ.
fb.ru
4. Теплоемкость. Определение теплоемкости веществ.
Теплоемкостью называется количество теплоты, которое надо сообщить единице массы, количества или объема вещества, чтобы его температура повысилась на 1 градус.
Различают
массовую теплоемкость с,
измеряемую в Дж/(кгК),
молярную  –Дж/(кмольК) и объемную с’ – Дж/(м3К).
–Дж/(кмольК) и объемную с’ – Дж/(м3К).
Связь между массовой, молярной и объемной теплоемкостью представлена следующими соотношениями:
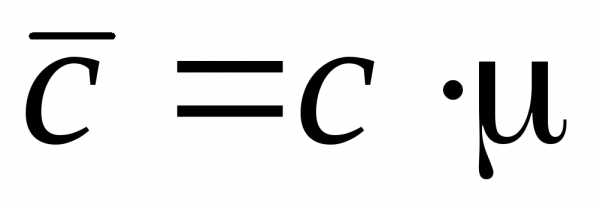 ;
; 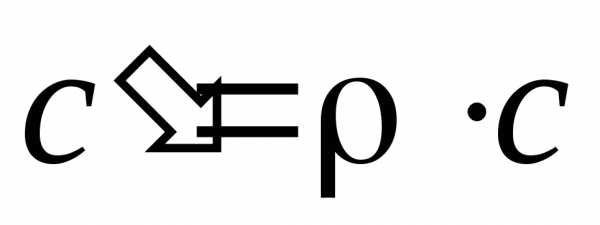 .
(1.12)
.
(1.12)
Теплоемкость газов зависит от термодинамического процесса, в котором подводится или отводится теплота. Если процесс задан условием z = idem, то теплоемкость в этом процессе будет определяться следующим образом:
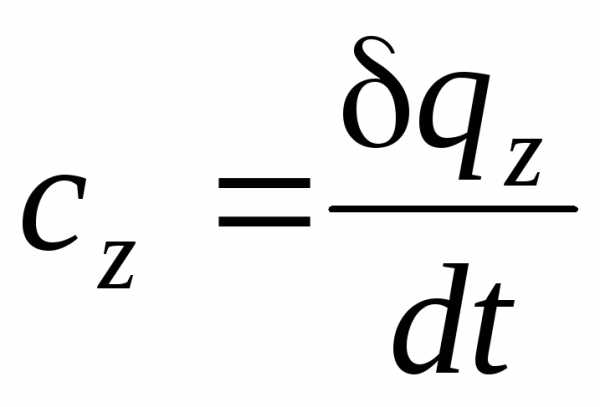 .
(1.13)
.
(1.13)
Эта теплоемкость называется истинной.
Экспериментальное определение теплоемкости обычно проводится в двух процессах: при постоянном объеме (изохорная теплоемкость cv ) и постоянном давлении (изобарная теплоемкость cp).
Теплоемкость реального газа зависит от температуры и давления. Теплоемкость идеального газа зависит только от температуры.
Для практических расчетов вводится понятие средней теплоемкости в интервале температур от t1 до t2, значение которой принимается неизменной для всего рассматриваемого интервала температур (сzm).
Из уравнения (1.13) следует, что количество теплоты, подведенной к телу (или отведенной от него) в процессе 1–2 (изобарном или изохорном), определяется соотношением
. (1.14)
Отсюда следует выражение средней теплоемкости газа
. (1.15)
Для большинства газов значения средней теплоемкости в интервале температур от t1 до t2 приведены в специальных термодинамических таблицах.
Для некоторых газов в определенном интервале температур истинная теплоемкость изменяется по линейному закону
. (1.16)
Подставив выражение (1.16) в уравнение (1.15), получим
, (1.17)
где сzm – называется первой средней теплоемкостью. Она численно равна истинной теплоемкости при среднеарифметической температуре процесса.
5. Математическое выражение 1го начала термодинамики
Первое начало термодинамики – это количественное выражение закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным законом природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только переходит из одного вида в другой».
Это утверждение и принимается в качестве постулата первого начала термодинамики
Первое начало термодинамики как математическое выражение закона сохранения и превращения энергии:
Внутренняя энергия изолированной системы сохраняет своё постоянное значение при всех изменениях, протекающих внутри системы, то есть . Изменение внутренней энергии неизолированной системы складывается из подведённой (отведённой) теплоты и подведённой (отведённой) работы, то есть.
в интегральной форме:
– эффективная работа;
 –
внешний теплообмен
–
внешний теплообмен
Полученные уравнения учитывают только внешние эффекты и справедливы только для обратимых процессов.
Уравнения являются математическим выражением первого начала термодинамики по внешнему балансу теплоты и работы и гласят: количество теплоты, подведенное извне, идет на изменение внутренней энергии системы и совершение работы.
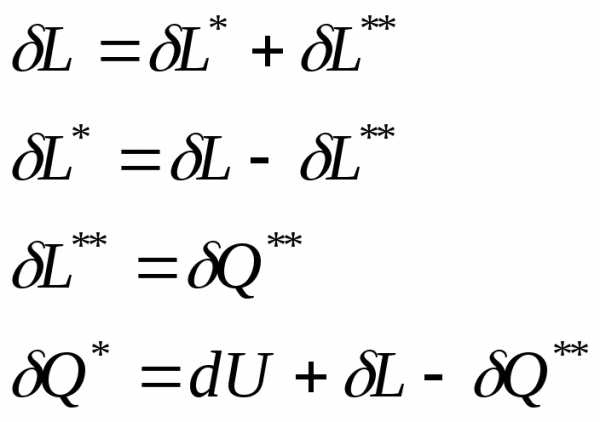
В термодинамике приняты следущие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное значение; если теплота отводится от тела, она имеет отрицательное значение.
studfiles.net
4 Теплоемкость газов
4.1 Основные определения. Массовая, объемная и молярная теплоемкости
Если к рабочему телу в каком-либо процессе подвести теплоту или отвести от него теплоту, то это приведет к изменению его температуры.
Отношение количества теплоты подведенной к рабочему телу (или отведенной от рабочего тела) в данном процессе к изменению его температуры называется теплоемкостью тела (системы тел):
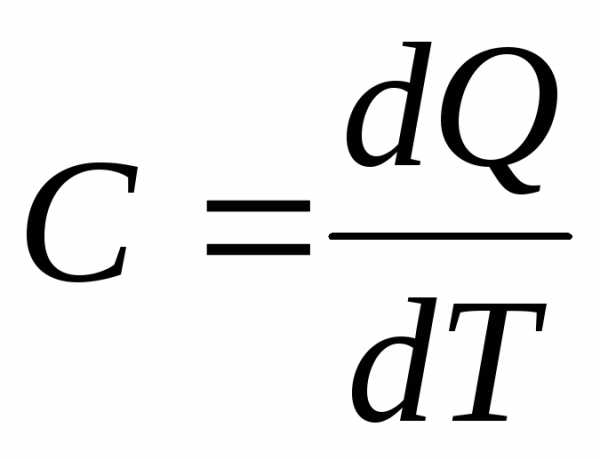 [Дж/К],
(4.1)
[Дж/К],
(4.1)
где dQ – элементарное количество теплоты; dT – элементарное изменение температуры.
Количество теплоты, подведенное к рабочему телу (или отведенное от рабочего тела) в каком-либо процессе х, для изменения его температуры на определенное количество градусов зависит от количества рабочего тела. В зависимости от количественной единицы рабочего тела, к которому подводится теплота, в термодинамике различают массовую /удельную/, объемную и мольную теплоемкости
Удельная /массовая/ теплоемкость сх – это теплоемкость, отнесенная к единице массы рабочего тела:
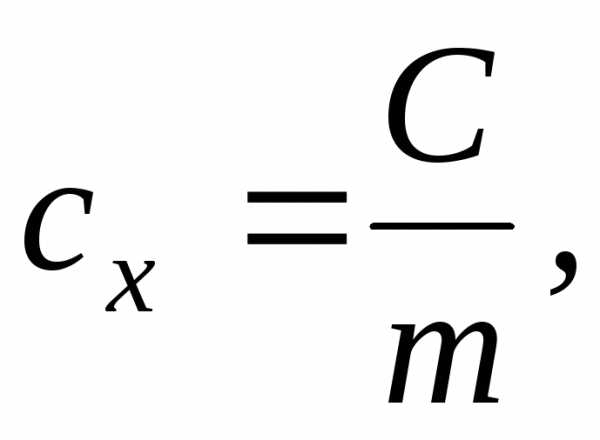 [Дж/кгК].
(4.2)
[Дж/кгК].
(4.2)
Объемная теплоемкость c‘х – это теплоемкость, отнесенная к единице объема рабочего тела при нормальных физических условиях (Р = 101325 Па и Т = 273,15 К):
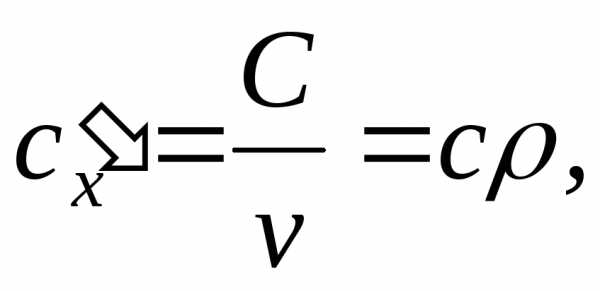 [Дж/м3К].
(4.3)
[Дж/м3К].
(4.3)
Мольная теплоемкость cx – это теплоемкость, отнесенная к количеству рабочего тела в молях:
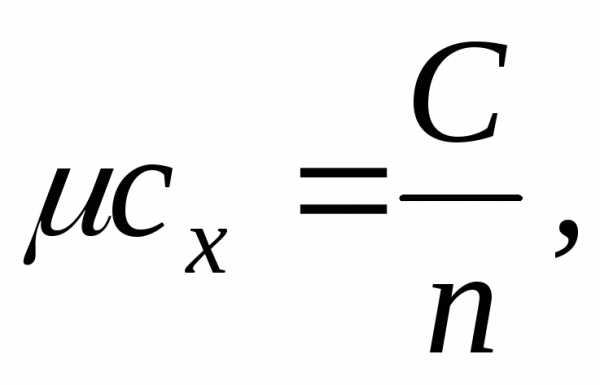 [Дж/кмольК]
(4.4)
[Дж/кмольК]
(4.4)
где n – количество газа в молях.
Между указанными теплоемкостями существует следующая связь:
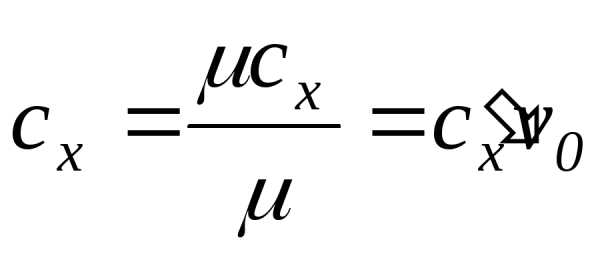 , (4.5)
, (4.5)
где v0 – удельный объем при нормальных физических условиях; – молярная масса.
Изменение
температуры рабочего тела при одном и
том же количестве сообщаемой теплоты
зависит от процесса, в котором подводится
теплота, поэтому теплоемкость является
функцией процесса. Т.е. одно и то же
рабочее тело в зависимости от процесса
требует для своего нагрева на один
градус различное количество теплоты.
Численно величина с изменяется от до
до .
.
4.2 Теплоемкость при постоянном давлении и при постоянном объеме. Уравнение Майера.
Как было отмечено ранее, теплоемкость зависит от характера термодинамического процесса, при котором подводится или отводится теплота, поэтому при экспериментальном определении ее значения обычно используют два термодинамических процесса: v = const и P = const. Значения теплоемкостей сv и cp для различных веществ сведены в таблицы и имеются в справочной литературе.
Известно, что (см. уравнение 4.1). Тогда для изохорного процесса:
(4.6)
Подведенная при постоянном объеме теплота, когда dl=0, расходуется только на изменение внутренней энергии du, поскольку в соответствии с первым законом термодинамики
dq = du + dl. (4.7)
Тогда, в соответствии с (4.7) имеем:
. (4.8)
Для изобарного процесса:
. (4.9)
При P = const некоторое количество теплоты идет также на совершение работы, поэтому для изменения температуры рабочего тела на 1К при P = const требуется большее количество теплоты, чем при v = const и, следовательно, cpсv.
Исходя
из уравнений (4.7, 4.8, 4.9) и 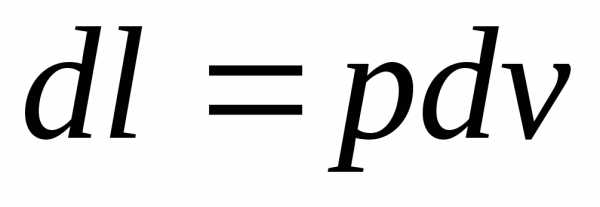 ,
имеем:
,
имеем:
. (4.10)
Так как из уравнения состояния , то для идеального газа далее получаем:

 .
.
Или:

 .
.
(4.11)
Выражение (4.11) называют уравнением Майера.
Т.е.
для изменения температуры рабочего
тела в интервале температур от  до
до в изобарном процессе 1-2Р (рис. 4.1) требуется большее количество
теплоты, чем в изохорном процессе 1-2v.
Это видно из изображения процессов в
в изобарном процессе 1-2Р (рис. 4.1) требуется большее количество
теплоты, чем в изохорном процессе 1-2v.
Это видно из изображения процессов в  -диаграмме.
Площадь, ограниченная кривой процесса
и осью абсцисс, представляет собой
количество теплоты, участвующей в
процессе, и
-диаграмме.
Площадь, ограниченная кривой процесса
и осью абсцисс, представляет собой
количество теплоты, участвующей в
процессе, и
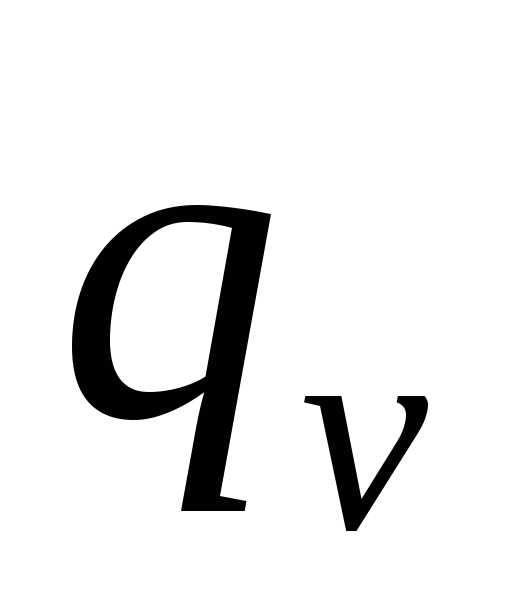 ,
т.е. пл.12ps2ps1 12vs2vs1
,
т.е. пл.12ps2ps1 12vs2vs1
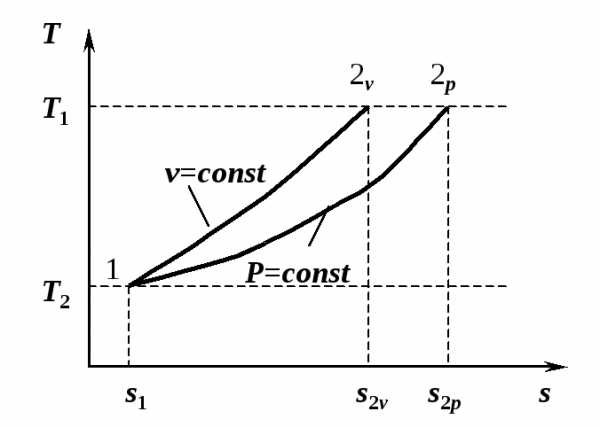
Рис. 4.1. К вычислению количества теплоты в термодинамическом процессе
В термодинамике часто используется отношение теплоемкости при постоянном давлении и постоянном объеме:
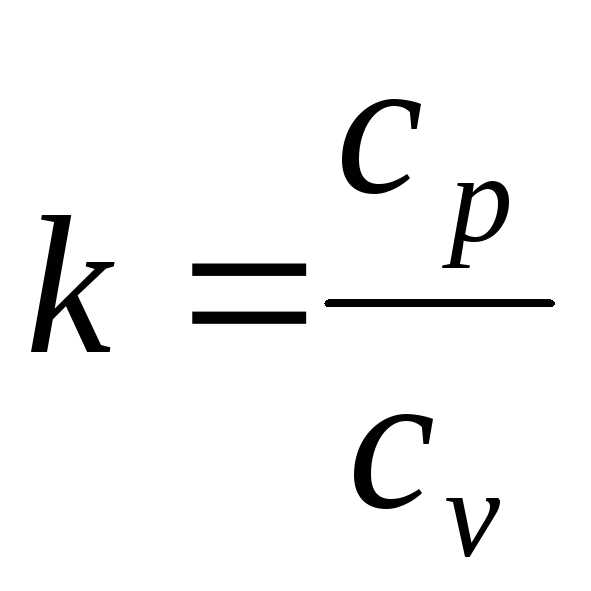 . (4.12)
. (4.12)
С учетом изложенного выше, первый закон термодинамики может быть представлен в виде:
,
или
. (4.13)
В упрощенных расчетах используются постоянные значения мольных теплоемкостей, не зависящих от температуры (табл. 4.1).
Постоянные
значения мольных теплоемкостей и
показатель адиабаты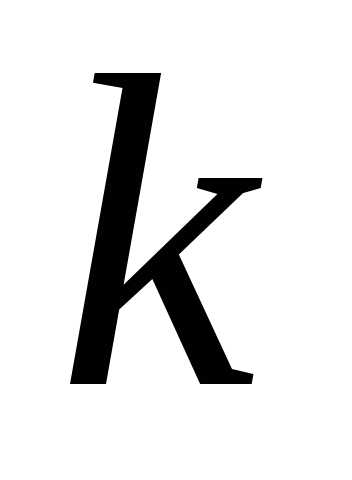
Таблица 4.1 – Постоянные значения мольных теплоемкостей
Атомность газа | Мольная теплоемкость, кДж/мольК |
| |
|
| ||
Одноатомный | 12,5 | 20,8 | 1,67 |
Двухатомный | 20,8 | 29,1 | 1,4 |
Многоатомный | 25,0 | 33,3 | 1,33 |
Теплоемкости cp и сv не зависят ни от объема, ни от давления, а являются однозначной функцией температуры c = (T).
Отношение
количества теплоты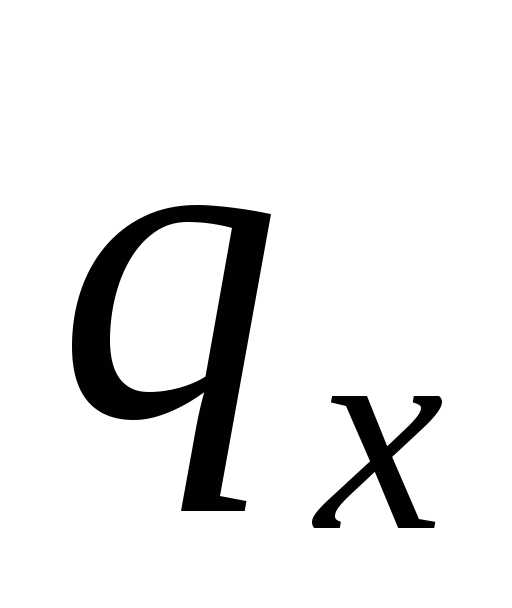 ,
подведенной или отведенной в данном
процессе, к соответствующему изменению
температурыназывается средней теплоемкостью тела
в данном процессех:
,
подведенной или отведенной в данном
процессе, к соответствующему изменению
температурыназывается средней теплоемкостью тела
в данном процессех:
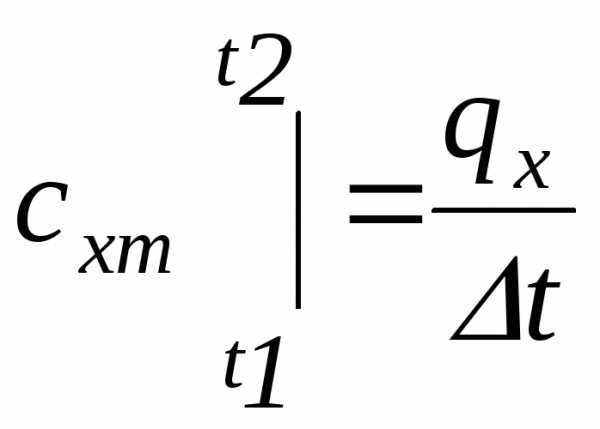 .
.
Индекс т означает medium – средняя.
Предел,
к которому стремится средняя теплоемкость
при 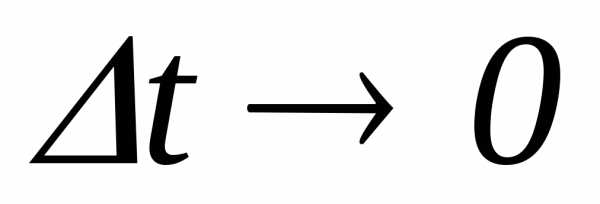 называется
истинной теплоемкостью тела в данном
процессех:
называется
истинной теплоемкостью тела в данном
процессех:
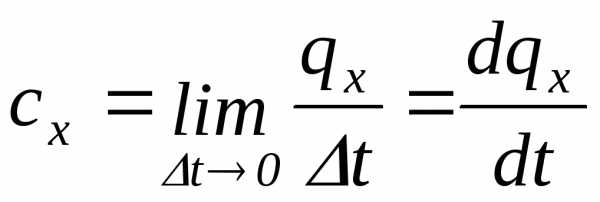 . (4.14)
. (4.14)
В таблице 4.2 приведена классификация различных видов теплоемкости в зависимости от единиц количества вещества (массовые, объемные и мольные), температуры (истинные и средние) и процесса (изохорные и изобарные).
Классификация теплоемкостей
Таблица 4.2
Теплоемкость | Массовая, кДж/(кгК) | Объемная, кДж/(м3К) | Мольная, кДж/(мольК) | |||
истинная | средняя | истинная | средняя | истинная | средняя | |
Изохорная |
|
|
|
|
|
|
Изобарная |
|
|
|
| |
|
Для многих теплотехнических расчетов зависимость принимают линейной так, что
.
studfiles.net
28. Теплоёмкость. Молярная и удельная теплоёмкости. Связь между ними. Формула Майера.
Количество
тепла, при получении которого температура
тела повышается на один градус, называется
теплоемкостью. Согласно этому определению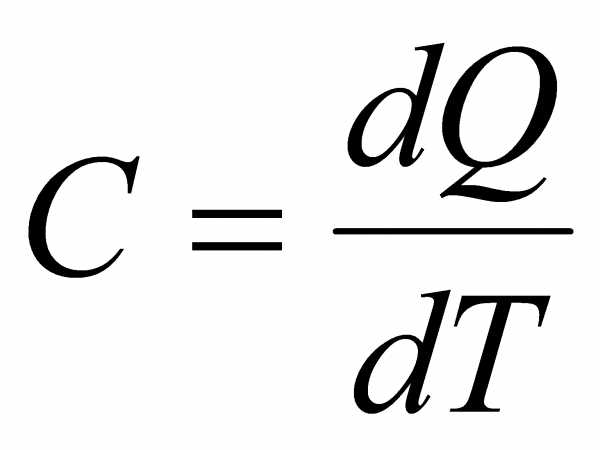 .
.
Теплоемкость, отнесенная к единице массы, называется удельной теплоемкостью. Теплоемкость, отнесенная к одному молю, называется моляpной теплоемкостью.
Итак, теплоемкость опpеделяется чеpез понятие количества теплоты. Но последнее, как и pабота, зависит от пpоцесса. Значит и теплоемкость зависит от пpоцесса. Сообщать теплоту – нагpевать тело – можно пpи pазличных условиях. Однако пpи pазличных условиях на одно и то же увеличение темпеpатуpы тела потpебуется pазличное количество теплоты. Следовательно, тела можно хаpактеpизовать не одной теплоемкостью, а бесчисленным множеством (столько же, сколько можно пpидумать всевозможных пpоцессов, пpи котоpых пpоисходит теплопеpедача). Однако на пpактике обычно пользуются опpеделением двух теплоемкостей: теплоемкости пpи постоянном объеме и теплоемкости пpи постоянном давлении.
Теплоемкость различается в зависимости от того, при каких условиях происходит нагревание тела — при постоянном объеме или при постоянном давлении.
Если нагревание тела происходит при постоянном объеме, т. е. dV = 0, то работа равна нулю. В этом случае передаваемое телу тепло идет только на изменение его внутренней энергии, dQ = dE, и в этом случае теплоемкость равна изменению внутренней энергии при изменении температуры на 1 К, т. е.
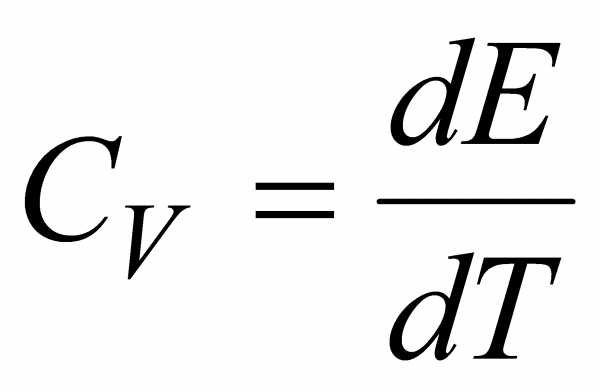 .Поскольку
для газа
.Поскольку
для газа 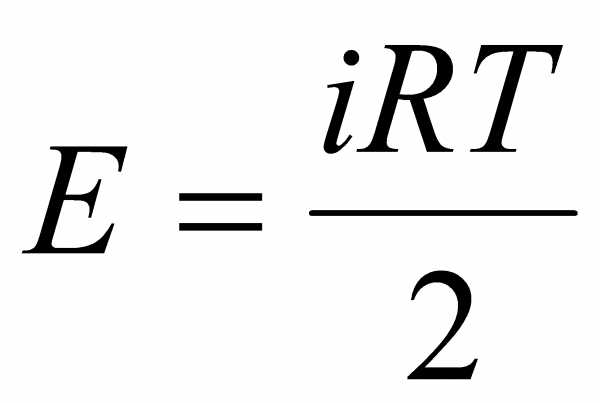 ,
то
,
то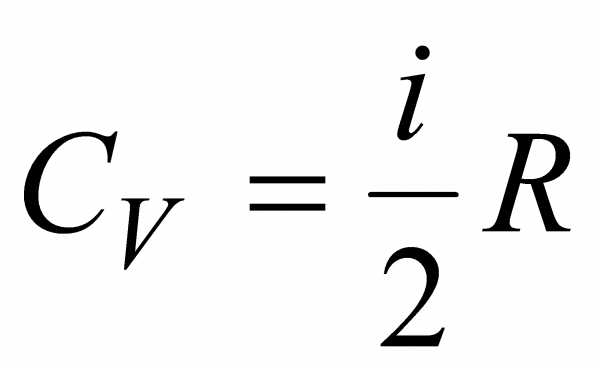 .Эта
формула определяет теплоемкость 1 моля
идеального газа, называемую молярной.
При нагревании газа при постоянном
давлении его объем меняется, сообщенное
телу тепло идет не только на увеличение
его внутренней энергии, но и на совершение
работы, т.е.dQ = dE + PdV.
Теплоемкость при постоянном давлении
.Эта
формула определяет теплоемкость 1 моля
идеального газа, называемую молярной.
При нагревании газа при постоянном
давлении его объем меняется, сообщенное
телу тепло идет не только на увеличение
его внутренней энергии, но и на совершение
работы, т.е.dQ = dE + PdV.
Теплоемкость при постоянном давлении 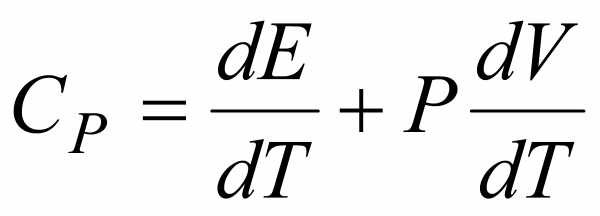 .
.
Для идеального газа PV = RT и поэтому PdV = RdT.
Учитывая
это, найдем.Отношение 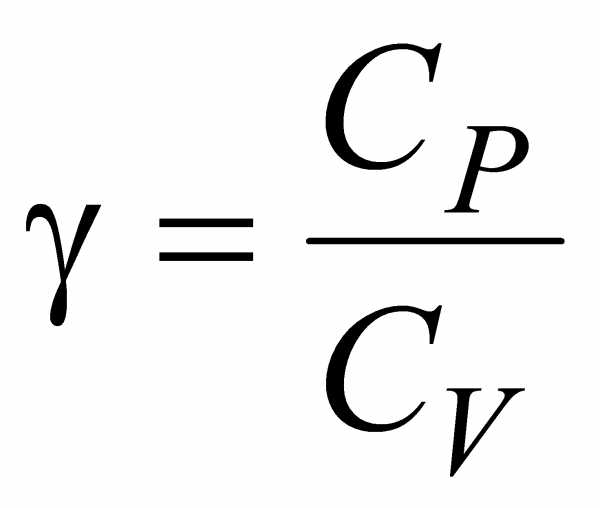 представляет собой величину, характерную
для каждого газа и определяемую числом
степеней свободы молекул газа. Измерение
теплоемкости тела есть, таким образом,
способ непосредственного измерения
микроскопических характеристик
составляющих его молекул.
представляет собой величину, характерную
для каждого газа и определяемую числом
степеней свободы молекул газа. Измерение
теплоемкости тела есть, таким образом,
способ непосредственного измерения
микроскопических характеристик
составляющих его молекул.
Ф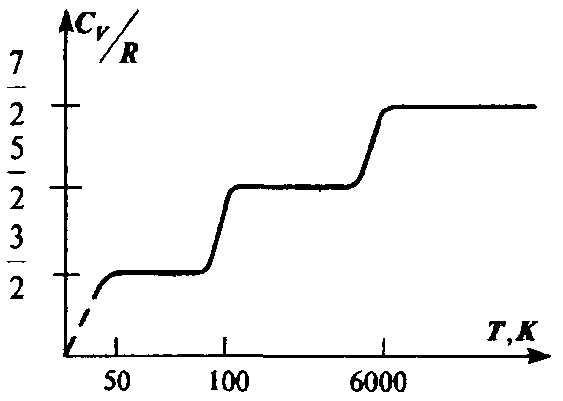 ормулы
для теплоемкости идеального газа
приблизительно верно описывают
эксперимент, причем, в основном, для
одноатомных газов. Согласно формулам,
полученным выше, теплоемкость не должна
зависеть от температуры. На самом деле
наблюдается картина, изображенная на
рис., полученная опытным путем для
двухатомного газа водорода. На участке
1 газ ведет себя как система частиц,
обладающих лишь поступательными
степенями свободы, на участке 2 возбуждается
движение, связанное с вращательными
степенями свободы и, наконец, на участке
3 появляются две колебательные степени
свободы. Ступеньки на кривой хорошо
согласуются с формулой (2.35), однако между
ними теплоемкость растет с температурой,
что соответствует как бы нецелому
переменному числу степеней свободы.
Такое поведение теплоемкости указывает
на недостаточность используемого нами
представления об идеальном газе для
описания реальных свойств вещества.
ормулы
для теплоемкости идеального газа
приблизительно верно описывают
эксперимент, причем, в основном, для
одноатомных газов. Согласно формулам,
полученным выше, теплоемкость не должна
зависеть от температуры. На самом деле
наблюдается картина, изображенная на
рис., полученная опытным путем для
двухатомного газа водорода. На участке
1 газ ведет себя как система частиц,
обладающих лишь поступательными
степенями свободы, на участке 2 возбуждается
движение, связанное с вращательными
степенями свободы и, наконец, на участке
3 появляются две колебательные степени
свободы. Ступеньки на кривой хорошо
согласуются с формулой (2.35), однако между
ними теплоемкость растет с температурой,
что соответствует как бы нецелому
переменному числу степеней свободы.
Такое поведение теплоемкости указывает
на недостаточность используемого нами
представления об идеальном газе для
описания реальных свойств вещества.
Связь молярной теплоёмкости с удельной теплоёмкостьюС=M•с, где с — удельная теплоёмкость, М — молярная масса.Формула Майера.
Для любого идеального газа справедливо соотношение Майера:
,где R — универсальная газовая постоянная, — молярная теплоемкость при постоянном давлении, — молярная теплоемкость при постоянном объёме.
studfiles.net
Теплоемкость газа и газовой смеси.
Теплоемкость газов
Понятие о теплоемкости
Замысловатый термин “теплоемкость” не что иное, как способность тела расходовать внешнюю тепловую энергию для повышения внутренней кинетической энергии собственных молекул, т. е. повышать температуру при подводе тепла извне.
Как мы уже знаем из предыдущих статей, повышение температуры любого вещества сопровождается увеличением кинетической энергии его частиц, скорость которых начинает возрастать. Этот процесс неизбежно сопровождается уменьшением внутренней потенциальной энергии молекул тела, поскольку они слабее взаимодействуют посредством гравитационных и электромагнитных полей (в первую очередь из-за увеличения расстояния между ними).
Различные вещества способны по-разному “впитывать” внешнюю энергию. Чтобы нагреть до определенной температуры, например, 1 кг нержавеющей стали, необходимо затратить значительно больше тепла, чем для нагрева 1 кг чугуна.
Подобный факт наталкивает на мысль о введении понятия некоторой способности материальных тел “захватывать” и “впитывать” поступающее от окружающей среды тепло. Именно этим физическим свойством материальных тел является теплоемкость.
Чтобы повысить температуру единицы количества вещества на dT, необходимо сообщить ему теплоту dq.
Отношение c = dq/dT называют удельной теплоемкостью вещества.
Удельная теплоемкость показывает, какое количество теплоты необходимо подвести к единице вещества, чтобы нагреть его на 1К (один градус Кельвина).
В зависимости от выбранной единице количества вещества различают массовую (отнесенную к 1 кг), киломольную (отнесенную к 1 кмолю) и объемную (отнесенную к 1 м3) удельные теплоемкости.
Удельная теплоемкость газа зависит от способа подвода к нему теплоты. Очевидно, что на основании определения теплоемкости и уравнения первого закона термодинамики можно записать:
c = dq/dT = (du + pdv)/dT = du/dT + pdv/dT.
Величину pdv/dT называют удельной работой. Она показывает, какую работу совершает единица количества газа при повышении его температуры на 1К.
Если при подводе теплоты к газу занимаемый им объем остается постоянным (v = const), то dv = 0 и удельная теплоемкость cv = du/dT, откуда du = cvdT.
Если же при подводе к газу теплоты его давление остается неизменным (p = const), то удельная теплоемкость будет равна:
cp = cv + pdv/dT. (1)
Следовательно, удельная теплоемкость при постоянном давлении больше удельной теплоемкости при постоянном объеме на удельную работу.
Если продифференцировать уравнение состояния pv = RT при p = const, получим выражение удельной работы для идеальных газов:
dA = pdv/dT = R. (2)
Эта формула позволяет уяснить физический смысл газовой постоянной. Газовая постоянная R – это работа, совершаемая единицей количества газа при нагревании на 1К, если теплота подводилась при постоянном давлении.
Подставив в уравнение (1) значение удельной газовой постоянной из формулы (2), получим уравнение Майера:
cv – cp = R.
Для идеального газа значения cp и cv постоянны, поэтому и отношение cp/cv = k тоже является величиной постоянной.
Нагревая идеальный газ от температуры T1 до T2 при постоянном объеме, необходимо подвести количество теплоты, равное:
qv = cv(T1 – T2),
а для нагревания при постоянном давлении:
qp = cp(T1 – T2).
***
Зависимость теплоемкости от температуры
Удельная теплоемкость реальных газов в отличие от идеальных газов зависит от давления и температуры. Зависимостью удельной теплоемкости от давления в практических расчетах можно пренебречь. Но зависимость удельной теплоемкости от температуры необходимо учитывать, поскольку она очень существенна.
Исследования показывают, что удельная теплоемкость реальных газов является сложной функцией температуры:
c = f(T).
Из этого следует, что в различных температурных интервалах для нагревания единицы количества газа на 1К требуется разное количество теплоты.
Однако, если выбрать достаточно узкий температурный интервал, то для него можно принять удельную теплоемкость постоянной. Очевидно, что если этот температурный интервал стремится к нулю, удельная теплоемкость соответствует истинной удельной теплоемкости при данной температуре:
c = lim Δq/ΔT при Т стремящемся к нулю, или c = dq/dT, откуда
dq = cdT.
Чтобы определить количество теплоты, необходимое для нагревания газа от T1 до T2, необходимо проинтегрировать полученную дифференциальную зависимость.
При практическом решении теплотехнических задач пользуются понятием средней удельной теплоемкости в заданном температурном интервале.
Средняя удельная теплоемкость (cm) газа в некотором интервале температур – это количество теплоты, которое необходимо подвести к газу или отвести от него, чтобы изменить температуру на 1К в данном температурном интервале.
***
Удельная теплоемкость газовой смеси
Под удельной массовой теплоемкостью ссм газовой смеси понимают количество теплоты, необходимое для нагревания 1 кг смеси на 1К. Очевидно, что это количество теплоты можно получить путем суммирования количества теплоты, необходимое для нагревания каждого компонента, входящего в состав смеси:
ссм = Σ cimi,
где:
ci – удельная массовая теплоемкость i-го компонента смеси;
mi – массовая доля этого компонента в смеси.
Аналогично можно определить удельную объемную теплоемкость газовой смеси – как сумму удельных объемных теплоемкостей ее компонентов. Удельная киломольная теплоемкость смеси газов определяется по формуле:
μсм ссм = Σ μiciri,
где: μi – молекулярная масса компонента смеси; ri – объемная доля компонента в составе смеси.
***
Термодинамические процессы
Скачать теоретические вопросы к экзаменационным билетам
по учебной дисциплине “Основы гидравлики и теплотехники”
(в формате Word, размер файла 68 кБ)
Скачать рабочую программу
по учебной дисциплине “Основы гидравлики и теплотехники” (в формате Word):
Скачать календарно-тематический план
по учебной дисциплине “Основы гидравлики и теплотехники” (в формате Word):
k-a-t.ru
Теплоемкости удельные твердых веществ, жидкостей и газов (газов – при постоянном давлении 1 бар абс) + справочные плотности. Твердые вещества. Удельная теплоемкость при 20 °C (если не указано другое).
Жидкости. Удельная теплоемкость при 20 °C (если не указано другое).
Газы. Удельная теплоемкость при постоянном давлении 1 бар абс, при 20 °C (если не указано другое).
|
tehtab.ru