Лекция 4. Адсорбция
4
Адсорбция
Адсорбция является универсальным методом, позволяющим практически полностью извлечь примесь из газовой или жидкой среды. В химической промышленности, в частности в ТНВ, адсорбционный метод широко используется для гладкой очистки и осушки технологических потоков, улучшения качества сырья и продуктов и является одним из методов защиты окружающей среды.
Адсорбция – это концентрирование веществ на
поверхности или в объеме твердого тела.
В процессе адсорбции участвуют как
минимум два компонента. Твердое
вещество, на поверхности или в объеме
которого происходит концентрирование
поглощаемого вещества, называется адсорбентом.
Поглощаемое вещество, находящееся в
газовой или жидкой фазе называется адсорбтивом,
а после того, как оно перешло в
адсорбированное состояние –
С термодинамической точки зрения адсорбция проявляется с уменьшением свободной энергии Гиббса (G). Как и все процессы, сопровождающие уменьшением энергии Гиббса, адсорбция является самопроизвольным процессом. Переход вещества из газовой или жидкой фазы в адсорбированное состояние связан с потерей по меньшей мере одной степени свободы, (трехмерная объемная газовая или жидкая фаза двухмерная поверхностная фаза), что ведет к уменьшению энтропии системы (S). Поскольку энтальпия (Н) связана с энергией Гиббса и энтропией уравнением Н = G + TS, то в процессе адсорбции она убывает, и следовательно, адсорбция – процесс экзотермический.
Адсорбционные явления делят на два основных типа: физическую адсорбцию и хемосорбцию (сорбцию, основанную на силах химического взаимодействия). Физическая адсорбция вызывается силами молекулярного взаимодействия: дисперсионными и электростатическими. Дисперсионные силы вносят основной вклад в энергию взаимодействия молекул. Так, молекулы любого адсорбтива обладают флуктуирующими диполями и квадруполями, вызывающими мгновенные отклонения распределения электронной плотности от среднего распределения. При сближении молекул адсорбтива с атомами или молекулами адсорбента движение флуктуирующих диполей приобретает систематический и строго упорядоченный характер, что приводит к возникновению притяжения между ними. В ряде случаев дисперсионные силы усиливаются электростатическими силами – ориентационными и индукционными. Ориентационные силы возникают при взаимодействии полярных молекул с поверхностью, содержащей, электростатические заряды (ионы, диполи), а индукционные – вызываются изменением электронной структуры молекул адсорбтива и адсорбента под действием друг друга.
В отличие от физической адсорбции, при хемосорбции не сохраняется индивидуальность адсорбтива и адсорбента. При сближении молекул адсорбтива с поверхностью адсорбента происходит перераспределение электронов взаимодействующих компонентов с образованием химической связи. Если физическую адсорбцию можно сравниь с конденсацией, то хемосорбция рассматривается как химический процесс, протекающий на поверхности раздела фаз.
Физическую адсорбцию и хемосорбцию можно отличить на основании численного значения теплоты адсорбции. Теплота адсорбции компонентов промышленных газов соизмерима с теплотой их конденсации и не превышает 85-125 кДж/моль. Теплота хемосорбции одного моля вещества достигает нескольких сотен кДж. Хемосорбция, как правило, протекает с небольшой скоростью, это обстоятельство часто используется для ее распознания. Кроме того, хемосорбция может протекать при высоких температурах, когда физическая адсорбция пренебрежимо мала. При хемоморбции характерным является резкое, скачкообразное изменение поглотительной способности по извлекаемому компоненту при переходе от адсорбента одной химической природы к адсорбенту другой природы. При хемосорбции адсорбированные молекулы не могут перемещаться по поверхности адсорбента, их положение фиксировано, и такая адсорбция называется локализованной. Физическая адсорбция может быть как локализованной, так и не локализованной. Обычно, при повышении температуры молекулы приобретают подвижность и характер процесса изменяется: локализованная адсорбция переходит в нелокализованную.
Структура и применение промышленных адсорбентов
Большинство промышленных адсорбентов отличается «ажурной» внутренней структурой, включающей поры различного размера. При этом решающее влияние на адсорбционную способность и скорость поглощения оказывает содержание мелких пор в единице объема или массы адсорбента. В зависимости от размеров поры подразделяют на три типа: микро-, мезо- (переходные) и макропоры.
Микропоры – наиболее мелкие поры, имеют размеры, соизмеримые с размерами адсорбируемых молекул. Их эффективные радиусы находятся в интервале от 5 до 15А. Суммарный объем промышленных адсорбентов обычно не превышает 0,5 см3/г. Характерной чертой адсорбции в микропорах является существенное повышение энергии адсорбции по сравнению с адсорбцией в более крупных порах. Например, при одинаковом количестве поглощенного n-гексана активным углем с микропорами и макропористой активной сажей энергия адсорбции в первом случае в 1,6 раза больше, чем во втором. В случае поглощения паров (или газов) повышение энергии адсорбции в микропорах приводит к резкому возрастанию адсорбционной способности в области малых равновесных давлений. В таких промышленных адсорбентах, как активные угли или синтетические цеолиты, размеры микропор соизмеримы с размерами промежутков между порами, образованных веществом адсорбента. Это приводит к тому, что все атомы или молекулы вещества адсорбента находятся во взаимодействии с молекулами адсорбата в микропорах, то есть во всем пространстве микропор существует поле адсорбционных сил. В этом заключается основное отличие адсорбции в микропорах от адсорбции в более крупных порах. Адсорбция в микропорах сводится к объемному заполнению адсорбционного пространства микропор адсорбируемыми молекулами. Основными параметрами микропор являются их объем и обобщенная характеристика их размеров.
Переходные
поры.
Эффективные радиусы мезопор гораздо
больше размеров адсорбируемых молекул
и колеблются от 15 до 1000-2000 А.
Стенки таких пор образованы очень
большим числом атомов или молекул
вещества адсорбента. Для этого случая
приобретает физический смысл понятие
о поверхности раздела фаз, то есть о
поверхности пор адсорбента. Обычно
поверхность адсорбента относят к единице
его массы и пользуются понятием
Макропоры имеют эффективные радиусы больше 1000-2000 А. Их удельная поверхность очень мала от 0,5 до 2 м 2/г, вследствие чего адсорбцией на поверхности этих пор можно пренебречь. Объем макропор у активных углей составляет от 0,2 до 0,8 см3/г.
Все адсорбенты в соответствии с преобладающим размером пор делят на три класса: макропористые, мезопористые и микропористые. Некоторые макропористые адсорбенты применяются в хроматографии, где адсорбируются органические вещества, имеющие молекулы большого размера. К переходнопористым адсорбентам принадлежит большое число силикагелей, алюмогелей, алюмосиликатных катализаторов, а также многие виды природных глин, применяемых для удаления относительно крупных молекул из различных жидких сред, например, при очистке масел. Типичными представителями микропористых адсорбентов являются дегидратированные кристаллические алюмосиликаты – цеолиты и некоторые типы активных углей. Подавляющее большинство промышленных адсорбентов, применяемых для очистки газов и рекуперации паров, например, активные угли и силикагели, содержат широкую гамму пор различного размера и относятся к смешанным структурным типам.
Адсорбционные равновесия. Типы изотерм адсорбции.
Всякий технологический адсорбционный процесс, независимо от того, по какой схеме он осуществляется – периодической или непрерывной, включает ряд обязательных стадий, в первую очередь, стадию адсорбции и десорбции. Только комплексное рассмотрение равновесных и кинетических закономерностей позволяет выявить оптимальные условия осуществления процесса в целом. Большинство промышленных адсорбционных процессов основано на избирательном поглощении отдельных компонентов парогазовой смеси из потока газа-носителя. Адсорбционная способность при поглощении пара или газа зависит от типа адсорбента, его пористой структуры, природы поглощаемого вещества, его парциального давления и температуры.
При равновесии для выбранной системы адсорбент – адсорбтив количество поглощенного газа или пара является функцией парциального давления поглощаемого вещества и температуры:
а = f (p, T),
это уравнение является термическим, то есть оно справедливо в любых заданных температурных условиях процесса. В качестве характеристики адсорбционных свойств пористых тел используют зависимость адсорбционной способности от давления при постоянной температуре (изотерму адсорбции)
а = f (p) при Т=const.
Изотерма адсорбции является источником информации о структуре адсорбента, тепловом эффекте адсорбции и ряде других физико-химических и технологических характеристик. Брунауэр выделил пять основных типов изотерм адсорбции
Рис. 1. Основные типы изотерм адсорбции
В
случае технических адсорбентов тип I
характерен для микропористых адсорбентов,
практически не содержащих переходных
пор. Начальные выпуклые участки изотерм
типов II
и IV
указывают на присутствие существенного
объема микропор наряду с макро и
мезопорами. Менее крутой начальный
подъем кривых характерен для
переходнопористых адсорбентов, где
осуществляется моно- и полимолекулярная
адсорбция. Вогнутые начальные участки
редко встречающихся изотерм типов III
и V
характерны для систем, где взаимодействие
молекул адсорбата с адсорбентом намного
меньше межмолекулярного взаимодействия
молекул адсорбата, например, вызванного
проявлением водородных связей. Основное
отличие изотерм II
от IV
и III
от V
типов заключается в том, что объем
переходных пор (IV
и V
типы) в результате капиллярной конденсации
заполняется адсорбатом раньше, чем
относительное давление приблизится к
единице. В результате этого на изотермах
появляется верхний, почти горизонтальный
участок. При описании адсорбционного
равновесия количества поглощенного
вещества обычно выражают в молях на
грамм адсорбента, граммах на 100 г
адсорбента ( то есть в массовых %), а
иногда в граммах на см
Кинетика адсорбции
Кинетика адсорбции рассматривает вопросы диффузии в единичных гранулах адсорбента и скорость отработки адсорбционной емкости этих гранул. Кинетику адсорбции в потоке газа изучают, используя единичные гранулы адсорбента и слой толщиной в одну гранулу. На экспериментальных установках получают первичную информацию о скорости адсорбции, то есть о скорости насыщения гранулы адсорбатом. Обычно в качестве основной кинетической зависимости принимают изменение адсорбционной емкости во времени в потоке газа-адсорбтива а = f () или степени отработки адсорбционной емкости от времени
= а/а = f (), а – равновесная адсорбционная емкость.
Ч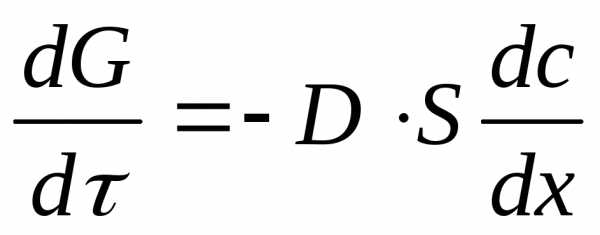 тобы
провести опыт в чисто внутридиффузионной
области и исключить фактор влияния
скорости подвода вещества к внешней
поверхности гранулы, предварительно
проводят серию опытов при разных
последовательно увеличивающихся
скоростях потока. При этом выбирают
такую минимальную скорость потока, выше
которой дальнейшее увеличение скорости
уже не приводит к изменению формы
кинетической кривой. Обычно влияние
фактора подвода вещества на скорость
отработки адсорбционной емкости гранул
практически исключается при линейной
скорости потока 0,25 м/с и объемной
скорости 1,5 л/см3 мин и выше.
тобы
провести опыт в чисто внутридиффузионной
области и исключить фактор влияния
скорости подвода вещества к внешней
поверхности гранулы, предварительно
проводят серию опытов при разных
последовательно увеличивающихся
скоростях потока. При этом выбирают
такую минимальную скорость потока, выше
которой дальнейшее увеличение скорости
уже не приводит к изменению формы
кинетической кривой. Обычно влияние
фактора подвода вещества на скорость
отработки адсорбционной емкости гранул
практически исключается при линейной
скорости потока 0,25 м/с и объемной
скорости 1,5 л/см3 мин и выше.
Коэффициент диффузии
Проникновение адсорбата внутрь зерна адсорбента процесс диффузионный, и следовательно, характеризуется коэффициентом диффузии. Под коэффициентом диффузии понимают количество вещества, диффундирующего в единицу времени через квадратный см поверхности при градиенте концентрации, равном единице. В технической адсорбции D определяют по приближенной зависимости
D = kr2/20,5,
где r – радиус гранулы; k – коэффициент, зависящий от формы гранул; – время полуотработки адсорбционной емкости, то есть промежуток времени, прошедший от начала опыта до того момента, когда количество адсорбированного вещества достигнет 50% от равновесной адсорбционной емкости. Для шара k = 0,308. Для цилиндра значение k зависит от соотношения длины гранулы к радиусу. Численное значение коэффициента диффузии, как правило находится в интервале (1-20)10-5 см2/г
Виды переноса вещества в пористом теле
Поскольку промышленные адсорбенты отличаются разнообразием пористой структуры, то это и определяет особенности механизма переноса в пористом теле.
1) В крупных порах, когда диаметр пор больше средней длины свободного пробега молекул адсорбента, преимущественным видом переноса является нормальная или объемная диффузия.
Основным уравнением кинетики диффузионных процессов в гомогенной среде являются законы Фика. При стационарной адсорбции диффузия происходит в направлении выравнивания концентрации поглощаемого вещества, причем градиент концентрации постоянен во времени. В этом случае скорость адсорбции выражается первым законом Фика: (1)
где G – количество диффундирующего вещества; dG/d – скорость диффузии или диффузионный поток; D – коэффициент диффузии (знак минус указывает на уменьшение концентрации адсорбтива в направлении потока; S – поверхность, перпендикулярная направлению потока; c – концентрация адсорбтива в газовой фазе; х – координата длины; dc/dx – градиент концентрации.
Уравнение (1) используют в работах теоретического плана – при изучении механизма переноса адсорбтива в транспортных порах на специальных установках, в которых обеспечивается постоянство градиента концентрации.
Для практических целей больший интерес представляет изучение нестационарной диффузии. Нестационарная диффузия сопровождается адсорбцией, когда концентрация адсорбата в твердой фазе изменяется и градиент концентрации непостоянен. Для описания нестационарной адсорбции пользуются вторым законом Фика:
(2)
где а – концентрация адсорбата в адсорбированном состоянии.
Скорость нормальной диффузии определяется числом столкновений молекул газа друг с другом. Коэффициент диффузии в этом случае зависит от средней длины тепловой скорости молекул и средней длины свободного пробега молекул : D = 1/3 . (3)
Величины и , а следовательно, и коэффициент диффузии возрастают при повышении температуры. В приближенных расчетах принимают:
D ~ T1,75 (4)
2) При малом размере пор, когда длина свободного пробега молекул намного больше радиуса пор, фактором, определяющим скорость диффузии, становится частота соударений со стенками пор. Такая диффузия называется молекулярной или кнудсеновской. При столкновении адсорбирующихся молекул с поверхностью они некоторый интервал времени фиксируются на активных центрах адсорбента, а после этого, благодаря тепловому движению, удаляются в газовую фазу. коэффициент молекулярной диффузии определяется средней тепловой скоростью движения молекул и диаметром поры dп:
D = 1/3 dп. (5)
В то же время:
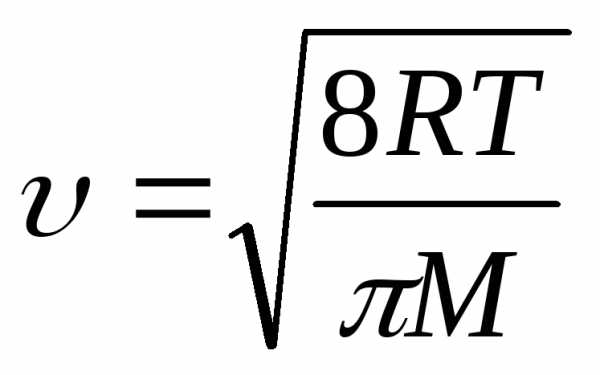
(6)
где М – относительная молекулярная масса газа.
Следовательно, коэффициент молекулярной диффузии и температура связаны следующей зависимостью:
D ~ T 0,5 (7)
3) Если поры по размерам соизмеримы с поглощаемыми молекулами, адсорбционный процесс приобретает активированный характер. По аналогии с представлениями Аррениуса, развитыми для химической реакции, при активированной адсорбции не все молекулы могут проникнуть в поры и быть там поглощенными, а лишь те, которые обладают некоторым избыточным запасом энергии. Этот избыток называют энергией активации.
Коэффициент диффузии связан с энергией активации Еа следующей зависимостью:
D=D0 exp-(Ea/RT) (8)
где D0 – предэкспоненциальный множитель.
Величина предэкспоненциального множителя зависит от природы, как адсорбента, так и адсорбтива. Например, предадсорбция полярных веществ на цеолите приводит к частичной блокировке входных окон и, как следствие, понижению скорости сорбции и уменьшению величины D0.
Связь между энергией активации и коэффициентом диффузии (уравнение 8) используют для вычисления энергии активации на основе экспериментальных данных. Для этого исследуют кинетические кривые адсорбции конкретного вещества при двух температурах Т1 и Т2. Соответствующие им коэффициенты диффузии могут быть определены по уравнениям:
D1 = D0 exp-(Ea1/RT1) (9)
D2 = D0 exp-(Ea2/RT2) (10)
Энергия активации практически постоянна, если интервал исследуемых температур Т1-Т2 невелик. СледовательноЕа1 Еа2 = Еа
Отсюда:
(11)(12)(13)
Соотношение коэффициентов диффузии может быть заменено на соотношение времен отработки их адсорбционной емкости до любой степени, например 50 %:
(14)
Энергия активации увеличивается по мере приближения диаметра входного окна поры к диаметру молекул адсорбтива. Например, при переходе от цеолита NaA к КА разница между определяющим размером пор и критическим диаметром молекул становится меньше одного ангстрема, при этом наблюдается резкий рост энергии активации. Таким образом, энергию активации можно рассматривать как молекулярно ситовую характеристику цеолитов.
Зависимость энергии активации от диаметра входного окна d0 описывается уравнением
Еа = Е0 ехр (A dкр/d0)
где Е0 – предэкспоненциальный множитель, А – постоянная величина для каждого адсорбтива, dкр – критический диаметр молекул адсорбата.
Энергия активации зависит также от размера катиона, входящего в состав цеолита. Здесь играют роль два противоположных фактора: с одной стороны, чем меньше катион, тем больше диаметр входного окна и легче проникновение молекул адсорбата в адсорбционную полость, с другой стороны, крупные катионы легче деформируются, способствуя проникновению адсорбируемых молекул.
4) Интенсивность переноса вещества в гранулах промышленных адсорбентов усиливается благодаря миграции молекул по поверхности пор. Этот вид переноса получил названиеповерхностной диффузии. Движение молекул по поверхности происходит скачкообразно. Если длину скачка обозначить через , а время пребывания молекулы в адсорбированном состоянии через , то коэффициент поверхностной диффузии определится из соотношения
D = 2/4 (15)
В
то же время: 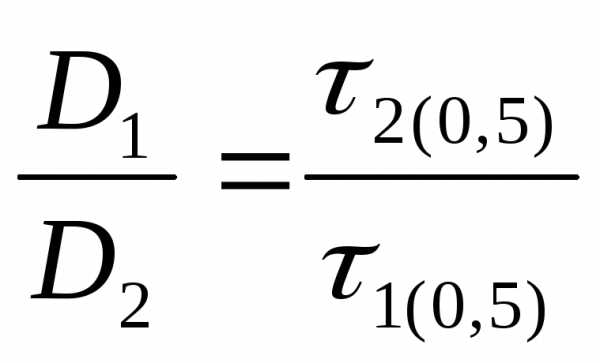
= 0 ехр (Е0/RT)
(16)
= 0 ехр (Е0/RT)
(16)
где 0 – период колебания атомов в структуре адсорбента, приблизительно равный 10-13 с.
Тогда:
(17)В этой формулеD0 – коэффициент диффузии двухмерного газа на идеально однородной поверхности, при Т или Еа=0.
Коэффициент поверхностной диффузии связан с температурой следующей зависимостью: D Tn e–Ea/RT (18)
где n может изменяться от 0,5 до 1,5.
При повышении температуры уменьшается адсорбционная способность и градиент концентрации в адсорбированной фазе. Поэтому роль поверхностной диффузии в общей скорости переноса вещества падает.
studfiles.net
АДСОРБЦИЯ • Большая российская энциклопедия
АДСО́РБЦИЯ (от лат. ad – на и sorbeo – поглощать), поглощение вещества из газовой фазы или жидкого раствора поверхностным слоем твёрдого тела или жидкости. Явление А. вызывается наличием адсорбц. cилового поля, создаваемого за счёт нескомпенсированности межмолекулярных cил в поверхностном слое. Вещество, создающее такое поле, называется адсорбентом, вещество, молекулы которого могут адсорбироваться, – адсорбтивом, уже адсорбиров. вещество – адсорбатом. Процесс, обратный А., – десорбция. А. – частный случай сорбции. Применение адсорбц. процессов датируется кон. 18 в., когда независимо и практически одновременно появились три публикации: итал. натуралист Ф. Фонтана и К. Шееле в 1777 описали поглощение газов древесным углем, в 1785 Т. Е. Ловиц обнаружил способность таких углей обесцвечивать растворы винных кислот, поглощая органич. примеси.
Физич. А. вызывается силами молекулярного взаимодействия. Осн. вклад в энергию взаимодействия вносят дисперсионные силы. Их величина приблизительно постоянна для адсорбентов любой химич. природы, поэтому вызываемое этими силами взаимодействие носит неспецифич. характер. Иногда дисперсионное взаимодействие усиливается электростатическим – ориентационным и индукционным. Электростатич. взаимодействие зависит от химич. природы адсорбтива, следовательно, является специфическим. Специфич. взаимодействие может усиливаться за счёт образования водородных связей между адсорбиров. молекулами и полярными группами, находящимися на поверхности адсорбента (напр., водородные связи образуются при А. воды и спиртов на силикагеле, поверхность которого покрыта гидроксильными группами). Теплота физич. А. составляет, как правило, 8–25 кДж/моль. Физич. А. можно обратить, понизив давление газа или концентрацию растворённого вещества. Физич. А. не вызывает изменений индивидуальных свойств молекул адсорбата. Поглощение вещества может быть обусловлено образованием химич. связи между молекулами адсорбата и поверхностным слоем адсорбента. Такое поглощение называется хемосорбцией. Хемосорбция необратима, её теплота св. 80 кДж/моль. При хемосорбции молекулы адсорбата образуют поверхностные химич. соединения с адсорбентом.
Равновесная адсорбция
Если скорости А. и десорбции равны, то это свидетельствует об установлении адсорбц. равновесия. Кривые зависимости равновесной А. от концентрации или давления адсорбтива при постоянной темп-ре называются изотермами А. Наиболее простая изотерма А. представляет собой прямую, выходящую из начала координат, где на оси абсцисс отложено давление адсорбтива $p$ (или концентрация $c$), по оси ординат – величина адсорбции $a$. Эта область А. называется областью Генри: $a=Γp, Γ$ – коэф. Генри.
И. Ленгмюром была предложена (1914–1918) теория мономолекулярной локализов. А. (молекулы адсорбата не передвигаются по поверхности) при следующих допущениях: поверхность однородна, т. е. все адсорбц. центры имеют одинаковое сродство к молекулам адсорбтива; молекулы адсорбата не взаимодействуют друг с другом. Уравнение Ленгмюра имеет вид: $a=a_{макс}bp/(1+bp)$ или $p=a/b(a_{макс}-a)$, где $a$ – количество адсорбиров. вещества, $a_{макс}$ – предельная величина А. в плотном монослое, $p$ – давление адсорбтива, $b$ – адсорбц. коэф. Полимолекулярная, или многослойная, А., при которой молекулы пара, адсорбируясь, образуют плёнку толщиной в неск. монослоёв, описывается уравнением Брунауэра – Эммета – Теллера (уравнение БЭТ, 1938):$$a=\frac{a_{макс}Cp/p_0}{(1-p/p_0)[1+(C-1)p/p_0},$$где $p_0$ – давление насыщенного пара при темп-ре А., $C$ – константа. Уравнение БЭТ применяют для определения удельной поверхности адсорбентов.
В 1914 М. Полани предложена потенциальная теория А., согласно которой вблизи поверхности адсорбента существует потенциальное адсорбц. поле, убывающее с расстоянием от поверхности; давление адсорбтива, равное вдали от поверхности $p$, вблизи неё возрастает и на некотором расстоянии достигает значения $p_0$, при котором адсорбтив конденсируется.
Адсорбенты обычно разделяют на непористые (радиусы кривизны поверхностей которых весьма велики и стремятся к бесконечности) и пористые. Пористые адсорбенты содержат микро-, супермикро-, мезо- и макропоры (см. Пористость). В макропорах А. крайне мала, её обычно не учитывают при оценке адсорбц. свойств адсорбентов. Характерная особенность А. в микро- и супермикропорах – повышение энергии А. по сравнению с поглощением вещества на непористом адсорбенте той же химич. природы. Этот эффект является результатом наложения полей поверхностных сил противоположных стенок пор. В микро- и супермикропорах А. происходит объёмно, в мезопорах – по механизму послойного заполнения, завершаемого капиллярной конденсацией.
Для микропористых адсорбентов М. М. Дубинин разработал теорию объёмного заполнения микропор (ТОЗМ). Введя представление о функции распределения объёмов пор по значениям химич. потенциала адсорбата в них, Дубинин и Л. В. Радушкевич получили (1947) уравнение изотермы А., которое записывается в виде: $W/W_0=exp[–(A/βE_0)^2]$, где $W$ и $W_0$ – текущая и предельная величины А. пара в единице объёма, $A$ – дифференциальная мольная работа адсорбции, $A=RT\ln(p_0/p)$, $R$ – универсальная газовая постоянная, $T$ – абсолютная темп-ра, $E_0$ – характеристич. энергия адсорбции стандартного пара (обычно бензола или азота), $β$ – коэф. подобия, аппроксимируемый отношением парахоров адсорбируемого и стандартного веществ.
Уравнение Дубинина – Радушкевича применимо для описания изотерм А. в интервале относит. равновесных давлений от 5·10–4 до 0,4 на адсорбентах с однородной микропористой структурой, т. е. адсорбентах, в которых отсутствуют супермикропоры. Т. к. в адсорбц. технике микропористые адсорбенты получили наибольшее распространение, ТОЗМ применяется не только в физико-химич. исследованиях, но и в инженерных расчётах.
Кинетика и динамика адсорбции
Элементарный акт А. осуществляется практически мгновенно. Поэтому временны́е зависимости А. лимитируются в осн. механизмом диффузии вещества к месту А. Диффуз. процессы определяются концентрацией адсорбтива, темп-рой, химич. природой и пористой структурой адсорбента, концентрацией др. веществ в объёме и на поверхности. А. в порах протекает значительно медленнее, чем на открытой поверхности. А. из жидких растворов происходит с меньшей скоростью, чем из газовых смесей. Зависимость величины А. от времени называют кинетической кривой А.
Кинетику А. в потоке газа изучают, используя единичные гранулы адсорбента и слой толщиной в одну гранулу. На практике обычно применяют слои адсорбента, толщина которых существенно превышает слой в одно зерно, т. е. изучают А. в динамич. условиях. При изучении динамики А. через слой адсорбента пропускают газовый или жидкостный поток, содержащий адсорбируемые вещества, и измеряют нарастание концентрации адсорбируемого вещества за слоем адсорбента как функцию времени. Появление за слоем поглощаемого вещества называется проскоком, время до проскока – временем защитного действия. Зависимость концентрации данного компонента за слоем от времени – выходная кривая, из анализа которой получают полную информацию об эффективности адсорбц. процесса.
Технологическое оформление адсорбционных процессов
Широко распространены установки с неподвижным слоем адсорбента, осн. узлом которых являются адсорберы – полые колонны, заполненные адсорбентом. Газовый или жидкостный поток, содержащий адсорбируемые компоненты, пропускается через шихту (слой адсорбента) до проскока адсорбтива; затем поток направляется в др. адсорбер. Целевые компоненты, поглощённые шихтой, извлекаются путём регенерации адсорбента (нагреванием адсорбера, вытеснением водяным паром и др.). Высокой производительностью характеризуются адсорбц. установки с псевдоожиженным («кипящим») слоем адсорбента, в которых газовый поток поступает в адсорбер снизу, приводя адсорбент во взвешенное состояние, что сокращает время А. и десорбции. Применяются установки с движущимся слоем адсорбента. В них адсорбент под действием силы тяжести медленно опускается, из нижней части адсорбера потоком воздуха направляется в вертикальную трубу, смонтированную параллельно адсорбц. колонне, и поднимает зёрна адсорбента в верхнюю часть колонны. Газовый поток, содержащий пары адсорбиров. веществ, поступает в ср. часть адсорбера и движется вверх к адсорбенту. В верхней части колонны непрерывно происходит А., в нижней – регенерация адсорбента. Широко используются т. н. короткоцикловые установки: при А. газ подаётся в адсорбер под значит. давлением, десорбция происходит из-за сброса давления, затем вновь давление поднимают.
В качестве адсорбентов применяют вещества с развитой поверхностью: активир. угли, силикагели, оксид алюминия, цеолиты; из непористых адсорбентов – технич. углерод (сажа) и высокодисперсный SiO2 (аэросил). См. также Сорбенты.
Адсорбция в природе и технологии
А. играет важную роль во мн. природных (напр., обогащение почв, образование вторичных рудных месторождений) и биологич. (функционирование клеточных мембран) процессах. Адсорбц. технологии широко применяют для очистки, осушки, разделения газовых и жидких смесей: очистки пром. выбросов и сточных вод, в т. ч. выбросов атомных электростанций, детоксикации загрязнённых почв, кондиционирования питьевой воды, разделения нефтей, извлечения драгоценных металлов из растворов и пульп, получения обогащённого кислородом воздуха, очистки лекарственных препаратов. Адсорбенты используют как наполнители при произ-ве полимеров, носители в катализе, в хроматографии, а также в медицине для извлечения вредных веществ, попавших в желудочно-кишечный тракт организма (энтеросорбция) или для очистки крови (гемосорбция). Явление А. используется при крашении тканей, в полиграфич., пищевой пром-сти, в радиоэлектронной технике и др.
bigenc.ru
адсорбция – это… Что такое адсорбция?
АДСО́РБЦИЯ -и; ж. [от лат. ad- – к и sorbere – поглощать, всасывать]. Поглощение вещества из газа или раствора поверхностным слоем жидкого или твёрдого адсорбента (используется в химии, технике и т.п. для разделения и очистки веществ).
◁ Адсорбцио́нный, -ая, -ое.
АДСО́РБЦИЯ (от лат. ad — на, при и sorbeo — поглощаю), поглощение какого-либо вещества (адсорбата) из газообразной среды или раствора поверхностным слоем жидкости или твердого тела (адсорбентом). Различают два вида адсорбции: физическую и химическую (хемосорбцию (см. ХЕМОСОРБЦИЯ)). Менее прочная физическая адсорбция не сопровождается существенными изменениями молекул адсорбата. Она обусловлена силами межмолекулярного взаимодействия (см. МЕЖМОЛЕКУЛЯРНОЕ ВЗАИМОДЕЙСТВИЕ), которые связывают молекулы в жидкостях и некоторых кристаллах и проявляются в поведении сильно сжатых газов. Существенное отличие физической адсорбции — ее обратимость. При хемосорбции молекулы адсорбата и адсорбента образуют химические соединения. Часто адсорбция обусловлена и физическими и химическими силами, поэтому не существует четкой границы между физической адсорбцией и хемосорбцией.Явление адсорбции связано с тем, что силы межмолекулярного взаимодействия на грАݐؑƐՠраздела фаз нескомпенсированы, и, следовательно, пограничный слой обладает избытком энергии – свободной поверхностной энергией (см. ПОВЕРХНОСТНАЯ ЭНЕРГИЯ). В результате притяжения поверхностью раздела фаз находящихся вблизи нее молекул адсорбата свободная поверхностная энергия уменьшается, т.е. процессы адсорбции энергетически выгодны. Адсорбция всегда является экзотермическим процессом, т. е. протекает с выделением теплоты адсорбции Hs.
Значения энтальпии (см. ЭНТАЛЬПИЯ) физической адсорбции достаточно велики (порядка 10 ккал/моль) из-за слабых атомных взаимодействий. Физическая адсорбция легко обратима, поэтому, например, в случае адсорбции газа, достаточно легко может осуществиться замена адсорбированного слоя газа другим газом. Это явление называется обменной адсорбцией.
Процесс адсорбции заканчивается установлением адсорбционного равновесия между адсорбентом и адсорбатом. Условием равновесия является равенство химических потенциалов обеих фаз. С ростом температуры или давления адсорбата в объеме увеличивается частота попаданий молекул адсорбата на поверхность адсорбента; пропорционально ей возрастает скорость адсорбции и увеличивается равновесное количество адсорбированных молекул. Кривые зависимости равновесной адсорбции от температуры или давления адсорбата называются, соответственно, изобарой и изотермой адсорбции.
Адсорбированные молекулы могут перемещаться по поверхности, совершая при этом колебательные движения, то приближаясь к поверхности, то удаляясь от нее. Время, в течение которого молекула находится на поверхности, называется временем адсорбции. С ростом температуры время адсорбции уменьшается: чем выше температура, тем интенсивнее колебательное движение, и больше вероятность того, что в процессе таких колебаний связь молекулы с поверхностью будет разорвана и молекула покинет поверхность. Процесс, при котором адсорбированные молекулы покидают поверхность, называется десорбция (см. ДЕСОРБЦИЯ). Скоростью адсорбции (десорбции) называется отношение количества молекул, адсорбирующихся (десорбирующихся) за единицу времени, к единице поверхности или массы адсорбента. Если скорости адсорбции и десорбции равны друг другу, устанавливается адсорбционное равновесие. В состоянии равновесия количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и др.).
В случае контакта поверхности кристалла и жидкого раствора из жидкости на поверхность твердого тела переходят молекулы, находящиеся в растворе. Между их концентрациями в растворе и на поверхности адсорбента устанавливается равновесие. Вещества, адсорбируемые из раствора, называются поверхностно-активными веществами (см. ПОВЕРХНОСТНО-АКТИВНЫЕ ВЕЩЕСТВА (ПАВ)) (ПАВ). Высокая адсорбируемость ПАВов связана с сильным снижением поверхностного натяжения (см. ПОВЕРХНОСТНОЕ НАТЯЖЕНИЕ) раствора на данной поверхности по сравнению с поверхностным натяжением чистого растворителя на этой же поверхности. Инактивные вещества повышают поверхностное натяжение и ухудшают адсорбцию.
Если теплота адсорбции сравнима с поверхностной энергией адсорбента, то в процессе адсорбции может существенно меняться кристаллическая структура поверхности твердого тела, причем при физической адсорбции перестройке подвергаются в основном поверхности молекулярных кристаллов, а в случае хемосорбции изменения поверхностной структуры наблюдаются даже для металлов и ионных кристаллов. Адсорбированные на поверхности пленки сильно изменяют свойства поверхности, а в ряде случаев затрагивают и более толстые приповерхностные слои.
Адсорбция играет важную роль во многих природных процессах, таких, как обогащение почв и образование вторичных рудных месторождений. Именно благодаря адсорбции осуществляется первая стадия поглощения различных веществ из окружающей среды клетками и тканями биологических систем, функционирование биологических мембран, первые этапы взаимодействия ферментов с субстратом, защитные реакции против токсичных веществ. Многие адсорбенты (активный уголь, каолин (см. КАОЛИН), иониты (см. ИОНИТЫ) и др.) служат противоядиями, поглощая и удаляя из организма вредные вещества. Адсорбенты обычно имеют большую удельную поверхность — до нескольких сотен м2/г. В промышленности адсорбцию осуществляют в специальных аппаратах — адсорберах; применяют для осушки газов, очистки органических жидкостей и воды, улавливания ценных или вредных отходов производства.
dic.academic.ru
Адсорбция.
Коллоидная химия
Адсорбция.
Сорбция
Сорбцией (от латинского sorbeo – поглощаю, втягиваю) называют любой процесс поглощения одного вещества (сорбтива) другим (сорбентом), независимо от механизма поглощения.
В зависимости от механизма сорбции различают адсорбцию, абсорбцию, хемосорбцию и капилярную конденсацию.
Адсорбция
Адсорбция это процесс, происходящий на границе раздела фаз. Он затрагиваетолько поверхностные слои, взаимодействующих фаз, и не распространяется на глубинные слои этих фаз.
Адсорбцией называют явление накопления одного вещества на поверхности другого. В общем случае, адсорбцией называют изменение концентрации вещества на границе раздела фаз.
Абсорбция
Абсорбция, в отличии от адсорбции, это процесс захватывающий не только поверхность раздела фаз, но распространяющийся на весь объём сорбента.
Примером процесса абсорбции является растворение газов в жидкости.
Хемосорбция
Хемосорбцией называется поглощение одного вещества другим, сопровождающееся их химическим взаимодействием.
Капилярная конденсация
Капиллярная конденсация — сжижение пара в капиллярах, щелях или порах в твердых телах.
Явление конденсации отлично от физической адсорбции.
Таким образом, сорбционные процессы различны по их механизму. Однако, любой сорбционный процесс начинается с адсорбции на границе соприкасающихся фаз, которые могут быть жидкими, газообразными или твёрдыми.
Адсорбция
Напомним, что адсорбцией называют явление накопления одного вещества на поверхности другого. В общем случае, адсорбцией называют изменение концентрации вещества на границе раздела фаз.
Адсорбция происходит на любых межфазовых поверхностях и адсорбироваться могут любые вещества.
Адсорбционное равновесие, т.е. равновесное распределение вещества между пограничным слоем и граничащими фазами является динамическим равновесием и быстро устанавливается.
Адсорбция понижается с понижением температуры.
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтивом, поглощённое — адсорбатом. Вещество, на поверхности которого происходит адсорбция – адсорбентом.
Адсорбция представляет собой обратимый процесс. Процесс, обратный адсорбции, называется десорбцией.
Удаление адсорбированных веществ с адсорбентов при помощи растворителей называют элюцией.
Различают молекулярную и ионную адсорбцию. Это различение происходит в зависимости от того, что адсорбируется – молекулы или ионы вещества.
Адсорбция на поверхности жидкостей
На поверхности жидкостей могут адсорбироваться частицы веществ, растворённых в жидкостях. Адсорбция сопровождает процесс растворения, влияя на распределение частичек растворённого вещества между поверхностным слоем растворителя и внутренним его объёмом.
В соответствии со вторым началом термодинамики поверхностная энергия жидкостей стремится к минимуму. В чистых растворителях уменьшение этой энергии происходит путём сокращения поверхности.
В растворах поверхностная энергия может понижаться или увеличиваться за счёт изменения концентрации частиц в поверхностном слое жидкости.
Гиббсом было установлено, что распределение растворяемого в жидкости вещества происходит так, чтобы достигалось максимальное уменьшение поверхностного натяжения.
Он же предложил уравнение, определяющее величину адсорбции Г, т.е избытка вещества, накапливающегося в 1 см2 поверхностного слоя, имеющего толщину примерно в одну молекулу, по сравнению с содержанием этого вещества в таком же объёме внутри жидкости.
Где Δσ – изменение поверхностного натяжения, соответствующее изменению концентрации ΔС. Величина Δσ/ΔС называется поверхностной активностью.
Следовательно, адсорбция Г зависит от величины поверхностной активности и концентрации вещества С.
Если при этом поверхностное натяжение уменьшается, то адсорбция Г имеет положительное значение.
Положительная адсорбция. Поверхностно-активные вещества.
Чем сильнее вещество понижает поверхностное натяжение, тем больше оно будет накапливаться в поверхностном слое.
Концентрация растворённого вещества в поверхностном слое станет значительно выше, чем в остальном объёме жидкости. Возникающая разность концентраций неизбежно вызовет диффузию, которая будет направлена из поверхностного слоя внутрь жидкости и явится препятствием для полного перехода всех растворённых частиц в поверхностный слой. Установится подвижное адсорбционное равновесие между растворённым веществом в поверхностном слое и остальном объёме жидкости.
Адсорбцию, сопровождающуюся накоплением вещества в поверхностном слое, называют положительной. Пределом её служит полное насыщение поверхностного слоя адсорбируемым веществом.
Положительно адсорбирующиеся вещества называют также поверхностно-активными веществами (ПАВ). В водных растворах роль ПАВов будут играть вещества с жирной и дифильной природой (жиры, большинство жирных кислот, кетоны, спирты, холестерин и др.).
Отрицательная адсорбция. Поверхностно-инактивные вещества.
Если растворённое вещество увеличивает поверхностное натяжение, то оно будет выталкиваться из поверхностного слоя внутрь адсорбента. Такую адсорбцию называют отрицательной.
Пределом отрицательной адсорбции является полное вытеснение адсорбтива из поверхностного слоя внутрь адсорбента (растворителя).
В результате разности концентраций возникнет диффузия, которая будет направлена в поверхностный слой. Поэтому в поверхностном слое всегда окажется некоторое количество адсорбтива.
Вещества, резко повышающие поверхностное натяжение, почти не содержатся в поверхностном слое разбавленных растворов. Лишь значительное увеличение концентрации подобных растворов приводит к перемещению в поверхностный слой заметных количеств растворённого вещества, что сопровождается увеличением поверхностного натяжения.
Отрицательно адсорбирующиеся вещества называются поверхностно-инактивными.
Адсорбция и поверхносное натяжение биологических жидкостей
Отрицательная и положительная адсорбция различных веществ в крови и протоплазме клеток имеет большое значение для обмена веществ в живых организмах.
Поверхностное натяжение биологических жидкостей значительно ниже, чем воды. Поэтому гидрофобные вещества, например кислоты жирного ряда, стероиды, будут накапливаться у стенок сосудов, клеточных мембран, что облегчает их проникновение сквозь эти мембраны.
Жидкость | Поверхностное натяжение эрг/см2 |
|---|---|
Ртуть | 430,0 |
Вода | 72,7 |
Глицерин | 65,0 |
Сыворотка крови человека (при 38 С) | 46 – 47 |
Этиловый спирт | 22,0 |
Эфир | 16 |
Цитоплазма амёб (на границе с маслом) | 0,5 – 1,5 |
Для адсорбции из водных растворов большое значение имеет наличие у молекул полярных (гидрофильных) и неполярных (гидрофобных) групп.
Так, в молекуле масляной кислоты имеется полярная группа СООН и гидрофобная углеводородная цепь:
Молекулы обладающие одновременно обеими видами групп, называются дифильными.
У дифильной молекулы с короткой гидрофобной цепью преобладают гидрофильные свойства, поэтому такие молекулы хорошо растворяются в воде, адсорбируясь отрицательно.
С удлинением углеводородной цепи усиливаются гидрофобные свойства молекул и понижается их растворимость в воде.
Следовательно, к поверхностно-активным веществам принадлежат вещества дифильной структуры, имеющие меньшее, чем растворитель, поверхностное натяжение, и растворение которых приводит к положительной адсорбции, вызывая понижение поверхностного натяжения.
Поверхностно-инактивные вещества обладают противоположными свойствами.
Одновременно с увеличением гидрофобных свойств молекул повышается их поверхностная активность. Так удлинение цепи в гомологическом ряду жирных кислот, спиртов, аминов и др. на радикал –СН2– увеличивает их способность к положительной адсорбции в разбавленных растворах в 3,2 раза (правило Траубе-Дюкло).
Поверхностные плёнки
Молекулы веществ с преобладанием гидрофобных свойств (жирные кислоты с большим молекулярным весом и др.) располагаются в основном на поверхности воды, образуя поверхностные плёнки.
При небольшом количестве таких молекул поверхностной плёнки не образуется. Если же молекул много, то они располагаются упорядоченно, одна рядом с другой, причём их гидрофобные части выступают над водной поверхностью, образуя так называемый частокол Лэнгмюра.
1 – беспорядочное расположение дифильных молекул; 2 – частокол Лэнгмюра; 3 – избыток молекул; 4 – гидрофильная часть молекул; 5 – гидрофобная часть молекул;
Поверхностная плёнка образуется мономолекулярным слоем молекул, каждая из которых занимает на поверхности воды определённую площадь. Толщину слоя и площадь, занимаемую каждой молекулой, можно расчитать.
Так, молекулы жирных кислот, имеющие по одной полярной группе (масляная, валериановая, каприновая кислоты и т.п.) занимают на поверхности воды площадь 21 · 10-16 см2, независимо от длины углеводородной цепи.
Жирные кислоты с двумя полярными группами (например, олеиновая кислота) занимает площадь, вдвое большую, а молекулы с тремя полярными группами (например, тристеарин) – втрое большую площадь и т.д.
При избытке вещества с преимущественно гидрофобными свойствами его молекулы располагаются над молекулярной плёнкой.
Кессонная болезнь
Образование поверхностных плёнок нередко затрудняет процесс фильтрации.
На границе раздела воздух–вода в пузырьках воздуха, находящихся в растворе, может адсорбироваться поверхностно-активное вещество. Плёнка этого вещества образует как-бы оболочку вокруг пузырька. Такой пузырёк при продавливании через узкие поры в фильтре не способен резко деформироваться и поэтому может закупорить более крупные отверстия в фильтре, чем пузырёк без плёнки.
У водолазов, работающих на больших глубинах, иногда возникает, так называемая, кесонная болезнь. В их скафандры воздух подаётся под давлением и, следовательно, в крови водолазов растворяется повышенное количество газов.
При слишком быстром поднятии на поверхность давление в скафандрах резко понижается, и значительная часть газов крови выделяется в виде пузырьков, на которых образуется поверхностная плёнка из содержащихся в крови поверхностно-активных веществ.
Пузырьки газов закупоривают мелкие сосуды в различных тканях и органах, что приводит к тяжёлому заболеванию или даже гибели человека.
Подобная же паталогия может возникнуть и в результате резкого падения атмосферного давления при разгерметизации скафандров лётчиков и кабин самолётов при высотных полётах.
Для лечения кессонной болезни больного помещают в барокамеру, где создают большое давление. Пузырьки газов вновь растворяются в крови. В течении нескольких суток давление в барокамере медленно снижают. За это время избыточный газ из крови столь же медленно удаляется через лёгкие, не создавая закупорок.
Адсорбция твёрдыми телами
Твёрдыми телами могут адсорбироваться газы и пары, а также молекулы и ионы растворённых веществ.
Природа сил, вызывающих адсорбцию
Адсорбция на твёрдых телах может быть объяснена наличием силовых полей притяжения, возникающих за счёт неуравновешенных связей в кристалической решётке.
На выступающих участках твёрдого адсорбента (на активных центрах) адсорбция идёт особенно сильно. Так выступы на частичке угля в 4,5 раза интенсивнее адсорбируют кислород, чем углубления на его поверхности.
Адсорбционные силы слагаются из валентных сил взаимодействия (химических) и более слабых ван-дер-ваальсовых (физических). Роль тех и других при разных случаях адсорбции различна. Так, в самом начале адсорбции большинства газов, когда их давление мало, наблюдается химическая адсорбция. С увеличением давления она уступает место физической, которая в основном определяет адсорбцию газов.
Адсорбционные силы могут быть достаточно велики. Так, для полного удаления со стекла адсорбированных молекул воды его необходимо сильно нагревать в вакууме.
Адсорбенты, обладающие мощными силовыми полями, оказываются сплошь покрытыми адсорбированными частицами. При незначительных же адсорбционных силах только более активные центры покрываеются адсорбируемыми частицами.
На адсорбцию влияет не только природа адсорбента, но и адсорбтива. Так, на твёрдых адсорбентах сильнее адсорбируются те газы, которые легче сжижаются, т.е. критическая температура которых выше.
Обратимость адсорбции
Адсорбция представляет собой обратимый процесс. Адсорбированные частицы не остаются не остаются неподвижными. Они удерживаются на адсорбенте всего сотые и тысячные доли секунды и, десорбируясь, замещаются на новые частицы. К тому же они не являются строго фиксированными на адсорбенте, а могут перемещаться по его поверхности. В итоге устанавливается динамическое адсорбционное равновесие между свободными и адсорбированными частицами.
Скорость адсорбции
Скорость адсорбции имеет большое значение для практического использования различных адсорбентов.
Например, в противогазе проходящий через коробку воздух должен очень быстро очищаться от примесей отравляющих веществ, что возможно лишь при высоких скоростях адсорбционных процессов.
Необходимо указать, что активированный уголь в противогазе играет роль не только адсорбента ряда отравляющих веществ, но и катализатора реакций разложения некоторых из них.
В частности, активированный уголь катализирует гидролиз фосгена:
COCl2 + h3O = HCl + CO2.
Повышение температуры понижает физическую адсорбцию адсорбцию, так как при этом усиливается движение молекул в адсорбционном слое, нарушается ориентация адсорбированных молекул, т.е. увеличивается десорбция.
С другой стороны увеличение температуры увеличивает энергию адсорбированных частиц, что усиливает химическую адсорбцию.
Следовательно, в одних случаях повышение температуры усиливает десорбцию, в других – увеличивает адсорбцию.
Так, для большинства газов повышение температуры уменьшает адсорбцию. В то же время увеличение температуры от –185 до +20°С в 10 раз увеличивает адсорбцию кислорода платиной, так как при этом возрастает химическая адсорбция.
Повышение давления газов и паров увеличивает адсорбцию.
Капилярная конденсация
При адсорбции паров наблюдают так называемую капилярную конденсацию, протекающую на угле и других пористых адсорбентах.
Сконденсировавшаяся в капилярах жидкость образует вогнутый мениск, над которым пар оказывается насыщенным при более низком давлении, чем над плоской поверхностью. Это повышает конденсацию паров в капилярах адсорбента.
Капилярная конденсация особенно выражена у легко сжижаемых газов.
Хемосорбция
При хемосорбции вещество вступает с адсорбентом в химическую реакцию, например:
O2 + 2Cu = 2CuO.
Если вновь образующиеся при хемосорбции молекулы диффундируют в глубь вещества адсорбента, то достижение сорбционного равновесия наступает медленнее, так как оно зависит от скорости диффузии.
Если же при хемосорбции на поверхности сорбента возникают недиффундирующие молекулы, т.е. образуется плёнка, то она тормозит и со временем останавливает процесс хемосорбции.
Так, пластинка алюминия, сорбируя кислород, покрывается плёнкой из оксида оалюминия, что быстро прекращает процесс хемосорбции:
4Al + 3O2 = 2Al2O3.
Хемосорбция, как и всякая химическая реакция, может быть экзо- или эндотермической. Следовательно повышение температуры усиливает одни хемосорбционные процессы и ослабляет другие.
Полностью разграничить адсорбцию и хемосорбцию нельзя. Обычно эти два процесса протекают совместно.
xn—-7sbb4aandjwsmn3a8g6b.xn--p1ai
Адсорбция – это… Что такое Адсорбция?
Адсорбция (лат. ad — на, при; sorbeo — поглощаю) — это, в широком смысле, процесс изменения концентрации у поверхности раздела двух фаз, а в более узком и употребительном — это повышение концентрации одного вещества (газ, жидкость) у поверхности другого вещества (жидкость, твердое тело).
Основные понятия
Поглощаемое вещество, ещё находящееся в объёме фазы, называют адсорбтив, поглощённое — адсорбат. В более узком смысле под адсорбцией часто понимают поглощение примеси из газа или жидкости твёрдым веществом (в случае газа и жидкости) или жидкостью (в случае газа) — адсорбентом. При этом, как и в общем случае адсорбции, происходит концентрирование примеси на границе раздела адсорбент-жидкость либо адсорбент-газ. Процесс, обратный адсорбции, то есть перенос вещества с поверхности раздела фаз в объём фазы, называется десорбция. Если скорости адсорбции и десорбции равны, то говорят об установлении адсорбционного равновесия. В состоянии равновесия количество адсорбированных молекул остается постоянным сколь угодно долго, если неизменны внешние условия (давление, температура и состав системы)[1].
Адсорбция и хемосорбция
На поверхности раздела двух фаз помимо адсорбции, обусловленной в основном физическими взаимодействиями (главным образом это Ван-дер-Ваальсовы силы), может идти химическая реакция. Этот процесс называется хемосорбцией. Чёткое разделение на адсорбцию и хемосорбцию не всегда возможно. Одним из основных параметров по которым различаются эти явления является тепловой эффект: так, тепловой эффект физической адсорбции обычно близок к теплоте сжижения адсорбата, тепловой эффект хемосорбции значительно выше. Кроме того в отличие от адсорбции хемосорбция обычно является необратимой и локализованной. Примером промежуточных вариантов, сочетающих черты и адсорбции и хемосорбции является взаимодействие кислорода на металлах и водорода на никеле: при низких температурах они адсорбируются по законам физической адсорбции, но при повышении температуры начинает протекать хемосорбция.
Схожие явления
В предыдущем разделе говорилось о случае протекания гетерогенной реакции на поверхности- хемосорбции. Однако бывают случаи гетерогенных реакций по всему объему, а не только на поверхности- это обычная гетерогенная реакция. Поглощение по всему объёму может проходить и под воздействием физических сил- этот случай называется абсорбцией.
| Виды взаимодействий | Взаимодействия только на поверхности | Взаимодействия по всему объёму |
|---|---|---|
| Физические | Адсорбция | Абсорбция |
| Химические | Хемосорбция | Гетерогенная реакция |
Физическая адсорбция
| Модели физической адсорбции | |
| Образование монослоя | Энергетическая диаграмма |
| Рис. 1: a) адсорбент, b) адсорбат, c) адсорбтив (газовая фаза или раствор) | Рис. 2: a) адсорбент, b) адсорбат, c) газовая фаза, d – расстояние, E – энергия, Eb – энергия адсорбции, (1) десорбция, (2) адсорбция |
| Поликонденсация | Избирательная адсорбция |
| Рис. 3: a) адсорбент, b) адсорбат, c) конденсат, d) адсорбтив (газовая фаза или раствор) | Рис. 4: a) адсорбент, b) адсорбат, c) адсорбтивы (газовая фаза или раствор): показана преимущественная адсорбция частиц голубого цвета |
Причиной адсорбции являются неспецифические (то есть не зависящие от природы вещества) Ван-дер-Ваальсовы силы. Адсорбция, осложнённая химическим взаимодействием между адсорбентом и адсорбатом, является особым случаем. Явления такого рода называют хемосорбцией и химической адсорбцией. «Обычную» адсорбцию в случае, когда требуется подчеркнуть природу сил взаимодействия, называют физической адсорбцией.
Физическая адсорбция является обратимым процессом, условие равновесия определяется равными скоростями адсорбции молекул адсорбтива P на вакантных местах поверхности адсорбента S* и десорбции — освобождения адсорбата из связанного состояния S − P:
- ;
уравнение равновесияя в таком случае:
- ,
где K — константа равновесия, [S − P] и [S*] — доли поверхности адсорбента, занятые и незанятые адсорбатом, а [P] — концентрация адсорбтива.
Количественно процесс физической мономолекулярной адсорбции в случае, когда межмолекулярным взаимодействием адсорбата можно пренебречь, описывается уравнением Ленгмюра:
- ,
где — доля площади поверхности адсорбента, занятая адсорбатом, — адсорбционный коэффициент Ленгмюра, а P — концентрация адсорбтива.
Поскольку и, соответственно, , уравнение адсорбционного равновесия может быть записано следующим образом:
Уравнение Ленгмюра является одной из форм уравнения изотермы адсорбции. Под уравнением изотермы адсорбции (чаще применяют сокращённый термин — изотерма адсорбции) понимают зависимость равновесной величины адсорбции от концентрации адсорбтива a=f(С) при постоянной температуре (T=const). Концентрация адсорбтива для случая адсорбции из жидкости выражается, как правило, в мольных либо массовых долях. Часто, особенно в случае адсорбции из растворов, пользуются относительной величиной: С/Сs, где С — концентрация, Сs — предельная концентрация (концентрация насыщения) адсорбтива при данной температуре. В случае адсорбции из газовой фазы концентрация может быть выражена в единицах абсолютного давления, либо, что особенно типично для адсорбции паров, в относительных единицах: P/Ps, где P — давление пара, Ps — давление насыщенных паров этого вещества. Саму величину адсорбции можно выразить также в единицах концентрации (отношение числа молекул адсорбата к общему числу молекул на границе раздела фаз). Для адсорбции на твёрдых адсорбентах, особенно при рассмотрении практических задач, используют отношение массы или количества поглощённого вещества к массе адсорбента, например мг/г или ммоль/г.
Значение адсорбции
Адсорбция — всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ и адсорбция примесей из газа либо жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее распространённая форма — активированный уголь), силикагели, цеолиты а также некоторые другие группы природных минералов и синтетических веществ.
Адсорбция (особенно хемосорбция) имеет также важное значение в гетерогенном катализе. Пример адсорбционных установок приведён на странице азотные установки.
Установка для проведения адсорбции называется адсорбером.
См. также
Примечания
Литература
- Фролов Ю. Г. Курс коллоидной химии. Поверхностные явления и дисперсные системы. – М.: Химия, 1989. – 464 с.
- Кельцев Н. В. Основы адсорбционной техники. – М.: Химия, 1984. – 592 с.
- Грег С., Синг К. Адсорбция, удельная поверхность, пористость. – М.: Мир, 1984. – 310 с.*
- Адамсон А. Физическая химия поверхностей. – М.: Мир. 1979. – 568 с.
- Оура К., Лифшиц В. Г., Саранин А. А. и др. Введение в физику поверхности / Под ред. В. И. Сергиенко. — М.: Наука, 2006. — 490 с.
- Карнаухов А.П. Адсорбция. Текстура дисперсных и пористых материалов. — Новосибирск: Наука. 1999. — 470 с.
- Химическая энциклопедия. Т. 1. — М.: Советская энциклопедия, 1990. — 623 с.
- Полторак О.М. Термодинамика в физической химии. — М.: Высшая школа, 1991. — 319 с.
Ссылки
dic.academic.ru
Лекция 4. Адсорбция
4
Адсорбция
Адсорбция является универсальным методом, позволяющим практически полностью извлечь примесь из газовой или жидкой среды. В химической промышленности, в частности в ТНВ, адсорбционный метод широко используется для гладкой очистки и осушки технологических потоков, улучшения качества сырья и продуктов и является одним из методов защиты окружающей среды.
Адсорбция – это концентрирование веществ на поверхности или в объеме твердого тела. В процессе адсорбции участвуют как минимум два компонента. Твердое вещество, на поверхности или в объеме которого происходит концентрирование поглощаемого вещества, называется адсорбентом. Поглощаемое вещество, находящееся в газовой или жидкой фазе называется адсорбтивом, а после того, как оно перешло в адсорбированное состояние – адсорбатом. Любое твердое вещество обладает поверхностью, и следовательно, потенциально является адсорбентом. Однако, в технике используют твердые адсорбенты с развитой внутренней поверхностью. Развитие внутренней поверхности в твердом теле достигается путем создания специальных условий в процессе его синтеза или в результате дополнительной обработки.
С термодинамической точки зрения адсорбция проявляется с уменьшением свободной энергии Гиббса (G). Как и все процессы, сопровождающие уменьшением энергии Гиббса, адсорбция является самопроизвольным процессом. Переход вещества из газовой или жидкой фазы в адсорбированное состояние связан с потерей по меньшей мере одной степени свободы, (трехмерная объемная газовая или жидкая фаза двухмерная поверхностная фаза), что ведет к уменьшению энтропии системы (S). Поскольку энтальпия (Н) связана с энергией Гиббса и энтропией уравнением Н = G + TS, то в процессе адсорбции она убывает, и следовательно, адсорбция – процесс экзотермический.
Адсорбционные явления делят на два основных типа: физическую адсорбцию и хемосорбцию (сорбцию, основанную на силах химического взаимодействия). Физическая адсорбция вызывается силами молекулярного взаимодействия: дисперсионными и электростатическими. Дисперсионные силы вносят основной вклад в энергию взаимодействия молекул. Так, молекулы любого адсорбтива обладают флуктуирующими диполями и квадруполями, вызывающими мгновенные отклонения распределения электронной плотности от среднего распределения. При сближении молекул адсорбтива с атомами или молекулами адсорбента движение флуктуирующих диполей приобретает систематический и строго упорядоченный характер, что приводит к возникновению притяжения между ними. В ряде случаев дисперсионные силы усиливаются электростатическими силами – ориентационными и индукционными. Ориентационные силы возникают при взаимодействии полярных молекул с поверхностью, содержащей, электростатические заряды (ионы, диполи), а индукционные – вызываются изменением электронной структуры молекул адсорбтива и адсорбента под действием друг друга.
В отличие от физической адсорбции, при хемосорбции не сохраняется индивидуальность адсорбтива и адсорбента. При сближении молекул адсорбтива с поверхностью адсорбента происходит перераспределение электронов взаимодействующих компонентов с образованием химической связи. Если физическую адсорбцию можно сравниь с конденсацией, то хемосорбция рассматривается как химический процесс, протекающий на поверхности раздела фаз.
Физическую адсорбцию и хемосорбцию можно отличить на основании численного значения теплоты адсорбции. Теплота адсорбции компонентов промышленных газов соизмерима с теплотой их конденсации и не превышает 85-125 кДж/моль. Теплота хемосорбции одного моля вещества достигает нескольких сотен кДж. Хемосорбция, как правило, протекает с небольшой скоростью, это обстоятельство часто используется для ее распознания. Кроме того, хемосорбция может протекать при высоких температурах, когда физическая адсорбция пренебрежимо мала. При хемоморбции характерным является резкое, скачкообразное изменение поглотительной способности по извлекаемому компоненту при переходе от адсорбента одной химической природы к адсорбенту другой природы. При хемосорбции адсорбированные молекулы не могут перемещаться по поверхности адсорбента, их положение фиксировано, и такая адсорбция называется локализованной. Физическая адсорбция может быть как локализованной, так и не локализованной. Обычно, при повышении температуры молекулы приобретают подвижность и характер процесса изменяется: локализованная адсорбция переходит в нелокализованную.
Структура и применение промышленных адсорбентов
Большинство промышленных адсорбентов отличается «ажурной» внутренней структурой, включающей поры различного размера. При этом решающее влияние на адсорбционную способность и скорость поглощения оказывает содержание мелких пор в единице объема или массы адсорбента. В зависимости от размеров поры подразделяют на три типа: микро-, мезо- (переходные) и макропоры.
Микропоры – наиболее мелкие поры, имеют размеры, соизмеримые с размерами адсорбируемых молекул. Их эффективные радиусы находятся в интервале от 5 до 15А. Суммарный объем промышленных адсорбентов обычно не превышает 0,5 см3/г. Характерной чертой адсорбции в микропорах является существенное повышение энергии адсорбции по сравнению с адсорбцией в более крупных порах. Например, при одинаковом количестве поглощенного n-гексана активным углем с микропорами и макропористой активной сажей энергия адсорбции в первом случае в 1,6 раза больше, чем во втором. В случае поглощения паров (или газов) повышение энергии адсорбции в микропорах приводит к резкому возрастанию адсорбционной способности в области малых равновесных давлений. В таких промышленных адсорбентах, как активные угли или синтетические цеолиты, размеры микропор соизмеримы с размерами промежутков между порами, образованных веществом адсорбента. Это приводит к тому, что все атомы или молекулы вещества адсорбента находятся во взаимодействии с молекулами адсорбата в микропорах, то есть во всем пространстве микропор существует поле адсорбционных сил. В этом заключается основное отличие адсорбции в микропорах от адсорбции в более крупных порах. Адсорбция в микропорах сводится к объемному заполнению адсорбционного пространства микропор адсорбируемыми молекулами. Основными параметрами микропор являются их объем и обобщенная характеристика их размеров.
Переходные поры. Эффективные радиусы мезопор гораздо больше размеров адсорбируемых молекул и колеблются от 15 до 1000-2000 А. Стенки таких пор образованы очень большим числом атомов или молекул вещества адсорбента. Для этого случая приобретает физический смысл понятие о поверхности раздела фаз, то есть о поверхности пор адсорбента. Обычно поверхность адсорбента относят к единице его массы и пользуются понятием удельной поверхности. Для мезопор действие адсорбционных сил проявляется не во всем их объеме, а только на небольшом расстоянии от стенок. Поэтому на поверхности пор происходит мономолекулярная или полимолекулярная адсорбция паров, то есть образование последовательных адсорбционных слоев, завершающееся заполнением пор по механизму капиллярной конденсации. Основными параметрами переходных пор являются удельная поверхность, объем пор и функция распределения объема пор по размерам. В зависимости от количества пор и их радиусов удельные поверхности мезопористых адсорбентов могут находится в интервале от 10 до 500 м2/г. С помощью переходных пор осуществляется подвод вещества к микропорам, и их еще называют транспортными порами.
Макропоры имеют эффективные радиусы больше 1000-2000 А. Их удельная поверхность очень мала от 0,5 до 2 м2/г, вследствие чего адсорбцией на поверхности этих пор можно пренебречь. Объем макропор у активных углей составляет от 0,2 до 0,8 см3/г.
Все адсорбенты в соответствии с преобладающим размером пор делят на три класса: макропористые, мезопористые и микропористые. Некоторые макропористые адсорбенты применяются в хроматографии, где адсорбируются органические вещества, имеющие молекулы большого размера. К переходнопористым адсорбентам принадлежит большое число силикагелей, алюмогелей, алюмосиликатных катализаторов, а также многие виды природных глин, применяемых для удаления относительно крупных молекул из различных жидких сред, например, при очистке масел. Типичными представителями микропористых адсорбентов являются дегидратированные кристаллические алюмосиликаты – цеолиты и некоторые типы активных углей. Подавляющее большинство промышленных адсорбентов, применяемых для очистки газов и рекуперации паров, например, активные угли и силикагели, содержат широкую гамму пор различного размера и относятся к смешанным структурным типам.
Адсорбционные равновесия. Типы изотерм адсорбции.
Всякий технологический адсорбционный процесс, независимо от того, по какой схеме он осуществляется – периодической или непрерывной, включает ряд обязательных стадий, в первую очередь, стадию адсорбции и десорбции. Только комплексное рассмотрение равновесных и кинетических закономерностей позволяет выявить оптимальные условия осуществления процесса в целом. Большинство промышленных адсорбционных процессов основано на избирательном поглощении отдельных компонентов парогазовой смеси из потока газа-носителя. Адсорбционная способность при поглощении пара или газа зависит от типа адсорбента, его пористой структуры, природы поглощаемого вещества, его парциального давления и температуры.
При равновесии для выбранной системы адсорбент – адсорбтив количество поглощенного газа или пара является функцией парциального давления поглощаемого вещества и температуры:
а = f (p, T),
это уравнение является термическим, то есть оно справедливо в любых заданных температурных условиях процесса. В качестве характеристики адсорбционных свойств пористых тел используют зависимость адсорбционной способности от давления при постоянной температуре (изотерму адсорбции)
а = f (p) при Т=const.
Изотерма адсорбции является источником информации о структуре адсорбента, тепловом эффекте адсорбции и ряде других физико-химических и технологических характеристик. Брунауэр выделил пять основных типов изотерм адсорбции
Рис. 1. Основные типы изотерм адсорбции
В случае технических адсорбентов тип I характерен для микропористых адсорбентов, практически не содержащих переходных пор. Начальные выпуклые участки изотерм типов II и IV указывают на присутствие существенного объема микропор наряду с макро и мезопорами. Менее крутой начальный подъем кривых характерен для переходнопористых адсорбентов, где осуществляется моно- и полимолекулярная адсорбция. Вогнутые начальные участки редко встречающихся изотерм типов III и V характерны для систем, где взаимодействие молекул адсорбата с адсорбентом намного меньше межмолекулярного взаимодействия молекул адсорбата, например, вызванного проявлением водородных связей. Основное отличие изотерм II от IV и III от V типов заключается в том, что объем переходных пор (IV и V типы) в результате капиллярной конденсации заполняется адсорбатом раньше, чем относительное давление приблизится к единице. В результате этого на изотермах появляется верхний, почти горизонтальный участок. При описании адсорбционного равновесия количества поглощенного вещества обычно выражают в молях на грамм адсорбента, граммах на 100 г адсорбента ( то есть в массовых %), а иногда в граммах на см3 адсорбента.
Кинетика адсорбции
Кинетика адсорбции рассматривает вопросы диффузии в единичных гранулах адсорбента и скорость отработки адсорбционной емкости этих гранул. Кинетику адсорбции в потоке газа изучают, используя единичные гранулы адсорбента и слой толщиной в одну гранулу. На экспериментальных установках получают первичную информацию о скорости адсорбции, то есть о скорости насыщения гранулы адсорбатом. Обычно в качестве основной кинетической зависимости принимают изменение адсорбционной емкости во времени в потоке газа-адсорбтива а = f () или степени отработки адсорбционной емкости от времени
= а/а = f (), а – равновесная адсорбционная емкость.
Ч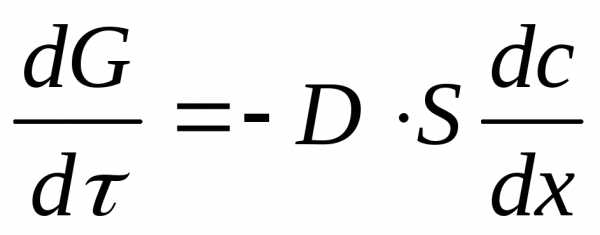 тобы
провести опыт в чисто внутридиффузионной
области и исключить фактор влияния
скорости подвода вещества к внешней
поверхности гранулы, предварительно
проводят серию опытов при разных
последовательно увеличивающихся
скоростях потока. При этом выбирают
такую минимальную скорость потока, выше
которой дальнейшее увеличение скорости
уже не приводит к изменению формы
кинетической кривой. Обычно влияние
фактора подвода вещества на скорость
отработки адсорбционной емкости гранул
практически исключается при линейной
скорости потока 0,25 м/с и объемной
скорости 1,5 л/см3 мин и выше.
тобы
провести опыт в чисто внутридиффузионной
области и исключить фактор влияния
скорости подвода вещества к внешней
поверхности гранулы, предварительно
проводят серию опытов при разных
последовательно увеличивающихся
скоростях потока. При этом выбирают
такую минимальную скорость потока, выше
которой дальнейшее увеличение скорости
уже не приводит к изменению формы
кинетической кривой. Обычно влияние
фактора подвода вещества на скорость
отработки адсорбционной емкости гранул
практически исключается при линейной
скорости потока 0,25 м/с и объемной
скорости 1,5 л/см3 мин и выше.
Коэффициент диффузии
Проникновение адсорбата внутрь зерна адсорбента процесс диффузионный, и следовательно, характеризуется коэффициентом диффузии. Под коэффициентом диффузии понимают количество вещества, диффундирующего в единицу времени через квадратный см поверхности при градиенте концентрации, равном единице. В технической адсорбции D определяют по приближенной зависимости
D = kr2/20,5,
где r – радиус гранулы; k – коэффициент, зависящий от формы гранул; – время полуотработки адсорбционной емкости, то есть промежуток времени, прошедший от начала опыта до того момента, когда количество адсорбированного вещества достигнет 50% от равновесной адсорбционной емкости. Для шара k = 0,308. Для цилиндра значение k зависит от соотношения длины гранулы к радиусу. Численное значение коэффициента диффузии, как правило находится в интервале (1-20)10-5 см2/г
Виды переноса вещества в пористом теле
Поскольку промышленные адсорбенты отличаются разнообразием пористой структуры, то это и определяет особенности механизма переноса в пористом теле.
1) В крупных порах, когда диаметр пор больше средней длины свободного пробега молекул адсорбента, преимущественным видом переноса является нормальная или объемная диффузия.
Основным уравнением кинетики диффузионных процессов в гомогенной среде являются законы Фика. При стационарной адсорбции диффузия происходит в направлении выравнивания концентрации поглощаемого вещества, причем градиент концентрации постоянен во времени. В этом случае скорость адсорбции выражается первым законом Фика: (1)
где G – количество диффундирующего вещества; dG/d – скорость диффузии или диффузионный поток; D – коэффициент диффузии (знак минус указывает на уменьшение концентрации адсорбтива в направлении потока; S – поверхность, перпендикулярная направлению потока; c – концентрация адсорбтива в газовой фазе; х – координата длины; dc/dx – градиент концентрации.
Уравнение (1) используют в работах теоретического плана – при изучении механизма переноса адсорбтива в транспортных порах на специальных установках, в которых обеспечивается постоянство градиента концентрации.
Для практических целей больший интерес представляет изучение нестационарной диффузии. Нестационарная диффузия сопровождается адсорбцией, когда концентрация адсорбата в твердой фазе изменяется и градиент концентрации непостоянен. Для описания нестационарной адсорбции пользуются вторым законом Фика:
(2)
где а – концентрация адсорбата в адсорбированном состоянии.
Скорость нормальной диффузии определяется числом столкновений молекул газа друг с другом. Коэффициент диффузии в этом случае зависит от средней длины тепловой скорости молекул и средней длины свободного пробега молекул : D = 1/3 . (3)
Величины и , а следовательно, и коэффициент диффузии возрастают при повышении температуры. В приближенных расчетах принимают:
D ~ T1,75 (4)
2) При малом размере пор, когда длина свободного пробега молекул намного больше радиуса пор, фактором, определяющим скорость диффузии, становится частота соударений со стенками пор. Такая диффузия называется молекулярной или кнудсеновской. При столкновении адсорбирующихся молекул с поверхностью они некоторый интервал времени фиксируются на активных центрах адсорбента, а после этого, благодаря тепловому движению, удаляются в газовую фазу. коэффициент молекулярной диффузии определяется средней тепловой скоростью движения молекул и диаметром поры dп:
D = 1/3 dп. (5)
В то же время:
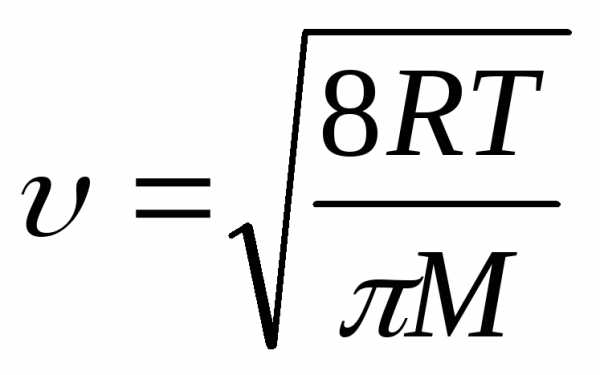
(6)
где М – относительная молекулярная масса газа.
Следовательно, коэффициент молекулярной диффузии и температура связаны следующей зависимостью:
D ~ T 0,5 (7)
3) Если поры по размерам соизмеримы с поглощаемыми молекулами, адсорбционный процесс приобретает активированный характер. По аналогии с представлениями Аррениуса, развитыми для химической реакции, при активированной адсорбции не все молекулы могут проникнуть в поры и быть там поглощенными, а лишь те, которые обладают некоторым избыточным запасом энергии. Этот избыток называют энергией активации.
Коэффициент диффузии связан с энергией активации Еа следующей зависимостью:
D=D0 exp-(Ea/RT) (8)
где D0 – предэкспоненциальный множитель.
Величина предэкспоненциального множителя зависит от природы, как адсорбента, так и адсорбтива. Например, предадсорбция полярных веществ на цеолите приводит к частичной блокировке входных окон и, как следствие, понижению скорости сорбции и уменьшению величины D0.
Связь между энергией активации и коэффициентом диффузии (уравнение 8) используют для вычисления энергии активации на основе экспериментальных данных. Для этого исследуют кинетические кривые адсорбции конкретного вещества при двух температурах Т1 и Т2. Соответствующие им коэффициенты диффузии могут быть определены по уравнениям:
D1 = D0 exp-(Ea1/RT1) (9)
D2 = D0 exp-(Ea2/RT2) (10)
Энергия активации практически постоянна, если интервал исследуемых температур Т1-Т2 невелик. СледовательноЕа1 Еа2 = Еа
Отсюда:
(11)(12)(13)
Соотношение коэффициентов диффузии может быть заменено на соотношение времен отработки их адсорбционной емкости до любой степени, например 50 %:
(14)
Энергия активации увеличивается по мере приближения диаметра входного окна поры к диаметру молекул адсорбтива. Например, при переходе от цеолита NaA к КА разница между определяющим размером пор и критическим диаметром молекул становится меньше одного ангстрема, при этом наблюдается резкий рост энергии активации. Таким образом, энергию активации можно рассматривать как молекулярно ситовую характеристику цеолитов.
Зависимость энергии активации от диаметра входного окна d0 описывается уравнением
Еа = Е0 ехр (A dкр/d0)
где Е0 – предэкспоненциальный множитель, А – постоянная величина для каждого адсорбтива, dкр – критический диаметр молекул адсорбата.
Энергия активации зависит также от размера катиона, входящего в состав цеолита. Здесь играют роль два противоположных фактора: с одной стороны, чем меньше катион, тем больше диаметр входного окна и легче проникновение молекул адсорбата в адсорбционную полость, с другой стороны, крупные катионы легче деформируются, способствуя проникновению адсорбируемых молекул.
4) Интенсивность переноса вещества в гранулах промышленных адсорбентов усиливается благодаря миграции молекул по поверхности пор. Этот вид переноса получил названиеповерхностной диффузии. Движение молекул по поверхности происходит скачкообразно. Если длину скачка обозначить через , а время пребывания молекулы в адсорбированном состоянии через , то коэффициент поверхностной диффузии определится из соотношения
D = 2/4 (15)
В
то же время: 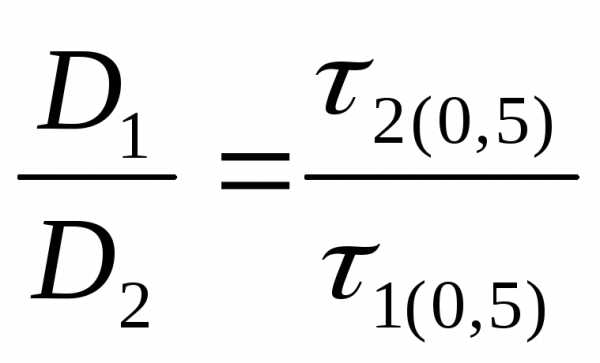
= 0 ехр (Е0/RT)
(16)
= 0 ехр (Е0/RT)
(16)
где 0 – период колебания атомов в структуре адсорбента, приблизительно равный 10-13 с.
Тогда:
(17)В этой формулеD0 – коэффициент диффузии двухмерного газа на идеально однородной поверхности, при Т или Еа=0.
Коэффициент поверхностной диффузии связан с температурой следующей зависимостью: D Tn e–Ea/RT (18)
где n может изменяться от 0,5 до 1,5.
При повышении температуры уменьшается адсорбционная способность и градиент концентрации в адсорбированной фазе. Поэтому роль поверхностной диффузии в общей скорости переноса вещества падает.
studfiles.net
Адсорбция – «Энциклопедия»
АДСОРБЦИЯ (от латинского ad – на и sorbeo поглощать), поглощение вещества из газовой фазы или жидкого раствора поверхностным слоем твёрдого тела или жидкости.
Явление адсорбции вызывается наличием адсорбционного силового поля, создаваемого за счёт нескомпенсированности межмолекулярных сил в поверхностном слое. Вещество, создающее такое поле, называется адсорбентом, вещество, молекулы которого могут адсорбироваться, – адсорбтивом, уже адсорбированное вещество – адсорбатом. Процесс, обратный адсорбции, – десорбция.
Адсорбция – частный случай сорбции. Применение адсорбционных процессов датируется концом 18 века, когда независимо и практически одновременно появились три публикации: итальянский натуралист Ф. Фонтана и К. Шееле в 1777 году описали поглощение газов древесным углем, в 1785 году Т. Е. Ловиц обнаружил способность таких углей обесцвечивать растворы винных кислот, поглощая органические примеси.
Физическая адсорбция вызывается силами молекулярного взаимодействия. Основной вклад в энергию взаимодействия вносят дисперсионные силы. Их величина приблизительно постоянна для адсорбентов любой химической природы, поэтому вызываемое этими силами взаимодействие носит неспецифический характер. Иногда дисперсионное взаимодействие усиливается электростатическим – ориентационным и индукционным. Электростатическое взаимодействие зависит от химической природы адсорбтива, следовательно, является специфическим. Специфическое взаимодействие может усиливаться за счёт образования водородных связей между адсорбированными молекулами и полярными группами, находящимися на поверхности адсорбента (например, водородные связи образуются при адсорбции воды и спиртов на силикагеле, поверхность которого покрыта гидроксильными группами). Теплота физической адсорбции составляет, как правило, 8-25 кДж/моль. Физическую адсорбцию можно обратить, понизив давление газа или концентрацию растворённого вещества. Физическая адсорбция не вызывает изменений индивидуальных свойств молекул адсорбата. Поглощение вещества может быть обусловлено образованием химической связи между молекулами адсорбата и поверхностным слоем адсорбента. Такое поглощение называется хемосорбцией. Хемосорбция необратима, её теплота свыше 80 кДж/моль. При хемосорбции молекулы адсорбата образуют поверхностные химические соединения с адсорбентом.
Реклама
Равновесная адсорбция. Если скорости адсорбции и десорбции равны, то это свидетельствует об установлении адсорбционного равновесия. Кривые зависимости равновесной адсорбции от концентрации или давления адсорбтива при постоянной температуре называются изотермами адсорбции. Наиболее простая изотерма адсорбции представляет собой прямую, выходящую из начала координат, где на оси абсцисс отложено давление адсорбтива р (или концентрация с), по оси ординат – величина адсорбции а. Эта область адсорбции называется областью Генри: а = Гр, Г – коэффициент Генри.
И. Ленгмюром была предложена (1914-1918) теория мономолекулярной локализованной адсорбции (молекулы адсорбата не передвигаются по поверхности) при следующих допущениях: поверхность однородна, то есть все адсорбционные центры имеют одинаковое сродство к молекулам адсорбтива; молекулы адсорбата не взаимодействуют друг с другом. Уравнение Ленгмюра имеет вид: а = а = амаксbр/(1+bр) или р = а/b(амакс – а), где а – количество адсорбированного вещества, амакс – предельная величина адсорбции в плотном монослое, р – давление адсорбтива, b – адсорбционный коэффициент. Полимолекулярная, или многослойная, адсорбция, при которой молекулы пара, адсорбируясь, образуют плёнку толщиной в несколько монослоёв, описывается уравнением Брунауэра – Эммета – Теллера (уравнение БЭТ, 1938 год):
где р0 – давление насыщенного пара при температуре адсорбции, С – константа. Уравнение БЭТ применяют для определения удельной поверхности адсорбентов.
В 1914 году М. Полани предложена потенциальная теория адсорбции, согласно которой вблизи поверхности адсорбента существует потенциальное адсорбционное поле, убывающее с расстоянием от поверхности; давление адсорбтива, равное вдали от поверхности р, вблизи неё возрастает и на некотором расстоянии достигает значения р0, при котором адсорбтив конденсируется.
Адсорбенты обычно разделяют на непористые (радиусы кривизны поверхностей которых весьма велики и стремятся к бесконечности) и пористые. Пористые адсорбенты содержат микро-, супермикро-, мезо- и макропоры (смотри Пористость). В макропорах адсорбция крайне мала, её обычно не учитывают при оценке адсорбционного свойств адсорбентов. Характерная особенность адсорбции в микро- и супермикропорах – повышение энергии адсорбции по сравнению с поглощением вещества на непористом адсорбенте той же химической природы. Этот эффект является результатом наложения полей поверхностных сил противоположных стенок пор. В микро- и супермикропорах адсорбция происходит объёмно, в мезопорах – по механизму послойного заполнения, завершаемого капиллярной конденсацией.
Для микропористых адсорбентов М. М. Дубинин разработал теорию объёмного заполнения микропор (ТОЗМ). Введя представление о функции распределения объёмов пор по значениям химического потенциала адсорбата в них, Дубинин и Л. В. Радушкевич получили (1947 год) уравнение изотермы адсорбции, которое записывается в виде: W/W0 = ехр[-(A/βE0)2], где W и W0 – текущая и предельная величины адсорбции пара в единице объёма, А – дифференциальная мольная работа адсорбции, А = RTln(p0/p), R – универсальная газовая постоянная, Т – абсолютная температура, Е0 – характеристическая энергия адсорбции стандартного пара (обычно бензола или азота), β – коэффициент подобия, аппроксимируемый отношением парахоров адсорбируемого и стандартного веществ.
Уравнение Дубинина – Радушкевича применимо для описания изотерм адсорбции в интервале относительных равновесных давлений от 5?10-4 до 0,4 на адсорбентах с однородной микропористой структурой, то есть адсорбентах, в которых отсутствуют супермикропоры. Так как в адсорбционной технике микропористые адсорбенты получили наибольшее распространение, ТОЗМ применяется не только в физико-химических исследованиях, но и в инженерных расчётах.
Кинетика и динамика адсорбции. Элементарный акт адсорбции осуществляется практически мгновенно. Поэтому временные зависимости адсорбции лимитируются в основном механизмом диффузии вещества к месту адсорбции. Диффузные процессы определяются концентрацией адсорбтива, температурой, химической природой и пористой структурой адсорбента, концентрацией других веществ в объёме и на поверхности. Адсорбция в порах протекает значительно медленнее, чем на открытой поверхности. Адсорбция из жидких растворов происходит с меньшей скоростью, чем из газовых смесей. Зависимость величины адсорбции от времени называют кинетической кривой адсорбции.
Кинетику адсорбции в потоке газа изучают, используя единичные гранулы адсорбента и слой толщиной в одну гранулу. На практике обычно применяют слои адсорбента, толщина которых существенно превышает слой в одно зерно, то есть изучают адсорбцию в динамических условиях. При изучении динамики адсорбции через слой адсорбента пропускают газовый или жидкостный поток, содержащий адсорбируемые вещества, и измеряют нарастание концентрации адсорбируемого вещества за слоем адсорбента как функцию времени. Появление за слоем поглощаемого вещества называется проскоком, время до проскока – временем защитного действия. Зависимость концентрации данного компонента за слоем от времени – выходная кривая, из анализа которой получают полную информацию об эффективности адсорбционного процесса.
Технологическое оформление адсорбционных процессов. Широко распространены установки с неподвижным слоем адсорбента, основным узлом которых являются адсорберы – полые колонны, заполненные адсорбентом. Газовый или жидкостный поток, содержащий адсорбируемые компоненты, пропускается через шихту (слой адсорбента) до проскока адсорбтива; затем поток направляется в другой адсорбер. Целевые компоненты, поглощённые шихтой, извлекаются путём регенерации адсорбента (нагреванием адсорбера, вытеснением водяным паром и другим). Высокой производительностью характеризуются адсорбционные установки с псевдоожиженным («кипящим») слоем адсорбента, в которых газовый поток поступает в адсорбер снизу, приводя адсорбент во взвешенное состояние, что сокращает время адсорбции и десорбции. Применяются установки с движущимся слоем адсорбента. В них адсорбент под действием силы тяжести медленно опускается, из нижней части адсорбер потоком воздуха направляется в вертикальную трубу, смонтированную параллельно адсорбционных колонн, и поднимает зёрна адсорбента в верхнюю часть колонны. Газовый поток, содержащий пары адсорбированных веществ, поступает в среднюю часть адсорбера и движется вверх к адсорбенту. В верхней части колонны непрерывно происходит адсорбция, в нижней – регенерация адсорбента. Широко используются так называемые короткоцикловые установки: при адсорбции газ подаётся в адсорбер под значительным давлением, десорбция происходит из-за сброса давления, затем вновь давление поднимают.
В качестве адсорбентов применяют вещества с развитой поверхностью: активированные угли, силикагели, оксид алюминия, цеолиты; из непористых адсорбентов – технический углерод (сажа) и высокодисперсный SiO2 (аэросил). Смотри также Сорбенты.
Адсорбция в природе и технологии. Адсорбция играет важную роль во многих природных (например, обогащение почв, образование вторичных рудных месторождений) и биологических (функционирование клеточных мембран) процессах. Адсорбционные технологии широко применяют для очистки, осушки, разделения газовых и жидких смесей: очистки промышленных выбросов и сточных вод, в том числе выбросов атомных электростанций, детоксикации загрязнённых почв, кондиционирования питьевой воды, разделения нефтей, извлечения драгоценных металлов из растворов и пульп, получения обогащённого кислородом воздуха, очистки лекарственных препаратов. Адсорбенты используют как наполнители при производстве полимеров, носители в катализе, в хроматографии, а также в медицине для извлечения вредных веществ, попавших в желудочно-кишечный тракт организма (энтеросорбция) или для очистки крови (гемосорбция). Явление адсорбции используется при крашении тканей, в полиграфической, пищевой промышленностях, в радиоэлектронной технике и др.
Лит.: Брунауер С. Адсорбция газов и паров. М., 1948. Т. 1; Бур Я. де. Динамический характер адсорбции. М., 1962; Дубинин М. М. Адсорбция и пористость. М., 1976; он же. Современное состояние теории объемного заполнения микропор углеродных адсорбентов//Известия Академии Наук СССР. Сер. химическая. 1991. № 1; Кельцев Н. В. Основы адсорбционной техники. 2-е изд. М., 1984; Жуховицкий А. А., Шварцман Л. А. Физическая химия. 5-е изд. М., 2001.
Н. С. Поляков.
knowledge.su