Как происходит процесс разложения воды электрическим током
Чистая, дистиллированная вода почти совершенно не проводит электрического тока.
Она обладает огромным сопротивлением. Например, сопротивление кубического сантиметра дважды перегнанной воды равно сопротивлению медной проволоки сечением в квадратный миллиметр, длина которой равна примерно 200 тысячам километров. Таким количеством проволоки можно больше чем 20 раз соединить между собой Москву и Владивосток. Для электролиза дистиллированная вода не годится. Нужна такая вода, которая бы хорошо проводила электрический ток, то есть была бы электропроводной.
Чтобы сделать воду электропроводной, в ней нужно растворить какую-нибудь соль, кислоту или основание, которые дают ионы.
Большинство химических соединений, растворяясь в воде, распадаются на части, которые приобретают при этом тот или иной заряд. Образующиеся заряженные частицы называются ионами, а разложение вещества на ионы — электролитической диссоциацией.
Обыкновенная поваренная соль (NaCl) при растворении в воде распадается на ион натрия (Na
и один двухвалентный ион кальция (Са), заряженный положительно. Треххлористое железо (FeCl3) при диссоциации на ионы дает три одновалентных отрицательных иона хлора (3Сl—) и один трехвалентный положительный ион железа (Fe+++).
Итак, при электролитической диссоциации соли образуются отрицательно заряженные ионы, которые называются анионами, и положительно заряженные ионы — катионы.
Кислоты при диссоциации образуют положительно заряженный ион водорода и отрицательно заряженный кислотный остаток. Серная кислота (H 2SO4) распадается на два положительно заряженных иона водорода (2Н+) и кислотный остаток — анион (SO4 —), обладающий двумя отрицательными зарядами.
Щелочи при диссоциации образуют положительный ион металла и отрицательный ион гидроксила. Положительные и отрицательные ионы, образующиеся при растворении в воде солей, кислот и оснований, переносят через раствор электрический ток.
Если в раствор, содержащий ионы, поместить две металлические пластинки и подключить к ним постоянный ток от аккумулятора, то положительные ионы — катионы — сразу же начнут передвигаться к отрицательному электроду, который называется катодом, а отрицательные ионы — анионы — направятся к положительному полюсу — аноду. Находящиеся у электрода анионы отдадут ему свои отрицательные заряды — электроны (е) — и разрядятся. В то же самое время разрядятся и катионы, получив электроны от своего электрода. Их места тут же занимают новые ионы, и через раствор начинает проходить электрический ток. Чем больше ионов в растворе, тем лучше через него будет проходить электрический ток и тем больше электропроводность такого раствора.
Чтобы получить много ионов, недостаточно растворить много вещества. Необходимо, чтобы взятая соль, кислота или основание хорошо распадались на ионы, то есть хорошо диссоциировали. Имеются такие химические соединения, которые диссоциируют очень хорошо, и почти все молекулы растворенного вещества распадаются на ионы. Но есть и такие, которые диссоциируют плохо: только очень незначительная часть всех растворенных молекул распадается на ионы, а остальные остаются в виде недиссоциированных молекул.
Отношение числа распавшихся молекул к общему числу растворенных молекул называется степенью диссоциации. Чем меньше степень диссоциации, тем хуже электропроводность раствора.
К соединениям, обладающим плохой электропроводностью, относится дистиллированная вода. Подсчитано, что из 10 миллионов молекул воды на ионы распадается
только одна молекула, образуя один положительно заряженный ион водорода (Н+) и один отрицательно заряженный ион гидроксила (ОН). Понятно, что при такой малой диссоциации электропроводность дистиллированной воды должна быть совершенно ничтожной и она не может быть использована для электролиза. Вот почему для получения из воды кислорода необходимо иметь подкисленную или подщелоченную воду.
Нам уже известно, что кислота в воде диссоциирует на ионы водорода и кислотный остаток, а щелочь — на ионы металла и ионы гидроксила. Естественно было бы ожидать, что в растворе, подкисленном серной кислотой, на катоде будут разряжаться ионы водорода, а на аноде — ионы SO4 . Ионы водорода, разрядившись, перейдут в атомы, которые, соединяясь попарно, дадут молекулу водорода, а ионы SO4 , отдав свой заряд электроду, перейдут в раствор в виде незаряженного кислотного остатка—радикала SO4. Соединяясь с водой, этот радикал образует серную кислоту и кислород.
Можно было бы ожидать, что в щелочных растворах ионы натрия разрядятся на катоде, переходя в атомы натрия, которые, соединяясь с водой, дадут щелочь и водород. На аноде ионы гидроксила, потеряв свои электроны, соединятся попарно, образуя из радикалов воду, освобождая кислород.
Однако в действительности в кислых и щелочных растворах процесс образования кислорода и водорода происходит иначе.
Несмотря на то, что в щелочных растворах имеется очень много ионов натрия и мало ионов водорода, на катоде в первую очередь разряжаются ионы водорода.
В растворах, подкисленных серной кислотой, на аноде прежде всего разряжаются ионы гидроксила, полученные за счет диссоциации воды, а не ионы SO4, которых неизмеримо больше. Это объясняется тем, что разряд ионов водорода или гидроксила происходит легче, чем ионов натрия или SO4. Поэтому в щелочных растворах, которые обычно применяются для электролиза воды, на катоде разряжаются главным образом ионы водорода, а на аноде — ионы гидроксила. Как только эти ионы разрядятся, немедленно образуются новые ионы за счет диссоциации молекул воды.
Таким образом, при электролитическом получении кислорода и водорода расходуется только вода. Литр воды дает примерно 1360 литров водорода и 680 литров кислорода.
Под руководством учителя и соблюдая меры предосторожности, можно сделать опыт, показывающий, как разлагается вода.
Возьмите банку с широким горлом и наполните ее на две трети 20-процентным водным раствором щелочи. Плотно закройте банку пробкой, в которую вставлены две никелевые проволочки с небольшими пластинками на концах — электродами. В середину пробки вставьте коротким концом загнутую стеклянную трубку, через которую будут выходить газы. Второй, длинный конец трубки опустите в чашку с водой, чтобы в нее во время опыта не попадал воздух. Подключите к верхним концам электродов постоянный ток от двухвольтового аккумулятора. На электродах под раствором сразу же появятся пузырьки газа. Это кислород и водород, которые, смешиваясь, образуют гремучий газ.
Вспомним свойство этой смеси газов. Если ее поджечь, она легко взрывается.
Поэтому подходить с огнем к банке опасно.
Чтобы убедиться, что в банке образовались кислород и водород, пропустите сначала немного газа через чашечку с чистой водой, а затем поставьте вместо нее чашечку с мыльной водой.
Образуются мыльные пузыри, наполненные гремучим газом. Раздастся легкий взрыв.
В пузыре была гремучая смесь — смесь одного объема кислорода с двумя объемами водорода.
Мы пока только разложили воду, но не разделили образовавшиеся газы и не получили кислорода.
Если вы нашли ошибку, пожалуйста, выделите фрагмент текста и нажмите Ctrl+Enter.
www.activestudy.info
Процесс разложения воды электрическим током
Для демонстрационных и лабораторных опытов по разложению воды с железными электродами в качестве электролита широко используют насыщенный раствор соды Na2СО3; он удобнее, чем растворы едких щелочей, так как меньше разъедает кожу рук. Но у раствора большее сопротивление, и в больших приборах, как прибор Гофмана (см. ниже), при достаточно быстро идущем электролизе раствор нагревается, что приводит к ошибке в определении объема. Поэтому раствор соды следует применять лишь для упрощенных приборов (см. ниже).
В процессе электролиза щелочных электролитов (едкого натра, соды) при выделении газов образуется обильная пена, мешающая отсчету (сравнению) объемов. Избежать образования пены можно прибавлением этилового спирта (20 мл на 80 мл рабочего раствора).
Приборы наполняют соответствующими растворами через верхнюю воронку при открытых кранах градуированных трубок. Когда уровень жидкости в трубках дойдет вверху до суженной части, краны закрывают и доливают в воронку столько раствора, чтобы уровень его был выше уровня в трубках. (Слишком много наливать раствора в воронку не следует, так как туда же будет вытесняться газами жидкость во время электролиза.) После этого, осторожно открывая краны, заполняют раствором оставшийся в каждой трубке объем, но так, чтобы жидкость не попала в оттянутые трубочки выше кранов. Если немного жидкости случайно попало выше крана, ее надо удалить из трубочки тонким жгутиком фильтровальной бумаги. В приборах, изображенных на рисунках 102, а и 103, б, это можно сделать, сливая часть жидкости через нижний кран или опуская воронку ниже уровня жидкости в трубке (при открытом верхнем кране). Не удаленный из трубочки раствор может помешать испытанию собранных газов. Готовый к демонстрации прибор подключают к источнику постоянного тока в соответствии с обозначениями полюсов у выходных клемм выпрямителя, чтобы заранее знать, где какой газ будет выделяться. Скорость выделения газов при необходимости регулируют реостатом, следя за тем, чтобы раствор в нижней части прибора не перегревался (при больших сопротивлениях в узких трубках, как у самодельного прибора на рисунке 103, б, раствор может нагреться даже до кипения). Когда в трубке с отрицательным электродом соберется водорода около половины ее объема (объем кислорода в другой трубке будет соответственно вдвое меньше), выключают ток, производят соответствующий отсчет пли приблизительно сравнивают объемы газов и испытывают их. Для испытания водорода медленно открывают кран градуированной трубки и подносят к отверстию горящую лучинку. Газ вытесняется вверх и сгорает.
Для испытания кислорода лучше пользоваться насадкой, изображенной на рисунке 104. При открывании крана газ заполняет надетую на пробку широкую трубочку (ее можно отрезать от пробирки), где его легко обнаружить тлеющей лучинкой. Зная катод и анод у прибора и соблюдая порядок присоединения, насадку надевают на соответствующую трубку заранее.
По окончании демонстрации опыта раствор из прибора нужно вылить, весь прибор хорошо промыть водой, краны насухо вытереть и смазать. Последнее особенно важно при применении щелочных растворов во избежание «заедания» шлифов, которое может привести к порче прибора.
На рисунках 105 и 106 изображены упрощенные приборы для электролитического разложения воды, сделанные из обрезанной стеклянной банки, воронки для порошков, стакана. В зависимости от размеров эти приборы применяют для демонстрационных или лабораторных опытов. Внутреннее сопротивление приборов относительно невелико, поэтому для лабораторных опытов с ними можно использовать маломощные выпрямители ВС-12, ВС4-12 или батарейки для карманного фонаря, однако не менее 12 в (три плоские батарейки, соединенные последовательно). Для демонстрационных опытов нужны более мощные источники постоянного тока— выпрямители, с батарейками процесс идет медленно.
В качестве электродов в этих приборах используют толстую железную проволоку, гвозди, железные или никелевые пластинки, стержни графитовых карандашей, расколотые вдоль. Сосуд электролизера можно поместить в кольцо или зажим штатива или в специальные приспособления с контактами, к которым присоединяют наружные концы электродов
Для закрывания нижнего отверстия (горла) банки или воронки лучше использовать резиновые пробки, через которые и проходят электроды. Если приходится пользоваться корковыми пробками, то на них наливают внутрь сосуда расплавленную менделеевскую замазку слоем до 1 см и дают застыть. Заливание парафином нежелательно, так как во время опыта он нередко расплавляется, всплывает и попадает в пробирки.
Приемниками для газов служат пробирки, которые непосредственно надевают на электроды, градуированные или неградуированные стеклянные трубки, подвешенные на проволоке. Деталь подвеса показана на рисунке 106, б
В качестве электролита почти во всех таких приборах применяют насыщенный раствор карбоната натрия Na2CO3, реже — 10-процентный раствор NaOH. Графитовые электроды позволяют использовать также растворы серной кислоты (1 : 10 по объему) и 10-процентный раствор сульфата натрия.
Для того чтобы при погружении в сосуд трубок, наполненных раствором, не смачивать электролитом руки, можно укрепить на изогнутой толстой проволоке каучуковую пробку, которой и закрывать при погружении и при вынимании после опыта трубки (пробирки). В основном такая пробка нужна только для закрывания отверстия пробирки (трубки) по окончании электролиза, чтобы оставшаяся в пробирке жидкость не вытекала и в пробирку не вошел воздух. При погружении же наполненную раствором пробирку можно закрывать небольшим кусочком бумаги, в таком виде переворачивать и опускать в раствор, где бумажка отпадает и может быть извлечена лучинкой. Впрочем, если руки сейчас же вымыть водой, то непродолжительное соприкосновение с раствором соды и щелочи и даже серной кислоты указанной концентрации не представляет никакой опасности.
Раствор карбоната натрия для опыта должен быть по возможности свежий. При электролизе раствора на аноде образуется оксид углерода CO2, который, реагируя с карбонатом натрия, переводит его в кислую соль. Если гидрокарбоната натрия в растворе накопится много, то оксид углерода СО2перестанет полностью поглощаться и будет выделяться на аноде вместе с кислородом. Следовательно, пользоваться долго одним и тем же раствором нельзя. Электролиз в указанных приборах ведут, пока пробирка над катодом наполнится водородом наполовину, кислорода в другой пробирке (трубке) будет соответственно вдвое меньше. Этих объемов вполне достаточно для испытания. Для сравнения объемов газов на пробирки надевают резиновые колечки и по выключении тока устанавливают их на уровне оставшихся в пробирках (трубках) жидкостей. После испытания водорода и кислорода (при испытании следить, чтобы не сдвинулись кольца) растворы из пробирок выливают, в пробирку, где был кислород, наливают (до кольца) воды и выливают ее в пробирку, где был водород. Чтобы уровень воды в этой пробирке также оказался у кольца, необходимо прилить еще такой же объем, следовательно, объемы газов относятся как 1 : 2.
Более точные измерения в условиях этих опытов невозможно произвести, так как это потребовало бы внесения многочисленных поправок для приведения объемов газов к нормальным условиям с учетом упругости водяных паров, растворимости газов и пр.
class.in.ua
Разрыв молекул воды и Закон сохранения энергии. Какую использовать воду
В данной статье поговорим про разрыв молекул воды и Закон сохранения энергии. В конце статьи эксперимент для дома.
Нет никакого смысла изобретать установки и устройства по разложению молекул воды на водород и кислород не учитывая Закон сохранения энергии. Предполагается, что возможно создать такую установку, которая на разложение воды будет затрачивать меньшее количество энергии, чем та энергия, которая выделяется в процессе сгорания (соединения в молекулу воды). В идеале, структурно, схема разложения воды и соединение кислорода и водорода в молекулу будет иметь циклический (повторяющийся) вид.
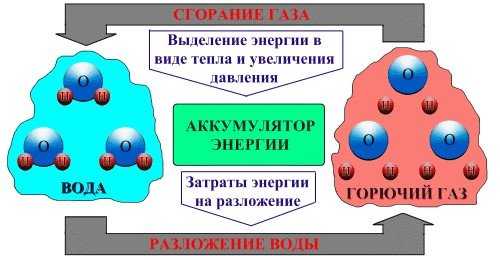
Изначально, имеется химическое соединение – вода (H2O). Для её разложения на составляющие – водород (Н) и кислород (О) необходимо приложить определённое количество энергии. Практически, источником этой энергии может быть аккумуляторная батарея автомобиля. В результате разложения воды образуется газ, состоящий в основном из молекул водорода (Н) и кислорода (О). Одни, называют его «Газ Брауна», другие говорят, что выделяющийся газ, ничего не имеет общего с Газом Брауна. Думаю, нет необходимости рассуждать и доказывать, как называется этот газ, ведь это не важно, пускай этим занимаются философы.
Газ, вместо бензина поступает в цилиндры двигателя внутреннего сгорания, где посредством искры от свечей системы зажигания воспламеняется. Происходит химическое соединение водорода и кислорода в воду, сопровождаемое резким выделением энергии взрыва, заставляющего двигатель работать. Вода, образованная в процессе химического соединения, выпускается из цилиндров двигателя в виде пара через выпускной коллектор.
Важным моментом является возможность повторного использования воды для процесса разложения на составляющие – водород (Н) и кислород (О), образованной в результате сгорания в двигателе. Ещё раз посмотрим на «цикл» круговорота воды и энергии. На разрыв воды, которая находится в устойчивом химическом соединении, затрачивается определённое количество энергии. В результате сгорания, наоборот выделяется определённое количество энергии. Выделяемая энергия может быть грубо рассчитана на «молекулярном» уровне. Из-за особенностей оборудования, затрачиваемую на разрыв энергию рассчитать сложнее, её проще измерить. Если пренебречь качественными характеристиками оборудования, потерями энергии на нагрев, и другими немаловажными показателями, то в результате расчётов и измерений, если они проведены правильно, окажется, что затраченная и выделенная энергии равны друг другу. Это подтверждает Закон сохранения энергии, который утверждает, что энергия никуда не пропадает и не появляется «из пустоты», она лишь переходит в другое состояние. Но мы хотим использовать воду как источник дополнительной «полезной» энергии. Откуда эта энергия вообще может взяться? Энергия тратится не только на разложение воды, но и на потери, учитывающие КПД установки по разложению и КПД двигателя. А мы хотим получить «круговорот», в котором энергии больше выделяется, чем затрачивается.
Я не привожу здесь конкретные цифры, учитывающие затраты и выработку энергии. Один из посетителей моего сайта прислал мне на Майл книгу Канарёва, за что я ему очень благодарен, в которой популярно разложены «подсчёты» энергии. Книга является очень полезной, и пара последующих статей моего сайта будет посвящена именно исследованиям Канарёва. Некоторые посетители моего сайта утверждают, что я своими статьями противоречу молекулярной физике, поэтому в своих последующих статьях я приведу на мой взгляд — основные результаты исследований молекулярщика — Канарёва, которые моей теории не противоречат, а даже наоборот подтверждают моё представление о возможности низкоамперного разложения воды.
Если считать, что вода, используемая для разложения – это самое устойчивое, конечное химическое соединение, и её химические и физические свойства такие же, как у воды, высвобождаемой в виде пара из коллектора двигателя внутреннего сгорания, то какими производительными установки по разложению не были, нет смысла пытаться получать дополнительную энергию из воды. Это противоречит Закону сохранения энергии. И тогда, все попытки использовать воду в качестве источника энергии — бесполезны, а все статьи и публикации на эту тему не более чем заблуждения людей, или просто — обман.
Любое химическое соединение при определённых условиях распадается или соединяется вновь. Условием для этого может служить физическая среда, в которой находится это соединение – температура, давление, освещённость, электрическое, или магнитное воздействие, либо наличие катализаторов, других химических веществ, или соединений. Воду можно назвать аномальным химическим соединением, обладающую свойствами, не присущими всем остальным химическим соединениям. К этим свойствам (в том числе) относятся реакции на изменения температуры, давления, электрического тока. В естественных Земных условиях, вода – устойчивое и «конечное» химическое соединение. В этих условиях имеется определённая температура, давление, отсутствует какое либо магнитное, или электрическое поле. Существует много попыток и вариантов изменить эти естественные условия для того, чтобы разложить воду. Из них, наиболее привлекательно выглядит разложение посредством воздействия электрического тока. Полярная связь атомов в молекулах воды настолько сильна, что можно пренебречь магнитным полем Земли, которое не оказывает никакого влияния на молекулы воды.
Небольшое отступление от темы:
Есть предположение определённых деятелей науки, что Пирамиды Хеопса не что иное, как огромные установки для концентрации энергии Земли, которую неизвестная нам цивилизация использовала для разложения воды. Узкие наклонные тоннели в Пирамиде, назначение которых до настоящего времени не раскрыто, могли использоваться для движения воды и газов. Вот такое «фантастическое» отступление.
Продолжим. Если воду поместить в поле мощного постоянного магнита, ничего не произойдёт, связь атомов будет по-прежнему сильнее этого поля. Электрическое поле, образованное мощным источником электрического тока, приложенное к воде посредством электродов, погруженных в воду, вызывает электролиз воды (разложение на водород и кислород). При этом, затраты энергии источника тока огромны — не сопоставимы с энергией, которую можно получить от обратного процесса соединения. Здесь и возникает задача минимизировать затраты энергии, но для этого необходимо понять как происходит процесс разрыва молекул и на чём можно «сэкономить».
Для того, чтобы верить в возможность использования воды, как источника энергии мы должны «оперировать» не только на уровне единичных молекул воды, а так же на уровне соединения большого числа молекул за счёт их взаимного притяжения и дипольного ориентирования. Мы должны учитывать межмолекулярные взаимодействия. Возникает резонный вопрос: Почему? А потому, что перед разрывом молекул необходимо их сначала сориентировать. Это, так же является ответом на вопрос «Почему в обычной электролизёрной установке используется постоянный электрический ток, а переменный – не работает?».
В соответствии с кластерной теорией, молекулы воды имеют положительные и отрицательные магнитные полюса. Вода в жидком состоянии имеет не плотную структуру, поэтому молекулы в ней, притягиваясь разноимёнными полюсами и отталкиваясь одноимёнными, взаимодействуют друг с другом, образуя кластеры. Если для воды, находящейся в жидком состоянии, представить оси координат и попытаться определить в каком направлении этих координат больше ориентированных молекул, у нас ничего не получится, потому что ориентация молекул воды без дополнительного внешнего воздействия — хаотична.
В твёрдом состоянии (состоянии льда) вода имеет структуру упорядоченных и точно ориентированных определённым образом друг относительно друга молекул. Сумма магнитных полей шести молекул H2O в состоянии льда в одной плоскости равна нулю, а связь с соседними «шестёрками» молекул в кристалле льда приводит к тому, что в целом, в определённом объёме (куске) льда отсутствует какая либо «общая» полярность.
Если лёд растает от повышения температуры, то многие связи молекул воды в «решётке» разрушатся и вода станет жидкой, но всё равно «разрушение» будет не полным. Большое количество связей молекул воды в «шестёрки» сохранится. Такая талая вода называется «структурированной», является полезной для всего живого, но для разложения на водород и кислород не подходит потому, что необходимо будет тратить дополнительную энергию на разрыв межмолекулярных связей, затрудняющих ориентацию молекул перед их «разрывом». Значительная потеря кластерных связей в талой воде произойдёт позже, естественным путём.
Если в воде имеются химические примеси (соли, или кислоты), то эти примеси препятствуют соединению соседних молекул воды в кластерную решётку, отнимая у структуры воды водородные и кислородные связи, чем при низких температурах нарушают «твёрдую» структуру льда. Всем известно, что растворы кислотных и щелочных электролитов не замерзают при отрицательных температурах так же, как и солёная вода. Благодаря наличию примесей, молекулы воды становятся легко ориентируемыми под действием внешнего электрического поля. Это с одной стороны хорошо, не надо тратить лишнюю энергию на полярную ориентацию, но с другой стороны это плохо, потому, что эти растворы хорошо проводят электрический ток и в результате этого, в соответствии с Законом Ома, амплитуда тока необходимая на разрыв молекул оказывается значительной. Низкое межэлектродное напряжение приводит к низкой температуре электролиза, поэтому такая вода используется в электролизёрных установках, но для «лёгкого» разложения такая вода не годится.
Какая же вода должна применяться? Вода должна иметь минимальное количество межмолекулярных связей – для «лёгкости» полярной ориентации молекул, не должна иметь химических примесей, увеличивающих её проводимость – для уменьшения тока, используемого для разрыва молекул. Практически, такой воде соответствует дистиллированная вода.
Вы можете провести простой эксперимент сами
Налейте свеже-дистиллированную воду в пластиковую бутылку. Поместите бутылку в морозильную камеру. Выдержите бутылку около двух-трёх часов. Когда Вы достанете бутылку из морозильной камеры (трясти бутылкой нельзя), Вы увидите, что вода находится в жидком состоянии. Откройте бутылку и тонкой струйкой выливайте воду на наклонную поверхность из нетеплопроводного материала (например — широкую деревянную доску). На Ваших глазах вода будет превращаться в лёд. Если в бутылке осталась вода, закройте крышку, резким движением ударьте дном бутылки о стол. Вода в бутылке резко превратится в лёд.
Эксперимент может не получиться, если дистилляция воды была произведена более пяти суток назад, некачественно, или подвергалась тряске, в результате чего, в ней появились кластерные (межмолекулярные) связи. Время выдержки в морозильной камере, зависит от самой морозильной камеры, что так же может повлиять на «чистоту» эксперимента.
Этот эксперимент подтверждает, что минимальное количество межмолекулярных связей именно в дистиллированной воде.
Ещё один важный аргумент в пользу дистиллированной воды: Если Вы видели, как работает электролизёрная установка, то знаете, что использование водопроводной (даже очищенной через фильтр) воды загрязняет электролизёр так, что без регулярной его чистки снижается эффективность электролиза, а частая чистка сложного оборудования – лишние трудозатраты, да и оборудование из-за частых сборок – разборок придёт в негодное состояние. Поэтому даже и не думайте использовать для разложения на водород и кислород водопроводную воду. Стэнли Мэйер использовал водопроводную воду только для демонстрации, чтобы показать какая «крутая» у него установка.
Чтобы понять то, к чему нам необходимо стремиться, мы должны понять физику процессов, происходящих с молекулами воды во время воздействия электрического тока. В следующей статье мы вкратце, без «заумной нагрузки на мозг» ознакомимся с теорией профессора Канарёва о строении молекул воды, кислорода и водорода.
meanders.ru
Электрохимические процессы разложение воды – Справочник химика 21
Разность равновесных потенциалов электродных реакций называется обратимым напряжением разложения электролита Uo- Последнее численно равно э. д. с. электрохимической цепи, в которой протекает реакция, обратная реакции при электролизе. Например, обратимое напряжение разложения воды равно э. д. с. водороднокислородной цепи, при отборе тока от которой идет синтез воды из водорода и кислорода (см. 178). При 298 К э. д. с. этой цепи, а следовательно, и Uo равны 1,23 В. Учитывая соответствие между э. д. с. и обратимым напряжением разложения, последнее можно определить по термодинамическим данным согласно (175.9). При электролизе воды происходит выделение водорода на катоде и кислорода на аноде, причем каждый процесс сопровождается свойственным ему перенапряжением, зависящим, в первую очередь, от материала электродов [c.515]На практике процесс электролиза воды реализуется при более высоком напряжении. Данное обстоятельство связано с тем, что, помимо затрат электроэнергии на проведение собственно электрохимического разложения воды, необходимо затрачивать электроэнергию на преодоление электрического сопротивления электролита, диафрагмы, электродов, контактов, а также дополнительного сопротивления, обусловленного концентрационной и диффузионной поляризацией, перенапряжением процессов выделения водорода и кислорода. Напряжение на ячейке для электролиза воды можно представить в виде суммы следующих составляющих (баланс напряжения) [c.23]
Постоянный электрический ток используют в электрохимических производствах как для процессов разложения веществ, так и для процессов синтеза [9], при этом необходимо соблюдение определенных условий. Например, разложение воды начинается при напряжении [c.78]
Электрохимическое выделение кислорода является неотъемлемой частью процесса разложения воды и протекает следующим образом [c.205]
Изучение водородного перенапряжения позволяет выяснить механизм этой реакции и представляет большой интерес с теоретической точки зрения. Установленные при этом закономерности можно частично распространить и на другие электрохимические реакции, что значительно повышает теоретическую значимость работ по водородному перенапряжению. Изучение водородного перенапряжения имеет также большое практическое значение, потому что современная промышленная электрохимия является преимущественно электрохимией водных растворов, и процессы электролитического разложения воды могут накладываться на любые катодные и анодные реакции. Водородное перенапряжение составляет значительную долю напряжения на ваннах по электролизу воды и растворов хлоридов. Знание природы водородного перенапряжения позволяет уменьшить его, а следовательно, снизить расход электроэнергии и улучшить экономические показатели этих процессов. В других случаях (электролитическое выделение металлов, катодное восстановление неорганических и органических веществ, эксплуатация химических источников тока) знание природы водородного перенапряжения позволяет успешно решать обратную задачу — нахождение рациональных путей его повышения. Все эти причины обусловили то, что изучение процесса катодного выделения водорода и природы водородного перенапряжения всегда находилось и находится в центре внимания электрохимиков. [c.397]
Рассчитайте теоретическое значение напряжения разложения электролита процесса хромирования [сернокислый раствор оксида хрома (VI) СгОз1, пользуясь термодинамическими функциями компонентов электрохимической реакции (не учитывать побочный процесс электролитического разложения воды). [c.201]
Вот один из самых казалось бы простых электрохимических процессов разложение воды на водород и кислород. [c.41]
Отклонение выхода по току от 100 % может быть обусловлено протеканием побочных процессов разложением воды, восстановлением или окислением примесей, участием материала электрода в электрохимической реакции и др. Поэтому следует подбирать такие условия электролиза (pH раствора, материал электрода, растворитель, фоновый электролит и т.п.), чтобы выход по току был близок к 100 %. [c.517]
Представление о том, что в растворах электролитов существуют свободные заряженные частицы — ионы, не сразу утвердилось в электрохимии. На первом этапе своего развития электрохимическая наука обходилась без этого представления. Тем не менее уже с начала XIX в. стали появляться теоретические модели, объяснявшие явление электропроводности в проводниках 2-го рода. Первая такая модель была предложена литовским ученым X. Гротгусом в 1805 г. применительно к процессу электрохимического разложения воды на водород и кислород. Представив молекулы воды в виде диполей, X. Грот-гус располагал их цепочкой между катодом и анодом электролизера фис. 2).Далее он предполагал, что при электролизе положительный конец диполя воды, обращенный к катоду, отщепляется и из него образуется [c.7]
К фотоэлектрохимическим процессам разложения воды можно отнести также и электрохимические реакции, протекающие при облучении светом электрода (металлы, неорганические и органические полупроводники), либо адсорбированных на поверхности электрода частиц. [c.338]
Нередко возникает задача электролитического получения полимерных пленок на катоде [15, 27, 62], поскольку анодное осаждение обладает рядом недостатков, например плохими электрическими характеристиками покрытий вследствие включения материала анода в растущую полимерную пленку. При осаждении на катоде полимерных покрытий из водных растворов в прикатодном пространстве происходит концентрирование гидроксильных ионов вследствие электрохимической реакции разложения воды. Чтобы полимерное вещество могло быть осаждено на катоде, оно должно удовлетворять двум требованиям растворяться в кислой или нейтральной среде и осаждаться при подщелачивании [15]. При проведении же процесса электроосаждения полимеров из неводных растворов дополнительно необходимы достаточно высокая проводимость растворителя и диссоциация полимерного вещества в нем с образованием поликатиона, а также тщательная очистка раствора от следов воды. Эти условия могут быть созданы, [c.32]
Проведение процесса электросинтеза органических соединений в водных растворах связано и с рядом осложнений. Во многих случаях электрохимическая реакция на аноде или катоде сопровождается разложением воды, что обусловливает низкий выход продукта электролиза по току. Кроме того, что особенно существенно для анодных процессов, разложение воды приводит к появлению на поверхности электрода активных частиц, например, на аноде радикалов ОН, которые могут, путем взаимодействия с исходным или конечным продуктом электросинтеза, направлять реакцию в сторону образования побочных продуктов. [c.57]
www.chem21.info
Вода, разложение термическое – Справочник химика 21
Объяснение. Когда спираль не накалена, разложение паров воды не наблюдается. По мере усиления нагревания спирали реакция сдвигается в сторону разложения молекул воды. Разложение молекул воды происходит в непосредственной близости от раскаленной поверхности платиновой спирали. За счет процессов диффузии, а также за счет движения вверх молекул пара, продукты термической диссоциации выносятся из зоны реакции в газоизмерительную трубку. Здесь в пневматической ванне пары воды конденсируются, а газообразные кислород и водород поступают в измерительную бюретку. Опыт наглядно показывает зависимость скорости термической диссоциации воды от температуры. Чем выше температура поверхности платины, играющей в данном процессе роль катализатора, тем больше образуется в единицу времени гремучего газа. Следователь- [c.104]Физический смысл гН можно уяснить из следующего. Вода подвергается термическому разложению на водород и кислород [c.71]
Гидрирование в эмульсиях, например восстаиовление ароматических динитросоединений в водной эмульсии. При этом улучшаются условия отвода реакционного тепла, облегчается выделение растворимого в воде диамина, предотвращается разложение термически нестабильных динитросоединений. [c.516]
Удаление внешней влаги, называемое сушкой, протекает даже и при комнатной температуре. С повышением температуры этот процесс становится еще интенсивнее и практически заканчивается при 105—110°С. В температурном интервале 100—200 “С из угля выделяются окклюдированные газы и начинаются процессы собственно термической деструкции в наиболее термически нестойких твердых топливах — торфах и некоторых молодых бурых углях. Основным продуктом этого процесса является вода, которая называется пирогенетической водой или водой разложения. Довольно трудно установить, когда заканчивается выделение гигроскопической влаги и начинается образование пирогенетической воды. В большинстве случаев это невозможно и поэтому нельзя с уверенностью определить начало термической деструкции. [c.243]
Для выражения степени окисленности можно использовать а) степень окисленности, вычисляемую на основе элементарного состава б) теплоту сгорания в) выход газа и воды при термическом разложении. [c.15]
Желто-коричневый, плавится без разложения, термически устойчивый. Плохо растворяется в холодной воде. Кристаллогидратов не образует. Не реагирует с разбавленными кислотами. Разлагается кипящей водой, царской водкой , щелочами, гидратом аммиака. Проявляет слабые окислительно-восстановительные свойства. Получение см. 88 , 887 . [c.447]
Белый, плавится без разложения. Термически устойчивый. Безводный порошкообразный К28 пирофорен в сухом воздухе. Хорошо растворяется в воде (сильный гидролиз по аниону). Реакционноспособный во влажном состоянии окисляется кислородом воздуха, присоединяет серу. Разлагается кислотами. Типичный восстановитель. Получение см. 43 , 63 [c.37]
Разложение воды. Процесс термического разложения воды можно описать следующими реакциями [c.330]
Белый, плавится без разложения, термически устойчивый. Хорошо растворяется в воде (гидролиз по аниону), создает сильнощелочную среду, переводит в раствор цинк и алюминий. Частично разлагается концентрированной серной кислотой. Вступает в реакции обмена. Получение см. 28, 29 330, 332. [c.174]
В обычном состоянии этот неметалл с формулой Э2 — бесцветный газ, не имеющий запаха и вкуса, негорючий и малорастворимый в воде, не поддерживающий горение и вообще химически весьма инертный. Только с литием он уже при комнатной температуре образует соединение ЫдЭ, а при нагревании реагирует с магнием, окисляя его до Получить Эд в лаборатории можно из его соединения ЭНд (действуя бромной водой) или термическим разложением соли состава (ЭН )(Э02). Что такое [c.232]
Красно-фиолетовый, плавится и кипит без разложения, термически устойчивый. Не растворяется в холодной воде, не реагирует с разбавленными кислотами. Разлагается кипящей водой. Восстанавливается кальцием, окисляется кислородом. Получение см. 688. [c.345]
Белый, плавится без разложения, термически устойчивый. Хорошо растворяется в холодной воде (гидролиз по аниону). Реагирует с горячей водой, кислотами. Вступает в реакции обмена. Образует изополисоединения. Получение см. 332, 342″, 344 [c.179]
Не всегда при добавлении воды разложение сопровождается образованием тетрагалогенида кремния разложение водой может наступить раньше, чем начнется термическое разложение вещества, при этом некоторые вещества переходят в полимерные соединения кремния, которые при термическом разложении образуют Si . Карбид кремния образуется также при сожжении соединений, содержащих у одного атома кремния три атома галогена или атомы галогена и водорода. Такие соединения сжигаются при добавлении к навеске небольшого количества хромированного асбеста, асбеста и воды. [c.53]
Устойчивость к воздействию высоких температур — одно из характерных свойств амфиболовых асбестов. В настоящее время вопрос о поведении амфиболов при нагревании изучен достаточно широко. Термоаналитические исследования как природных, так и искусственных амфиболов химического состава, проведенные в различных газовых средах и в вакууме, в статических и динамических условиях [28], позволили выявить влияние этих параметров на процесс выделения воды, последовательность термических превращений, их механизм и изучить продукты разложения, С привлечением современных методов исследования рассмотрены многие другие вопросы, касающиеся окисления железа, явлений упорядочения и структурных превращений при нагревании. [c.137]
Запах сточных вод населенных мест, представляющий собой смесь запаха фекалий с запахами разложения жиров, белков, мыла и т. д., является довольно характерным. Он зависит от разложения хозяйственно-бытовых стоков и от того, какие в воде преобладают процессы — окислительные или восстановительные. Подобный запах могут иметь также некоторые сточные воды предприятий пищевой промышленности. Сточные воды от термической переработки угля имеют запах фенолов, смолы, сероводорода сточные воды химической промышленности имеют характерные запахи, зависящие от вида производства, например запах органических соединений сероуглерода, сложных и простых эфиров, спиртов, органических кислот, азотсодержащих соединений, меркаптанов, ацетилена и т. д.
www.chem21.info
Разложение воды электричеством | Русская Физика
56. Разложение воды электричеством
Прибор для разложения воды состоит из трёх колб, две из которых – закрытые, а одна – открытая. Все три колбы заполнены водой и сообщаются между собой в нижней части.
В закрытых колбах размещены электроды. Один из них соединён с отрицательной клеммой внешнего источника электрического тока и называется катодом, а другой соединён с положительной клеммой и называется анодом.
Внешний электрический источник нагнетает электроны на катод и создаёт на нём избыточное электрическое давление. С анода источник электроны отбирает, и там – пониженное электронное давление.
Постепенно повышенное давление электронов катода распространяется на всю катодную колбу, а пониженное распространяется на всю анодную колбу.
И только в направлении от катода в сторону анода электронное давление будет плавно уменьшаться от катодного до анодного. В этом направлении в воде образуется, своего рода, канал с таким плавно изменяющимся электронным давлением.
Сразу скажем, что в процессе разложения воды в катодной колбе собирается водород, а в анодной – кислород.
Прежде чем рассматривать физику разложения, ещё раз представим себе молекулу воды. Она состоит из атома кислорода и примкнувшей к нему молекулы водорода: O(Hm. У атома кислорода контурного жёлоба нет, и поэтому он сам и молекула воды, которую он образует, электрический ток не проводят. Контурный жёлоб есть только у молекулы водорода, но эта молекула располагается с одной стороны атома кислорода и охватывается его стволом.
Разложение молекул воды начинается на катоде.
Под напором избыточного давления электроны переходят с катода на те молекулы воды, которые примыкают к нему своей водородной стороной. При достижении порогового значения избыточного давления электроны, как клин, отделяют в каждой такой молекуле воды молекулу водорода от атома кислорода.
Отрыв происходит так резко, что атом кислорода разворачивается и своим теперь уже открытым жёлобом оказывается направленным в противоположную сторону от катода.
На его открытом жёлобе будет уже повышенное давление электронов.
Среди примыкавших к оторванным атомам кислорода молекул воды окажутся и те, которые будут повёрнуты к ним своими водородными сторонами.
С ними произойдёт то же самое, что и с теми, которые примыкали к катоду, тоесть при пороговом избыточном давлении электроны, как клин, отделят в них молекулы водорода от атомов кислорода.
При этом часть электронов с предыдущего атома кислорода переместится на вновь разорванную молекулу воды.
В этот момент каждая оторванная молекула водорода оказывается между двух атомов кислорода и прилипает к тому из них, в сторону которого она получила толчок во время отрыва.
Таким образом молекула водорода перескакивает с одного атома кислорода на другой в сторону катода.
Если мы начнём рассматривать процесс дальше, то заметим, что и все другие оторванные молекулы водорода будут перескакивать с атома на атом кислорода в сторону катода. Такой процесс будет продолжаться на всём протяжении канала от катода до анода.
Это произойдёт и с теми молекулами воды, которые примыкают к аноду. Электронные клинья оторвут от них молекулы водорода, и те, сорвавшись, уйдут в направлении к катоду.
С освободившихся атомов кислорода избыточные электроны перейдут на анод.
Как видим, на всём протяжении канала от катода до анода молекулы водорода перепрыгивают с одной молекулы воды на другую в сторону катода.
В результате на катоде появляются свободные молекулы водорода, а на аноде – свободные атомы кислорода.
Собираясь в пузырьки, они поднимаются вверх и скапливаются над водой. Атомы кислорода при этом объединяются в молекулярные пары O2.
Так как электроны перескакивают только на те молекулы воды, которые повёрнуты к ним своими водородными сторонами, можно подумать, что прочие молекулы воды распадаться не будут. Но учитывая то, что в процессе разложения происходят интенсивные движения частиц, затрагиваемые ими молекулы воды будут случайным образом разворачиваться и принимать подходящие положения.
Итак, в процессе электрического разложения воды происходят два вида перескоков с молекулы на молекулу:
- электроны перескакивают в направлении от катода к аноду;
- молекулы водорода перескакивают в направлении от анода к катоду.
russkaja-fizika.ru
Разложение воды на водород и кислород
Существуют различные способы получения водорода и кислорода, которые условно можно разделить на промышленные и лабораторные.
Один из наиболее простых и популярных методов получения и кислорода, и водорода – разложение воды на водород и кислород. Уравнение данной химической реакции имеет вид:
.
Учитывая, что разложению подверглось 100 г воды, рассчитаем её количество вещества:
;
;
;
.
Согласно уравнению реакции, вода, водород и кислород находятся в следующих мольных соотношениях:
;
.
Это означает, что количество вещества продуктов реакции будет равно:
;
.
Тогда, объемы выделившихся в ходе реакции разложения воды газов будут равняться:
;
;
.
;
.
ru.solverbook.com