Лабораторные способы получения водорода: Разложение воды под действием электрического тока
Закон Авогадро гласит
(*ответ*) В равных объемах различных газов при одинаковых условиях содержится одинаковое количество вещества
В равных объемах различных газов при одинаковой температуре содержится одинаковое количество вещества
В равных объемах различных газов при одинаковом давлении содержится одинаковое количество вещества
В равных объемах различных газов содержится одинаковое количество вещества
Закон постоянства состава:
(*ответ*) Вещества имеют постоянный состав независимо от способов их получения
Вещества имеют постоянный состав при определенном способе их получения
Любые природные вещества имеют постоянный состав
Вещества имеют постоянный состав независимо от условий их хранения
Закон сохранения массы
(*ответ*) Масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции
Масса веществ, вступивших в химическую реакцию, меньше массы веществ, образующихся в результате реакции
Масса веществ, вступивших в химическую реакцию, почти всегда равна массе веществ, образующихся в результате реакции
Закон сохранения массы открыл
(*ответ*) Ломоносов
Бойль
Лавуазье
Менделеев
Закон, лежащий в основе составления уравнений реакций, – это
(*ответ*) Закон сохранения массы веществ
Закон Авогадро
Периодический закон
Закон постоянства состава
Замерзание воды – это явление
(*ответ*) Физическое
Сезонное
Химическое
Природное
Запись 4N2 означает
(*ответ*) 4 молекулы азота
4 атома азота
8 атомов азота
молекулу азота
К постоянным компонентам воздуха относятся
(*ответ*) Азот
(*ответ*) Кислород
Углекислый газ
Водяной пар
Количество вещества 11 г углекислого газа СО2 равно
(*ответ*) 0,25 моль
0,5 моль
2,5 моль
4 моль
Количество вещества кислорода, содержащее 18∙ 1023 молекул, равно _ моль
(*ответ*) 3
1
2
22
Лабораторные способы получения водорода:
(*ответ*) Разложение воды под действием электрического тока
(*ответ*) Взаимодействие металлов с кислотами
Разложение гидридов металлов
Реакция между раскаленным железом и водяным паром
Лабораторные способы получения кислорода:
(*ответ*) Электролиз воды
(*ответ*) Разложение перекиси водорода
Фракционная перегонка жидкого воздуха
Разложение озона
Лед образуется на поверхности водоемов, потому что
(*ответ*) Плотность льда меньше плотности воды
Образовавшийся лед препятствует замерзанию более глубоких слоев воды
Твердые вещества всегда плавают на поверхности жидкости
Вода обладает высокой теплоемкостью
Масса 12 ∙ 1023 молекул водорода равна
(*ответ*) 4 г
4 кг
2 г
2 кг
способ разложения воды в электролизере и конструкция последнего – патент РФ 2241071
Изобретение относится к области электрохимии, в частности к технологии и техническим средствам электролитического получения водорода и кислорода. В процессе электролиза перемешивание электролита осуществляется пульсацией давления в виде циклических растягивающих напряжений по отнулевому циклу, создаваемых путем изменения в сторону увеличения рабочего объема электролизера, полностью заполненного электролитом, в направлении между двумя электродами. При этом корпус электролизера имеет, по меньшей мере, один фрагмент, который установлен подвижно с возможностью возвратно-поступательного перемещения. В качестве такого фрагмента использован один из электродов электролизера, выполненный в виде поршня или мембраны. Технический эффект – повышение производительности электролизера, упрощение его конструкции. 2 н. и 4 з.п. ф-лы, 4 ил.
Рисунки к патенту РФ 2241071
Изобретение относится к области электрохимии, в частности к способу электролитического получения водородно-кислородной смеси и конструкции электролизера, наиболее эффективно используемых для газопламенной технологии в ряде отраслей промышленности.
Горение водородно-кислородной смеси (гремучий газ) сопровождается выделением значительного количества теплоты. Стандартная энтальпия этой реакции в расчете на один моль образующейся жидкой воды равна 285,8 кДж. Температура водородного пламени достигает 2800°С. Водородно-кислородным пламенем пользуются для сварки и резки металлов. Последнее время водород рассматривается как перспективное горючее для наземных и воздушных транспортных средств.
В промышленности водород получают главным образом из природного газа. Этот газ, состоящий в основном из метана, смешивают с водяным паром и кислородом. При нагревании смеси газов до 800-900°С в присутствии катализатора происходит реакция, которую можно схематически изобразить уравнением:
2СН4+О 2+2H2O=2CO2+6H2
Полученную смесь газов разделяют. Водород очищают и транспортируют в стальных баллонах под давлением.
Важным промышленным способом получения водорода служит его выделение из коксового газа или газов переработки нефти. Оно осуществляется глубоким охлаждением, при котором все газы, кроме водорода, сжижаются [1].
Недостатком вышеописанных способов получения водорода является их технологическая сложность и большая энергоемкость, которые могут быть реализованы лишь в индустриальных масштабах на крупных специализированных производствах, откуда газ в баллонах транспортируется к потребителю, что экономически не всегда оправдано.
Для удовлетворения нужд в водородном топливе в ограниченном количестве на мелких и средних предприятиях существуют автономные источники получения водорода – электролизеры, которые под действием электрического тока разлагают воду на водород и кислород. Принятая технология по своей сути проста и не требует особо сложного оборудования. Однако и в ней имеются проблемы, требующие своего разрешения.
Известен способ электролиза, принятый за прототип, который включает подвод электролита к электродам, разложение воды на водород и кислород под действием постоянного электрического тока, последующий отвод газов и тепла из зоны электролиза за счет циркуляции электролита. Перемешивание последнего, помимо циркуляции, усиливается за счет пульсации давления, по крайней мере одного из газов, что достигается периодическим его накоплением и сбросом. Это, в конечном итоге, приводит к усилению миграции электролита в порах электрода, в частности анода.
Таким образом достигается упрощение процесса электролиза и обеспечение технических результатов, в частности увеличение ресурса электродов [2].
Технически способ реализуется с помощью установки, которая включает собственно электролизер, в корпусе которого размещены электроды, связанные с источником постоянного электрического тока. В установке смонтированы и устройства инфраструктуры, включающие средства заливки-слива электролита, сбора газовой смеси и перемешивания. Последнее выполнено в виде мембранного регулятора с пружиной, соединенного с патрубком сбора кислорода, снабженного дополнительной пружиной, связанной одной стороной шарниром со штоком мембраны, а другой – с корпусом регулятора. Для поддержания давления электролита ниже атмосферного предусмотрена специальная мембранная емкость, содержащая регулирующую пружину [2].
Недостатком способа-прототипа является его ограниченная применимость, распространяющаяся только на электролизеры с пористыми электродами. Применение способа в установках со сплошными электродами приведет к воздействию на электролит повышенных давлений со стороны пульсирующего газа, что, в конечном итоге, резко повысит работу пересыщения электролита газом и потребует дополнительных энергозатрат. Следует также отметить, что эффективность перемешивания, достигаемая за счет пульсации давления одного из газов и заключающаяся в усилении миграции электролита в порах электрода, будет значительно снижена в силу сопротивлений, вызванных капиллярными силами, действующими в жидкой среде, замкнутой в порах твердого тела. В случае способа-прототипа пульсации будут иметь место в областях электрода, близких к пространству, заполненному пульсирующим газом, и не коснутся других областей, расположенных дальше и глубже.
Установка, реализующая способ, включает в себя, помимо технологически необходимых устройств, средство создания пульсаций в одном из газов, выделяемых в процессе электролиза, которое содержит по меньшей мере пять различных упругих элементов, соблюдение соотношений между величинами жесткости которых и обеспечивает осуществление способа в том виде, как он описан. Известно, однако, что в процессе эксплуатации любой упругий элемент подвержен усталостным явлениям, меняющим его силовые характеристики. И в этом смысле, выход из номинального значения жесткости хотя бы одного упругого элемента из пяти приведет к искажению процесса регулирования перепада давлений и к снижению качественной стороны реализуемого способа, т.е. ухудшению процесса перемешивания. В конечном итоге, основным недостатком установки является ее низкая надежность, отражающаяся и на качестве способа.
Целью изобретения является создание условий, способствующих повышению производительности электролизера, и упрощение конструкции последнего, делающее его работу более надежной.
Поставленная задача, согласно изобретения, достигается за счет того, что в способе разложения воды в электролизере, включающем подвод электролита к электродам, разложение воды на водород и кислород под действием электрического тока, на электролит воздействуют пульсацией давления в виде циклических растягивающих напряжений по отнулевому циклу, создаваемых путем изменения в сторону увеличения рабочего объема электролизера, полностью заполненного электролитом, в направлении между двумя электродами. При этом пульсацию давления осуществляют с частотой не менее 5 Гц, и рабочий объем электролизера изменяют в сторону увеличения не менее 3% от первоначального. Электрический ток подают импульсами, совпадающими по фазе с циклами растягивающих напряжений на стадии их нарастания. Последние сочетают с напряжениями, превышающими предел прочности электролита на растяжение при отношении циклов между ними не менее 50 к 1. При реализации второго из напряжений электрический ток отключают.
Реализация описанного выше способа осуществляется с помощью электролизера, содержащего корпус, в котором смонтированы электроды, связанные с источником электрического тока, при этом, по меньшей мере один электрод выполнен в виде фрагмента корпуса и установлен с возможностью совершения возвратно-поступательных движений в направлении другого электрода.
Техническая сущность изобретения состоит в структурировании молекул электролита, которое заключается в их ориентации вдоль силового поля от катода к аноду путем растяжения электролита в этом направлении и ослабления, таким образом, внутримолекулярных связей, что, в конечном итоге, приводит к снижению энергозатрат на процесс диссоциации и повышению производительности по выходу получаемого газа. Другими словами, циклическая растягивающая электролит пульсация приводит к консолидации (укрупнению) пузырьков газа, собравшихся у электродов, и соответствующему увеличению активной (рабочей) поверхности у последних, способствуя повышению производительности. Укрупнение пузырьков приводит к образованию микропотоков электролита у поверхности электродов, активизируя его перемешивание за счет турбулизации и интенсифицируя отрыв образовавшихся пузырьков производимых газов. Это также повышает производительность и облегчает отвод газов. Совмещение импульсов растяжения и подачи тока на электроды способствует снижению энергоемкости процесса электролиза. Важным преимуществом является снижение работы и уровня пересыщения электролита растворенными газами, являющимися центрами образования зародышей газовой фазы, что происходит при растяжении жидкой фазы, т.е. электролита. Уменьшение уровня пересыщения ведет к уменьшению омического сопротивления электролита, что позволяет, при прочих равных с прототипом технологических показателях, повысить производительность электролизера. Этому же способствует и то, что во время действия растягивающих напряжений облегчается диссоциация воды на ионы H и ОН– за счет ослабления внутренних связей в молекулах Н2О. При этом подвижность ионов возрастает, что эквивалентно уменьшению сопротивления электролита.
Техническая реализация способа осуществляется в электролизере, конструкция которого проста и не выходит за рамки идеологии обычных гидравлических машин, в частности, силовых гидроцилиндров.
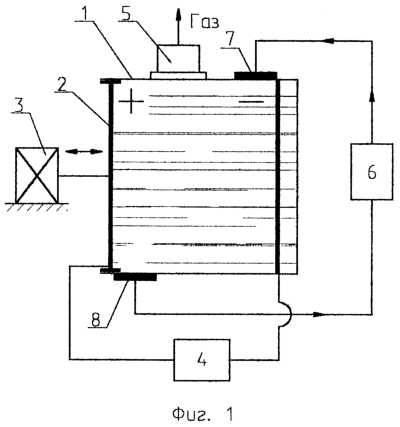
На фиг.1 и 2 схематически изображены два конструктивных варианта исполнения электролизера, реализующих предлагаемый способ.
На фиг.3 изображены циклограммы напряжений и тока, поясняющие сущность процесса, организуемого в электролизере.
На фиг.4 дано схематическое изображение фрагмента электрода для пояснения явлений, имеющих место у его поверхности при осуществлении предлагаемого способа.
Установка для осуществления способа электролиза воды состоит из корпуса 1, представляющего собой емкость с днищем, имеющая поперечное сечение любой формы, например цилиндрической. Крышка 2 корпуса 1 выполнена подвижной в режиме возвратно-поступательных перемещений и связана с соответствующим приводом 3. Крышка 2 может быть изготовлена в форме поршня (фиг.1) или мембраны (фиг.2). Внутри корпуса 1 смонтирован катод, который с анодом и источником 4 постоянного тока образуют силовую цепь электролизера. Анод последнего совмещен с крышкой 2. Источник 4 содержит устройство формирования импульсов тока, согласованных с циклами растягивающих импульсов или режимом движения подвижной крышки 2. Инфраструктура электролизера включает в себя устройства: 5 – отвода полученных газов и 6 – рециркуляционный насос электролита, связанный с полостью электролизера через клапаны: 7 – впуска и 8 – выпуска.
Работает установка с использованием предлагаемого способа следующим образом.
Исходное состояние установки для осуществления способа электролиза воды состоит в том, что полость корпуса 1 полностью заливают щелочным электролитом с 25% содержанием NaOH или 34% КОН. При этом в полости полностью исключают воздушные подушки, что может быть достигнуто стравливанием под контролем воздуха из электролизера при его заполнении электролитом.
В работу электролизер вводят включением привода 3, под действием которого крышка 2 начинает совершать возвратно-поступательные перемещения. Величина последних рассчитана таким образом, что рабочий объем электролизера изменяется не менее чем на 3% от первоначального в сторону увеличения, что создает по всему объему электролита растягивающие напряжения по отнулевому циклу. Перемещения носят циклический характер и частота колебаний устанавливается на минимальном уровне, т.е. 5 Гц, но может быть и более до ультразвукового диапазона. Изменение объема на 3% обеспечивает величину растягивающих напряжений менее предела прочности электролита, т.е. не нарушая его сплошности и не вызывая кавитационных явлений (см. фиг.3). Постоянный ток с источника 4 подается импульсами, совпадающими по фазе с циклами растягивающих напряжений на стадии их нарастания. Такой режим связан с тем, что в растянутом электролите резко падает величина пересыщения газом, в связи с чем уменьшается омическое сопротивление, что способствует уменьшению энергозатрат.
При растяжении электролита из-за ослабления внутримолекулярных связей интенсифицируется процесс ионизации, т.е. происходит увеличение катионов водорода и анионов кислорода, также способствующих увеличению выхода получаемых газов. Как показали исследования, на электродах в цикле возрастания растягивающих напряжений в электролите происходит “стягивание” мелких пузырьков полученного газа, ранее располагавшихся в виде пленки, в крупные пузыри, ориентированные в основном в направлении движения тока. Этот процесс сопровождается освобождением части поверхности электрода, на которой идет интенсивное газообразование. Образование крупных пузырей ведет к появлению между ними не только свободных поверхностей электрода, но и появлению микропотоков электролита, определяемых авторами как микровихри, которые интенсивно турбулизируют околоэлектродное пространство, тем самым улучшая перемешивание и интенсифицируя процесс газообразования (фиг.4). Крупные пузыри, в силу их большой “парусности”, легко отрываются от электрода рециркуляционным потоком электролита, создаваемого насосом 6, и улавливаются устройством 5 отвода полученного газа. Отключение тока на стадии уменьшения растягивающего напряжения в электролите связано с экономией электроэнергии, тем более, что на этой стадии все активные процессы, связанные с увеличением производительности, имеют тенденцию к затуханию в связи с ростом давления. К тому же омическое сопротивление электролита растет из-за повышения его плотности в этот момент. Через 50 растягивающих электролит циклов целесообразно осуществить очистку электродов от окислов путем создания в электролите кавитации, что достигается некоторым увеличением хода поршня или мембраны при отключенном электропитании (см. фиг.3) и закрытых клапанах 7 и 8. Таким образом происходит нарушение сплошности электролита из-за превышения предела его прочности, что стимулирует образование кавитационных пузырьков, которые при схлопывании создают ударные волны в объеме электролита, интенсивно очищая электроды.
Лабораторные исследования, проведенные в OOO ”ВРТ” для проверки основных положений предлагаемого способа, подтвердили его эффективность, что позволит при промышленном освоении увеличить коэффициент полезного действия электролизера в несколько раз.
Источники информации
1. Якименко Л.Н. Получение водорода, кислорода, хлора и щелочей. М.: Химия, 1981.
2. Патент РФ №2006527, кл. С 25 В 1/04, выдан 30.01.94 – прототип.
ФОРМУЛА ИЗОБРЕТЕНИЯ
1. Способ разложения воды в электролизере, включающий подвод электролита к электродам, разложение воды на водород и кислород под действием электрического тока, отличающийся тем, что на электролит воздействуют пульсацией давления в виде циклических растягивающих напряжений по отнулевому циклу, создаваемых путем изменения в сторону увеличения рабочего объема электролизера, полностью заполненного электролитом, в направлении между двумя электродами.
2. Способ по п.1, отличающийся тем, что пульсацию давления осуществляют с частотой не менее 5 Гц.
3. Способ по п.1, отличающийся тем, что рабочий объем электролизера изменяют в пределах не менее 3% от первоначального.
4. Способ по п.1, отличающийся тем, что электрический ток подают импульсами, совпадающими по фазе с циклами растягивающих напряжений на стадии их нарастания.
5. Способ по п.1, отличающийся тем, что растягивающие напряжения сочетают с напряжениями, превышающими предел прочности электролита на растяжение, при отношении числа циклов между ними не менее 50:1, при реализации второго из напряжений электрический ток отключают.
6. Электролизер, содержащий корпус, в котором смонтированы электроды, связанные с источником электрического тока, отличающийся тем, что, по меньшей мере, один электрод выполнен в виде фрагмента корпуса и установлен с возможностью совершения возвратно-поступательных движений в направлении другого электрода.
www.freepatent.ru
Разложение воды электрическим током « Учи физику!
Когда ток проходит через металлы, они не изменяются, кроме тех случаев, когда по тонкой проволоке пропускается ток большой силы. Тогда проволока раскаляется и может даже расплавиться. Жидкости проводят электрический ток не так, как металл. Жидкости разлагаются электрическим током, и вы можете легко произвести опыт разложения воды.
Достаньте два обрезка тонкой платиновой проволоки. Расплющите их немного и припаяйте к концам медных проволок. Платиновые проволоки воткните в пробку на небольшом расстоянии друг от друга так, чтобы места спаек с медными проволоками оказались в пробке. Этой пробкой заткните стеклянную воронку, как показано на рис. 123, и залейте еще сверху сургучом или стеарином, чтобы не просачивалась вода.
Воронку укрепите на подставке, налейте в нее воды и прибавьте немного серной кислоты. Теперь соедините медные проволоки с батареей из 2—4 элементов, и вы увидите, что платиновые проволоки покроются пузырьками, которые начнут отрываться и всплывать на поверхность. Вместо оторвавшихся пузырьков появятся новые, и, наконец, вода как будто «закипит». Это ток разлагает воду на составные части.
Вода состоит из двух газов: водорода и кислорода. Образующиеся вокруг проволок пузырьки газа —ето и есть водород и кислород. Газы эти легко собрать и, исследуя их, убедиться, что мы получили действительно водород и кислород.
Налейте в две пробирки воды, подкисленной серной кислотой, заткните одну из пробирок пальцем и опустите ее в воронку отверстием вниз. Когда отверстие пробирки будет в воде, отнимите палец. Вода из пробирки не потечет, — вы, наверное, помните, каким физическим законом объясняется это явление. Наденьте теперь пробирку на одну из платиновых проволок; маленькие пузырьки газа, поднимаясь кверху, будут скопляться у дна и постепенно вытеснят воздух из пробирки. Когда пробирка наполнится газом, снимите ее и быстро заткните пальцем, чтобы не выпустить газа. Таким же образом можно собрать газ с другой проволоки.
Уже в самом начале разложения воды можно заметить, что вокруг одной платиновой проволоки образуется вдвое больше пузырьков, чем вокруг другой. Зная, что вода состоит из двух частей водорода и одной части кислорода, вы легко догадаетесь, что в той пробирке, где пузырьков вдвое больше, выделяется водород, а в другой, следовательно,, кислород. Заметим, что водород выделяется проволокой, соединенной с цинком батареи, значит, с отрицательным полюсом ее. Если вы поднесете зажженную спичку к пробирке, снятой с этой проволоки, послышится слабый взрыв, и газ загорится голубоватым пламенем. Значит, это действительно водород.
Кислород не горит, но зато прекрасно поддерживает горение. Дерево гораздо сильнее разгорается в кислороде, чем в воздухе. Вы можете это сейчас же проверить. Опустите в пробирку, наполненную кислородом, тлеющую спичку, и она вспыхнет ярким пламенем.
В конце книги вы прочтете о том, как получить водород и кислород химическим способом и произвести с ними мною интересных опытов.
Б. Донат
“Физика в играх”
uchifiziku.ru
разложение воды под действием электрического тока на водород и кислород-это хим. или физ. явление?
разложение в данном случае происходит под действием физического фактора и потому утверждать что реакция химическая лишь потому что из одного сложного вещесва образуются два простых нельзя. Разложение воды под действием тока это и правда электролиз. Реакция протеает не за счет химических веществ.
Вам необходимо выучить, что такое химическое явление и что такое физическое явление и знать разницу между ними. Например, при кипячении воды образуется пар. Это физическое явление, т. к. происходит переход из одного агрегатного состояния в другое (из жидкости в газ) , а при пропускании постоянного электрического тока вода разлагается на кислород и водород, которые по химическим и физическим свойствам разнятся от свойств воды, поэтому данное явление – химическое, в данном случае произошла химическая реакция (реакция разложения) , когда из одного сложного вещества (вода) получили два простых (кислород и водород).
touch.otvet.mail.ru
Электролиз при действии постоянного ток
Процесс окисления — восстановления, который осуществляется действием постоянного электрического тока, называется электролизом. [c.162]Принято различать электролиз расплавов и растворов электролитов. В последнем случае необходимо учитывать, что помимо ионов, на которые диссоциирует электролит, в растворе содержатся ионы Н+ и ОН , получающиеся при диссоциации воды. Под действием постоянного электрического тока осуществляется направленное движение ионов к соответствующим электродам. Ионы разряжаются на электродах в последовательности, определяемой теми же двумя факторами 1) силой окислителя и [c.106]
Под электролизом понимается разложение химического соединения действием постоянного электрического тока, например разложение воды на водород и кислород. [c.409]
Действие постоянного электрического тока на влажный грунт вызывает в нем электроосмос, электрофорез, электролиз, обменные реакции, образование и накопление новых химических соединений. [c.95]
Для электролиза воды нужен набор аппаратов. Их соединяют в технологическую схему. Основной аппарат схемы — это электролизер. В нем под действием постоянного электрического тока часть воды разлагается на водород и кислород,- а электролит непрерывно циркулирует, проходя через электролитические ячейки, а затем через холодильник. Циркулирующий электролит увлекает с собой выделившийся водород и кислород. Газы отделяются от него и собираются раздельно. Далее газы проходят через аппараты для отделения брызг электролита, промыватели и холодильники (конденсаторы). [c.19]
Приготовление электролитически осажденного серебра. При получении серебра в качестве анода используют серебряную пластину (серебро должно быть совершенно чистым, применять его сплавы нельзя), катодом служит серебряная проволока или пластина, а электролитом— раствор 0,7 г нитрата серебра в 200 мл 0,5%-ной азотной кислоты. Серебро в виде нитевидных кристаллов осаждается на катоде под действием постоянного тока (1,5—2 В). Во время электролиза образовавшиеся кристаллы стряхивают с катода по мере их накопления, что убыстряет процесс. По окончании электролиза, т. е. полного растворения анода, кристаллы серебра отфильтровывают, промывают водой и сушат на воздухе. [c.51]
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах под действием постоянного электрического тока. Он возможен в растворах или расплавах электролитов. При электролизе на отрицательно заряженном электроде (катоде) происходит процесс восстановления, на положительно заряженном электроде (аноде) — процесс окисления. Инертные электроды графит, золото, платина) в процессе электролиза химически не окисляются. Ако-ды из более активных металлов (никель, железо, медь и др.) при электролизе могут окисляться, при этом идет их растворение. [c.246]
При электролизе вещество разлагается под действием постоянного электрического тока. При пропускании тока через раствор или расплав электролита положительно заряженные ионы перемещаются к катоду, а отрицательно заряженные — к аноду. На электродах ионы разряжаются и происходит выделение составных частей электролита или водорода и кислорода воды. [c.127]
Механизм электролиза. Окислительно-восстановительный процесс, протекающий под действием постоянного электрического тока, проходящего через раствор электролита или через расплавленный электролит, называется электролизом. При электролизе водных растворов электролитов на катоде восстанавливаются ионы водорода Н+ или другие катионы, а на аноде окисляются или ионы гидроксила ОН”, или другие ионы, или сам анод. Анод может быть растворимым и нерастворимым. Если при электролизе вещество, из которого изготовлен анод, окисляется, то анод называется растворимым. В противном случае анод будет нерастворимым (таковы, например, платиновый и графитовый аноды). Процессы электролиза и получения тока в гальванических элементах взаимно противоположны. Так, гальванический элемент [c.302]
Вместе с тем, незначительное количество водорода в системе исключает возможность образования большого объема взрывоопасной смеси водорода с окислителем (хлором, воздухом). Поэтому, несмотря на наличие в процессе электролиза множества постоянно действующих источников воспламенения (открытые [c.30]
Существуют два варианта метода. 1. Выделение вещества происходит при действии постоянного тока, получаемого от внешнего источника (внешний электролиз). 2. Выделение вещества происходит при действии постоянного тока, возникающего при погружении в анализируемый раствор гальванической пары (внутренний электролиз) [1]. [c.133]
Существуют два варианта электровесового метода. По первому из них, наиболее широко распространенному, который собственно и называют электровесовым методом, выделение веществ на электродах происходит при действии постоянного тока, полученного от внешнего источника (аккумулятора, выпрямителя и т. п.). По второму варианту постоянный ток возникает при погружении в анализируемый раствор так называемой гальванической пары, и в этом случае внешнего источника тока не требуется Этот вариант электровесового анализа называют методом внутреннего электролиза. [c.254]
Основной процесс получения из рассола под действием постоянного тока хлора, каустической соды и водорода осуществляется в цехе электролиза в диафрагменных ваннах с твердым катодом. [c.85]
Электролитический метод нанесения металлического слоя состоит в электролизе растворов, содержащих соль осаждаемого металла. Анодом (за редким исключением) служит металл покрытия, катодом — образец (изделие). Под действием постоянного электрического тока, получаемого от внешнего источника (аккумулятор, выпрямитель и др.), на катоде, куда притекают из внешней цепи электроны, происходит разряд положительно заряженных ионов металла из раствора и образование металлопокрытия. Растворяющийся при электролизе анод посылает в раствор положительно заряженные ионы металла, поддерживая тем самым постоянство их концентрации. [c.172]
Прохождение постоянного тока через проводники второго рода вызывает химическое разложение вещества. На электродах при этом образуются продукты окисления — восстановления. На положительном электроде (аноде) протекает окисление, на отрицательном (катоде) — восстановление. Процесс разложения вещества под действием постоянного электрического тока называется электролизом. [c.11]
Явление электролиза. Разложение электролитов под действием постоянного электрического тока с образованием новых химических вешеств на электродах, подводящих ток, называется электролизом. Аппараты, в которых проводится электролиз, называют электролизерами (электролитические ванны или просто ванны). [c.308]
www.chem21.info
Разложения реакции I воды током I действием
Электрохимическая кинетика — это область гетерогенной кинетики, в которой изучают скорости межфазных реакций между заряженными частицами. Электрохимические реакции идут под действием поляризующего источника тока, поставляющего электроны к одному из электродов (катоду) и отводящего от другого электрода (анода). Происходящие при этом реакции восстановления или окисления приводят к разложению растворенного электролита или растворителя (воды). Это явление, называемое электролизом, подчиняется законам Фарадея. Скоростью электрохимической реакции можно управлять с помощью делителя напряжения (см. рис. ХП.5 и XXV. 2). [c.291]Если же в результате движения материальных частиц вещества изменяют свой качественный состав и вследствие этого приобретают новые качества, то такие явления называются химическими явлениями или химическими реакциями, К таким явлениям относятся, например, горение угля с образованием нового вещества — углекислого газа, образование ржавчины на железе под влиянием влаги и кислорода воздуха, разложение воды на кислород и водород под действием электрического тока и т. д. [c.6]
Действие электрического тока вызывает многие химические реакции. Так, при пропускании электрического тока через подкисленную воду происходит выделение водорода и кислорода при пропускании тока через расплавленный хлористый натрий (поваренную соль) происходит разложение этого вещества на металлический натрий и газообразный хлор и т. д. [c.15]
Явление электролиза на примере разложения воды под действием электрического тока впервые было обнаружено еще в конце XVIII столетия. Существование строгой пропорциональности между количеством протекшего электричества и количеством выделенного на электродах вещества было установлено значительно позже М. Фарадеем. Открытые им в 1833 г. законы электролиза по существу приводятся к одному фундаментальному положению, непосредственно вытекающему из самой природы электрохимических реакций. Закон Фарадея состоит в утверждении, что на каждый фарадей количества электричества, пропущенного через электролитическую ячейку, в электрохимическую реакцию на аноде и на катоде вступает по одному грамм-эквиваленту вещества. [c.26]
Таким путем определяют медь, свинец, висмут, кадмий и некоторые др. металлы. В качестве катода удобно брать металлическую ртуть, так как образование амальгам облегчает электролитическое выделение многих металлов. С другой стороны, на металлической ртути сильно затруднено выделение водорода, и поэтому легко избежать побочной реакции разложения воды под действием электрического тока. [c.221]
Кулонометрическое титрование. Сущность метода заключается в том, что параллельно с электрохимической реакцией, протекающей под действием электрического тока, в растворе происходит также химическая реакция между определяемым веществом и продуктом электрохимической реакции. Электролиз ведут в растворе, содержащем большой избыток посторонних ионов, которые также способны к электрохимическому превращению таким приемом устраняют нежелательные побочные реакции, главная из которых— разложение воды. [c.517]
Во всех перечисленных случаях электрический ток расходуется непосредственно на окисление или восстановление определяемых ионов. Однако такие прямые кулонометрические методы сравнительно редко применяются на практике. Значительно большее распространение получил метод так называемого кулонометрического титрования. В этом методе параллельно с электрохимической реакцией, протекающей под действием электрического тока, в растворе происходит также химическая реакция между определяемым веществом и продуктом электрохимической реакции. Ток расходуется главным образом на электрохимическое окисление-восстановление посторонних ионов, которые специально вводят в раствор в большом избытке. Продукты окисления-восстановления реагируют далее с определяемым веществом. Такой прием позволяет устранить нежелательные побочные реакции, главная из которых — разложение воды. [c.228]
Какие типы превращения может иметь хлорноватистая кислота какие условия способствуют превращению по одному из этих направлений При получении белильной извести ток хлора пропускают в насыщенный раствор гидрата окиси кальция, охлажденный водой. За счет какой реакции будет выделяться теплота при пропускании хлора в раствор гидрата окиси кальция Что будет образовываться в растворе, если не отводить выделяющуюся теплоту Зачем при получении белильной извести необходимо охлаждение За счет какого вещества раствор белильной извести обладает белящим действием Напишите уравнения реакций взаимодействия белильной извести с растворами кислот угольной и серной. Какие продукты получаются при термическом разложении белильной извести [c.35]
Наличие свободной серной кислоты в пределах содержания ее в техническом железном купоросе (10—15 г/л) не отражается отрицательно на выходе по току Ре (И1). (Заметной разницы в показателях при окислении растворов реактивного и технического железного купороса не выявлено.) Положительное действие кислоты можно, по-видимому, усмотреть в том, что она сдвигает потенциал нежелательного процесса разложения воды в область более положительных значений и тем самым облегчает преимущественное протекание реакции окисления ионов железа. [c.106]
Было изучено действие отвержденной эпоксидной смолы на металлические поверхности [Л. 4-11]. Установлено, что результаты зависят как от структуры эпоксидной смолы, так и от металла. Коррозия металла вызывается непосредственно химическими реакциями и ускоряется при пропускании тока. Коррозия замедляется, если на поверхности металла образуются нерастворимые продукты и, наоборот, ускоряется при удалении таких продуктов. Значительное влияние оказывает отсутствие или присутствие воды. Кроме того, важное значение имеют концентрация и подвижность ионов, образующихся в эпоксидной смоле, проницаемость воды и электролитов в эпоксидную смолу, гип и концентрация наполнителя. Эпоксидные смолы вызывают слабую коррозию меди [Л. 4-92], однако она может быть усилена продуктами разложения эпоксидных смол [Л. 4-104]. [c.68]
Под действием тока сульфат–(2nt) ионы (рис. 30) переходят из католита в анолит. На аноде происходит разложение воды по реакции [c.116]
В принципе можно выбрать такую силу тока в электролитической цепи, чтобы она составляла менее 1 % величины диффузионного предельного тока. В этом случае мешающие реакции начинают протекать только после того, как прореагировало 99% определяемого вещества. Попрешность составляет, таким образом, менее —1%. Но проведение анализа при небольшой силе тока требует больших затрат времени. Поэтому обычно поступают по-другому в анализируемый раствор вво-.дят довольно большую концентрацию вспомогательного ре-.агента, окислительно-восстановительный потенциал которого немного больше
www.chem21.info
Есть ли способ разделение воды на кислород и водород без нагревания и электричества?
Есть. Рассмотрим все способы получения водорода из воды… Вода – очень устойчивое соединение. Для разложения воды на водород и кислород чаще всего используют электрический ток. Реакцию разложения вещества под действием электрического тока называют электролизом. Разложить воду можно так же нагрев ее до высокой температуры ( выше 2500 °С. ). Впервые водород из воды выделил французский химик А. Лавуазье. Он пропускал водяной пар через железную трубу, раскаленную докрасна в пламени. При высокой температуре вода взаимодействует с железом, образуя железную окалину Fe3O4, а водород выделяется в свободном виде. Металлы, расположенные в ряду активности левее магния, вытесняют водород из воды уже при комнатной температуре. К их числу относится натрий. Реакция воды и натрия сопровождается выделением теплоты. Ну и как правильно заметил Mikhail Levin, затраты на получение водорода всегда выше чем при его сгорании.
разве что химикаты какие засыпать
Если бы я такой знал, вам бы точно не сообщил. Я бы стал тогда миллиардером.
Берешь молекулу воды, атом кислорода складываешь в одну баночку, атомы водорода в другую, потом, следующую молекулу…
по любому, придется затратить больше энергии, чем потом получится при сжигании водорода.
touch.otvet.mail.ru