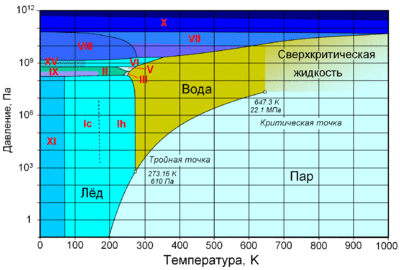
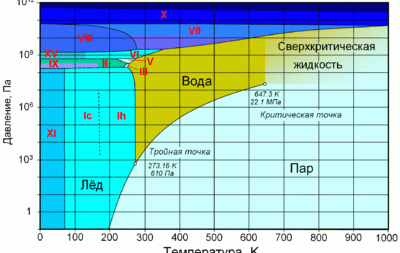
Температура плавления льда = температура замерзания воды в зависимости от давления 1-2100 бар. Таблица.Имеется в виду обычный Лед I. Практически несжимаем, сжимаемость в 4 раза хуже, чем у воды. Плотность примерно 920 кг/м3
|
dpva.ru
Наибольшая плотность и температура замерзания воды
Пресная вода приобретает наибольшую плотность при температуре +4°. По мере понижения температуры пресной воды до 4° плотность ее увеличивается, достигает наибольшей величины при 4°, и при дальнейшем охлаждении плотность ее начинает уменьшаться.
В морской воде температура, соответствующая наибольшей плотности ее, находится в зависимости от степени солености воды; с увеличением солености температура наибольшей плотности понижается.
Температура замерзания пресной воды равна 0°, в морской же воде она зависит от степени солености, чем последняя больше, тем и температура замерзания ниже.
Таким образом, оказывается, что и температура наибольшей плотности и температура замерзания морской воды – обе зависят от степени солености, и с увеличением последней обе тоже понижаются, но только не одинаково быстро: понижение температуры наибольшей плотности идет быстрее. Зависимость между этими двумя свойствами морской воды и ее соленостью видна из следующей таблицы:
Отсюда видно, что при солености 24,695‰ температуры наибольшей плотности (6) и замерзания (т) сравниваются, и при больших соленостях температура наибольшей плотности уже ниже температуры замерзания. Иначе говоря, при соленостях более 24,7‰ морская вода до самого момента замерзания становится все тяжелее и тяжелее, тогда как пресная вода или мало соленая – обратно. Влияние этих условий на замерзание морской воды подробнее разобрано далее в статье о льдах в океанах.
~1~ ~2~ ~3~ ~4~ ~5~ ~6~ ~7~ ~8~ ~9~ ~10~ ~11~ ~12~ ~13~ ~14~ ~15~ ~16~ ~17~ ~18~ ~19~ ~20~ ~21~ ~22~ ~23~ ~24~ ~25~ ~26~ ~27~ ~28~ ~29~ ~30~ ~31~ ~32~ ~33~ ~34~ ~35~ ~36~ ~37~ ~38~ ~39~ ~40~ ~41~ ~42~ ~43~ ~44~ ~45~ ~46~ ~47~ ~48~ ~49~ ~50~ ~51~ ~52~ ~53~ ~54~ ~55~ ~56~ ~57~ ~58~ ~59~ ~60~ ~61~ ~62~ ~63~ ~64~ ~65~ ~66~ ~67~ ~68~ ~69~ ~70~ ~71~ ~72~ ~73~ ~74~ ~75~ ~76~ ~77~ ~78~ ~79~ ~80~ ~81~ ~82~ ~83~ ~84~ ~85~ ~86~ ~87~ ~88~ ~89~
techpharm.ru
при какой температуре вода замерзает
Здравствуйте! Принято считать, что при нормальном атмосферном давлении и наличии в воде микро-взвесей – ядер кристаллизации вода начинает кристаллизовываться при слабо отрицательной температуре (-0,1 С) , именно поэтому в шкале Цельсия значение 0 градусов и принято за значение температуры фазового перехода Вода-Лёд и Лёд-Вода. Но ещё давно было обнаружено, что вода иногда сохраняется в жидком виде и не замерзает при довольно низкой температуре. Это чаще всего наблюдается с чистой дистиллированной водой, поскольку в ней нет микровзвесей (служащих ядрами кристаллизации) и можно обнаружить такую жидкую воду при температуре даже -20 С. С этим часто сталкиваются метеорологи, когда проводят наблюдения по психрометру, у которого один их термометров обёрнут батистом, смоченным дистиллированной водой. Поэтому при наблюдении при низкой температуре воздуха записывается в данных смоченного термометра “лёд! ” или “вода! “”, поскольку при разном состоянии воды на смоченном термометре расчёт влажности будет разным. Но чаще всего переохлаждённая и незамёрзшая вода встречается в атмосфере. Микрокапельки облаков (а это также дистиллят) не замерзают даже до -30 С и иногда ниже (облака нижнего яруса) , в то время как облака среднего (2-6 км) и верхнего (более 6 км) обычно состоят из микрокристаллов. Выпадение переохлаждённого дождя при отрицательной температуре воздуха, хотя и редкое, но очень опасное явление природы – ГОЛОЛЁД, вызывающее быстрое намерзание льда на проводах, ветвях и деревьях, массовые обломы ветвей и даже падения деревьев, а также обрывы проводов и не нужно путать это явление с ГОЛОЛЕДИЦЕЙ – скользкой дорогой (которое наблюдается всю зиму) . Подробнее см. по этому вопросу мой ответ на вопрос: <a rel=”nofollow” href=”http://otvet.mail.ru/question/9919177/” target=”_blank”>http://otvet.mail.ru/question/9919177/</a> Кроме того, из-за наличия в атмосфере переохлаждённых капельно-жидких облаков при отрицательной температуре возникает очень опасное явление погоды для авиации – Обледенение ВС (воздушных судов) . При этом переохлаждённые капельки облака при встрече с поверхностью ВС ударяются об неё и мгновенно намерзают, создавая очень плотный “матовый лёд”, обладающий сильной адгезией (“налипанием на поверхность”). Поэтому лёд начинает быстро нарастать на крыльях, фюзеляже, воздухозаборниках двигателей и даже на винтах винтомоторных самолётов! Из за обледенения в мире уже произошло в истории авиации сотни авиапроисшествий, и к сожалению, они продолжают происходить, несмотря на применяемые технические средства по удалению обледенения с поверхности ВС и тщательные рекомендации авиационных синоптиков по обходу опасных зон обледенения. Мне пришлось участвовать в расследовании нескольких таких авиапроисшествий. Так что переохлаждённая вода в атмосфере не так уж и безобидна! Всего Вам доброго
273 по Кельвину )
Вода вроде при нуле градусов, а молоко по-моему -1 , -2 градуса!Когда воде захочется тогда она и замерзает!
чистая дистилированная вода замерзает при 0 градусов по цельсию, вода из крана замерзает при температуре -3 -4 градуса0 градусов однако, если в воду добавить соль, то температура замерзания уменьшится
0 градусов Цельсия – температура таяния льда. Замерзает же вода при любой температуре ниже этой точки.
конешн при нуле!
При нуле замерзает! Становится льдом тоже при нуле!
завидую тебе, Люба! столько ответов на пустой вопрос…. может мне тоже фото с декольте сделать….
а кто ее знает..?)… даже нет интереса.. думать..
ннннннннннннннннннууууууууууууууууууу вввввввввввввроде -2 застывает а точно позвони в гидромицентр!
а я в школе не учуся не знаю! ! но по моему -273 мир перестает вообще существовать!!
touch.otvet.mail.ru
Зависит ли температура замерзания воды от атмосферного давления?
Все же на кипение все перевели: плохо предупреждение читали. Естественно, что зависит: молекулы воздуха движутся быстрее молекул замерзающей воды и передают ей часть энергии. Атмосферное давление определяется в самом общем плане плотностью воздуха (количеством молекул в единице объема в переводе на эти условия). При высоком давлении молекул воздуха будет больше и столкновений с молекулами воды также. Отсюда вывод, что чем выше давление, тем меньше должна быть энергия молекул воды, а температура – мера кинетической энергии молекул. Значит при высоком давлении замерзание начнется при более низкой температуре.
Зависит, поэтому высоко в горах невозможно сварить яйца. Вода кипит, а температура кипения ниже 100, вот ино и не варятся
да, и температура кипения тоже зависит от даления
Температура замерзания воды с увеличением давления понижается, а не повышается, как это следовало бы ожидать. Этой аномалией можно объяснить существование жидкой воды на больших глубинах в морях при температуре, значительно ниже 0°С. Только немногие вещества (висмут, галлий, германий и др. ) имеют такую же аномалию, при которой твердая фаза легче жидкой. При замерзании чистая вода расширяется почти на 10%, у морского льда изменение объема происходит на меньшую величину. Поскольку вода при замерзании расширяется, увеличение внешнего давления понижает температуру ее замерзания; температура плавления льда, наоборот, повышается с давлением. В лабораторных условиях при давлении более 40 тыс. атмосфер можно получить лед, который будет плавиться при температуре 175°C. Теплоемкость и теплота плавления льда уменьшаются с температурой, теплопроводность же почти не зависит от температуры. ================= Между внешним давлением и точкой замерзания (плавления) воды наблюдается интересная зависимость. С повышением давления до 2200 атмосфер она падает: с увеличением давления на каждую атмосферу температура плавления понижается на 0,0075°С. При дальнейшем увеличении давления, точка замерзания воды начинает расти: при давлении 3530 атмосфер вода замерзает при -17°с, при 6380 атмосферах – при 0°С, а при 20670 атмосферах – при 76°С. В последнем случае будет наблюдаться горячий лед.
touch.otvet.mail.ru
При какой температуре замерзает дистиллированная вода?
Ответ на этот вопрос представляется очевидным – при 0 градусов Цельсия, – однако он не совсем корректен. Если подвергнуть медленному охлаждению очень чистую (дистиллированную ) воду, то она может оставаться жидкой и при температуре в несколько градусов ниже нуля. Однако, если в эту переохлажденную воду бросить маленький кусочек льда, щепотку снега или просто пыли, вода мгновенно замерзнет, прорастая по всему объему длинными кристаллами. Столь странное поведение воды объясняется особенностями процесса кристаллизации. Превращение жидкости в кристалл происходит в первую очередь на примесях и неоднородностях – частичках пыли, пузырьках воздуха, царапинах на стенках сосуда. Чистая вода центров кристаллизации практически лишена, поэтому она может переохлаждаться (и довольно сильно) , оставаясь жидкой. При атмосферном давлении температура кипения дистиллированной воды +100 градусов Цельсия
В учебнике химии за 8 класс написано что при нуле градусов по Цельсию замерзает) Кипит при +100C
-50 градусов замерзнет любая! +100 радусов закипает любая!
0 градусов по Цельсию замерзает, 100 градусов закипает!
при 0С замерзает, при 100С закипает вот если ее хорошо посолить то замерзать она будет при -2, -3 С а точка кипения зависит от давления: чем ниже давление тем при более низкой температуре кипит вода и наоборот
Выше чем обычная
при 0 градусов она не замерзнет, при -1 уже начнет замерзать. 0 градусов это таккая температура, при которой вода еще остается водой (при охлаждении) , а лед – льдом (при нагревании)
Дистиллированная вода, совершенно лишённая всяких примесей, не имеет и ядер кристаллизации, а поэтому её замерзание начинается при очень низких температурах. Начальная точка замерзания дистиллированной воды составляет -42 градуса. Учёным удалось добиться переохлаждения дистиллированной воды до -70 градусов.
Замерзание дистиллированной воды происходит при температуре примерно -10-11С
что нужно добавить в дистиллированную воду чтобы она не замерзала в системе охлаждения двигателя внутреннего сгорания
touch.otvet.mail.ru
При какой температуре замёрзнет вода в водопроводной трубе? Зависит ли это от давления воды в трубе?
“Как известно, вода находящаяся под давлением не замерзает” кто вам это “напел” , не зависит температура кристализации от давления! Давление может повысить температуру воды, не не т замерзания! А в колонках вода не замерзает потому что клапан стоит внизу, в земле, там тепло, и после закрытия клапана столб воды просто сливается в землю, магистраль которая идет на верх просто остается БЕЗ ВОДЫ, вот и не замерзает. Обратите внимание, когда нажимаете на рычаг колонки, вода не сразу идет, а сначала заполняет вертикальную трубу. Кто то своим больным умом смекнул что вода в колонках не замерзает, а выводы, ума сделать не хватило, а вы этот бред разносите.
если речь идето водопроводе то при открытом кранике вода не замерзнет даже при -50
текучая не замерзает, а стоячая.. . какое ж там давление???
При 0°С. От давления в трубе это почти не зависит. Я так думаю. Да и какое там давление? Высота водонапорной башни. Каждые 10м дают одну атмосферу всего.
Для меня это новость.
Температура замерзания воды понижается при увеличении давления примерно на 1 гр. С на каждые 130 атм. и достигает минимума (-22 гр. С) при давлении 2200 атм. При дальнейшем увеличении давления температура замерзания увеличивается и может стать выше 0 гр. (при очень большом давлении).
touch.otvet.mail.ru
Температура замерзания, определение – Справочник химика 21
Константа замерзания (криоскопическая постоянная) Кзам, или моляльное понижение температуры замерзания, является величи ной, характерной для данного растворителя и независящей от при роды растворенного вещества. Физический смысл ее ясен из при веденного уравнения К зам — ЭТО понижениб температуры замерза ния раствора, содержащего 1 моль вещества в 1000 г растворителя при условии, что раствор этой концентрации обладает свойствами идеального и растворенное вещество не диссоциирует и не ассо циирует. Для экспериментального определения Кзаи следует изме рить понижение температуры замерзания разбавленных растворов а затем пересчитать эти данные на 1 моль. [c.78]Исследование свойств разбавленных растворов неэлектролитов пока ало, что понижение давления пара, повышение температуры кипения и понижение температуры замерзания обусловлены только числом растворенных частиц в определенном количестве данного растворителя и не зависят от природы растворенного вещества. В этом заключается сущность законов Рауля. [c.131]
Даны эмпирические зависимости для определения температуры замерзания пластовых вод и таблица для нахождения глубины заложения водоводов в зависимости от типа грунта и плотности воды. [c.139]
На основании данных о понижении температуры замерзания раствора или повыщения температуры кипения нельзя установить молекулярную массу макромолекул, но для определения ее может использоваться четвертое и последнее коллигативное свойство растворов, осмотическое давление. [c.145]
При сгорании спиртов развивается меньшая температура, что облегчает создание надежно работающего двигателя. Кроме того, спирты имеют более высокую теплоемкость и скрытую теплоту испарения, чем нефтепродукты. Это обстоятельство, а также высокое относительное содержание спиртов в готовых топливных смесях (до 40—50%) дает возможность с успехом использовать спирты для охлаждения стенок камеры сгорания. Этиловый спирт (этанол) СгН ,ОН имеет температуру кипения 78° С и очень низкую температуру замерзания —П4. Обычно применяют спирт ректификат, содержащий около 6% воды по весу плотностью около 0,814 или же водные растворы спирта еще меньшей концентрации. При смешении этилового спирта с водой из-за гидратации (образования групп молекул С2Н5ОН-л НгО) происходит уменьшение объема и плотность оказывается повышенной. Добавление воды в спирт, при определенных условиях может играть положительную роль, так как она понижает температуру сгорания и одновременно увеличивает газообразование и массу отбрасываемого вещества. [c.122]
Можно было бы считать прямыми ответами на этот вопрос как истинное предложение Температура замерзания воды при нормальных условиях 32°F , так и ложное Температура замерзания воды при нормальных условиях 0°Ру>. С другой стороны, хотя не требуется, чтобы прямой ответ был истинным, необходимо, чтобы он имел правильную форму в противном случае ответ не считается прямым. Так, предложение Температура замерзания воды при нормальных условиях указана в Справочнике по химии и физике- – не является прямым ответом на вопрос (1), поскольку в нем содержится всего лишь инструкция, по которой спрашивающий может сам найти истинный и прямой ответ на вопрос. Кроме того, следует подчеркнуть, что этим предложением не ограничивается выполнение задания, поставленного в вопросе,— после того как спрашивающий получит такой ответ на вопрос (1), ему предстоит еще проделать определенную работу, чтобы получить окончательный и удовлетворяющий его ответ. То же самое, хотя и в меньшей степени, верно для предложений типа Температура замерзания воды при нормальных условиях на 211° F выше, чем температура замерзания спирта- или Температура замерзания ва ы при нормальных условиях Итак, хотя для какой-то части спрашивающих эти предложения могут оказаться небесполезными, ни одно из [c.24]
Предварительно многократно определяют температуру замерзания растворителя, затем после внесения определенного количества растворенного вещества в данный растворитель — температуру замерзания получепного раствора. Процесс кристаллизации чистого растворителя, начиная с появления первого кристаллика до полного затвердевания всей жидкости, протекает при постоянной и [c.187]
Отклонения температур замерзания, вычисленных для идеальных растворов, от температур замерзания, определенных экспериментально для концентрированных растворов и приписывавшиеся раньше необходимости введения поправки на образование твердых растворов, в действительности, как показано теперь, обусловлены применением заниженного значения теплоты плавления безводной перекиси водорода. [c.185]
Основными физическими характеристиками нефтей, их фракций и нефтепродуктов являются плотность и молекулярный вес. Для определения плотности применяют различные пикнометры. Чтобы установить молекулярный вес, измеряют температуру замерзания какого-либо чистого вещества, которое является растворителем (бензол, циклогексан, фенол и др.). Затем определяют температуру замерзания растворителя при добавлении в него исследуемой нефтяной фракции или нефтепродукта. Раствор замерзает при более низкой температуре, чем чистый растворитель. По этой разнице температур можно вычислить молекулярный вес исследуемого вещества. [c.232]
Для большинства ранее проводившихся определений молекулярного веса углеводородов применялись простые формы криоско-пического метода (понижение температуры замерзания [348—353]). Было использовано много растворителей, но для лучших из них точность определения составила 1—2 %. Эбулиоскопические методы (повышение температуры кипения) обычно более быстрые и такие же точные [354—358]. Наконец был сделан обзор но сравнению этих двух методов в нескольких различных нефтяных лабораториях. Низкие молекулярные веса обычно определяют по методам плотности паров [359—360]. Все эти методы дают ряд средних молекулярных весов, определяемых [c.206]
К сожалению, способ определения молекулярной массы по изменению температуры замерзания или кипения раствора имеет свои пределы. Для соединений с большой молекулярной массой оказывается трудным ввести [c.144]
В соответствии с классическим определением Аррениуса (1887 г.) кислотами называют вещества, которые в водном растворе диссоциируют с образованием ионов водорода, а основаниями — вещества, диссоциирующие с образованием ионов гидроксила. Это определение было большим шагом вперед по сравнению с эмпирическими критериями, которые, правда, и до настояш,его времени используются на практике для оценки кислотно-основных свойств веществ. В соответствии с классической теорией для кислот и оснований характерна реакция нейтрализации, в результате которой образуется вода, а типичные свойства прореагировавших компонентов исчезают. При выпаривании раствора получается соль, катио
www.chem21.info