4.6.1. Теоретические основы процесса ректификации
Ректификация — процесс разделения жидких летучих смесей на компоненты или группы компонентов (фракции) путем многократного двустороннего массо- и теплообмена между противоточ- но движущимися паровым и жидкостным потоками. Необходимое условие процесса ректификации —■ различная летучесть (упругость пара) отдельных компонентов.
При взаимодействии противоточно движущихся потоков в процессе ректификации происходит диффузия легколетучего компонента (J1J1K) из жидкости в пар и труднолетучего компонента (ТЛК) из пара в жидкость. Способ контактирования потоков может быть ступенчатым (в тарельчатых колоннах) или непрерывным (в насадочных колоннах).
В результате многократно повторяющегося на последовательных тарелках (ступенях) контактирования движущихся в противотоке по высоте колонны жидкости и пара составы взаимодействующих фаз существенно изменяются: паровой поток при движении вверх обогащается JTJTK, а жидкостный, стекая вниз, обедняется им, т. е. обогащается ТЛК. При достаточно большом пути контакта противоположно движущихся потоков по колонне в итоге можно получить пар, выходящий из верхней части колонны, представляющий собой более или менее чистый ЛЛК, конденсация которого дает дистиллят, а из нижней части колонны — сравнительно чистый ТЛК, так называемый кубовый остаток.
Жидкостный поток в колонне (флегма) образуется в результате частичной конденсации пара, выходящего из верхней части колонны, в специальных теплообменных аппаратах — дефлегматорах или вводится в колонну в виде питания. Для создания парового потока в нижнюю часть колонны вводят определенное количество теплоты непосредственным впуском греющего пара (случай открытого обогрева колонны) или подачей его в специальный теплообменник — испаритель, в котором теплота передается кипящему кубовому остатку через поверхность теплопередачи (случай закрытого обогрева).
4.6.2. Фазовое равновесие в системе этанол—вода
Летучесть отдельных компонентов смеси характеризуют коэффициентом испарения К ~ у/х — он кипением концентрации данного вещества в паровой фазе у к концентрации его в жидкой фазе х при условии, что рассматриваемые фазы бинарной смеси находятся в равновесном состоянии.
Летучая часть бражки состоит в основном из воды и этанола,поэтому в процессе выделения спирта бражку рассматривают как бинарную смесь этанола и воды. В верхней части рис. 4.6 линия 1 изображает зависимость равновесного состава пара уот состава жидкости х при атмосферном давлении и температуре кипения для смеси этанол—вода. Линия представляет собой геометрическое место точек значений коэффициентов испарений этанола Кэ= у/хиз водно- спиртовой смеси. При малых концентрациях спирта в смеси значения Кэмаксимальны (около 13), при больших — минимальны (около 1).
Линия
равновесного состава в точке А пересекает
диагональ, следовательно, в этой
точке состав паровой и жидкой фаз
одинаковый. Эта точка получила название
азео- тропная точка, или точка нераздельного
кипения. Для нее
у~х или К
В соответствии с законом М. С. Вревского при повышении давления растворы с низкой концентрацией спирта (примерно до 30—40 мае. %) образуют пары с большим содержанием спирта, а растворы с высокой концентрацией спирта — пары с меньшим содержанием спирта, что наглядно показано в верхней части рис. 4.6 пунктирной линией. Из рисунка также видно, что с изменением давления сдвигается и положение азеотропной точки. Так, при давлении 9,33 кПа (температура кипения 27 °’С) нераздельнокипящая точка смещает концентрацию этанола вправо — в сторону увеличения вплоть до х= 100 %, т. е. при таком давлении пар всегда будет иметь большую концентрацию спирта, нежели исходная жидкость.
А 1 y-f(x) ^ | УI |
/ I | |
f у V У | [ I г I ! |
t=f(x) | I АI |
p=f(x) | I I и! |
100
о
Б
Концентрация спирта в жидкости (х), %
О 0)
aа
Р
<о
hU0
Оо
о-—
И
<» о •ЭЧ
100
Рис. 4.6. Зависимость концентрации спирта в паре у,температуры кипения tи давления пара Рот состава жидкой бинарной смеси этанол — вода хпри давлении:
7 — атмосферном; 2— ниже атмосферного; 3— выше атмосферного
Анализируя положение кривой фазового равновесия, легко установить, что при атмосферном давлении пар над жидкостью будет обогащаться этанолом только до азеотропной точки. Следовательно, путем ректификации (многократного испарения и конденсации) при атмосферном давлении можно достичь максимальной концентрации этанола — 97,2 об. %.
Если же требуется получить этанол более высокой концентрации, необходимо уменьшить давление, тогда азеотропная точка сдвинется вправо. Этим примером иногда пользуются на практике при получении абсолютного спирта.
4.6.3. ПОЛУЧЕНИЕ СПИРТА-СЫРЦА
Спирт-сырец получают на одно- и двухколонных ректификационных установках. В процессе получения спирта-сырца из бражки отгоняются этанол и примеси с большей летучестью, чем этанол.
Одноколонная сырцовая установка (рис. 4.7, а) состоит из полной ректификационной колонны, дефлегматора и холодильника. Бражка нагревается в дефлегматоре и поступает в среднюю часть колонны. В нижней части колонны (отгонной, или бражной) спирт извлекается из бражки паром, вводимым в кубовую часть колонны. Бражка, освобожденная встречным потоком пара в нижней части колонны, именуется после этого бардой, непрерывно выводится из колонны через гидрозатвор или бардорегулятор. В отгонной части колонны обычно 18—22 тарелки.
В верхней части колонны (концентрационной, или спиртовой) устанавливают 9—10 ситчатых или многоколпачковых тарелок, на которых происходит концентрация спирта в поднимающемся по-

Рис. 4.7. Схемы сырцовых ректификационных установок:
а — одноколонная; б — двухколонная: 1 и 2— бражная и спиртовая колонны; 3 — дефлегматор; 4 — холодильник спирта. Обозначения: А —бражка; Б — барда; В —вода; Л —лютерная вода; П — греющий пар; СС — спирт-сырец
токе пара в результате встречного перемещения стекающей флегмы. Спиртовой пар концентрацией около 88 об. % из колонны поступает в дефлегматор, где значительная его часть (около 2/3) конденсируется, отдавая теплоту бражке и воде, образуй флегму. Оставшаяся часть (около 1/3) спиртового пара поступает в холодильник, где конденсируется, превращаясь в спирт-сырец, и охлаждается.
В отечественной промышленности применяют только одноколонные сырцовые установки. По сравнению с двухколонными (рис. 4.7, б) они проще по устройству и в эксплуатации, в них меньше расходуется пара и воды, их легко автоматизировать, однако имеют большую рабочую высоту и дают барду с меньшим содержанием сухих веществ, так как она смешивается с лютерной водой.
Давление в нижней части колонны обычно поддерживается в пределах 8—12кПа; давление в верхней части зависит от состояния и площади поверхности теплопередачи дефлегматора и может изменяться в пределах 1—5 кПа.
Расход пара и воды на сырцовых установках колеблется в широких пределах и зависит от концентрации спирта в бражке и спирте-сырце, состояния и конструкции установки, а также от режима эксплуатации. На 1 дал спирта-сырца расходуется 18—26 кг пара и 0,1—0,15 м3воды. Потери при получении спирта обычно не превышают 0,3 % спирта, введенного с бражкой.
studfiles.net
4.3. Методы расчета процесса ректификации
Система уравнений (4.1.) справедлива для произвольновыбранной пары сечений и без труда преобразуется к виду, при котором можно опустить номер сечения и в самом общем случае записать:
G – g = const1 , (1*)
Gy – gx = const2 , (2*) (4.2)
Gi” – gi’ = const3 . (3*)
Разделив ( 2* ) и ( 3* ) на ( 1* ), получим :
 (4.3)
(4.3)
Точка с координатами (xП; iП) называется полюсом. Полюс обладает следующим свойством. В диаграмме i – x,y ( рис. 4.8) любая прямая, связывающая состояние жидкости и пара, встречающихся на тарелке, проходит через полюс.
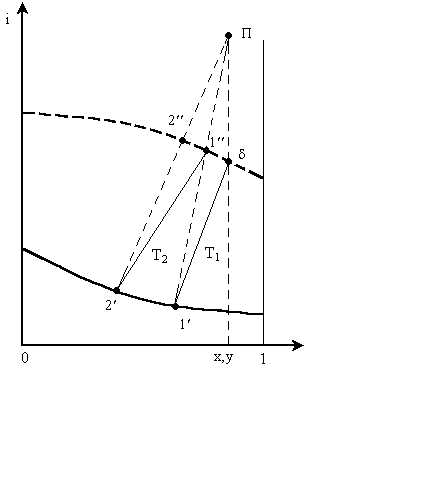
Рис. 4.8. К расчёту процесса ректификации в диаграмме i –x, y
Прямые, проходящие через полюс ректификации, называются полюсными лучамииликоннодами.
Число изотерм в рассматриваемой диаграмме определяет число теоретических тарелок. Чтобы воспользоваться методом Поншона – Бошняковича, необходимо располагать для выбранной смеси диаграммой i – x,y, для построения которой требуется проведение значительного числа сложных экспериментов. К настоящему времени известно ограниченное количество таких диаграмм, что затрудняет практическое использование этого метода.
Метод определения числа теоретических тарелок МакКэба – Тиле
Выведем основное уравнение, лежащее в основе этого метода. С этой целью найдём величину Gn из уравнения общего материального баланса
(4.4)

Подставим полученное уравнение в выражение для энергетического баланса
(4.5)
Введем два упрощающих допущения. Первое допущение состоит в том, что энтальпия паровой фазы не зависит от концентрации (а значит и от сечения):
Т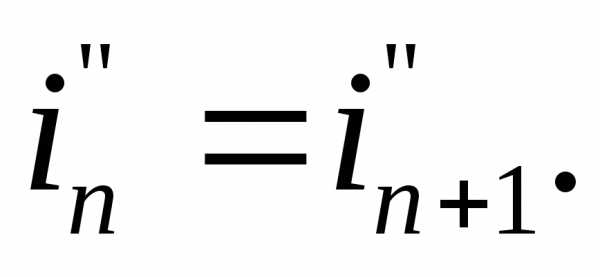 огда
можно записать
огда
можно записать
(4.6)
Преобразуя выражение (4.6), получим:
где r – теплота парообразования.
Второе допущение состоит в том, что теплота парообразования не зависит от концентрации (а значит и от сечения), т.е. rn+1 = rn. Последнее допущение в основном и определяет неточность метода, так как,например, для смеси азот – кислород при нормальном давлении rO2 > rN2 на 23%. Преобразуя (4.6), получим: gn+1 = gn; т.е. поток жидкости по всей секции колонны остается постоянным и, следовательно, gn+1 = gn = const = g. Тогда из уравнения для общего материального баланса получим, что G n+1 = Gn = G = const. Уравнение материального баланса по низкокипящему компоненту перепишется в виде:(4.7)
или
(4.8)
где g/G – флегмовое отношение.
Это уравнение называется уравнением линии материального баланса или рабочей линией.
Уравнение рабочей линии представляет собой прямую, проходящую через точки
Так
как сечения выбраны произвольно,
то можно сделать вывод, что это уравнение
связывает концентрации пара и жидкости
влюбомсечении данной секции колонны. Уравнение
рабочей линии даёт
возможность рассчитать число теоретических
тарелок. Графическая интерпретация
метода представлена в диаграмме у – х
на рис. 4.9.
даёт
возможность рассчитать число теоретических
тарелок. Графическая интерпретация
метода представлена в диаграмме у – х
на рис. 4.9.
Рис. 4.9. Расчёт числа теоретических тарелок методом МакКэба – Тиле
Число точек на равновесной кривой определяет число теоретических тарелок.
Для двухсекционной колонны диаграмма будет иметь такой вид (рис. 4.10.):
Р ис.
4.10. Положение рабочих линий в диаграмме
y – x для двусекционной колонны
ис.
4.10. Положение рабочих линий в диаграмме
y – x для двусекционной колонны
Рассмотренный метод определения числа теоретических тарелок отличается простотой и наглядностью, требует сравнительно мало данных по термодинамическим свойствам смеси, однако, в силу принятых допущений может использоваться для определения числа теоретических тарелок лишь в качестве первого приближения.
studfiles.net
Теоретические основы процесса ректификации
Ректификация – это последовательное многократное противоточное осуществление процессов испарения и конденсации. Для иллюстрации процесса ректификации рассмотрим разделение воздуха в предположении, что воздух может рассматриваться как двухкомпонентная смесь азота и кислорода. Схема ректификационной колонны представлена на рис. 4.4, характерные точки процесса ректификации показаны в диаграмме температура – концентрация (рис. 4.5.).


концентрация
Рис. 4.4. Схема ректификационной колонны
I – купол; II – конденсатор ; III – ситчатая или колпачковая тарелка; IV – испаритель (куб)
Рис. 4.5. Процесс ректификации в диаграмме температура – концентрация
Предположим, что в колонну поступает насыщенный пар (точка 1). В идеальном установившемся процессе слой жидкости выше уровня питания имеет тот же состав, что и питающая жидкость, хотя жидкость в точке 2 имеет меньшую температуру, чем температура жидкости подпитки. Пар поднимается вверх по колонне и барботирует
через жидкость, тогда как жидкость, проходящая через тарелку, опускается на следующую нижнюю тарелку через трубу (или слив). В процессе барботажа через слой жидкости пар, имеющий более высокую температуру, передает теплоту жидкости, как показано на рис. 4.6.

Рис. 4.6. Тепло- и массообмен пузырька при движении через жидкость в колонне
В результате передачи теплоты небольшая порция пара высококипящего компонента (в данном случае кислорода) конденсируется из парового пузырька, а небольшая порция
низкокипящего компонента (в данном случае азота) испаряется из объёма жидкости.
Таким образом, пар, движущийся вверх через слои жидкости, на тарелках обогащается азотом, а жидкость, стекающая вниз, через которую барботируют пузырьки пара,
обогащается кислородом.
На идеальной или теоретической тарелке пар, выходящий из жидкости, будет иметь ту же температуру, что и жидкость на тарелке, т. е. пар будет покидать тарелку в состоянии, определяемом точкой 3 на рис. 4.5. Затем пар будет проходить через
следующий слой жидкости (на следующей тарелке, точка 4), и весь процесс повторится. При движении пара вверх по колонне через последующие слои жидкости он будет все
более и более обогащаться азотом. Жидкость, стекающая вниз по колонне от одной тарелки к другой, будет все более обогащаться кислородом за счет из
паровой фазы. Используя большое число тарелок, можно достигнуть весьма высокой
чистоты обоих компонентов. К нижней части колонны (кубу) необходимо подводить некоторое количество теплоты для обеспечения снабжения паром пространства колонны, находящегося ниже уровня питания, а от вершины колонны необходимо отводить теплоту для обеспечения снабжения жидкостью части колонны выше уровня питания. В
действительности обычно никогда не достигается полное разделение. В реальной ректификационной колонне пар покидает тарелку при температуре, отличной от средней температуры жидкости на тарелке. Следовательно, для достижения заданного уровня разделения требуется число тарелок больше теоретического. Действительные процессы, происходящие в ректификационных колоннах, характеризуются существенной необратимостью, кроме того, при ректификации возникают потери, связанные с гидравлическим сопротивлением, конечным временем контакта фаз, неадиабатичностью процесса и т.д. Расчет процесса ректификации состоит в определении числа теоретических и действительных тарелок.
Теоретическая тарелка – то место в колонне, где достигается равновесие между жидкостью и паром.
Для определения числа действительных тарелок при известном числе теоретических часто пользуются понятием коэффициента полезного действия тарелки h, который определяют как отношение числа теоретических тарелок nт к числу действительных тарелок nд h = nт / nд. Коэффициент полезного действия тарелки h зависит от типа тарелки, разделяемой смеси и т.д.
Для определения числа теоретических тарелок ректификационной колонны приведём вывод основных уранений, характеризующих её работу. С этой целью рассмотрим выделенный участок ректификационной колонны ( рис. 4.7.).
 |
Рис. 4.7. К расчёту процесса ректификации
Для участка колонны между сечениями n и n + 1 запишем три уравнения – общий материальный баланс (1), материальный баланс по низкокипящему компоненту (2), энергетический баланс (3)
(4.1)
Приведенные выше уравнения лежат в основе методов определения числа теоретических
ректификационных тарелок.
infopedia.su
1.1 Теоретические основы процесса ректификации. Расчет ректификационной установки для разделения бинарной смеси этиловый спирт-вода
Похожие главы из других работ:
Абсорбционная очистка вентиляционных газов от N-метилформамида и выделение его в чистом виде методом ректификации
4.1 Характеристика процесса ректификации [4]
Ректификация – это неравновесный тепло – и массообменный процесс, осуществляемый в ректификационных колоннах, где происходит непрерывный обмен компонентами между жидкостью и паром, находящимися в постоянном контакте…
Абсорбционная очистка вентиляционных газов от N-метилформамида и выделение его в чистом виде методом ректификации
4.2 Расчет процесса ректификации
На диаграмме (рис.4.2) по данным таблицы 4.2 построена зависимость температуры кипения раствора N-метилформамида в воде от состава раствора (нижняя кривая) и пара (верхняя кривая). Состав выражен в мольных долях N-метилформамида. Таблица 4…
Анализ процесса термоконтактного крекинга на примере установки непрерывного коксования в псевдоожиженном слое
1.2 Теоретические основы процесса
Термолиз углеводородов происходит по гомолетическому механизму. При гомолитическом разрыве пара электронов, принадлежащая ранее двум связываемым атомам, поровну распределяется между ними: Y – X >Y + X где Y-X — валентно-насыщенная молекула; Y…
Гравиметрический анализ
1.1 Теоретические основы
Задача количественного анализа – определение количественного содержания химических элементов в соединениях. Количественный анализ – основное средство определения качества материалов, которое зависит от количества основных компонентов…
Определение урана и тория в твердых материалах
II. Теоретические основы
Для качественного определения урана и тория применяют методы химического, радиометрического, спектрального, а для урана еще и люминесцентного анализа…
Осушка газа методом абсорбции
1. Теоретические основы
1.1 Влажность углеводородных газов Вода, присутствующая в углеводородных газах в виде паров, удаляется из газа в процессе осушки…
Очистка воды гиперфильтрацией
Теоретические основы процесса гиперфильтрации
Процессы разделения жидких систем играют важную роль во многих отраслях народного хозяйства. Для осуществления этих процессов уже давно применяют разнообразные способы: перегонку и ректификацию, абсорбцию и адсорбцию, экстракцию и др…
Применение метода абсорбции при осушке газов
1. Теоретические основы
1.1 Влажность углеводородных газов Вода, присутствующая в углеводородных газах в виде паров, удаляется из газа в процессе осушки…
Производство медного купороса из медного лома
3.2.1 Теоретические основы процесса
В отсутствии окислителей, в частности кислорода воздуха, в разбавленной серной кислоте медь практически не растворяется. Она с достаточной скоростью растворяется в горячей концентрированной серной кислоте…
Разработка процесса производства изопропилбензола на ОАО “Омский каучук”
1.1. Теоретические основы процесса алкилирования
Алкилирование – это широкий класс реакций, в результате которых в молекулу М вводят группу атомов R при условии, что при этом образуется связь какого-либо из атомов М с атомом С группы R…
Расчет ректификационной установки для разделения бинарной смеси этиловый спирт-вода
1 Теоретические основы процесса ректификации и описание технологической схемы
…
Расчет установки изомеризации
1.1 Теоретические основы процесса изомеризации
Реакции изомеризации, являясь равновесными, происходят без изменения объёма, поэтому термодинамическое равновесие зависит только от температуры…
Химизм процесса пиролиза
1. Теоретические основы процесса пиролиза
Пиролиз – процесс высокотемпературного разложения углеводородного сырья, протекающий при температурах свыше 600° С. Пиролиз представляет собой сложный процесс, состоящий из большого количества химических превращений…
Химизм процесса пиролиза
1.3 Теоретические основы процесса гидрирования
Пирогаз, получаемый в процессе пиролиза имеет сложный состав, в частности он содержит ацетиленовые и кумольные углеводороды. Поэтому для их удаления используется процесс гидрирования…
Электрогравиметрический метод анализа
1.1 Теоретические основы
Электрогравиметрия – старейший электрохимический метод анализа, известен с 1684 года. В настоящее время он применяется только для определения меди и анализа медных сплавов, содержащих олово, свинец, кадмий и цинк. Будучи безэталонным методом…
him.bobrodobro.ru
1.1 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА. Расчет ректификационной колонны
Похожие главы из других работ:
Двухкаскадная пропаново-этановая холодильная установка. Разработка испарителя-конденсатора
1.2 Теоретические основы процесса теплообмена
Перенос энергии в форме тепла, происходящий между телами, имеющими различную температуру, называется теплообменом. Движущей силой любого процесса теплообмена является разность температур более нагретого и менее нагретого тел…
Конструкция теплообменника
1.2 Теоретические основы процесса
Разработка теории любого сложного явления образуется на анализе, который позволяет выделять в нем отдельные составляющие, описываемые достаточно простыми моделями…
Проект отделения дуговой электропечи для выплавки стали
2. Теоретические основы процесса
Процесс плавки с окислением состоит из следующих периодов: 1) заправка печи; 2) загрузка шихты впечь; 3) плавление шихты; 4) окислительный период; 5) восстановительный период; 6) выпуск плавки. В процессе плавки материал…
Производство биотоплива
1. Теоретические основы биотехнологического процесса
Биоэтанол – это жидкое спиртовое топливо, которое производится из сельскохозяйственной продукции, содержащей крахмал или сахар, например, из кукурузы, зерновых или сахарного тростника. В отличие от спирта…
Производство разбавленной азотной кислоты по схеме АК-72: отделение окисления аммиака
3.1 Теоретические основы процесса
Получение азотной кислоты методом прямого синтеза основано на взаимодействии жидких оксидов азота с водой и кислородом под давлением и при повышенной температуре…
Процессы и аппараты НГП
1.3 Теоретические основы процесса теплопередачи
Тепловые процессы или теплообмен — обобщенное название процессов передачи энергии в виде теплоты между телами, имеющими различную температуру. Движущей силой процесса теплообмена является разность температур…
Пути повышения эффективности процесса производства стирола
1. Теоретические основы процесса
Существует несколько способов получения стирола: 1) Термическое декарбоксилирование коричной кислоты проводится при температуре 120-130ОС и атмосферном давлении. Выход стирола составляет около 40% 2) Дегидратация фенилэтилового спирта…
Расчет ректификационной колонны
1.1 ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
Ректификация получила широкое распространение во многих отраслях промышленности для разделения однородных жидких смесей с различной температурой кипения образующих их жидкостей…
Расчёт абсорбционной установки
1.1 Теоретические основы разрабатываемого процесса
абсорбция технологическая установка химическая Абсорбцией называют процесс поглощения газов или паров из газовых или парогазовых смесей жидкими поглотителями (абсорбентами)…
Реакторный блок установки каталитического крекинга
1.1 Теоретические основы процесса
каталитический крекинг гидроочищенный Процесс каталитического крекинга гидроочищенного сырья является целевым в наборе процессов установки и позволяет получать следующие продукты: – жирный газ и нестабильный бензин…
Реконструкция цеха по производству глицерина мощностью 100 т/сутки в городе Красноярске
2.1 Теоретические основы процесса
При взаимодействии воды с жирами происходи гидролитическое расщепление последних. На практике этот процесс носит название омыления, гидролиза или расщепления жиров. Реакция протекает с образованием жирных кислот и глицерина…
Ректификационная переработка нефти и продукции из нее
1. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ ПРОЦЕССА
Нестабильный бензин, получаемый на газоотбензинивающей установке методом компрессии, абсорбции, низкотемпературной ректификации или адсорбции, состоит из углеводородов от этана до гептана включительно…
Технология производства керамического кирпича
6. Теоретические основы технологического процесса
…
Тиоколы
2.1 Теоретические основы процесса
…
Установка каталитического крекинга нефтяного сырья
1.1 Теоретические основы процесса
Каталитический крекинг является химическим процессом деструктивного каталитического превращения нефтяных фракций в моторные топлива и сырье для производства технического углерода, кокса и нефтехимии…
prod.bobrodobro.ru