что это такое, особенности, свойства и производство :: SYL.ru
Энергия реакций распада и синтеза в ядре атома давно нашла применение в науке и технике. Она используется в промышленности, оружии, геологии, на атомных электростанциях. Процессы ядерных реакций могут приносить как пользу, так и огромный вред. В статье речь пойдет о том, что это такое – тритий, как он добывается, о его использовании в атомной энергетике и какие опасности связаны с его применением.
Изотопы водорода
Прежде чем объяснить, что это такое тритий, необходимо познакомиться с понятием изотопа.
Атом любого вещества состоит из ядра и электронов (отрицательно заряженных частиц), движущихся по орбитам вокруг него. Ядро атома содержит положительно заряженные частицы – протоны, и частицы с нейтральным зарядом – нейтроны.
В обычном атоме число электронов и протонов совпадает, а вот количество нейтронов может отличаться. В этом случае элементы, имеющие разное число нейтронов в ядре, называются изотопами элемента.
Водород имеет заряд 1, то есть в нем содержится один электрон и один протон. Его изотопы – протий, дейтерий и тритий. Слово “протий” образовано от греческого слова “первый”. Этот элемент имеет лишь один протон в ядре. По сути, он представляет собой привычный нам водород.
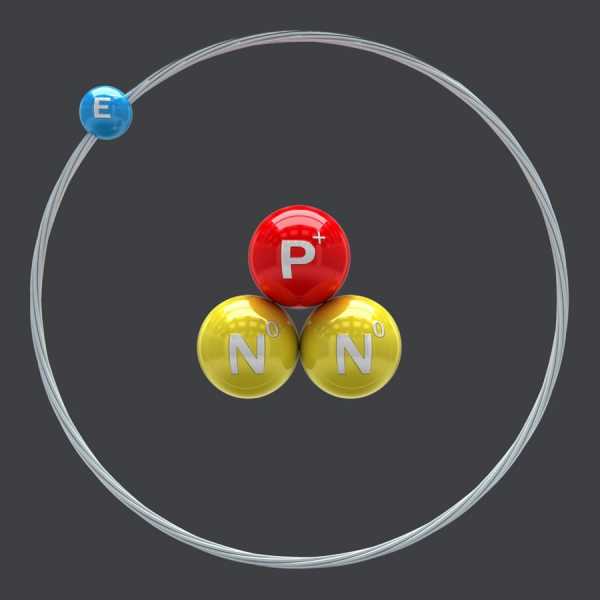
Дейтерий означает “второй”. В его ядре имеется один протон и один нейтрон. А тритий переводится как “третий” и содержит в ядре опять же один протон, но два нейтрона.
Краткий ответ на вопрос “Тритий – что это такое?” выглядит так: это третий изотоп химического элемента водорода.
История открытия
Названия для изотопов 1Н и 2Н – протия и дейтерия – были предложены американским физиком Гарольдом Юри. Обнаружив существование дейтерия, ученые сразу предположили наличие третьего изотопа водорода, имеющего два нейтрона в ядре. Юри для исследований использовал метод спектрального анализа. Однако результатов он не дал. Оказалось, что концентрация трития слишком мала, чтобы его можно было обнаружить традиционными способами. В природе это вещество практически невозможно найти. Поэтому для исследований стали использоваться другие методы, например, масс-спектрометрия.

В 1934 году Эрнест Резерфорд сумел искусственно получить третий изотоп при помощи ядерных реакций. Само собой, название было выбрано заранее, и, по аналогии с протием и дейтерием, он стал называться тритием.
Свойства
В нормальных условиях физические свойства трития примерно такие же, как у обычного водорода. Он имеет газообразное состояние; вкус, запах и цвет отсутствуют. При понижении температуры до -250 °C он становится легкой бесцветной жидкостью. А при нагревании он напоминает снег.
Атомная масса трития равняется примерно 3 а.е.м.
Тритий является радиоактивным веществом. Период полураспада составляет 12 лет, что является очень удобным в исследованиях. Канал распада элемента – бета. Тритий превращается в изотоп гелий-3. При этом происходит испускание электронов и антинейтрино.
Дефект масс и энергия связи трития
Одним из ключевых в физике элементарных частиц является понятие энергии связи атомных ядер. Под энергией связи ядра трития понимают то количество энергии, которое необходимо, чтобы произошло расщепление его ядра на отдельные нуклоны. Поскольку ядра удерживаются так называемым сильным взаимодействием, требуется большое количество энергии, чтобы их расщепить.
Чтобы высчитать энергию связи ядра, необходимо знать массу субатомных частиц. Известно, что масса покоя ядра меньше суммарной массы нуклонов в его составе. Разницу между массами ядра и суммами его нуклонов называют дефектом масс.
Дефект массы трития, как и других ядер, рассчитывается по формуле:
Δm = (Z*mp + N*mn) – Мя, где
Z – число протонов;
N – число нейтронов;
mp – масса протона;
mn – масса нейтрона;
Мя – масса ядра.
Удельная энергия связи для элемента трития составляет 2 827,2 кэВ на нуклон.
Тритий в природе
Количество этого изотопа в природе является ничтожным. Связано это с его радиоактивностью, то есть нестабильностью ядра.
В природе он вырабатывается в основном в верхних слоях атмосферы. Его формирование осуществляется при сталкивании частиц космических лучей с ядрами атомов, например, азота. Поскольку тритий образуется в атмосфере, его источники на Земле – осадки (дождь и снег).
По подсчетам ученых, в чистом виде трития на Земле содержится едва ли более 1 кг. Поэтому его вырабатывают искусственно, в лабораторных условиях.

Производство трития
В настоящее время получение данного изотопа не представляет трудностей, но является чрезвычайно дорогостоящим процессом. Для изготовления одного килограмма вещества требуются затраты в размере 30 млн долларов.
В качестве сырья используют чаще всего литий. Реже – бериллий или бор. Литий подвергают нейтронному облучению на циклотроне. Затем его растворяют в воде, получая водород, в составе которого имеется тритий. Половина лития приходит в негодность в результате этого процесса и отравляется в утиль.
Для получения водорода с тритием из бериллия и бора их обрабатывают серной кислотой.
Еще одним способом получения изотопа является облучение тяжелой воды дейтронами. Тяжелая вода – вещество, образующееся из дейтерия (другое название – оксид дейтерия). После облучения такую воду подвергают электролизу и затем извлекают тритий.
В настоящее время элемент производится в основном на территории США, Канады и России.

Радиоактивность
Тритий является радиоактивным. При его распаде выделяется бета-излучение, представляющее собой поток электронов.
При внешнем облучении организма тритий не наносит серьезного вреда. Однако при попадании внутрь с водой, пищей или воздухом он может нанести существенный ущерб здоровью. Дело в том, что являясь изотопом водорода, тритий способен замещать его в химических соединениях. Таким образом, он попадает внутрь живых клеток и встраивается в их структуру. Это сказывается на генетической информации клетки.
Как было сказано, в природе тритий практически не встречается, поэтому едва ли может нанести вред живым организмам. Однако предприятия атомной промышленности становятся источником искусственной выработки этого изотопа. Атомные электростанции выбрасывают тритий в жидком и газообразном состоянии. Причина этого в том, что изотоп практически не фильтруется. В год на АЭС образуется до 4 кг трития. Результатом выбросов становится радиоактивное загрязнение почвы, воздуха и воды. Таким образом, он является потенциальным источником заражения живых организмов. Именно поэтому тритий был занесен в список контролируемых параметров при оценке качества питьевой воды.
Применение
Основное направление использования трития – атомная промышленность. Дело в том, что реакция слияния дейтерия и трития приводит к управляемому термоядерному синтезу. Энергия связи трития настолько велика, что в ходе термоядерных реакций вырабатывается в огромном количестве, в разы больше, чем при реакциях распада атомных ядер, поэтому управляемые термоядерные реакции могут стать главным источником энергии на Земле на многие годы. В связи с этим ученые в настоящее время работают над строительством термоядерного реактора, в котором процессы синтеза ядер происходили бы в крупных масштабах. Наиболее известный проект такого реактора – строящийся в настоящее время ITER (ИТЭР) во Франции.

Производство трития может успешно применяться для военных целей, например, при создании термоядерного оружия.
С использованием трития изготавливаются специальные светящиеся краски. Это обусловлено радиолюминесценцией – явлением свечения элемента при радиоактивном распаде. Светящиеся краски наносят на шкалы приборов, а также используются для изготовления брелоков и часов. Количество трития в них не настолько велико, чтобы нести угрозу для здоровья.
Тритий применяется в качестве индикатора химических реакций.
Наконец, этот изотоп используется для определения возраста объектов, которым не более 100 лет, например, вин.

Итак, что это такое – тритий? Выводы:
- Тритий – изотоп водорода, имеющий в ядре один протон и два нейтрона.
- Изотоп практически не встречается в природе, но успешно производится в лабораториях.
- Тритий радиоактивен, и его использование может принести человечеству и пользу, и вред.
www.syl.ru
Дейтерий Википедия
Дейте́рий (лат. deuterium, от греч. δεύτερος «второй»), тяжёлый водород, обозначается символами D и 2H — стабильный изотоп водорода с атомной массой, равной 2. Ядро (дейтрон) состоит из одного протона и одного нейтрона.
Открыт в 1932 году американским физико-химиком Гарольдом Юри. Природное содержание — 0,0115 ± 0,0070[2] %.
Изотопные модификации соединений водорода
Соединения изотопов водорода практически не различаются по химическим свойствам, но обладают довольно различными физическими свойствами (температура плавления, кипения, вес)[3]. Молекула D2, состоит из двух атомов дейтерия. Вещество имеет следующие физические свойства:
- Температура плавления −254,5 °C.
- Температура кипения −249,5 °C (23,57K).
- Межъядерное расстояние 0,07416 нм[4].
- Энергия диссоциации (при 0K) 439,68 кДж/моль[4].
Содержание дейтерия в природном водороде — 0,011…0,016 ат.%
По своим химическим свойствам соединения дейтерия имеют определенные особенности. Так, например, углерод-дейтериевые связи оказываются более «прочными», чем углерод-протиевые, из-за чего химические реакции с участием атомов дейтерия идут в несколько раз медленнее. Этим, в частности, обусловлена токсичность тяжёлой воды (вода состава D2O называется тяжёлой водой из-за большой разницы в массе протия и дейтерия).
Получение
Мировое производство дейтерия — десятки тысяч тонн в год. Крупнейшими производителями тяжёлой воды в мире являются Индия, Китай и Иран[6]. В промышленности для получения тяжелой воды (обогащения воды дейтерием) в своей основе служат процессы ионного обмена, в особенности Girdler Sulfide process, использующий изотопный обмен между водой и сероводородом. Также используется многоступенчатый электролиз воды, ректификация воды, аммиака, жидкого водорода и т. д. [4] При электролизе 100 л воды выделяется 7,5 мл 60-процентного D2O[7].
Содержание дейтерия в природной воде в 1,03 раза больше, чем в паре (это коэффициент разделения для данной смеси). Поэтому если после кипячения не всю воду выливать, а подливать к остатку природной воды и снова кипятить, то в воде чайника постепенно будет происходить накопление тяжелой воды. Однако очень медленное, поэтому даже при большом количестве повторений этого процесса содержание тяжелой воды не станет опасным для здоровья, вопреки предположению В. В. Похлебкина в книге «Чай. Его типы, свойства, употребление», вышедшей в 1968 году[8].
История открытия и изучения
Дейтерий был открыт в 1932 году Гарольдом Юри и его коллегами спектральным методом.
Резерфорд, недовольный предложенным открывателями названием «дейтон»[9], предложил вариант названия — «диплоген», а ядро, соответственно, — «диплон».
Учёные высказывали гипотезу о существовании стабильных изотопов лёгких элементов ещё в 1913 году при изучении неона. Существование этих изотопов было доказано в 1920 году методом масс-спектрометрии. Правда, в то время преобладала теория, согласно которой изотопы различались числом «внутриядерных электронов» различных атомов элемента (нейтрон был открыт позже — в 1932 году). Измерения относительной атомной массы водорода дали значение, близкое к 1 а. е. м., которое равно массе протона. Поэтому предполагалось, что водород не может содержать внутриядерный электрон, иначе он скомпенсирует заряд ядра. Таким образом, считалось, что у водорода нет тяжёлых изотопов.
Дейтерий впервые был открыт химиком Гарольдом Юри, работавшим в Колумбийском университете в конце 1931 года. Фердинанд Брикведде, который помогал Юри, провёл дистилляцию пяти литров жидкого водорода, полученного в криогенном цикле. Брикведде работал в новой лаборатории низких температур, открытой в Национальном бюро стандартов и весов США (NIST). В результате объём жидкости составил 1 мл. Ранее такая же методика использовалась для наработки тяжелых изотопов неона. Техника испарения жидкого водорода позволила увеличить долю изотопа водорода с массой 2 до такой степени, чтобы его можно было надежно зарегистрировать методами спектроскопии [10].
15 июня 1933 года Юри, Мерфи и Брикведде направили письмо редактору научного журнала «The Journal of Chemical Physics», в котором предложили названия для изотопов водорода — протий (англ. protium), дейтерий (англ. deuterium) и тритий (англ. tritium; в случае его открытия, поскольку на тот момент тритий ещё не был открыт), в письме они отмечали, что произвели первые два названия от греческих слов «protos» («первый») и «deuteros» («второй»)[11]
Применение
Наибольшие количества дейтерия применяются в атомной энергетике[6]. Он обладает самыми лучшими свойствами замедления нейтронов. В смеси с тритием или в соединении с литием-6 (гидрид лития 6LiD) применяют для термоядерной реакции в водородных бомбах. При взрыве происходят реакции: D (d, γ) 4He, D (t, n) 4He Также применяется в качестве меченого стабильного индикатора в химических, биологических и других лабораторных исследованиях и технике[6]. Перспективным также представляется применение дейтерия (в смеси с тритием) для получения высокотемпературной плазмы, необходимой для осуществления управляемого термоядерного синтеза (см. проект ITER)[6].
С некоторых пор дейтерий используется в медицине компаниями, разрабатывающими лекарства, которые с его помощью пытаются увеличить время метаболизма лекарства, то есть замедлить его вывод из организма, это замедление в модифицированных дейтерием лекарствах наблюдается благодаря первичному дейтериевому изотопному эффекту — уменьшению скорости реакции разрыва углерод-дейтериевых связей по сравнению с углерод-протиевыми [13][14].
Также дейтерий используется в нейтронных генераторах[6].
Примечания
- ↑ 1 2 3 Audi G., Wapstra A. H., Thibault C. The AME2003 atomic mass evaluation (II). Tables, graphs, and references (англ.) // Nuclear Physics A. — 2003. — Vol. 729. — P. 337—676. — DOI:10.1016/j.nuclphysa.2003.11.003. — Bibcode: 2003NuPhA.729..337A.
- ↑ 1 2 3 4 Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — DOI:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.
- ↑ Кузьменко, 2007, с. 298.
- ↑ 1 2 3 Бердоносов С. С. Дейтерий // Физическая энциклопедия : [в 5 т.] / Гл. ред. А. М. Прохоров. — М.: Большая российская энциклопедия, 1994. — Т. 4: Пойнтинга — Робертсона — Стримеры. — 704 с. — 40 000 экз. — ISBN 5-85270-087-8.
- ↑ 1 2 Дейтерий / В кн.: Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- ↑ 1 2 3 4 5 Александр Семёнов. Дейтерий и тритий: водород, да не тот // Наука и жизнь. — 2018. — № 8. — С. 45-51.
- ↑ Кузьменко, 2007, с. 299.
- ↑ Дейтерий — в чайнике? // Химия и жизнь. — 1969. — № 2. — С. 24—25.
- ↑ М. Олифант. Дни Кембриджа // Rutherford. Recollections of the Cambridge days”. Elsevier, Amsterdam, 1972. (рус.)
- ↑ Urey H., Brickwedde F., Murphy G. A Hydrogen Isotope of Mass 2 (англ.) // Physical Review. — 1932. — Vol. 39. — P. 164—165. — DOI:10.1103/PhysRev.39.164. — Bibcode: 1932PhRv…39..164U.
- ↑ Urey H. C., Murphy G. M., Brickwedde F. G. (1933). “A Name and Symbol for H2*”. The Journal of Chemical Physics. 1: 512–513. DOI:10.1063/1.1749325.
- ↑ Dan O’Leary (2012). “The deeds to deuterium”. Nature Chemistry. 4: 236. DOI:10.1038/nchem.1273.
- ↑ Michael J. Barratt, Donald E. Frail. Drug Repositioning: Bringing New Life to Shelved Assets and Existing Drugs. — John Wiley & Sons, 2012. — P. 319.
- ↑ Graham L. Patrick. An Introduction to Drug Synthesis. — Oxford University Press, 2015. — P. 380.
Литература
- Кузьменко Н. Е., Ерёмин В. В., Попков В. А. Начала химии. — М.: Изд-во Экзамен, 2007. — Т. 1. — С. 299.
wikiredia.ru
Дейтерий атомное ядро – Справочник химика 21
Конечно, здесь речь идет об определенных изотопах элемента, чаще всего о главных, наиболее стабильных, т. е. тех, которые доминируют в природной плеяде его изотопов. Например, в плеяде водорода преобладает самый легкий изотоп [ Н (99,98%). Более тяжелого изотопа — дейтерия 1 0 — только 0,02%. Таким образом, резко преобладает легкий изотоп, и можно сделать вывод, что наиболее устойчивое атомное ядро имеет изотоп Н. При написании символа, обозначающего тот или иной изотоп, в соответствии с предложением Ф. Жолио-Кюри, число нуклонов или округленное значение атомной массы и заряд ядра записывают слева от символа элемента соответственно сверху и снизу = + Э. Например, изотоп урана-238 обозначается как 9223 и. [c.212]Хи.мический символ Н. Порядковый номер 1. Атомная масса 1,00797. Число известных изотопов 4, из которых Н -протий, Н – дейтерий (символ О) и [Н – тритий (символ Т) обнаружены в природе, а четвертый – [Н — получен искусственно. Ядро атома водорода содержит один протон. Электронная конфигурация 15 . Основное отличие водорода от остальных элементов заключается в том, что его единственный электрон находится непосредственно в сфере действия атомного ядра — у него нет промежуточного электронного слоя. При потере электрона образуется положительный ион Н , представляющий собой элементарную частицу — протон. [c.156]
ЯДЕРНАЯ ЭНЕРГИЯ (атомная энергия), выделяется при превращениях атомных ядер. Источник Я. э.— внутр. энергия атомного ядра, обусловленная сильным взаимод. между протонами и нейтронами, а также их движением внутри ядра. Я. э. в миллионы раз превосходит энергию хим. превращений. Изменение массы покоя ядер при их превращениях может достигать по порядку величины 0,1%, тогда как перестройка внеш. электронных оболочек при хим. превращениях сопровождается изменением массы покоя атомов и молекул не более чем на 10 %. Особенно энергетически выгоден синтез легких ядер и деление тяжелых. Так, при синтезе гелия из ядер дейтерия и трития выделяется энергия 17,6 МэВ (3,5 МэВ на нуклон), при делении урана — ок. 200 МэВ ( 1 МэВ на нуклон). Радиоакт. распад также сопровождается выделением Я. э., однако его малая скорость обусловливает ничтожно малую полезную мощность.
Действующих поверхностей, закон 2/688, 689 Дейтерий 2/23 атомное ядро, см. Дейтрон(ы) оксид, см. Тяжёлая вода определение 5/335, 336 получение 2/25, 392 5/33 применение 2/25, 26 4/785 5/802 свойства 1/403, 775 2/24, 25, 190, [c.588]
Сравнивая энергию у-излучения радионуклидов с энергией связи нейтронов в различных атомных ядрах, видим, что при создании фотонейтронных источников в качестве источников у-излучения можно использовать офаниченное число радионуклидов, а в качестве мишеней только бериллий и дейтерий, у которых энергия связи нейтронов в ядрах равна соответственно 1,665 и 2,226 МэВ, Реакцию (у, п) могут вызвать лишь у-кванты, энергия которых превышает указанную энергию связи нейтрона. [c.48]
Ядерные свойства изотопа в отличие от химических свойств его предопределяются не зарядом атомного ядра, а его составом, при одинаковом же составе — строением ядра. Поэтому у изотопов одного и гого же элемента ядерные свойства совершенно различны. Так, протий (Н) и дейтерий (D) — не радиоактивны, а тритий (Т) — радиоактивен. Протий поглощает нейтроны, превращаясь в дейтерий посредством ядерной реакции [c.185]
Метод нейтронографии основан на эффекте рассеяния потока медленных нейтронов атомными ядрами вещества. Контраст появляется вследствие различия интенсивности рассеяния монохроматического потока нейтронов на ядрах различной массы, причем существенно, что в отличие от рентгеновских лучей и электронов поток нейтронов не несет электрического заряда и, следовательно, интенсивность их рассеяния определяется только массой ядра. Практически применение метода нейтронографии основывается на сравнении интенсивности рассеяния на ядрах водорода и дейтерия при исследовании системы, содержащей некоторое количество дейтерированных молекул в среде водородсодержащих цепей, или наоборот. Контраст в этом случае особенно велик из-за двукратного изменения рассеивающей массы. Источником потока нейтронов обычно являются ядерные реакторы. Длина волны потока зависит от энергии нейтронов области температур 20—100°С отвечают значения равные 1,6—1,8 А Используя холодные нейтроны, получают пучки с длинами волн до 10 А. [c.82]
Открытие нейтрона позволило установить, что атомное ядро состоит только из протонов и нейтронов (Д. Д. Иваненко) и именно эти две частицы являются кирпичиками , из которых построены ядра всех элементом. Поэтому они получили общее название нуклонов, т. е. в переводе на русский язык, частиц, образующих ядра. Напомним, что масса протона равна единице, а его электрический заряд +1 масса нейтрона также близка к единице, а заряд равен нулю. Поэтому заряд ядра атома любого элемента определяется только числом протонов, а масса ядра (или атомная масса элемента) определяется суммой чисел протонов и нейтронов. Например, атомный номер алюминия Z=13, а масса его ядра (атомная масса) равна 27. Так как заряд ядра алюминия равен + 13, то, очевидно, в его состав должно обязательно входить 13 протонов, а чтобы масса ядра была равной 27, к этому числу протонов необходимо добавить 14 нейтронов. Таким образом, в состав ядра алюминия вхо-дит 27 нуклонов, из которых 13 протонов и 14 нейтронов. Подобным образом можно узнать числа протонов и нейтронов в ядрах атомов всех элементов. Если обозначить атомную массу элемента через А, то ясно, что сумма чисел нейтронов и протонов (Z) равны А, т. е. число нейт-ронов в ядре равно разности (А—Z). Так, простейший атом водорода (Z=l) не содержит нейтронов и его ядро состоит только из одного протона. Однако в 1932 г было обнаружено ядро, заряд которого также равен единице, но масса его вдвое больше, чем масса протона. По химическим свойствам элемент с таким ядром не отличается от водорода и, следовательно, является изотопом водорода, в котором ядро состоит из одного протона и одного добавочного нейтрона. Этот самый, простой из изотопов был назван дейтерием, или тяжелым водородом. Обозначается символом D. Как и обычный водород, дейтерий образует воду D2O, которую называют тяжелой. Тяжелый водород существует на Земле наряду с обычным, но только в очень малом количестве — примерно в отношении 6000 1. Существует также еще более тяжелый изотоп водорода тритий, атомная масса которого равна 3. Тритий содержит в ядре, кроме протона два нейтрона. [c.280]
В феврале 1932 г. появилась краткая заметка Д. Чад-вика об открытии им новой ядерной частицы — нейтрона, с массой, почти равной массе протона, но электрически нейтральной. В апреле 1932 г. советский физик Д. Д. Иваненко впервые высказал гипотезу — ныне общепринятую,— что атомные ядра состоят из протонов и нейтронов. Согласно этой модели, в ядре атома с массовым числом А и атомным номером 2 содержится 2 протонов и Л — 2 нейтронов. Например, в ядре атома висмута содержится 83 протона и 126 нейтронов. Положительный заряд протонов компенсируется отрицательным зарядом 83 электронов, находящихся в оболочках. Ядра разных изотопов одного и того же элемента содержат, очевидно, равное количество протонов, но различное число нейтронов. Например, ядро водорода — это один протон, в ядре тяжелого изотопа водорода — дейтерия, кроме протона, имеется один нейтрон. [c.44]
Два явления, мне кажется, ставят это вне сомнения во-первых, экспериментальная легкость распадения атомного ядра всех химических элементов при бомбардировке их в электромагнитном поле большой интенсивности (в циклотронах) быстро движущимися материальными частицами (водородом, дейтерием, нейтронами, гелием, т. е. а-частицами). Во вторых, проникновение в вещест- [c.32]
Предметом ядерной химии являются реакции, в которых происходит превращение элементов, т. е. изменение ядер их атомов. Самопроизвольный распад радиоактивных атомов, рассмотренный выше, представляет собой ядерную реакцию, в которой исходным является одно ядро. Известны и другие реакции, в которых с ядром реагируют протон р, дейтрон (ядро атома дейтерия Н) й, альфа-частица а, нейтрон п или фотон у (обычно гамма-лучи). Удалось вызвать атомные превращения и под действием очень быстрых электронов. Вместо а-частиц (ядер Не) иногда используют ядра более легкого изотопа гелия Не. В последнее время все шире применяют для бомбардировки атомных ядер ускоренные ядра более тяжелых элементов вплоть до неона. [c.581]
Как уже указывалось выше, обозначение изотопа включает в себя массовое число (равное сумме протонов и нейтронов) и атомный номер (равный числу протонов ядра). Например, дейтерий обозначается символом Н.
www.chem21.info
Очистка воды от тяжелых изотопов дейтерия, трития и кислорода
Одним из важнейших показателей качества воды является ее изотопный состав. Природная вода на 99,7 мол. % состоит из «легкой» воды, молекулы которой образованы природными атомами водорода …
Особого внимания заслуживают два показателя: задержка метастазирования и потеря веса животных за время экспериментов. Ярко выраженное стимулирующее действие «легкой» воды на иммунную систему животных привело к задержке развития метастазов на 40 % по сравнению с контрольной группой, а потеря массы у животных, которые пили «легкую» воду, к концу опыта была в два раза меньше.
При воздействии на подопытных животных γ-облучением в дозе LD50 обнаружено, что выживаемость животных, употреблявших в течение 15 дней перед облучением «легкую» воду (30 ppm), в 2,5 раза выше, чем в контрольной группе (доза облучения 850 R), что указывает на радиопротекторные свойства «легкой» воды. При этом у выживших мышей опытной группы количество лейкоцитов и эритроцитов в крови осталось в пределах нормы, в то время как в контрольной группе оно значительно сократилось.
Было отмечено также четкое положительное влияние воды на показатели насыщения тканей печени кислородом: при этом увеличение величины рО2составляло 15 %, то есть дыхание клеток увеличивалось в 1,3 раза. О полезном действии реликтовой воды на здоровье мышей свидетельствовала их повышенная резистентность и увеличение веса по сравнению с контролем. Это значит, что употребление «легкой» воды для жителей больших городов в условиях повышенного фона радиации обосновано.
«Легкая» вода увеличивает скорость метаболических реакций, например, при старении, метаболическом синдроме, диабете и т.п. [22]. Кроме этого, согласно данным предварительных исследований, в пробах «легкой» воды сперматозоиды несколько дольше сохраняли свою функциональную активность, которая повышается по мере снижения содержания дейтерия в воде. Если принять во внимание общеизвестный факт о том, что воспроизводство жизни связано с потенциалом жизнедеятельности половых клеток, то станет ясно значение реликтовой воды для будущих поколений. Данные факты способствуют разработке промышленных установок для извлечения тяжелых изотопов из воды.
«Легкая» вода увеличивает скорость метаболических реакций, например, при старении, метаболическом синдроме и т.п. Согласно данным предварительных исследований, в пробах «легкой» воды сперматозоиды несколько дольше сохраняли свою функциональную активность

Установки разделения тяжелых изотопов
В настоящее время существует несколько способов извлечения тяжелых изотопов из воды: изотопный обмен в присутствии палладия и платины, электролиз воды в сочетании с каталитическим изотопным обменом между водой и водородом, колоночная ректификация, вакуумное замораживание холодного пара с последующим оттаиванием и др. [23]. В способе получения обедненной дейтерием питьевой воды за счет замораживания-оттаивания льда получение льда осуществляют замораживанием пара, образующегося из исходной воды при температуре, не превышающей +10 °C, а в процессе оттаивания льда на него дополнительно воздействуют ультрафиолетовым и инфракрасным излучениями и насыщают талую воду газом или смесью газов.
При смешивании «легкой» (Н2О) и тяжелой (D2O + T2O) воды происходит изотопный обмен: Н2О + D2O = 2 НDO; h3O + T2O = 2 НТО. Поэтому дейтерий и тритий в обычной воде находятся в форме HDO и НТО. При этом температура замерзания для D2O составляет +3,8 °С, а для Т2О +9 °С, HDO и НТО замерзают соответственно при +1,9 °С и при +4,5 °С. Установлено, что при температуре в пределах от 0 до +1,9 °С молекулы воды с дейтерием и тритием, в отличие от «легкой» (протиевой) воды, находятся в метастабильно-твердом неактивном состоянии.
Это свойство лежит в основе фракционного разделения «легкой» и тяжелой воды путем создания разряжения воздуха над поверхностью воды при этой температуре. «Легкая» вода интенсивно испаряется, а затем улавливается при помощи морозильного устройства, превращаясь в лед. «Тяжелая» же вода, находясь в неактивном твердом состоянии и обладая значительно меньшим парциальным давлением, остается в испарительной емкости исходной воды вместе с растворенными в воде солями и примесями.
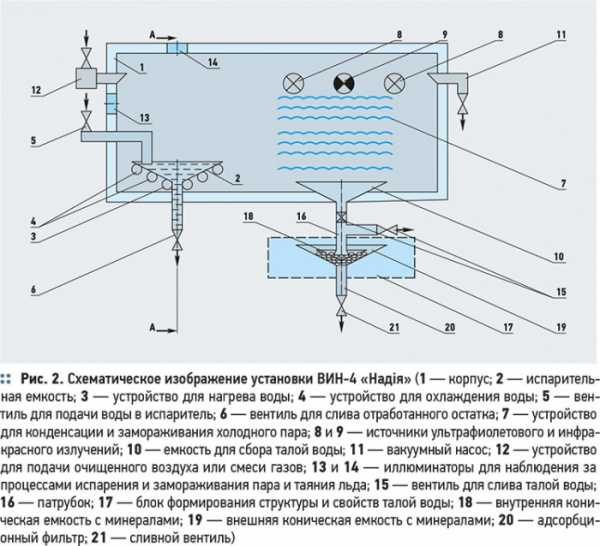
На этом принципе работает сконструированная Г.Д. Бердышевым и И.Н. Варнавским совместно с Институтом экспериментальной патологии, онкологии и радиобиологии имени Р. Кавецкого РАН Украины промышленная установка ВИН-4 «Надiя» по производству «легкой» воды с пониженным на 30-35 % содержанием дейтерия и трития (рис. 2).
Установка состоит из корпуса 1, в котором установлена испарительная емкость 2 для исходной воды с устройствами нагрева 3 и охлаждения воды 4. Здесь же имеется вентиль 5 для подачи воды в испаритель и вентиль 6 для слива отработанного остатка, обогащенного тяжелыми изотопами водорода. В корпусе также расположено устройство 7 для конденсации и замораживания холодного пара в виде набора тонкостенных трубчатых элементов, которые соединены с насосом для прокачивания через них хладагента. Устройство 7 совместно с источниками ультрафиолетового 8 и инфракрасного 9 излучений размещено над емкостью 10 для сбора талой воды. Внутренняя полость корпуса 1 соединена патрубком 11 с вакуумным насосом — источником разряжения воздуха. Кроме того, корпус 1 снабжен устройством 12 для подачи в его внутреннюю полость установки очищенного воздуха или смеси газов. Дополнительно установка ВИН-4 оборудована системой терморегулирования в полости испарительной емкости 2 для контроля заданной температуры процесса испарения исходной обрабатываемой воды. В корпусе имеются иллюминаторы 13 и 14 для наблюдения за процессами испарения, замораживания холодного пара и таяния льда. Емкость сбора талой воды 10 снабжена вентилями 15 для слива талой воды и патрубком 16 для соединения с блоком формирования структуры и свойств талой воды 17. Блок 17 включает внутреннюю коническую емкость 18 с минералами. На выходе емкости 19 установлен адсорбционный фильтр 20 и сливной вентиль 21.
Установлено, что при температуре в пределах от 0 до +1,9 °С молекулы воды с дейтерием и тритием, в отличие от «легкой» воды, находятся в метастабильно-твердом неактивном состоянии
Установка работает следующим образом. Из водопровода испарительную емкость 2 наполняют водой и через устройство 4 прокачивают хладагент. При достижении заданной температуры, не превышающей +10 °С, процесс охлаждения воды прекращают. Затем герметизируют корпус 1 и через патрубок 11 начинают откачивать воздух, создавая разряжение во внутреннем объеме корпуса установки. Создание разряжения сопровождается сначала интенсивным выделением из всего объема исходной воды растворенных в ней газов и их удаление, а затем интенсивным парообразованием вплоть до кипения воды, за которым наблюдают через иллюминаторы 13 и 14. Образующийся холодный пар конденсируется и намерзает на поверхности трубчатых элементов морозильника 7. Когда толщина льда достигает заранее заданной величины, процесс испарения прекращают. Вакуумный насос выключают, включают источники ультрафиолетового 8 и инфракрасного 9 излучений, а через устройство 12 вводят в полость корпуса 1 очищенный воздух или смесь газов; затем доводят давление в корпусе 1 до уровня или выше атмосферного. Остаток воды емкости 2, обогащенный тяжелыми изотопами, через вентиль 6 сливают в отдельные емкости или сливают в накопитель. По мере облучения и таяния льда талая вода поступает в емкость 10, затем в блок 17 формирования структуры и свойств талой воды. Проходя через минералы внутренней 18 и наружной 19 конических емкостей и далее через фильтр 20, талая вода завершает свой путь, приобретая целебные биологически активные свойства.
Подобную установку по получению биологически активной питьевой воды с пониженным содержанием дейтерия путем электролиза сконструировали в 2000 году российские ученые Ю.Е. Синяк, В.Б. Гайдадымов и А.И. Григорьев из Института медико-биологических проблем (рис. 3). Установка содержит емкость 1 с конденсатом атмосферной влаги или дистиллятом, которая соединена с анодной камерой 2 электролизера с ионообменным электролитом. Электролизер содержит пористые электроды (анод 2 и катод 3) из титана, покрытые платиной, преобразователь электролизных газов в воду, конденсатор 10 и сборник «легкой» воды. Кроме того, устройство дополнительно снабжено осушителем кислорода 4, реактором изотопного D2/h3O обмена 5, внешние боковые стенки которых образованы из ионообменных мембран, и кондиционером для воды 11. Внешние стенки реактора 5 и осушителя 4 образованы из ионообменных мембран 6, 8; осушитель кислорода содержит ионообменный катионит, а кондиционер для воды 11, в свою очередь, образован из фильтра со смешанными слоями ионообменных материалов — адсорбента и минерализатора, содержащего гранулированные кальций-магний карбонатные материалы.
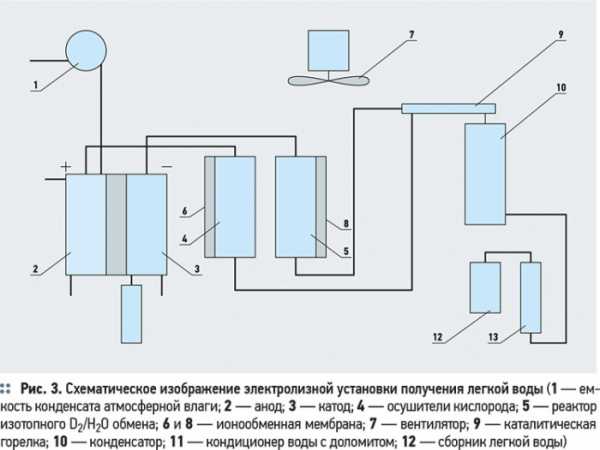
Конденсат атмосферной влаги или дистиллят поступает в анодную камеру электролизера с твердым электролитом, где осуществляется процесс электролиза при температуре 60-80 °C. Образующиеся в результате электролиза обедненные дейтерием газообразные водород и кислород с парами воды подают в осушитель кислорода 4, где происходит сушка за счет сорбции паров воды ионообменным наполнителем (катионитом) и прохождения через ионообменные мембраны 6. Затем высушенный электролизный водород подается в каталитический реактор изотопного обмена 5, где он подвергается изотопному D2/h3O обмену с парами воды и водородом на катализаторе, состоящим из активированного угля с добавками 4-10 % фторопласта и 2-4 °% палладия или платины. После изотопного D2/h3O обмена водород осушают от паров воды (D2O), которые сорбируются и удаляются через ионообменники реактора 8, размещенные на его внешних боковых стенках. Осушенные газы поступают в преобразователь электролизных газов и в каталитическую горелку 9. Пламя факела направляют в конденсатор 10, охлаждаемый в протоке водопроводной водой, где пары воды конденсируются и поступают в кондиционер 11 для доочистки на сорбционном фильтре. Затем вода поступает в сборник воды, обедненной дейтерием 12. Охлаждение устройства и работа ионообменных мембран по осушке электролизных газов от паров воды осуществляется вентилятором 7. Окончательную доочистку воды и последующую ее минерализацию проводят кальций-магнийсодержащими карбонатными минералами и доломитом. Производительность установки по «легкой» воде составляет 50 мл воды в час.
При вакуумном замораживании-оттаивании получают микроминерализованную питьевую воду со сниженным содержанием дейтерия на 10-35 % и с упорядоченной льдоподобной структурой, характерной талой воде
При электролизном процессе у воды с пониженным на 60 % и выше содержанием дейтерия сохраняются негативные свойства дистиллированной воды (отсутствие минерализации, повышенное содержание растворенных газов, неупорядоченная молекулярная структура воды). Она является исходным материалом для получения питьевой воды космонавтов. Преимуществом электролизного процесса является максимально возможное удаление дейтерия (до 90 °%).
При вакуумном замораживании-оттаивании получают микроминерализованную питьевую воду со сниженным содержанием дейтерия на 10-35 % и с упорядоченной льдоподобной структурой, характерной талой воде. Поэтому предпочтение отдается этому способу получения «легкой» воды.
Разработанные в последние годы комбинированные методы изотопного обмена и ректификации позволяют получать «легкую» воду высокой изотопной чистоты. Первая в мире ректификационная установка по изотопной очистке воды была спроектирована в 1975 году швейцарской фирмой Sulzer и пущена в эксплуатацию на реакторе HFR ILL. В 1987 году аналогичная, но гораздо более мощная установка была создана в Канаде для канадских АЭС.
В конце 1990-х годах в Петербургском институте ядерной физики имени Б.П. Константинова была создана первая отечественная ректификационная колонна по изотопному разделению воды. Высота колонны — 10 м, диаметр — 80 мм. В основу этой установки заложен комбинированный метод изотопного обмена в системе «пары воды-водород» и низкотемпературной ректификации изотопов водорода.
В ходе реакции каталитического изотопного обмена (КОИ) между парами воды и дейтерием при температуре 200 °С происходит извлечение протия и трития из «тяжелой» воды и их последующий перевод в газообразную фазу:
DOT + D2 = DT + D2O,
HDO + D2 = DH + D2O.
Степень извлечения трития из «тяжелой» воды определяется константой равновесия и при трехступенчатой очистке составляет не более 30 °%. Очищенная от протия и трития «тяжелая» вода возвращается в реактор. Смесь изотопов водорода D2, DT, HD после очистки от примесей и охлаждения до температуры 25 K подается в низкотемпературную колонну. За счет процессов массообмена между газообразной и жидкой фазой изотопов водорода происходит концентрирование трития в нижней, а протия — в верхней части колонны. Обедненный по протию и тритию поток дейтерия в виде D2O возвращается в блок КИО. Из верхней части низкотемпературной колонны происходит отбор концентрата протия в виде «легкой» воды, а из нижней — концентрат трития в виде тритиевой воды.
Ректификация воды относится к массообменным процессам и осуществляется в противоточных колонных аппаратах с контактными элементами — насадками или тарелками. В этом процессе происходит непрерывный обмен между движущимся относительно друг друга молекулами жидкой и паровой водяной фазы. При этом жидкая фаза обогащается более высококипящим компонентом, а паровая фаза — более низкокипящим дейтерием и другими тяжелыми изотопами — тритием (Т) и кислородом (18О).
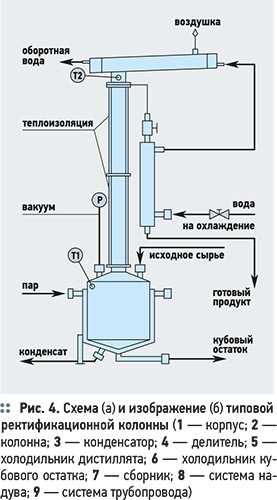

В большинстве случаев ректификацию осуществляют в противоточных колонных аппаратах с различными контактными элементами
В большинстве случаев ректификацию осуществляют в противоточных колонных аппаратах с различными контактными элементами (рис. 4). Процесс массообмена происходит по всей высоте колонны между стекающей вниз флегмой и поднимающимся вверх паром. Чтобы интенсифицировать процесс массообмена, применяют насадки и тарелки, что позволяет увеличить поверхность массообмена. В случае применения насадки жидкость стекает тонкой пленкой по ее поверхности, в случае применения тарелок пар проходит через слой жидкости на поверхности тарелок.
Расчет ректификационной колонны производится по диаграмме кипения воды для заданных параметров ректификации — состава исходной воды, кубового остатка, дистиллята, производительности и рабочем давлении в колонне. Затем подбирается тип и количество тарелок, определяется скорость движения пара, диаметр колонны, коэффициенты массопередачи, высота колонны, гидравлическое сопротивление тарелок. После этого проводится расчет эксплуатационных свойств, а также экономические показатели использования ректификационной колонны. На практике для более глубокой очистки воды от тяжелых изотопов используется не одна ректификационная колонна, а батарея из десяти и более отдельных колонн (до 20).
Данный метод изотопного разделения воды имеет ряд существенных преимуществ по сравнению с существующими способами и позволяет производить очистку природной воды от дейтерия до величин порядка 20-30 ppm. Кроме того, производительность изотопной очистки воды этим методом выше других способов, что существенно снижает ее стоимость. Предполагается, что при широкомасштабном производстве «легкой» воды в будущем она станет доступной каждому человеку.
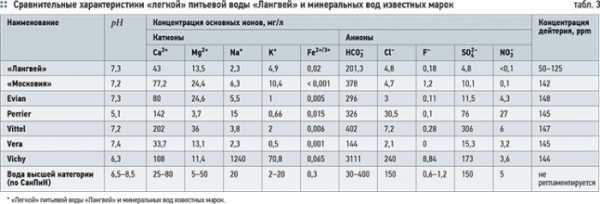
В последнее время на отечественном рынке появилась «легкая» питьевая вода «Лангвей», которая производится методом колоночной ректификации с различным остаточным содержанием дейтерия (от 125 до 50 ppm) (табл. 3).

На основании клинических испытаний, проведенных в Российском научном центре восстановительной медицины и курортологии и в Институте красоты, «легкая» питьевая вода «Лангвей» рекомендована для нормализации углеводного и липидного обмена, артериального давления, коррекции веса, улучшения работы желудочно-кишечного тракта, увеличения скорости водообмена и выведения шлаков и токсинов из организма [19].
Основное воздействие «легкой» воды на организм объясняется постепенным снижением содержания дейтерия в физиологических жидкостях тела за счет реакций изотопного H-D-обмена. Анализ полученных результатов может свидетельствовать о том, что очистка воды организма от «тяжелой» воды с помощью «легкой» питьевой воды позволяет улучшить работу некоторых жизненно-важных систем организма. При регулярном потреблении «легкой» воды происходит более полная очистка всего организма от «тяжелой» воды за счет реакций изотопного H-D-обмена в физиологических жидкостях, а также зафиксировано изменение изотопного состава мочи и содержание в ней кальция. Ежедневное употребление «легкой» питьевой воды позволяет естественным образом снизить содержание «тяжелой» воды в организме человека за счет реакций изотопного H-D-обмена. Этот процесс сопровождается увеличением функциональной активности клеток, органов и некоторых систем организма. При этом происходит нормализация обменных процессов, увеличиваются защитные силы и устойчивость организма к внешним неблагоприятным воздействиям.
Регулярное употребление «легкой» питьевой воды позволяет естественным образом снизить содержание «тяжелой» воды в организме человека до величины 111 ppm. Это оказывает благоприятное воздействие на обмен веществ, улучшает самочувствие, повышает работоспособность, а также способствует быстрому восстановлению организма после больших физических нагрузок.
Положительные свойства «легкой» питьевой воды подтверждены исследованиями и клиническими испытаниями. Показано, что «легкая» вода нормализует обмен веществ и артериальное давление, снижает содержание сахара в крови у больных сахарным диабетом II-го типа, очищает организм от токсинов и шлаков, способствует быстрому заживлению и восстановлению костных и мышечных тканей после травм, обладает противовоспалительным действием, усиливает действие лекарственных препаратов, способствует коррекции веса, защищает клетки от радиации, устраняет признаки посталкогольной абстиненции. «Легкая» вода также рекомендуется для быстрой и глубокой очистки организма, что необходимо при нарушениях обменных процессов, перед операцией и в послеоперационный период, а также при лечении опухолевых заболеваний.

«Легкая» вода нормализует обмен веществ и артериальное давление, снижает содержание сахара, очищает организм от токсинов и шлаков, способствует быстрому заживлению и восстановлению костных и мышечных тканей после травм, обладает противовоспалительным действием
Клинические испытания «легкой» воды с остаточным содержанием дейтерия 60-100 ppm, проведенные РНЦ восстановительной медицины и курортологии Министерства здравоохранения РФ, показали, что она может быть рекомендована как вспомогательное средство в комплексном лечении больных метаболическим синдромом (артериальная гипертония, ожирение, нарушение углеводного обмена, дислипидемия) и сахарным диабетом.
Кроме того, было обнаружено, что «легкая» вода улучшает качество жизни при почечно-каменной болезни и различных нарушениях в работе желудочно-кишечного тракта (колиты и гастриты). Учитывая динамику распределение воды в организме, реакции изотопного (H/D и 16O/18O) обмена и результаты, полученные на «легкой» воде, можно ожидать, что наибольший эффект изотопная очистка воды будет оказывать на регуляторные системы организма и обмен веществ.
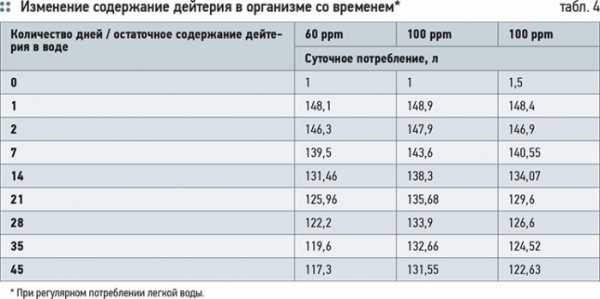
Эффективность воздействия «легкой» воды зависит от многих параметров — массы тела, количества воды в организме, количества ежедневно потребляемой «легкой» воды и степени ее изотопной чистоты. В табл. 4 приведены результаты расчетов изменения содержания дейтерия в организме при регулярном потреблении «легкой» воды с различным остаточным содержанием дейтерия.
Расчет проведен, исходя из следующих данных: суточное потребление «легкой» воды — 1,0 или 1,5 л; суточный водообмен — 2,5 л; содержание дейтерия в организме соответствует его содержанию в природной воде — примерно 150 ppm; объем воды в организме — 45 л (масса тела приблизительно 75 кг).
Исследованные положительные свойства «легкой» воды позволяют говорить о дальнейших перспективах использования «легкой» воды в медицине, быту и пищевой промышленности. В будущем запланированы эксперименты, в которых «легкую воду» будут потреблять космонавты, поскольку для космических полетов особенно важны противорадиационные свойства «легкой» воды.

Заключение
Легкая вода — это сложная по своей структуре и составу изотопная разновидность природной воды, оказывающая полифизиологическое действие на организм человека — противоопухолевое, радиопротекторное и общее оздоравливающее. Основное воздействие, оказываемое «легкой» водой на организм — это постепенное снижение содержания дейтерия за счет реакций изотопного H-D-обмена в физиологических жидкостях. Анализ полученных результатов позволяет говорить о том, что очистка организма от «тяжелой» воды с помощью «легкой» воды позволяет существенно улучшить работу важнейших жизненных систем организма.
Учитывая роль воды в организме, рассчитанные изотопные эффекты «тяжелой» воды и результаты, полученные на «легкой» воде, можно ожидать, что наибольший эффект может сказаться на регуляторных системах, метаболизме и энергетическом аппарате живой клетки, то есть именно тех клеточных системах, которые используют высокую подвижность протонов (D) и высокую скорость разрыва водородных H+ и D- связей. Кроме этого, «легкая» вода обладает меньшей вязкостью, чем «тяжелая» вода, что позволяет ей легче проникать через клеточные мембраны и тем самым регулировать скорость водообмена в организме. Растворимость неорганических солей в легкой воде несколько выше, чем в тяжелой воде, что дает ей возможность более эффективно выводить продукты метаболизма и вредные солевые примеси из организма. Скорость ферментативных (каталитических) реакций в легкой воде несколько выше, чем в обычной воде. Это позволяет интенсифицировать обменные процессы, что помогает организму быстрее восстанавливаться после больших нагрузок. Таким образом, «легкая» вода позволяет естественным образом, без применения каких-либо фармацевтических средств, существенно повысить обменные процессы организма.
teragaz.ru