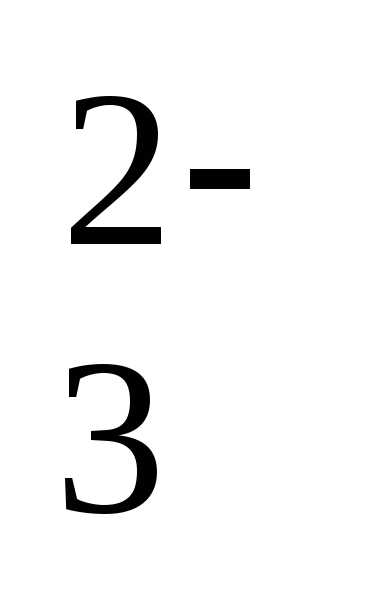Углекислый газ и карбонатная система воды (часть вторая)
(<< Начало – Часть 1)
ОГЛАВЛЕНИЕ
6. СО2 И ФИЗИОЛОГИЯ ДЫХАНИЯ АКВАРИУМНЫХ РЫБ
Подавляющему большинству свободноживущих многоклеточных животных для дыхания необходим кислород. С другой стороны также жизненно необходимо выведение из организма образующегося углекислого газа. Исполнение и сопряжение этих процессов составляют сущность т.н. внешнего дыхания. В ракурсе нашей темы важны два аспекта. Во-первых, доставку кислорода и выведение небезопасных продуктов метаболизма рыб выполняет система красной крови – эритроциты и плазма. Во-вторых, рыбы имеют замкнутую систему кровообращения, или систему кровообращения с высоким давлением. В таких системах органы и ткани получают необходимое количество крови не только в зависимости от интенсивности своей жизнедеятельности, но и в зависимости от состояния самих сосудов. Рассмотрим это несколько подробнее.
Транспорт газов в организме рыб. Основную часть работы, связанную с обменом газов в организме, т.е. снабжение кислородом и удаление углекислого газа, выполняет система красной крови: плазма и эритроциты. Как известно, гемоглобин (
Среда с высоким содержанием СО2 (капилляры активно функционирующих тканей) усиливает, облегчает диссоциацию HbO2, что приводит к более полной отдаче кислорода, «залповой разрядке» HbO2, по сравнению с таковой в неактивных тканях. Такое влияние СО2 на отдачу гемоглобином кислорода известно как эффект Бора. Считается, что у рыб эффект Бора более выражен, чем у наземных позвоночных.
Обеспечив ткани кислородом, кровь должна выполнить и другую часть своей работы – удалить небезопасные продукты метаболизма, в том числе СО2
рН = рК1+lg[HCO3–]/[CO2]
Т.е., СО2 переводится в НСО3–; при этом отношение [HCO3 –]/[CO2] сохраняется постоянным при увеличении концентрации его компонентов, и значение рН не изменяется. Этот процесс происходит в эритроцитах при участии цинк-содержащего фермента карбангидразы. СО2, как и О2, являясь мелкой, не несущей заряда молекулой, свободно диффундирует через клеточные мембраны эритроцита по градиенту концентрации. В рабочих капиллярах это направление плазма – эритроцит. В эритроците карбангидраза многократно ускоряет реакцию СО2+Н2О→Н++НСО3–, идущую в свободной воде весьма слабо (К1=4•10-7). Накапливающийся в эритроцитах НСО3– переводится в плазму в обмен на хлорид-ион Cl– благодаря работе ионных каналов. Это обеспечивает свободную работу карбангидразы, но приводит к перераспределению хлорид-ионов из плазмы в эритроцит – т.н. хлоридный сдвиг. Остающийся в эритроците ион водорода
В капиллярах жаберного аппарата происходят процессы, обратные рассмотренным. Углекислый газ покидает плазу крови по градиенту концентрации в направлении плазма – окружающая среда. Несущий заряд гидрокарбонат-ион НСО3–, в отличие от СО2, не способен проникать через клеточные мембраны жаберного эпителия. Но в соответствии с уравненим Хендерсона-Хассельбальха, изменение отношения НСО3–/СО2 при снижении концентрации СО 2 приводит к разложению гидрокарбонатов по реакции: НСО3– → СО2+ОН–и СО2 свободно диффундирует в воду.
Оставшийся ОН– нейтрализуется освободившимися после образования НbО2 ионами водорода Н+ – процесс, обратный эффекту Холдейна. Жаберный эпителий, как и эритроциты, также обладает повышенным содержанием карбангидразы, но ее роль в процессе обмена СО2 не совсем ясна. Более вероятным представляется сопряжение работы карбангидразы с механизмами удаления аммония NH4+ и Н+, а также поглощением ионов Na+ и Cl–, протекающими у рыб в жабрах. Приблизительно таким образом работают механизмы обмена газов в естественных условиях, т.е. в воде, находящейся в состоянии, близком к газовому равновесию и содержащей мало углекислого газа.
Низкое содержание СО2 в большинстве природных вод и постоянство направления градиента концентрации углекислого газа в направлении организм – среда, дало основание некоторым физиологам для радикальной формулировки: рыбы живут в углекислотном вакууме. Именно поэтому рыбы обладают минимальной среди всех позвоночных буферной емкостью крови. К сожалению это не всегда так даже в природе, например, в тропических водоемах с кислой водой, рН которой, как мы убедились, зависит от содержания СО2. В этих случаях рассмотренный выше эффект Бора мог бы сыграть отрицательную роль. Но природа решила это противоречие весьма просто: живущие в таких водах рыбы не обладают выраженным эффектом Бора и их гемоглобин способен к транспорту кислорода даже при высоком содержании СО2
в крови. Это относится к большинству успешно освоенных аквариумистикой мелких харациновых, карповых, радужницам и др., о чем упоминалось выше. Для аквариумиста важно, что все они удовлетворительно переносят плотные посадки (т.н. «плотные» рыбы) и прекрасно чувствуют себя в слабощелочной воде. Тем не менее, кислые природные воды еще прячут в себе немало «запретных плодов»: взять хотя бы дискуса Хеккеля – Symphysodon discus Haeckel,1840…В отличие от выше упомянутых, многие обитатели текущих и слабощелочных вод обладают гемоглобином, чувствительным к эффекту Бора, что при содержании их в аквариумах может привести к проблемам. При высоком содержании СО2 в воде аквариума, низких значениях рН и dКН имеет место следующее противоречие. Содержание кислорода в воде достаточно для насыщения гемоглобина кислородом в жабрах. Но остаточное высокое содержание СО2 в плазме крови приводит к уменьшению доли
Кровеносная система рыб. В замкнутой системе кровообращения каждый тип сосудов выполняет свою определенную физиологическую функцию. Кровь движется по сосудам от центра – сердца, к периферии – капиллярам. Сердце, являясь источником движения, создает необходимые для перемещения крови импульс и давление. Кровяное давление рыб четко кореллирует с частотой сердечных сокращений. Аорта и крупные магистральные артерии, благодаря эластичности своих стенок, сглаживают пульсовую волну и поддерживают скорость кровотока. Более мелкие артериолы, путем изменения своего просвета за счет тонуса гладкомышечной оболочки, регулируют кровоснабжение различных органов. Прекапиллярные артериолы определяют количество работающих в каждом органе капилляров, опять же за счет изменения своего просвета.
В собственно капиллярах происходит обмен жидкостей и газов между кровью и тканевой жидкостью, непосредственно омывающей элементы тканей. Стенки капилляров не имеют мышечных элементов, поэтому величина их просвета, а значит и возможность продвижения по ним крови, зависит только от давления крови в артериолах. Cуммарное сечение капилляров почти в 1000 раз больше сечения аорты (данные для млекопитающих). Объем капиллярного ложа составляет большую часть объема всего сосудистого русла и многократно превышает объем имеющийся крови. Поэтому для нормальной жизнедеятельности организма очень важна физиологическая управляемость системы кровообращения.
Венозная часть сердечно-сосудистой системы является емкостным, коллекторным звеном. Скорость кровотока в венах значительно ниже, чем в артериях. Вены могут вмещать до 80% крови, способствуя ее перераспределению в организме. Наиболее емкими являются вены брюшной полости, селезенки и кожи, составляя т.н. депо крови в организме. В состоянии покоя организм депонирует до 50% своей крови, да и в состоянии активности определенная часть крови всегда находится в депо. Физиологические механизмы депонирования крови и ее мобилизации из депо специфичны и к сожалению мало изучены даже у человека. Емкость венозной части сосудистого русла определяет очень важную величину венозного возврата крови к сердцу. При недостаточном венозном возврате крови возможна рефлекторная остановка сердца. Недостаточность венозного возврата крови к сердцу возможна, например, при расстройствах кровообращения, связанных с обширными травмами, некрозами, действием раздражающих кожу веществ. В основе этого явления лежит неуправляемое расширение капилляров, что приводит к падению кровяного давления и недостаточному венозному возврату.
Организм всегда обходится только частью имеющейся крови, снабжая ей лишь постоянно работающие (мозг, сердце, почки, жабры) и активно функционирующие структуры. В основе этого лежит т.н. принцип перемежающейся активности функционирующих структур: органы никогда не работают все вместе, а только поочередно и частично (Крыжановский Г.Н.). Из него же вытекает необходимость постоянного перераспределения крови и ее частичное депонирование.
Среди регуляторов кровоснабжения органов и тканей организма важное значение принадлежит углекислому газу. Но если СО2 активно функционирующих структур является физиологическим стимулятором их местного кровоснабжения, то тотальное повышение уровня СО2 крови вызывает ее перераспределение по механизму стресс-реакции. При этом происходит т.н. централизация кровообращения: продолжают активно снабжаться кровью только постоянно работающие органы (см. выше), а остальные оказываются на «голодном пайке» за счет сокращения прекапиллярных артериол. В результате кровь циркулирует только по магистральным сосудам и постоянно работающим органам – сердцу, мозгу, почкам, жабрам. Понятно, что такое состояние долго продолжаться не может, и если содержание СО2 не уменьшится, организм отвечает формированием патологических процессов. Их конкретное проявление группоспецифично, но чаще всего это локальные кожные некрозы и нарушения обмена жидкости.
Так, у живородок, атерин наиболее, уязвима кожа. На теле, чаще всего возле спинного плавника или хвоста, появляются белые пятно, или сетка. Их размер и окраска увеличивается и усиливается. В течение 1-2 суток рыба погибает. По внешним признакам заболевание сравнивают с химическим ожогом (Р. Бауэр), или описывают как флексибактериоз, колумнариоз (Дж. Баслер). Антимикробные препараты малоэффективны. Даже по перенесении в другую воду, заболевшие рыбы погибают; выживают только экземпляры, у которых кожа не была повреждена. Молодь гораздо чувствительнее взрослых.
У некоторых цихлид – скалярий, акар, псевдотрофеусов – длительная централизация кровообращения приводит к застою крови в воротной вене печени. Вследствие этого увеличивается давление в капиллярах органов брюшной полости, что приводит к экссудации жидкости в брюшную полость и развитию асцита – водянки брюшной полости. Антимикробные препараты опять же малоэффективны, но нормализация условий содержания часто позволяет добиться положительных результатов. При этом проявляется одна из особенностей действия углекислого газа на организм: длительность периода восстановления близка к длительности периода воздействия (Массарыгин А.Г., 1973).
Золотые рыбы как бы объединяют в себе оба предыдущих типа. Но в отличие от живородок, их кожные реакции в силу возможности более длительного развития процесса, формируют несколько иную клиническую картину: локальные очаги кожного некроза отторгаются и образуются открытые, глубокие трофические язвы. Как и у живородок, их терапия также зачастую безуспешна.
Следует обратить внимание, что СО2 в нормальных условиях является естественным физиологическим регулятором кровоснабжения органов. Поэтому его недостаток также может быть опасен, особенно для молоди. Но такие состояния легче контролировать, просто придерживаясь рекомендуемых значений показателя рН. Так, например, личинки звездчатого анциструса (Ancistrus leucostictus), черного ножа (Apteronotus albifrons) при рН>7,5 не переходят на экзогенное питание и даже при наличии стартового корма пассивно лежат на дне, погибая от голода. Как известно, СО2 для молоди является мощным стимулятором двигательной активности. Информации по рекомендуемым значениям dКН, рН и др. в аквариумной литературе довольно много.
Подытожить разговор о СО2-системе можно с экологической точки зрения, поскольку грамотно устроенный декоративный аквариум все же является моделью экологической системы. В течение жизненного цикла организм рыб встречается с разнообразными экологическими факторами. Безусловно СО2 и рН относятся к экологическим факторам, являясь также и факторами лимитирующими, поскольку и СО2, и рН влияют на выживаемость рыб. Диапазон колебаний содержания СО2 в среде, совместимый с жизнью рыб не превышают 10 раз. Так например, если для многих живородок содержание СО2 1-2мг/л является комфортным, то при 10-15мг/л СО2 о долгой и «счастливой» жизни этих рыб не может быть и речи. В то же время, колебания концентраций многих ионов (для них биологические мембраны непроницаемы) большинство рыб выдерживают в диапазоне до 100 крат (2 порядка), и являются относительно этих факторов эврибионтами. Так, например, минимальная жесткость воды, согласно ПРСаСО3 составляет 0,35°dGH. Такое значение общей жесткости весьма рекомендуемо для размножения красных неонов (Cheirodon axelrodi). Но малек этого вида прекрасно себя чувствует и в воде с общей жесткостью 30°dGH. То же можно сказать и о гидрокарбонатах. Однако возможны и исключения. Так, для большинства рыб физиологический диапазон колебаний значения кислотности воды составляет 2 порядка, или 2 единицы рН: рН 6,0-8,0. Но есть и виды, диапазон устойчивости (толерантности) которых не превышает 10 крат – 1 единицы рН. К таковым относятся некоторые эндемики Танганьики, Амазонии (Symphysodon discus), являющиеся т.н. стенобионтными видами. Можно утверждать, что стенобионты не выдерживают более 10-кратного диапазона колебаний экологического гидрохимического фактора и стенобионтными по отношению к СО2 являются многие аквариумные рыбы.
Таким образом, действие углекислоты на рыб полностью укладывается в рамки закона толерантности Шелфорда: на организм отрицательно влияет как избыток, так и недостаток СО2 и для комфортного самочувствия неодходимо его присутствие в «стандартных» количествах, определяемых dКН и газовым равновесием.
7.МИНИ-ПРАКТИКУМ
Аквариумисту всегда есть смысл знать состояние буферной системы воды своего аквариума. К счастью рынок предоставляет для этого широкий ассортимент недорогих гидрохимических тестов, как зарубежных, так и отечественных. На практике, при расчетах по приведенным выше уравнениям, наибольшие затруднения вызывает совмещение единиц измерения результатов теста с требованиями химии. Для решения уравнений необходимо представить концентрации измеренных параметров в молярной форме, тогда как тесты показывают значение жесткости (общей и карбонатной) – в градусах немецких, а углекислого газа – в мг/л. Тогда для расчета молярной концентрации СО2 напомним формулу: [СО2]=z/44 (10-3М, или mM), где z мг/л – измеренная с помощью СО2-теста концентрация углекислого газа.
Для пересчета единиц измерения жесткости можно предложить следующие формулы:
[Ca++] = 0,18 (x°dGH) (10-3M, или mM)
[HCO3–] = 0,36(y°dKH) (10-3M, или mM)
где x° и y° – соответственно общая и карбонатная жесткость, измеренная в немецких градусах.
В качестве примера рассмотрим: 1) воду из-под крана; 2) ту же воду, отстоянную в течение суток; 3) воду из старого аквариума с плотной посадкой рыбы, но почти без растений; 4) утреннюю воду из старого аквариума без аэрации, с большим количеством растений, но малым количеством рыб; 5) ту же воду вечером. Для удобства результаты измерений собраны в таблицу 1:
|
№ примера |
dGH |
dKH |
СО2, мг/л |
|
1 |
10 |
7 |
26 |
|
2 |
10 |
8 |
4 |
|
3 |
17 |
2 |
6 |
|
4 |
11 |
8 |
12 |
|
5 |
11 |
10 |
10 |
После преобразований по приведенным выше формулам, результаты измерений представлены в таблице 2:
|
№ примера |
[Ca++] |
[HCO3–] |
[CО2]общ |
[CО2]р |
|
1 |
1,8 |
2,5 |
0,6 |
0,3 |
|
2 |
1,8 |
2,9 |
0,1 |
0,4 |
|
3 |
3 |
0,7 |
0,1 |
0,05 |
|
4 |
2,0 |
2,9 |
0,3 |
0,5 |
|
5 |
2,2 |
3,6 |
0,25 |
0,8 |
Значение равновесной углекислоты [CO2]р рассчитывалось по формуле:
[CО2]p=[Ca++][HCO3–]2/34,3 (см. гл. 3)
Рассмотрим полученные результаты.
1). Вода из-под крана в зависимости от региона, сезона и пр., может содержать от 20 до 40мг/л СО2, что превышает ее равновесное значение в два и более раза. Даже по абсолютному содержанию углекислоты (более 15мг/л), такая вода непригодна для жизни большинства видов аквариумных рыб, не считая присутствия хлора, хлорамина, железа и прочих «благ цивилизации». Предлагаемые рынком кондиционеры для воды не устраняют избытка СО2, поэтому даже при их использовании, подмены воды следует производить осторожно (лучше меньше, но чаще), с учетом видового состава рыбного населения аквариума.
2). Данный пример демонстрирует «мобильность» СО2 и сравнительно низкий уровень [СО2]общ при состоянии воды, приближающемся к газовому равновесию. Сравнительно низкие остаточные количества углекислого газа в отстоянной водопроводной воде определяются его содержанием в воздухе (з-н Генри– см. гл.2). Поскольку в такой воде [CO2]общ<[CО2]р, она склонна к отложению известняка СаСО3 при разложении гидрокарбонатов: Са+++2НСО3–>СаСО3v+СО2^+Н2О. Тогда на дне и стенках посуды образуется известковая корка, часто с примесью железа. При этом кислотность воды достигает рН 8,0-8,2, с тенденцией к возрастанию при увеличении продолжительности отстаивания. В очень жесткой воде кислотность может достигать значений рН>8,5. В последнем случае при массированной подмене воды могут возникнуть проблемы с т.н. мягководной рыбой.
3). Следует обратить внимание, что в этом примере значение карбонатной «жесткости» (2°dKH) меньше рекомендуемого минимума (4°dKH). Поскольку [CO2]общ>[CO2]р, такая вода будет растворять известняк грунта, поэтому общая жесткость воды в данном примере превышает жесткость воды из водопровода. В воде с таким низким значением карбонатной «жесткости» следует ожидать проблем со здоровьем многих видов живородок, атерин, танганийских цихлид, скалярий и др.. Повысить уровень карбонатной «жесткости» можно частыми подменами воды (до 3-х и более раз в неделю), препаратом «рН-uр», или с помощью пищевой соды NaHCО3. Соду можно добавлять из расчета половины чайной ложки на 100 литров воды, контролируя значение dКН с помощью соответсвующего теста. Примеры 2 и 3 иллюстрируют положения, обсуждаемые в главах 3 и 4.
4) и 5). Из данных примеров видно влияние фотосинтеза водных растений на состояние углекислотного равновесия аквариумной воды. Несмотря на сходство с примером 2 ([CO2]общ<[CO2]р), отложения СаСО3 не происходит, т.к. этому препятствуют органические вещества, содержащиеся в воде аквариума. Сильно заиленный грунт поставляет в воду значительные количества СО2(10-12мг/л), но поскольку
[СО2 ]общ<[ СО2 ]р, рост растений не очень активный. Любопытно, что соотношение обеих форм угольной кислоты не изменяется даже за ночь. Высокое значение dKH обеспечивает устойчивость буферной системы воды и удовлетворительное самочувствие видов рыб, мало чувствительных к углекислому газу – харациновых, меланотений и некоторых других. В то же время отсутствие продувки поддерживает стабильно высокий уровень содержания СО2. При этом карбонатная «жесткость» dKH остается наиболее информативным и удобным параметром в оценке буферной емкости аквариумной воды. Несколько повышенная общая жесткость связана с использованием в прошлом углекислотной подкормки растений.
В заключении хотелось бы выразить благодарность моим товарищам: Бугайцу С., Мухину Б., Опаленко М., Телегину А. и Хмелевскому Ю., взявшим на себя труд по прочтению рукописи и благодаря поддержке и деловым замечаниям которых, данная работа увидела свет.
© Александр Яночкин, 2005 г.
© Аква Лого, 2005 г.
8. ИСПОЛЬЗОВАННАЯ ЛИТЕРАТУРА
1. Бауэр Р. Болезни аквариумных рыб. М.: Аквариум, 2000 – 176с.
2. Ввозная Н.Ф. Химия воды и микробиология. М.: Высш. школа, 1979 – 340с.
3. Зайчик А.Ш., Чурилов Л.П. Общая патофизиология. СПб., 2001 – 624с.
4. Кляшторин Л.Б. Водное дыхание и кислородные потребности рыб. М.: Легкая и пищевая промышленность, 1982 – 168с.
5. Корзюков Ю.А. Болезни аквариумных рыб. М.: Колос, 1979 – 175с.
6. Кочетов А.М. Декоративное рыбоводство. М.: Просвещение, 1991 – 384с.
7. Общий курс физиологии человека и животных. Кн.2. Физиология висцеральных систем. Под ред.Ноздрачева А.Д. и др.. М.: Высш.школа, 1982 – 528с.
8. Перельман А.И. Геохимия природных вод. М.: Наука,1982 – 154с.
9. Проссер Л., Браун Ф. Сравнительная физиология животных. М.: Мир, 1979 – 752с.
10. Скуг Д., Уэст Д. Основы аналитической химии. Т.1. М.: Мир, 1979 – 480с.
11. Смит Л.С. Введение в физиологию рыб. М.: Агропромиздат, 1986 – 168с.
12. Спотт С. Содержание рыбы в замкнутых системах. М.: Легкая и пищевая промышленность, 1983 – 192с.
Поля, отмеченные знаком *, обязательны для заполнения.
www.aqualogo.ru
22. Кислотно-основное равновесие в природных водах.РН атм. Осадков.
Кислотно-осн. равновесие в природных водах определяется присутствием ионов карбонатна НСО3 и СО3.
При рН =7: [H+]=[ НСО3–]+2[CO32-]+[OH–]
Карбонатную систему образуют неорг. соединения углерода присутствующие в природных водах в виде производных уголной к-ты.
СО2газ→СО2(р-р)+Н2О→ Н2 СО3
Диссоциация Н2 СО3:
1 стадия: Н2 СО3→ НСО3–+Н+ k1=аН+*а НСО3-/а Н2 СО3
2 стадия: Н2 СО3→ Н+ + СО32- k2=а СО32-* аН+/а НСО3-
k2< k1, примерно на 4 порядка, поэтому вклад во 2 ступени диссоциации величину рН можно не учитывать.
Выпадение кислотных дождей.
Кислотными дождями наз-ся осадки с рН<5,5. г Питлокри (Шотландия) рН=2,4.
Основной вклад в кислотность носит соединение S (до 80%) и азота (до 15%)
В 1872 году Роберт Смит ввел термин в своей книге «Воздух и дождь, начало химической климатологии ».
Последствия выпадения кислотных дождей:
1)закисление почвенных водоемов;
2)в почве уменьшается продуктивность, сокращается поступление питательных веществ, падает урожайность с/х культур.
3) страдают леса (высыхают,особенно хвойные)
4) разрушаются памятники архитектуры.
5) ухудшается состояние техногенных объектов следствии коррозии.
6)люди вынуждены употреблять загрязненную воду и т. Д. в климатической среде увеличивается подвижность тяжелых металлов. Для уменьшения кислотности осадков необходимо снижать выбросы в атм-ру осадков серы и азота.
23. Растворимость карбонатов и рН природных вод.
Среди карбонатов самыми распространенными яв-ся СаСО3
Кальцит преобладает в умеренной климатической зоне, а арагонит в теплых тропических морях.
Арагонит не стабильная форма постепенно переходит в кальцит. Растворение карбонатов в природных водоемах чаще протекает в присутствии СО2
СаСО3+ Н2О + СО2→Са2++2НСО3–
НСО3– – включается в общую систему карбонатных равновесий и влияет на рН природных вод.
[H+]= (pCO22 k2k1k г(СО2)γНСО3/k нсо3 γСО32+)1/3
k нсо3=аса2+*асо3-
для большинства поверхностных вод при наличии контакта с карбонатными породами рН =8,3-8,4. в литосфере помимо СаСО3 встречается еще Са Mg(СО3)2
растворение в природных водах:
Са Mg(СО3)2→Ca2+Mg 2+ +СO32-
в природных водах возможны взаимные преобразования кальцита и доломита:
Са Mg(СО3)2+ Ca2→Ca СO3+Mg 2+
K= а Mg 2+/а Ca2
Карбонатное равновесие в океане .
В морской воде помимо СО2 ,СО3 , НСО2 присутствуют другие ионы, кот нужно учитывать при расчетах.
В океанах по глубине выделяют 4 зоны с разной степенью насыщения воды карбонатами.
1 зона – до глубины 800м (пересыщен карбонатами)
2 зона – до 2000 м (недосыщена карбонатами)
3 зона – до 4000 м (равновесное состояние)
4 зона – до дна (недонасыщенное состояние связана с ростом гидростатического давления).
24.Жесткость природных вод.Классификация природных вод по величине жесткости. Способы уменьшения жесткости воды.
Жесткостью называют свойство воды, обусловленное наличием в ней растворимых солей кальция и магния. Различают следующие виды жесткости.
Общая жесткость. Определяется суммарной концентрацией ионов кальция и магния. Представляет собой сумму карбонатной (временной) и некарбонатной (постоянной) жесткости.
Карбонатная жесткость. Обусловлена наличием в воде гидрокарбонатов и карбонатов (при рН>8.3) кальция и магния. Данный тип жесткости почти полностью устраняется при кипячении воды и поэтому называется временной жесткостью. При нагреве воды гидрокарбонаты распадаются с образованием угольной кислоты и выпадением в осадок карбоната кальция и гидроксида магния.
Некарбонатная жесткость. Обусловлена присутствием кальциевых и магниевых солей сильных кислот (серной, азотной, соляной) и при кипячении не устраняется (постоянная жесткость).
Реагентное умягчение. Метод основан на добавлении в воду соды или гашенной извести. При этом соли кальция и магния переходят в нерастворимые соединения и, как следствие, выпадают в осадок. Этот метод оправдан при относительно больших расходах воды, поскольку связан с решением ряда специфических проблем: фильтрации осадка, точной дозировки реагента.Катионирование. Метод основан на использовании ионообменной гранулированной загрузки (чаще всего ионообменные смолы). Такая загрузка при контакте с водой поглощает катионы солей жёсткости (кальций и магний). Взамен, в зависимости от ионной формы, отдавая ионы натрия иливодорода. Эти методы соответственно называются Na-катионирование и Н-катионирование. Как правило, жёсткость воды снижается при одноступенчатом натрий-катионировании до 0,05-0,1 мг-экв/л, при двухступенчатом — до 0,01 мг-экв/л.Лучшим реагентом для устранения общей жесткости воды является ортофосфат натрия Na3PO4: 3Ca(HCO3)2 + 2Na3PO4 → Ca3(PO4)2↓+ 6NaHCO3 3MgSO4 + 2Na3PO4 → Mg3(PO4)2↓ + 3Na2SO4 Ортофосфаты кальция и магния очень плохо растворимы в воде, поэтому достигается лучшее умягчение воды. В промышленности с помощью ионообменных фильтров заменяют ионы кальция и магния на ионы натрия и калия, получая мягкую воду. Определенное умягчение воды происходит и в бытовых фильтрах для питьевой воды. Отфильтрованная вода дает меньше накипи. Полностью очистить воду можно методом перегонки(дистилляцией)
studfiles.net
4.3. Карбонатное равновесие в океане
Неорганические
соединения углерода в морской воде
представлены, как и в случае пресных
поверхностных и глубинных вод, диоксидом
углерода
и ионами НСО и СО
и СО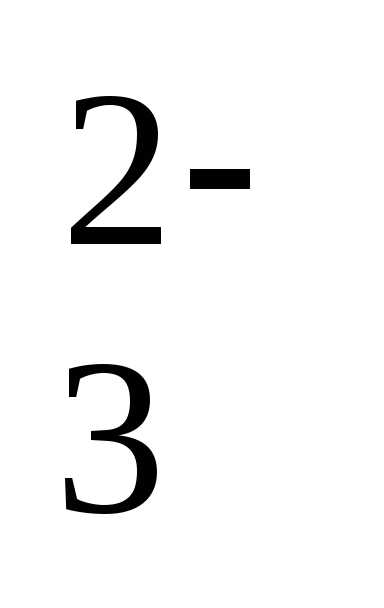 .
Химические превращения, связывающие
между собой отдельные компоненты
карбонатной системы, едины для воды
океана и пресноводных водоемов. Однако
в отличие от пресных водных систем вода
океанов представляет собой
многокомпонентный раствор электролитов
средней концентрации, который
характеризуется высокими значениями
ионной силы
.
Химические превращения, связывающие
между собой отдельные компоненты
карбонатной системы, едины для воды
океана и пресноводных водоемов. Однако
в отличие от пресных водных систем вода
океанов представляет собой
многокомпонентный раствор электролитов
средней концентрации, который
характеризуется высокими значениями
ионной силы
Таблица 5. Коэффициенты
активности ионов НСО и СО
и СО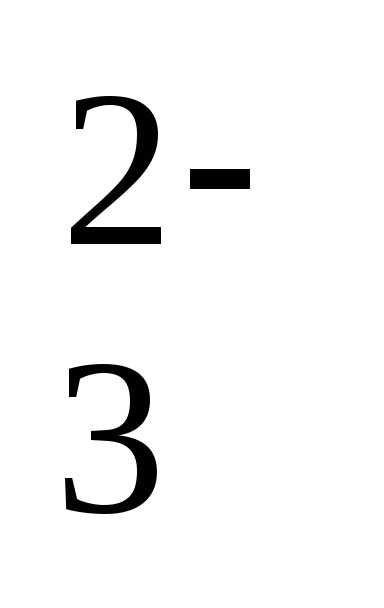 в морской воде, вычисленные по константам
диссоциации угольной кислоты при
различных значениях хлорности
в морской воде, вычисленные по константам
диссоциации угольной кислоты при
различных значениях хлорности
Ионы | Значение при хлорности (%о) | |||||
2 | 6 | 10 | 14 | 18 | 20 | |
НСО | 0,833 | 0,647 | 0,519 | 0,460 | 0,428 | 0,412 |
СО | 0,292 | 0,085 | 0,042 | 0,027 | 0,020 | 0,017 |
Для воды океана величина ионной силы может быть определена как функция хлорности:
I = 0,0147 + 0,03592 . С1%о + 0,000068 . (С1%о)2, (45)
где I – ионная сила раствора;
Cl%o – величина хлорности воды в промилле.
При расчетах
карбонатных равновесий для морской
воды следует использовать данные об
активности ионов. Коэффициенты активности
ионов НСО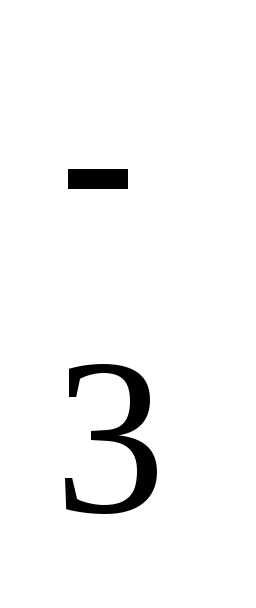 и СО
и СО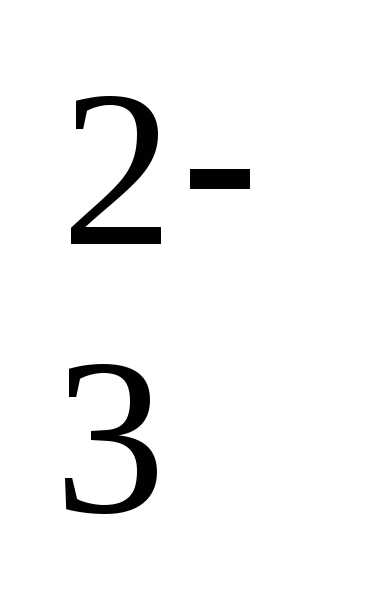 резко уменьшаются при росте хлорности
воды (таблица 5). Их расчет по теории
Дебая—Хюккеля позволяет получитьудовлетворительные
результаты
лишь при малых значениях ионной силы
раствора (для морской поды — до хлорности
2%о). Экспериментальное определение
коэффициентов активности представляет
определенные трудности. В связи с этим
при расчете равновесий в морской
воде наиболее часто используют значения
концентрационных кажущихся, или
смешанных, констант. Так, для констант
диссоциации угольной кислоты по первой
и второй ступеням смешанные константы
диссоциации имеют вид:
резко уменьшаются при росте хлорности
воды (таблица 5). Их расчет по теории
Дебая—Хюккеля позволяет получитьудовлетворительные
результаты
лишь при малых значениях ионной силы
раствора (для морской поды — до хлорности
2%о). Экспериментальное определение
коэффициентов активности представляет
определенные трудности. В связи с этим
при расчете равновесий в морской
воде наиболее часто используют значения
концентрационных кажущихся, или
смешанных, констант. Так, для констант
диссоциации угольной кислоты по первой
и второй ступеням смешанные константы
диссоциации имеют вид:
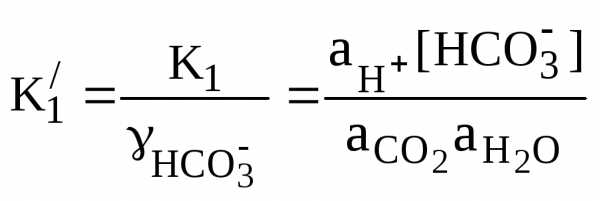 ; (46)
; (46)
, (47)
где 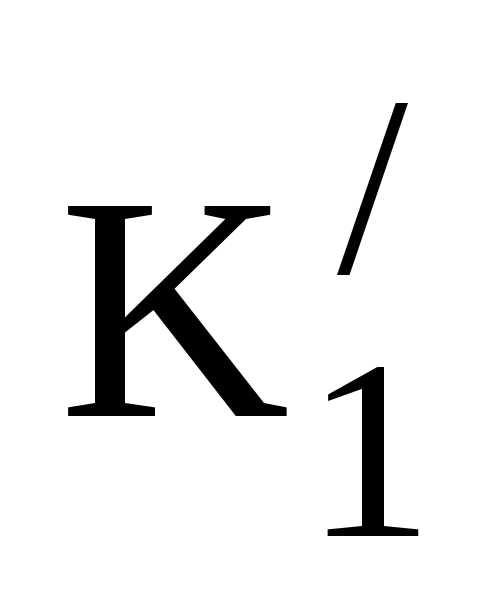 и
и 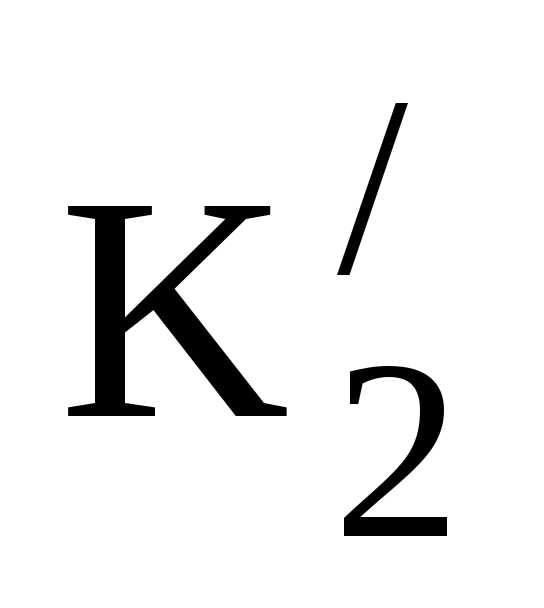 – смешанные константы диссоциации;
– смешанные константы диссоциации;
К1 и К2 – термодинамические константы диссоциации.
В отличие от термодинамических констант, смешанные константы диссоциации угольной кислоты зависят от солености и хлорности морской воды. Их использование позволяет избежать необходимости введения коэффициентов активности, так как они уже учтены при экспериментальном определении констант. При различных хлорности и температуре воды значения констант диссоциации угольной кислоты по первой и второй ступеням могут быть найдены, например, по уравнениям:
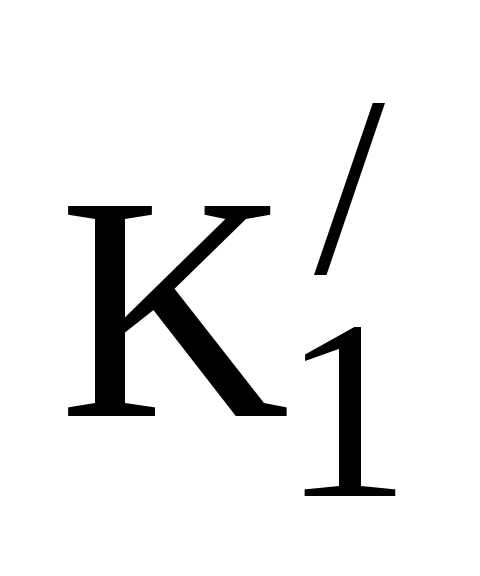 = 6,3784
– 0,01137 . Сl%0 – 0,010765Т+ 1,563 . 10–4T2; (48)
= 6,3784
– 0,01137 . Сl%0 – 0,010765Т+ 1,563 . 10–4T2; (48)
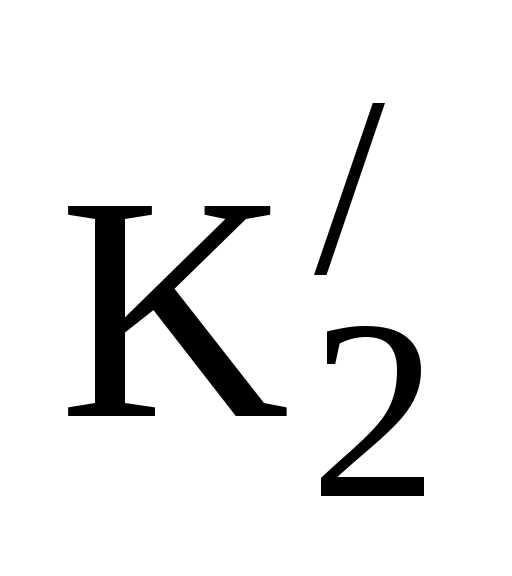 = 9,8227 – 0,2719 . С1%о – 0,015215T
+ 1,3232 . 10–4T2.
(49)
= 9,8227 – 0,2719 . С1%о – 0,015215T
+ 1,3232 . 10–4T2.
(49)
Протекание процессом растворения или осаждения СаСО3 в рассматриваемой карбонатной системе океана зависит, помимо парциального давления СO2 и температуры, от солености воды и величины гидростатического давления. В океанах создается весьма неоднородное распределение насыщенности воды карбонатом кальция; по глубине обычно выделяют четыре зоны с различной степенью насыщения воды карбонатами.
Первая зона – поверхностный слой воды до глубины 300-800 м – значительно пересыщена. Этому способствуют сравнительно высокие температуры и низкие парциальные давления диоксида углерода.
Вторая зона охватывает слой глубиной до 1500-2000 м. В связи с интенсификацией процесса окисления органического вещества в этой зоне происходит увеличение Рсо2 и может возникнуть недонасыщение карбонатом кальция.
Третья зона (до 3500-4500 м) отличается состоянием, близким к равновесному.
Четвертая зона (от 3500-4500 м до дна) характеризуется ярко выраженным недонасыщением воды карбонатом кальция, связанным с ростом гидростатического давления.
studfiles.net
Углекислый газ и карбонатная система воды – Часть 1 – ШКОЛА Воинствующего Крестьянина – Школа Комплексного Землепользования – Комплексное Землепользование
Мне очень часто задают вопросы и вопросы очень важные:
“Какие параметры необходимо соблюсти в первую очередь, а какие во-вторую?”
Этот вопрос повторяется, в различных интерпритациях, не зависимо от того, какой из отраслей наиболее интересует человека. Будь то получение биогаза или культивирование синезеленых водорослей, кормление птицы или животных, выращивание овощей в открытом грунте или в теплице.
Всегда, везде, повсюду мы сталкиваемся с водой. Вода самый распространенный и универсальный растворитель, без воды немыслима жизнь на земле. А много ли мы знаем о воде? Казалось бы много, но…
Если Вы ставите своей целью извлечь максимум выгоды из своей деятельности с минимальными затратами, вам не обойтись без знаний, во многих областях.
Те кто считают, что им достаточно научиться” управлять”, а конкретными и специальными знаниями должны владеть специалисты в отдельной области, правы, но от части. Какова эта “часть” правоты? Покажет время, и не столь далекое.
А мы пока вооружимся знаниями которые помогут ориентироваться в вопросах о роли воды в получении прибыли. Как не смешно это выглядет.
Многим известны рекомендации по использованию воды, более мягкой и кислой, по сравнению с фильтратом, полученого из шлама после ферментации биосубстракта в биореакторе. Удобно пользоваться для этой цели дистиллированной водой, мягкой и слабокислой, смешивая ее с водой из сборника – накопителя. Но оказывается, что при этом жесткость исходной воды уменьшается пропорционально разведению, а рН практически не изменяется. Свойство сохранять значение показателя рН независимо от степени разведения, называется буферностью. В этой статье мы познакомимся с основными компонентами буферных систем воды: кислотностью воды – рН, содержанием углекислого газа – СО2, карбонатной «жесткостью» – dКН (эта величина показывает содержание в воде гидрокарбонат-ионов НСО3–; этот параметр называют щелочностью), общую жесткость – dGН (для упрощения принимается, что ее составляют только ионы кальция – Са++). Обсудим их влияние на химический состав природной воды и фильтрата, собственно буферные свойства, а также механизм воздействия рассматриваемых параметров на живые организмы. Большинство химических реакций, рассматриваемых ниже, являются обратимыми, поэтому вначале важно познакомиться с химическими свойствами обратимых реакций; это удобно сделать на примере воды и показателя рН.
ОГЛАВЛЕНИЕ
- О химических равновесиях, единицах измерения и рН
- СО2 со товарищи, рН и снова единицы измерения
- Природная вода и углекислотное равновесие
- О воде – шламовом фильтрате и произведении растворимости
- Карбонатная буферная система
- СО2 и физиология дыхания.
- Мини-практикум
- Использованная литература
1. О ХИМИЧЕСКИХ РАВНОВЕСИЯХ, ЕДИНИЦАХ ИЗМЕРЕНИЯ И pН
Вода является хотя и слабым, но все же электролитом, т. е. способна к диссоциации, описываемой уравнением
Н2О→Н+ +ОН–
Этот процесс обратим, т.е.
Н++ОН–→Н2О
C химической точки зрения ион водорода Н+всегда является кислотой. Ионы, способные связывать, нейтрализовывать кислоту (Н+), являются основаниями. В нашем примере это – гидроксил-ионы (ОН–), но в аквариумной практике, как будет показано ниже, доминирующим основанием является гидрокрабонат-ион НСО3–, ион карбонатной «жесткости». Обе реакции протекают с вполне измеримыми скоростями, определяемыми концентрацией: скорости химических реакций пропорциональны произведению концентраций реагирующих веществ. Так для обратной реакции диссоциации воды Н++ОН–→Н2О ее скорость выразится следующим образом:
Vобр = Кобр[Н+][OH–]
К – коэффициент пропорциональности, называемый константой скорости реакции.
[ ]-квадратные скобки обозначают молярную концентрацию вещества, т.е. количество молей вещества в 1 литре раствора. Моль можно определить как вес в граммах (или объем в литрах – для газов) 6∙1023 частиц (молекул, ионов) вещества – число Авогадро. Число, показывающее вес 6∙1023 частиц в граммах равно числу, показывающему вес одной молекулы в дальтонах.
Так, например, выражение [H2O] обозначает молярную концентрацию водного раствора … воды. Молекулярный вес воды составляет 18 дальтон (два атома водорода по 1д, плюс атом кислорода 16д), соответственно 1 моль (1М) Н2О – 18 грамм. Тогда 1 литр (1000 грамм) воды содержит 1000:18=55,56 молей воды, т.е. [H2O]=55,56М=const.
Поскольку диссоциация – процесс обратимый (Н2О↔Н++ОН–), то при условии равенства скоростей прямой и обратной реакции (Vпр=Vобр), наступает состояние химического равновесия, при котором продукты реакции и реагирующие вещества находятся в постоянных и определенных соотношениях: Кпр[H2O] = Kобр[H+][OН–]. Если константы объединить в одной части уравнения, а реагенты в другой, то получим
Кпр/Кобр = [H+][OH–]/[H2O] = К
где К также является постоянной величиной и называется константой равновесия.
Последнее уравнение является математическим выражением т.н. закона действия масс: в состоянии химического равновесия отношение произведений равновесных концентраций реагентов является постоянной величиной. Константа равновесия показывает, при каких пропорциях реагентов наступает химическое равновесие. Зная значение К, можно предсказать направление и глубину протекания химической реакции. Если К>1, реакция протекает в прямом направлении, если К<1 – в обратном. Используя константу равновесия, с химическими уравнениями можно обращаться как с алгебраическими и производить соответствующие вычисления. Точность их не очень высока, но они относительно просты и наглядны, что позволяет глубже понять смысл рассматриваемых процессов. Численное значение константы равновесия индивидуально и постоянно для каждой обратимой химической реакции. Оно определяется экспериментально, и эти значения приводятся в химических справочниках.
В нашем примере К= [H+][OН–]/[H2O] = 1,8∙10-16. Поскольку [H2O] =55,56 =const, то ее можно объединить с К в левой части уравнения. Тогда:
К[H2O]=[H+][OH–]=(1,8∙10-16)∙(55,56)=1∙10-14= const. = Кw
Преобразованное в такую форму уравнение диссоциации воды называется ионным произведением воды и обозначается Кw. Значение Кw остается постоянным при любых значениях концентраций Н+ и ОН–, т.е. с увеличением концентрации ионов водорода Н+, уменьшается концентрация ионов гидроксила – ОH–и наоборот. Так, например, если [H+] = 10-6, то [OH–] = Kw/[H+] = (10-14)/(10-6)=10-8. Но Кw = (10-6).(10-8) =10-14 = const. Из ионного произведения воды следует, что в состоянии равновесия [H+] = [OH–] = √Кw = √1∙10-14 = 10-7М.
Однозначность связи между концентрацией ионов водорода и гидроксила в водном растворе позволяет для характеристики кислотности или щелoчности среды пользоваться одной из этих величин. Принято пользоваться величинoй концентрации ионов водорода Н+. Поскольку величинами порядка 10-7 оперировавть неудобно, в 1909 году шведский химик К.Серензен предложил использовать для этой цели отрицательный логарифм концентрации водородных ионов Н+ и обозначил его рН, от лат. potentia hydrogeni – сила водорода: рН = -lg[H+]. Тогда выражение [H+]=10-7 можно записать коротко как pH=7. Т.к. предложенный параметр не имеет единиц измерения, он называется показателем (рН). Удобство предложения Серензона вроде бы очевидно, но он подвергался критике современников за непривычную обратную зависимость между концентрацией ионов водорода Н+ и значением показателя рН: с увеличением концентрации Н+, т.е. с увеличением кислотности раствора, значение показателя рН уменьшается. Из ионного произведения воды следует, что показатель рН может принимать значения от 0 до 14 с точкой нейтральности рН=7. Органы вкуса человека начинают различать кислый вкус со значения показателя рН=3,5 и ниже.
Для нас, актуален диапазон рН 4,5-9,5 (ниже будет рассматриваться только он) и традиционно принята следующая шкала с непостоянной ценой деления:
- рН<6-кислая
- рН 6,0-6,5 – слабокислая
- рН 6,5-6,8 – очень слабокислая
- рН 6,8-7,2 –нейтральная
- рН 7,2-7,5 – очень слабощелочная
- рН 7,5-8,0 – слабощелочная
- рН>8 – щелочная
На практике в большинстве случаев гораздо информативнее оказывается более грубая шкала с постоянной ценой деления:
- рН=5±0,5 – кислая
- рН=6±0,5 – слабокислая
- рН=7±0,5 – нейтральная
- рН=8±0,5 – слабощелочная
- рН>8,5 – щелочная
Среды с рН<7,5 и рН>9,5 являются биологически агрессивными, и их следует считать непригодными для метаболизма метанообразующих. Поскольку показатель рН является логарифмической величиной, то изменение рН на 1 единицу означает изменение концентрации ионов водорода в 10 раз, на 2 – в 100 раз и т.д.. Изменение концентрации Н+ вдвое приводит к изменению значения показателя рН лишь на 0,3 единицы.
Многие рыбы, растения, животные и человек, без особого вреда для здоровья переносят и 100-кратные (т.е. на 2 единицы рН) изменения кислотности воды. Однако это не относится к метанообразующим бактериям. Практика показывает, что метанообразующие бактерии имеют максимальные показатели метаболизма в среде с рН 7,0-8,0. С. Спотт считает рН 7,1-7,8 оптимальным показателем.
Дистиллированная вода имеет рН 5,5–6,0, а не ожидаемое рН=7. Чтобы разобраться с этим парадоксом, необходимо познакомиться с «благородным семейством»: СО2 и его производными.
2. СО2 СО ТОВАРИЩИ, pН, И СНОВА ЕДИНИЦЫ ИЗМЕРЕНИЯ
Согласно закону Генри содержание газа воздушной смеси в воде пропорционально его доле в воздухе (парциальному давлению) и коэффициенту абсорбции. Воздух содержит до 0,04% СО2, что соответствует его концентрации до 0,4 мл/л. Коэффициент абсорбции СО2 водой=12,7. Тогда 1 литр воды может растворить 0,6 – 0,7 мл СО2 (мл, а не мг!). Для сравнения, его биологический антипод – кислород, при 20%-ном содержании в атмосфере и коэффициенте абсорбции 0,05 обладает растворимостью 7 мл/л. Сравнение коэффициентов абсорбции показывает, что при прочих равных растворимость СО2 значительно превышает растворимость кислорода. Попробуем разобраться, за что же такая несправедливость.
В отличие от кислорода и азота, углекислый газ – СО2, является не простым веществом, а химическим соединением – оксидом. Как и другие оксиды, он взаимодействует с водой с образованием гидратов оксидов и, как и у других неметаллов, его гидроксидом является кислота (угольная):
СО2+Н2О = Н2СО3.
В итоге большей относительной растворимостью углекислый газ обязан химическому связыванию его водой, чего не происходит ни с кислородом, ни с азотом. Рассмотрим внимательнее кислотные свойства угольной кислоты, применив закон действия масс и приняв во внимание, что [H2O] = const:
СО2+Н2О↔Н++НСО3–; К1 = [Н+][HCO3–]/[CO2] = 4∙10-7
НСО3–↔Н++СО3—; К2 = [H+][CO3—]/[HCO3–] = 5,6∙10-11
здесь К1 и К2 – константы диссоциации угольной кислоты по 1 и 2-ой ступени.
Ионы НСО3– называются гидрокарбонатами (в старой литературе бикарбонатами), а ионы СО3— – карбонатами. Порядок величин К1 и К2говорит о том, что угольная кислота является весьма слабой кислотой (К1<1 и К2 <1), а сравнение величин К1 и К2 – о том, что в ее растворе доминируют гидрокарбонат-ионы (К1>К2).
Из уравнения К1 можно рассчитать концентрацию ионов водорода Н+:
[H+] = K1[CO2]/[HCO3–]
Если выразить концентрацию Н+ через рН, как это в свое время сделали Хендерсон и Хассельбальх для теории буферных растворов, то получим:
рН = рК1 – lg[CO2]/[HCO3–]
или удобнее
рН = рК1 + lg[HCO3–]/[CO2]
где, по аналогии с рН, рК1 = -lgК1 =-lg4∙10-7 ≈ 6,4 = const. Тогда pH=6,4 + lg[HCO3–]/[CO2]. Последнее уравнение известно как уравнение Хендерсона – Хассельбальха. Из уравнения Хендерсона – Хассельбальха следуют по крайней мере два важных вывода. Во-первых, для анализа величины показателя рН необходимо и достаточно знания концентраций компонентов только СО2-системы. Во-вторых, значение показателя рН определяется отношением концентраций [HCO3–]/[CO2], а не наоборот.
Поскольку содержание [HCO3–] неизвестно, для вычисления концентрации Н+ в дистиллированной воде можно воспользоваться принятой в аналитической химии формулой [H+] = √K1[CO2]. Тогда рН = -lg√K1[CO2]. Чтобы оценить интересующую нас величину показателя рН, вернемся к единицам измерения. Из закона Генри известно, что концентрация СО2 в дистиллированной воде составляет 0,6мл/л. Выражение [CO2] означает молярную концентрацию (см. выше) углекислого газа. 1М СО2 весит 44 грамма, и принормальных условиях занимает объем 22,4 литра. Тогда для решения задачи необходимо определить, какую долю от 1М, т.е. от 22,4 литров, составляют 0,6 мл. Если концентрация СО2 выражена не в объемных, а в весовых единицах, т.е. в мг/л, то искомую долю необходимо считать от молярного веса СО2 – от 44 грамм. Тогда искомая величина составит:
[CO2] = x∙10-3/22,4 = y∙10-3/44
где х – объемная (мл/л), у – весовая (мг/л) концентрация СО2. Простейшие вычисления дают приблизительную величину 3∙10-5М СО2, или 0,03mM. Тогда
рН = -lg√K1[CO2] = -lg√(4∙10-7)(3∙10-5) = -lg√12∙10-12 = -lg(3,5∙10-6)≈ 5,5
что вполне согласуется с измеряемыми значениями.
Из уравнения Хендерсона-Хассельбальха видно, как величина показателя рН зависит от отношения [НСO3–]/[СО2]. Приблизительно можно считать, что если концентрация одного компонента превышает концентрацию другого в 100 раз, то последней можно пренебречь. Тогда при [НСО3–]/[СО2] = 1/100 рН = 4,5, что можно считать нижним пределом для СО2-системы. Меньшие значения показателя рН обусловлены присутствием не угольной, а других минеральных кислот, например серной, соляной. При [НСО3–]/[СО2] = 1/10, рН ≈ 5,5. При [НСО3–]/[СО2] = 1, или [НСО3–] = [СО2], рН ≈ 6,5. При [НСО3–]/[СО2] = 10, рН ≈ 7,5. При [НСО3–]/[СО2] =100, рН ≈ 8,5. Считается, что при рН>8,3 (точка эквивалентности фенолфталеина) свободная углекислота в воде практически отсутствует.
3. ПРИРОДНАЯ ВОДА И УГЛЕКИСЛОТНОЕ РАВНОВЕСИЕ
В природе атмосферная влага, насыщаясь СО2 воздуха и выпадая с осадками, фильтруется через геологическую кору выветривания. Принято считать, что там она, взаимодействуя с минеральной частью коры выветривания, обогащается т.н. типоморфными ионами: Ca++, Mg++, Na+, SO4—, Сl–и формирует свой химический состав.
Однако работами В.И. Вернадского и Б.Б. Полынова показано, что химический состав поверхностных и грунтовых вод регионов с влажным и умеренно влажным климатом формирует в первую очередь почва. Влияние же коры выветривания связано с ее геологическим возрастом, т.е. со степенью выщелоченности. Разлагающиеся растительные остатки поставляют в воду СО2, НСО3– и зольные элементы в пропорции, соответствующей их содержанию в живом растительном веществе: Cа>Na>Mg. Любопытно, что практически во всем мире питьевая вода, используемая и в метановых реакторах, в качестве доминирующего аниона содержит гидрокарбонат-ион НСО3–, а из катионов – Ca++, Na+, Mg++, нередко с некоторой долей Fe. А поверхностные воды влажных тропиков вообще удивительно однообразны по химическому составу, отличаясь лишь степенью разведения. Жесткость таких вод крайне редко достигает средних значений (8ºdGH), удерживаясь обычно на уровне до 4ºdGН. Ввиду того, что в таких водах [CO2]≈[HCO3–], они имеют слабокислую реакцию и значение показателя рН 6,0-6,5. Обилие листового опада и активно идущее его разрушение при большом количестве осадков могут приводить к весьма высокому содержанию в таких водах СО2 и гумусовых веществ (фульвокислот) при почти полном отсутствии зольных элементов. Таковы т.н. «черные воды» Амазонии, в которых значение показателя рН может опускаться до 4,5 и дополнительно удерживаться т.н. гуматным буфером.
На содержание СО2 в природных водах оказывает влияние и их подвижность. Так в проточных водах СО2 содержится в концентрации 2 – 5 мг/л (до 10), тогда как в стоячих водах болот и прудов эти величины достигают значения 15 – 30 мг/л .
В засушливых и бедных растительностью регионах на формирование ионного состава поверхностных вод заметное влияние оказывает геологический возраст горных пород, слагающих кору выветривания и их химический состав. В них рН и пропорции типоморфных ионов будут отличаться от приведенных выше. В результате формируются воды с заметным содержанием SО4—и Сl–, а из катионов могут преобладать Nа+ с заметной долей Mg++. Возрастает и общее содержание солей – минерализация. В зависимости от содержания гидрокарбонатов, значение показателя рН таких вод колеблется в среднем от рН 7±0,5 до рН 8±0,5, а жесткость всегда выше 10ºdGH. В стабильно щелочных водах, при рН>9, основными катионами всегда будут Mg++ и Na+ с заметным содержанием калия, поскольку Са++ осаждается в форме известняка. В этом плане особенно интересны воды Великой Африканской рифтовой долины, которая характеризуется т.н. содовым засолением. При этом даже воды таких гигантов, как озера Виктория, Малави и Танганьика отличаются повышенной минерализацией и таким высоким содержанием гидрокарбонатов, что карбонатная «жесткость» в их водах превышает жесткость общую: dKH>dGH.
Содержащиеся в воде СО2 и его производные – гидрокарбонаты и карбонаты, связаны между собой т.н. углекислотным равновесием:
СО2 + Н2О↔Н++НСО3–↔2Н+ + СО3—
В тех регионах, где кора выветривания молодая и содержит известняк (СаСО3), углекислотное равновесие выражается уравнением
СаСО3 + СО2 + Н2О ↔ Cа++ + 2НСО3–
Применив к этому уравнению закон действия масс (см. выше) и приняв во внимание, что [H2O]=const и [CaCO3]=const (твердая фаза), получаем:
[Ca++][HCO3–]2/[CO2] = КСО2
где КСО2 – константа углекислотного равновесия.
Если концентрации действующих веществ выражены в миллимолях (mM,10-3М), то КСО2 = 34,3. Из уравнения КСО2 видна неустойчивость гидрокарбонатов: в отсутствие СО2, т.е. при [CO2]=0, уравнение не имеет смысла. При отсутствии углекислого газа гидрокарбонаты разлагаются до СО2 и подщелачивают воду: НСО3–→ОН–+СО2. Содержание свободной СО2 (для «неживой» воды весьма незначительное), которое обеспечивает устойчивость данной концентрации гидрокарбонатов при неизменном рН, называется равновесной углекислотой – [CO2]р. Она связана как с содержанием углекислого газа в воздухе так и с dКН воды: с ростом dКН увеличивается и количество [СО2]р. Содержание СО2 в природных водах как правило близко к равновесной и именно эта их особенность, а не значения dKH, dGН и рН чаще всего отличает состояние природных вод от аквариумной воды. Решив уравнение КСО2относительно СО2, можно определить концентрацию равновесной углекислоты:
[CO2]р = [Ca++][HCO3–]2/КСО2
Поскольку понятия общей жесткости, карбонатной «жесткости» и кислотности являются культовыми, то интересно, что уравнения:
К1 = [H+][HCO3–]/[CO2]
и
КСО2 = [Ca++][HCO3–]2/[CO2]
объединяют их в одну систему. Разделив КСО2 на К1, получим обобщенное уравнение:
КСО2/К1=[Ca++][HCO3–]/[H+]
Напомним, что [H+] и рН объединяет обратнопропорциональная зависимость. Тогда последнее уравнение показывает, что параметры: dGH, dKH и рН связаны прямопропорционально. Это значит, что в состоянии, близком к газовому равновесию, увеличение концентрации одного компонента приведет к увеличению концентрации остальных. Данное свойство хорошо заметно при сравнении химического состава природных вод разных регионов: более жесткие воды отличаются более высокими значениями рН и dКН.
Для рыб оптимальное содержание СО2 составляет 1–5мг/л. Концентрации более 15мг/л опасны для здоровья многих видов рыб (см. ниже). Однако для метаболизма синезеленых водорослей концентрация 20-36мг/л является наиболее благоприятной.
Таким образом, с точки зрения углекислотного равновесия, содержание СО2 в природных водах всегда близко к [CO2]р.biogas.ucoz.net
Карбонатное равновесие – Большая Энциклопедия Нефти и Газа, статья, страница 2
Карбонатное равновесие
Cтраница 2
При изучении состава природных вод и его формирования нужно владеть приемами расчета характеристик карбонатного равновесия, способами получения горных растворов и методикой определения окислительно-восстановительных условий среды ( осадочных пород, в частности), при которых формируется состав подземных и поверхностных вод. Все эти вопросы и нашли свое отражение в соответствующих статьях сборника. [16]
Расчет этих характеристик дает возможность наиболее ясно представить качество воды с точки зрения карбонатного равновесия. [17]
Отложение карбонатов на стенках труб чаще всего наблюдается в тешюобменных аппаратах вследствие нарушения карбонатного равновесия, вызванного температурными условиями. Однако кальций может выделяться из воды и вследствие биохимических процессов в трубах. [18]
При заводнении карбонатных коллекторов, как и в терригенных отложениях, в случае нарушения карбонатного равновесия возможно выделение Нзб и СОг, наличие которых в попутно-извле-каемых водах приводит к резкому повышению коррозионной агрессивности перекачиваемых сред. [19]
Снижение давления и, как следствие, потеря пластовыми флюидами растворенной углекислоты приводит к нарушению карбонатного равновесия в извлекаемой воде, пересыщенной бикарбонатом кальция, и к выпадению осадка. [20]
Вторая группа причин кристаллизации и отложения карбонатных солей из попутно добываемых вод заключается в нарушении карбонатного равновесия, что приводит к уменьшению растворимости карбоната кальция в воде. [21]
От других методов, поскольку при контакте активных масс с агрессивной водой в ней самопроизвольно устанавливается карбонатное равновесие. Такой метод стабилизации воды перспективен для небольших водоочистных комплексов, так как не требуется контроля процесса и сложного оборудования известкового хозяйства. Однако, замедление скорости реакции при низких температурах воды и невозможность получения воды с положительным индексом стабильности ( / 0 7) для создания защитной карбонатной пленки на поверхности трубопроводов ограничивают применение данного метода. [22]
Например, исследованиями С.Н. Маринина с соавторами ( И.З. Ах-метшина, Г.А. Бабалян) [23, 101] установлено, что на карбонатное равновесие существенное влияние могут оказывать природные амфотерные соединения, переходящие из нефти в воду. [23]
Из солей, определяющих минерализацию пластовых вод, наименьшей растворимостью обладает бикарбонат кальция, количеством которого и определяется карбонатное равновесие. [24]
В данном сообщении рассмотрены результаты исследования натриевой функции стеклянных электродов при температурах до 150 и показано их применение для изучения карбонатных равновесий. Для исследований было выбрано натриево-алюмо-боросиликатное стекло ЭСЛ-51-04, обладающее натриевой функцией в широкой области рН – растворов и выпускаемое нашей промышленностью. [25]
Данное уравнение показывает, что если количество бикарбонатных ионов ( НСОд) соответствует определенному количеству свободного углекислого газа СО2, то существует карбонатное равновесие. [27]
В мягких маломинерализованных водах содержание гидрокарбонатов незначительно и количество свободной угольной кислоты, соответствующее равновесию с СОз атмосферы при данной температуре, может оказаться большим, чем это необходимо для карбонатного равновесия. Поэтому при контакте с бетоном таких вод возможно растворение карбонатной пленки. Крайне незначительная концентрация ионов Са2 в воде способствует растворению извести из цементного камня. [28]
Если при отстаивании нефти концентрация ее может в отдельных случаях уменьшаться, то в процессе отстаивания пластовых сточных вод от механических примесей концентрация последних может увеличиваться за счет окисления закисного железа, нарушения сульфатного или карбонатного равновесия, смешения железосодержащих вод с сероводородными, а в открытых сооружениях еще и вследствие попадания механических примесей в воду извне, особенно во время пыльных бурь. [29]
Нарушение равновесия ведет к замене одних форм другими. Согласно карбонатному равновесию, определенному содержанию в воде НСО3 – – ионов соответствует вполне определенное количество свободной углекислоты – так называемая равновесная углекислота. [30]
Страницы: 1 2 3 4
www.ngpedia.ru
Углекислотное равновесие – Энциклопедия по машиностроению XXL
СО2, то определяемому этим содержанием парциальному давлению должно было бы отвечать содержание СО2 в воде 0,5—1 мг/л. Вместе с тем подавляющее большинство поверхностных и подземных вод содержит значительно большее количество СО2 вследствие его участия в так называемом углекислотном равновесии . [c.6]Подставив найденные значения равновесных концентраций отдельных компонентов углекислотного равновесия (выраженных Через их исходные концентрации) в уравнение (1-24), получим [c.26]
Подставив эти величины в уравнение углекислотного равновесия (1-24), получим [c.28]
Концентрация Н+ в воде уменьшается, а величина pH возрастает, что вызывает смещение углекислотного равновесия в сторону образования карбонат-ионов. При этом происходят следующие процессы [c.67]
Различные формы угольной кислоты в водных растворах связаны так называемым динамическим углекислотным равновесием [c.21]
При наличии ионов Са2+ углекислотное равновесие выражается уравнением [c.21]
Увеличение степени минерализации воды приводит к уменьшению в ней количества свободной угольной кислоты, необходимой для поддержания углекислотного равновесия. Это обусловливает большую агрессивность воды, содержащей много солей, при равном содержании свободной угольной кислоты. [c.22]
Термический метод умягчения воды целесообразно применять при использовании карбонатных вод, идущих на питание котлов низкого давления а также в сочетании с реагентными методами умягчения воды. Он основан на смещении углекислотного равновесия при ее нагревании в сторону образования карбоната кальция, что описывается реакцией [c.474]
Концентрация растворенных газов в воде зависит от множества факторов природы газа, температуры воды, степени минерализации воды, парциального давления газа над водой, pH воды и др. Это во многих случаях существенно затрудняет ее аналитическое определение в технологических процессах и требует специальных методов анализа. Концентрация СО2 в природной воде существенно зависит от степени минерализации воды, углекислотного равновесия и составля- [c.40]
В чем сущности углекислотного равновесия и связанных с ним понятий стабильности и нестабильности воды [c.47]
Углекислотное равновесие 26 Удельная электрическая проводимость 38 Ультрафильтрация 160 Умягчение воды 102 Устойчивость коллоидных систем 49 Утилизация стоков 151 [c.306]
Выпадение карбонатов в осадок связано с нарушением углекислотного равновесия при подщелачивании катодного пространства, так как при этом равновесие НСО 7СО я смещается в сто- [c.47]
НАРУШЕНИЕ УГЛЕКИСЛОТНОГО РАВНОВЕСИЯ — ОСНОВНОЙ ФАКТОР ВЫДЕЛЕНИЯ КАРБОНАТА КАЛЬЦИЯ ИЗ ВОДНЫХ РАСТВОРОВ [c.22]
Для выражения способности вод с разной карбонатной жесткостью к выделению твердой фазы карбоната кальция нами предложен коэффициент углекислотного равновесия [c.26]
Гусев Б. Т., Кандидатская диссертация, Роль углекислотного равновесия при магнитной обработке природной воды, МЭИ, 1967. [c.142]
Концентрация растворенных газов в воде зависит от множества факторов природы газа, температуры воды, степени минерализации воды, парциального давления газа над водой, pH воды и т. п. Это во многих случаях существенно затрудняет их аналитическое определение в технологических процессах и требует специальных методов анализа. Концентрация СО2 в природной воде существенно зависит от степени углекислотного равновесия и составляет примерно 0,5 мг/кг (10 моль/кг) при 293 К. Концентрация О2 в значительной степени зависит от содержания в воде органических веществ и температуры. При увеличении температуры от 273 до 308 К концентрация кислорода в чистой воде уменьшается от 14,6 до 6,5 мг/кг. [c.31]
Таким образом, pH возрастает, что вызывает смещение углекислотного равновесия в сторону образования ионов СО , в которые переходят все формы угольной кислоты. Увеличение концентрации СО 3 вызывает реакцию образования труднорастворимого карбоната кальция [c.54]
Условия углекислотного равновесия согласно реакциям [c.292]
С помощью уравнений материального баланса и констант диссоциации ионные концентрации компонентов углекислотного равновесия запишутся в виде [c.294]
Тогда условия углекислотного равновесия (12.9) приводятся к виду [c.295]
Углекислотное равновесие 24—28 Удельные приведенные затраты на производство дистиллята 220, 252 Уменьшение сбросов 255 Умягчение воды, методы 164 Установки комбинированные 192 [c.325]
Следует отметить важность правильного отбора пробы для анализа. Доказано экспериментально, что содержание углекислоты в исследуемой воде при контакте с воздухом быстро изменяется, стремясь к равновесию с окружающей атмосферой. Обычное содержание СОг в воздухе лабораторий таково, что в воде, находящейся в углекислотном равновесии с этим воздухом, концентрация СОг составляет 1—3 мг/кг. Следовательно, все воды, в которых концентрация углекислоты выше 1—3 мг/кг, будут при отборе пробы и ее титровании терять углекислоту и анализ их [c.269]
В присутствии ионов Са + углекислотное равновесие схематически вь -ражается уравнениями [c.24]
Нормальной работе систем оборотного водоснабжения препятствуют различного рода отложения и обрастания, образующиеся в теплообменных аппаратах, трубопроводах и градирнях в процессе эксплуатации. К наиболее часто встречающимся отложениям относятся солевые, и в частности” отложения карбоната кальция, образующиеся наиболее интенсивно на поверхностях теплообмена вследствие нарушения углекислотного равновесия в системах обо- [c.13]
УГЛЕКИСЛОТНОЕ РАВНОВЕСИЕ В ПРИРОДНЫХ ВОДАХ И В оборотной воде [c.14]
Изменение температуры раствора приводит к перераспределению различных форм углекислоты в соответствии с изменением констант приведенных выше уравнений. Увеличение или уменьшение в растворе концентрации какого-либо компонента углекислотного равновесия приводит к соответствующему изменению концентраций других компонентов до тех пор, пока снова не установится равновесие согласно уравнению [c.15]
Если />0, вода считается стабильной. Такая вода способна создавать на стали карбонатную защитную пленку СаСОз. Если /способна растворять СаСОз. Авторы работы [5] показали, что для воды с температурой 60 °С индекс насыщения примерно на единицу выше, чем для воды того же со-става при температуре 10 °С. В умягченной воде углекислотное равновесие теряет смысл. [c.14]
При подкислении воды серной кислотой происходит нейтрализация бикарбонатов кальция и магния с образованием сульфатов, обладающих высокой растворимостью и не выпадающих в осадок. В процессе подкис-ления понижается щелочность воды и увеличивается концентрация свободной углекислоты, которая предотвращает нарушение углекислотного равновесия и образование малорастворимого карбоната СаСОз. [c.33]
Установление углекислотного равновесия, сопровождающееся или выделением каобоната кальция в осадок, или переходом его в раствор из донных отложений. [c.17]
Уравнение (1-23) характеризует условия так называемого углекислотного равновесия, т. е. равновесия системы, содержащей одновременно ионы Са -Ь и НСОз”. Из уравнения (1-23) следует, что равновесие может наблюдаться тодько в том случае, когда одновременно с ионами Са2+ и НСОГ в растворе присутствует в определенной концентрации и угольная кислота НгСОз, называемая равновесной угольной кислотой. [c.24]
Уравнение (1-26) показывает равновесие между концентрациями молекул НгСОз и СО2. Так как СО2 — газообразный продукт, то растворимость его в воде зависит от парциального давления СО2 в воздухе и температуры. При определенных условиях (повышенная температура, малое парциальное давление СО2) может оказаться, что величина растворимости СО2 в воде будет меньше величины ее равновесной концентрации (определяемой только концентрациями Са + и НС01 ),в которой СО2 была в растворе в системе, находившейся в равновесном состоянии. В этом случае избыток СО2, содержащейся в растворе , будет выделяться из воды в виде газа (десорбция СО2), приводя тем самым к нарушению углекислотного равновесия. Система (т. е. вода, содержащая Са + и НСОГ) окажется неустойчивой и в ней [c.24]
Последнее уравнение позволяет рассчитать величину х и по найденной величине его найти значения равновесных концентраций отдельных компонентов углекислотного равновесия. Величина х указывает одновременно число молей СаСОз, которые выделятся из 1 л воды до момента установления равновесия. [c.26]
Расчет концентрации агрессивной СОз может быть произведен методом, аналогичным тому, который был применен при выводе уравнения (1-27), характеризующего состояние равновесия при Сщсо,[c.27]
Возможность образования осадка карбоната кальция определяется рассмотренным выше углекислотным равновесием. Образующиеся возле металлической поверхности продукты анодной (Ре +) и катодной (ОН ) реакции могут оказывать влияние на углекислотное равновесие, сдвигая его в ту или иную сторону. При этом условия осаждения СаСОз отличаются от тех условий, которые создаются в объеме воды вдали от корродирующей поверхности металла. [c.46]
Стабилизация воды предусматривает обработку ее для снижения коррозионной активности путем поддержания углекислотного равновесия. Обычно в первый период эксплуатации водопроводов в воду добавляют реагенты, способствующие образованию на внутренних стенках труб защитной пленки из карбоната кальция (при этом вода должна иметь положительный индекс насыщения, /=рН—рН5>0). После того как на поверхности сформируется защитная пленка, для ее сохранения индекс насыщения стабилизированной (обработанной) воды должен быть близким к нулю, так как под воздействием СО2 защитная пленка может раствориться. Поэтому стабилизационную обработку воды следует проводить непрерывно для поддержания необходимого количественного соотнощения НСОз и СО2. [c.97]
Л1етод стабилизационной обработки воды фильтрованием через дробленый мрамор можно применять при карбонатной жесткости воды менее 3 мэкв/л. При большой жесткости воды затрудняется наступление состояния углекислотного равновесия. Нельзя фильтровать через дробленый мрамор воду, содержащую марганец и железо, без предварительной очистки ее,, чтобы не допустить загрязнения фильтра. Применение подобных фильтров особенно выгодно для малых установок их отличает простота конструкций и обслуживания [43]. [c.98]
Как показывает многолетний опыт эксплуатации, при применении необработанной водопроводной воды в ряде случаев работа подогревателей осложняется интенсивным выделением в трубках карбонатной или карбонатно-железистой накипи. Появление отложений обусловливается качеством исходной водопроводной воды. Если характеризовать химический состав воды индексом стабильности Яс, показывающим состояние углекислотного равновесия в воде, и возможность выделения карбоната кальция при смещении равновесия, а также карбонатной жесткостью Жк, дающей представление о концентрации основного накипеобразователя в воде, то образование крабонатной накипи возможно при условии Яс>0 и Жк>4,5 мг-экв/кг. [c.140]
Задача представленной в этой главе программы ПРЕДОЧ -расчет равновесных концентраций ионов в воде, подвергнутой совместной коагуляции и известкованию. Исходными параметрами для расчета являются ионный состав исходной воды, термодинамические константы, характеризующие углекислотное равновесие воды, концентрация углекислого газа в исходной воде, дозы коагулянта, значение pH известкованной воды. [c.41]
В программе ПРЕДОЧ, так же как и в программе ТИТР, реализуется метод последовательных приближений до достижения требуемой точности расчета по ионной силе раствора, используются термодинамические соотношения по ионному произведению воды, ее углекислотному равновесию и закономерности поведения слабых растворов сильных электролитов, описанные в гл. 3. [c.44]
Приведенное выше подтверждает, что выделение твердой фазы карбоната кальция из водных растворов под влиянием магнитного поля можетпроисходитьтолько из Пересы-щенного раствора в отношении этой соли, определяемое углекислотным равновесием. [c.30]
В процессе нагрева и испарения воды углекислотное равновесие смещается. Это смещение можно определить по известному составу примесей. При установлении нового состояния равновесия если концентрация НСО3 согласно (12.2) снизится на 2х моль/л, то концентрации СОз и СО 2 увеличатся на х моль/л каждая. Из (12.3) видно, что при снижении концентрации НСО на у моль/л соответственно повысятся концентрации ОН и СО2 на у моль/л. Тогда можно записать, что концентрация растворенной в воде СО2 составит [c.292]
В системах водяного охлаждения тсплонагруженных деталей (чистых циклах) образуются преимущественно отложения карбоната кальция. Причиной их возникновения является сдвиг углекислотного равновесия, который интенсифицируется с повышением температуры. Максимальная интенсивность отложений наблюдается в зонах местного кипения воды [c.172]
Находящиеся в воде ионы НСОз, СОз и углекислый газ связаны углекислотным равновесием [c.24]
mash-xxl.info
Карбонатное равновесие – Справочник химика 21
Карбонатное равновесие. Из элей, образующих минеральный состав пластовых вод, наименьшей растворимостью обладает бикарбонат кальция, количеством которого и определяется карбонатное равновесие. [c.92]Из уравнения основного карбонатного равновесия следует, что воды с одинаковым содержанием свободной угольной кислоты, но с различной концентрацией гидрокарбонатов будут проявлять неодинаковую активность по отношению к карбонату кальция. Поэтому маломинерализованные воды вследствие избытка свободной угольной кислоты могут проявлять агрессивные свойства по отношению к бетону. Если концентрация гидрокарбонатов больше, чем это необходимо для осуществления равновесия со свободной угольной кислотой, т. е. вода имеет повышенную щелочность, то карбонатное равновесие снова становится неустойчивым, но уже из-за избытка гидрокарбонат-ионов. Нарушением основного карбонатного равновесия объясняется и образование карбонатной накипи при нагревании воды. С повышением температуры растворимость диоксида углерода в воде уменьшается и поэтому наблюдается смещение карбонатного равновесия в направлении образования свободной угольной кислоты и карбонат-ионов при разложении гидрокарбонатов. С ионами Са + карбонат-ионы образуют карбонат кальция, растворимость которого понижается с повышением температуры. [c.101]
Углекислотная коррозия. Этот вид коррозии проявляется при нарушении карбонатного равновесия ввиду наличия агрессивной угольной кислоты в воде. Равновесная угольная кислота не является агрессивной по отношению к бетону. Она наряду с ионами НС0 способствует образованию защитной пленки на поверхности бетона. Агрессивная угольная кислота разрушает этот защитный слой. Определяющими факторами протекания углекислотной коррозии являются концентрация СОг в воде, условия омывания бетона водой, плотность бетона. Бетоны, имеющие высокую плотность, более устойчивы к углекислотной коррозии. Предельно допустимые концентрации агрессивной угольной кислоты в воде, контактирующей с бетоном, определяются в зависимости от общего солесодержания воды, концентрации гидрокарбонатов, условий протекания коррозии и составляют с учетом действующих факторов от 3 до 8,3 мг/л. [c.107]
Следовательно, после смешения ее со сточной водой хлоркальциевого типа будет нарушаться карбонатное равновесие, в результате чего при длительном отстое произойдет выпадение карбоната кальция. [c.124]
Объем осадка при нарушении карбонатного равновесия становится заметным при содержании в воде НСО-3 более 200 мг-ион- л при снижении давления до 0,4 МПа. При выходе воды на поверхность и контакте ионов железа с кислородом воздуха образуются закись и окись железа, которые, гидроли-зуясь, образуют коллоидную гидроокись Ре(ОН)з в виде хлопьевидной суспензии, выпадающей в осадок. В сероводородсодержащих водах взвеси представлены в основном сернистым железом. [c.151]
Повышение температуры приводит к нарушению известково-карбонатного равновесия и образованию накипи, которая вместе с продуктами коррозии затрудняет диффузию кислорода к катодным участкам. Однако в присутствии большого количества хлорид-ионов осадок на отдельных участках может терять свои защитные свойства, что приводит к развитию язвенной коррозии. [c.38]
В воде растворимы только карбонаты щелочных металлов и аммония. Гидрокарбонаты с двухзарядными катионами растворимы, как правило, лучше соответствующих карбонатов. Именно поэтому карбонатное равновесие играет чрезвычайно важную роль в природе. Все карстовые явления связаны с образованием и разложением гидрокарбоната кальция [c.311]
А. Исследование кислородного режима и сопряженных с ним факторов (pH, карбонатное равновесие). Кислородный режим является одним из факторов, существенно изменяющихся под влиянием многих токсикантов. Поэтому определять кислород необходимо регулярно и систематически. Наряду с кислородом определяются СОг, pH, карбонаты, бикарбонаты и БПК, причем существенное значение имеют круглосуточные определения содержания растворенных газов, с интервалом через 3—4 часа. [c.246]
Количественный расчет агрессивной СОг при известном содержании ингредиентов ионного состава СОг можно произвести исходя из теоретических положений о карбонатном равновесии. [c.222]
КАРБОНАТНОЕ РАВНОВЕСИЕ В СИСТЕМАХ С ЧИСТЫМ КИСЛОРОДОМ И В АНАЭРОБНЫХ ФИЛЬТРАХ [c.331]
РАСЧЕТ ХАРАКТЕРИСТИК КАРБОНАТНОГО РАВНОВЕСИЯ [c.158]
Воды, в которых имеется избыточное (над равновесным) содержание гидрокарбонатов, т. е. повышенная щелочность, называются нестабильными. Поскольку такие воды не насыщены свободной угольной кислотой, карбонатное равновесие в таких водах смещается в сторону разложения гидрокарбонатов. При наличии ионов Са2+, Mg2+ в нестабильной воде наблюдается отложение карбонатов на стенках аппаратуры. [c.102]
Выщелачивающая коррозия. В мягких маломинерализованных водах содержание гидрокарбонатов незначительно и количество свободной угольной кислоты, соответствующее равновесию с СОз атмосферы при данной температуре, может оказаться большим, чем это необходимо для карбонатного равновесия. Поэтому при контакте с бетоном таких вод возможно растворение карбонатной пленки. Крайне незначительная концентрация ионов Са + в воде способствует растворению извести из цементного камня. [c.107]
При изучении состава природных вод и его формирования нужно владеть приемами расчета характеристик карбонатного равновесия, способами получения горных растворов и методикой определения окислительно-восстановительных условий среды (осадочных пород, в частности), при которых формируется состав подземных и поверхностных вод. Все эти вопросы и нашли свое отражение в соответствующих статьях сборника. [c.4]
Расчет компонентов карбонатного равновесия выполняется на основе теории сильных электролитов. Однако надо иметь в виду, что расчет коэффициентов активности по формулам является до некоторой степени приближенным, а при сумме ионов свыше 3— [c.159]
Расчет характеристик карбонатного
www.chem21.info