Температура замерзания воды – интересные свойства и значения
Чистая вода — считается самой лучшей жидкостью, которая отлично очищает и увлажняет организм. Человеческое тело состоит из воды где-то на 70%.
Если вы испытываете усталость, сонливость или вялость, то рекомендуется выпить один стакан теплой воды. По результатам эксперимента, человеку на один килограмм массы тела следует выпивать около 30 мл воды. Поэтому если ваш вес составляет 70 кг, то советуется каждый день потреблять 2,1 л воды. Чтобы удовлетворить потребности организма в жидкости, рекомендуется ежедневно выпивать не менее 1,5 литра воды, можно пить каждые 40-50 минут по пол стакана водички.
Вода обладает многими полезными свойствами и без неё невозможно жизнь на Земле. Все знают, чтобы вода замерзла, температура замерзания должна быть 0 градусов Цельсия, но это в случае нормальных природных условиях.

Стоит отметить, что давление в разных точках земного шара существенно отличается, поэтому температура замерзания воды зависит от определенного показателя давления.
Важно понять тот факт, что чем выше будет давление в окружающей среде, тем больше температура замерзания или наоборот, чем ниже в природной среде давление, тем меньше температура кристализации.
Температура замерзания воды в океанах и морях
Не забывайте учитывать наличие молекул и примесей в воде. Они сильно влияют на температуру замерзания воды. К примеру, солёная вода способна замерзать при очень низких температурах (около -2 градусов Цельсия).
Если взять абсолютно чистую воду, то она может даже не замерзнуть при температуре -70 градусов Цельсия. Кровь рыб обычно замерзает при температуре -1 °С. Многие ученые задавались вопросом, как рыбам удается не замерзнуть при слишком низких температурах. Оказывается, существуют такие виды рыб, которые способны вырабатывать в поджелудочной железе белки. Именно они впитываются кровью и не дают возможности начать процесс кристализации.
Смотрите также — Температура Солнца в градусах по цельсию — интересные факты о Солнце

Интересные свойства и значения воды
- Дистиллированная вода является отличным диэлектриком и почти не способна проводить ток.
- При замерзании и испарении она расширяется.
- Единственное вещество, которому удается находиться сразу в трёх агрегатных состояниях.
- Способна растворить практически все вещества на Земле.
- Ледники содержат в себе около 2/3 части всего мирового запаса пресной воды.
- Принято считать, что температура замерзания пресной воды составляет 0 градусов по Цельсию, а морская вода замерзает при температуре — -1,8°С.
Моментальная заморозка воды — видео
pristor.ru
При какой температуре замерзает вода
Что влияет на градус замерзания
Представим, что у нас есть идеальная среда с температурой ровно 0°C – общеизвестно, что вода замерзает именно при этом градусе – и в эту среду мы помещаем кусочек льда и воду в жидком состоянии. Что произойдет? Собственно, ничего: вода не замерзнет, а лед не начнет таять. Объяснение в том, что в данной модели нет условий для фазового перехода.
Простыми словами: помимо снижения температуры до определенного градуса, на замерзание воды влияют и другие факторы. Один из них – атмосферное давление, которое создаётся гравитационным притяжением воздуха к Земле. И температура замерзания воды находится в прямой зависимости от давления.
Рассмотрим это на примере: чем выше мы поднимаемся над уровнем моря, ниже становится атмосферное давление и тем выше должна быть температура для кристаллизации воды. На высоте в 1000 метров вода замерзает при температуре +2 °C; поднявшись еще на километр, мы увидим, что вода кристаллизируется уже при +4 °C.
Наличие примесей
Также, кроме давления и температуры, на замерзание воды влияет ее состав: в ней в том или ином количестве находятся органические и минеральные частицы, то есть кусочки глины, песка, пыли. Когда температура в окружающей среде снижается до необходимого градуса, вокруг этих частиц образуются кристаллы: кусочки пыли, песка, камня выполняют роль ядрового центра, вокруг которого начинается процесс кристаллизации.
А в дистиллированной (очищенной) воде процесс замерзания протекает иначе: поскольку в ней нет потенциальных ядер кристаллизации, вода может охладиться до минусовой температуры, но не замерзнуть.
Итак, время замерзания воды зависит от таких факторов:
- атмосферное давление в окружающей среде;
- температура воздуха;
- количество жидкости;
- ее химический состав;
- в какой емкости находится h3O (или отсутствие емкости).
Феноменальные свойства h3O
Приведем еще несколько фактов об удивительном поведении воды:
- При замерзании молекулы воды расширяются, и ее масса становится тяжелей массы льда. Лед, согласно закону Архимеда, выталкивается на поверхность. Таким образом природа закрывает коркой льда водоемы, защищая и сохраняя все живое в их глубинах.
- Горячая вода замерзнет быстрее, чем холодная. Звучит невероятно, но это так. Называется это явление «парадокс «Мпембы». Дело в том, что у горячей воды больше теплоотдача и более высокая насыщенность ядрами кристаллизации.
- В вакууме при 0°C вода сначала закипает, потом одна восьмая ее испаряется, а оставшееся количество замерзает.
- Учеными при лабораторных исследованиях была получена так называемая стеклообразная вода – аморфная твердая субстанция, из которой состоят кометы во Вселенной. Для перехода воды в такое состояние необходимо за считаные миллисекунды понизить температуру до -137 градусов Цельсия.
- Максимальной плотность h3O будет при +4°C.
Моментальная заморозка воды – 5 невероятных трюков: Видео
vseowode.ru
Температура замерзания воды – Справочник химика 21
Иногда денатурированный спирт находит применение в автомобилях. У этилового спирта очень низкая температура замерзания — минус 117 С. А температура замерзания воды О “С. Эти две цифры зимой становятся очень важными для владельцев автомобилей. Водой заполняют [c.93]Свойство растворов понижать температуру замерзания воды широко используется в практике для приготовления так называемых антифризов, которые представляют собой водные растворы некоторых органических и неорганических веществ. Эти растворы не замерзают при низких температурах и потому широко применяются для охлаждения двигателей автомобилей и тракторов в условиях Крайнего Севера. Например, такой антифриз, как 55%-ный раствор этиленгликоля в воде, не замерзает даже при температуре 233 К-
Температура замерзания раствора, содержащего 2,6152 10 кг эфира этиленгликоля в 0,1 кг воды, ниже температуры замерзания воды на 0,5535°. Определите молекулярную массу эфира, если теплота плавления воды 6029 Дж/моль. [c.194]
Диаграмма состояния воды. На рис. 82 показана в схематической форме (т. е. без строгого соблюдения масштаба) диаграмма состояния воды в области невысоких давлений. Кривая ОС представляет зависимость давления насыщенного пара жидкой воды от температуры, кривая О А — зависимость давления насыщенного пара льда от темпе-, ратуры и кривая ОВ — зависимость температур замерзания воды от внешнего давления. Эти три кривые разделяют диаграмму на поля, каждое из которых отвечает одному из агрегатных состояний воды —пару, жидкости и льду. [c.248]
Какова температура замерзания воды по Фаренгейту при нормальных условиях [c.24]
Ученые пользуются для измерения температуры стоградусной шкалой, или шкалой Цельсия. В этой шкале температуре замерзания воды соответствует иоль градусов — это пишется О “С. Комнатная температура — примерно 25 °С, а температура кипения воды — 100 “С. Температура кипения четыреххлористого углерода 77 С, так что он, как видите, закипает и превращается в пар легче, чем вода. Температуры более низкие, чем температура замерзания воды, пишутся со знаком минус. Например, метан кипит при температуре на 161 градус ниже, чем температура замерзания воды, это пишется — 161°С. В США для измерения температуры обычно. применяется шкала Фаренгейта. Кое-где автор приводит в скобках температуру по Фаренгейту. Например, температура кипения воды 100 С (212 F), а четыреххлористого углерода 77 “С (171″Р).
Можно было бы считать прямыми ответами на этот вопрос как истинное предложение Температура замерзания воды при нормальных условиях 32°F , так и ложное Температура замерзания воды при нормальных условиях 0°Ру>. С другой стороны, хотя не требуется, чтобы прямой ответ был истинным, необходимо, чтобы он имел правильную форму в противном случае ответ не считается прямым. Так, предложение Температура замерзания воды при нормальных условиях указана в Справочнике по химии и физике- – не является прямым ответом на вопрос (1), поскольку в нем содержится всего лишь инструкция, по которой спрашивающий может сам найти истинный и прямой ответ на вопрос. Кроме того, следует подчеркнуть, что этим предложением не ограничивается выполнение задания, поставленного в вопросе,— после того как спрашивающий получит такой ответ на вопрос (1), ему предстоит еще проделать определенную работу, чтобы получить окончательный и удовлетворяющий его ответ. То же самое, хотя и в меньшей степени, верно для предложений типа Температура замерзания воды при нормальных условиях на 211° F выше, чем температура замерзания спирта- или Температура замерзания ва ы при нормальных условиях Итак, хотя для какой-то части спрашивающих эти предложения могут оказаться небесполезными, ни одно из [c.24]
Равновесие в двухфазной системе жидкая вода — лед характеризуется кривой ОВ, выражающей зависимость температуры замерзания воды от давления. Следует обратить внимание, что в отличие от большинства других веществ для воды в известных пределах повышение давления вызывает понижение температуры ее замерзания. Это объясняется тем, что плотность льда меньше плотности воды, а повышение давления всегда способствует образованию той фазы, которая обладает меньшим объемом, т. е. большей плотностью (принцип смещения равновесий см. 87). [c.249]
Плавление льда сопровождается поглощением теплоты в количестве 1,436 ккал/моль при 0°С. Большая часть ее расходуется на указанный частичный разрыв водородных связей между молекулами воды в кристаллах льда. Плавление льда в отличие от плавления большинства других веществ сопровождается уменьшением объема (лед легче воды и плавает на ней). Это уменьшение объема достигает 10%, т. е. весьма значительно. Все это показывает, что расположение молекул воды в кристаллах льда является Менее плотным, чем в жидкой воде . Увеличение объема воды при ее замерзании означает, что с повышение
www.chem21.info
Температура замерзания воды | Интересные факты, мифы, заблуждения
Чистая вода при 0 °С не замерзает— как и вода морская.
Для того чтобы вода замерзла, ей нужно что-то, к чему могли бы прицепиться ее молекулы. Кристаллы льда формируются вокруг «ядер» — например, частичек пыли. Если же таковых нет, можно охладить воду до -42 °С, прежде чем та начнет замерзать.
Охлаждение воды без замораживания известно как «переохлаждение». Делать это нужно не торопясь. Можно, к примеру, поместить бутылку очень чистой воды в морозильник и переохладить ее. Но стоит вам вытащить бутылку наружу и постучать пальцем по стеклу — вода в момент превратится в лед.

Сверхбыстрое охлаждение воды имеет совершенно иной эффект. Минуя стадию льда (обладающую равномерной кристаллической решетчатой структурой), она трансформируется в хаотическое аморфное твердое тело, известное как «стеклообразная вода» (названная так из-за случайного расположения молекул, схожего со структурой стекла). Для получения «стеклообразной воды» температуру необходимо понизить до -137 °С буквально за пару миллисекунд. «Стеклообразную воду» на Земле можно встретить лишь в стенах лабораторий, но во Вселенной как раз эта форма воды встречается наиболее часто — именно из нее состоят кометы.
Из-за высокого содержания солей морская вода регулярно охлаждается ниже 0 °С без замерзания. Кровь рыб, как правило, замерзает где-то при -0,5 °С, поэтому морских биологов долго ставил в тупик вопрос: как рыбы ухитряются выживать в полярных морях? Оказывается, такие виды, как антарктическая ледяная рыба и сельдь, вырабатывают в поджелудочной железе белки, впитываемые их кровью. Именно белки препятствуют образованию ядер кристаллизации льда (почти как антифриз в радиаторе автомобиля).
Зная об особенностях воды при низких температурах, вы не удивитесь, узнав, что точка ее кипения (даже при нормальном давлении) — не обязательно 100 °С. Она вполне может быть и гораздо выше. Правда, и здесь жидкость нужно нагревать медленно, причем в сосуде без единой царапины. Именно в царапинах содержатся те самые воздушные полости, возле которых формируются первые пузырьки.
Кипение начинается, когда пузырьки водяного пара, расширяясь, пробивают поверхность воды. Чтобы такое произошло, температура должна быть достаточно высока — настолько, чтобы давление, создаваемое паровым пузырьком, превысило атмосферное. В нормальных условиях это 100 °С, но если в воде нет мест, где могут образовываться пузырьки, для преодоления поверхностного натяжения пробивающихся в жизнь пузырьков требуется больше тепла. (По той же причине надувать воздушный шарик вначале труднее, чем под конец.)
Этим, кстати, объясняется, почему чашка с кипящим кофе может взорваться, забрызгав все вокруг, стоит вынуть ее из микроволновой печи или помешать в ней ложкой. Движение вызовет цепную реакцию, в результате чего вся содержащаяся в кофе вода стремительно испарится.
И наконец, еще одна, последняя водяная странность: горячая вода замерзает быстрее холодной. Первым на это обратил внимание Аристотель еще в IV веке до н. э., однако научный мир признал его правоту лишь в 1963 г. — спасибо упорству танзанийского школьника по имени Эра-сто Мпемба. Мальчуган подтвердил слова древнего грека, наглядно продемонстрировав, что подслащенная молочная смесь превратится в мороженое быстрее, если ее сначала нагреть. Но в чем тут секрет, нам неизвестно до сих пор.
Зачем НАДО менять конституцию? Основной этап сбора Коллективных обращений продлится с 1 марта по 31 мая 2019 года Скачать бланк обращения https://yadi.sk/d/_LgYG_MAcJ8rpA
zablugdeniyam-net.ru
Температура кипения и температура замерзания (кристаллизации) раствора
Температура замерзания (кристаллизации) жидкости– это температура, при которой давление насыщенного пара жидкости равно давлению насыщенного пара кристаллов.
Так как согласно закону Ф. Рауля, давление насыщенного пара над раствором нелетучего вещества ниже давления пара над чистым растворителем, следовательно, при одном и том же внешнем давлении температура кипения раствора выше температуры кипения чистого растворителя, а температура замерзания раствора ниже температуры замерзания чистого растворителя.
Количественно эта зависимость установлена законом Ф. Рауля«Повышение температуры кипения или понижение температуры замерзания идеального раствора прямо пропорционально моляльной концентрации растворенного вещества».
∆Ткип.= Е*См, ∆Тзам.= К*См, где
См– моляльная концентрация раствора, мол/Кг,
Е – эбулеоскопическая постоянная, град/мол,
К – криоскопическая постоянная, град/мол.
Е и К показывают повышение температуры кипения и понижение температуры замерзания раствора, в котором в 1 кг растворителя растворен 1 моль вещества.
Пример 1: для воды Е = 0,52 град/мол, К = 1,86 град/мол.
Так при растворении в 1000 г воды 342 г сахара (С12Н22О11) или 46 г этилового спирта (С2Н5ОН) температура замерзания каждого раствора понизится на 1,860.
Например: определить температуру замерзания 40 % масс. водного растворителя глицерина (С3Н8О3). 100 г раствора состоит из 40 г глицерина и 60 г воды. Таким образом на 1000 г воды (растворителя) содержится 666 г глицерина. Молекулярная масса С3Н8О3равна 92. Моляльная концентрация раствора 666/92 = 7,24 моля/кГ
∆Тзам.= 1,86*7,24 = 13,50
Ответ: температура замерзания 40 % водного раствора глицерина – 13,50С.
Пример 2: раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при – 0,2790С. Вычислите мольную массу глицерина.
Решение: температура кристаллизации чистой воды 00С, следовательно, понижение температуры кристаллизации Δt= 0- (-0,2790) = 0,2790. Масса глицеринаm(г), приходящаяся на 1000 г воды,
m= 11,04*1000/800 = 13,8
подставляем значение mв уравнение
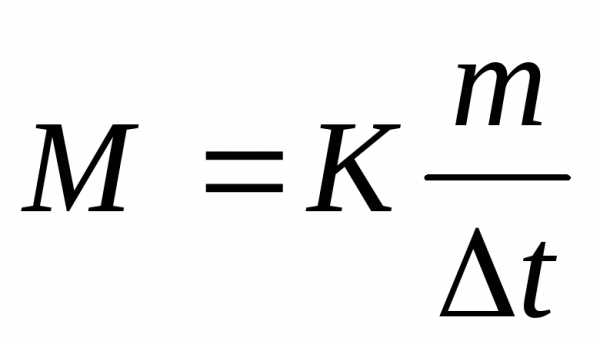 ,
,
тогда мольная масса глицерина
М = 1,86*13,8/0,279 = 92 г/моль.
В измерениях температур кипения и замерзания растворов основаны эбуллиоскопические и криоскопические методы определения молекулярных масс веществ. При этом используют формулу:
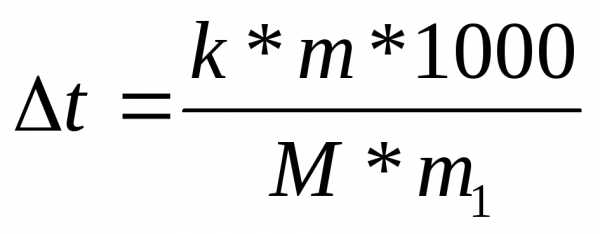
К – криоскопическая или эбулеоскопическая константа;
mи М– соответственно масса растворенного вещества и его мольная масса;
m1– масса растворителя.
Неэлектролиты и электролиты
Одни вещества в растворенном или расплавленном состоянии проводят эдектрический ток (электролиты), другие в тех же условиях эл. ток не проводят (не электролиты).
Свойства растворов относятся к коллигативным свойствам, т.е. к таким свойствам, которые зависят от концентрации частиц в растворе. Значение коллигативных свойств растворов, получающихся при растворении электролитов, аномально высоки.
Например: При растворении 1 моля хлорида натрия в 100 г воды понижение температуры замерзания раствора составляла не 1,86°, а 3,36°, т.е. примерно в 2 раза больше теории.
Полученные экспериментальные данные приводят к выводу о распаде (диссоциации) молекул электролита в растворе на более мелкие частицы (ионы). Теория электролитической диссоциации создана С. Аррениусом. Основные положения этой теории:
1) при растворении электролитов происходит диссоциация их молекул на заряженные частицы – ионы;
2) при диссоциации устанавливается термодинамическое равновесие между образовавшимися ионами и молекулами;
3) величина заряда иона совпадает с валентностью атома элемента или кислотного остатка, а число положительных зарядов равно числу отрицательных зарядов;
4) в целом раствор нейтрален. Растворы электролитов проводят электрический ток – “проводники второго рода”.
Согласно современной теории растворов диссоциация происходит в результате взаимодействия растворенного вещества с молекулами растворителя. Хорошо диссоциируют молекулы с ионной и ковалентной полярной связью. Неполярные и малополярные молекулы не диссоциируют или диссоциируют очень мало. На диссоциацию электролитов в значительной степени влияет полярность растворителя. Чем выше полярность растворителя, тем выше степень диссоциации электролита.
Диссоциация кислот НСl = Н+ + Сl–
Н2SO4 = 2Н+ + SO2-4
СНзСООН ↔ СНзСОО–
С точки зрения электрической диссоциации кислотами называются электролиты, образующие в водных растворах ионы водорода (Н+).
Диссоциация оснований NaOH=Na+ +OH–
Ва(ОН)2 = Ва2+ + 2ОН–
NН4ОН ↔ NН+4 + ОН–
Основаниями называются электролиты, диссоциирующие в водном растворе с образованием гидроксид-ионов (ОН).
Диссоциация солей NaCl = Na+ +Cl–
NiSO4 = Ni2+ + SO2-4
K3PO4=ЗK++POЗ–4
studfiles.net
как зависит температура замерзания воды от давления
В разделе Наука, Техника, Языки на вопрос Зависит ли температура замерзания воды от атмосферного давления? заданный автором Олег Пивовар лучший ответ это Все же на кипение все перевели: плохо предупреждение читали. Естественно, что зависит: молекулы воздуха движутся быстрее молекул замерзающей воды и передают ей часть энергии. Атмосферное давление определяется в самом общем плане плотностью воздуха (количеством молекул в единице объема в переводе на эти условия). При высоком давлении молекул воздуха будет больше и столкновений с молекулами воды также. Отсюда вывод, что чем выше давление, тем меньше должна быть энергия молекул воды, а температура – мера кинетической энергии молекул. Значит при высоком давлении замерзание начнется при более низкой температуре.
Ответ от 22 ответа[гуру]Привет! Вот подборка тем с ответами на Ваш вопрос: Зависит ли температура замерзания воды от атмосферного давления?
Ответ от Ђоварищ[гуру]
Канэшна!
Ответ от Артем Равочкин[гуру]
естесьно
Ответ от Почитатель прекрасного[эксперт]
Зависит, поэтому высоко в горах невозможно сварить яйца. Вода кипит, а температура кипения ниже 100, вот ино и не варятся
Ответ от Kos[гуру]
да, и температура кипения тоже зависит от даления
Ответ от Julik[гуру]
Температура замерзания воды с увеличением давления понижается, а не повышается, как это следовало бы ожидать.
Этой аномалией можно объяснить существование жидкой воды на больших глубинах в морях при температуре, значительно ниже 0°С. Только немногие вещества (висмут, галлий, германий и др. ) имеют такую же аномалию, при которой твердая фаза легче жидкой.
При замерзании чистая вода расширяется почти на 10%, у морского льда изменение объема происходит на меньшую величину. Поскольку вода при замерзании расширяется, увеличение внешнего давления понижает температуру ее замерзания; температура плавления льда, наоборот, повышается с давлением. В лабораторных условиях при давлении более 40 тыс. атмосфер можно получить лед, который будет плавиться при температуре 175°C. Теплоемкость и теплота плавления льда уменьшаются с температурой, теплопроводность же почти не зависит от температуры.
=================
Между внешним давлением и точкой замерзания (плавления) воды наблюдается интересная зависимость. С повышением давления до 2200 атмосфер она падает: с увеличением давления на каждую атмосферу температура плавления понижается на 0,0075°С. При дальнейшем увеличении давления, точка замерзания воды начинает расти: при давлении 3530 атмосфер вода замерзает при -17°с, при 6380 атмосферах – при 0°С, а при 20670 атмосферах – при 76°С. В последнем случае будет наблюдаться горячий лед.
Ответ от 2 ответа[гуру]
Привет! Вот еще темы с нужными ответами:
Ответить на вопрос:
22oa.ru
Температура – замерзание – вода
Температура – замерзание – вода
Cтраница 3
Свойство растворенных веществ понижать температуру замерзания воды широко используется в практике для приготовления так называемых антифризов. Антифризы – это водные растворы некоторых неорганических или органических веществ, незамерзающие при низких температурах и применяемые в качестве охладительных смесей. [31]
Способность растворенных веществ понижать температуру замерзания воды используется на практике для приготовления так называемых антифризов. [33]
Подсчитайте, на сколько различаются температуры замерзания воды, насыщенной воздухом, и чистой воды. [34]
Эмульсионная полимеризация при температурах ниже температуры замерзания воды требует, естественно, применения веществ, понижающих температуру замерзания. [35]
Задачи работы: экспериментально определить температуры замерзания воды и раствора, рассчитать осмотическую концентрацию. [36]
Как влияет повышение давления на температуру замерзания воды. [37]
В настоящее время известно, что температура замерзания воды зависит от диаметра капилляров, в которых она находится. Так, замораживая кипяченую воду в стеклянных капиллярах, Боровик-Романова показала [15], что при диаметре трубки 1 57 мм температура замерзания была равной-6 4 С, при диаметре 0 15 мм – 14 6 С, при диаметре 0 06 мм – 18 5 С. [39]
При мере прибавления соли к воде температура замерзания воды будет понижаться: фигуративная точка раствора движется вниз по кривой О / С, выражающей зависимость между изменением температуры и концентрацией раствора, находящегося в равновесии со льдом. [40]
При мере прибавления соли к воде температура замерзания воды будет понижаться: фигуративная точка раствора движется вниз по кривой ОК, выражающей зависимость между изменением температуры и концентрацией раствора, находящегося в равновесии со льдом. [41]
Ломоносов пользовался термометром, в котором температура замерзания воды принималась за 0, а кипения – за 150, таким образом температура минус 131 соответствует приблизительно минус 87 С. Но такую температуру нельзя измерить ртутным термометром, так что сообщения из Енисейска, на которые опирался Ломоносов, были ошибочны. Замерзание ртути было открыто и описано в письме, адресованном в Академию наук наблюдателем Томской метеорологической станции Петром Саломатовым в 1734 г. В 1735 г. академик Гмелин наблюдал замерзание ртути в термометре, но в полном смысле слова не поверил своим глазам. [42]
Свойство поваренной соли понижать в растворе температуру замерзания воды с древних времен используется для борьбы с гололедом на дорогах. Предприятия коммунального и дорожного хозяйства в зимнее время года давно применяют поваренную соль для посыпки дорог, для предупреждения аварий и травматизма. На посыпку дорог используется в основном попутная соль калийных производств. [43]
Трубы из полиэтилена эластичны, выдерживают температуру замерзания воды, гидравлические удары. Пластмассовые трубы не корродируют, имеют гладкую внутреннюю поверхность, что уменьшает сопротивление течению жидкостей, легко соединяются сваркой, склеиванием и потому находят широкое применение в различных отраслях народного хозяйства. [45]
Страницы: 1 2 3 4
www.ngpedia.ru